间充质干细胞的无血清培养基及间充质干细胞的临床级规模化培养方法与流程
本发明涉及干细胞培养
技术领域:
,尤其涉及间充质干细胞的无血清培养基及间充质干细胞的临床级规模化培养方法。
背景技术:
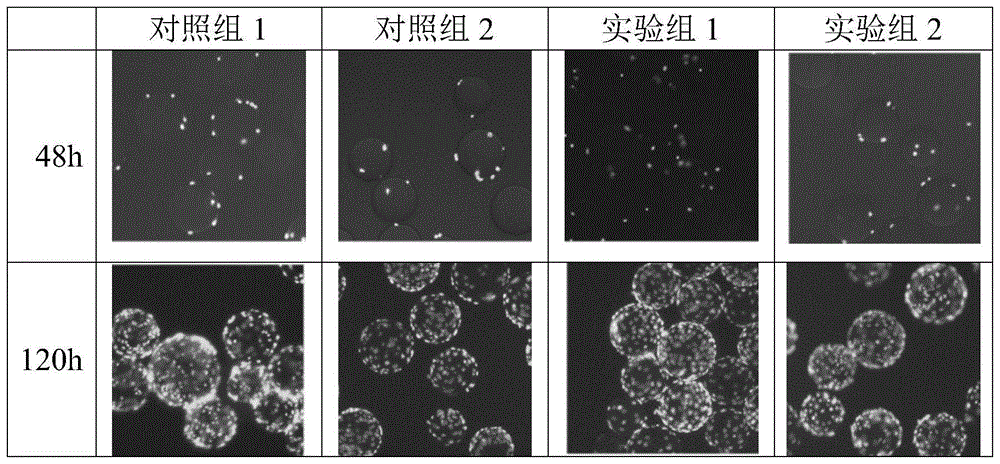
:干细胞及其代表的再生医学领域研究近二十年来不断取得重大技术突破,引发了人们对干细胞技术产业化及临床应用的高度重视。干细胞产业是一个典型的战略性新兴产业,具有高技术性、高壁垒性及高风险性,同时又具有巨大的发展潜力。截止到2019年,全球已有16款干细胞产品上市,其中间充干细胞(mesenchymalstemcells,mscs)由于具有多种优点而成为产品最多,发展最为迅猛的干细胞类型。如欧盟委员会(ec)批准的tigenix公司生产的脂肪来源mscs治疗复杂肛周瘘的新药alofisel,日本批准的mesoblast公司生产的骨髓来源mscs治疗gvhd的新药temcell,韩国kfda先后批准的全球首个fcb-pharmicell公司生产的治疗急性心肌梗死的自体骨髓mscs药物hearticellgram-ami、medi-post公司生产的治疗软骨再生的脐带mscs药物cartistem、anrerogen公司生产的治疗复杂性克罗恩病并发肛瘘的自体脂肪来源mscs药物cuepistem,美国fda批准的athersys公司生产的治疗赫尔勒综合症的异体骨髓来源mscs药物multistem,以及加拿大卫生部批准的美国osiris公司的异体骨髓来源mscs药物prochymal等等。间充质干细胞来源于发育早期的中胚层,是一类非造血干细胞,其广泛存在于骨髓、皮下脂肪、骨外膜、肌肉、滑膜、滑液、肝脏、外周组织、脐带、脐带血及胎盘等组织。mscs具有高度自我更新能力、多向分化潜能,可在体外培养扩增,不仅能够支持造血干细胞的生长,还具有免疫调控的作用;不同的诱导条件下,在体外可分化为骨、软骨、肌肉、神经、心肌、内皮和脂肪等,连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复。因此,mscs具有广阔的临床应用前景,是细胞替代治疗和组织工程的首选种子细胞,是移植领域和自身性免疫疾病治疗的研究热点。目前行业内对规模化、标准化、产业化的,可临床应用的间充质干细胞相关技术与产品的需求呼声越来越高。细胞培养基是细胞培养的关键材料,提供细胞合适的体外生长环境和充足的营养,其性能很大程度上决定了细胞增殖性能和细胞功能、质量与安全性。细胞培养基经历了有血清培养基、无血清培养基发展阶段,目前抗体及重组蛋白生产所用的哺乳动物细胞大部分已经使用无血清培养基培养。但是,对于mscs的无血清培养基,纵观目前国内市场,产品质量参差不齐,导致mscs制品良莠不齐,很难保证mscs制品的安全性与有效性。国内mscs无血清培养基市场基本上为价格昂贵的国外品牌所垄断,并且在细胞扩增效率、原代与传代培养、干性维持等性能指标及原料控制等方面均未能达到规模化细胞制备的应用标准。因此,高质量国产临床级mscs无血清培养基的研发与生产,mscs规模化制备已经成为mscs产业发展的战略基础。现有的间充质干细胞培养方法使用的培养基大都含有动物血清,如最为常见的胎牛血清(fetalbovineserum,fbs)。fbs成分复杂且含有异种蛋白质,容易携带病毒或被支原体感染等。另一方面,fbs批间差异较大,来源不稳定,对体外大规模扩增mscs工艺影响较大。目前有研究表明,mscs在培养过程中会吞噬培养基中的蛋白质,培养基中含有牛血清白蛋白,可以使受者体内产生抗牛白蛋白抗体引起免疫反应,从而导致或者尤其是在重复输注mscs治疗后失效。因此,越来越多研究人员及企业开始研发fbs的替代物。目前,以gibico,stemcell、takara等为代表的商业无血清、无蛋白mscs培养基是市场上的主流产品。在已有的mscs无血清培养基中,有些无法实现高密度培养过程;有些虽能很好地支持细胞生长,但可能导致细胞表达产物能力降低,甚至丧失;此外,商业无血清培养基的配方常属商业机密,且组分复杂、价格昂贵,既不利于特定细胞株培养技术的研究,也无法直接用于细胞培养过程的研究、开发和优化。并且,还有部分血清替代物会使用人血清活血请衍生物,包括人源血清、血小板衍生物、脐血清等。这些产品随来源于人,但成分仍然不明确,而且资源少,难于实现量产,无法保证mscs体外大规模培养。针对目前市面上主流产品存在的性能不够稳定、细胞传代能力和扩增能力不足,无法实现高密度、规模化扩增的缺点,本领域仍在不断研发无动物源、化学成分明确的培养基,特别是适合干细胞规模化、临床级的培养基。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供间充质干细胞的无血清培养基,该培养基无动物源、化学成分明确,能够可实现间充质干细胞的规模化、临床级、高密度培养。本发明还提供间充质干细胞的临床级规模化培养方法。本发明提供的间充质干细胞的无血清培养基包括:氨基酸类、维生素类、无机盐类、ph缓冲剂、脂类、核酸类和其他物质;所述的氨基酸类包括:甘氨酸、丙氨酸、天冬酰胺、天冬氨酸、胱氨酸、半胱氨酸、亮氨酸、异亮氨酸、谷氨酸、谷氨酰胺、精氨酸、组氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸;所述的维生素类包括:维生素c、生物素、氯化胆碱、泛钙素、叶酸、维生素b2、维生素b12、盐酸吡哆醇、盐酸硫胺素、肌醇和烟酰胺;所述无机盐类包括:氯化钙、五水合硫酸铜、七水合硫酸铁、硫酸镁、硫酸锰、七水合硫酸锌、柠檬酸铁、氯化钠、氯化钾、氯化锂、丁酸钠、钼酸铵、六水合氯化镍、磷酸氢二钠和磷酸二氢钠;所述ph缓冲剂类包括:碳酸氢钠和hepes;所述脂类包括:亚油酸所述核酸类包括:腺嘌呤和胸苷;其他物质类包括:葡萄糖、腐胺、硫辛酸和丙酮酸钠。本发明提供的无血清培养基在经典的dmem/f12基础培养基的基础上,通过实验优化,调整氨基酸、无机盐和维生素等成分及添加浓度,采用柠檬酸铁和丁酸钠的组合物替代转铁蛋白,采用硫酸锌代替胰岛素,其他组分的组成也十分合理,能够为细胞的生长、增殖提供充分的养分,更加适合mscs无血清条件及高密度培养,从而获得良好的培养效果。一些实施例中,所述氨基酸类中各组分的质量份为:甘氨酸15~20份、丙氨酸1~10份、天冬酰胺1~10份、天冬氨酸1~10份、胱氨酸10~50份、半胱氨酸10~20份、亮氨酸10~100份、异亮氨酸10~100份、谷氨酸1~10份、谷氨酰胺100~600份、精氨酸100~200份、组氨酸10~50份、赖氨酸50~100份、蛋氨酸10~20份、苯丙氨酸10~50份、脯氨酸10~50份、丝氨酸10~50份、苏氨酸10~100份、色氨酸2~20份、酪氨酸10~100份和缬氨酸10~100份。一些具体实施例中,所述氨基酸类中各组分的质量份为:甘氨酸18.75份、丙氨酸4.45份、天冬酰胺7.5份、天冬氨酸6.65份、胱氨酸31.29份、半胱氨酸17.56份、亮氨酸59.05份、异亮氨酸54.47份、谷氨酸7.35份、谷氨酰胺292份、精氨酸105份、组氨酸31.46份、赖氨酸91.25份、蛋氨酸17.24份、苯丙氨酸35.48份、脯氨酸30份、丝氨酸26.25份、苏氨酸53.45份、色氨酸10份、酪氨酸55.79份和缬氨酸52.85份。一些实施例中,所述的维生素类中各组分的质量份为:维生素c1~100份、生物素0.0005~0.005份、氯化胆碱1~10份、泛钙素0.4~4.0份、叶酸0.4~4.0份、维生素b20.4~4.0份、维生素b120.4~4.0份、盐酸吡哆醇0.4~4.0份、盐酸硫胺素0.4~4.0份、肌醇2~20份和烟酰胺0.4~4.0份。一些具体实施例中,所述的维生素类中各组分的质量份为:维生素c50份、生物素0.0035份、氯化胆碱8.98份、泛钙素2.24份、叶酸2.65份、维生素b20.219份、维生素b120.68份、盐酸吡哆醇2.25份、盐酸硫胺素2.17份、肌醇12.60份和烟酰胺2.02份;一些实施例中,所述无机盐类中各组分的质量份为:氯化钙100~150份、五水合硫酸铜0.0001~0.002份、七水合硫酸铁0.1~0.5份、硫酸镁10~100份、硫酸锰0.0003~0.003份、七水合硫酸锌1.0~2.0份、柠檬酸铁3000~5000份、氯化钠5000~10000份、氯化钾300~500份、氯化锂100~500份、丁酸钠0.0003~0.003份、钼酸铵0.0003~0.003份、六水合氯化镍0.0001~0.0005份、磷酸氢二钠10~100和磷酸二氢钠20~200份。一些具体实施例中,所述无机盐类中各组分的质量份为:氯化钙116.6份、五水合硫酸铜0.0013份、七水合硫酸铁0.417份、硫酸镁97.67份、硫酸锰0.0025份、七水合硫酸锌1.45份、柠檬酸铁3920份、氯化钠6995.5份、氯化钾400份、氯化锂423.9份、丁酸钠0.0025份、钼酸铵0.0025份、六水合氯化镍0.00025份、磷酸氢二钠71.02和磷酸二氢钠140份。一些实施例中,所述ph缓冲剂类中各组分的质量份为:碳酸氢钠1000~2000份和hepes3000~5000份;一些具体实施例中,所述ph缓冲剂类中各组分的质量份为:碳酸氢钠1200份和hepes3574.5份;所述脂类中各组分的质量份为:亚油酸0.001~0.05份;一些具体实施例中,所述脂类中各组分的质量份为:亚油酸0.042份;一些实施例中,所述核酸类中各组分的质量份为:腺嘌呤2~20份和胸苷0.1~0.5份;一些具体实施例中,所述核酸类中各组分的质量份为:腺嘌呤10份和胸苷0.365份;一些实施例中,其他物质类中各组分的质量份为:葡萄糖1000~4500份、腐胺0.005~0.05份、硫辛酸0.1~1.0份、丙酮酸钠50~100份。一些具体实施例中,其他物质类中各组分的质量份为:葡萄糖3151份、腐胺0.015份、硫辛酸0.105份、丙酮酸钠55份。一些实施例中,所述无血清培养基包括水和:一些具体实施例中,所述无血清培养基包括水和:本发明所述的无血清培养基作为干细胞培养的基础培养基的应用。本发明所述的无血清培养基是改良的dmem/f12基础培养基,其在动物细胞培养中,可以替代dmem/f12基础培养基。在本发明中,该无血清培养基作为干细胞培养的基础培养基。采用该培养基能够使细胞适应大规模、高密度的培养体系,获得良好的培养效果。所述干细胞为间充质干细胞,具体为脂肪、脐带或骨髓来源的间充质干细胞。本发明实施例中,以脐带来源的间充质干细胞作为试材验证本发明所述无血清培养基的功能。本发明还提供了干细胞培养的补充因子,其包括:氢化可的松、人表皮生长因子、人碱性成纤维细胞生长因子、wnt-5a、多聚-l-赖氨酸、l-谷胱甘肽、β-巯基乙醇、亚硒酸钠、亚麻酸、胆固醇、乙醇胺、pluronicf-68、tween80、大豆卵磷脂、大豆胰酶抑制剂和大豆水解物。本发明所述的补充因子中,采用大豆水解物替代动物来源成分(如牛血清白蛋白等),所述大豆水解物也可替换为麦麸水解物或棉籽水解物。一些实施例中,所述补充因子中各组分的质量份为:氢化可的松0.002~0.02份、人表皮生长因子0.01~0.05份、人碱性成纤维细胞生长因子0.01~0.05份、wnt-5a0.01~0.1份、多聚-l-赖氨酸0.01~0.1份、l-谷胱甘肽0.4~4份、β~巯基乙醇0.1~1.0份、亚硒酸钠0.005~0.01份、亚麻酸0.01~0.05份、胆固醇0.4~4份、乙醇胺0.04~0.4份、pluronicf-68100~1000份、tween804~40份、大豆卵磷脂5~50份、大豆胰酶抑制剂20~200份和大豆水解物2500~5000份。一些具体实施例中,所述补充因子中各组分的质量份为:氢化可的松0.018份、人表皮生长因子0.02份、人碱性成纤维细胞生长因子0.02份、wnt-5a0.05份、多聚-l-赖氨酸0.05份、l-谷胱甘肽2份、β~巯基乙醇0.39份、亚硒酸钠0.0067份、亚麻酸0.025份、胆固醇2.2份、乙醇胺0.2份、pluronicf-681700份、tween8022份、大豆卵磷脂25份、大豆胰酶抑制剂100份和大豆水解物3000份。本发明所述的补充因子中,所述氢化可的松、人表皮生长因子、人碱性成纤维细胞生长因子、wnt-5a是作为激素或生长因子成分;所述多聚-l-赖氨酸为贴壁因子,l-谷胱甘肽、β-巯基乙醇、亚硒酸钠作为抗氧化剂,还含有脂类成分、大豆胰酶抑制剂,并添加大豆水解物替代动物源成分。该补充因子能够保证在无动物源组分添加的情况下,干细胞能够快速增殖,且保持良好的干性。本发明还提供了一种干细胞培养的培养基,其包括本发明所述的无血清培养基和本发明所述的补充因子。本发明所述干细胞培养的培养基包括水和:本发明所述的培养基在干细胞临床级、规模化培养中的应用。本发明还提供了一种干细胞的临床级、规模化培养方法,其包括以本发明所述的培养基培养干细胞。本发明所述的临床级、规模化的干细胞培养方法包括:将干细胞与微载体接种至本发明所述的培养基,溶氧量50%±0.5%培养48~72h后,半量换液,溶氧量40%±0.5%培养至120~144h。在本发明的培养方法中:所述间充质干细胞的接种量为2.0×104cells/ml~4.0×104cells/ml,本发明实施例中,干细胞的接种量为2.5×104cells/ml;所述微载体的接种量为2~5g/l,本发明实施例中,微载体的用量为3g/l;所述培养体系的体系为3~20l。本发明实施例中,所述培养体系为3l。所述微载体在培养前经孵育,具体为:将微载体用pbs浸泡3h,更换新鲜pbs,121℃高压蒸汽灭菌20min,去除pbs后加入完全培养基,37℃孵育4h。所述培养的条件为37℃搅拌培养,所述搅拌的程序为:40~60rpm搅拌5~10min,停止10~20min,如此循环3~6h;间歇搅拌后,保持80~120rpm连续搅拌。本发明实施例中,所述搅拌的程序为:0~4h间歇搅拌:60rpm搅拌5min,停止15min,循环;4~120h持续搅拌:100rpm。本发明提供的间充质干细胞无血清培养基包括氨基酸类、维生素类、无机盐类、ph缓冲剂、脂类、核酸类和其他物质,该培养基能够为细胞的生长、增殖提供充分的养分,更加适合mscs无血清条件及高密度培养,从而获得良好的培养效果。本发明还提供了一种补充因子,其包括激素及生长因子、贴壁因子、抗氧化成分、脂类、大豆胰酶抑制剂和大豆水解物。该补充因子配合本发明所述的无血清培养基使用,能够保证在无动物源组分添加的情况下,干细胞能够快速增殖,且保持良好的干性。附图说明图1示各组mscs形态图(100×);图2示各组uc-mscs细胞扩增倍数;图3示各组uc-mscs细胞活率;图4示ph值监测结果图;图5示各组uc-mscs成脂分化效果图(400×);图6示各组uc-mscs成骨分化效果图(100×)。具体实施方式本发明提供了间充质干细胞的无血清培养基及间充质干细胞的临床级规模化培养方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明采用的试材皆为普通市售品,皆可于市场购得。其中,所述所述大豆或麦麸或棉籽水解物即指大豆水解物、麦麸水解物或棉籽水解物,在本发明实施例中,采用的为大豆水解物。本发明所述人表皮生长因子为重组人表皮生长因子,所述人碱性成纤维细胞生长因子为重组人碱性成纤维细胞生长因子,本发明所述的大豆胰酶抑制剂提取自大豆,购自sigma,货号为t6522。本发明所述的无血清培养基可为粉末状态存在,也可以液态形式存在,当其以液态形式存在时,其浓度可与实施例中的浓度相等,也可为实施例浓度的数倍,例如:1×、2×、10×。该无血清培养基可根据实际需要于使用前溶解或稀释。本发明所述的补充因子以冻干粉或液体形式存在,当其以液态形式存在时,其浓度可与实施例中的浓度相等,也可为实施例浓度的数倍,例如:1×、2×、10×。下面结合实施例,进一步阐述本发明:实施例1:mscs基础培养基配制本发明所述mscs基础培养基是在经典的dmem/f12基础培养基的基础上,通过实验优化,调整氨基酸、无机盐和维生素等成分及添加浓度,更加适合mscs无血清条件及高密度培养。具体成分包括:表1基础培养基配方实施例2补充因子制备根据表2配比,配制补充因子:表2补充因子配方成分名称质量份(份)氢化可的松0.018重组人表皮生长因子0.02重组人碱性成纤维细胞生长因子0.02wnt-5a0.05多聚-l-赖氨酸0.05l-谷胱甘肽2.00β-巯基乙醇0.39亚硒酸钠0.0067亚麻酸0.025胆固醇2.20乙醇胺0.20pluronicf-681700tween8022.00大豆卵磷脂25.00大豆胰酶抑制剂100.00大豆水解物3000实施例3完全培养基配制1l完全培养基配制:在1l实施例1基础培养基基础上补加实施例2的补充因子组合,使培养基中各组分的浓度如表3:表3完全培养基上述各组分充分搅拌混匀,直到完全溶解,调整ph值到7.0~7.2。实施例4实验组2完全培养基配制1l完全培养基配制:在1l实施例1基础培养基基础上补加多种补充因子组合,使培养基中各组分的浓度如表4:表4完全培养基上述各组分充分搅拌混匀,直到完全溶解,调整ph值到7.0~7.2。实施例5mscs大规模培养工艺细胞类型:脐带来源的mscs;选择p3代细胞开展实验,按1×104/cm2密度接种于t175培养瓶中,置于5%co2培养箱37℃培养。培养3-4天后细胞汇合度达90%以上,收集足够的细胞备用;微载体类型:cytodex-1;生物反应器类型:applikon生物反应器(5l);表5实验组设计培养流程:1、细胞接种量:2.5×104cells/ml/ml;先用1l完全培养基重悬7.5×107mscs备用;2、培养体积:3l;3、微载体3g/l;具体为:称量9g微载体,倒入1l装瓶中,用pbs浸泡3h,吸弃加入新的pbs,121℃高压蒸汽灭菌20min,吸去pbs并加入1l完全培养液,37℃孵育4h备用;4、细胞接种:上述细胞悬液与微载体悬液转移到上样瓶中,轻微晃动混匀;采用蠕动泵将混合液缓慢加了生物反应器中;5、间歇搅拌:60rpm搅拌5min,停止15min,如此循环4h;6、连续搅拌:间歇搅拌后,保持100rpm连续搅拌;7、细胞培养前48h,ph值维持在7.0-7.2之间;溶氧量维持在50%±0.5;8、换液时间:培养至60h;半量换液;9、换液后,ph值维持在7.0-7.4之间;溶氧量维持在40%~50%之间;10、培养120h。实施例6形态观察及活性检测对实施例3三个组的细胞进行抽样,抽样时间点为:48h,120h。形态结果如图1所示(100×)。培养120h后,分别取样,0.25%胰蛋白酶溶液消化收集各组uc-mscs,计算各组细胞数量、扩增倍数(表6、图2)及细胞活率(表6、图3)。结果表明实验组1扩增倍数显著高于其他各组(p<0.01);细胞活率显著高于其他各组(p<0.01)。表6各组uc-mscs细胞数量与活性检测结果实验组别活细胞数量(×104/ml)扩增倍数细胞活率(%)对照组125.23±0.9410.0991.01±0.68对照组218.23±0.627.29##84.57±1.15#实验组133.03±1.1413.21**95.38±0.74**实验组220.79±0.698.32δδ90.52±1.14注:**示实验组1与其他各组相比有极显著性差异,p<0.01;#示对照组2与对照组1相比有显著性差异,p<0.05;##示对照组2与对照组1相比有极显著性差异,p<0.01;δδ示实验组2与对照组1相比有极显著性差异,p<0.01。实施例7ph值监测结果细胞培养过程中,每隔12h取样检测ph值,结果如图4所示。实验结果表明在60h进行半量更换新鲜培养基,实验组的ph值相对于两对照组更为稳定,说明本发明培养基能更好的维持培养基ph值的稳定,有利于细胞高密度培养,维持旺盛的增殖能力与良好的活性。实施例8uc-mscs表面标志物检测培养120h后,分别对对照组1和实验组取样,0.25%胰蛋白酶溶液消化收集各组uc-mscs,流式细胞仪检测其表面marker如cd105、cd73、cd90、cd34、cd45、hla-dr等的表达情况。结果如表7。检测结果表明,对照组2的uc-mscs表面marker不达标;实验组1、实验组2与对照组1的uc-mscs表面markercd105、cd73、cd90阳性表达(>95%),而cd34、cd45、hla-dr阴性表达(<2%),两组之间无显著性差异。表明采用本发明无血清培养基培养uc-mscs不影响其表面标记物的表达。表7各组uc-mscs表面marker检测结果实验组别cd105cd90cd73cd34cd45hla-dr对照组1100.0%98.50%96.35%0.02%0.15%0.01%对照组296.35%91.75%92.35%0.12%0.45%0.02%实验组1100.0%97.46%99.80%0.01%0.00%0.01%实验组299.98%97.23%96.25%0.08%0.12%0.01%实施例9uc-mscs多向分化潜能检测培养120h后,分别对对照组1和实验组1取样,0.25%胰蛋白酶溶液消化收集各组uc-mscs,按1×105/ml密度接种于6孔板中,放入5%co2培养箱37℃培养。待各组uc-mscs融合度达80%以上,分别设置对照孔和诱导孔,诱导uc-mscs成骨和成脂分化。14天后对成脂分化实验组细胞进行油红o染色,21天后对成骨分化实验组细胞进行茜素红染色。实验结果表明采用本发明无血清培养基培养uc-mscs不会影响其成脂成骨分化潜能,维持其干性(图5、图6)。以上仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1