一种三元金属Pd-M-Ir纳米酶及其制备方法和应用与流程
本发明涉及金属纳米酶技术领域,尤其涉及一种三元金属pd-m-ir纳米酶(m=ru,rh,au),以及该种三元金属pd-m-ir纳米酶的制备方法和该种三元金属纳米pd-m-ir在免疫分析中的应用。
背景技术:
金属纳米酶作为新型的能够取代生物酶的一类无机材料,有着自身特点:如能够具有生物酶的功能,且能够在常温下长期稳定放置,不失活;但也具有一些自身的缺陷:如对于过氧化氢的吸附能偏低而导致其活性较弱。究其原因,主要是在催化过程中形成的羟基自由基能够较稳定的吸附在纳米酶的表面,而导致其他的过氧化氢分子不能较好的与纳米酶上的活性位点相结合,从而抑制催化活性。
在活性金属中,掺杂一些小半径的金属物质,往往能够降低活性金属的能带,从而降低活性金属对于中间产物的结合能。sun等曾报道了一种au/cupt的壳核纳米材料,由于铜元素的加入,使得铂元素对于中间产物的吸附能减弱,提升铂元素与氧分子的结合效率,进而提升铂在氧还原反应中的催化性能(j.am.chem.soc.,2014,136,pp5745-5749)。同样,fu等也基于此原理设计并合成了pdcupt三元材料来提升铂的催化性能(nanoscale,2017,9,pp1279-1284)。
在酶联免疫分析和免疫组化研究中,采用金属纳米酶能够很好的替代生物酶,并提高检测灵敏度,这为酶联免疫试剂和免疫组化染色剂的保存和应用研究提供了新的思路和方法。如常用于二抗标记的辣根过氧化物酶,容易受到温度和ph值等外界环境因素的影响,常常造成活性下降,从而导致该方法由于信号响应值偏低,而不能达到酶联免疫分析准确性和免疫组化中标记定位不准确,采用金属纳米酶替代辣根过氧化物酶,不仅能够替代辣根过氧化物酶的生物活性,也能够为二抗提供一个很好的载体,更好的保持其特异性。因此,金属纳米酶具有在酶联免疫分析和免疫组化分析中广泛的用途。
技术实现要素:
本发明针对金属纳米酶有待进一步开发利用的问题,提供一种三元金属pd-m-ir纳米酶(m=ru,rh,au)和其制备方法,以及所制备的三元金属pd-m-ir纳米酶的应用。
为实现上述目的,本发明采用以下技术方案。
本发明的第一方面,提供一种三元金属pd-m-ir纳米酶,所述m为ru、rh或au,所述三元金属pd-m-ir纳米酶为立方体结构。
本发明的另一方面,提供一种三元金属pd-m-ir纳米酶的制备方法,包括以下步骤:
(1)制备母核:用抗坏血酸还原四氯钯酸钠,制得纳米酶结构的母核。
优选的,四氯钯酸钠在聚乙烯吡咯烷酮(pvp)、抗坏血酸和溴化钾的作用下反应,制得纳米酶结构的母核。
更优选的,所述聚乙烯吡咯烷酮、抗坏血酸、溴化钾与四氯钯酸钠的质量比为(1.5-2)∶(1-1.2)∶(10-11)∶1。
反应温度低于80℃时,会造成母核形貌不统一,因此步骤(1)优选的反应温度为80-100℃。
进一步地,所述纳米酶结构的母核其平均边长为16-22nm。
(2)制备pd-m体系(m=ru,rh,au):母核与金属m盐在聚乙烯吡咯烷酮和抗坏血酸的作用下反应,制得pd-m体系;所述金属m盐为钌金属盐、铑金属盐、金盐或含金化合物。
优选的,所述金属m盐为三氯化钌水合物、三氯化铑三水合物或氯金酸水合物。
更优选的,所述金属m盐为三氯化钌水合物或三氯化铑三水合物时,所述母核中的pd与金属m盐的质量比为1∶(0.125-1.5)。
更优选的,所述金属m盐为三氯化钌水合物时,所述母核中的pd与三氯化钌水合物的质量比为1∶(0.3-0.4);所述金属m盐为三氯化铑三水合物时,所述母核中的pd与三氯化铑三水合物的质量比为1∶(0.4-0.5)。
更优选的,所述金属m盐为氯金酸水合物时,所述母核中的pd与氯金酸水合物的质量比为1∶(0.5-7.5)。
更优选的,所述金属m盐为氯金酸水合物时,所述母核中的pd与氯金酸水合物的质量比为1∶(0.6-0.8)。
抗坏血酸的浓度对反应体系中母核的团聚情况有影响,当抗坏血酸的浓度高于10mg/ml时会造成反应体系中的母核发生团聚,因此反应体系中抗坏血酸的浓度优选小于或等于10mg/ml。更优选的,所述金属m盐为氯金酸水合物时,反应体系中抗坏血酸的浓度优选小于或等于5mg/ml。
优选的,聚乙烯吡咯烷酮在反应体系中的浓度为6-16mg/ml。
优选的,当所述金属m盐为三氯化钌水合物或三氯化铑三水合物时,反应溶剂为乙二醇;当所述金属m盐为氯金酸水合物时,反应溶剂为水。
反应温度会影响pd-m体系表面的粗糙度,会改变其结构,因此,当所述金属m盐为三氯化钌水合物或三氯化铑三水合物时,反应溶剂优选乙二醇,反应温度优选大于或等于160℃,当所述金属m盐为氯金酸水合物时,反应溶剂优选水,反应温度优选大于或等于80℃。
(3)制备pd-m-ir纳米酶:pd-m体系与铱盐在聚乙烯吡咯烷酮和抗坏血酸的作用下反应,制得pd-m-ir。
优选的,所述铱盐为六氯铱酸钠水合物。
优选的,pd-m体系与六氯铱酸钠水合物的质量比为1∶(0.125-3)(以pd计算,以下同)。
更优选的,pd-m体系与六氯铱酸钠水合物的质量比为1∶(0.75-1)。
优选的,反应温度大于或等于160℃。
以上所述制备方法,所述的聚乙烯吡咯烷酮的分子量约为55000。
本发明的另一方面,提供以上所述制备方法制备的三元金属pd-m-ir纳米酶在免疫组化中的应用。
与现有技术相比,本发明的有益效果是:
本发明通过用抗坏血酸还原四氯钯酸钠,制得纳米酶结构的母核;然后母核与金属m盐反应制得pd-m体系,pd-m体系再通过与铱盐在高温下反应形成三元金属pd-m-ir(m=ru,rh,au)纳米酶,该三元金属pd-m-ir纳米酶对酸碱和温度具有很好的耐受性,尤其是三元金属pd-ru-ir纳米酶,完全可以替代辣根过氧化物酶应用于免疫组化中。本发明首次制备形成pd-ru-ir三元金属纳米材料,并将其应用于免疫组化,为提升免疫组化敏感性提供了思路。
附图说明
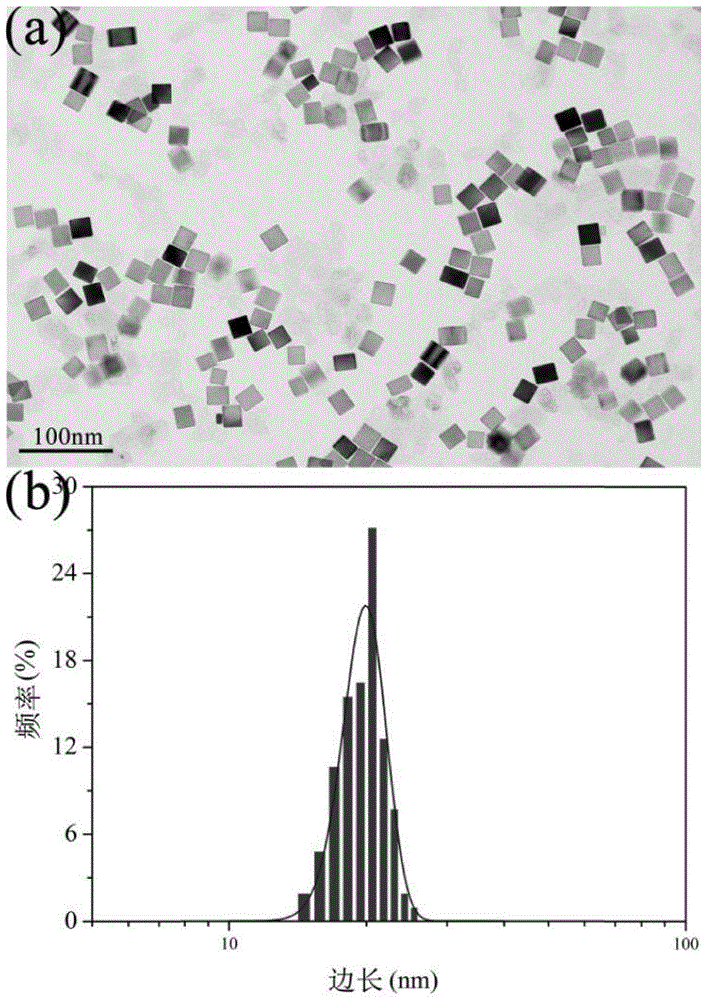
图1为实施例1-3中制备的母核的透射电镜图及其边长分布;
图2为实施例1制备的三元金属pd-ru-ir纳米酶的透射电镜图及其元素分布;
图3为实施例1制备的三元金属pd-ru-ir纳米酶的x射线电子能谱图;
图4为实施例1制备的三元金属pd-ru-ir纳米酶对酸碱和温度的耐受性图;
图5为实施例1制备的三元金属pd-ru-ir纳米酶应用于免疫组化的效果图;
图6为实施例2制备的三元金属pd-rh-ir纳米酶的透射电镜图及其元素分布;
图7为实施例3制备的三元金属pd-au-ir纳米酶的透射电镜图及其元素分布。
具体实施方式
为了更充分的理解本发明的技术内容,下面结合具体实施例对本发明的技术方案作进一步介绍和说明。
对于本领域的技术人员来说,通过阅读本说明书公开的内容,本发明的特征、有益效果和优点将变得显而易见。以下实施例主要目的是用于进一步介绍本发明方法的具体实施过程,不代表本发明方法仅能按以下实施例实现,如制备pd-ru体系时,本发明方法可在160℃以上的反应温度下进行,该条件在发明内容中已明确阐明,虽然具体实施方式中仅以200℃为例,并不代表该反应的反应温度只能是200℃。
实施例1
本实施例提供一种三元金属pd-ru-ir纳米酶的制备方法,包括步骤:(1)制备母核,(2)制备pd-ru体系,(3)制备pd-ru-ir纳米酶。具体步骤如下:
(1)制备母核
称取110mg的pvp,65mg的抗坏血酸,600mg的溴化钾,将其加入到圆底烧瓶中,并加入8ml水。在80℃油浴锅中预热,然后向圆底烧瓶中加入3ml(19mg/ml)na2pdcl4水溶液,反应持续3h(反应温度80℃)后结束反应。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(母核),然后将反应产物分散于乙二醇中,配制成pd的浓度为2mg/ml的母核胶体溶液。
(2)制备pd-ru体系
称取100mg的pvp,50mg的抗坏血酸,将其加入到圆底烧瓶中,并加入8ml乙二醇,随之加入1ml步骤(1)制备的母核胶体溶液,然后升温至200℃,随后向圆底烧瓶中逐滴加入7.4ml氯化钌水合物的浓度为0.1mg/ml的乙二醇溶液(其中含12.5mg/ml的pvp),氯化钌水合物滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(pd-ru体系)。
(3)制备pd-ru-ir纳米酶
将步骤(2)收集到的反应产物分散于8ml乙二醇中,并向其中加入100mg的pvp,50mg的抗坏血酸,然后升温至200℃,随后向其中逐滴加入6.8ml六氯铱酸钠水合物的浓度为0.25mg/ml的乙二醇溶液,滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(三元金属pd-ru-ir纳米酶)。将三元金属pd-ru-ir纳米酶分散于5ml的水中,备用。
实施例2
本实施例提供一种三元金属pd-rh-ir纳米酶的制备方法,包括步骤:(1)制备母核,(2)制备pd-rh体系,(3)制备pd-rh-ir纳米酶。具体步骤如下:
(1)制备母核
称取110mg的pvp,65mg的抗坏血酸,600mg的溴化钾,将其加入到圆底烧瓶中,并加入8ml水。在80℃油浴锅中预热,然后向圆底烧瓶中加入3ml(19mg/ml)na2pdcl4水溶液,反应持续3h(反应温度80℃)后结束反应。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(母核),然后将反应产物分散于乙二醇中,配制成pd的浓度为2mg/ml的母核胶体溶液。
(2)制备pd-rh体系
称取100mg的pvp,50mg的抗坏血酸,将其加入到圆底烧瓶中,并加入8ml乙二醇,随之加入1ml步骤(1)制备的母核胶体溶液,然后升温至200℃,随后向圆底烧瓶中逐滴加入9.3ml三氯化铑三水合物的浓度为0.1mg/ml的乙二醇溶液(其中含12.5mg/ml的pvp),氯化钌水合物滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(pd-rh体系)。
(3)制备pd-rh-ir纳米酶
将步骤(2)收集到的反应产物分散于8ml乙二醇中,并向其中加入100mg的pvp,50mg的抗坏血酸,然后升温至200℃,随后向其中逐滴加入6.8ml六氯铱酸钠水合物的浓度为0.25mg/ml的乙二醇溶液,滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(三元金属pd-rh-ir纳米酶)。将三元金属pd-rh-ir纳米酶分散于5ml的水中,备用。
实施例3
本实施例提供一种三元金属pd-au-ir纳米酶的制备方法,包括步骤:(1)制备母核,(2)制备pd-au体系,(3)制备pd-au-ir纳米酶。具体步骤如下:
(1)制备母核
称取110mg的pvp,65mg的抗坏血酸,600mg的溴化钾,将其加入到圆底烧瓶中,并加入8ml水。在80℃油浴锅中预热,然后向圆底烧瓶中加入3ml(19mg/ml)na2pdcl4水溶液,反应持续3h(反应温度80℃)后结束反应。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(母核),然后将反应产物分散于乙二醇中,配制成pd的浓度为2mg/ml的母核胶体溶液。
(2)制备pd-au体系
称取5mg的pvp,3mg的抗坏血酸,将其加入到圆底烧瓶中,并加入8ml水,随之加入1ml步骤(1)制备的母核胶体溶液,然后升温至95℃,随后向圆底烧瓶中逐滴加入2ml浓度为0.7mg/ml的氯金酸溶液,氯金酸溶液滴加完成后继续反应15min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(pd-au体系)。
(3)制备pd-au-ir纳米酶
将步骤(2)收集到的反应产物分散于8ml乙二醇中,并向其中加入100mg的pvp,50mg的抗坏血酸,然后升温至200℃,随后向其中逐滴加入6.8ml六氯铱酸钠水合物的浓度为0.25mg/ml的乙二醇溶液,滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(三元金属pd-rh-ir纳米酶)。将三元金属pd-rh-ir纳米酶分散于5ml的水中,备用。
对比例1
对比例1提供一种钯母核的制备方法,具体步骤如下:称取110mg的pvp,65mg的抗坏血酸,600mg的溴化钾,将其加入到圆底烧瓶中,并加入8ml水。在80℃油浴锅中预热,然后向圆底烧瓶中加入3ml(19mg/ml)na2pdcl4水溶液,反应持续3h(反应温度75℃)后结束反应。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(母核),然后将反应产物分散于乙二醇中,配制成pd的浓度为2mg/ml的母核胶体溶液。
对比例2
对比例2提供一种钯母核的制备方法,具体步骤如下:称取110mg的pvp,65mg的抗坏血酸,600mg的溴化钾,将其加入到圆底烧瓶中,并加入8ml水。在80℃油浴锅中预热,然后向圆底烧瓶中加入3ml(19mg/ml)na2pdcl4水溶液,反应持续3h(反应温度90℃)后结束反应。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(母核),然后将反应产物分散于乙二醇中,配制成pd的浓度为2mg/ml的母核胶体溶液。
对比例3
对比例3提供一种钯母核的制备方法,具体步骤如下:称取110mg的pvp,65mg的抗坏血酸,600mg的溴化钾,将其加入到圆底烧瓶中,并加入8ml水。在80℃油浴锅中预热,然后向圆底烧瓶中加入3ml(19mg/ml)na2pdcl4水溶液,反应持续3h(反应温度100℃)后结束反应。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(母核),然后将反应产物分散于乙二醇中,配制成pd的浓度为2mg/ml的母核胶体溶液。
由实施例1-3及对比例1-3制备的母核的透射电镜图发现,制备母核时的反应温度会影响母核的形貌,对比例1的反应温度为75℃,其制备的母核的形貌不统一,而实施例1和对比例2-3制备的母核的形貌一致。
对比例4
对比例4提供一种pd-ru体系的制备方法,包括步骤(1)制备母核和步骤(2)制备pd-ru体系,其中步骤(1)与实施例1的步骤(1)相同,步骤(2)如下:称取100mg的pvp,165mg的抗坏血酸,将其加入到圆底烧瓶中,并加入8ml乙二醇,随之加入1ml步骤(1)制备的母核胶体溶液,然后升温至200℃,随后向圆底烧瓶中逐滴加入7.4ml氯化钌水合物的浓度为0.1mg/ml的乙二醇溶液(其中含12.5mg/ml的pvp),氯化钌水合物滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(pd-ru体系)。反应现象与实施例1的相似,反应过程中未发现明显的母核团聚的现象。
对比例5
对比例5提供一种pd-ru体系的制备方法,包括步骤(1)制备母核和步骤(2)制备pd-ru体系,其中步骤(1)与实施例1的步骤(1)相同,步骤(2)如下:称取100mg的pvp,200mg的抗坏血酸,将其加入到圆底烧瓶中,并加入8ml乙二醇,随之加入1ml步骤(1)制备的母核胶体溶液,然后升温至200℃,随后向圆底烧瓶中逐滴加入7.4ml氯化钌水合物的浓度为0.1mg/ml的乙二醇溶液(其中含12.5mg/ml的pvp),氯化钌水合物滴加完成后继续反应10min,然后将反应液冷却至室温。向圆底烧瓶中加入母核胶体溶液后,反应液中出现母核团聚的现象。
对比例6
对比例6提供一种pd-ru体系的制备方法,包括步骤(1)制备母核和步骤(2)制备pd-ru体系,其中步骤(1)与实施例1的步骤(1)相同,步骤(2)如下:称取100mg的pvp,50mg的抗坏血酸,将其加入到圆底烧瓶中,并加入8ml乙二醇,随之加入1ml步骤(1)制备的母核胶体溶液,然后升温至160℃,随后向圆底烧瓶中逐滴加入7.4ml氯化钌水合物的浓度为0.1mg/ml的乙二醇溶液(其中含12.5mg/ml的pvp),氯化钌水合物滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(pd-ru体系)。
对比例7
对比例7提供一种pd-ru体系的制备方法,包括步骤(1)制备母核和步骤(2)制备pd-ru体系,其中步骤(1)与实施例1的步骤(1)相同,步骤(2)如下:称取100mg的pvp,50mg的抗坏血酸,将其加入到圆底烧瓶中,并加入8ml乙二醇,随之加入1ml步骤(1)制备的母核胶体溶液,然后升温至150℃,随后向圆底烧瓶中逐滴加入7.4ml氯化钌水合物的浓度为0.1mg/ml的乙二醇溶液(其中含12.5mg/ml的pvp),氯化钌水合物滴加完成后继续反应10min,然后将反应液冷却至室温。反应液在12000rpm的转速下用水离心洗涤3次,收集反应产物(pd-ru体系)。
由实施例1及对比例6-7制备的pd-ru体系的透射电镜图发现,反应温度会影响pd-m体系表面的粗糙度,会改变其结构,当反应温度低于160℃时,会造成pd-m体系表面粗糙,发生结构改变。
实施例1-3中制备的母核的透射电镜图及其边长尺寸大小分布图如图1所示,其中,a的透射电镜图显示,钯的母核呈立方体结构,边长经统计计算约为19.8nm,如b所示
实施例1制备的三元金属pd-ru-ir纳米酶的透射电镜图及其元素分布图如图2所示,其中,a是三元金属pd-ru-ir纳米酶的透射电镜图,b是三元金属pd-ru-ir纳米酶高倍透射电镜图,c是三元金属pd-ru-ir纳米酶的暗场tem图像,d是pd元素的元素分布图,e是ru元素的元素分布图,f是ir的元素分布图,g是pd、ru和ir三种元素的元素分布组合图。
实施例1制备的三元金属pd-ru-ir纳米酶的x射线电子能谱图如图3所示,由图3可见,在掺杂ru元素之后,表层的铱元素的能谱向高场发生偏移。
测试实施例1制备的三元金属pd-ru-ir纳米酶对酸碱和温度的耐受性,方法如下:
测试温度对三元金属pd-ru-ir纳米酶活性的影响:将相同浓度的三元金属pd-ru-ir纳米酶(4×10-6mg/ml)置于不同的温度下(30-100℃)加热30min,然后分别取10μl样品,加入到ph=4的醋酸盐缓冲液中孵育,其中醋酸盐缓冲液含有2mol/l的h2o2和0.8mol/l的3,3′,5,5′-四甲基联苯胺,测试652nm处的吸光度(每个样品重复测试三次),各样品的吸光值分别除以30℃时孵育测得的吸光值,所得值为该样品的相对活性值。
测试ph对三元金属pd-ru-ir纳米酶的活性影响:将相同浓度的三元金属pd-ru-ir纳米酶(4×10-6mg/ml)进行离心,弃去上清,然后分别加入等体积的不同ph值的缓冲液(ph=2-11),室温下震荡30min,分别取10μl样品,加入到ph=4的醋酸盐缓冲液中孵育,其中醋酸盐缓冲液含有2mol/l的h2o2和0.8mol/l的3,3′,5,5′-四甲基联苯胺,测试652nm处的吸光度(每个样品重复测试三次),各样品的吸光值分别除以ph=7.0时孵育测得的吸光值,所得值为该样品的相对活性值。
实施例1制备的三元金属pd-ru-ir纳米酶对酸碱和温度的耐受性的测试结果如图4所示,三元金属pd-ru-ir纳米酶在不同ph条件下(ph=2-11)处理30min,以及在不同温度条件下(30-100℃)处理30min,其活性保持稳定,说明该三元金属pd-ru-ir纳米酶对酸碱和温度具有良好的耐受性。
测试实施例1制备的三元金属pd-ru-ir纳米酶应用于免疫组化研究。首先,小鼠肝组织切片先用二甲苯浸泡三次(15min/次),然后用无水乙醇、85%乙醇和75%乙醇分别浸泡三次,每次的浸泡时间是5min,最后用去离子水浸泡5min,即完成脱腊过程。然后,使用3%h2o2,室温避光孵育10min,阻断切片中可能存在的过氧化物酶。接着,通过edta(ph=8.0)的抗原修复液修复抗原,并且用pbs缓冲液洗涤3次,每次洗涤时间为5min。随后,用3%的牛血清白蛋白溶液封闭切片,封闭时间为30min。封闭结束后,轻轻甩掉封闭液,向切片中加入一抗,切片置于4℃冰箱中孵育过夜。待孵育结束后,用pbs缓冲液洗涤3次,每次5min,随后加入二抗(三元金属pd-ru-ir纳米酶标记山羊抗兔igg),室温孵育50min,用pbs缓冲液洗涤掉未结合的二抗,加入dab显色液显色,用自来水终止反应,加入苏木素复染细胞核3min,随即将切片脱水封片,用显微镜镜检并收集图像信息。苏木素染细胞核为蓝色,dab显出的阳性表达为棕黄色。免疫组化分析结果如图5所示,其中,a、b是商业化染料用于阴性组的染色结果图,c、d是商业化染料用于阳性组的阳性结果图,e、f是三元金属pd-ru-ir纳米酶用于阴性组的染色结果图,g、h是三元金属pd-ru-ir纳米酶用于阳性组的染色结果图;统计结果表明:g的棕色光密度值的强度是c的光密度值的8.7倍。
实施例2制备的三元金属pd-rh-ir纳米酶的透射电镜图及其元素分布图如图6所示,其中,a是金属pd-rh-ir纳米酶的透射电镜图,b是金属pd-rh-ir纳米酶的高倍透射电镜图,c是金属pd-rh-ir纳米酶的暗场tem图像,d是pd元素的元素分布图,e是rh元素的元素分布图,f是ir的元素分布图,g是pd、rh和ir三种元素的元素分布组合图。
实施例3制备的三元金属pd-au-ir纳米酶的透射电镜图及其元素分布图如图7所示,其中,a是金属pd-au-ir纳米酶的透射电镜图,b是金属pd-au-ir纳米酶的高倍透射电镜图,c是纳米金属pd-au-ir纳米酶的暗场tem图像,d是pd元素的元素分布图,e是au元素的元素分布图,f是ir的元素分布图,g是pd、au和ir三种元素的元素分布组合图。
以上所述仅以实施例来进一步说明本发明的技术内容,以便于读者更容易理解,但不代表本发明的实施方式仅限于此,任何依本发明所做的技术延伸或再创造,均受本发明的保护。
- 还没有人留言评论。精彩留言会获得点赞!