一种癌胚抗原电化学免疫传感器的制备方法和检测方法与流程
本发明涉及免疫传感器领域,具体涉及一种癌胚抗原电化学免疫传感器的制备方法和检测方法。
背景技术:
癌胚抗原(CEA)是一种分子量极大的糖蛋白,常用于肿瘤标记。CEA浓度的检测不仅可以用于胃肠道和呼吸道的肿瘤诊断,还可以通过检测人体内癌胚抗原的含量及量的变化,表明肿瘤的性质,从而对肿瘤的诊断、病程分析及指导临床治疗起辅助作用。因此CEA浓度的测定对临床肿瘤诊断具有重大的意义。癌胚抗原的定量检测方法最常见的分析方法包括荧光免疫法,酶联免疫吸附测定法,电化学免疫传感器测定法,放射免疫测定法,电化学发光免疫测定法和质谱免疫测定法。其中电化学免疫传感器测定法具有分析速度快、仪器装置简便、灵敏度高等优点。
电化学免疫传感器可分为阻抗型免疫传感器、电容型免疫传感器、电位型传感器和电流型传感器。电流型免疫传感器是在电位一定的情况下测定由于抗原抗体特异性结合成复合物后电流的改变,它又分为酶标记型和非酶标记型。目前,常用的非酶标记型电化学免疫传感器如化学(物理)吸附、共价键结合、交联法、嵌入法等,都暴露出检测时间长、费用高、生物分子稳定性低、生物分子失活性高、步骤复杂的缺点。而酶标记型电化学免疫传感器有很多酶可以用于酶标记型免疫传感器,如辣根过氧化物酶、葡萄糖氧化酶、碱性磷酸酶和脲酶。酶生物传感器是通过检测酶促反应产生的H2O2,但这类酶生物传感器会受到溶解氧的严重影响而导致电化学响应不稳定。常用的生物电化学传感器都需要比较复杂的检测步骤,并且需要彻底清洗才能使用,非常容易使检测结果出现错误。
技术实现要素:
本发明的目的在于提供一种癌胚抗原电化学免疫传感器,其具有灵敏度高、结果准确可靠、成本低、快速、使用方便且制备过程极其简单的特点。
为达到上述目的,本发明的技术方案为,其制备方法具体步骤如下:
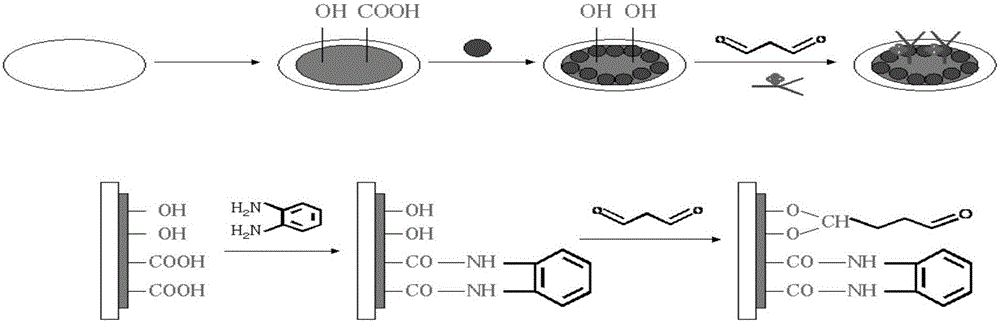
步骤1:取聚邻苯二胺纳米微球0.013g,利用超声震荡分散在1mL的水中,并在室温下保存备用;
步骤2:将玻碳电极:用清洗剂超声清洗5~10min后,在沉积电位为1.75V下,0.1M pH=5.0的PBS中,用线性扫描溶出伏安法沉积300s,得到处理后的玻碳电极;
步骤3:处理后的玻碳电极在扫描电位为+0.3~+1.3V,pH=7.0的PBS中做循环伏安曲线直到获得稳定的电流电压曲线为止;
步骤4::将此电极浸泡在20mM的戊二醛溶液中12~24h,得到戊二醛修饰的玻碳电极;
步骤5:用水充分清洗以除去玻碳电极上非化学吸附的戊二醛,把该电极浸入100μL HRP标记的CEA抗体溶液与200μL聚邻苯二胺纳米微球溶液的混合液中5~10h后得到聚邻苯二胺纳米微球/HRP标记的CEA抗体修饰电极;
步骤6:用水将电极冲洗干净,晾干;
步骤7:将干燥后的免疫传感器于含有0.04%BSA的PBS溶液中4℃下浸泡1~3h,将制备好的免疫传感器泡于4℃ 0.1M pH=7.0的PBS中,即可得到癌胚抗原电化学免疫传感器。
2,检测方法
步骤1:取5μL的CEA标准样品配置成浓度为0.1ng/ml、5ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml的溶液作为测试溶液,并在室温(25±1.0℃)下孵育10~60min;
步骤2:测试溶液在2.0mM H2O2和pH=5.0~8.0无氧的PBS混合溶液中进行差分脉冲伏安扫描,其扫描电压为-0.5~-0.75V;
步骤3:启动电化学反应,分别测量0.1ng/ml、5ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml的CEA溶液对应的电流强度,建立电化学电流强度与CEA溶液浓度之间的定量关系。
本方案的优点在于:
1,聚邻苯二胺纳米微球的制备采用臭氧作为氧化剂,不仅产物无污染,在氧化过程中也不会带入金属杂质。
2,这种免疫传感器中含有的聚邻苯二胺纳米微球带有正电荷的氨基与带负电的玻碳电极发生静电结合作用,聚邻苯二胺纳米微球同时与戊二醛反应,从而有利于酶的固定。聚邻苯二胺纳米微球和戊二醛应用于酶生物传感器中,构建电极与酶的氧化还原位点之间的直接电子转移,从而消除溶解氧的干扰。聚邻苯二胺具有固化酶、高的选择通透性、良好耐腐蚀性能,同时还具有丰富的氨基和亚氨基,有利于抗体蛋白质的功能化和提高酶的生物活性。
3,纳米微球的比表面积大,进一步提高了暴露在晶体外部的氨基和亚氨基数量,提高了检测的灵敏度和稳定性,其线性范围0.1~50ng/ml,检测限最低0.05ng/ml,表明该免疫传感器可以达到准确测定的目的。该传感器制备方法简单、成本低、灵敏度高、稳定性好。
4,检测只需要一步即可,检测步骤简单方便,不容易出错。
进一步,所述聚邻苯二胺纳米微球的制备方法为:200μL 0.1M邻苯二胺加入3mL水中,向溶液中通入30ml/min的臭氧并不断搅拌,在常温下搅拌3~5h后将反应得到的产物在7000G的重力加速度下离心5min,分离得到的沉淀物即是聚邻苯二胺纳米微球。发明人通过实验发现采用上述参数制备的聚邻苯二胺纳米微球粒径最均匀。
进一步,所述清洗剂超声清洗先经过体积比为1:1的HNO3溶液清洗,然后通过甲苯或者无水乙醇清洗,最后采用纯水清洗干净,发明人通过实验发现使用这种组合的清洗剂和清洗方式可以彻底洗去附着在电极表面的有机物杂质。
进一步,所述电极浸泡在20mM的戊二醛溶液中12h,可以使电极表面完全附着戊二醛,同时也不会在电极表面物理吸附过量戊二醛,造成浪费。
进一步,所述通入臭氧的速率为30ml/min,搅拌时间为5h,该方法制得的聚邻苯二胺纳米微球的直径为200nm,搅拌时间太短,形成的纳米微球粒径不均匀,影响电化学免疫传感器的稳定性。
进一步,所述测试溶液孵育时间为40min,发明人通过大量实验发现,采用上述溶液孵育时间,癌胚抗原电化学电流响应最明显,传感器测试的灵敏度最高。
进一步,所述无氧的PBS的混合溶液的pH=7.0,发明人通过实验发现,采用上述条件癌胚抗原蛋白的活性最高。
附图说明
图1是本发明实施例1纳米聚邻苯二胺纳米微球的电子显微镜图片;
图2是本发明癌胚抗原电化学免疫传感器的制备流程图;
图3是本发明实施例1,2~7检测方法中不同pH值的PBS-响应电流强度线性图;
图4是本发明实施例1,8~13检测方法中不同的孵育时间-响应电流强度线性图;
图5是本发明检测癌胚抗原电化学免疫传感器在不同癌胚抗原浓度下的线性拟合图。
具体实施方式
下面通过具体实施方式对本发明作进一步详细的说明:
说明书附图中的附图标记包括:。
本说明书中使用的术语“HRP”指:辣根过氧化物酶;“CEA”指:癌胚抗原;“BSA”指:牛血清白蛋白;“PBS”指:磷酸缓冲盐溶液。
实施例1:
1、聚邻苯二胺纳米微球的制备(POPD)
200μL 0.1M邻苯二胺加入3mL水中,向溶液中通入30ml/min的臭氧并不断搅拌,在常温下搅拌5h后将反应得到的产物在7000G的重力加速度下离心5min,分离得到的沉淀物即是聚邻苯二胺纳米微球。
2、免疫传感器的制备
步骤1:将玻碳电极分别用0.3μm和0.05μm的Al2O3抛光;
步骤2:先用1:1的HNO3超声清洗5min后,再采用无水乙醇超声清洗5min,最后采用纯水超声清洗5min;在沉积电位为1.75V下,0.1M pH=5.0的PBS中,用线性扫描溶出伏安法沉积300s,得到处理后的玻碳电极;
步骤3:处理后的玻碳电极在扫描电位为+0.3~+1.3V,pH=7.0的PBS中做循环伏安曲线直到获得稳定的电流电压曲线为止;
步骤4:将此电极浸泡在20mM的戊二醛溶液中约12h,得到戊二醛修饰的玻碳电极;
步骤5:用水充分清洗以除去非化学吸附的戊二醛,把该电极浸入100μL HRP标记的CEA抗体溶液和200μL自制的聚邻苯二胺纳米微球溶液的混合液中5h后得到聚邻苯二胺纳米微球/HRP标记的CEA抗体修饰电极;
步骤6:用水将电极冲洗干净,晾干;
步骤7:将干燥后的免疫传感器于含有0.04%BSA的PBS溶液中4℃下浸泡1h,:将制备好的免疫传感器泡于4℃ 0.1M pH=7.0的PBS中,即可得到癌胚抗原电化学免疫传感器。
3、检测方法
步骤1:取5μL的CEA标准样品配置成浓度为0.1ng/ml、5ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml的溶液作为测试溶液,并在室温(25±1.0℃)下孵育40min。
步骤2:然后分析物在2.0mM H2O2和无氧的pH=7.0PBS的混合溶液中进行差分脉冲伏安扫描,其扫描电压为-0.5~-0.75V。
步骤3:启动电化学反应,分别测量0.1ng/ml、5ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml的CEA溶液对应的电流强度,建立电化学电流强度与CEA溶液浓度之间的定量关系。
4、免疫传感器的电流响应特性
不同浓度的CEA标准样品进行测定后得出的标准曲线,电流的减少百分比整体的趋势是随着CEA浓度的增加而增加,其中在1-50ng/ml浓度范围内出现良好的线性关系,回归方程为y=0.0653x+12.492,相关系数为0.996,这种新型聚邻苯二胺纳米微球修饰的免疫传感器对CEA浓度的检出限为0.1ng/ml。
最终获得检测癌胚抗原电化学免疫传感器。
实施例2:
按所述的相同步骤重复进行实施例1,但是聚邻苯二胺制备中通入臭氧后,搅拌时间为3h。免疫传感器的制备中的清洗剂为1:1的硝酸、甲苯、去离子水;在20mM戊二醛溶液中浸渍24h;得到戊二醛修饰的玻碳电极在自制的聚邻苯二胺纳米微球溶液的混合液中浸渍10h。干燥后的免疫传感器于含有0.04%BSA的PBS溶液中4℃下浸泡3h。
最终制得检测癌胚抗原电化学免疫传感器。
实施例3:
按所述的相同步骤进行实施例1,但是无氧PBS溶液的pH=5.0。
实施例4:
按所述的相同步骤进行实施例1,但是无氧PBS溶液的pH=5.5。
实施例5:
按所述的相同步骤进行实施例1,但是无氧PBS溶液的pH=6.0。
实施例6:
按所述的相同步骤进行实施例1,但是无氧PBS溶液的pH=6.5。
实施例7:
按所述的相同步骤进行实施例1,但是无氧PBS溶液的pH=7.5。
实施例8:
按所述的相同步骤进行实施例1,但是无氧PBS溶液的pH=8.0。
实施例9:
按所述的相同步骤进行实施例1,但是检测方法中,孵育时间为10min。
实施例10:
按所述的相同步骤进行实施例1,但是检测方法中,孵育时间为20min。
实施例11:
按所述的相同步骤进行实施例1,但是检测方法中,孵育时间为30min。
实施例12:
按所述的相同步骤进行实施例1,但是检测方法中,孵育时间为50min。
实施例13:
按所述的相同步骤进行实施例1,但是检测方法中,孵育时间为60min。
采用实施例1制备的癌胚抗原电化学免疫传感器对加标样品进行检测:
取空白血清样品,采用标准加入法分别配置了不同浓度的癌胚抗原溶液,按照发明具体实施例1中的具体实验步骤,构建癌胚抗原电化学免疫传感器并对加标样品进行了检测,检测结果如表1所示,
表1牛血清中癌胚抗原的检测结果
由表1检测结果可知,结果的相对标准偏差小于3%,标明本发明对于血清中癌胚抗原的检测精度高,结果准确可靠。
如图3所示为实施1、3~8中,在不同pH值下无氧PBS溶液中进行测量,从图3中可以明显观察到pH值为7的无氧PBS溶液中电化学免疫传感器的电流响应最明显。
如图4所示为实施例1、9~13中,免疫传感器的孵育时间为10~60分钟得到的电流响应值。从图4中可以明显观察孵育时间在10~40分钟内,随着孵育时间的增长,电流响应值明显增大,当孵育时间超过40分钟后,随着孵育时间的增长,电流响应值增长缓慢。因此,孵育时间为40分钟最合适。
如图5所示为实施例1在0.1ng/ml到80ng/ml不同浓度的CEA溶液中得到的标准曲线图,其回归方程为y=0.4459x+27.046(R2=0.9981,n=18)。这种电化学免疫传感器对CEA的检出限为0.05ng/ml。
- 还没有人留言评论。精彩留言会获得点赞!