抑制素A定量检测试剂盒及其制备方法与流程
本发明涉及生物
技术领域:
,特别是涉及一种抑制素A定量检测试剂盒及其制备方法。
背景技术:
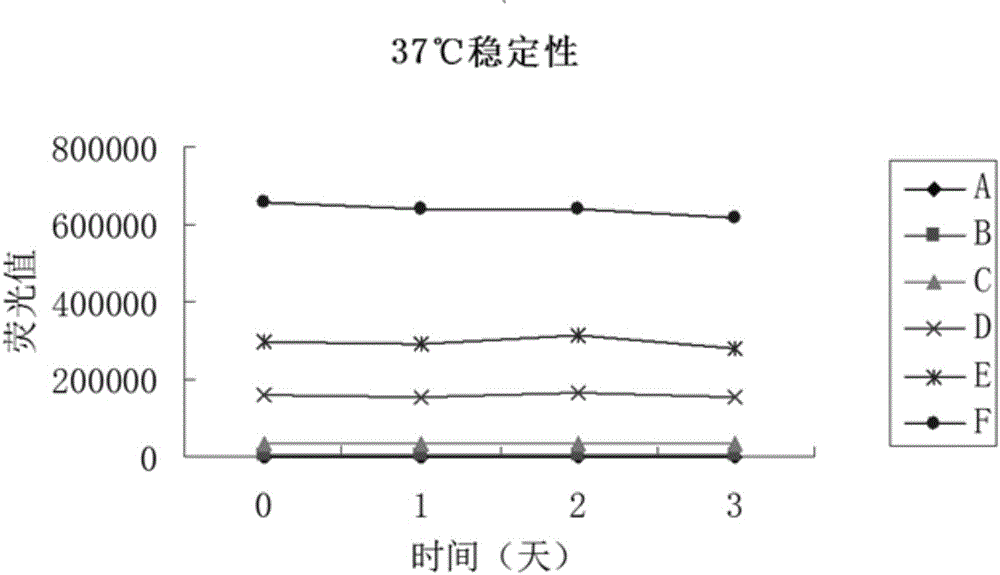
:抑制素(Inhibin,INH)是转化生长因子β(TGF-β)超家族成员之一,为α-亚单位和β-亚单位通过二硫键连接而成的异质二聚体糖蛋白激素。β-亚单位又有βA和βB两种形式,与α-亚单位分别形成抑制素A(INHA,αβA)和抑制素B(INHB,αβB)。目前,对于人抑制素A,检测试剂盒主要采用化学发光免疫测定法,对于人抑制素B,检测试剂盒主要采用酶联免疫反应。利用化学发光免疫测定法检测时,化学发光的发射强度依赖于各种环境因素,在不同的环境体系中,发射强度和时间的曲线有较大的差别,因此,需严格控制外界的各种因素。利用酶联免疫反应检测时,反应步骤繁琐,反应时间长,且酶反应易受各种干扰因素的干扰,反应的特异性和灵敏度低。对于抑制素A的检测,如何制备一种避免上述缺陷的试剂盒,是目前抑制素A检测亟待解决的问题之一。技术实现要素:本发明主要解决的技术问题是提供一种抑制素A定量检测试剂盒及其制备方法,可利用时间分辨免疫荧光测定技术进行抑制素A的检测,避免化学发光免疫测定法和酶联免疫反应检测时的缺陷。为解决上述技术问题,本发明提供一种抑制素A定量检测试剂盒,包括实验缓冲液、增强液、浓缩洗液、标记物、校准品及包被板;实验缓冲液包括体积比为0.1-100%的小牛血清和第一缓冲液;增强液为含0.4-0.6ml/LTritonX-100的水溶液;浓缩洗液包括3-5ml/LTween-20和第二缓冲液;标记物由抑制素A单克隆抗体与镧系元素离子螯合物按1:1-1:3m/m制得;校准品包括6个浓度的冻干粉,冻干粉由抑制素A抗原和第三缓冲液冷冻干燥而成;包被板为采用包被液、封闭液、反应板制成的包被板,包被液包括0.1-10μg/mL抑制素A单克隆抗体和第四缓冲液,封闭液为第五缓冲液。其中,第一缓冲液各组分及浓度为:1-10g/LNaCl,0.1-10‰EDTA,0.1-20‰FPC,0.1-10‰鼠血清,0.1-10‰硫柳汞,0.1-10%曙红,pH7.0-8.0、5-100mmol/LTris-HCl,其中,FPC、鼠血清的浓度为体积比,EDTA、硫柳汞、曙红的浓度为质量比;增强液的水溶液包括:0.4-0.6g/L乙酸钠,0.002-0.004g/Lβ-NTA,0.020-0.030g/LTOPO,0.7-0.9‰冰醋酸,0.5-1.5‰无水乙醇,其中,冰醋酸、无水乙醇的浓度为体积比;第二缓冲液各组分及浓度为:22.4-22.6g/LNaCl,0.4-0.6ml/LFPC,0.07-0.09‰亮蓝母液,pH7.0-8.0、5-100mmol/LTris-HCl,其中,FPC、亮蓝母液的浓度为体积比;第三缓冲液各组分及浓度为:1-100g/LBSA,0.1-50g/LNaCL,0.1-10g/LNaN3,0.1-10mL/L硫柳汞,pH7.0-8.0、5-100mmol/LTris-HCl;第四缓冲液、第五缓冲液为pH7.0-8.0、5-100mmol/LTris-HCl缓冲液。其中,小牛血清的浓度为50%,TritonX-100的浓度为0.5ml/L,Tween-20的浓度为4ml/L,抑制素A单克隆抗体与镧系元素离子螯合物的比例为1:1m/m,标准品的抑制素A抗原的浓度为0pg/mL、50pg/mL、200pg/mL、600pg/mL、1000pg/mL、2000pg/mL。其中,第一缓冲液各组分及浓度为:5g/LNaCl,4‰EDTA,10‰FPC,6‰鼠血清,6‰硫柳汞,6%曙红,pH7.8、50mmol/LTris-HCl;增强液的水溶液包括:0.5g/L乙酸钠,0.003g/Lβ-NTA,0.024g/LTOPO,0.8‰冰醋酸,1‰无水乙醇;第二缓冲液各组分及浓度为:22.5g/LNaCl,0.5ml/LFPC,0.08‰亮蓝母液,pH7.8、50mmol/LTris-HCl;第三缓冲液各组分及浓度为:50g/LBSA,20g/LNaCL,5g/LNaN3,6mL/L硫柳汞,pH7.8、50mmol/LTris-HCl;第四缓冲液、第五缓冲液为pH7.8、50mmol/LTris-HCl缓冲液。其中,镧系元素为铕元素。为解决上述技术问题,本发明提供一种抑制素A定量检测试剂盒的制备方法,包括以下步骤:实验缓冲液的制备方法:在第一缓冲液中加入体积比为0.1-100%的小牛血清;增强液的制备方法:增强液为含0.4-0.6ml/LTritonX-100的水溶液;浓缩洗液的制备方法:在第二缓冲液中加入3-5ml/LTween-20;标记物的制备方法:将抑制素A单克隆抗体和镧系元素离子螯合物按1:1-1:3m/m混合,混合均匀后,28-37℃静置12-48h,将静置后的混合物经SephacryIS-200层析柱(Φ1.0×30cm)洗脱,获得标记物;校准品的制备方法:将抑制素A抗原用第三缓冲液稀释至6个浓度,将该6个浓度的液态校准品进行真空冷冻干燥,获得校准品冻干粉;包被板的制备方法:包被液包括0.1-10μg/mL抑制素A单克隆抗体和第四缓冲液,封闭液为第五缓冲液,在反应板中加入包被液,再用封闭液进行封闭,晾干,获得包被板;将制备的实验缓冲液、增强液、浓缩洗液、标记物、校准品及包被板分装、组装,完成抑制素A定量检测试剂盒的制备。其中,第一缓冲液各组分及浓度为:1-10g/LNaCl,0.1-10‰EDTA,0.1-20‰FPC,0.1-10‰鼠血清,0.1-10‰硫柳汞,0.1-10%曙红,pH7.0-8.0、5-100mmol/LTris-HCl,其中,FPC、鼠血清的浓度为体积比,EDTA、硫柳汞、曙红的浓度为质量比;增强液的水溶液包括:0.4-0.6g/L乙酸钠,0.002-0.004g/Lβ-NTA,0.020-0.030g/LTOPO,0.7-0.9‰冰醋酸,0.5-1.5‰无水乙醇,其中,冰醋酸、无水乙醇的浓度为体积比;第二缓冲液各组分及浓度为:22.4-22.6g/LNaCl,0.4-0.6ml/LFPC,0.07-0.09‰亮蓝母液,pH7.0-8.0、5-100mmol/LTris-HCl,其中,FPC、亮蓝母液的浓度为体积比;第三缓冲液各组分及浓度为:1-100g/LBSA,0.1-50g/LNaCL,0.1-10g/LNaN3,0.1-10mL/L硫柳汞,pH7.0-8.0、5-100mmol/LTris-HCl;第四缓冲液、第五缓冲液为pH7.0-8.0、5-100mmol/LTris-HCl缓冲液。其中,小牛血清的浓度为50%,TritonX-100的浓度为0.5ml/L,Tween-20的浓度为4ml/L,抑制素A单克隆抗体与镧系元素离子螯合物的比例为1:1m/m,标准品的抑制素A抗原的浓度为0pg/mL、50pg/mL、200pg/mL、600pg/mL、1000pg/mL、2000pg/mL。其中,第一缓冲液各组分及浓度为:5g/LNaCl,4‰EDTA,10‰FPC,6‰鼠血清,6‰硫柳汞,6%曙红,pH7.8、50mmol/LTris-HCl;增强液的水溶液包括:0.5g/L乙酸钠,0.003g/Lβ-NTA,0.024g/LTOPO,0.8‰冰醋酸,1‰无水乙醇;第二缓冲液各组分及浓度为:22.5g/LNaCl,0.5ml/LFPC,0.08‰亮蓝母液,pH7.8、50mmol/LTris-HCl;第三缓冲液各组分及浓度为:50g/LBSA,20g/LNaCL,5g/LNaN3,6mL/L硫柳汞,pH7.8、50mmol/LTris-HCl;第四缓冲液、第五缓冲液为pH7.8、50mmol/LTris-HCl缓冲液。其中,镧系元素为铕元素。本发明的有益效果是:区别于现有技术的情况,本发明的抑制素A定量检测试剂盒包括实验缓冲液、增强液、浓缩洗液、标记物、校准品及包被板,通过上述各部分可对抑制素A进行定量检测,具体为采用时间分辨免疫荧光测定技术进行测定,在测定时,可避免化学发光免疫测定法和酶联免疫反应检测时的缺陷,且测定结果准确、可靠。附图说明图1是本发明抑制素A定量检测试剂盒剂量-反应标准曲线;图2是本发明抑制素A定量检测试剂盒热稳定性测试中荧光值走势图;图3是本发明抑制素A定量检测试剂盒与对照试剂盒样本检测线性相关性图。具体实施方式本发明抑制素A定量检测试剂盒包括实验缓冲液、增强液、浓缩洗液、标记物、校准品及包被板,上述各部分的制备方法具体如下。实验缓冲液的制备:在含5g/LNaCl、4‰EDTA、10‰FPC、6‰鼠血清、6‰硫柳汞、6%曙红的pH7.8、50mmol/L的Tris-HCl溶液中加入体积比为50%的小牛血清,混合均匀。增强液的制备:将0.5g/L乙酸钠、0.003g/Lβ-NTA、0.024g/LTOPO、0.8‰冰醋酸、1‰无水乙醇、0.5ml/LTritonX-100配制成水溶液,配制成的水溶液即增强液。其中,β-NTA为β-萘甲酰三氟丙酮,TOPO为三正辛基氧化磷。浓缩洗液的制备:在含22.5g/LNaCl、0.5ml/LFPC、0.08‰亮蓝母液的pH7.8、50mmol/L的Tris-HCl溶液中加入4ml/LTween-20,混合均匀。标记物的制备:将抑制素A单克隆抗体按照1:1m/m加入Eu-DTTA-Na瓶中,充分混匀,置于35℃静置30h,将静置后的混合物过SephacryIS-200层析柱(Φ1.0×30cm),用50mmol/L、pH7.8的Tris-HCL缓冲液洗脱,获得标记物。此制备的标记物为母液,之后按1:30-1:50稀释使用。其中,混合比例1:1为质量比,Eu-DTTA-Na为Eu3+-N2-[P-异氰酸-苄基]-二乙烯三胺四乙酸钠。校准品的制备:以抑制素A抗原标准物质为参比,将抑制素A抗原用缓冲液稀释成0pg/mL、50pg/mL、200pg/mL、600pg/mL、1000pg/mL、2000pg/mL6个浓度的液态校准品,将该液态校准品进行真空冷冻干燥,获得冻干粉校准品。其中,缓冲液为含50g/LBSA、25g/LNaCL、8g/LNaN3、8mL/L硫柳汞的pH7.8、50mmol/L的Tris-HCl溶液。包被板的制备:将抑制素A单克隆抗体用缓冲液稀释至4μg/mL,其中,缓冲液为pH7.8、50mmol/LTris-HCl缓冲液,用4μg/mL的抑制素A单克隆抗体在反应板上进行包被,将反应板洗涤1次,然后再用封闭液进行封闭,最后将反应板甩干、晾干,真空包装,2-8℃保存备用。对于上述缓冲液,还可为50mmol/L、pH9.6的碳酸缓冲液、20mmol/L、pH4.5的磷酸盐缓冲液或50mmol/L、pH4.5的柠檬酸盐缓冲液。对上述制备的实验缓冲液、增强液、浓缩洗液、Eu3+标记抑制素A抗体、校准品进行分装,对上述制备的抑制素A抗体包被的包被板进行铝箔袋封装,其中,标记物按500μL/瓶或1.1ml/瓶进行分装,校准品以500μL/瓶或1.0ml/瓶进行冷冻干燥。将分装、封装好的物品进行组装,即得本发明试剂盒。对于组装前的物品,需抽出3份进行特异性、精密性、灵敏度及稳定性检测,检测合格后才能组装。对于上述制备的试剂盒,其使用方法具体为:将试剂及所需数量的包被板平衡至室温(20-25℃);将40ml浓缩洗液和960ml蒸馏水在干净的容器中混合,作为工作洗涤液备用;向校准品和标记物中加入相应体积的纯化水,具体地,半自动:校准品和标记物均加入0.5ml纯化水,全自动:校准品加入1.0ml纯化水,标记物加入1.1ml纯化水,加入纯化水后,充分溶解,轻轻混匀;将标记物用实验缓冲液按体积比1:30加入洁净的一次性容器中并混匀;按照25ul/孔加入校准品和样本,按照100μl/孔加入实验缓冲液,加贴封片;包被板在室温下,用振荡器缓慢振荡孵育1.5小时,孵育结束后,用洗板机洗涤4次,拍干;向每孔中加入100μl已配好的铕标记物工作液,混匀,加贴封片;包被板在室温下,用振荡器缓慢振荡孵育1.5小时,孵育结束后,用洗板机洗涤6次,拍干;洗涤完成后,向每孔中加入增强液100μl,于室温下缓慢振荡5分钟后上机检测,在30分钟内完成检测。在实际应用中,可将检测结果按规定数据进行曲线拟合分析,转入唐氏综合症风险评估软件,获得胎儿出生缺陷的发生机率。综上所述,本发明试剂盒采取镧系离子中的铕作为示踪物,利用其独特的荧光特性,如:荧光衰变时间长、激发光和发射光之间的Stokes位移较大和荧光光带窄,采用波长分辨和时间延迟技术以及解离-增强技术,可最大程度消除背景荧光的干扰,使得检测结果更加可靠,同时具有敏感性高、重复性好、特异性强、定量范围宽、检测速度快、标记物稳定等特点。下面详细阐述本发明试剂盒的性能特点。如图1所示,图1是本发明抑制素A定量检测试剂盒剂量-反应标准曲线,标注曲线的绘制具体为:将抑制素A校准品浓度值与相应反应孔测定的荧光值用LOG-LOG_B数学模型进行拟合,绘制标准曲线。在试剂盒的测量范围内,剂量-反应标准曲线线性相关系数应不低于0.9900,而图1所示,剂量-反应标准曲线线性相关系数达到0.998。如表1所示,表1为本发明试剂盒灵敏度测试,具体为,将试剂盒校准品A点重复检测20次,计算其荧光值均值和标准偏差(SD),求得相对应的浓度值,结果不高于5.0pg/mL。表1本发明试剂盒灵敏度测试本发明试剂盒特异性测试,具体为:与108pg/ml促甲状腺激素(hTSH)的交叉反应率不高于1%;与108pg/ml黄体生成素(hLH)的交叉反应率不高于1%;与108pg/ml催乳素(PRL)的交叉反应率不高于1%;与108pg/ml绒毛膜促性腺激素(hCG)的交叉反应率不高于1%;与2×107pg/ml甲胎蛋白(hAFP)的交叉反应率不高于1%。如表2所示,表2为本发明试剂盒准确性测试,测试结果具体为:以企业校准品为对照,本发明校准品B、C点的实测浓度与标示浓度绝对偏差的绝对值均≤6pg/ml,本发明校准品D-F点的实测浓度与标示浓度相对偏差的绝对值≤20%。表2本发明试剂盒准确性测试校准点BCDEF标示值5020060010002000测定值51.61201.81598.71995.661993.91偏差1.591.840.22%0.44%0.31%如表3所示,表3为本发明试剂盒批内不精密度测试,具体为:一次实验中分别测定在标准曲线范围内高、中、低3种不同浓度的质控品,各测定20个平行孔,计算测定结果的平均值标准差(SD),批内不精密度结果应符合批内不精密度(CV%)应不超过15.0%。表3本发明试剂盒批内不精密度测试如表4所示,表4为本发明试剂盒批间不精密度测试,具体为:用三批试剂盒分别测定低值质控品,每批试剂盒各测10孔,计算30次测定结果的平均值与标准差(SD),批间不精密度结果应符合批间不精密度(CV%)应不超过20.0%。表4表4为本发明试剂盒批间不精密度测试如表5所示,表5为本发明校准品不精密度测试,具体为:取同一批号校准品20套,再从每套校准品(零值除外)中对各浓度校准品各取1孔(每个浓度的校准品点20孔)进行检测,计算测定结果的平均值与标准差(SD),计算校准品瓶间标准差与校准品均一性CV。校准品中B点、C点的不精密度(CV)应不超过20.0%,D点、E点、F点的不精密度(CV)应不超过15.0%。表5本发明校准品不精密度测试如图2所示,图2是本发明抑制素A定量检测试剂盒热稳定性测试中荧光值走势图,热稳定性测试(加速破坏测试)具体为:试剂盒在37℃进行烘烤,烘烤3天,在烘烤过程中检测试剂盒的性能指标。根据图2所示数值,说明本发明试剂盒具有良好的热稳定性。如图3所示,图3是本发明抑制素A定量检测试剂盒与对照试剂盒样本检测线性相关性图,即本发明试剂盒与对照试剂盒临床样本相关性分析,具体为,检测400例孕母血清样本,两种试剂盒的线性回归方程为y=1.0745x-11.872,R2=0.9984。根据图3所示,本发明试剂盒与对照试剂盒的检测结果一致。其中,对照试剂盒为BECKMANCOULTER公司的抑制素A定量检测试剂盒。以上所述,本发明试剂盒线性范围宽、灵敏度高、特异性强、准确性好、精密性好、热稳定性好。以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的
技术领域:
,均同理包括在本发明的专利保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1