一种基于数字微流控技术和表面增强拉曼散射技术的靶标检测方法及系统与流程
本发明属于数字微流控技术领域,主要涉及一种基于数字微流控技术和表面增强拉曼散射技术的靶标检测方法。
背景技术:
数字微流控技术(digitalmicrofluidics,dmf)是一种新兴的、基于介电润湿效应在微电极阵列上实现对单个离散的液滴精准操纵的微流控技术。通过分别对电极阵列上不同的电极施加电压,可以实现液滴的移动、生成、混合和分裂(1、miller,e.m.;ng,a.h.;uddayasankar,u.;wheeler,a.r.analbioanalchem2011,399,337-345;2、choi,k.;ng,a.h.;fobel,r.;wheeler,a.r.annurevanalchem2012,5,413-440.)。数字微流控芯片由于其灵活性高、重构性强,易于与其他技术如光学、电化学、质谱、核磁等技术结合,在蛋白质分析、细胞培养等方面得到了广泛应用,尤其适合步骤繁琐、多重复操作的免疫反应(3、ng,a.h.;choi,k.;luoma,r.p.;robinson,j.m.;wheeler,a.r.analchem2012,84,8805-8812.)。基于数字微流控技术的免疫反应与一般大体积下的免疫分析方法相比优势在于:1、试剂消耗少:通过调控电极尺寸和芯片上、下极板的高度,液滴体积可控在纳升至微升的范围内;2、检测时间短:由于反应集中在纳升至微升的液滴里进行,扩散距离相比大体积降低了两个数量级,加之数字微流控技术特有的动态孵育技术,使得抗原、抗体分子更快接触免疫磁珠或者芯片表面,大大缩短免疫反应所需时间(4、shamsi,m.h.;choi,k.;ng,a.h.;wheeler,a.r.labchip2014,14,547-554.);3、自动化:自动化过程代替技术人员的操作,减小了人为误差,节省人力资源的同时得到重复、可信的结果,尤其适合传染性样本的检测。
根据之前文献报道,数字微流控平台上的免疫分析方法一般以化学发光、荧光、电化学等技术作为检测手段(5、ng,a.h.;choi,k.;luoma,r.p.;robinson,j.m.;wheeler,a.r.analchem2012,84,8805-8812;6、emani,s.;sista,r.;loyola,h.;trenor,c.c.,3rd;pamula,v.k.;emani,s.m.bloodcoagulfibrinolysis2012,23,760-768;7、rackus,d.g.;dryden,m.d.;lamanna,j.;zaragoza,a.;lam,b.;kelley,s.o.;wheeler,a.r.labchip2015,15,3776-3784.)。这些检测手段提供了准确、灵敏的分析结果,但也不可避免地存在一些局限性。酶的使用大大增加了检测成本,而且其不稳定性容易造成分析结果差异性大;荧光技术固有的光漂白的缺点,限制其检测灵敏度的提高;电化学分析手段虽然具有灵敏、低成本的优势,但数字微流控芯片上复杂的内置电极制作过程限制了其发展。因此,需要发展一种简单、低成本和高灵敏的检测分析技术。
表面增强拉曼散射技术(surfaceenhancedramanscattering,sers)作为一种分子振动光谱技术,可以精确反映单个分子的振动信息,被认为是一种超灵敏、非标记的检测分析技术(8、wang,y.;yan,b.;chen,l.chemrev2013,113,1391-1428.)。由于其超高灵敏度、高分辨率、抗光漂白和不受水干扰等优势,由此技术发展产生的表面增强拉曼探针被广泛应用于dna分析、蛋白质分析、生物成像等领域(9、li,j.;zhu,z.;zhu,b.;ma,y.;lin,b.;liu,r.;song,y.;lin,h.;tu,s.;yang,c.analchem2016,88,7828-7836.)。显著的增强效应和均一的“热点”分布是表面增强拉曼探针应用于定量分析的关键。
因此我们提出了一种以免疫分析为基础,结合自动化数字微流控平台和超灵敏表面增强拉曼散射技术的新方法以实现靶标的快速、灵敏、自动化定量检测。
技术实现要素:
本发明提出一种结合数字微流控技术和表面增强拉曼散射技术的靶标检测方法和系统,以实现复杂体系中痕量靶标的快速、灵敏、自动化定量分析。
本发明的技术方案为:
该靶标检测系统包括数字微流控芯片、表面增强拉曼探针、拉曼信号采集单元和用于靶标载体的磁珠四部分;其中,所述的数字微流控芯片由上、下极板两部分组成,下极板由下至上包括衬底、电极阵列、介质层和疏水层,上极板由上至下包括基底、导电层和疏水绝缘层;表面增强拉曼探针包括金属核、拉曼报告分子、壳层三部分,拉曼报告分子包埋在核壳结构之间。表面增强拉曼探针用于和磁珠孵育,使探针标记在形成免疫复合物的磁珠上;芯片上的洗涤过程是通过永久磁铁或者电磁铁固定芯片上的磁珠,通过操控电极将不包含磁珠的上清液移走至废液池。所述的金属核,优选为金核,所述的壳层,优选为银壳层。
所述的电极阵列为基底上特定图案的金属电极阵列,包括贮液池电极、驱动电极和接触电极三部分,电极阵列通过金属蒸镀、光刻和湿法刻蚀技术得到;所述的介质层为介电性能好的、透明度高的、抗击穿能力强的介电材料;疏水层材料为特氟龙的水相分散液或者油相分散液。
数字微流控芯片的上、下极板之间填充油,液滴浸润在油相中,以提高液滴能动性和防止液滴挥发。液滴中加入表面活性剂防止生物粘附,避免磁珠表面的蛋白以及液滴中的蛋白粘附芯片表面,提高液滴能动性及提高芯片的使用寿命。
本发明的又一技术方案为:
基于数字微流控技术和表面增强拉曼散射技术的靶标检测方法,包括如下步骤:(1)免疫磁珠的准备:选择顺磁性磁珠作为固相载体,并包被相应的捕获抗体用于特异性捕获样品中的靶标;(2)芯片组装及上样:在数字微流控芯片上引入一个含有免疫磁珠的液滴,组装上极板并在芯片上、下极板之间填充油,分别在不同的贮液池引入洗液、样品、带有生物素标记的检测抗体、链酶亲和素和生物素化的表面增强拉曼探针液滴;(3)免疫反应:依次生成含有样品和检测抗体的液滴,相继与免疫磁珠进行动态孵育,形成磁珠-抗体-抗原-抗体免疫复合物,每次孵育后进行充分洗涤;(4)拉曼探针标记:依次生成含有链酶亲和素和表面增强拉曼探针的液滴,相继与磁珠进行动态孵育,探针标记在形成免疫复合物的磁珠上,每次孵育后进行充分洗涤;(5)拉曼信号采集:移走废液及贮液池中未反应的液滴,将芯片置于拉曼采集平台上进行信号采集。
其中,步骤(3)和(4)中,液滴的生成通过依次控制贮液池电池和相邻驱动电极的通断电实现。芯片上的动态孵育步骤通过控制相应电极的通断电实现,设置程序使液滴在相邻的上、下、左、右四个相邻的电极上自动化循环往复运动。芯片上的洗涤过程是通过永久磁铁或者电磁铁固定芯片上的磁珠,通过操控电极将不包含磁珠的上清液移走至废液池,并从清洗液的贮液池中生成一个洗液液滴,对磁珠进行重悬混匀。
其中,步骤(5)中,拉曼信号采集可采用大型拉曼仪器或者小型便携式拉曼采集仪。
本发明数字微流控平台结合表面增强拉曼散射技术的方法有如下优势:1、数字微流控技术具有液滴体积小,试剂消耗少的优点,因此大大降低了检测成本,同时缩短了检测时间;2、数字微流控技术最突出的优势在于其自动化和集成化,其自动化大大简化了检测过程,节省了人力资源,同时减小了人为的误差以得到准确、重复、可信的结果,而且这种非直接接触的检测方式避免了二次感染的隐患,尤其适合传染性样本的检测;其集成化的优势使得数字微流控技术易与其他技术如质谱、核磁、拉曼等技术集成,极大拓展了数字微流控技术在药物筛选、疾病诊断、细胞培养等方面的应用;3、具有核壳结构并包埋拉曼报告分子的表面增强拉曼探针,由于拉曼报告分子和结构分子被包埋在核和壳层之间,因此核壳之间可形成亚纳至纳米级别的间隙,形成大量均一的“热点”以产生显著的拉曼增强效应,可用于超灵敏的定量分析,其拉曼信号强、均一性好、稳定性高,可应用于生物医疗、食品安全、环境监测等领域。表面增强拉曼技术超灵敏的特点极大地提高了检测的灵敏度和可靠性,而且其具有辨别分子振动微小变化的能力,能够在非标记拉曼方面实现超灵敏、即时检测。
附图说明
图1为数字微流控芯片。(a)芯片结构示意图;(b)芯片侧面展示图。
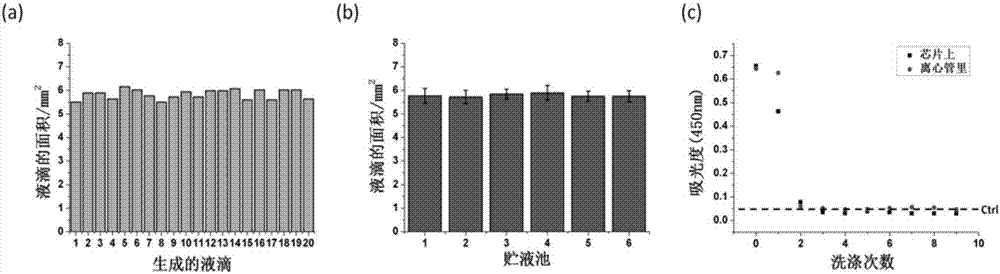
图2为数字微流控芯片工作性能。(a)、(b)液滴生成均一性表征;(c)芯片上洗涤效率。
图3为表面增强拉曼探针合成。
图4为表面增强拉曼探针表征。(a)表面增强拉曼探针tem表征;(b)表面增强拉曼探针均一性表征;(c)表面增强拉曼探针稳定性表征。
图5为dmf-sers方法用于h5n1定量检测。(a)不同h5n1浓度样品所采集的拉曼信号;(b)血清中h5n1定量检测。
图6为dmf-sers方法对于h5n1检测特异性响应。
图7为dmf-sers方法与标准方法对比。
具体实施方式
1、芯片的制作
如附图1所示,数字微流控芯片分为上、下极板两部分,下极板加工工艺复杂,包括衬底、电极阵列、介质层和疏水层;上极板包括基底、导电层和绝缘疏水层。下极板的电极阵列包括30个驱动电极(每个尺寸为2.2mm×2.2mm),6个贮液池电极(每个尺寸为5.4mm×3.6mm),电极之间的间隙为20μm,以及单排的48个接触电极用于连接驱动系统。
下极板具体制作流程:
(1)下极板采用石英玻璃作为衬底,通过磁控溅射的方法蒸镀300nm厚的铬层,然后通过光刻技术及湿法刻蚀技术形成具有特定图案的电极阵列;
(2)介质层选用介电常数高、厚度均匀、抗击穿能力强的绝缘材料,本实施例选用负性光刻胶su-81040通过旋涂光刻形成,厚度约为11.7μm;
(3)疏水层采用特氟龙材料(teflon1600),本方案使用聚四氟乙烯ptfe水分散液旋涂退火工艺形成,厚度约为200nm。
上极板具体制作流程:
(1)基底采用普通透明玻璃;
(2)导电层选用透光率高、导电性能好的材料,利用磁控溅射的方法在基底镀上一层氧化铟锡(即ito);
(3)通过等离子体活化ito玻璃表面,增强表面润湿性,改善表面粘附力;
(4)上极板疏水层同样采用特氟龙材料(teflon1600),通过旋涂聚四氟乙烯ptfe水分散液形成。
上、下极板用双面胶将其分隔开,高度约为360μm,液滴被夹在中间形成三明治结构,因此单个贮液池电极上液滴体积约为7μl,单个驱动电极上液滴体积约为1.7μl。
2、数字微流控平台
数字微流控自动化平台包括芯片驱动系统、微流操控软件、数字微流控芯片、网络摄像头、永久磁铁(或电磁铁)以及拉曼集成系统。芯片由芯片支架固定并通过pogo针接口(48针或96针)连接到芯片驱动装置上,通过驱动系统在芯片的上极板和下极板的电极之间产生正弦函数电流(0~180vrns,10khz)以操控液滴进行移动、生成、分裂和混合。微流操控软件可以控制电极的“开”和“关”,并具备实时控制和分步控制两种操控方式。
芯片通过油封(氟油fc40或者硅油)的方式隔绝污染,防止液滴挥发并提高液滴移动能动性。液滴中加入表面活性剂,进一步提高液滴的能动性和防止液滴中的蛋白粘附芯片表面,本实施例中,所用的表面活性剂为普朗尼克f127(0.1wt%)。
液滴的生成通过按一定次序进行电极的通断电控制,从贮液池电极单元产生一个小液滴,生成的液滴大小约为1.7μl,可连续生成3~4个液滴。芯片上的动态孵育步骤通过控制相应电极的通断电实现,设置程序使液滴在相邻的上、下、左、右四个相邻的电极上自动化循环往复运动。芯片上的洗涤过程是通过永久磁铁或者电磁铁固定芯片上的磁珠,通过操控电极将不包含磁珠的上清液移走至废液池,并从清洗液的贮液池中生成一个洗液液滴,对磁珠进行重悬混匀。
3、表面增强拉曼探针的合成
表面增强拉曼探针为核壳结构,包括金核、拉曼报告分子、银壳层三部分,拉曼报告分子包埋在核壳结构之间。本实施例选用的金核大小为50nm,包埋的拉曼报告分子为4-巯基苯甲酸(4-mercaptobenzoicacid,4-mba),银壳层的厚度为5nm。
其中,50nm金纳米粒子通过柠檬酸钠还原氯金酸的方法合成,具体方法为:首先,所用的玻璃器皿提前用新制的王水金浸泡,然后用超纯水洗净;然后,在圆底烧瓶中加入100ml0.01wt%氯金酸溶液并在回流和强搅拌的条件下加热煮沸;接着向煮沸的氯金酸溶液中快速加入0.8ml1wt%新制的柠檬酸钠溶液;最后,在回流和强搅拌的条件下煮沸半小时左右即可得到均一的50nm的金纳米粒子。
表面增强拉曼探针的合成方法具体为:首先,在金纳米粒子表面吸附4-巯基苯甲酸分子4-mba通过金-硫化学键(au-s)牢牢吸附在金纳米粒子表面。取一定量的金溶胶(23pm)于圆底烧瓶中,在轻微搅拌下加入一定量1mm的4-mba(乙醇溶解)使得终浓度为3μm,在室温下孵育1小时;然后,通过离心(5000rpm,5min)除去游离的4-mba分子,所得的金沉淀物用新制的27μm的柠檬酸钠水溶液重悬,柠檬酸盐通过静电排斥作用稳定纳米粒子以防止金纳米粒子团聚;其次,在回流和搅拌下将修饰过4-mba的金纳米粒子(46pm,5ml)加热煮沸,依次缓慢逐滴加入硝酸银溶液(20mm,100μl)和柠檬酸钠溶液(20mm,300μl),银壳层也是在柠檬酸钠还原下形成,因为柠檬酸钠作为一个弱还原剂不仅可以缓慢还原金属离子,而且作为保护剂防止纳米粒子团聚;最后,煮沸20分钟左右即可得到包埋4-mba的表面增强拉曼粒子。为了将sers粒子应用于免疫体系中,对sers粒子进行生物素化(biotin)修饰。在新制备的sers粒子(46pm,1ml)中加入biotin-peg-sh(100μm,47μl),加入的量为理论上该分子满单层吸附的量,在室温下孵育1小时,然后通过离心除去游离的biotin-peg-sh,重悬在缓冲溶液中,即可得到经过biotin修饰的sers探针。所合成的sers探针拉曼信号强、均一性好、稳定性高。
4、免疫磁珠的准备
在带有甲苯璜酰基的磁珠(
5、基于dmf-sers方法的定量检测步骤
基于数字微流控技术和表面增强拉曼散射技术,实现靶标h5n1定量检测步骤如下:(1)芯片组装及上样:首先,在数字微流控芯片上引入一个2μl含有免疫磁珠(5mg/ml)的液滴,组装上极板并在芯片上、下极板之间填充氟油(fc40),然后分别在不同的贮液池引入7μl洗液、样品、带有生物素标记的检测抗体(biotinylatedrabbitanti-h5n1hemagglutininpolyclonalantibody,7.5μg/ml)、链酶亲和素和sers探针液滴;(3)免疫反应:体系所用电压为100vdc,10khz,通过依次控制电极的通断电,依次生成含有样品和检测抗体的液滴,相继与免疫磁珠进行动态孵育5分钟左右,形成磁珠-抗体-抗原-抗体免疫复合物,每次孵育后进行3~5次充分洗涤;(4)拉曼探针标记:依次生成含有链酶亲和素和sers探针的液滴,相继与磁珠进行动态孵育5分钟左右,使探针标记在形成免疫复合物的磁珠上,每次孵育后进行3~5次充分洗涤;(5)拉曼信号采集:重悬磁珠之后,移走废液及贮液池中未反应的液滴,将芯片及磁珠液滴置于拉曼采集平台上进行信号采集。测试所用的拉曼仪器为便携式拉曼仪(iramanplus),所采用的激光为785nm激光,采集模式为单次采集,采集时间为10秒。4-mba两个特征的拉曼谱峰分别在1071cm-1and1580cm-1处,其中采用1071cm-1处的谱峰强度进行定量,因为此峰的拉曼强度略高于1580cm-1峰的强度。
本发明的结果见图1至图7。其中:
图1为数字微流控芯片的结构示意图(a)及侧面展示图(b)。图(a)中1为芯片接入外部电路的接触电极;2为驱动电极;3为贮液池电极。图(b)中4为上基底层;5为导电玻璃(ito)涂层;6为疏水化涂层;7为介电层;8为下极板基底层;9为外部接入电路;10为上、下极板间隔层;11为下极板电极层;12为夹在上、下极板间的液滴。
图2为芯片工作性能表征,分别包括液滴生成均一性的表征(a和b)和洗涤效率(c)的表征。芯片所生成液滴的大小由其体积决定,由于芯片上、下极板的高度是固定的,因此液滴的大小由其面积决定,通过软件对生成的液滴进行面积拟合。图(a)和(b)分别表示芯片上同一贮液池和不同贮液池所生成液滴的面积。芯片上洗涤效率的表征方法如下:ca-m-beads分散在游离hrp的液滴里,在芯片上实施洗涤过程(同时在离心管里以相同体积实施洗涤过程作为对比),收集每一次的洗液于96孔板中,加底物tmb显色进行吸光度的测定,通过洗液中hrp的量表征洗涤效率。
图3为表面增强拉曼探针合成示意图,为50nm金核吸附拉曼报告分子(4-mba),包被5nm厚的银壳层,以biotin-peg-sh分子进行sers粒子表面功能化修饰。
图4为表面增强拉曼探针的表征。(a)为探针的tem表征,浅色的银壳层均匀包被深颜色的金核,壳层厚度约为5nm;(b)为探针的均一性考察,其拉曼信号随着浓度的增大成线性增强,说明探针均一性良好,可用于定量检测;(c)为探针的稳定性考察,分别考察表面未修饰的sers粒子(黑)、经过biotin修饰的sers粒子(红)的稳定性,该图表明经过biotin修饰的sers粒子稳定性大大提高。
图5为dmf-sers方法用于h5n1定量检测。(a)为不同浓度样品所采集的拉曼光谱;(b)为血清中h5n1定量检测,以拉曼光谱1071cm-1处的强度进行定量分析。
图6为dmf-sers方法对于h5n1检测特异性响应。以常见的几种蛋白标志物prostatespecificantigen(psa),c-reactiveprotein(crp),hepatitisbsurfaceantigen(hbsag),cardiactroponint(ctnt)为负对照,验证dmf-sers方法对h5n1检测的特异性(各标志物的浓度分别为h5n1:0.085nm;psa,crp,hbsag:0.85nm;ctnt:0.135nm)。
图7为dmf-sers方法与标准方法对比,以人血清为复杂体系,以相同h5n1浓度的血清样品进行该方法与标准elisa方法的一致性分析。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种便携式智能拉曼光谱采集设备的制造方法与工艺
- 用于改善基底表面硬度及耐磨性的Ni‑WC复合涂层及其制备的制造方法与工艺
- 一种具有SERS活性的金/银/聚合物/银核壳纳米蘑菇材料及其制备方法和应用与制造工艺
- 用于增强使用无执照射频谱带进行的传输的帧结构和先听后讲规程(LBT)的技术的制造方法与工艺
- 一种基于近邻协同增强的高光谱混合像元分类方法与制造工艺
- 一种单分散银壳磁性微球的制备方法及其SERS应用与制造工艺
- 一种大口径材料表面散射的高速测量装置和方法与制造工艺
- 纳米金比色探针的制备方法及其检测碘离子的方法与制造工艺
- 一种复合型纳米结构拉曼增强基底、制备方法及应用与制造工艺
- 一种CaF2光学基底表面和亚表面损伤探测方法与制造工艺