TOR蛋白抑制剂抑制植物枯萎病菌、黄萎病菌的新用途的制作方法
本发明涉及TOR蛋白抑制剂的新用途,尤其涉及TOR蛋白抑制剂抑制植物枯萎病菌、黄萎病菌的新用途。
背景技术:
植物枯萎病是典型的维管束病害,发病突然,症状包括严重的点斑、萎蔫或整株植物的死亡等。枯萎病的病原菌为尖孢镰刀菌(Fusarium oxysporum),属于半知菌亚门,镰刀菌属。枯萎病菌是一种世界性分布的土传病原真菌,寄主范围广泛,可引起瓜类、茄科、香蕉、棉花、豆科及花卉等100多种植物枯萎病的发生。植物黄萎病是危害较为严重的维管束病害,其病原菌主要为大丽轮枝菌(Verticillium dahliae Kleb)和黑白轮枝菌(Verticillium alboatrum),为半知菌亚门、淡色孢科、轮枝菌属。大丽轮枝菌由于寄主极其广泛,对高温和剧烈温度变化的适应能力较强,所以在棉花等众多感染黄萎病的植物上主要报道的均为大丽轮枝菌。大丽轮枝菌的寄主范围极广,国外报道可危害38科660种植物,其中农作物184种,杂草153种。我国经鉴定,寄主植物至少20科80种,大田作物包括向日葵、茄子、辣子、番茄、烟草、马铃薯、棉花、甜瓜、西瓜、黄瓜、花生、土豆、菜豆、绿豆、大豆、芝麻、甜菜等。
棉花枯萎病(Fusarium oxysporumf.sp.Vasinfectum)和黄萎病(Verticillium dahliae Kleb)是世界棉花种植区的主要病害,一旦发生很难根除,中国大部分棉区均有发生。棉花枯萎病发生较为普遍;棉花黄萎病是一种危害严重的世界性病害,具有分布广、危害重、寄主范围宽、传播途径多、存活时间久等特点,被称为棉花的“癌症”。棉花病株导管常因菌丝及孢子的大量繁殖,刺激邻近的薄壁细胞产生胶状物质及侵填体而堵塞导管,使水分和无机盐的运输发生困难,从而导致棉株萎蔫;同时分泌的毒素引起植株萎蔫死亡。棉花在整个生长过程中都会遭受黄萎病和枯萎病的侵害。目前,防治棉花枯萎病和黄萎病的主要方法还是化学农药防治。一般化学药剂有多菌灵、甲霜·噁霉灵、噁霉灵、甲基托布津、克黄枯、枯黄基因素、棉花三清等。化学防治方法作用时效性强、稳定性高,但是大量化学药剂的使用会随着食物链循环累积,不仅污染环境而且危害人体健康。为解决这一问题,2015年农业部制定出台了关于农业污染防治的相关意见,意见中明确指出要减少花肥、农药的使用量;化学药剂的长期使用在防治病害的同时也会杀死其他有益生物;除此之外还会诱导病原菌产生抗药性,目前人们正在积极寻求其他防治方法来代替化学药剂的使用。
TOR(Target ofRapamycin)是一种进化中保守的丝氨酸、苏氨酸蛋白激酶,在真菌、动物、植物中通过整合营养和能量信号来促进细胞的增殖和生长。TOR信号通路在动物胚胎形成、分生组织激活,植物根和叶的生长、开花、衰老和生命周期的控制中都扮演着关键作用。近几年研究发现,TOR还具有调节核糖体的生物合成、促进翻译、新陈代谢调节和抑制自噬的功能。通过RNA干扰技术干扰动植物的TOR基因或tor突变能够导致胚胎致死,说明TOR基因在动植物的生长发育进程中扮演着核心作用。
雷帕霉素(Rapamycin,RAP)是一种大环内酯类免疫抑制剂,由吸水链霉菌产生,它通过与FKBP12蛋白结合形成二元复合物,该复合物再与TOR蛋白的FRB结构域结合,从而抑制TOR蛋白的活性。研究发现,当FKBP12基因发生突变,丧失与雷帕霉素的结合能力后,雷帕霉素就不再抑制TOR蛋白的活性。在植物中,由于FKBP12基因发生适应性突变,丧失了与雷帕霉素的结合能力,于是雷帕霉素对植物的TOR蛋白没有抑制作用;在真菌、动物中,雷帕霉素可以抑制TOR蛋白的活性。因此,雷帕霉素可以作为植物病虫害的生物农药。随着TOR信号通路研究的不断深入,目前除了雷帕酶素外,TOR蛋白的抑制剂还有KU-0063794,Torin 1,AZD8055等二代抑制剂,这些抑制剂主要作用于TOR蛋白的激酶活性域。TOR蛋白抑制剂目前主要应用于临床医学的研究,部分还用于植物的生长发育以及代谢通路的调控机制等研究,但通过抑制真菌的TOR蛋白活性来进行植物病害的防治还未见相关报道。
技术实现要素:
本发明的目的是针对以上问题提供一种TOR蛋白抑制剂抑制植物枯萎病菌、黄萎病菌的新用途。
为实现上述目的所采用的技术方案是:
一种TOR蛋白抑制剂在抑制植物枯萎病菌、黄萎病菌中的应用。
作为优选地,所述TOR蛋白抑制剂为Rapamycin、Torin 1、Rapamycin与Torin 1的混合物或者Rapamycin与真菌化学杀菌剂的混合物。
作为优选地,所述真菌化学杀菌剂为植物枯萎病菌或黄萎病菌杀菌剂。
作为优选地,所述植物为棉花或者马铃薯。
一种真菌杀菌剂,包含TOR蛋白抑制剂。
作为优选地,所述TOR蛋白抑制剂为Rapamycin、Torin 1、Rapamycin与Torin 1的混合物或者Rapamycin与真菌化学杀菌剂的混合物。
作为优选地,所述真菌化学杀菌剂为植物枯萎病菌或黄萎病菌杀菌剂。
作为优选地,所述真菌化学杀菌剂为甲霜·噁霉灵。
作为优选地,当杀菌剂应用于棉花枯萎病菌时,所述Rapamycin的浓度为0.1~1μmol/L;所述Torin 1的浓度为5~20μmol/L;所述Rapamycin与Torin 1的混合物中Rapamycin的浓度为1~50nmol/L,Torin 1的浓度为1~5μmol/L;所述Rapamycin与甲霜·噁霉灵的混合物中Rapamycin的浓度为10~100nmol/L,甲霜·噁霉灵的浓度为0.05~0.1mL/L;当杀菌剂应用于棉花黄萎病菌时,所述Rapamycin的浓度为1~10nmol/L;所述Torin 1的浓度为20~80μmol/L;所述Rapamycin与Torin 1的混合物中Rapamycin的浓度为1~5nmol/L,Torin 1的浓度为5~10μmol/L;所述Rapamycin与甲霜·噁霉灵的混合物中Rapamycin的浓度为0.5~2nmol/L,甲霜·噁霉灵的浓度为10~20μL/L。
作为优选地,当杀菌剂应用于马铃薯枯萎病菌时,所述Rapamycin的浓度为0.1~1μmol/L;所述Torin 1的浓度为10~40μmol/L;所述Rapamycin与Torin 1的混合物中Rapamycin的浓度为1~50nmol/L,Torin 1的浓度为1~5μmol/L;所述Rapamycin与甲霜·噁霉灵的混合物中Rapamycin的浓度为50~200nmol/L,甲霜·噁霉灵的浓度为0.05~0.1mL/L;当杀菌剂应用于马铃薯黄萎病菌时,所述Rapamycin的浓度为1~8nmol/L;所述Torin 1的浓度为10~100μmol/L;所述Rapamycin与Torin 1的混合物中Rapamycin的浓度为1~5nmol/L,Torin 1的浓度为5~10μmol/L;所述Rapamycin与甲霜·噁霉灵的混合物中Rapamycin的浓度为0.5~2nmol/L,甲霜·噁霉灵的浓度为10~20μL/L。
本发明的有益效果是:本发明首次将用于临床医学的TOR蛋白抑制剂用于植物枯萎病、黄萎病的防治研究中,通过研究发现TOR蛋白抑制剂Rapamycin、Torin 1、及Rapamycin分别与Torin 1、真菌化学杀菌剂的混合物均能有效地抑制植枯萎病、黄萎病病菌,Rapamycin与Torin1或者化学农药能够协同作用来抑制植物枯萎病、黄萎病,为防治枯萎病、黄萎病新药研究提供了非常有意义的基础,应用于新型杀菌剂的前景广阔,市场前景好,为防治枯萎病、黄萎病提供了一种新的选择,能够大幅度减少化学农药的使用,对降低农药使用、延缓害虫抗性的产生具有重要意义,对维持生态系统的平衡和可持续发展也具有重大的应用价值。
附图说明
图1为经不同浓度RAP处理的棉花枯萎和黄萎病菌菌落生长情况图;DMSO为对照。
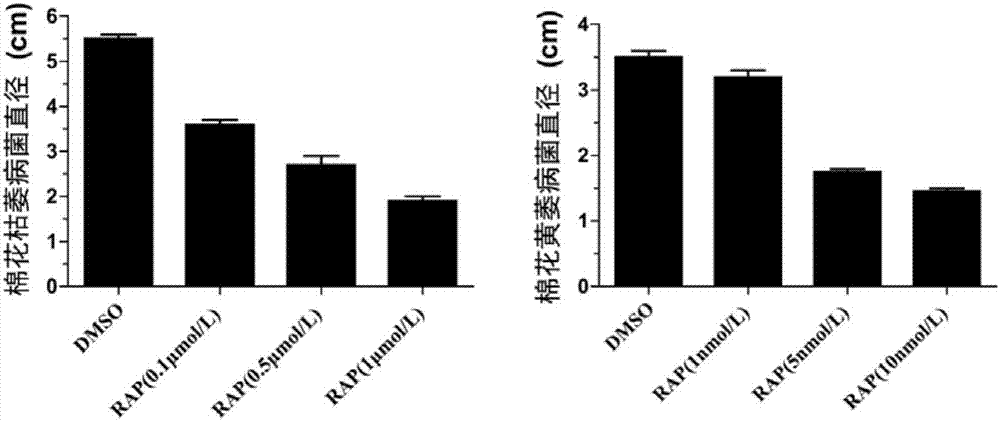
图2为经不同浓度的RAP处理培养后棉花枯萎和黄萎病菌的菌落直径。
图3为经不同浓度Torin1处理的棉花枯萎和黄萎病菌菌落生长情况图;DMSO为对照。
图4为经不同浓度的Torin1处理培养后棉花枯萎和黄萎病菌的菌落直径。
图5为经不同浓度甲霜·噁霉灵处理的棉花枯萎和黄萎病菌菌落生长情况图;DMSO为对照。
图6为经不同浓度的甲霜·噁霉灵处理培养后棉花枯萎和黄萎病菌的菌落直径。
图7经不同浓度RAP+Torin1组合处理的棉花枯萎和黄萎病菌菌落生长情况图;DMSO为对照。
图8为经不同浓度的RAP+Torin1组合处理培养后棉花枯萎和黄萎病菌的菌落直径。
图9为RAP+Torin1组合处理棉花枯萎和黄萎病菌得到的协同作用曲线;R:Rapamycin;T:Torin1。
图10经不同浓度RAP+甲霜·噁霉灵组合处理的棉花枯萎和黄萎病菌菌落生长情况图;DMSO为对照。
图11为经不同浓度的RAP+甲霜·噁霉灵组合处理培养后棉花枯萎和黄萎病菌的菌落直径。
图12为RAP+甲霜·噁霉灵组合处理棉花枯萎和黄萎病菌得到的协同作用曲线;R:Rapamycin;J:甲霜·噁霉灵。
具体实施方式
本发明中所用主要试剂:
Rapamycin、Torin 1均购自美国Selleck Chemicals公司。
Rapamycin(Sirolimus,雷帕霉素):是一种特定的mTOR抑制剂,目录号S1039。
Torin 1:mTORC1/2抑制剂,目录号S2827。
甲霜·噁霉灵为市售常见农药,有效成分为30%甲霜·噁霉灵,包含6%甲霜灵和24%噁霉灵。
棉花枯萎病菌和黄萎病菌、马铃薯枯萎病菌和黄萎病菌均购自北纳创联(苏州)生物技术有限公司。
实施例1.Rapamycin、Torin1和甲霜·噁霉灵处理棉花枯萎病菌和棉花黄萎病菌
真菌孢子悬浮液的制备:用PDA固体培养基分别培养棉花枯萎病菌和黄萎病菌。用打孔器分别取一块含有棉花枯萎病菌和黄萎病菌的培养基分别放入无菌的100mL PDA液体培养基中培养,25℃、200rpm培养2-3天,然后用四层无菌纱布过滤,就能得到纯净的棉花枯萎病菌和黄萎病菌孢子悬浮液。
一、用Rapamycin分别处理棉花枯萎病菌和黄萎病菌
设置不同的Rapamycin(RAP)浓度梯度处理棉花枯萎病菌和黄萎病菌:
处理棉花枯萎病菌的Rapamycin浓度为0.1μmol/L、0.5μmol/L和1μmol/L;
处理棉花黄萎病菌的Rapamycin浓度为1nmol/L、5nmol/L和10nmol/L。
将PDA培养液灭菌后冷却至55℃左右,分别加入前面设置的不同浓度的Rapamycin,混匀后倒入无菌的圆皿中,待凝固后分别加入5μL上述制备好的棉花枯萎病菌和黄萎病菌的孢子悬浮液,每个处理设3次重复。圆皿封口后置于25℃真菌培养箱中暗培养,棉花枯萎病菌培养5天、黄萎病菌培养10天后观察并统计真菌直径,结果如图1、2所示,观察真菌生长状况可以发现,随着Rapamycin浓度的增加,真菌生长受到的抑制越来越明显。根据统计的真菌直径可以发现:用Rapamycin处理枯萎病菌,IC50的药物浓度为0.5μmol/L;用Rapamycin处理黄萎病菌,IC50的药物浓度为5nmol/L。
二、用Torin1分别处理枯萎病菌和黄萎病菌
设置不同的Torin1浓度梯度处理棉花枯萎病菌和黄萎病菌:
处理棉花枯萎病菌的Torin1浓度为5μmol/L、10μmol/L和20μmol/L;
处理棉花黄萎病菌的Torin1浓度为20μmol/L、40μmol/L和80μmol/L。
将PDA培养液灭菌后冷却至55℃左右,分别加入前面设置的不同浓度的Torin1,混匀后倒入无菌的圆皿中,待凝固后加入5μL前述制备好的棉花枯萎病菌和黄萎病菌孢子悬浮液,每个处理设3次重复。圆皿封口后置于25℃真菌培养箱中暗培养。棉花枯萎病菌培养5天、黄萎病菌培养10天后观察并统计真菌直径,结果如图3、4所示,观察真菌生长状况可以发现,随着Torin1浓度的增加,真菌生长受到的抑制越来越明显。根据统计的真菌直径可以发现,用Torin1处理枯萎病菌,IC50的药物浓度为20μmol/L;用Torin1处理黄萎病菌,IC50的药物浓度为40μmol/L。
三、用甲霜·噁霉灵分别处理枯萎病菌和黄萎病菌
设置不同的甲霜·噁霉灵浓度梯度处理棉花枯萎病菌和黄萎病菌:
处理棉花枯萎病菌的甲霜·噁霉灵浓度为0.1mL/L、0.5mL/L和1mL/L;
处理棉花黄萎病菌的甲霜·噁霉灵浓度为0.01mL/L、0.05mL/L和0.1mL/L。
将PDA培养液灭菌后冷却至55℃左右,分别加入前面设置的不同浓度的甲霜·噁霉灵,混匀后倒入无菌的圆皿中,待凝固后加入5μL上述制备好的棉花枯萎病菌和黄萎病菌孢子悬浮液,每个处理设3次重复。圆皿封口后置于25℃真菌培养箱中暗培养。棉花枯萎病菌培养5天、黄萎病菌培养10天后观察并统计真菌直径,结果如图5、6所示,观察真菌生长状况可以发现,随着甲霜·噁霉灵浓度的增加,真菌生长受到的抑制越来越明显。根据统计的真菌直径可以发现,用甲霜·噁霉灵处理枯萎病菌,IC50的药物浓度为0.5mL/L;用甲霜·噁霉灵处理黄萎病菌,IC50的药物浓度为0.05mL/L。
实施例2.Rapamycin+Torin1组合用药处理棉花枯萎病菌和黄萎病菌
一、用Rapamycin+Torin1组合用药处理棉花枯萎病菌
Rapamycin的浓度分别为:1nmol/L、10nmol/L、50nmol/L;Torin1的浓度分别为:1μmol/L、5μmol/L。将不同浓度的Rapamycin和Torin1两两组合得到6个组合分别用来处理枯萎病菌。PDA培养基和加入Rapamycin+Torin1的方法、处理棉花枯萎病菌的方法与实施例1中一样,只是加入菌抑制剂为Rapamycin+Torin1,且为不同浓度组合。
二、用Rapamycin+Torin1组合用药处理棉花黄萎病菌
Rapamycin的浓度分别为:1nmol/L、2nmol/L、5nmol/L;Torin1的浓度分别为:5μmol/L、10μmol/L。将不同浓度的Rapamycin和Torin1两两组合得到6个组合分别用来处理黄萎病菌。PDA培养基和加入Rapamycin+Torin1的方法、处理棉花黄萎病菌的方法与实施例1中一样,只是加入菌抑制剂为Rapamycin+Torin1,且为不同浓度组合。
三、结果观察
棉花枯萎病菌培养5天、黄萎病菌培养10天后观察并统计真菌直径,结果如图7、8所示。观察真菌生长状况可以发现,随着Rapamycin+Torin1组合用药浓度的增加,真菌生长受到的抑制越来越明显。根据统计的真菌直径可以发现,用Rapamycin+Torin1组合用药处理枯萎病菌,IC50的药物浓度为Rapamycin:10nmol/L+Torin1:1μmol/L;用Rapamycin+Torin1组合用药处理黄萎病菌,IC50的药物浓度为Rapamycin:2nmol/L+Torin1:10μmol/L。同时,根据CompuSyn软件计算得到这两种药物之间的联合效应,结果如图9所示,不同浓度的RAP和Torin1组合使用来处理棉花枯萎病菌和黄萎病菌具有协同作用(CI<1表示具有协同作用;CI=1表示具有叠加作用;CI>1表示具有拮抗作用)。通过药物抑菌实验发现,Rapamycin+Torin1组合使用时达到IC50所需的药物浓度显著低于单药所需的药物浓度,即Rapamycin+Torin1能够协同作用来抑制植物枯萎病、黄萎病。
实施例3.Rapamycin+甲霜·噁霉灵组合用药处理棉花枯萎病菌和黄萎病菌
按照实施例2的方法用Rapamycin+甲霜·噁霉灵组合用药处理棉花枯萎病菌和黄萎病菌。
处理棉花枯萎病菌时,Rapamycin的浓度分别为:10nmol/L、50nmol/L、100nmol/L;甲霜·噁霉灵的浓度分别为:0.05mL/L、0.1mL/L。将不同浓度的Rapamycin和甲霜·噁霉灵两两组合得到6个组合分别来处理枯萎病菌。
处理棉花黄萎病菌时,Rapamycin的浓度分别为:0.5nmol/L、1nmol/L、2nmol/L;甲霜·噁霉灵的浓度分别为:10μL/L、20μL/L。将不同浓度的Rapamycin和甲霜·噁霉灵两两组合得到6个组合分别来处理黄萎病菌。
结果观察:棉花枯萎病菌培养5天、黄萎病菌培养10天后观察并统计真菌直径,结果如图10、11所示。观察真菌生长状况可以发现,随着Rapamycin+甲霜·噁霉灵组合用药浓度的增加,真菌生长受到的抑制越来越明显。根据统计的真菌直径可以发现,用Rapamycin+甲霜·噁霉灵组合用药处理枯萎病菌,IC50的药物浓度为Rapamycin:50nmol/L+甲霜·噁霉灵:0.05mL/L;用Rapamycin+甲霜·噁霉灵组合用药处理黄萎病菌,IC50的药物浓度为Rapamycin:1nmol/L+甲霜·噁霉灵:20μL/L。同时,根据CompuSyn软件计算得到这两种药物之间具有协同效应,结果如图12所示,通过药物抑菌实验发现,Rapamycin+甲霜·噁霉灵组合使用时达到IC50所需的药物浓度显著低于单药所需的药物浓度,即Rapamycin+甲霜·噁霉灵能够协同作用来抑制植物枯萎病、黄萎病。
实施例4.用Rapamycin、Torin1、甲霜·噁霉灵、Rapamycin+Torin1和Rapamycin+甲霜·噁霉灵处理马铃薯枯萎病菌和黄萎病菌
按照实施例1-3的方法,用不同浓度梯度的Rapamycin、Torin1、甲霜·噁霉灵、Rapamycin+Torin1和Rapamycin+甲霜·噁霉灵分别处理马铃薯枯萎病菌和黄萎病菌。
处理马铃薯枯萎病菌,单独用药时药物的浓度梯度为:RAP:0.1μmol/L、0.5μmol/L和1μmol/L;Torin1:10μmol/L、20μmol/L和40μmol/L;甲霜·噁霉灵:0.1mL/L、0.5mL/L和1mL/L。组合用药时,Rapamycin+Torin1:Rapamycin的浓度分别为:1nmol/L、10nmol/L、50nmol/L;Torin1的浓度分别为:1μmol/L、5μmol/L;Rapamycin+甲霜·噁霉灵:Rapamycin的浓度分别为:50nmol/L、100nmol/L、200nmol/L;甲霜·噁霉灵的浓度分别为:0.05mL/L、0.1mL/L。
处理马铃薯黄萎病菌,单独用药时药物的浓度梯度为:RAP:1nmol/L、4nmol/L和8nmol/L;Torin1:10μmol/L、50μmol/L和100μmol/L;甲霜·噁霉灵:0.01mL/L、0.05mL/L和0.1mL/L。组合用药时,Rapamycin+Torin1:Rapamycin的浓度分别为:1nmol/L、2nmol/L、5nmol/L;Torin1的浓度分别为:5μmol/L、10μmol/L;Rapamycin+甲霜·噁霉灵:Rapamycin的浓度分别为:0.5nmol/L、1nmol/L、2nmol/L;甲霜·噁霉灵的浓度分别为:10μL/L、20μL/L。
马铃薯枯萎病菌培养5天、黄萎病菌培养10天后观察并统计真菌直径,马铃薯枯萎病菌和黄萎病菌用各种药物处理的IC50值如表1所示:
表1各药物处理马铃薯枯萎病菌和黄萎病菌的IC50值
和棉花枯萎病菌和黄萎病菌一样,Rapamycin、Torin1也可以有效的抑制马铃薯枯萎病菌和黄萎病菌;并且Rapamycin+Torin1和Rapamycin+甲霜·噁霉灵组合使用时达到IC50所需的药物浓度显著低于单药所需的药物浓度,即Rapamycin+Torin1和Rapamycin+甲霜·噁霉灵组合用药来抑制植物枯萎病、黄萎病时可以大量地减少化学农药的使用。
应该指出的是,本发明中的各药物浓度仅仅是用于说明本发明,而不是对本发明的限制,在本发明的构思前提下使用本发明中的Rapamycin和Torin1(无论何种药物浓度)来防治植物枯萎病和黄萎病以及使用Rapamycin+Torin1或Rapamycin+甲霜·噁霉灵组合药物(无论何种药物浓度组合)来防治植物枯萎病和黄萎病都属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺