从极端微生物中获得的TET外切蛋白酶的组合物水解多肽的用途的制作方法
本发明涉及包含氨基肽酶的组合物,尤其是包含四面体氨基肽酶的组合物,也称为“tet氨基肽酶”。
背景技术:
在食品工业中,“长”肽,也称为“复合物”,自然地存在于待消耗的食物中。这些长肽通常是降解过程不足的结果,有时是有毒的,这会导致对含有这些肽的食物不耐受或过敏,并降低其营养效率。这些肽还决定了许多食物(例如面包、奶酪、腌制肉等)的味道和质地。
谷蛋白不耐受可能是最常见的食物不耐受之一。它是由一类称为“麦醇溶蛋白”的复杂蛋白质引起的,这些蛋白质进入谷蛋白组成中,其中这些蛋白质有时带有一种称为“免疫优势”的肽,这会导致对谷蛋白敏感或不耐受的人发生过敏反应。
由于这些原因,食品工业在许多过程中使用蛋白水解酶,目的在于降解谷蛋白并降低其免疫原性。这些蛋白酶本质上是内切蛋白酶,可以将蛋白质和长肽裂解成片段。这些内切蛋白酶不但用于糕点、奶酪、饼干的生产过程中,而且还用于果汁或啤酒的生产中,甚至欲用于特殊食物的蛋白质水解产物的生产中。这些蛋白酶通常来自细菌或真菌,其确切性质通常被保密。
然而,目前使用的蛋白酶的缺点是它们不允许产生足够短的肽以消除食物肽的所有毒性部分,或不允许产生能有效消化肽的肽。例如,在对谷蛋白敏感或不耐受的人中,谷蛋白的不完全消化会在消化系统中引起“免疫优势”肽的存在,并最终产生乳糜泻的症状。
中温氨基肽酶已经被开发用于降解这些复杂的食物肽,但是它们弱的催化活性和它们在其活性下的物理化学条件将它们限制于仅用于改变食物的味道。
亚松森·杜拉(asunci(的味道。用于)等人(来自霍氏热球菌的新型tet肽酶复合物的结构和生化特征揭示了超嗜热古生菌中集成的肽降解系统(thestructuralandbiochemicalcharacterizationsofanoveltetpeptidasecomplexfrompyrococcushorikoshiirevealanintegratedpeptidedegradationsysteminhyperthermophilicarchaea),分子微生物学(2009)72(1),26-40),其涉及与表达三种氨基肽酶的霍氏热球菌(pyrococcushorikoshii),表征为肽酶phtet3,并将其与phtet1和phtet2进行比较。这些不是包含衍生自极端微生物的氨基肽酶的组合物,即不是包含分离自极端微生物的氨基肽酶的组合物,因此它们与原始微生物本身有很大不同。
技术实现要素:
本发明旨在弥补所有这些缺点。因此,本发明涉及包含至少一种第一氨基肽酶和至少一种第二氨基肽酶的组合物,所述第一氨基肽酶和所述第二氨基肽酶彼此不同,所述第一氨基肽酶和所述第二氨基肽酶衍生自极端微生物,所述第一氨基肽酶和所述第二氨基肽酶为四面体氨基肽酶或tet氨基肽酶家族的氨基肽酶,所述第一氨基肽酶占组合物总重量的高达40重量%,其中,如果所述第一氨基肽酶和所述第二氨基肽酶不同于phtet2和phtet3,则所述第一氨基肽酶占组合物总重量的高达50重量%。发明人做出了令人惊讶的观察,即使用包含至少两种tet氨基肽酶的组合物能够降解肽,尤其是在混合物中,并且能够发挥超出每种tet蛋白各自单独活性的相加作用的协同作用。实际上,不是观察组合物的总体活性,该总体活性对应于组合物中存在的各种tet氨基肽酶的活性的组合,本发明人发现了不同的总体活性可通过反应介质的物理化学条件或通过组合物的不同tet氨基肽酶之间的相互作用/干扰进行调节。
“氨基肽酶”是指在肽、多肽或蛋白质的末端表现出氨基酸裂解活性的酶。根据本发明的“肽”是指包含至少2个氨基酸的氨基酸链。肽可以从蛋白质的降解或从化学合成中获得。根据本发明的“多肽”是指比肽的氨基酸链更长的氨基酸链,其是从蛋白质的降解而不是从化学合成中获得的。肽和多肽可以具有生物学功能。然而,作为细胞过程的一部分,肽和多肽不能单独行使这一功能。根据本发明的“蛋白质”是指含有具有生物学功能的氨基酸链并且在生物体中天然存在的分子。这种生物学功能是细胞中自然过程的一部分。因此,该组合物包含两种彼此不同的氨基肽酶,其中每个具有彼此不同的氨基酸序列。换言之,氨基肽酶具有的氨基酸序列相差一个氨基酸。换言之,两种氨基肽酶的序列彼此相差一个或多个氨基酸。
用于本发明组合物中的四面体氨基肽酶或tet氨基肽酶是从极端微生物中分离的,更具体地,是从海洋极端微生物中分离的。根据merops分类,这些四面体氨基肽酶或tet氨基肽酶属于金属氨基肽酶家族m42和m18。换言之,tet氨基肽酶是包含12个亚单位的酶复合物形式,这些亚单位具有自组装成形成典型四面体结构的构造的特殊性。这种形式有助于酶的极大稳定性。“金属氨基肽酶”是指这些氨基肽酶在活性位点内都具有共同存在的至少一种金属离子。
“极端微生物”是指肉眼不可见、只能用显微镜观察的活生物。这些微生物可以具有不同的生命形式,包括细菌、微观真菌、古细菌、原生生物、微观绿藻、浮游动物、真涡虫、变形虫和病毒。“极端微生物”描述了一种其正常生存条件通常代表大多数其他生物体的致命条件的生物体。这些生存条件可能是生物体所生活环境的高温或低温、极端压力、高盐度、酸性或碱性,存在放射性或缺乏氧气或光照。
这些tet氨基肽酶与其他氨基肽酶的不同之处在于它们可能对某些类型的氨基酸非常特异。因此,根据本发明的组合物可以组合不同的tet氨基肽酶,从而将肽或所谓的复合蛋白质降解为足够短的肽。因此,可以降解所有有毒的部分,从而可以有效地消化它们。由于所使用的组合物具有特定的氨基肽酶活性,因此可以获得这种最终结果。基于底物的多肽含量以及希望得以修饰甚至完全降解的部分的多肽含量确定了该氨基肽酶活性。为此,对于本发明的组合物,我们选择相关的tet氨基肽酶作为它们对某些氨基酸的特异性以及它们在活性上的彼此相互作用/相互干扰的函数。另外,发明人已经发现,某些tet氨基肽酶在某些条件下表现出比现有技术中已知的其他tet氨基肽酶更好的降解富含特定氨基酸类型的肽的活性,即它们对这种类型的氨基酸具有特异性。换言之,tet氨基肽酶的各种相关性不是简单地添加组合物中相关的tet氨基肽酶的已知活性。
在根据本发明的组合物中,第一氨基肽酶占组合物总重量的高达40重量%。“占组合物总重量的高达40重量%”是指第一氨基肽酶可以占组合物总重量的1重量%、2重量%、3重量%、4重量%、5重量%、6重量%、7重量%、8重量%、9重量%、10重量%、11重量%、12重量%、13重量%、14重量%、15重量%、16重量%、17重量%、18重量%、19重量%、20重量%、21重量%、22重量%、23重量%、24重量%、25重量%、26重量%、27重量%、28重量%、29重量%、30重量%、31重量%、32重量%、33重量%、34重量%、35重量%、36重量%、37重量%、38重量%、39重量%或40重量%。当组合物仅由两种tet氨基肽酶组成时,第二氨基肽酶因此可以占组合物总重量的至少60重量%,这表示60重量%、61重量%、62重量%、63重量%、64重量%、65重量%、66重量%、67重量%、68重量%、69重量%、70重量%、71重量%、72重量%、73重量%、74重量%、75重量%、76重量%、77重量%、78重量%、79重量%、80重量%、81重量%、82重量%、83重量%、84重量%、85重量%、86重量%、87重量%、88重量%、89重量%、90重量%、91重量%、92重量%、93重量%、94重量%、95重量%、96重量%、97重量%、98重量%或99重量%。那么,根据相对于组合物总重量的第一氨基肽酶的重量,第一tet氨基肽酶和第二tet氨基肽酶的重量比可以是相对于组合物总重量的1:99(重量比)至相对于组合物总重量的40:60(重量比)。
然而,如果第一氨基肽酶和第二氨基肽酶不是phtet2和phtet3,则第一氨基肽酶可以占组合物总重量的高达50重量%。根据本发明“占组合物总重量的高达50重量%”是第一种氨基肽酶可以占组合物总重量的1重量%、2重量%、3重量%、4重量%、5重量%、6重量%、7重量%、8重量%、9重量%、10重量%、11重量%、12重量%、13重量%、14重量%、15重量%、16重量%、17重量%、18重量%、19重量%、20重量%、21重量%、22重量%、23重量%、24重量%、25重量%、26重量%、27重量%、28重量%、29重量%、30重量%、31重量%、32重量%、33重量%、34重量%、35重量%、36重量%、37重量%、38重量%、39重量%、40重量%、41重量%、42重量%、43重量%、44重量%、45重量%、46重量%、47重量%、48重量%、49重量%或50重量%。
“所述第一氨基肽酶和所述第二氨基肽酶不同于phtet2和phtet3”是指所述第一氨基肽酶和所述第二氨基肽酶包含、基本上由以下氨基酸分子组成或由以下氨基酸分子组成,该氨基酸分子的序列与序列phtet2(seqidno:2)或序列phtet3(seqidno:3)具有小于65%的同一性。“两个序列之间的%同一性”是指当为了比较两个氨基酸序列通过本领域技术人员已知的任何方式对这两个氨基酸序列进行比对时,这两个序列呈现其氨基酸链相同的序列部分。所有这些部分确定了两个序列之间的同一性百分比。“与phtet2序列(seqidno:2)或phtet3序列(seqidno:3)小于65%的同一性”是指与phtet2序列(seqidno:2)或phtet3序列(seqidno:3)的同一性为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%或64%。
这意味着在组合物仅由第一tet氨基肽酶和第二tet氨基肽酶组成的实施方式中,如果第一氨基肽酶和第二氨基肽酶不是phtet2和phtet3,则第二tet氨基肽酶占组合物总重量的至少50重量%,这表示50重量%、51重量%、52重量%、53重量%、54重量%、55重量%、56重量%、57重量%、58重量%、59重量%、60重量%、61重量%、62重量%、63重量%、64重量%、65重量%、66重量%、67重量%、68重量%、69重量%、70重量%、71重量%、72重量%、73重量%、74重量%、75重量%、76重量%、77重量%、78重量%、79重量%、80重量%、81重量%、82重量%、83重量%、84重量%、85重量%、86重量%、87重量%、88重量%、89重量%、90重量%、91重量%、92重量%、93重量%、94重量%、95重量%、96重量%、97重量%、98重量%或99重量%。
有利地,所述至少一种第一氨基肽酶和所述至少一种第二氨基肽酶选自由以下组成的组中的氨基肽酶:phtet1、phtet2、phtet3、phtet4和mjtet。
phtet1由氨基酸序列seqidno:1表示,phtet2由氨基酸序列seqidno:2表示,phtet3由氨基酸序列seqidno:3表示,phtet4由氨基酸序列seqidno:4表示,以及mjtet由氨基酸序列seqidno:5表示。
换言之,根据本发明的组合物的第一tet氨基肽酶和第二tet氨基肽酶对可以选自由以下组成的对的列表:phtet1-phtet2、phtet1-phtet3、phtet1-phtet4、phtet1-mjtet、phtet2-phtet3、phtet2-phtet4、phtet2-mjtet、phtet3-phtet4、phtet3-mjtet、phtet4-mjtet。
有利地,所述氨基肽酶包含、基本上由以下组成或由以下组成:具有seqidno:1至seqidno:5的各个序列的氨基酸分子,或显示出氨基肽酶活性的蛋白质,所述蛋白质包含、基本上由以下组成或由以下组成:其序列与序列seqidno:1至seqidno:5之一具有至少65%同一性的氨基酸分子。
根据本发明的“与序列seqidno:1至seqidno:5之一具有%同一性”是指蛋白质具有氨基酸序列,当该氨基酸序列与序列seqidno:1(phtet1的序列)、seqidno:2(phtet2的序列)、seqidno:3(phtet3的序列)、seqidno:4(phtet4的序列)或seqidno:5(mjtet的序列)之一比对以比较两个序列时,可以观察到一个氨基酸序列与另一个氨基酸序列相同的序列部分。根据本发明的“与序列seqidno:1至seqidno:5之一具有至少65%的同一性”是指同一性的百分比可以是65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%的同一性。换言之,所考虑的蛋白质是具有与序列seqidno:1至seqidno:5之一的同一性百分比为上述同一性之一并且具有氨基肽酶活性(即在聚合物的n-末端的氨基酸裂解活性)的氨基酸序列的蛋白质。
结构研究清楚地表明,即使同源性较低,也可以根据特定标准将酶分配给tet家族。然而,尽管各种酶复合物显示出很大的结构同源性,但是tet之间的序列同一性百分比不是很高。例如,phtet1与phtet2和phtet3显示大约37%的同一性(55%同源性),而后两者在它们之间显示48%同一性(70%同源性)。
与通过引用并入本文中的亚历山大·阿波莱尔(alexandreappolaire)博士的论文“tet家族的大型蛋白水解组装的研究:低聚过程和相关的功能调节(studyofthelargeproteolyticassembliesofthetetfamily:oligomerizationprocessandassociatedfunctionalregulation)”的参考文献中的情况一样,发明人保留了5条标准来表征表现出氨基肽酶活性的蛋白质:
1)将二聚化结构域插入序列中:在编码氨基肽酶的基因的中部插入特定结构域是tet氨基肽酶结构的第一个强标记(schoehn,g.,vellieux,f.m.d,asuncióndurá,m.,receveur-bréchot,v.,fabry,c.m.s,ruigrok,r.w.h,ebel,c.,roussel,a.和franzetti,b.,(2006)古细菌肽酶组装成两个不同的四级结构:四面体和巨型八面体(anarchaealpeptidaseassemblesintotwodifferentquaternarystructures:atetrahedronandagiantoctahedron),生物化学杂志(thejournalofbiologicalchemistry)281:36327-36337)。
2)二聚化界面:“idigaxxxe”图样的出现对于tet二聚体的组装起决定性作用。r320y321残基的存在也表现出很重要。
3)十二面化界面:这是交互作用定义不明确的区域;它涉及极性、疏水相互作用、氢键和盐桥。似乎决定性的是,在单体之间的界面处以适当的构型存在α5螺旋与带有负载与其上的长侧链的残基的存在相关。但是,似乎很难确定在基因组中可被鉴定的标准序列。
4)催化结构域的折叠:几种非常保守的甘氨酸的存在对于tet的催化结构域的折叠似乎很重要。
5)活性位点:该位点的保守性是tet和m42家族肽酶特性的一部分,由以下残基定义:phtet3中的h65xd67、d181、e213e214、e/d236和h319,并且涉及两种金属离子的配位。这些离子通常是co2+或zn2+离子,但是某些结构被表征为具有不同的离子,例如q11z05_cyth3的结构已被表征为具有携带fe2+离子的活性位点。
根据发明人,必须满足这五个标准,以将肽酶鉴定为四面体tet肽酶。
有利地,所述第一氨基肽酶占组合物总重量的高达10重量%,特别是占组合物总重量的高达5重量%。
因此,有可能通过添加少量的第一氨基肽酶非常精确地调节组合物的氨基肽酶的作用。所以,这种向组合物中添加少量的tet氨基肽酶能够在使底物的多肽含量与本发明的组合物接触之后,对获得的产物性质产生重大影响。
有利地,所述第一氨基肽酶占组合物总重量的50重量%,条件是所述第一氨基肽酶和所述第二氨基肽酶不同于phtet2和phtet3。
换言之,在根据本发明的组合物的替代方案中,其中后者仅由第一氨基肽酶和第二氨基肽酶组成,只要所述第一氨基肽酶和所述第二氨基肽酶与phtet2和phtet3不同,这两种tet氨基肽酶可以等摩尔比例。
有利地,本发明的组合物至少包含第三氨基肽酶,所述第三氨基肽酶是来自四面体氨基肽酶或tet氨基肽酶家族的氨基肽酶。在组合物包含三种tet氨基肽酶的情况下,三联体(triplet)可以选自由以下组成的三联体列表:phtet1-phtet2-phtet3、phtet1-phtet2-phtet4、phtet1-phtet2-mjtet、phtet1-phtet3-phtet4、phtet1-phtet3-mjtet、phtet1-phtet4-mjtet、phtet2-phtet3-phtet4、phtet2-phtet3-mjtet、phtet2-phtet4-mjtet、phtet3-phtet4-mjtet。此外,在组合物包含四种tet氨基肽酶的情况下,四联体(quadruplet)可以选自由以下组成的四联体列表:phtet1-phtet2-phtet3-phtet4、phtet1-phtet2-phtet3-mjtet、phtet2-phtet3-phtet-mjte、phtet1-phtet3-phtet4-mjtet。此外,在组合物包含五种氨基肽酶的情况下,五联体(quintuplet)可以是phtet1-phtet2-phtet3-phtet4-mjtet。
因此,有可能增加不同于第一tet氨基肽酶和第二tet氨基肽酶的第三tet氨基肽酶的作用,因此,这可以改善组合物的作用范围,从而更好地修饰目标食物肽、多肽和蛋白质。因此,第一tet氨基肽酶可以占组合物总重量的高达40重量%,而占剩余组合物总重量的至少60重量%可以在第二tin氨基肽酶和第三tet氨基肽酶之间分配。
但是,当第一氨基肽酶和第二氨基肽酶与phtet2和phtet3不同时,组合物的比例应使第一tet氨基肽酶占组合物总重量的高达50重量%,而占剩余组合物总重量的至少50重量%可以在第二tet氨基肽酶和第三tet氨基肽酶之间分配。
因此,通过示例性的方式,存在这样的实施方式,根据该实施方式,该组合物由第一tet氨基肽酶、第二tet氨基肽酶和第三tet氨基肽酶组成,并且据此,相对于组合物总重量,第一氨基肽酶、第二氨基肽酶和第三氨基肽酶的重量比例如下:50/25/25、40/30/30、40/40/20、10/10/80或甚至10/20/70。
有利地,所述第一氨基肽酶、第二氨基肽酶和第三氨基肽酶具有等摩尔或基本等摩尔的比例。
“等摩尔或基本等摩尔的比例”是指第一氨基肽酶、第二氨基肽酶和第三氨基肽酶的量相同或基本相同,即它们彼此非常接近。这样的精确度使得可以精确定义组合物的氨基肽酶活性,并因此更好地适应于待降解的肽。
有利地,所述组合物还包含内肽酶,特别是嗜热菌蛋白酶,特别是序列seqidno:6的嗜热菌蛋白酶。嗜热菌蛋白酶是属于金属蛋白酶家族的内肽酶。嗜热菌蛋白酶是由各种芽孢杆菌属(bacillus)物种产生的金属蛋白酶家族中最稳定的成员。与许多在加热和变性过程中发生构象变化的蛋白质不同,嗜热菌蛋白酶在高达至少70℃下不会发生重大构象变化。因此,嗜热菌蛋白酶在tet蛋白质最活跃的温度下保持稳定和活跃。
“内肽酶”是指能够裂解肽、多肽或蛋白质的非末端氨基酸之间的键的酶。
由于可以裂解非末端氨基酸,因此该组合物表现出更广泛的氨基肽酶活性。
本发明还涉及根据本发明的组合物用于修饰包含肽、多肽和/或蛋白质的底物的全部或部分多肽含量的用途。
“底物的全部或部分多肽含量的修饰”是指底物的部分多肽含量的至少一种修饰。换言之,底物的多肽含量不同于与本发明的组合物接触后获得的产物的多肽含量。例如,在包含三种蛋白质的多肽含量的情况下,所有含量的修饰对应于三种蛋白质的完全降解。相反,该含量的一部分的修饰可以对应于三种蛋白质中的一种蛋白质的完全降解,或者对应于三种蛋白质中的两种蛋白质甚至底物的三种蛋白质中的一种蛋白质的部分修饰。本领域技术人员能够确定蛋白质含量是否被完全或部分修饰。
在本发明中,“底物的全部或部分多肽含量的修饰”和“底物的全部或部分多肽含量的降解”之间没有区别。关于本发明的主题,这些表达可以彼此替换而没有问题。实际上,多肽含量的修饰是该含量的至少一种成分(肽、多肽或蛋白质)降解的结果。
因此,根据本发明的组合物可以用于修饰包含肽、多肽和/或蛋白质的底物的全部或部分的多肽含量。这些肽、多肽和/或蛋白质会受到tet氨基肽酶的作用,形成全部或部分的组合物,因此它们被修饰成短肽,从而消除了它们的毒性部分,并更好地消化了底物的多肽含量在与组合物接触后获得的产物的肽含量。
有利地,底物至少包含谷蛋白和/或乳清的肽、多肽和/或蛋白质。
因此,通过使用根据本发明的组合物可以修饰谷蛋白或乳清的肽、多肽和/或蛋白质,其中这两种蛋白质组装体包括肽、多肽和/或蛋白质,这是导致最终消费者食物不耐受和过敏的原因。如前所述,谷蛋白主要由两个蛋白质家族组成:麦醇溶蛋白和谷蛋白。这些蛋白质不溶于水,使面团(在面粉复水后获得)具有在食品工业中使用的粘弹性,从而使产品具有一定的结构。乳清含有大部分的乳水,其由94%的水、4%至5%的乳糖,可溶性蛋白质(9%干物质)和矿物质盐组成。乳清蛋白由于其必需氨基酸的高含量而具有真正的营养价值。最重要的是β-乳球蛋白(β-lg)、α-乳白蛋白(α-la)、牛免疫球蛋白(igg)、牛血清白蛋白(bsa)和牛乳铁蛋白(lf)。
有利地,底物包含以下蛋白质中的至少一种:麦醇溶蛋白、β-乳球蛋白、α-乳白蛋白、免疫球蛋白、血清白蛋白和乳铁蛋白。
如上所述,根据本发明的组合物的用途允许对这些蛋白质进行修饰,这些蛋白质是最终消费者中食物不耐受和过敏的原因。
有利的是,形成全部或部分组合物的所述氨基肽酶可以同时、分别或随时间推移使用。
同时、分别或随时间推移使用这些氨基肽酶的可能性使组合物的总体活性适应于使用组合物的底物上的多肽含量成为可能。实际上,为了适应修饰随时间推移底物多肽含量的作用,有可能利用组合物的不同的氨肽酶活性、尤其是氨肽酶的功能,它们的比例以及它们在活性方面的相互作用。形成组合物的氨基肽酶可以同时使用。这样,它们可以例如同时添加到包含待修饰的底物的介质中。氨基肽酶也可以单独使用。例如,在长链的情况下,可以将一部分的氨基肽酶添加到链的一端,而将另一部分添加到链的另一端。可以开发这样的方案,以更快地在添加氨基肽酶的链内获得均匀分布。还可以开发这样的方案,当在链的一端引入的氨肽酶需要在培养基中适应一段时间后,才适合与在链的另一端添加的其他氨肽酶接触。氨基肽酶也可随时间推移使用。因此,有可能在一定时间内添加氨基肽酶,以修饰底物的多肽含量。因此,考虑到反应介质中已经存在的第一氨基肽酶对这种新添加的氨基肽酶的活性的相互作用/干扰,有可能添加一种或多种其他氨基肽酶,以修饰由第一氨基肽酶修饰产生的全部或部分多肽含量。
在本发明的有利方面,tet蛋白质可以固定在支持物上,特别是柱、二氧化硅或磁珠,或适合于固定蛋白质的任何其他支持物。
特别地,可以以交联酶晶体或clec(交联酶晶体)的形式使用酶。
因此,本发明涉及一种组合物,其中组合物的一种或多种氨基肽酶,优选所有氨基肽酶为交联晶体形式。
因此,本发明涉及一种组合物,其中组合物的一种或多种氨基肽酶,优选所有氨基肽酶特别是以交联晶体的形式被固定。
本发明还涉及用于修饰包含肽、多肽和/或蛋白质的底物的全部或部分多肽含量的方法,所述方法包括接触步骤:
·所述底物与
·根据本发明上述的组合物的接触,
所述至少第一氨基肽酶和所述至少第二氨基肽酶可以在高于80℃的温度下活化,并且任选地在所述接触步骤之前包括使所述底物的多肽变性的步骤。
术语“接触步骤”是指其中底物的多肽含量和组合物的tet氨基肽酶可以彼此相互作用以修饰底物的多肽含量的步骤。
“可以在高于80℃的温度下活化的第一氨基肽酶和所述至少第二氨基肽酶”是指氨基肽酶可以从其不裂解底物的肽、多肽和/或蛋白质的氨基酸的阶段,直至它们裂解这些氨基酸的阶段。
底物多肽可以首先经历变性步骤,例如用丙醇变性,其具有通过组合物的氨基肽酶促进其修饰的作用。这些多肽是天然具有三级结构的那些。因此,有机溶剂(如丙醇)引起非共价键的破坏,例如多肽的内部氢键。但是,这样的键稳定了多肽的三级结构。因此,这种破坏导致多肽的不稳定、不折叠甚至变性。
本发明还涉及能够通过本发明的方法获得的食品化合物。
本发明还涉及一种食品化合物,其包含至少一种以下修饰形式的蛋白质:麦醇溶蛋白、β-乳球蛋白、α-乳白蛋白、免疫球蛋白、血清白蛋白和乳铁蛋白,所述食品化合物还包含根据本发明的组合物。
根据附图将更好地理解本发明,这些附图通过实施例的方式提供,但并非是限制性的。
附图的简要说明:
以下所有附图均表示说明吸光度(以mau表示)与洗脱时间(以秒表示)的函数关系的色谱图。
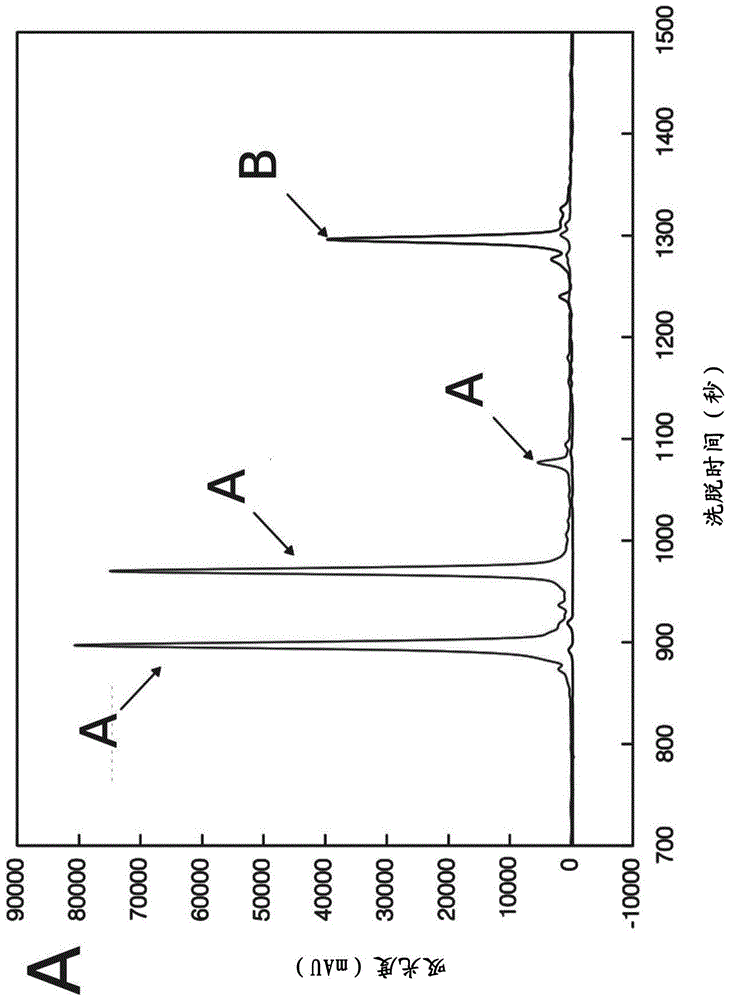
-图1a、1b和1c是与phtet3(图1a和曲线a)和phtet2(图1b和曲线c)温育15分钟水解合成肽2的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。曲线b中示出了对照样品,即在没有肽酶的情况下温育的肽。图1c代表3个色谱图的叠加图;
-图2a和2b是与phtet4温育15分钟的合成肽4(图2a)和与phtet1温育15分钟水解合成肽1(图2b)的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图;
-图3a、3b、3c和3d是与phtet3(图3a和曲线a)、mjtet(图3b和曲线b)或10%phtet3/90%mjtet的混合物(图3c和曲线c)温育15分钟水解合成肽5的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。曲线d中示出了对照样品,即在没有肽酶的情况下温育的肽。图3d表示4个色谱图的叠加图;
-图4a、4b、4c和4d是与phtet3(图4a和曲线a)、mjtet(图4b和曲线b)或5%phtet3/95%mjtet的混合物(图4c和曲线c)温育15分钟水解合成肽5的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。曲线d中示出了对照样品,即在没有肽酶的情况下温育的肽。图4d表示4个色谱图的叠加图;
-图5a、5b和5c是在不同温度下(40℃(曲线a)或60℃(曲线b))与phtet3(图5a)、mjtet(图5b)或5%phtet3/95%mjtet的混合物(图5c)温育15分钟水解合成肽5的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。在图5a、5b和5c中看不到对照样品,即没有肽酶的情况下温育的肽;
-图6a、6b和6c是与phtet4(图6a)、mjtet(图6b)或50%phtet4/50%mjtet的混合物(图6c)温育5、15或30分钟水解合成肽7的动力学的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。曲线a:5分钟;曲线b:15分钟;曲线c:30分钟。曲线d中示出了对照样品,即在没有肽酶的情况下温育的肽;
-图7显示了与mjtet(曲线a)或50%phtet4/50%mjtet的混合物(曲线b)温育30分钟水解合成肽7的动力学的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。曲线c中示出了对照样品,即在没有肽酶的情况下温育的肽;
-图8显示了在反相色谱法(rp-hplc)中分析乳清蛋白的水解产物得到的色谱图;
-图9显示了在反相色谱法(rp-hplc)中分析乳清蛋白在ph=6.2(实线)和ph=9.5(虚线)下的水解产物得到的色谱图。水解产物之间具有很小差异;
-图10显示了分析单独的乳清蛋白在ph=6.2下的水解产物(曲线d)以及与不同tet进行不同温育后的水解产物得到的色谱图的叠加图。(仅显示部分色谱图)。图10a显示了单独与phtet2温育(曲线a)。图10b显示了单独与phtet3温育(曲线b)。图10c表示与等摩尔量的phtet2和phtet3温育(曲线c);
-图11显示了分析与tet氨基肽酶的不同组合物相比,与等摩尔量的phtet2和phtet3(曲线a)温育后乳清蛋白的水解产物得到的色谱图的叠加图。(仅显示部分色谱图)。图11a表示与单独的phtet2(曲线b)和90%的phtet2和10%的phtet3的混合物(曲线b1)的温育。图11b表示与单独的phtet3(曲线c)和10%的phtet2和90%的phtet3的组合物(曲线c1)的温育。图11c表示与90%的phtet2和10%的phtet3的组合物(曲线b1)以及与10%的phtet2和90%的phtet3的组合物(曲线c1)的温育;
-图12显示了图11a、11b和11c的色谱图以及分析仅乳清蛋白在ph=6.2下的水解产物得到的色谱图(曲线d)的叠加图。仅显示部分色谱图;
-图13显示了分析仅乳清蛋白在ph=9.5下的水解产物(曲线d)以及与不同的tet氨基肽酶温育后的水解产物得到的色谱图的叠加图。(仅显示部分色谱图);
-图13a显示了仅与phtet4的温育(曲线a)。图13b显示了仅与mjtet的温育(曲线b)。图13c表示与等摩尔量的phtet4和mjtet的组合物的温育(曲线c);
-图14显示了在反相hplc(zorbaxsb-300c18柱)中获得的色谱图的叠加图。曲线a:在嗜热菌蛋白酶存在下温育的乳清样品。曲线b:在嗜热菌蛋白酶和tet氨基肽酶存在下温育的乳清样品。曲线c:单独温育的乳清样品。此处使用的柱使分析小肽成为可能,因此看不到小肽的“完整”蛋白质;
-图15显示了将合成肽7掺入与phtet3(图15a)、mjtet(图15b)、phtet4(图15c)或33%phtet3/33%phtet4/33%mjtet的组合物(图15d)温育的酪蛋白水解产物中的水解的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。曲线a:对照(在没有酶的情况下将肽7掺入到酪蛋白水解产物中);曲线b:phtet3;曲线c:mjtet;曲线d:phtet4;曲线e:33%phtet3/33%phtet4/33%mjtet的混合物;
-图16显示了分析谷蛋白样品得到的色谱图的叠加图:未温育的对照(曲线a)、未加酶温育的(曲线b)、与等摩尔量的酶phtet1、phtet2和phtet3温育的(vs线)。温育2小时后,有几个吸收峰下降,这反映了几种谷蛋白蛋白质的显著降解;
-图17显示了在谷蛋白样品水解的反相色谱法(rp-hplc)中分析得到的色谱图的叠加图。曲线a:在嗜热菌蛋白酶存在下温育的总谷蛋白样品。曲线b:在嗜热菌蛋白酶和tet氨基肽酶phtet1、phtet2和phtet3存在下温育的总谷蛋白样品;
-图18显示了从用于每种混合物的新乳清蛋白水解产物的对照样品的rp-hplc分析中得到的色谱图的叠加图;
-图19显示了从新的乳清蛋白水解产物被tet的不同混合物(混合物1-5)水解后,样品的rp-hplc分析中得到的色谱图的叠加图;
-图20显示了通过tet(70%phtet2、15%phtet3、15%phtet4)的混合物#1(混合物1)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图;
-图21显示了通过tet(70%phtet2、15%phtet4、15%mjtet)的混合物#2(混合物2)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图;
-图22显示了通过tet(90%mjtet、10%phtet4)的混合物#3(混合物3)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图;
-图23显示了通过tet(70%mjtet,15%phtet1、15%tet3)的混合物#4(混合物4)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图;
-图24显示了通过tet(70%mjtet,15%phtet3、15%tet4)的混合物#5(混合物5)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图;
-图25显示了通过tet(100%phtet4)的混合物#6(tet4-1或混合物6)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图;
-图26显示了通过tet的混合物#1和#2水解乳清蛋白水解产物的肽的rp-hplc中分析得到的色谱图的叠加图;
-图27和28显示了与phtet2(“tet2”)相比,tet的混合物1和#2水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图。
具体实施方式
实施例:
实施例1
材料和方法
对合成肽进行的tet氨基肽酶活性测试
为了测试tet氨基肽酶对合成肽的活性,将总浓度为50μg/ml的tet氨基肽酶的不同混合物与终浓度为0.5mm的各种肽以100μl的最终体积进行温育。在反应结束时将内标添加到实验中(在显示的色谱图中不可见),色氨酸样品的浓度为50μm。该内标用于提高计算介质中产物含量的准确性。换言之,精确地知道注入到色谱柱中的标准品的含量,因此可以归一化获得的响应信号。标准品是在实验中不反应的化合物,其对信号的响应非常接近所测产物。在这种情况下,选择的内标是色氨酸。在rp-hplc分析之前,将内标添加到样品中指示的浓度。活性测试是在50mmpipes缓冲液、150mmkcl中于ph=7.5下进行,除了其中存在phtet4的测试是在50mmches缓冲液、150mmkcl中于ph=9.5下进行的以外。然后将反应介质在所需温度(40℃或60℃)下振荡(500rpm)温育不同的时间。然后将管置于冰中以终止水解反应。然后,将80μl反应介质添加到320μl的包含2%乙腈(acn)和0.1%三氟乙酸(tfa)的溶液中。然后将样品以10,000g离心10分钟,然后转移到小瓶中,然后将其注射到rp-hplc柱上进行分析。除了进行rp-hplc分析外,还通过质谱法分析了这些活性测试的反应介质,以便精确地确定观察到的水解产物的大小。这样可以识别在色谱图上观察到的不同峰,并可以最佳地追逐水解过程。
从牛乳清制备蛋白质水解产物
乳清代表牛奶凝结后获得的液体部分,并且是尤其在干酪工业中获得的副产物。它包含约10%的蛋白质,所述蛋白质分为5个主要家族:β-乳球蛋白(50%)、α-乳白蛋白(20%)、免疫球蛋白(10%)、牛血清白蛋白(10%)和乳铁蛋白(2.8%)。在当前情况下,这些各种蛋白质被水解,所得肽被用作模型底物。将牛乳清溶液在终浓度为100μg/ml的嗜热菌蛋白酶
对乳清蛋白水解产物的tet氨基肽酶活性测试
为了测试tet氨基肽酶对乳清蛋白水解产物中存在的肽的水解活性,将总浓度为50μg/ml的各种tet蛋白混合物与水解产物,以最终体积为100μl一起温育。没有将辅助因子添加到反应中。phtet2和phtet3的活性测试是针对天然ph值为6.2的乳清蛋白水解产物进行的。用phtet4和mjtet进行的测试系列是在ph=9.5的条件下进行的。然后将反应介质在振动(500rpm)下于60℃温育2小时。然后将管置于冰中以终止水解反应。然后,将80μl反应介质添加到320μl的由2%乙腈(acn)和0.1%三氟乙酸(tfa)组成的溶液中。然后将样品以10,000g离心10分钟,然后转移到小瓶中,然后将其注射到rp-hplc柱上进行分析。
反相hplc分析(rp-hplc)
将每种样品100μl注入到μrpcc2/c18柱(4.6mmх100mm)(ge
对谷蛋白蛋白质的tet氨基肽酶活性测试
使用金属搅拌器在允许其溶解的溶液(150mmnacl、20mmtris-hcl、50%丙醇,ph=7.5)中制备谷蛋白蛋白质
反相hplc(rp-hplc)分析
该过程与上述指示相同。但是,将样品沉积在jupiterc18柱(4.6mmх200mm)(phenomenex)上,然后用线性梯度为0-40%的b相洗脱吸附的蛋白质。
结果
这些实验中使用的tet酶是m42家族的金属氨基肽酶(merops)。它们都属于相同的酶家族,并且在它们中具有非常强的结构同一性。另一方面,它们实际上是具有不同特异性的不同酶。
所使用的各种tet的三维结构非常相似,尽管它们对不同的底物都有特异性。因此,phtet1是谷氨酰胺基肽酶,phtet2是对一些不带电荷的疏水性和极性残基具有显著残留活性的亮氨酰氨基肽酶(leukyl-aminopeptidase),phtet3是赖氨酰氨基肽酶,phtet4是严格的甘氨酰氨基肽酶,mjtet是一种对疏水和带正电荷的残基具有显著活性的亮肽(leucid)。mjtet也是唯一对芳香族残基具有水解活性的化合物。
使用单酰基-pna(4-硝基苯胺)或单酰基-amc(7-氨基-4-甲基香豆素)类型的底物可获得上述所有结果。它们代表两个残基的肽,第一残基是要测定其肽酶活性的残基,第二个残基是在释放时会在可见光中发射信号的发色团。因此,我们可以测量肽酶对每个已知残基的亲和力。
因此,已经设计并合成了具有特定序列的几种肽(下表1)。一方面,被称为“富集”的15个残基的5个肽,即这些肽的n-末端已经富集了特定类型的残基:
-肽1:富集带负电荷的残基
-肽2:富集疏水残基
-肽3:富集带正电荷的残基
-肽4:富集甘氨酸
-肽5:富集芳香族残基
表1:研究期间使用的合成肽列表
这些肽中的每一个均带有富集的n-末端。其后是4个残基,它们补偿了富集区的作用(特别是肽的溶解性)。c-末端是保守的,并带有相同系列的7个残基ytswnse(seqidno:7),这些残基是根据其在280nm处的吸光度和溶解度而选择的。
另一方面,有5个所谓的“随机”肽,即它们包含15个相同的残基,但根据不同的序列分布:肽6;肽7;肽8;肽9;肽10。
在使用上述肽作为底物对tet氨基肽酶进行的各种实验过程中,发明人观察到了几种出乎意料的活性。
氨基肽酶phtet3对带正电荷的残基表现出最佳活性;它被归类为赖氨酰氨基肽酶,对亮氨酸、蛋氨酸、谷氨酰胺和天冬氨酸具有残基活性。但是,在对合成肽进行的测试中,在富含疏水残基的肽(肽2)中观察到了phtet3的显著活性(图1a)。
用氨基肽酶phtet2进行了相同的测试(图1b),根据现有技术,它是对疏水残基最有效的氨基肽酶phtet(即源自热球菌的氨基肽酶)。
值得注意的是,phtet3对富含疏水残基的肽表现出比phtet2更大的活性(图1c)。实际上,在活性测试的15分钟内,在存在phtet3的情况下,肽的第一残基的水解比在存在phtet2的情况下更快。
在分别富含谷氨酸和甘氨酸残基的肽1和肽4的情况下,也观察到这种类型的“出乎意料的”活性。当在肽酶的存在下温育这些肽时(所述肽酶理论上对末端富集的残基表现出最大的水解活性),没有观察到水解活性(图2a和2b)。
当针对其n-末端富含芳香族残基的肽测量phtet3的活性时,观察到另一个出乎意料的结果(图3a)。鉴于文献中提供的数据,观察到phtet3水解芳香族残基非常令人惊讶。实际上,对通过质谱法洗脱的蛋白质的不同峰进行的分析显示,n-末端酪氨酸已被水解的肽的大量积累。
到目前为止,通过分析tet氨基肽酶对二肽的活性已经获得了tet氨基肽酶的酶特异性的表征,这是文献中可获得的数据。phtet3对合成肽2和5的活性的测试表明,实际上,tet氨基肽酶的活性可能取决于底物肽的性质。实际上,即使phtet3不能水解由tyr-pna二肽携带的酪氨酸残基,但后者在肽5的背景下对这种残基显示出很高的水解效率。迄今为止,还没有相同类型的出乎意料的活性被示出;但是,不排除更大规模(即,使用更多种类的底物)的测试可能会揭示其他活性。
图1a、1b、1c、2a和2b的结果表明,尽管已经描述了这些酶中的一些的事实,但将它们整合到酶组合物中并非易事。实际上,在设计特定的酶促组合物时,除了这些氨基肽酶的理论特异性之外,还必须考虑到要修饰的食物肽的性质和要修饰的位点周围的残基,以及反应介质的物理-化学参数。这些结论以及使用根据本发明的组合物的优点在随后的实验中得到强调。
加速水解和调节
mjtet90%/tet310%
为了证明tet氨基肽酶组合物对改善肽的水解的兴趣,针对富含芳香族残基的肽5测试了10%phtet3和90%mjtet的组合物的活性(图3a-3d)。每个氨基肽酶都单独与底物肽一起温育;通过rp-hplc分析的反应介质显示两种氨基肽酶对该肽都具有活性。在反应介质中,鉴定出4种降解产物,分别对应于底物肽,除了完整的底物(pep-0)外,还水解了一个(pep-1)、两个(pep-2)、三个(pep-3)或四个(pep-4)残基。
在phtet3的情况下(图3a),存在肽pep-1的积累,而完整的底物肽不再存在于介质中。
在肽mjtet的情况下(图3b),完整的肽的一部分仍存在于反应介质中,而水解产物的残基则以几乎相等的量存在。最终水解产物肽pep-4略有积累。
在两种氨基肽酶的组合物存在下温育肽后,底物肽不再存在于介质中,并且肽pep-4的积累更多,这表明与单独使用氨基肽酶相比,在包含tet氨基肽酶的组合物存在下,肽5的水解更有效(图3c)。将这三个测试得到的色谱图叠加在图3d上,由此可以清楚地观察到,向混合物中添加10%的氨基肽酶phtet3(单独)可以显著加速肽的水解,即使这对肽没有最佳活性。
mjtet95%/tet35%
通过改变tet3/mjtet混合物的比例进行相同的实验。这次,将肽在95%mjtet和5%phtet3的组合物存在下温育。
同样,在phtet3的情况下,将氨基肽酶与底物肽温育15分钟后,肽pep-1会大量积累(图4a)。完整的肽pep-0本身仍大量存在于反应介质中。以95%存在的mjtet对肽5的水解曲线(图4b)接近以90%获得的水解曲线(图3b)。
这些数据,与用95%mjtet和5%phtet3的组合物获得的数据相比(图4c),再次显示了通过向反应混合物中添加氨基肽酶phtet3加速了肽的水解(图4d)。在单独使用酶的情况下,观察到中间反应产物pep-1、pep-2和pep-3积累。在最后一个实验中,这些中间产物的浓度降低了,而最终产物pep-4的浓度却增加了。因此,添加5%的肽phtet3可以加速肽的水解过程。
更加有趣的是,观察到在这种特定情况下,添加理论上对希望水解的残基没有特异性的氨基肽酶使得增加tet氨基肽酶组合物的一般效率成为可能。
最后,tet氨基肽酶组合物的这两个实例,比例的改变显示了通过根据本发明的组合物提供了在水解调节方面的可能性,在这种情况下,允许修饰肽底物而不是完全破坏它们。
上述实验是在60℃下进行的。它们也可在40℃下进行,然后将获得的数据与先前的数据进行比较(图6)。
当phtet3氨基肽酶单独与底物肽在40℃下温育时,观察到水解显著降低。实际上,在这种情况下,只有肽pep-1可见并且量很少(图5a)。
另一方面,在mjtet的情况下观察到相同的效果,其中所有中间产物肽以及最终产物pep-4都是可见的,并且仅水解显著减慢(图5b)。
在95%mjtet和5%phtet3组合物的情况下(图5c),最终产物pep-4的浓度大大降低。另一方面,有趣的是注意到各种中间产物pep-1、pep-2和pep-3依次以几乎等同于在60℃下水解的量存在。因此,在40℃下对第一残基即酪氨酸的水解与在60℃下使用tet组合物时一样有效,而当单独使用氨基肽酶时,后者的水解大大降低。另一方面,其余的水解过程似乎被放慢了,这导致我们观察到的结果是底物肽仍然大量存在,而相比之下最终产物的积累很少。
该实例再次证明了调节作用,该调节作用可以整合到修饰根据本发明的底物的多肽含量的方法中。在这一部分中,显示了含量(tet氨基肽酶的不同比例)和温度的调节。为了获得更精细、更精确的肽修饰,还可以整合ph和时间调节。这些实例是用两种tet氨基肽酶进行的。但是,添加其他tet氨基肽酶可以更广泛或更精确地靶向目标肽。
随机肽的mjtet/phtet4组合物
测量了由氨基肽酶mjtet和phtet4的组合物水解随机肽7的动力学(图6)。5分钟、15分钟和30分钟后,通过rp-hplc分析肽的水解。肽7具有在n-末端呈递甘氨酸的特殊性。
氨基肽酶phtet4的特征表明它是一种甘氨酸-氨基肽酶。这就是为什么针对肽7测试其活性时仅观察到第一个甘氨酸残基水解的原因(图6a)。因此,我们可以看到肽pep-1的积累。
在通过氨基肽酶mjtet水解肽的情况下,我们观察到除了肽pep-1之外,还有肽pep-2和pep-3,以及对应于pep-4的肽(图6b)。另一方面,注意到在15至30分钟之间,底物肽pep-0的浓度似乎没有降低。同时,我们注意到pep-2的浓度降低了,而pep-3的浓度却增加了。在此观察到的现象是由于氨基肽酶对水解产物的亲和力大于起始底物的亲和力这一事实。
当包含等摩尔比例的两种氨基肽酶phtet4和mjtet的组合物与底物肽接触并温育时,观察到肽的水解显著改善(图6c)。完整肽pep-0的浓度在5至30分钟之间逐渐降低。另一方面,肽pep-1的浓度最初在5和15分钟之间增加,然后在15和30分钟之间急剧减少。
与单独的mjtet或与mjtet和phtet4的组合物温育30分钟后获得的色谱图覆盖在图7中。因此,可以观察到最终肽以相对类似的量存在,而底物肽几乎已完全水解。值得注意的是,在实验过程中,两种肽酶中没有一个能够完全水解该肽的第一残基。用第三种肽酶phtet3进行了测试。
在该实例中,底物肽的第一残基的水解通过肽酶组合物的加入而被加速,该肽酶组合物再次没有表现出最佳活性。应当指出的是,通过以特定方式调节tet氨基肽酶的类型、它们的比例、温度甚至ph值,这种修饰方法使得肽与观察到的水解中间产物之一(在图6b中15分钟时富集了pep-2肽的情况下)的混合物富集成为可能。
复杂混合物中肽水解的调节
乳清蛋白水解产物
乳清代表牛奶凝结后获得的液体部分。它包含约10%的蛋白质,所述蛋白质分为5个主要家族:β-乳球蛋白(50%)、α-乳白蛋白(20%)、免疫球蛋白(10%)、牛血清白蛋白(10%)和乳铁蛋白(2.8%)。
在以下测试中使用的底物是乳清蛋白水解产物,其制备已在上面说明。为了分析水解产物的相对肽组合物,在hplc系统上通过反相色谱法对其进行分析。对照水解产物的分析得到的色谱图如图9所示。
为了能够在最佳活性条件下分析tet酶对这些肽的活性,不同ph值下制备了两种水解产物。这两个色谱图叠加在图9中。
因此观察到色谱图的总体外观保持不变。因此,在ph变化期间,肽组成没有急剧变化。但是,洗脱曲线有细微变化。在分析结果时考虑了这些临时变化。
phtet2/phtet3组合物(50/50%、90/10%和10/90%)
在此,当将tet氨基肽酶用于本发明的特征组合物中时,证明了调节复杂混合物中特定肽水解的可能性。
当单独使用氨基肽酶时,首先测量phtet2和phtet3的活性(图10)。观察到并不是所有的肽都被tet氨基肽酶占据,这是由于使用的两种tet氨基肽酶具有不同的和标记的底物的特异性这一事实。用于该实验的肽混合物是复杂的混合物,我们还观察到了由氨基肽酶负载的不同肽的水解程度的差异。为了清楚起见,只显示了部分色谱图。但是,可以在整个色谱图上观察到呈现的结果。
当将水解产物与等摩尔量的2种氨基肽酶的组合物一起温育时,然后在溶液中的大多数肽上观察到水解活性的提高。出乎意料的是,水解度通过改变组合物中不同tet的比例而发生变化(图11)。
图12显示了使用3种不同比例的phtet2和phtet3的组合物获得的色谱图。首先,“等摩尔”混合物对应于每种tet的50%,这在图10中也可见。虚线所示的色谱图对应于每种tet氨基肽酶的不同比例,一种占90%,另一种占10%,反之亦然。因此,注意到水解曲线被修饰,这意味着混合物中每种tet氨基肽酶的比例的变化都会改变溶液中肽的水解程度。所有不同色谱图的叠加图显示在图12中,可以清楚地看到肽水解中可能的调节。
到目前为止,这是一个令人惊讶的结果。此外,要注意的是,水解的调节根据肽而变化。因此,可以通过精细地改变组合物中每种tet氨基肽酶的比例来调节各种肽的水解。现有技术中没有信息能够暗示可以通过改变混合物中不同tet的浓度以靶向方式调节肽的水解。
mjtet/phtet4组合物(50/50%)
下面介绍的第二系列测试涉及氨基肽酶mjtet和phtet4。所得色谱图的一部分的重叠图如图13所示。在这种情况下,观察到对甘氨酸残基特异的氨基肽酶phtet4在单独使用时不能水解肽。因此,对照色谱图和用phtet4温育后得到的色谱图的叠加非常清晰。相反,mjtet能够水解存在于肽混合物中的几种肽。
这一系列测试的显著结果与以下事实有关:当将mjtet和phtet4混合到组合物中时,底物肽的水解显著增加。
同样,这种不可预测的结果表明使用特异的tet氨基肽酶组合物可以特异性调节混合物中各种肽的水解程度。迄今为止获得的各种结果表明,还可以根据反应介质的物理化学条件来调节tet氨基肽酶的活性。因此,我们提出了一种基于这些酶的异常特性的方法。
phtet1/phtet2/phtet3/嗜热菌蛋白酶组合物
这些实验中使用的乳清来自上萨瓦省(haute-savoie)的一家奶酪工厂。乳清在4℃下运输,然后分成1ml样品存储在-20℃下。
与嗜热菌蛋白酶温育后(图14),样品中存在大量小肽,这是由于嗜热菌蛋白酶水解乳清蛋白的结果。
值得注意的是,在与嗜热菌蛋白酶和tets温育后,这些肽中的绝大多数已被降解。我们注意到一些肽的富集,这些肽代表与tet氨基肽酶活性相关的降解产物。
酪蛋白水解产物中特定肽的水解
phtet3、mjtet和phtet4(33/33/33%)组合物
在该实验中,将合成肽7掺入复合肽,酪蛋白水解产物(sigma)的混合物中。用氨基肽酶phtet3、mjtet和phtet4的组合物温育后,通过rp-hplc分析反应介质。进行的各种实验的结果显示在图15中。可以毫无异议地鉴定肽,并且可以观察到其降解的第一阶段。环境的复杂性使短片段的分析变得更加复杂。
当酪蛋白水解产物和肽7的混合物与氨基肽酶phtet3或mjtet一起温育时,观察到目的肽没有被很好地水解(图15a和b)。然而,如所预期的,混合物的酪蛋白水解产生的少量肽至少部分地被tet氨基肽酶水解。
当混合物在phtet4存在下温育时,只有目的肽被氨基肽酶phtet4水解,并且几乎完全水解(图15c),唯一出现的肽是pep-1肽。
当在三种tet氨基肽酶的组合物存在下温育肽的混合物时,也完全缺少完整的目的肽pep-0(图15d)。另一方面,在后一种情况下,应注意的是肽pep-1本身已被水解,因为与单独使用phtet4的实验相比,其浓度已大大降低。
该实验表明,该方法使得可以精确地靶向混合物中的肽以修饰或消除该肽。
部分天然谷蛋白蛋白质的特异性水解
phtet1/phtet2/phtet3(33/33/33%)组合物
谷蛋白是多种蛋白质的混合物,分为两个主要家族,即谷蛋白和麦醇溶蛋白。一些麦醇溶蛋白带有一种称为“免疫优势”的肽,该肽在对谷蛋白敏感或不耐受的人中引起过敏反应。这种综合征被称为乳糜泻。
在图16所示的色谱图上,观察到在丙醇中溶解的总谷蛋白样品与等摩尔量的氨基肽酶phtet1、phtet2和phtet3的组合物一起温育后,样品中的麦醇溶蛋白浓度显著下降。
在这种情况下,单独的氨基肽酶phtet1、phtet2和phtet3组合物,即不添加内肽酶,可以降低溶解在50%丙醇溶液中的总谷蛋白样品中携带免疫优势肽的蛋白质的浓度。
phtet1/phtet2/phtet3/嗜热菌蛋白酶组合物
在将谷蛋白与嗜热菌蛋白酶内切蛋白酶一起温育后,我们在图17中注意到样品中的大量小肽是由于内切蛋白酶非常有效地水解谷蛋白蛋白质导致的。当将氨基肽酶phtet1、phtet2和phtet3整合到组合物中时,绝大多数吸收峰会减少,这将转化为所有这些峰被氨基肽酶水解。
我们还注意到一些代表氨基肽酶降解产物的峰的富集。
实施例2
修饰肽谱的结果
材料和方法
乳清蛋白水解产物的tet氨肽酶活性测试
为了测试tet氨基肽酶的各种组合对乳清蛋白水解产物中存在的肽的水解活性,将总浓度为50μg/ml的各种tet蛋白混合物与水解产物以最终体积为100μl一起温育。没有将辅助因子添加到反应中。活性测试在ph=7.5的条件下进行,除了其中存在phtet4的测试,其在ph=9.5的条件下进行。然后将反应介质在振动(500rpm)下于60℃温育2小时。然后将管置于冰中以终止水解反应。然后,将80μl反应介质添加到320μl由2%乙腈(acn)和0.1%三氟乙酸(tfa)组成的溶液中。然后将样品以10,000g离心10分钟,然后转移到小瓶中,并将其注射在rp-hplc柱上进行分析。
反相hplc(rp-hplc)分析
将每种样品100μl注入连接到perkin
对色谱图的“窗口”(图18至28)有意进行了限制。仅显示了其本身的洗脱梯度,即480秒至4080秒之间的窗口。实验的第一分钟对应于进样后对色谱柱的洗涤(0-480秒),以及梯度洗脱后的洗涤结束(4080-6000秒)。
图18至28显示了rp-hplc分析得到的色谱图的叠加图。
以下描述了对以上定义的混合物(“混合物”或“组合物”)进行的各种测试。
使用的底物的控制
为了确保在新的乳清蛋白水解产物的分析中具有均质性和可重复性,将各种“对照”样品进行叠加和比较(图18)。
不幸的是,由于技术问题,混合物3对照样品丢失了。
因此看来,理论上在肽的末端包含更多多样性的所使用的新的水解产物是完全均一且稳定的,因为其分析结果可完全重现。
由不同混合物水解肽
将该乳清蛋白水解产物与tet的各种混合物一起温育。图19显示了新的乳清蛋白水解产物被不同的tet混合物水解后,样品的rp-hplc分析所得到的色谱图的叠加图。
图19所示的叠加图使得观察到在tet的不同混合物水解后获得的肽的显著可变性。在这一系列实验中测试的混合物中,使用的大多数肽酶都是phtet2或mjtet。因此,很可能使用不同的tet混合物获得的潜在可变性可能会更大。
因此,获得了由肽的精细修饰引起的“肽谱的重塑”。
图20至28显示了用不同的tet混合物水解后,在反应介质的rp-hplc中分析后获得的不同色谱图。标题中标明了混合物编号及其组成。
对这些各种混合物的观察清楚地表明,根据本发明的技术如何使肽谱“成形”成为可能。
可以彻底改变肽的性质,而又不完全降解它们:混合物1、2。另外,可以更精细地修饰介质中的肽:混合物5、6。
为了更好地理解在它们之间混合不同酶的优势,示出了通过各种混合物水解后或在单独的酶和酶的混合物之间获得的色谱图的几个叠加图。
混合物1和混合物2
图26表示通过tet的混合物#1和#2(混合物#1:70%phtet2、15%phtet3、15%phtet4;混合物#2:(70%phtet2、15%phtet4、15%mjtet)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图之一。
两次运行之间略有差异。
此处的大多数肽酶是phtet2,在两种混合物中均占70%。肽酶的这种主要存在解释了在色谱图之间可以观察到的相似性。尽管非常相似,但它们并不相同。唯一的区别是在一种存在phtet3的情况下,而另一种是在存在mjtet的情况下。
对合成肽的研究表明,肽phtet3和mjtet在肽环境中具有相似的行为。此处似乎仍然存在显著差异,并且这两种肽酶不能用来替代另一种。
比较tet2与混合物1和2
如上述几行所述,多数肽酶(此处为phtet2)强烈影响总体肽谱。在当前情况下,这非常清楚,尤其是根据图27和28,其是通过tet的混合物#1和#2(分别与phtet2相比,混合物#1:70%phtet2、15%phtet3、15%phtet4;混合物#2:70%phtet2、15%phtet4、15%mjtet)水解乳清蛋白水解产物的肽的rp-hplc分析中得到的色谱图的叠加图,因为在这两种情况下,仅用肽酶水解后的肽谱都非常接近由肽酶混合物水解后获得的肽谱。
观察到的少量差异是由于“少数”肽酶引起的。有趣的是,注意到在这种情况下,与由多数肽酶进行的修饰相比,这些差异相对较小。
实施例3
酶phtet3的结晶
使用悬浮在greinerbio-one品牌的24孔comboplate板上的液滴法获得phtet3蛋白质的晶体。用于实验的晶体是在使用以下母液的条件下形成的:100mmtris-hcl、100mmnacl、100mm(nh4)so4、43%2-甲基-2,4-戊二醇和ph=8。为了结晶,将1ml母液置于结晶板的孔中,通过将1.5μl浓缩至20mg/ml的phtet3蛋白质溶液和1.5μl母液混合,在硅烷化的盖玻片上形成液滴。
晶体的交联
为了使phtet3晶体交联,用最终1%戊二醛(v/v)实施的母液制备交联溶液。将1μl交联溶液的液滴沉积在硅烷化的盖玻片上,然后将较早获得的各种晶体转移到这些液滴中。通过温育1个晚上获得交联;然后收集交联的晶体,并放置在最初的母液的液滴,同时等待使用。所获得的交联晶体具有至少0.5mm的较大尺寸。
交联酶活性测试
为了能够在工业酶法中使用这些交联的酶晶体,进行了实验以检查一旦交联后酶是否仍然具有活性。
为了便于观察晶体的活性,使用了生色底物,在这种情况下为lys-pna。因此,将交联的phtet3晶体在所谓的活性缓冲液中温育,该活性缓冲液由150mmnacl和50mmpipes组成,ph=7.5,含有浓度为5mm的lys-pna底物。选择该底物特别是因为酶phtet3对氨基酸赖氨酸具有最大的活性。
可以观察到1μl活性缓冲液的液滴,其中已在室温下温育10分钟的phtet3的交联晶体的直径基本上为几毫米,通常为6-7mm(在室温下与phtet3的交联晶体温育10分钟后,以5mm观察到1μl的lys-pna底物的液滴)。因此,我们可以清楚地观察到lys-pna底物显著水解的下降迹象的亮黄色。该实验表明,phtet3酶一旦结晶并交联,仍然具有活性。这是交联后仍具有活性的大的酶复合物的罕见实例。
交联晶体的稳定性测试
为了能够在上述方法中使用这些晶体,评估了它们的机械强度和理化稳定性。
在ph=7.5的含有150mmnacl、50mmpipes的缓冲溶液中、以16,000g对晶体进行10个离心-悬浮周期,而未观察到晶体的完整性或活性的任何损失。
将相同的晶体在相同的缓冲液中于90℃温育1小时;再次,温育后未观察到晶体完整性或活性的损失。
它们还可以在milli-q蒸馏水中温育7天,而不会损失晶体完整性或活性。最后的实验特别有趣,因为不可能用相同的非结晶酶观察到这种稳定性。
结论
这些结果表明,有可能产生表现出tet酶水解活性的clec。另外,这些晶体具有非常显著的机械抗性和物理化学稳定性的性能。在工业环境中,这些宏观晶体在与底物温育后可以容易地过滤。因此,它们代表了固定化酶的策略,从工业和原始角度来看,这完全是现实的。
- 还没有人留言评论。精彩留言会获得点赞!
- OTUD5的单克隆抗体制备及其在癌症治疗中的用途的制造方法与工艺
- 一种胱氨酸蛋白酶抑制剂C测定试剂盒的制造方法与工艺
- 氮氧化物作为新型组蛋白去乙酰化酶抑制剂的抗肿瘤应用的制造方法与工艺
- 一种硼替佐米水溶性药用组合物及其制备方法和用途与制造工艺
- 初级癌症疗法后使用的含硼蛋白酶体抑制剂的制造方法与工艺
- 斯氏副柔线虫半胱氨酸蛋白酶抑制剂Pj_CPI基因克隆、重组表达方法及应用与制造工艺
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- 一种高产脯氨酸蛋白酶的黑曲霉菌株的制造方法与工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺