细胞因子诱导的杀伤细胞的双特异性抗体介导的癌症治疗的制作方法
发明领域
本公开涉及基于细胞的免疫治疗和药物相关的组合物和方法。本公开尤其涉及用于治疗癌症的治疗法。
背景
基于细胞的免疫治疗对于癌症治疗有很大的希望。然而,很难获得大量可以有效靶向肿瘤细胞的抗肿瘤特异性效应物免疫细胞。细胞因子诱导的杀伤细胞(即cik)是细胞毒性免疫效应细胞,由于cik具有抗肿瘤细胞毒性和多样的t细胞受体特异性而成为新一代抗肿瘤免疫细胞治疗的强有力的候选物。
cik是来自离体或者体外扩增细胞的异质细胞群体。cik可以在可溶性因子,例如抗cd3抗体、ifn-γ和il-2的存在下在标准培养条件下产生。cik细胞可以同时表达t细胞标志物cd3和自然杀伤细胞(即nk)标志物cd56,并且具有t和/或nk细胞表型。基于cik的治疗成为有希望的癌症治疗方法,主要因为cik扩增相对容易,并且cik具有不受主要组织相容性复合物(即mhc)限制的t和nk细胞的抗肿瘤活性。
然而,对于基于细胞的免疫治疗存在已知的挑战。基于细胞的免疫治疗通常是剂量限制性的、时间限制性的、昂贵的、劳动密集型的,并且尚未转化为常规的临床应用。
因此,需要改进目前基于细胞的免疫治疗以提供更有效率和效果的癌症治疗方法,该治疗方法更容易制备、具有更好的临床稳定性和功效以及降低的系统毒性。本公开通过提供显著改善癌症患者的治疗和管理的新型组合物和方法解决了改进基于细胞的免疫治疗的需要。
概述
本技术涉及一种组合物,其包含msbody和细胞毒性免疫细胞,其中所述msbody包含:a)对肿瘤抗原具有特异性的第一抗原结合部分,和b)与所述免疫细胞结合的第二抗原结合部分。
在一些实施方案中,所述细胞毒性免疫细胞是细胞因子诱导的杀伤(cik)细胞、t细胞、自然杀伤(nk)细胞、自然杀伤t细胞或者淋巴因子激活的杀伤(lak)细胞。在一些实施方案中,所述细胞是所述细胞因子诱导的杀伤(cik)细胞。在一些实施方案中,所述msbody与所述细胞因子诱导的杀伤(cik)细胞的细胞表面或者膜蛋白结合。
在一些实施方案中,所述蛋白质是cd3或者fc受体。在一些实施方案中,所述肿瘤抗原选自所述组,该组由egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72,cix、psma、叶酸结合蛋白、gd2、gd3、gm2、vegf、vegfr、整联蛋白αvβ3、整联蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白组成。
在一些实施方案中,所述cik细胞包含异质细胞群体。在一些实施方案中,所述异质细胞群体包含至少两个细胞。在一些实施方案中,所述cik细胞是dc3+cd56+细胞。在一些实施方案中,所述cik细胞针对肿瘤细胞具有非mhc限制性细胞溶解活性。
在一个方面,本技术还提供了一种用于制备包含msbody和细胞毒性免疫细胞的组合物的方法。
在另一个方面,本技术进一步提供了一种治疗包括癌症患者的患者的方法,包括:a)从所述患者获得外周血淋巴细胞(pbl)样品;b)用抗cd3抗体、ifn-γ和il-2孵育pbl以获得cik细胞;c)用双特异性抗体武装所述cik细胞,其中每个msbody包含对肿瘤抗原具有抗原结合特异性的第一抗原结合部分,和与所述cik细胞结合的第二抗原结合部分,和d)施用所述具有结合的双特异性抗体武装的cik细胞到有需要的患者。
在一个方面,本技术提供了一种包含组合物的试剂盒,所述组合物包含msbody和细胞毒性免疫细胞,其中所述msbody包含:a)对肿瘤抗原具有特异性的第一抗原结合部分,和b)与所述细胞结合的第二抗原结合部分,以及使用说明书。
附图简述
作为本公开的实施方案,提供的是仅通过示例而非限制说明的附图,其中:
图1描绘了双特异性抗体(msbody)可以武装在cik细胞上并且裂解肿瘤细胞。抗cd3特异性单链抗体可以由多种msbody抗体共享。靶抗原特异性单体抗体对于每一种msbody抗体是不同的,并且可以识别靶标,例如her2或者ep-cam。所有msbody可以在表达cd3的活化cik细胞的表面上武装,以形成武装活化cik细胞(acc)。如右图所示,msbody抗体可以通过同时结合cd3和靶抗原来瞬时连接cik细胞和癌细胞,同时,抗体的fc部分可以结合免疫辅助细胞的fc受体。这触发cik细胞和免疫辅助细胞活化,包括细胞毒性颗粒融合、瞬时细胞因子释放和/或增殖。附着癌细胞的重定向裂解涉及穿孔素的膜穿孔以及由颗粒酶诱导的继发性程序性细胞死亡。
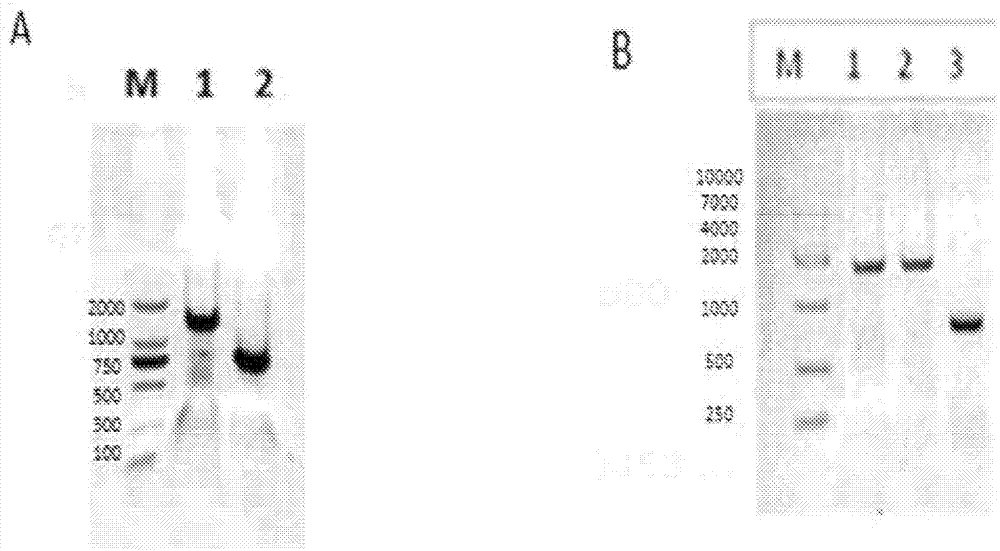
图2描述了1%琼脂糖凝胶电泳。a.泳道m:dl2000标志物;泳道1:抗-ep-camhc;泳道2:抗ep-camlc;b.泳道m:dl10000标志物;泳道1:赫赛汀hc;泳道2:l2k-scfv;泳道3:赫赛汀lc。
图3描述了考马斯蓝染色的sds-page凝胶和通过hplc-sec检测的双特异性抗体的纯度。a.考马斯蓝染色的还原的8%sds-page凝胶。b.考马斯蓝染色的未还原的6%sds-page凝胶(泳道m:蛋白标志物,泳道1.her2xcd3msbody,泳道2.ep-camxcd3msbody);c.纯化的her2xcd3msbody;d.纯化的ep-camxcd3msbody。
图4描述了her2×cd3msbody与sk-br-3细胞(a)和jurkat(b)细胞表面结合的流式细胞分析;黑色实线:msbody和黑色虚线:赫赛汀或者l2k单克隆抗体。
图5描述了ep-camxcd3msbody与sw480细胞(a)和jurkat(b)细胞表面结合的流式细胞分析;黑色实线:msbody和黑色虚线:抗-ep-cam单克隆抗体或者l2k单克隆抗体。
图6是通过抗-cd45/cd3/cd56抗体的facs检测cik细胞的表型。a.cd45阳性对照;b.cd3和cd56阴性对照;c.cd45阳性人群;d.右上象限显示cd3和cd56双阳性。
图7描述了msbody分子介导的共结合分析。a.未经cfse或pkh26染色的sk-br-3和cik共结合阴性对照;b.经cfse和pkh26染色的sk-br-3和cik共结合对照,分别不加msbody;c.右上象限显示与msbody共结合的两种细胞。
图8描述了msbody武装活化cik细胞(acc)的特异性。通过流式细胞术测定具有从100nm至0.78nm一系列浓度的her2×cd3msbody武装活化的cik细胞,pe标记的抗人iggfc。
图9描述了武装活化cik细胞(acc)裂解sk-br-3乳腺癌细胞。(■)her2×cd3msbody的系列稀释液或者(●)100nmhigg。acc与sk-br-3靶细胞以e:t=5:1比例孵育,24小时后通过使用荧光染料cfse和pi的基于流式细胞检测来测定细胞裂解。图示来自一式三份测定的平均值。
图10描述了her2×cd3msbody诱导的针对sk-br-3细胞的细胞毒性。24小时(a)或48小时(b)后测定细胞裂解,使用her2×cd3msbody(●)赫赛汀(■)higg(▼)的系列稀释液引入细胞裂解,并且使用graphpadprism软件测定ec50值和最大裂解。
图11描述了ep-cam×cd3msbody诱导的针对sw480细胞的细胞毒性结果。24小时(a)或48小时(b)后测定细胞裂解,使用ep-cam×cd3msbody(■)抗-ep-cam单克隆抗体(▼)higg(○)的系列稀释液引入细胞裂解,使用graphpadprism软件测定ec50值和最大裂解。
图12描述了武装活化cik细胞(acc)可以抑制肿瘤生长,(●)无cik细胞和msbody(■)注射未武装的cik细胞(▲)注射用her2×cd3msbody武装的cik细胞。
附图的部分或所有是用于示例的示意性表示;因此,它们不必描述所示元件的实际相对尺寸或者位置。提供附图是出于说明一个或多个实施例的目的,明确理解它们将不用于限制以下权利要求的范围或含义。
详述
贯穿本公开,本文涉及本发明营养物、组合物和方法的多种实施方案。多种实施方案的描述旨在提供各种说明性示例而不应解释为对替代物的描述。相反,应当注意,本文提供的多种实施方案的描述可以具有重叠的范围。本文讨论的实施方案仅仅是说明性的,并且不意味着限制本公开的范围。
同样贯穿本公开,多种出版物、专利和公开的专利说明书通过识别引文来引用。这些出版物、专利和公开的专利说明书公开的内容在此通过引用并入本公开中,以更全面地描述本公开所述领域的状态。
定义
如在说明书和权利要求书中所用,单数形式“一”,“一个”和“所述”包括复数指代,除非上下文另有明确规定。例如,术语“电极”包括多个电极,包括其混合物。
如本文所使用的,术语“包含”旨在表示装置和方法包括的组件或步骤,但不排除其他。“基本上由……组成”当用于限定装置和方法时,应当意味着排除对该组合具有任何实质意义的其它组件或步骤。“由……组成”应当意味着排除其它组件或步骤。这些过渡术语中的每一个所限定的实施方案在本公开的范围内。
所有数字名称,例如距离、尺寸、温度、时间、电压和浓度,包括范围,是以±0.1的增量变化的近似值。应当理解是,尽管不总是明确地指出,所有的数字标号前都有术语“约”。还应当理解是,尽管不总是明确说明,本文所描述的组件仅仅是示例性的并且这些组件的等效物在本领域是已知的。
“肿瘤抗原”是在肿瘤细胞中产生的抗原物质,即它在宿主中触发免疫应答。肿瘤抗原可用于鉴定肿瘤细胞并且对用于癌症治疗是潜在的候选物。机体中的正常蛋白质不是抗原性的。然而,在肿瘤发生过程中,某些蛋白质产生或者过表达并因此对机体显示“外源”。这可能包括与免疫系统良好隔离的正常蛋白质、通常以极小量产生的蛋白质、通常仅在某些发育阶段产生的蛋白质或者其结构由于突变而修饰的蛋白质。
如本文所用,术语“细胞毒性免疫细胞”是指当用本公开的双特异性抗体激活和武装时,靶向并杀死肿瘤细胞或细胞系或被病原体感染的细胞的免疫系统的细胞。示例的细胞毒性免疫细胞包括但不限于cik细胞、t细胞、cd8+t细胞、活化的t细胞、单核细胞、自然杀伤(nk)细胞、nkt细胞、淋巴因子激活的杀伤(lak)细胞、巨噬细胞和树突细胞。
如本文所用,术语“多肽”意在包括单个“多肽”以及多个“多肽”,并且是指由通过酰胺键(也称为肽键)线性连接的单体(氨基酸)组成的分子。术语“多肽”是指两个或者更多个氨基酸的任一条或多条链,而不是指特定长度的产物。因此,肽、二肽、三肽、寡肽、“蛋白质”、“氨基酸链”或用于指两个或者更多个氨基酸的一条或多条链的任何其他术语包括在“多肽”的定义中,并且术语“多肽”可被这些术语的任一个替代或互换。术语“多肽”也意指多肽的表达后修饰的产物,包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知的保护/封闭基团的衍生化、蛋白水解切割或者通过非天然发生的氨基酸产生的修饰。多肽可来自天然生物源或者通过重组技术产生,但不必从指定的核酸序列翻译而来。其可以以任何方式产生,包括通过化学合成。
“同源性”或者“同一性”或者“相似性”是指两个肽之间或两个核酸分子之间的序列相似性。同源性可以通过比较每个序列中为了比较目的而可以比对的位置来确定。当比较序列中的位置被相同的碱基或氨基酸占据时,则分子在该位置是同源的。序列之间的同源性程度是由序列共享的匹配或者同源位置的数量的函数。尽管优选小于25%的同一性,“不相关”或者“非同源”序列与本公开的序列之一仍共享小于40%的同一性,。
多核苷酸或者多核苷酸区域(或者多肽或者多肽区域)与另一个序列的“序列同一性”具有一定百分比(例如60%、65%、70%、75%、80%、85%、90%、95%、98%或者99%),是指当比对时,在比较两个序列时碱基(或者氨基酸)的百分比是相同的。这种比对和百分比同源性或者序列同一性可以使用本领域已知的软件程序来测定,例如ausubel等,eds.(2007)currentprotocolsinmolecularbiology。生物等效多核苷酸是那些具有上述指定的百分比同源性和编码具有相同或者相似生物活性的多肽。
术语“等效核酸或多核苷酸”是指与核酸或其互补序列的核苷酸序列具有一定程度的同源性或者序列同一性的核苷酸序列的核酸。双链核酸的同源物意在包括与或者与其互补序列具有一定程度同源性的核苷酸序列的核酸。在一个方面,核酸的同源物能够与核酸或其互补序列杂交。同样,“等效多肽”是指与参考多肽的氨基酸序列具有一定程度同源性或者序列同一性的多肽。在一些方面,所述序列同一性是至少约70%、75%、80%、85%、90%、95%、98%或99%。在一些方面,所述等效序列保留参考序列的活性(例如表位结合)或者结构(例如盐桥)。
杂交反应可以在不同“严格性”的条件下进行。一般,低严格杂交反应在约10×ssc,40℃下或者等效离子强度/温度的溶液中进行。中严格杂交通常在约6×ssc,50℃下进行,以及高严格杂交反应一般在约1×ssc,60℃下进行。杂交反应还可以在本领域技术人员熟知的“生理条件”下进行。生理条件的非限制性实例是通常在细胞中发现的温度、离子强度、ph和mg2+的浓度。
如本文所用,术语“可检测标记”意指直接或者间接地与待检测组合物(例如多核苷酸或者蛋白质例如抗体)直接或者间接缀合的可检测的化合物或者组合物,以产生“标记的”组合物。该术语还包括与多核苷酸缀合的序列,其将在插入序列表达时提供信号,例如绿色荧光蛋白(gfp)等。所述标记可以由自身检测(例如放射性同位素标记或者荧光标记)或者在酶标记的情况下,可以催化可检测的底物化合物或者组合物的化学变化。这些标记可以适合于小规模检测或者更适合于高通量筛选。因此,合适的标记包括但不限于放射性同位素、荧光染料、化学发光化合物、染料和蛋白质,包括酶。所述标记可以简单地检测或者可以定量。简单地检测的响应一般包括其存在仅被证实的响应,而被量化的响应一般包括具有可量化(例如可报告的数字)值(例如强度、极化和/或其它性质)的响应。在发光或者荧光测定中,可检测的响应可能由直接使用与实际参与结合的测定组分相关联的发光体或荧光团,或者间接使用与另一个(例如报道分子或指示剂)组分相关联的发光体或者荧光团产生。
如本文所用,“抗体”或者“抗原结合多肽”是指特异性识别并结合抗原的多肽或者多肽复合物。抗体可以是一个完整抗体和任何抗原结合片段或者其单链。因此,术语“抗体”包括含有分子的任何蛋白质或肽,所述分子包含结合抗原具有生物活性的免疫球蛋白分子的至少一部分。这样的实例包括但不限于重链或轻链的互补决定区(cdr)或者其配体结合部分、重链或者轻链可变区、重链或者轻链恒定区、框架(fr)区或者其任何部分、或者结合蛋白的至少一部分。
如本文所用,术语“抗体片段”或者“抗原结合片段”是抗体的一部分,例如f(ab')2、f(ab)2、fab'、fab、fv、scfv等。不管结构如何,抗体片段与被完整抗体识别的相同抗原结合。术语“抗体片段”包括适体、镜像异构体和双抗体。术语“抗体片段”还包括通过结合特异性抗原形成复合物而起抗体作用的任何合成或者基因工程蛋白。
“单链可变片段”或者“scfv”是指免疫球蛋白的重链(vh)和轻链(vl)可变区的融合蛋白。在一些方面,所述区域与10至约25个氨基酸的短接头肽连接。所述接头可富含灵活性的甘氨酸以及溶解性的丝氨酸或苏氨酸,并且可以将vh的n-末端与vl的c-末端连接,或反之亦然。尽管去除了恒定区并且引入了接头,该蛋白质还是保留了原始免疫球蛋白的特异性。scfv分子是本领域已知的并且描述于例如美国专利no:5,892,019中。
术语“抗体”包括可以在生物化学上区分的多种类型广泛的多肽。本领域技术人员知道重链分为γ、μ、α、δ或者ε,其中有一些亚类。该链的性质将抗体的“类别”分别确定为igg、igm、igaigg或ige。免疫球蛋白亚类(同种型),例如igg1、igg2、igg3、igg4、igg5等,是经过充分表征的并且已知其赋予了功能特异性。根据本公开,这些类别和同种型的抗体中的每个的修饰形式对于技术人员而言都是易于辨别的,因此它们都在本发明的范围内。所有免疫球蛋白类型清楚地在本公开的范围内,以下讨论总体上针对免疫球蛋白分子的igg类别。关于igg,其是标准免疫球蛋白分子,包含两条相同的分子量约23,000道尔顿的轻链多肽和两条相同的分子量为53,000-70,000的重链多肽。四条链通常通过二硫键以“y”构型连接,其中轻链在"y"的开口处开始括住重链并延续至整个可变区。
本公开的抗体、抗原结合多肽、变体或者其衍生物包括但不限于多克隆、单克隆、多特异性、人、人源化、灵长类化或者嵌合抗体;单链抗体;表位结合片段,例如fab、fab'和f(ab')2、fd、fvs、单链fvs(scfv)、单链抗体、二硫键连接的fv(sdfv)、包含vl或vh结构域的片段、通过fab表达文库产生的片段;以及抗独特型(抗-id)抗体(包括例如本文公开的light抗体的抗-id抗体)。本公开的免疫球蛋白或者抗体分子可以是任何类型(例如igg、ige、igm、igd、iga和igy)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或者亚类的免疫球蛋白分子。
轻链分为kappa或lambda(κ,λ)。每种重链类可与κ或者λ轻链结合。一般地,当免疫球蛋白由杂交瘤、b细胞或者遗传改造的宿主细胞产生时,轻链和重链彼此共价键合,并且两条重链的“尾”部通过共价二硫键或者非共价键相互结合。在重链中,氨基酸序列是由位于y构型的叉状末端的n末端开始直至位于各条链底端的c末端。
轻链和重链均被分成结构和功能同源性区域。术语“恒定的”和“可变的”作为功能使用。在这方面,应当理解,轻(vl)链和重(vh)链部分的可变结构域决定抗原识别和特异性。相反,轻链(cl)和重链(ch1、ch2或ch3)的恒定结构域赋予重要的生物学性质,例如分泌、经胎盘运动性、fc受体结合、补体结合等。按照惯例,随着恒定区结构域与抗体的抗原结合位点或氨基末端的距离越远,该结构域的数量增加。n-末端部分是可变区并且在c-末端部分是恒定区,所述ch3和cl结构域实际上分别包含重链和轻链的羧基末端。
如上所述,可变区允许抗体选择性地识别并且特异性结合抗原上的表位。换言之,抗体的vl结构域和vh结构域、或者互补决定区(cdr)的亚区相结合,形成了定义为三维抗原结合位点的可变区。这种四元抗体结构在y的各个臂末端处形成了抗原结合位点。更具体地,抗原结合位点是由每个vh和vl链的三个cdr来定义的(即cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3)。在一些情况下,例如衍生自骆驼科物种或者基于骆驼科动物免疫球蛋白改造的某些免疫球蛋白分子,完整的免疫球蛋白分子可以仅由重链构成而不具有轻链。例如参见hamers-casterman等,nature363:446-448(1993)。
在天然抗体中,存在于各个抗原结合结构域中的6个“互补决定区”或者“cdr”是短的、非连续的氨基酸序列,当所述的抗体在水性环境中呈现其三维构型时,所述的氨基酸序列特异性地定位,从而形成抗原结合结构域。抗原结合结构域中的其余氨基酸称为“框架”区,其显示低的分子内可变性。框架区主要采用β-片构型而cdrs形成连接β-片结构的环,并且在某些情况下所述的环形成了β-片结构的一部分。因此,框架区起到了形成支架的作用,其中所述的支架使得cdr通过链内非共价作用以正确的方向定位。由定位的cdr形成的抗原结合位点定义了与位于免疫反应性抗原上的表位互补的表面。这种互补的表面促进了抗体与其同源的表位的非共价结合。对于任何给定的重链可变区和轻链可变区,本领域的任何普通技术人员都可以容易地分别鉴定含cdr区域和框架区的氨基酸,这是因为这些氨基酸已经被精确地定义(参见“sequencesofproteinsofimmunologicalinterest,”kabat,e.等,u.s.departmentofhealthandhumanservices,(1983);以及chothiaandlesk,j.mol.biol.,196:901-917(1987),其整体通过引用并入本文)。
在本领域中使用和/或接受的术语具有两个或者多个定义的情况下,本文所使用的术语的定义意在包括所有这样的含义,除非明确地做出了相反的说明。具体实例为术语“互补决定区”(“cdr”)的使用,该术语描述的是在重链和轻链多肽的可变区内发现的非连续的抗原结合位点。该特定区域已由kabat等,u.s.dept.ofhealthandhumanservices,“sequencesofproteinsofimmunologicalinterest”(1983)和由chothia等,j.mol.biol.196:901-917(1987)描述,其整体通过引用并入本文。根据kabat和chothia,在将该cdr彼此对比时,其定义包括氨基酸残基的重叠或亚区。然而,关于抗体或其变体的cdr的定义应用均在本文所定义和使用的术语的范围内。包含了特定cdr的确切残基数将随着cdr的序列和大小的变化而变化。根据抗体的可变区的氨基酸序列,本领域的技术人员可以通过常规方式确定哪些残基包含特定的cdr。
本文公开的抗体可来自任何动物来源,包括鸟类和哺乳动物。优选地,所述抗体是人、鼠、驴、兔、山羊、豚鼠、骆驼、美洲驼、马或者鸡抗体。在另一个实施方案中,所述变区在来源中可以是condricthoid(例如来自鲨鱼)。
如本文所用,术语“重链恒定区”包括衍生自免疫球蛋白重链的氨基酸序列。包含重链恒定区多肽包含以下中的至少一种ch1结构域、铰链(例如上游铰链区,中游铰链区和/或下游铰链区)结构域、ch2结构域、ch3结构域或者其变体或片段。例如,用于本公开的结合多肽可以包括:包含ch1结构域的多肽链;包含ch1结构域,铰链结构域的至少一部分和ch2结构域的多肽链;包含ch1结构域和ch3结构域的多肽链;包含ch1结构域、铰链结构域的至少一部分和ch3结构域的多肽链,或者包含ch1结构域、铰链结构域、ch2结构域和ch3结构域的至少一部分的多肽链。在另一个实施方案中,本公开的多肽包括包含ch3结构域的多肽链。此外,用于本公开的结合多肽可以缺乏ch2结构域的至少一部分(例如ch2结构域的全部或部分)。如上所述,本领域普通技术人员应当理解所述重链恒定区可以被修饰,使得它们在氨基酸序列上与天然存在的免疫球蛋白分子不同。
本文公开的抗体的重链恒定区可以衍生自不同的免疫球蛋白分子。例如多肽的重链恒定区可以包含衍生自igg1分子的ch1结构域和衍生自igg3分子的铰链区。在另一个实例中,重链恒定区可以包含部分衍生自igg1分子和部分衍生自igg3分子的铰链区。在另一个实例中,重链部分可以包含部分地衍生自igg1分子和部分衍生自igg4分子的嵌合铰链。
如本文所用,术语“轻链恒定区”包括衍生自抗体轻链的氨基酸序列。优选地,轻链恒定区包含恒定kappa(κ)结构域或者恒定lambda(λ)结构域中的至少一个。
“轻链-重链对”是指可以通过轻链的cl结构域和重链的ch1结构域之间的二硫键形成二聚体的轻链和重链的集合。
如前所述,多种免疫球蛋白类别的恒定区的亚基结构和三维构型是熟知的。如本文所用,术语“vh结构域”包括免疫球蛋白重链的氨基末端可变结构域并且术语“ch1结构域”包括免疫球蛋白重链的第一(氨基最末端)恒定区结构域。ch1结构域与vh结构域相邻并且是免疫球蛋白重链分子的铰链区的氨基末端。
如本文所用,术语“ch2结构域”包括例如采用常规的编号方案由抗体的约第244个残基延伸至第360个残基(第244个残基至第360个残基,kabat编号系统;第231-340个残基,eu编号系统;参见kabat等,u.s.dept.ofhealthandhumanservices,“sequencesofproteinsofimmunologicalinterest”(1983))。ch2结构域是独特的,因为其不与另一个结构域紧密配对。而是,两条n连接的支链糖链插入在完整的天然igg分子的两个ch2结构域之间。此外,已经充分证明了所述ch3结构域从ch2结构域延伸至igg分子的c末端,并且包含约108个残基。
如本文所用,术语“铰链区”包括将ch1结构域与ch2结构域连接的重链分子的部分。该铰链区包含大约25个残基,并且是柔性的,因此使得两个n末端抗原结合区可以独立地移动。铰链区可以细分为三个不同的结构域:上游,中部和下游铰链结构域(roux等,j.immunol161:4083(1998))。
如本文所用,术语“二硫键”包括在两个硫原子之间形成的共价键。氨基酸半胱氨酸包含可以与第二个巯基形成二硫键或桥的巯基。在大部分天然存在的igg分子中,ch1和cl区通过二硫键连接,并且两个重链在对应于采用kabat标号系统的239和242的位置(采用eu编号系统的226或229的位置)处通过二硫键连接。
如本文所用,术语“嵌合抗体”被用于指其中免疫反应性区域或位点得自或衍生自第一种物种,而恒定区(根据本公开可以是完整的、部分的或者修饰的)得自第二种物种的任何抗体。在某些实施方案中,靶结合区或者位点来自非人来源(例如小鼠或灵长类动物)而恒定区是人的。
通过“特异性结合”或“对其具有特异性”,一般是指抗体通过其抗原结合结构域与表位结合,并且这种结合需要抗原结合结构域与所述表位之间一定的互补性。根据该定义,当抗体通过其抗原结合结构域比该抗体与随意的、无关的表位结合得更容易与表位结合时,称其与表位“特异性结合”。如本文所用,术语“特异性”用于对某种抗体与某种表位结合的相对亲和力进行定性。例如,对于给定表位,可认为抗体“a”比抗体“b”具有更高的特异性,或者与相关的表位“d”相比,可以认为抗体“a”与表位“c”的结合具有更高的特异性。
如本文所用,术语“融合的”,“连接的”和“缀合的”是指双特异性抗体中第一抗原结合部分和第二抗原结合部分之间的连接。这种连接可以通过重组(例如重组融合蛋白)或者化学方法引入。合适的化学手段的非限制性示例包括共价键、二硫键、氢键、静电键合和构象键,并且可涉及同型双功能或者异型双功能交联剂的使用。合适的交联和缀合方法公开于sen等,j.hemato.stemcellres.2001,10:247-260;美国专利no:us6,642,363和美国申请no:20060002852。
术语“同种异体”是指衍生自或者源于不同个体的样品。同种异体样品可以来自遗传不同、遗传相似(例如同胞)的不同个体。关于细胞、血浆或血清,该术语表示获得组合物的个体与将施用组合物的个体不同。同种异体还可以指从多于一个非同一个体(供体)产生的样品。
如本文所用,术语“治疗”(“treat”或“treatment”)是指治疗性治疗和预防性或防护性措施,其中目的在于预防或减慢(减轻)不需要的生理变化或紊乱,例如癌症的进展。有益的或者所需要的临床结果包括但不限于减轻症状、减轻疾病程度、稳定(即,不恶化)疾病状态、延迟或者减缓疾病进展、改善或者减轻疾病状态,以及缓解(部分或者全部),无论是可检测的或者不可检测的。与在未接受治疗下所期望的存活相比,“治疗”还可以指延长的存活。需要治疗的对象包括已经患有症状或紊乱的那些、以及倾向于具有症状或紊乱的那些或者其中症状或紊乱有待预防的那些。
“受试者”或者“个体”或者“动物”或者“患者”或者“哺乳动物”是指需要诊断,预后或者治疗的任何受试者,尤其是哺乳动物受试者。哺乳动物受试者包括人,家养动物,农场动物,和动物园、竞技或者宠物动物例如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、奶牛等。
如本文所用,短语诸如“对需要治疗的患者”或者短语“需要治疗的受试者”包括如下受试者,例如哺乳动物受试者,该受试者受益于本发明所使用的抗体或者组合物的施用,例如用于检测、用于诊断程序和/或用于治疗。
双特异性抗体介导的基于细胞的免疫治疗
本公开提供了用于改善治疗功效并且减少基于细胞的免疫治疗的不良作用的组合物和方法。通过将对肿瘤细胞具有特异性的抗体附着到免疫细胞(例如细胞毒性免疫细胞),该抗体可以有效地将免疫细胞靶向肿瘤(图1)。出乎意料地,这种靶向导致肿瘤杀伤的增强,表明靶向和细胞毒性之间的协同作用。
存在多种将抗体附着到细胞的方法。在一个方面,抗体还对免疫细胞具有特异性;因此这样的抗体是具有双重结合特异性的双特异性抗体。通过将这样的抗体与免疫细胞孵育,抗体将与免疫细胞结合。然后可以将抗体结合的免疫细胞施用于癌症患者,其中该抗体识别肿瘤细胞并因此使免疫细胞接近肿瘤细胞。
在一些方面,所述免疫细胞是细胞毒性免疫细胞。示例性细胞毒性免疫细胞包括但不限于cik细胞、t细胞、cd8+t细胞、活化的t细胞、单核细胞、自然杀伤(nk)细胞、nkt细胞、淋巴因子激活的杀伤(lak)细胞、巨噬细胞和树突细胞。
在一些实施方案中,所述细胞毒性免疫细胞是cik细胞。在一些实施方案中,双特异性抗体与cik细胞和肿瘤细胞的结合提高了cik介导的针对肿瘤细胞的细胞毒性。在一些实施方案中,这样的结合诱导cik细胞的活化以及cik细胞针对肿瘤细胞或者细胞系的细胞毒性。在一些实施方案中,所述结合诱导cik细胞的活化,其可以导致cik细胞的脱粒。
在一些实施方案中,所述双特异性抗体包含对肿瘤抗原具有特异性的第一抗原结合部分。肿瘤抗原的非限制性示例包括egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72、cix、psma、叶酸结合蛋白、gd2、gd3、gm2、vegf、vegfr、整联蛋白αvβ3、整联蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白。在一些实施方案中,所述第一抗原结合部分对与相应的非肿瘤细胞相比在肿瘤细胞中过表达蛋白质或者肽具有特异性。
在一些实施方案中,所述双特异性抗体包含结合细胞毒性免疫细胞的第二抗原结合部分。所述第二抗原结合部分是特异性结合在细胞毒性免疫细胞(例如cik细胞)表面上表达的抗原或者蛋白质或者多肽的任何分子。适用于本公开的细胞毒性免疫细胞表面上表达的示例性非限制性抗原可包括cd2、cd3、cd4、cd5、cd8、cd11a、cd11b、cd14、cd16a、cd27、cd28、cd45、cd45ra、cd56、cd62l、fc受体、lfa、lfa-1、tcrαβ、ccr7、巨噬细胞炎症蛋白1a、穿孔素和fas配体。在一些实施方案中,所述第二抗原结合部分结合细胞毒性免疫细胞(例如cik细胞)的cd3。在一些实施方案中,所述第二抗原结合部分结合细胞毒性免疫细胞的cd56。在一些实施方案中,所述第二抗原结合部分结合细胞毒性免疫细胞的fc受体。在一些实施方案中,所述双特异性抗体的fc区结合细胞毒性免疫细胞的fc受体。
在一些实施方案中,所述双特异性抗体对肿瘤抗原和cik细胞具有特异性,其使表达肿瘤抗原的肿瘤细胞接近cik细胞,导致通过cik细胞的抗肿瘤细胞毒性消除肿瘤细胞。在一些实施方案中,所述双特异性抗体对肿瘤抗原具有特异性,但对cik细胞不具有特异性,然而,所述双特异性抗体的fc区可以结合cik细胞的fc受体,其进而使肿瘤细胞紧密接近cik细胞,导致通过cik细胞的抗肿瘤细胞毒性消除肿瘤细胞。在一些实施方案中,所述双特异性抗体对cik细胞具有特异性,但对肿瘤细胞不具有特异性,然而,所述双特异性抗体的fc区可以结合肿瘤细胞的fc受体,其进而使所述肿瘤细胞紧密接近cik细胞,导致通过cik细胞的抗肿瘤细胞毒性消除肿瘤细胞。
在一些实施方案中,不对称双特异性抗体的单价单元对肿瘤抗原具有特异性,并且所述双特异性抗体的单链单元对cik细胞具有特异性。在一些实施方案中,不对称双特异性抗体的单价单元对cik细胞具有特异性,并且所述双特异性抗体的单链单元对肿瘤抗原具有特异性。另一种双特异性抗体具有两个单链单元,其中一个对肿瘤抗原具有特异性并且另一个对cik细胞具有特异性。这些双特异性抗体可以使细胞毒性免疫细胞(例如cik细胞)接近肿瘤细胞,导致通过细胞毒性免疫细胞的抗肿瘤细胞毒性消除肿瘤细胞。
在一些实施方案中,本公开提供了通过从患者获得pbl或者pbmc样品来治疗患者(包括癌症患者)的方法;用抗cd3抗体,ifn-γ和il-2孵育所述pbl或者pbmc以获得cik细胞;用双特异性抗体武装所述cik细胞,其中每个双特异性抗体包含对肿瘤抗原具有抗原结合特异性的第一抗原结合部分,和与所述cik细胞结合的第二抗原结合部分,并且施用所述具有结合的双特异性抗体武装的cik细胞到有需要的患者。本公开的抗原结合多肽、变体或者衍生物可用于与癌症或者传染病相关的某些治疗和诊断方法。当施用于患者时,所述双特异性抗体武装的细胞毒性免疫细胞将靶向和消除病原体感染的肿瘤细胞或者细胞。
本文公开的所述组合物和方法为肿瘤或者癌症或者感染病原体的患者提供了意想不到的和令人惊讶的有效治疗,因为武装所述细胞毒性免疫细胞以实现理想的治疗效果所需的双特异性抗体的浓度低。本公开的双特异性抗体能够使所述细胞毒性免疫细胞接近肿瘤细胞或感染的细胞以使所述细胞毒性免疫细胞裂解它们。
在一些实施方案中,为了实现相同的期望效果,武装所述细胞毒性免疫细胞所需的所述双特异性抗体的浓度比本领域中其他组合物至少低一个数量级。在一些实施方案中,用每106个细胞毒性免疫细胞0.001ng至50ng的所述双特异性抗体的量武装所述细胞。在一些实施方案中,用每106个细胞0.01ng至5ng的所述双特异性抗体的量武装所述细胞。在一些实施方案中,用每106个细胞0.1至1ng的所述双特异性抗体的量武装所述细胞。在一些实施方案中,用每106个细胞1ng的所述双特异性抗体的量武装所述细胞。在一些实施方案中,用于武装所述细胞毒性免疫细胞的所述双特异性抗体的浓度为100ng、50ng、40ng、30ng、20ng、15ng、10ng、5ng、4ng、3ng、2ng、1ng、0.5ng、0.1ng、0.05ng、0.01ng、0.005ng和0.001ng每106个细胞毒性免疫细胞。
细胞因子诱导的杀伤(cik)细胞
本公开的所述组合物包含双特异性抗体和细胞毒性免疫细胞,其中所述双特异性抗体包含对肿瘤抗原具有特异性的第一抗原结合部分,和与所述细胞结合的第二抗原结合部分。在一些实施方案中,所述细胞毒性免疫细胞是细胞因子诱导的杀伤(cik)细胞、t细胞、自然杀伤(nk)细胞、自然杀伤t细胞或者淋巴因子激活的杀伤(lak)细胞。
cik细胞是来自初始体细胞,例如t细胞或者外周血淋巴细胞(pbl)的离体或者体外扩增细胞的异质群体。cik具有混合的t和nk细胞表型,并且能够同时表达t细胞标记物cd3和nk细胞标记物cd56。在一些实施方案中,cik细胞的异质群体包含至少两个细胞。在一些实施方案中,所述cik细胞是cd3+cd56+细胞。在一些实施方案中,所述cik细胞是cd3+cd56-细胞。在一些实施方案中,所述cik细胞是cd3-cd56+细胞。在一些实施方案中,所述cik细胞针对肿瘤细胞或者细胞系具有非mhc限制性细胞溶解活性。在一些实施方案中,所述cik细胞具有抗肿瘤活性而不受tcr和mhc相互作用的限制。在一些实施方案中,所述cik细胞是具有不同tcr特异性的效应cd8t细胞,并且可以以非mhc限制性方式溶解肿瘤细胞。在一些实施方案中,cik细胞的mhc非限制性肿瘤杀伤主要基于存在于cik细胞和肿瘤细胞或者细胞系上的各种分子之间的相互作用。
cik细胞可以从具有初始cd4-cd8-表型的cd3+t淋巴细胞产生。cik细胞还可以由外周血单核细胞(即,pbmc)、外周血淋巴细胞(即,pbl)、以及骨髓细胞、脐带血细胞或者能够产生cik细胞的任何细胞类型产生。
用于扩增cik细胞的标准培养条件是本领域普通技术人员容易理解的,例如如lu等所述(anovelpopulationofexpandedhumancd3+cd56+cellsderivedfromtcellswithpotentinvivoantitumoractivityinmicewithseverecombinedimmunodeficiency,j.immunol.,1994,153(4):1687-1696),其需要添加可溶性因子,例如ifn-γ、il-2和抗cd3抗体几天至数周。不受理论的约束,加入ifn-γ以激活单核细胞并提供引起cik细胞的细胞毒性发展的信号。抗cd3抗体用于激活t细胞并提供促有丝分裂信号以诱导t细胞增殖,而il-2的添加随后维持所述t细胞增殖。il-1、il-7和胸腺球蛋白的添加也已显示有利于增加cik细胞的细胞毒性潜力(jiangj等,cytokine-inducedkillercellspromotingantitumorimmunity,j.translationalmed,2013,11:83;zollb等,generationofcytokine-inducedkillercellsusingexogenousinterleukin-2,-7or-12,cancerimmunolimmunother,1998,47(4):221-6)。
在一些实施方案中,同时表达t细胞标志物cd3和自然杀伤(即,nk)细胞标志物cd56(即,cd3+cd56+细胞)的扩增的cik细胞,具有针对肿瘤细胞或细胞系的细胞毒性,也具有初始静息和记忆t细胞的表型。在一些实施方案中,当在用于扩增cik细胞的标准培养条件下培养约21天时,超过90%的扩增细胞为cd3+细胞。在一些实施方案中,cd3+cd56+细胞的百分比在培养几天至数周后还增加。在一些实施方案中,cd3+cd56+cik细胞还共表达cd2、tcrαβ和cd8。在一些实施方案中,cd3+cd56+cik细胞不表达nk细胞的标志物cd16。
在一些实施方案中,cd3+cd56+细胞针对肿瘤细胞和细胞系介导的细胞毒作用不依赖于mhc。在一些实施方案中,cik不介导抗体依赖细胞介导的细胞毒作用(adcc)。在一些实施方案中,在所述培养条件下扩增的cik来源于t细胞而不来自nk细胞。在一些实施方案中,表达cd8t细胞标志物的cik比表达cd4t细胞标志物的cik具有更高的cd56表达水平。在一些实施方案中,cik细胞表达cd45ra、ccr7、cd62l、cd11a、cd27、cd28、巨噬细胞炎性蛋白1a、穿孔素和fas配体。在一些实施方案中,用于cik细胞的标准培养条件产生的cik细胞的异质群体包含具有不同tcr特异性但针对肿瘤细胞或细胞系的非mhc限制性细胞溶解活性的效应cd8t细胞。
在培养扩增后,cik细胞的产生和扩增速率可以从初始批细胞的几倍到几千倍变化。在扩增培养期间添加瞬时的同种异体刺激或者t调节细胞的消耗也可用于产生和扩增cik细胞。在培养扩增结束时,cik细胞通常包含分别具有cd3+cd56+和cd3+cd56-细胞两个主要亚型的cd3+t淋巴细胞的异质群体,。在一些实施方案中,所述cd3+cd56+片段认为是主要负责cik细胞的非mhc限制性抗肿瘤活性。在其他实施方案中,所述cd3+cd56-片段也可以具有非mhc限制性抗肿瘤活性。
在一些实施方案中,cik细胞表达cd8+或者cd4、或两者或非两者。在一些实施方案中,cik细胞主要是cd4-cd8+细胞。在其他实施方案中,cd4+cd8-cik细胞还可以存在于大量培养物中,而cd4+cd8+或者cd4-cd8-cik细胞较不频繁。在一些实施方案中,在cd3+cd56+cik细胞中更多的表现出终末分化的晚期效应物表型(cd45ro+;cd27低;cd28低;cd62l-;ccr7-),而cd3+cd56-的对应物表现出更早的记忆特征。
在一些实施方案中,cik细胞对来自样品的肿瘤细胞系或者新鲜分离的肿瘤细胞具有强效的细胞毒活性,所述样品包括急性髓性白血病、慢性髓性白血病、淋巴瘤、造血癌、肝癌、胃癌、肺癌、神经胶质瘤、结肠直肠癌和肾癌、非小细胞肺癌、肝细胞癌、复发性血液恶性肿瘤、非霍奇金淋巴瘤等。尽管cik细胞对肿瘤细胞或者细胞系显示出显著的特异性,但它们对正常组织或者细胞几乎没有或者没有细胞溶解活性。在一些实施方案中,cik细胞可以用作癌症患者的过继性细胞免疫治疗。
在一些实施方案中,cik细胞的细胞溶解活性不涉及mhc和t细胞受体(即,tcr)间相互作用,因为cik细胞的肿瘤细胞触发的细胞溶解活性不能通过中和mhc和tcr相互作用而阻断,例如抗cd3和抗hla-i类抗体。
在一些实施方案中,双特异性抗体与cik细胞和肿瘤细胞的结合是cik介导的针对肿瘤细胞或者细胞系的细胞毒性所需的。在一些实施方案中,cik细胞表达白细胞功能相关的抗原-1(lfa-1),其可以与由肿瘤细胞或者细胞系表达的配体icam-1、-2和-3结合。cik细胞的lfa-1与icam在肿瘤细胞上的结合可以参与效应物/靶向识别物以及稳定缀合物的形成。在一些实施方案中,抗lfa-1抗体可以抑制cik双特异性抗体肿瘤细胞缀合物的形成以及针对肿瘤细胞的cik细胞的细胞毒性。
在一些实施方案中,cik细胞表达活化nk受体,包括但不限于nkg2d、dnax辅助分子-1(dnam-1)和nkp30。nk受体(例如nkg2d)的配体,例如mica/b和ulbps,通常在肿瘤细胞或者细胞系上表达。在一些实施方案中,nk受体与其配体的连接可以诱导cik细胞的活化,其可以引起针对肿瘤细胞或者细胞系的脱粒和细胞毒作用。在一些实施方案中,通过抗体中和nk受体可以阻断针对肿瘤细胞或细胞系的cik细胞毒性。在一些实施方案中,在cik细胞上表达的nk受体参与cik细胞的tcr非依赖性肿瘤细胞识别和肿瘤细胞的非mhc限制性杀伤。
双特异性抗体结合
在一些实施方案中,所述双特异性抗体包含对肿瘤抗原具有特异性的第一抗原结合部分。在一些实施方案中,肿瘤抗原选自所述组,该组由egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72、cix、psma、结合蛋白、gd2、gd3、gm2、vegf、vegfr、整联蛋白αvβ3、整联蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白组成。
第一抗原结合部分
在一些实施方案中,本公开的双特异性抗体的第一抗原结合部分是任何分子并且对在肿瘤细胞的细胞表面上表达的肿瘤抗原具有特异性。
丰富的肿瘤抗原是本领域已知的并且通过筛选可以容易地鉴定新的肿瘤抗原。肿瘤抗原的非限制性实例包括egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72、cix、psma、叶酸结合蛋白、gd2、gd3、gm2、vegf、vegfr、整联蛋白αvβ3、整联蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白。
在一些实施方案中,与相应的非肿瘤细胞相比,所述第一抗原结合部分对肿瘤细胞上过表达的蛋白质具有特异性。如本文所用,“相应的非肿瘤细胞”是指与肿瘤细胞的起源具有相同细胞类型的非肿瘤细胞。注意,这样的蛋白质不必与肿瘤抗原不同。非限制性实例包括在大多数结肠、直肠、乳腺、肺、胰腺和胃肠道癌中过表达的癌胚抗原(cea);在乳腺、卵巢、结肠、肺、前列腺和子宫颈癌中频繁过表达的调蛋白受体(her-2,neu或c-erbb-2);在包括乳腺、头和颈、非小细胞肺和前列腺的实体瘤的范围内高度表达的表皮生长因子受体(egfr);去唾液酸糖蛋白受体;转铁蛋白受体;在肝细胞上表达的丝氨酸蛋白酶复合物受体;在胰腺导管腺癌细胞上过表达的成纤维细胞生长因子受体(fgfr);用于抗血管生成基因治疗的血管内皮生长因子受体(vegfr);在90%的非粘液性卵巢癌中选择性地过表达的叶酸受体;细胞表面糖萼;碳水化合物受体和聚合免疫球蛋白受体,其可用于向呼吸道上皮细胞的基因递送并且对治疗肺病如囊性纤维化有吸引力。
在一些实施方案中,所述第一抗原结合部分是针对病原体结合部分的多克隆群体的成员。本公开的组合物可以靶向的示例性非限制性病原体可以包括寄生虫、细菌、真菌和病毒病原体。
在一些实施方案中,所述第一抗原结合部分对微生物具有特异性。微生物的非限制性实例包括微生物表面受体和内毒素。内毒素的实例包括但不限于脂多糖(lps)和脂寡糖(los)。
第二抗原结合部分
在一些实施方案中,所述双特异性抗体包含与细胞毒性免疫细胞结合的第二抗原结合部分。在一些实施方案中,所述细胞是细胞因子诱导的杀伤(cik)细胞、t细胞、自然杀伤(nk)细胞、自然杀伤t细胞或者淋巴因子激活的杀伤(lak)细胞。在一些实施方案中,所述第二抗原结合部分与所述细胞因子诱导的杀伤(cik)细胞的细胞表面或者膜蛋白结合。在一些方面,所述蛋白质是cd3或者fc受体。在一些实施方案中,所述第二抗原结合部分与所述细胞的cd3结合。在一些实施方案中,所述第二抗原结合部分与所述细胞的cd56结合。在一些实施方案中,所述双特异性抗体的fc部分与所述细胞的fc受体结合。
在一些实施方案中,第二抗原结合部分是与细胞毒性免疫细胞(例如cik细胞)表面上表达的抗原特异性结合的任何分子。所述第二抗原结合部分对细胞毒性免疫细胞上的抗原是特异性的。示例性细胞毒性免疫细胞包括但不限于cik细胞、t细胞、cd8+t细胞、活化的t细胞、单核细胞、自然杀伤(nk)细胞、nkt细胞、淋巴因子激活的杀伤(lak)细胞、巨噬细胞和树突细胞。所述第二抗原结合部分与细胞毒性免疫细胞表面上表达的抗原特异性结合。适用于本公开的细胞毒性免疫细胞表面表达的示例性非限制性抗原可包括cd2、cd3、cd4、cd5、cd8、cd11a、cd11b、cd14、cd16a、cd27、cd28、cd45、cd45ra、cd56、cd62l、fc受体、lfa、lfa-1、tcrαβ,ccr7、巨噬细胞炎症蛋白1a、穿孔素和fas配体。在一些实施方案中,所述第二抗原结合部分与所述细胞毒性免疫细胞,例如cik细胞结合。在一些实施方案中,所述第二抗原结合部分与cd56结合。在一些实施方案中,所述第二抗原结合部分与lfa-1结合。在一些实施方案中,所述第二抗原结合部分与fc受体结合。在一些实施方案中,所述msbody的fc区与所述细胞毒性免疫细胞,例如cik细胞上的fc受体结合。
一旦鉴定了所述细胞毒性免疫细胞和所述特异性抗原,可以选择特异性msbody用作所述第二抗原结合部分。适合用作第二抗原结合部分的示例性非限制性分子是本领域熟知的,并且可包括抗体、抗体片段、单链可变片段(scfv)和抗体模拟物。适用于本公开的这些抗原结合组分可以使用本领域熟知的方法产生或者购自商业供应商(例如,rdidivisionoffitzgeraldindustriesintl(actonmass.,usa)和ebioscience,(sandiego,calif.usa)、santacruzbiotechnology(santacruz,calif.usa)和abcamintl(cambridge,mass.usa))。在一些实施方案中,例如,所述抗体的修饰过的,以产生抗体片段(例如fab、f(ab')2、scfv)。在一些实施方案中,所述结合部分是非抗体分子,例如抗体模拟物。适用于本公开的非限制性示例性抗体模拟物可包括:anticalins、具有纤连蛋白iii型结构域的多肽、avimers、adnectin以及具有两个或者多个结合结构域的非糖基化单链多肽。
双特异性抗体
本公开的多核苷酸可以在相同的多核苷酸分子上或者在单独的多核苷酸分子上编码抗原结合多肽、变体或其衍生物的整个重链和轻链可变区。另外,本公开的多核苷酸可以在相同的多核苷酸分子上或者在单独的多核苷酸分子上编码抗原结合多肽、变体或其衍生物的重链和轻链可变区的部分。
本公开的一个实施方案提供了包含两个不同的抗原结合多肽单元的异二聚体抗体。在一些实施方案中,所述异源二聚体与其相应的同源二聚体在大小上不同,并且所述大小差异可以用于促进异源和同源二聚体的分离。
在一些实施方案中,所述两个抗原结合多肽单元之一包含轻链-重链对,如野生型抗体。贯穿本公开,该单元还称为“单价单元”。在一些方面,另一个抗原结合多肽单元包含单链可变片段(scfv)。这样的scfv可以与抗体的恒定片段(fc)融合。贯穿本公开,该融合肽还称为“单链单元”。
本公开证明这样的不对称抗体是稳定的并且保持高的抗原结合率。这是出人意料的,因为已经证明即使在生理条件下单链抗体的同源二聚体也是不稳定的。例如ahma等,“scfvantibody:principlesandclinicalapplication”,clinicalanddevelopmentalimmunology,2012:980250(2012),证明基于scfv的igg样抗体是不稳定的并且需要进一步工程化以减少聚集并提高稳定性。
此外,由于不对称性,异源二聚体与包含任一个所述抗原结合多肽单元的同源二聚体具有不同的分子量。基于所述异源二聚体和同源二聚体之间的分子量差异,可以容易地从所述同源二聚体中分离出所需的异源二聚体。
容易地从同源二聚体中分离异源二聚体的能力对于制备双特异性抗体是特别有利的,其中所述两个抗原结合多肽中的任一个对不同的表位具有特异性。这是因为两种类型的同源二聚体(即包含单价单元的同源二聚体或者包含单链单元的同源二聚体)都不具有由所述异源二聚体提供的所需的双特异性。
在一个实施方案中,这种双特异性抗体对肿瘤抗原具有特异性并对cik细胞具有特异性,其使表达肿瘤抗原的肿瘤细胞接近cik细胞,导致通过cik细胞的抗肿瘤细胞毒性消除肿瘤细胞。在另一个实施方案中,这样的双特异性抗体仅对肿瘤抗原具有特异性而对cik细胞不具有特异性,然而,所述双特异性抗体的fc区可以与所述cik细胞的fc受体结合,其进而使表达肿瘤抗原的肿瘤细胞接近所述cik细胞,导致通过cik细胞的抗肿瘤细胞毒性消除肿瘤细胞。
在一些实施方案中,所述单价单元对肿瘤抗原具有特异性,并且所述单链单元对cik细胞具有特异性。具有这种排列特异性的不对称双特异性抗体还称为“单价单链双特异性抗体”或者“msbody”。相反,其中所述单价单元对cik细胞具有特异性并且所述单链单元对肿瘤抗原具有特异性的不对称双特异性抗体称为“smbody”。另一种双特异性抗体具有两个单链单元,其中一个对肿瘤抗原具有特异性并且另一个对cik细胞具有特异性,称为“ssbody”。
因此,在一个实施方案中,提供了一种抗体,其包含:(a)对肿瘤抗原具有特异性的轻链-重链对和(b)包含单链可变片段(scfv)和包含ch2结构域和ch3结构域的fc片段的融合肽,其中所述融合肽对cik细胞具有特异性。
上述任何抗体或者多肽可以进一步包括另外的多肽,例如指导编码多肽分泌的信号肽、如本文所述的抗体恒定区或者如本文所述的其他异源多肽。
本领域普通技术人员还将理解,本文公开的抗体可以是修饰的,使得它们在氨基酸序列上不同于衍生自天然存在的结合多肽。例如,衍生自指定蛋白的多肽或者氨基酸序列可以是相似的,例如与起始序列具有一定百分比同一性,如其可以是与起始序列60%、70%、75%、80%、85%、90%、95%、98%或者99%的同一性。
此外,可进行导致在“非必需”氨基酸区域保守取代或者改变的核苷酸或者氨基酸取代、缺失或者插入。例如,除了一个或多个个别氨基酸取代、插入或者缺失,例如一个、两个、三个、四个、五个、六个、七个、八个、九个、十个、十五个、二十个或更多个个别氨基酸取代、插入或者缺失,衍生自指定蛋白的多肽或氨基酸序列可以与起始序列相同。在某些实施方案中,衍生自指定蛋白的多肽或者氨基酸序列相对于起始序列具有1至5个、1至10个、1至15个或者1至20个单个氨基酸取代、插入或者缺失。
在某些实施方案中,抗原结合多肽包含氨基酸序列或者一个或多个通常与抗体不相关的部分。示例性修饰在下面更详细地描述。例如,本公开的单链fv抗体片段可以包含柔性接头序列,或者可以被修饰以添加功能部分(例如peg、药物、毒素或者标记)。
本公开的抗体、变体或者其衍生物包括修饰的衍生物,即通过将任何类型的分子共价连接至所述抗体,这样的共价连接不阻止所述抗体与所述表位结合。所述抗体可以是修饰的,例如但不限制性方式:如通过糖基化、乙酰化、聚乙二醇化、磷酸化、磷酸化、酰胺化、通过已知的保护/封闭基团的衍生化、蛋白水解切割、与细胞配体或者其它蛋白质的连接等。通过已知技术可以进行任何多种化学修饰,包括但不限于特异性化学切割、乙酰化、甲酰化、衣霉素的代谢合成等。另外,所述抗体可以含有一个或者多个非经典氨基酸。
在其他实施方案中,本公开的抗原结合多肽可以包含保守氨基酸取代。“保守氨基酸取代”是一种具有相似侧链的氨基酸残基取代所述氨基酸残基的取代。本领域已经定义具有相似侧链的氨基酸残基家族包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,免疫球蛋白多肽中的非必需氨基酸残基优选地被来自相同侧链家族的另一个氨基酸残基替换。在另一个实施方案中,氨基酸链可以用侧链家族成员中次序和/或组成不同但结构相似的链替换。
在一些实施方案中,所述抗体可以与治疗剂、前药、肽、蛋白质、酶、病毒、脂质、生物反应修饰剂、药物试剂或peg缀合。
所述抗体可以与治疗剂缀合或者融合,该治疗剂可以包括可检测标记(例如放射性标记)、免疫调节剂、激素、酶、寡核苷酸、光活性治疗剂或者诊断剂、可以是药物或者毒素的细胞毒性剂、超声增强剂,非放射性标记,其组合以及本领域已知的其他此类试剂。
所述抗体可以通过与化学发光化合物偶联进行可检测标记。然后通过检测化学反应过程中出现的发光的存在来确定化学发光标记的抗原结合多肽的存在。特别有用的化学发光标记化合物的实例是鲁米诺、异鲁米诺、芳族吖啶酯、咪唑、吖啶鎓盐和草酸酯。
所述抗体还可以使用荧光发射金属如152eu或者其它镧系元素进行可检测标记。这些金属可以使用如二亚乙基三胺五乙酸(dtpa)或者乙二胺四乙酸(edta)的金属螯合基团附着到所述抗体上。将多种部分与抗体缀合的技术是熟知的,例如参见arnon等,“monoclonalantibodiesforimmunotargetingofdrugsincancertherapy”,inmonoclonalantibodiesandcancertherapy;reisfeld等,(eds.),pp.243-56(alanr.liss,inc.(1985);hellstrom等,“antibodiesfordrugdelivery”,incontrolleddrugdelivery(2nded.);robinson等,(eds.),marceldekker,inc.,pp.623-53(1987);thorpe,“antibodycarriersofcytotoxicagentsincancertherapy:areview”,inmonoclonalantibodies'84:biologicalandclinicalapplications,pincheraetal.(eds.),pp.475-506(1985);“analysis,results,andfutureprospectiveofthetherapeuticuseofradiolabeledantibodyincancertherapy”,inmonoclonalantibodiesforcancerdetectionandtherapy;baldwin等,(eds.),academicpresspp.303-16(1985)和thorpe等,“thepreparationandcytotoxicpropertiesofantibody-toxinconjugates”,immunol.rev.(52:119-58(1982))。
制备方法
在一些实施方案中,本公开提供了制备一种组合物的方法,所述组合物包含双特异性抗体(msbody)和细胞毒性免疫细胞。
质粒pcho1.0-herceptinhl-kkw和pcho1.0-hygro-l2k-ldy用于表达her2×cd3msbody,并且质粒pcho1.0-抗ep-camhl-kkw和pcho1.0-hygro-l2k-ldy用于表达ep-cam×cd3(l2k)msbody。根据制造商的说明书,用maxcytestx(maxcyte)转染cho-s细胞,并在37℃、含5%(体积/体积)co2的潮湿培养箱中以135rpm培养14天。通过4500×g离心收获上清液并用0.22μm滤膜灭菌。基于制造商的手册,通过蛋白a亲和层析(rproteinaff;gehealthcare)、fabaffinitykbp琼脂糖高流动树脂(5ml体积,acrobiosystems公司)和sp阳离子交换层析柱提纯抗体。使用ym-30kd超滤膜替换pbs缓冲洗脱液蛋白质。通过在280nm处的uv吸光度测定纯化的igg的浓度(计算每种蛋白质的特异性诱导系数)。
用ficoll-histopaque(histopaque-1077,sigma)分离外周血单核细胞(pbmc)。第1天,在含1000iu/mlifn-γ和2%自血清的基础离体培养基中培养cik细胞。第2天,将2.5ng/ml抗人cd3ε,25iu/mlil-2,0.02ng/mlil-1α加入该培养基中。除非另有说明,否则cik细胞在离体混合物中刺激14天。
制备抗体的方法是本领域熟知的并且已在本文中描述。在某些实施方案中,本公开的抗原结合多肽的可变区和恒定区均是完全人的。完全人抗体可以使用本领域描述的和本文描述的技术制备。例如,针对特异性抗原的完全人抗体可以通过将所述抗原施用于转基因动物来制备,该转基因动物已经过修饰以产生响应于抗原攻击的抗体,但其内源基因座已经失能。可用于制备此类抗体的示例性技术描述于美国专利nos:6,150,584、6,458,592、6,420,140,其整体通过引用并入本文。
在某些实施方案中,所述制备的抗体不会在待治疗动物(例如人)中引起有害的免疫应答。在一个实施方案中,使用本领域公认的技术修饰本公开的抗原结合多肽、变体或者其衍生物以降低它们的免疫原性。例如,抗体可以是人源化的、灵长类化的、去免疫的或者可以制备的嵌合抗体。这些类型的抗体衍生自保留或者基本上保留亲本抗体的抗原结合特性但在人类中具有较低的免疫原性非人抗体,通常为鼠或者灵长类抗体。这可以通过多种方法实现,包括(a)将整个非人可变结构域接枝到人恒定区以产生嵌合抗体;(b)将一个或多个非人互补决定区(cdr)的至少一部分接枝到人框架和具有或者不具有关键框架残基保留的恒定区;或者(c)移植所述整个非人可变结构域,但通过表面残基替换,用人样区段“隐藏”它们。这些方法公开于morrison等,proc.natl.acad.sci.usa57:6851-6855(1984);morrison等,adv.immunol.44:65-92(1988);verhoeyen等,science239:1534-1536(1988);padlan,molec.immun.25:489-498(1991);padlan,molec.immun.31:169-217(1994)及美国专利nos:5,585,089、5,693,761、5,693,762和6,190,370,其整体通过引用并入本文。
去免疫还可以用于降低抗体的免疫原性。如本文所用,术语“去免疫”包括改变抗体以修饰t细胞表位(例如参见国际申请公开nos:wo/9852976a1和wo/0034317a2)。例如,分析来自起始抗体的可变重链和可变轻链序列以及来自每个v区的人类t细胞表位“图谱”显示:创建与互补决定区(cdr)和其他关键残基在序列上相关的表位的位置。分析来自所述t细胞表位图谱的单个t细胞表位,以鉴定具有改变终抗体活性的低风险的替代性氨基酸取代。设计一系列包含氨基酸取代的组合的可变重链和可变轻链序列并且这些序列随后并入一系列结合多肽中。通常,产生12至24个变体抗体并测试其结合和/或功能。然后将包含修饰的可变区和人恒定区的完整的重链和轻链基因克隆到表达载体中,并且随后将该质粒导入细胞系以产生完整抗体。然后在合适的生物化学和生物测定中比较该抗体,并且鉴定最佳变体。
本公开的抗原结合多肽的结合特异性可以通过体外测定法,例如免疫沉淀、放射免疫测定(ria)或酶联免疫吸附测定(elisa)来确定。
或者,描述用于生产单链单元的技术(美国专利no:4,694,778;bird,science242:423-442(1988);huston等,proc.natl.acad.sci.usa55:5879-5883(1988)以及ward等,nature334:544-554(1989))可适于产生本公开的单链单元。通过氨基酸桥连接重链和轻链片段的fv区形成单链单元,产生单链融合肽。还可以使用在大肠杆菌中组装功能性fv片段的技术(skerra等,science242:1038-1041(1988))。
可用于产生单链fvs(scfvs)和抗体的技术实例包括那些描述于:美国专利nos:4,946,778和5,258,498;huston等,methodsinenzymology203:46-88(1991);shu等,proc.natl.sci.usa90:1995-1999(1993)和skerra等,science240:1038-1040(1988)。对于一些用途,包括人体内抗体的体内使用和体外检测测定,可优选使用嵌合抗体、人源化抗体或者人抗体。嵌合抗体是其中抗体的不同部分衍生自不同动物物种的分子,例如具有衍生自鼠单克隆抗体的可变区和人免疫球蛋白恒定区的抗体。用于产生嵌合抗体的方法是本领域已知的。例如参见,morrison,science229:1202(1985);oi等,biotechniques4:214(1986);gillies等,j.immunol.methods125:191-202(1989);美国专利nos:5,807,715、4,816,567和4,816397,其整体通过引用并入本文。
人源化抗体是来源于非人物种抗体的抗体分子,其与具有来自非人物种的一个或多个互补决定区(cdr)和来自人免疫球蛋白分子的框架区所需的抗原结合。通常,来自cdr供体抗体的相应残基将取代人框架区中的框架残基以改变、优选改善抗原结合性。这些框架取代通过本领域熟知的方法鉴定,例如通过模拟cdr和框架残基间的相互作用以鉴定对抗原结合重要的框架残基和通过序列比较以鉴定在特定位置不寻常的框架残基。(例如参见,queen等,美国专利no:5,585,089;riechmann等,nature332:323(1988),其整体通过引用并入本文。)抗体可以使用本领域已知的多种技术来人源化,例如cdr移植(ep239,400;pct公布:wo91/09967;美国专利nos:5,225,539、5,530,101和5,585,089)、镶饰或表面重修(ep592,106;ep519,596;padlan,molecularimmunology28(4/5):489-498(1991);studnicka等,proteinengineering7(6):805-814(1994);roguska.等,proc.natl.sci.usa91:969-973(1994))和链改组(美国专利no:5,565,332,其整体通过引用并入本文)。
完全人抗体特别适用于人类患者的治疗性治疗。人抗体可以通过本领域已知的多种方法制备,包括使用来源于人免疫球蛋白序列的抗体文库的噬菌体展示方法。也参见美国专利nos:4,444,887和4,716,111和pct公开:wo98/46645、wo98/50433、wo98/24893、wo98/16654、wo96/34096、wo96/33735和wo91/10741,其各自全部内容通过引用并入本文。
还可以使用不能表达功能性内源免疫球蛋白但可表达人免疫球蛋白基因的转基因小鼠产生人抗体。例如人重链和轻链免疫球蛋白基因复合物可以随机引入或通过同源重组引入小鼠胚胎干细胞。或者,除了人重链和轻链基因外,可以将人可变区/恒定区和多样性区引入小鼠胚胎干细胞。小鼠重链和轻链免疫球蛋白基因可以与通过同源重组引入的人免疫球蛋白基因座分开或者同时呈现非功能性。特别地,jh区的纯合缺失防止内源性抗体的产生。扩增所述修饰的胚胎干细胞并且显微注射到胚泡中以产生嵌合体小鼠。然后将所述嵌合小鼠繁殖以产生表达人抗体的纯合后代。以正常方式用选定的抗原(例如所需目标多肽的所有或者一部分)免疫转基因小鼠。针对抗原的单克隆抗体可以使用常规杂交瘤技术从免疫的、转基因的小鼠获得。由所述转基因小鼠携带的人免疫球蛋白转基因在b细胞分化期间重排,并且随后经历类别转换和体细胞突变。因此,使用这种技术产生治疗上有用的igg,iga,igm和ige抗体是可能的。关于这种用于产生人抗体的技术的概述,参见lonbergandhuszarint.rev.immunol.73:65-93(1995)。关于这种用于产生人抗体和人单克隆抗体的技术的详细讨论和用于产生此类抗体的方案,例如参见,pct公开:wo98/24893、wo96/34096、wo96/33735;美国专利nos:5,413,923、5,625,126、5,633,425、5,569,825、5,661,016、5,545,806、5,814,318和5,939,598,其整体通过引用并入本文。此外,可以使用诸如abgenix,inc.(freemont,calif.)和genpharm(sanjose,calif.)公司来提供针对选定抗原的人抗体,所述人抗体使用与上述技术类似的技术。
识别选定表位的完全人抗体还可以使用称为“引导选择”(guidedselection)的技术产生。在该方法中,使用选定的非人单克隆抗体(例如,小鼠抗体)来指导完全人类抗体识别相同表位的选择性。(jespersetal.,bio/technology72:899-903(1988)。还参见美国专利no:5,565,332,其整体通过引用并入本文)。
在另一个实施方案中,使用常规程序(例如通过使用能够特异性结合编码鼠抗体的重链和轻链的基因的寡核苷酸探针)可以容易地分离和测序编码所需单克隆抗体的dna。所述分离的和亚克隆的杂交瘤细胞作为这种dna的优选来源。一旦分离,该dna可以置于表达载体中,然后将其转染到原核或者真核宿主细胞中,例如不另外产生免疫球蛋白的大肠杆菌细胞、猿cos细胞、中国仓鼠卵巢(cho)细胞或者骨髓瘤细胞。更具体地,所述分离的dna(其可以如本文所述合成)可用于克隆用于制造抗体的恒定区和可变区的序列,如newman等,1995年1月25日提交的美国专利no:5,658,570中描述,其通过引用并入本文。基本上,这需要从选定的细胞中提取rna,转化为cdna,并且使用ig特异性引物通过pcr来扩增。适用于该目的的引物还描述于美国专利no:5,658,570。如下面更详细讨论的,表达所需抗体的转化细胞可相对大量生长以提供免疫球蛋白的临床和商业供应。
另外,使用常规重组dna技术,本公开的抗原结合多肽的一个或者多个cdr可以插入框架区内,例如插入人框架区中以人源化非人抗体。所述框架区可以是天然存在的或者共有框架区,并且优选人框架区(例如参见,chothia等,j.mol.biol.278:457-479(1998),关于人框架区的列表)。优选地,通过框架区和cdr的组合产生的多核苷酸编码与所需多肽(例如light)的至少一个表位特异性结合的抗体。优选地,可以在框架区内进行一个或者多个氨基酸取代,并且优选地,所述氨基酸取代增强了抗体与其抗原的结合。另外,此类方法可用于使参与链内二硫键的一个或多个可变区半胱氨酸残基发生氨基酸取代或者缺失,以产生缺乏一个或者多个链内二硫键的抗体分子。所述多核苷酸的其他改变包括在本公开内容和本领域技术范围内。
此外,可使用通过剪接来自具有适当抗原特异性的小鼠抗体分子的基因以及来自具有适当生物学活性的人抗体分子的基因来开发用于产生“嵌合抗体”的技术(morrison等,proc.natl.acad.sci.usa:851-855(1984);neuberger等,nature372:604-608(1984);takeda等,nature314:452-454(1985))。如本文所用,嵌合抗体是其中不同部分衍生自不同动物物种的分子,例如具有衍生自鼠单克隆抗体的可变区和人免疫球蛋白恒定区的那些。
另一种用于产生重组抗体的高效方法由newman,biotechnology10:1455-1460(1992)公开。具体地,该技术导致包含猴可变结构域和人恒定序列的灵长类化抗体的产生。该参考文献其整体通过引用并入本文。此外,该技术还描述于共同转让的美国专利nos:5,658,570、5,693,780和5,756,096,其各自通过引用并入本文。
或者,可以使用本领域技术人员熟知的技术选择和培养产生抗体的细胞系。这样的技术描述于各种实验室手册和主要出版物中。在这方面,currentprotocolsinimmunology,coligan等,eds.,greenpublishingassociatesandwiley-interscience,johnwileyandsons,newyork(1991)中描述了适用于本公开如下所述的技术,其整体包括补充通过引用并入本文。
另外,本领域技术人员已知的标准技术可用于在编码本公开的抗体的核苷酸序列中引入突变,包括但不限于定点诱变和pcr介导的导致氨基酸取代的诱变。优选地,相对于参考的可变重链区cdr-h1、cdr-h2、cdr-h3和可变轻链区cdr-l1、cdr-l2或者cdr-l3,所述变体(包括衍生物)编码少于50个氨基酸取代、少于40个氨基酸取代、少于30个氨基酸取代、少于25个氨基酸取代、少于20个氨基酸取代、少于15个氨基酸取代、少于10个氨基酸取代、少于5个氨基酸取代、少于4个氨基酸取代、少于3个氨基酸取代或者少于2个氨基酸取代。或者,可以沿着编码序列的全部或部分随机引入突变,例如通过饱和诱变,并且可以筛选所得突变体的生物活性以鉴定保留活性的突变体。
在一些实施方案中,抗体模拟物用作抗原结合部分。抗体模拟物使用非免疫球蛋白蛋白支架作为抗体可变区的替代蛋白质框架。如本文所定义,抗体模拟物是包含适于特异性或随机序列变异的一个或者多个区域(即,环区域)的多肽,使得所述抗体模拟物与目的抗原特异性结合(例如在细胞毒性免疫细胞表面上表达的抗原,例如cd2、cd3、cd4、cd5、cd8、cd11b、cd14、cd16a、cd45、cd56)。非限制性示例性抗体模拟物可以包括基于脂笼蛋白(lipocalins)的anticalins并且描述于weissandlowman,chembiol.,7(8):177-184(2000);skerra,j.biotechnol.74(4):257-275和wo99/16873;具有纤连蛋白iii型结构域和至少一个随机化环的多肽描述于例如wo01/64942和美国专利no:6,818,418;具有p-夹心结构的多肽描述于wo00/60070;以及由两个或者更多个单体结构域组成的非糖基化单链多肽,其可以分别结合包括通过接头连接的蛋白质的任何类型的靶分子,描述于美国申请系列nos:10/133,128和10/871,602。
在美国申请系列nos.10/133,128和no.10/871,602中描述的具有非糖基化单链多肽的单体结构域的抗体模拟物与抗体的互补决定区(cdr)不同。与抗体不同,所述抗体模拟多肽能够独立折叠、形成热稳定性的稳定结构。例如,所述多肽在95℃下稳定至少10分钟,而结合亲和力没有明显的损失。所述单体结构域的其他特征包括低免疫原性、低毒性、足以穿透皮肤或其它组织的小尺寸以及一系列体内半衰期和稳定性。
可以产生针对由本文所述的第二抗原结合部分结合的抗原的抗体模拟物。例如,可以使用本领域已知的方法分析与细胞毒性免疫细胞表面上的抗原结合的抗体,例如抗体-抗原相互作用的三维晶体结构分析,以鉴定对抗原结合至关重要的特异性残基。一旦鉴定了这些残基,可对所述抗体模拟物的环区进行定点诱变,使得该环形成所述第二抗原结合部分的结合口袋。这样的修饰描述于例如,vogtandskerra,chembiochem.5(2):191-9(2004)。
lipovsek等(美国专利nos.6,818,418和7,115,396)公开了特征为纤连蛋白或者纤连蛋白样支架和至少一个可变环的抗体模拟物,称为adnectin。这些基于纤连蛋白的抗体模拟物显示出许多天然或工程抗体的相同的期望特征,包括对靶向配体的高亲和力和特异性。此外,这些基于纤连蛋白的抗体模拟物相对于抗体和抗体片段显示出某些益处。例如,这些抗体模拟物因天然的可折叠性和稳定性而不依赖于二硫键,并且因此在通常会分解抗体的条件下是稳定的。
beste等(proc.natl.acad.sci.u.s.a.(1999)96(5):1898-1903)公开了基于脂笼蛋白支架(anticalintm)的抗体模拟物。脂笼蛋白由在蛋白质的末端具有四个高变环的β-桶组成。beste等对所述环进行随机诱变并且选择与,例如荧光素结合。三个变体显示与荧光素的特异性结合,以及一个变体显示出与抗荧光素抗体的结合相似性。进一步的分析显示:所有的随机位置是可变的,这表明anticalintm将适合用作抗体的替代物。anticalintm是通常长度为160至180个残基的小的单链多肽,这提供了若干个优于抗体的优点,包括降低生产成本、提高储存期间的稳定性和降低免疫反应。
hamilton等(美国专利no:5,770,380)公开了合成的抗体模拟物,该模拟物使用杯芳烃的刚性、非肽有机支架连接多个可变肽环作为结合位点。所述肽环相对于彼此几乎从杯所述芳烃的同一侧突出。由于这种几何确认,所有所述环都可用于结合从而增加与配体的结合亲和力。然而,与其他抗体模拟物相比,所述基于杯芳烃的抗体模拟物不仅仅由多肽组成,并因此不易受到蛋白酶的攻击,并且在极端环境条件下相对稳定和具有长的寿命。此外,由于所述抗体模拟物的相对小的尺寸,其不太可能产生免疫原性应答。
murali等(cell.mol.biol.(2003)49(2):209-216)公开了将抗体还原成更小的肽模拟物的方法,称为“抗体样结合肽模拟物”,其还可以用作具有本公开的抗体的替代物。silverman等(nat.biotechnol.(2005)23:1556-1561)公开了融合蛋白,其是包含称为“avimers”的多个结构域的单链多肽。通过体外外显子改组和噬菌体展示从人细胞外受体结构域发育,所述avimer是一类结合蛋白,对于靶分子,其亲和性和特异性与抗体有些相似。与单个表位结合蛋白相比,这些所得的多结构域蛋白可以表现出增强的亲和力(在一些情况下亚纳摩尔(sub-nm))和特异性。关于avimers的构建和使用的其他细节可发现于美国专利公开nos.2004/0175756、2005/0048512、2005/0053973、2005/0089932和2005/0221384。
除了非免疫球蛋白框架外,在包含rna分子和非天然寡聚体(例如蛋白酶抑制剂、苯并二氮杂类、嘌呤衍生物和bb-转角模拟物)的化合物中也已经模拟了抗体性质,作为抗原结合部分,所有这些化合物都适用于本发明。
治疗方法
如本文所述,本公开提供了治疗包括癌症患者的患者的方法,通过:从所述患者获得外周血淋巴细胞(pbl)样品;用抗cd3抗体,ifn-γ和il-2孵育所述pbl以获得cik细胞;用双特异性抗体武装cik细胞,其中每个双特异性抗体包含对肿瘤抗原具有抗原结合特异性的第一抗原结合部分和与所述cik细胞结合的第二抗原结合部分,并且施用所述具有结合的双特异性抗体武装的cik细胞到有需要的患者。本公开的所述抗原结合多肽、变体或者衍生物可以用于与癌症或者传染病相关的某些治疗和诊断方法中。
本公开进一步涉及基于msbody和基于细胞的疗法,其涉及向患者(例如动物、哺乳动物和人)施用本公开的所述双特异性抗体和所述细胞毒性免疫细胞的所述组合物,用于治疗一种或多种本文所述的病症或者疾病。本公开的治疗性化合物,包括但不限于本公开的抗体(包括如本文所述的变体及其衍生物)和编码本公开的抗体(包括如本文所述的变体及其衍生物)的核酸或者多核苷酸。
本公开的所述双特异性抗体和所述细胞毒性免疫细胞的所述组合物还可以用于治疗、抑制或者预防包括恶性疾病、紊乱或与这样的疾病或紊乱相关的症状,例如与增加的细胞存活或者细胞凋亡的抑制相关的疾病,例如癌症(例如滤泡淋巴瘤,具有p53突变的癌症和激素依赖性肿瘤包括但不限于结肠癌、心脏肿瘤、胰腺癌、黑素瘤、成视网膜细胞、成胶质细胞瘤、肺癌、肠癌、睾丸癌、胃癌、成神经细胞瘤、粘液瘤,肌瘤、淋巴瘤、内皮瘤、成骨细胞瘤、破骨细胞瘤、骨肉瘤、软骨肉瘤,腺瘤、乳腺癌、前列腺癌、卡波西肉瘤和卵巢癌);自身免疫性疾病(例如多发性硬化、斯耶格伦综合征、格雷夫斯病、桥本甲状腺炎、自身免疫性糖尿病、胆汁性肝硬化、贝切特病、克罗恩病、多发性肌炎、系统性红斑狼疮和免疫相关性肾小球肾炎、自身免疫性胃炎、自身免疫性血小板减少性紫癜和类风湿关节炎)和病毒感染(例如疱疹病毒、痘病毒和腺病毒);炎症;移植物抗宿主病(急性和/或慢性);急性移植排斥和慢性移植排斥。本公开的抗原结合多肽、变体或其衍生物用于抑制癌症的生长、进展和/或转移,特别是上文或下文段落中列出的那些。
可以用本公开的所述抗体或者变体或者其衍生物治疗、预防、诊断和/或预后的与增加的细胞存活相关的其它疾病或症状,包括但不限于恶性肿瘤的进展和/或转移和相关病症,例如白血病(包括急性白血病(例如急性淋巴细胞性白血病、急性骨髓性白血病(包括成髓细胞、早幼粒细胞、骨髓单核细胞、单核细胞和红白血病))和慢性白血病(例如慢性骨髓性);真性红细胞增多症;淋巴瘤(例如霍奇金病和非霍奇金病);多发性骨髓瘤;瓦尔登斯特伦氏巨球蛋白血症;重链病和实体瘤,包括但不限于肉瘤和癌如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝细胞瘤、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、wilm's肿瘤、宫颈癌、睾丸肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突胶质细胞瘤、肾母细胞瘤、黑素瘤、成神经细胞瘤和视网膜母细胞瘤。
本公开的所述抗体还可以用于通过靶向微生物和免疫细胞以实现微生物的消除来治疗由微生物引起的感染性疾病或者杀死微生物。在一个方面,所述微生物是包括rna和dna病毒的病毒、革兰氏阳性细菌、革兰氏阴性细菌、原生动物或者真菌。
本公开的所述组合物可以用于通过用所述双特异性抗体武装激活的细胞毒性免疫细胞(例如cik细胞)来治疗感染病原体的患者的方法。当施用于患者时,所述武装的细胞毒性免疫细胞将靶向并消除病原体感染的细胞。示例性的细胞毒性免疫细胞包括但不限于cik细胞、t细胞、cd8+t细胞、活化的t细胞、单核细胞、nk细胞、nkt细胞、lak细胞、巨噬细胞和树突细胞。可以用本公开的组合物治疗的非限制性示例性病原体感染包括病毒、细菌、真菌和寄生病原体。
在一些实施方案中,所述病原体是病毒。可以用本公开的所述组合物治疗的示例性非限制性病毒感染,包括巨细胞病毒(cmv)、eb病毒(ebv)、i型单纯疱疹病毒(hsv-1)、ii型单纯疱疹病毒(hsv-ii)、bk病毒(bkv)、甲型肝炎病毒(hsv-a)、乙型肝炎病毒(hsv-b)、丙型肝炎病毒(hsv-c)、流感病毒、水痘、腺病毒、牛瘟、鼻病毒、艾柯病毒、轮状病毒、呼吸道合胞病毒、乳头瘤病毒、乳多泡病毒、疱疹病毒、虫媒病毒、汉坦病毒、柯萨基病毒、腮腺炎病毒、麻疹病毒、风疹病毒、脊髓灰质炎病毒、i型人免疫缺陷病毒(hiv-1)和ii型人类免疫缺陷病毒、任何小核糖核酸病毒、肠道病毒、杯状病毒科病毒、诺沃克病毒组的任何病毒、披膜病毒、例如登革热病毒、甲病毒、黄病毒、冠状病毒、狂犬病病毒、马尔堡病毒、埃博拉病毒、副流感病毒、正粘病毒、布尼亚病毒、沙粒病毒、呼肠孤病毒、轮状病毒、疱疹病毒、人t细胞白血病病毒i型、人t细胞白血病病毒ii型、猴免疫缺陷病毒、慢病毒、多瘤病毒、细小病毒、人类疱疹病毒-6、cercophehebine疱疹病毒1(b病毒)和痘病毒。
可以通过使用本公开的所述组合物治疗或者预防的细菌性疾病或病症,包括但不限于由分枝杆菌立克次氏体、支原体、奈瑟氏菌属(例如脑膜炎奈瑟氏球菌和淋病奈瑟氏球菌)、军团菌、霍乱弧菌、链球菌、例如肺炎链球菌、白喉棒状杆菌、破伤风杆菌、百日咳杆菌、嗜血杆菌(例如流感嗜血杆菌)、衣原体属、肠毒性大肠杆菌和炭疽芽孢杆菌(炭疽)引起的那些。
可以通过使用本公开的所述组合物治疗或预防的真菌疾病或病症,包括但不限于卡氏肺孢子虫或者曲霉菌。
可以通过使用本公开的所述组合物治疗或预防的原生动物疾病或病症,包括但不限于疟原虫、艾美球虫、利什曼原虫和锥虫。
任何特定患者的具体剂量和治疗方案将取决于多种因素,包括所用的特定抗原结合多肽、变体或其衍生物、所述患者的年龄、体重、一般健康状况、性别和饮食,以及施用时间、排泄速率、药物组合以及所治疗的特定疾病的严重性。医疗护理人员对这些因素的判断在本领域的普通技术范围内。该量还将取决于待治疗的个体患者、施用途径、制剂类型、所使用的化合物的特性、疾病的严重性和期望的效果。使用的量可以通过本领域公知的药理学和药代动力学原理确定。
施用本公开的所述双特异性抗体和所述细胞毒性免疫细胞的所述组合物的方法,包括但不限于真皮内、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。所述组合物可以通过任何方便的途径施用,例如通过输注或者弹丸注射、通过上皮或者粘膜皮肤内层(例如口腔粘膜、直肠和肠粘膜等)的吸收并且可以与其它生物活性剂一起施用。因此,本公开的所述组合物可以口服、直肠、胃肠外、脑池内、阴道内、腹膜内、局部(如通过粉末、软膏、滴剂或透皮贴剂)、口腔、或口服或鼻腔喷雾施用。
如本文所用,术语“肠胃外”是指包括静脉内、肌内、腹膜内、胸骨内、皮下和关节内注射和输注的给药模式。
给药可以是全身或者局部的。此外,可能需要通过任何合适的途径将本公开的所述组合物引入中枢神经系统,包括心室内和鞘内注射;心室内注射可以通过例如连接到储器(例如ommaya储器)的心室内导管来促进。还可以使用肺部给药,例如通过使用吸入器或者雾化器以及具有雾化剂的制剂。
可能需要将本公开的所述组合物局部施用于需要治疗的区域,这可以通过例如但不限于手术期间的局部输注、局部施用(例如与手术后的伤口敷料结合)、通过注射、通过导管、通过栓剂的方式实现,或者通过植入物,所述植入物是多孔、无孔或凝胶状材料,包括膜,例如硅橡胶膜或纤维。优选地,当施用本公开的蛋白质(包括抗体)时,必须谨慎使用蛋白质不吸收的材料。
在另一个实施方案中,本公开的所述双特异性抗体和所述细胞毒性免疫细胞的所述组合物可以在囊泡,特别是脂质体中递送(参见langer,1990,science249:1527-1533;treat等,inliposomesinthetherapyofinfectiousdiseaseandcancer,lopez-beresteinandfidler(eds.),liss,newyork,pp.353-365(1989);lopez-berestein,ibid.,pp.317-327;参见同上)。
在另一个实施方案中,本公开的所述组合物可以在控释系统中递送。在一个实施方案中,可以使用泵(参见sefton,1987,crccrit.ref.biomed.eng.14:201;buchwald等,1980,surgery88:507;saudek等,1989,n.engl.j.med.321:574)。在另一个实施方案中,可以使用聚合物材料(参见medicalapplicationsofcontrolledrelease,langerandwise(eds.),crcpres.,bocaraton,fla.(1974);controlleddrugbioavailability,drugproductdesignandperformance,smolenandball(eds.),wiley,newyork(1984);rangerandpeppas,j.,1983,macromol.sci.rev.macromol.chem.23:61;还参见levyetal.,1985,science228:190;during等,1989,ann.neurol.25:351;howard等,1989,j.neurosurg.71:105)。在另一个实施方案中,控释系统可以放置在治疗靶(即脑)附近,因此仅需要全身剂量的一部分(参见例如goodson,inmedicalapplicationsofcontrolledrelease,supra,vol.2,pp.115-138(1984))。其他控释系统在langer的综述(1990,science249:1527-1533)中讨论。
可以通过标准临床技术确定在治疗、抑制和预防炎性、免疫或恶性疾病、病症或症状中有效的本公开的所述双特异性抗体和所述细胞毒性免疫细胞的组合物的量。此外,可以任选地使用体外测定以帮助鉴定最佳剂量范围。在制剂中使用的精确剂量还将取决于施用途径和疾病、病症或症状的严重性,并且应当根据从业者的判断和每个患者的情况来决定。有效剂量可以从源于体外或动物模型测试系统的剂量-反应曲线推测。
用于治疗感染性或恶性疾病、症状或病症的方法包括施用本公开的所述双特异性抗体和所述细胞毒性免疫细胞的组合物,通常在可接受的动物模型中测试,用于所需的治疗或者预防活性,然后用于人类。合适的动物模型包括转基因动物,是本领域普通技术人员熟知的。例如,证明本文所述的抗原结合多肽的治疗效用的体外测定法包括抗原结合多肽对细胞系或患者组织样品的作用。所述抗原结合多肽对细胞系和/或组织样品的作用可以使用本领域技术人员已知的技术(例如本文别处公开的测定法)来测定。根据本公开,可用于确定是否指示施用特异性抗原结合多肽的体外测定包括体外细胞培养测定,其中患者组织样品在培养物中生长,并暴露于或以其它方式施用化合物,并且观察这种化合物对组织样品的影响。
在另一个实施方案中,本公开的所述组合物与抗肿瘤剂、抗病毒剂、抗细菌剂或者抗生素剂或者抗真菌剂组合施用。本领域已知的任何这些试剂可以在本公开的所述组合物中施用。
在另一个实施方案中,本公开的组合物与化疗剂组合施用。可以与本公开的所述组合物一起施用的化疗剂包括但不限于抗生素衍生物(例如多柔比星、博来霉素、柔红霉素和更生霉素);抗雌激素(例如他莫昔芬);抗代谢药(例如氟尿嘧啶、5-fu、甲氨蝶呤、氟尿苷、干扰素α-2b、谷氨酸、普卡霉素、巯嘌呤和6-硫鸟嘌呤);细胞毒素剂(例如卡莫司汀、bcnu、洛莫司汀、ccnu、阿糖胞苷、环磷酰胺、雌莫司汀、羟基脲、丙卡巴肼、丝裂霉素、白消安、顺铂和硫酸长春新碱);激素(例如甲羟孕酮、雌莫司汀磷酸钠、乙炔雌二醇、雌二醇、醋酸甲地孕酮、甲基睾酮、己烯雌酚二磷酸酯,氯苯亚甲基和睾内酯);氮芥衍生物(例如美法仑、苯丁酸氮芥,氮芥(氮芥)和噻替派);类固醇和组合(例如倍他米松磷酸钠)和其他(例如二碳嗪、天冬酰胺酶、米托坦、硫酸长春新碱、硫酸长春碱和依托泊苷)。
在另一个实施方案中,本公开的所述组合物与细胞因子组合施用。可以与本公开的所述组合物一起施用的细胞因子,包括但不限于il-2、il-3、il-4、il-5、il-6、il-7、il-10、il-12、il-13、il-15、抗-cd40、cd40l和tnf。
在另外的实施方案中,本公开的所述组合物与其它治疗或预防方案(例如放射疗法)组合施用。
组合物
本公开还提供药物组合物。这样的组合物包含有效量的双特异性抗体(例如msbody)、cik细胞和可接受的载体。在具体实施方案中,术语“药学上可接受的”是指由联邦或者州政府的管理机构批准的或在美国药典或其它公认的药典中列出的用于动物,更特别是用于人的。此外,“药学上可接受的载体”通常是任何类型的无毒固体、半固体或者液体填充剂、稀释剂、包封材料或者制剂助剂。
分离细胞毒性免疫细胞
根据本公开,治疗患有肿瘤或者感染病原体的患者的一个步骤是需要分离细胞毒性免疫细胞。在一些实施方案中,从包含可用双特异性抗体的多克隆群体武装的外周血单核细胞(即pbmc)或者外周血淋巴细胞(即pbl)的血液样品中分离所述细胞毒性免疫细胞。在一些实施方案中,所述血液样品获自自体供体。在一些实施方案中,所述血液样品获自同系供体。在其它实施方案中,所述血液样品获自同种异体供体或者同种异体供体池。
一旦获得所述血液样品,将用双特异性抗体武装所述细胞毒性免疫细胞。从pbmc或者pml中分开和分离特定细胞类型的方法是本领域熟知的。细胞分离的合适方法包括使用percolltm梯度或者ficoll-hypaque的密度梯度离心。可以进一步纯化细胞或者可以使用本领域熟知的阳性/阴性选择技术选择细胞亚群,例如使用负磁性免疫粘附,其使用针对存在于阴性选择的细胞上的细胞表面标记物的单克隆抗体的混合物。根据抗体的选择,可以使用该方法正向选择所需的细胞。在一些实施方案中,使用荧光激活细胞分选(即facs)分离所需细胞群体。细胞分开和分离的其他方法是本领域技术人员熟知的。在一些实施方案中,洗涤所述分离的细胞毒性免疫细胞,并在合适的培养基中冷冻保存以备将来使用。
在一些实施方案中,所述细胞毒性免疫细胞可能需要在用双特异性抗体武装前被激活(例如t细胞)并且离体扩增。在离体或者体外活化和扩增细胞毒性免疫细胞的方法是本领域熟知的。下面描述了适用于本公开的产生和扩增cik细胞和激活t细胞的方法。
产生和扩增cik细胞
cik细胞的产生和扩增是本领域普通技术人员熟知的,例如如lu等所述(anovelpopulationofexpandedhumancd3+cd56+cellsderivedfromtcellswithpotentinvivoantitumoractivityinmicewithseverecombinedimmunodeficiency,j.immunol,1994,153(4):1687-1696),其需要几天至几周(例如21天)定时加入可溶性因子,例如ifn-γ、il-2和抗cd3抗体。
在一些实施方案中,所述抗cd3抗体是可从ortho-biotech(raritan,n.j.)获得的okt3(莫罗单抗-cd3)或者可从bristol-meyerssquibb获得的单克隆抗体g19-4。适用于本公开的离体激活t细胞的另外的抗体是本领域技术人员熟知的。
il-1,il-7和胸腺球蛋白的添加也已显示有利于增加cik细胞的细胞毒性潜力(jiangj等,cytokine-inducedkillercellspromoteantitumorimmunity,j.translationalmed,2013,11:83;zollb等,generationofcytokine-inducedkillercellsusingexogenousinterleukin-2,-7or-12,cancerimmunolimmunother,1998,47(4):221-6)。在一些实施方案中,将所述扩增的cik细胞用10%胎牛血清和10%dmso翅片液氮冷冻保存,然后根据需要用于双特异性抗体武装的来解冻。
激活t细胞
在一些实施方案中,分离的t细胞通过用可溶性或者固定化的抗cd3抗体离体激活,描述于美国专利no:6,352,694和美国专利no:2003/0185823。然后在不存在外源性生长因子或者辅助细胞的情况下,通过用低剂量的il-2或il-7和il-15离体培养扩增所述分离的细胞。参见美国专利no:2003/0185823。
可以通过与固定在固体/不溶性支持物(1-5μg/ml)上的可溶性抗cd3抗体(约10-20ng/ml)或者抗cd3抗体离体接触来激活t细胞。在一些实施方案中,所述抗cd3抗体是可从ortho-biotech(raritan,n.j.)获得的okt3(莫罗单抗-cd3)或者可从bristol-meyerssquibb获得的单克隆抗体g19-4。适用于本公开的离体激活t细胞的另外的抗体是本领域技术人员熟知的。
在一些实施方案中,通过用抗cd3抗体和抗cd28抗体共刺激t细胞进行其激活。适用于本发明的抗cd28抗体是murm9.3(abbott-biotech)。适用于本发明的另外的抗cd28抗体将是本领域技术人员熟知的并且可以从许多商业来源购买,包括rdidivisionoffitzgeraldindustriesintl.(actonmass.usa)和ebioscience(sandiegocalif.usa)。在一些实施方案中,使用与共固定在固体支持物上的具有1:1化学计量的抗cd3抗体(例如okt3)和抗cd28抗体(例如murm9.3)的共刺激来激活t细胞。
在通过用抗cd3刺激或者用抗cd3和抗cd28共刺激激活t细胞后,该细胞在低剂量il-2(10iu/ml至约500iu/ml)存在下扩增约14天。在一些实施方案中,所述细胞在低剂量il-7(25-100ng/ml),任选在il-15(25-100ng/ml)存在下扩增。所述细胞可以在il-2、il-7和/或il-15的任何组合,以及起到扩增活化的t细胞作用的重组细胞因子和非天然存在的重组细胞因子中扩增。例如,il-2可以单独使用,或者与il-7和/或il-15组合使用。类似地,il-7可以单独使用,或者与il-2和/或il-15组合使用。技术人员将理解,活化的t细胞可以在多种条件下扩增(参见例如fernandez-botran,advancedmethodsincellularimmunology(crcpress2000)。重组il-2(proleukinil-2)可以从chiron(emeryville,calif.)购买。il-7和il-15可以从prospec-tanytechnogeneltd.(rehovotisrael)购买。适用于本发明的白介素的其它来源是本领域技术人员熟知的。在一些实施方案中,将所述活化的和扩增的t细胞用10%胎牛血清和10%dmso翅片液氮冷冻保存,然后根据需要用于双特异性抗体武装的来解冻。
用双特异性抗体武装cik细胞
本文公开的所述组合物和方法提供对患有肿瘤或癌症或感染病原体的患者的令人惊讶的有效治疗,因为武装所述细胞毒性免疫细胞以实现理想的治疗效果所需的双特异性抗体的浓度低。此外,本公开的所述双特异性抗体能够使所述细胞毒性免疫细胞接近肿瘤细胞或感染的细胞以使所述细胞毒性免疫细胞裂解肿瘤或感染的细胞。
在一些实施方案中,为了实现相同的期望效果,武装所述细胞毒性免疫细胞所需的双特异性抗体的浓度比本领域中其他组合物至少低一个数量级。在一些实施方案中,用每106个细胞毒性免疫细胞0.001ng至100ng的所述双特异性抗体(例如msbody)的量武装所述细胞(例如cik)。在一些实施方案中,用每106个细胞0.01ng至10ng的所述双特异性抗体的量武装所述细胞。在一些实施方案中,用每106个细胞0.1至1ng的所述双特异性抗体的量武装所述细胞。在一些实施方案中,用每106个细胞1ng的所述双特异性抗体的量武装所述细胞。在一些实施方案中,用于武装所述细胞毒性免疫细胞的所述双特异性抗体的浓度为100ng、50ng、40ng、30ng、20ng、15ng、10ng、5ng、4ng、3ng、2ng、1ng、0.5ng、0.1ng、0.05ng,0.01ng、0.005ng和0.001ng每106个细胞毒性免疫细胞。
在一些实施方案中,用0.001nm至1000nm的所述双特异性抗体(例如msbody)武装所述cik细胞以形成武装活化cik细胞(acc)。在一些实施方案中,用0.01nm至100nm的所述双特异性抗体(例如msbody)武装所述cik细胞以形成acc。在一些实施方案中,用0.1nm至100nm的所述双特异性抗体(例如msbody)武装所述cik细胞以形成acc。在一些实施方案中,用1nm至100nm的所述双特异性抗体(例如msbody)武装所述cik细胞以形成acc。在一些实施方案中,用10nm至100nm的所述双特异性抗体(例如msbody)武装所述cik细胞以形成acc。在一些实施方案中,用50nm至100nm的所述双特异性抗体(例如msbody)武装所述cik细胞以形成acc。在一些实施方案中,用于形成acc的所述双特异性抗体的浓度为1000nm、100nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、1nm、0.01nm和0.001nm。
所述细胞毒性免疫细胞(例如cik细胞)的武装可以使用本领域已知的任何合适的方法进行。在一些实施方案中,例如,可以洗涤所述细胞并在理想的浓度重重悬浮,然后与特定浓度的双特异性抗体一起孵育。经过一段时间合适的孵育,所述双特异性抗体可与所述细胞毒性免疫细胞(例如cik细胞)结合,洗涤该细胞以除去任何未结合的结合分子。在一些实施方案中,将所述武装的细胞毒性免疫细胞储存在液氮中以备将来使用。参见,uberti等,clin.immunol.andimmunopath.(1994);ueda等,transplantation(1993)。在一些实施方案中,将所述武装的细胞毒性免疫细胞以理想的浓度重悬于合适的培养基中并施用于有需要的患者。
在一些实施方案中,根据常规程序用药物载体配制所述组合物。术语“载体”是指与治疗剂一起施用的稀释剂、佐剂、赋形剂或缓冲剂。这样的药物载体可以是无菌液体例如水和油,包括石油;动物;植物或合成来源的,例如花生油、大豆油、矿物油、芝麻油等。当静脉内施用所述药物组合物时,水是优选的载体。盐溶液和葡萄糖水溶液和甘油溶液也可以用作液体载体,特别是用于可注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂乳、甘油、丙二醇等。如果需要,所述组合物还可以含有少量的润湿剂或乳化剂,或ph缓冲剂例如乙酸盐、柠檬酸盐或磷酸盐。抗菌剂如苄醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂如乙二胺四乙酸;还设想用于调节张力的试剂,例如氯化钠或葡萄糖。这些组合物可以采取溶液、悬浮液、乳液、片剂、丸剂、胶囊、粉末、持续释放制剂等形式。所述组合物可以使用传统的粘合剂和载体例如甘油三酯配制成栓剂。口服制剂可以包括标准载体例如药物级甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药物载体的实例描述于e.w.martin的remington'spharmaceuticalsciences中,其通过引用并入本文。这样的组合物将含有一定治疗有效量的、优选以纯化形式的抗原结合多肽,与合适量的载体一起,以提供用于对患者适当施用的形式。制剂应适合施用方式。亲本制剂可以包封在安瓿、一次性注射器或由玻璃或塑料制成的多剂量小瓶中。
在一些实施方案中,根据常规方法将所述组合物配制为适合于静脉内施用于人的药物组合物。通常,用于静脉内施用的组合物是在无菌等渗水性缓冲液中的溶液。如果需要,所述组合物还可以包括增溶剂和局部麻醉剂例如利多卡因,以减轻注射部位的疼痛。一般地,该成分以单位剂量形式单独或混合在一起供应,例如作为干燥的冻干粉末或无水浓缩物在密封容器例如指示活性剂的量的安瓿或小袋中。当所述组合物通过输注施用时,其可以用含有无菌药物级水或盐水的输注瓶分配。当所述组合物通过注射施用时,可以提供含注射用无菌水或盐水的安瓿,以便可以在施用之前混合成分。
药学上可接受的盐包括与阴离子如衍生自盐酸、磷酸、乙酸、草酸、酒石酸等的阴离子形成的盐,以及与阳离子形成的盐,例如衍生自钠、钾、铵、钙、氢氧化铁、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等。
在一些实施方案中,本公开提供了包含所述组合物和使用说明书的试剂盒。
实施例
应当理解,虽然已经结合上述实施例描述了本公开,但是前面的描述和示例旨在说明而不是限制本公开的范围。在本公开的范围内的其他方面、优点和修改对于本公开所属领域的技术人员将是显而易见的。
本公开不限于所描述的具体实施方案的范围,其旨在作为本公开的各个方面的单一说明,并且功能上等同的任何组合物或方法在本公开的范围内。对本领域技术人员显而易见的是,在不脱离本公开的精神或范围的情况下,可以对本公开的方法和组合物进行各种修改和改变。因此,本公开旨在覆盖本公开的修改和变化,只要它们落入所附权利要求及其等同物的范围内。
本说明书中提及的所有出版物和专利申请通过引用并入本文,其程度如同每个单独的出版物或专利申请被具体和单独地指示通过引用并入。
实施例1.制备msbody
1.1构建表达载体
选择pcho1.0作为克隆赫赛汀重链和轻链的表达载体。选择pcho1.0-潮霉素,并用潮霉素标志物替换puriycin标志物作为表达载体构建l2k的单链抗体。如表1所示设计的引物与根据如表2所示的lc、hc、scfv-fc、migk前导序列的基因序列和载体的多克隆位点有适当的重叠。在之前的实验中(参见pct/cn2012/08498,其整体通过引用并入本文)合成基因模板并亚克隆于pcdna3.1中。使用重叠pcr、用高保真dna聚合酶扩增片段lc、hc、scfv-fc。vl、cl、vh和ch1的pcr扩增条件包括在95℃下孵育5分钟、随后是在95℃下退化30秒的25个循环、在56℃下退火30秒、在72℃下延伸1分钟、在72℃闭合延伸3分钟。图2描绘了显示pcr产物的琼脂糖凝胶。
表1.pcr引物序列
通过avrii/bstz17i或ecorv/paci的限制性消化制备线性化载体,通过琼脂糖凝胶电泳来确认消化并通过nanodroptm仪器或其它方法测定浓度。将所述片段和线性化载体加入gibson
表2msbody的多肽和核酸序列
l2k-scfv单链融合肽(seqidno:1)
qvqlqqsgaelarpgasvkmsckasgytftrytmhwvkqrpgqglewigy
inpsrgytnynqkfkdkatlttdkssstaymqlssltsedsavyycaryy
ddhycldywgqgttltvssggggsggggsggggsqivltqspaimsaspg
ekvtmtcsasssvsymnwyqqksgtspkrwiydtsklasgvpahfrgsgs
gtsysltisgmeaedaatyycqqwssnpftfgsgtkleinrgaaaepksc
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshed
pevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeyk
ckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvk
gfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqg
nvfscsvmhealhnhytqkslslspgk
l2k-scfv单链融合肽核酸序列(seqidno:2)
caggtgcagctggtgcagagcggcggcggcgtcgtgcagccgggcaggtc
cctgagactgtcttgtaaggcttctggatacaccttcactagatacacaa
tgcactgggtcagacaggctcctggaaagggactcgagtggattggatac
attaatcctagcagaggttatactaactacaatcagaagtttaaggacag
attcacaatttctactgacaaatctaagagtacagccttcctgcagatgg
actcactcagacctgaggataccggagtctatttttgtgctagatattac
gatgaccactactgtctggactactggggccaaggtaccccggtcaccgt
gagctcaggaggcggcggttcaggcggaggtggaagtggtggaggaggtt
ctgatattcagatgacccagagcccgtcaagcttatctgcttctgtcgga
gacagagtcacaatcacatgttctgcttctagctctgtctcttacatgaa
ctggtatcagcagacacctggaaaggctcctaagcggtggatctacgaca
catctaagctcgcttctggagtcccttctagattctctggttctggctct
ggaacagactacacattcacaatctcttctctccaacctgaggacatcgc
tacatactactgccaacagtggtctagcaatcctttcacattcggacagg
gtaccaaactgcagatcacaagaggtgcggccgcagagcccaaatcttgt
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctgggggg
accgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatct
cccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagac
cctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgc
caagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtca
gcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaag
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctc
caaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccat
cccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaa
ggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagcc
ggagaacaactacaagaccacgcctcccgtgctggactccgacggctcct
tcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg
aacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacac
gcagaagagcctctccctgtctccgggtaaatga
单价单元的赫赛汀重链(seqidno:3)
evqlvesggglvqpggslrlscaasgfnikdtyihwvrqapgkglewvar
iyptngytryadsvkgrftisadtskntaylqmnslraedtavyycsrwg
gdgfyamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvk
dyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqt
yicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkp
kdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyn
styrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepq
vytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppv
ldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
单价单元的赫赛汀重链,核酸序列(seqidno:4)
gaagtgcagctggtggaaagcggcggcggcctggtgcagccgggcggatc
cctgcgcctgagctgcgcggcgagcggctttaacattaaagatacctata
ttcattgggtgcgccaggcgccgggcaaaggcctggaatgggtggcgcgc
atttatccgaccaacggctatacccgctatgcggatagcgtgaaaggccg
ctttaccattagcgcggataccagcaaaaacaccgcgtatctgcagatga
acagcctgcgcgcggaagataccgcggtgtattattgcagccgctggggc
ggcgatggcttttatgcgatggattattggggccagggcaccctggtgac
cgtgagctcagcctccaccaagggcccatcggtcttccccctggcaccct
cctccaagagcacctctgggggcacagcggccctgggctgcctggtcaag
gactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgac
cagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctact
ccctcagcagcgtggtgaccgtgccctccagcagcttgggcacccagacc
tacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaa
agttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccag
cacctgaactcctggggggaccgtcagtcttcctcttccccccaaaaccc
aaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggt
ggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacg
gcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaac
agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggct
gaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagccc
ccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacag
gtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcag
cctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagt
gggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg
ctggactccgacggctccttcttcctctacagcaagctcaccgtggacaa
gagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgagg
ctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaa
tga
单价单元的赫赛汀轻链(seqidno:5)
diqmtqspsslsasvgdrvtitcrasqdvntavawyqqkpgkapklliys
asflysgvpsrfsgsrsgtdftltisslqpedfatyycqqhyttpptfgq
gtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkv
dnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqg
lsspvtksfnrgec
单价单元的赫赛汀轻链,核酸(seqidno:6)
gatattcagatgacccagagcccgtcaagcttaagcgcgagcgtgggcga
tcgcgtgaccattacctgccgcgcgagccaggatgtgaacaccgcggtgg
cgtggtatcagcagaaaccgggcaaagcgccgaaactgctgatttatagc
gcgagctttctgtatagcggcgtgccgagccgctttagcggcagccgcag
cggcaccgattttaccctgaccattagcagcctgcagccggaagattttg
cgacctattattgccagcagcattataccaccccgccgacctttggccag
ggtaccaaagtggaaattaaacgaactgtggctgcaccatctgtcttcat
cttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgt
gcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtg
gataacgccctccaatcgggtaactcccaggagagtgtcacagagcagga
cagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaag
cagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggc
ctgagctcgcccgtcacaaagagcttcaacaggggagagtgttag
单价单元的ep-cam重链(seqidno:7)
evqlleqsgaelvrpgtsvkisckasgyaftnywlgwvkqrpghglewigdifpgsgnihynekfkgkatltadkssstaymqlssltfedsavyfcarlrnwdepmdywgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvslwclvkgfypsdiavewesngqpennydttppvldsdgsfflysdltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
单价单元的ep-cam重链,核酸(seqidno:8)
gaggtgcagctgctcgagcagtctggagctgagctggtaaggcctgggacttcagtgaagatatcctgcaaggcttctggatacgccttcactaactactggctaggttgggtaaagcagaggcctggacatggacttgagtggattggagatattttccctggaagtggtaatatccactacaatgagaagttcaagggcaaagccacactgactgcagacaaatcttcgagcacagcctatatgcagctcagtagcctgacatttgaggactctgctgtctatttctgtgcaagactgaggaactgggacgagcctatggactactggggccaagggaccacggtcaccgtctcctccgcgtcgaccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtctacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacgataccacgcctcccgtgctggactccgacggctccttcttcctctacagcgatctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga
单价单元的赫赛汀轻链(seqidno:9)
elvmtqspssltvtagekvtmsckssqsllnsgnqknyltwyqqkpgqppklliywastresgvpdrftgsgsgtdftltissvqaedlavyycqndysypltfgagtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
单价单元的赫赛汀轻链,核酸(seqidno:10)
gagctcgtgatgacacagtctccatcctccctgactgtgacagcaggagagaaggtcactatgagctgcaagtccagtcagagtctgttaaacagtggaaatcaaaagaactacttgacctggtaccagcagaaaccagggcagcctcctaaactgttgatctactgggcatccactagggaatctggggtccctgatcgcttcacaggcagtggatctggaacagatttcactctcaccatcagcagtgtgcaggctgaagacctggcagtttattactgtcagaatgattatagttatccgctcacgttcggtgctgggaccaagcttgagatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgttag
1.2表达和纯化
根据手册,用endofreeplasmidgigakit(qiagen,12391)制备用于瞬时转染的质粒。使用质粒pcho1.0-赫赛汀hl-kkw和pcho1.0-潮霉素-l2kscfv-fc-ldy表达her2×cd3msbody。使用质粒pcho1.0-抗-ep-camhl-kkw和pcho1.0-潮霉素-l2kscfv-fc-ldy表达ep-camxcd3msbody。根据制造商的说明书,用maxcytestx(maxcyte)转染cho-s细胞。将转染的cho-s细胞在37℃、5%(vol/vol)co2潮湿培养箱中以135rpm培养14天。通过2000*g离心收获上清液并用0.22μm滤膜灭菌。通过蛋白a亲和层析(rproteinaff;gehealthcare),fabaffinitykbpagarosehighflowresin(acrobiosystems公司,5ml体积)和sp阳离子交换层析柱(gehealthcare,10ml)纯化抗体。使用ym-30kd超滤膜、用pbs缓冲液代替蛋白质的洗脱。通过在280nm处的uv吸光度测定纯化的igg的浓度(计算每种蛋白质的特异性诱导系数)。
通过sds/page分析纯化的蛋白质(图3.a和b),分子量为约125kd。通过高性能尺寸排阻色谱法(hp-sec)测试批次的igg并显示为至少95%单体(图3.c和d),在体内使用的批次的内毒素水平为<1.1内毒素单位/mgigg。
1.3msbody的结合活性分析
使用sk-br-3和jurkat细胞测试her2×cd3msbody的cd3与her2的结合能力。收集3×105sk-br-3或jurkat细胞并与50μlpbs或160nm的赫赛汀或msbody的两倍系列稀释液一起孵育。约30分钟后,用1%fbs/pbs洗涤细胞两次,然后与2.5μlpe标记的抗人iggfc混合。将混合物在室温下孵育30分钟,再次用1%fbs/pbs洗涤细胞。然后在facs设备上对样品进行检查。如图4a所示,赫赛汀(黑色虚线)和her2×cd3msbody(黑色实线)都与乳腺癌细胞sk-br-3结合。该结果表明msbody可以有效地结合表达her2的癌细胞。收集jurkat细胞,并与50μlpbs或160nml2k单克隆抗体或msbody的两倍系列稀释液一起孵育。由双特异性配体(黑色实线)结合的jurkat细胞的丰度与l2k的(黑色虚线)一样高(图4b)。
收集3×105sw480或jurkat细胞以测试ep-cam×cd3msbody的结合活性。如图5a所示,抗ep-cam单克隆抗体(黑色虚线)和ep-cam×cd3msbody(黑色实线)都与结肠癌细胞sw480结合。如图5b所示,l2k单克隆抗体(黑色虚线)和ep-cam×cd3msbody(黑色实线)都与jurkat细胞结合。
实施例2.cik细胞培养以及细胞与细胞缔合测定
收集来自健康供体的血液以分离外周血单核细胞(pbmc)和自身血清。所述血液在700g、室温下离心20分钟,收集上清液作为自血清,其余的是血沉棕黄层。通过ficoll-histopaque(来自sigma的histopaque-1077)从血沉棕黄层中分离pbmc。第1天,在含750iu/mlifn-γ和2%自血清的基础离体培养基中培养cik细胞,第2天,将2.5ng/ml抗人cd3ε、25iu/mlil-2、0.02ng/mlil-1α加入该培养基中。除非另有说明,否则cik细胞在离体混合物中刺激生长14天。计数细胞并保持在1×106个细胞/ml。通过台盼蓝排除法(trypanblueexclusion)测定细胞的存活力。cik细胞与fitcmouseanti-humancd45(bd,bd555482)、ucht1peanti-humancd3(biolengend,300408)和cd56((pe/cy7anti-humancd56,biolegend318318)孵育(“武装”)。使用流式细胞术测量细胞表型,并将其定量为与fl2相比,fl1的右上象限中阳性细胞的百分比。总群体具有43.0%cd3和cd56双阳性(图6),其是具有高杀伤效率的nkt细胞组。
对于msbody分子介导的共结合测定,用celltracecfse(sigma)标记sk-br-3细胞(her2阳性)。通过细胞膜标记试剂盒(sigma)用pkh26标记cik细胞(cd3阳性)。将细胞(3×105个细胞/ml)重悬于pbs中,并在不同量的msbody分子存在下以1:1的比例在室温下混合30分钟。通过流式细胞术测量共结合并且定量为与fl2相比,fl1的右上象限中阳性细胞的百分比,代表cfse和pkh26双阳性群体(图7),约27.5%的细胞是由msbody共结合的。
实施例3.her2×cd3武装激活的cik细胞(acc)
在该实例中的msbody武装激活的cik细胞在图8中示出。收集3×105个cik细胞并与50μlpbs或者100nmmsbody的两倍系列稀释液一起孵育。约30分钟后,用1%fbs/pbs洗涤细胞两次,然后与2.5μlpe标记的抗人iggfc混合。将混合物在室温下孵育30分钟,再次用1%fbs/pbs洗涤细胞。然后在facs设备上对样品进行检查。
首先用5μmcfse对sk-br-3细胞(靶细胞)染色,然后以2×104个细胞/孔(100μl)接种在96孔中,然后用her2×cd3msbody武装活化的cik细胞或在第2天将来自100nm的2倍系列稀释浓度(效应细胞:e-t=5:1)的阴性对照higg和100ulacc(1×106acc/ml)加入靶细胞。24小时后收集细胞,用1ug/mlpi染色,然后用流式细胞术(fc500,beckmancoulter)计数。体外研究表明,her2×cd3msbody武装的acc在0.01-1.25ug/1×106个细胞的浓度下可以充分地裂解乳腺癌细胞。图9显示了通过由her2×cd3武装的acc介导的用于sk-br-3靶标的特异性细胞毒性的概述。
实施例4.her2×cd3和ep-cam×cd3acc的细胞毒性
使用sk-br-3细胞作为靶细胞,对于her2×cd3msbody、赫赛汀和l2k,以人igg作为对照,测量抗体诱导的细胞毒性。首先用5μmcfse对sk-br-3细胞(靶细胞)染色,然后以2×104个细胞/孔接种在96孔中,然后在第2天加入培养的cik(效应细胞:e-t=5:1)。同时,将等浓度的赫赛汀、l2k、msbody和人igg加入到细胞培养物中。24小时后收集细胞并用1ug/mlpi染色,然后用流式细胞术(fc500,beckmancoulter)计数。如果用cfse和pi双重染色则计为死细胞。细胞死亡率的测量为死细胞与总细胞的比率。细胞毒性计算为测量的细胞死亡率和自然细胞死亡率之间的差异。结果示于图10,其中与赫赛汀和l2k相比,msbody具有最高的细胞毒性。
通过使用人cik细胞作为效应细胞和ep-cam阳性人癌细胞系sw480作为靶细胞的流式细胞术测量重定向的细胞毒性。在14天的刺激生长后,通过在250grt下离心收集cik细胞。然后将细胞重悬于rpmi-1640完全培养基中并调节至4×106个细胞/ml。根据制造商的说明书(sigma-aldrich)用cfse染料对靶细胞染色。将等体积的靶标和效应细胞悬浮液混合并将150μl该悬浮液转移到96孔板的每个孔中。加入50μlep-cam×cd3系列稀释液或rpmi完全培养基(阴性对照)。除非另有说明,将板在37℃、5%co2加湿培养箱中孵育24小时或48小时。24小时或48小时后收集细胞,并用piat、以1ug/ml的终浓度染色,然后在facsfc500仪器(beckman,德国)上通过流式细胞术分析样品。靶细胞裂解确定为由cfse和pi染色呈阳性的细胞的百分比。所有样品重复进行。通过整合到graphpadprismversion5.0(graphpadsoftware,sandiego,ca)中的四级参数非线性拟合模型进行细胞毒性测定的数据分析。结果示于图8。
实施例5.采用转移异种移植肿瘤模型
动物,六(6)至八(8)周龄的nod-scid小鼠(nod.cb17-prkdcscid/ncr)获自beijinghfkbioscienceco.ltd并且容纳在湖北省食品药品安全评价中心中央实验室的屏障单元中。将5×106个nci-n87细胞、以终体积为0.1ml/小鼠注射到小鼠右胁腹中。在第1、3、6、9天通过静脉内注射武装活化cik。在研究期间,取出肝素化的血液样品用于测定抗体血浆水平,其在预期范围内。每3天测量肿瘤体积并由数字卡尺测量值计算为1/2×长度×宽度2(mm3)。结果表明武装的cik细胞抑制肿瘤生长(图11)。
实施例6.sw480人结肠癌异种移植模型
人异种移植模型中的所有动物实验在来自beijinghfkbioscienceco.ltd的nod/scid小鼠中进行。将小鼠保持在无菌和标准化环境条件下(室温20±1℃、相对湿度50±10%、12小时光:12小时暗节律)。他们接受高压灭菌的食物和床上用品并随意使用酸化(ph4.0)的饮用水。对它们进行渗漏测试并且仅使用igg水平低于100ng/ml的小鼠。将5×106个培养的cik细胞与5×106sw480结肠癌细胞混合,得到约1:1的有效e:t比。将cik和sw480混合物,以终体积为0.1ml/小鼠的量皮下注射到右胁腹中。一组动物仅注射sw480细胞以评估由cik效应细胞诱导的非特异性效应。对于最小残留疾病模型中的治疗组,在指示剂量为0.01、0.1、1mg/小鼠下、经sw480/cik接种1小时后,用msbody双特异性抗体(epcam×cd3)或缓冲剂(pbs)静脉内处理每组的6只动物,并在12天内重复处理4次。在建立的肿瘤模型中,当皮下生长肿瘤达到50-200mm3时,在第0天(阳性对照)和sw480接种后的第8天处理每组的8只动物并且处理重复2次。在指定日期用测径器以两个垂直维度测量肿瘤尺寸,并根据1/2×长度×宽度2(以mm3计)作为功效的相关性计算肿瘤体积。
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。
本文示例性描述的本发明可以在不存在本文未具体公开的任何一个或多个元件,一个或多个限制的情况下适当地实施。因此,例如,术语“包含”,“包括”,“含有”等应当被广泛地且无限制地理解。另外,本文中采用的术语和表达已经用作描述性而不是限制性术语,并且在使用这些术语和表达时并不意在排除所示和所描述的特征或其部分的任何等效物,而是认识到在本发明所要求保护的范围内,各种修改是可能的。
因此,应当理解,本文提供的材料、方法和实施例是优选实施方案的代表、是示例性的,并且不意图作为对本发明范围的限制。
本文已广泛且一般性地描述了本发明。一般公开内容中的每个较窄种类和亚类群也形成本发明的一部分。这包括本发明的一般性描述,不管所排除的材料是否在本文中具体描述,该描述具有从属中移除任何主题的附带条件或否定限制。
此外,本发明的特征或方面是根据马库什组描述的,本领域技术人员将认识到,本发明也因此根据马库什组的任何单个成员或亚组成员描述。
本文提及的所有出版物、专利申请、专利和其他参考文献的整体通过引用明确地并入本文,其程度如同通过引用单独地并入本文。在冲突的情况下,本说明书(包括定义)将控制。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺