槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷在制药中的用途的制作方法
本发明属于制药领域,涉及槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷新的制药用途,具体涉及槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷(ZYZ-772)在脂质代谢调节中的应用,尤其是在制备防治脂质代谢相关疾病的药物中的用途。
背景技术:
据文献报道,心血管疾病是目前造成世界死亡率的重要因素之一,2002年,世界卫生组织(WHO)的一份报告指出全球约50%的残疾及死亡是由心脏疾病或中风引起的,研究显示,心血管疾病主要致病因素之一是脂质代谢紊乱,因而,调节脂质代谢,降低血脂水平,对于预防及治疗心血管疾病具有重要现实意义。
花椒属芸香科植物,在中国《药性论》和《别录》这两部经典著作中记载了花椒有破血、去老血通脉的功能;现代药理研究发现,从花椒里提取出的挥发油具有抗血栓、降血脂、降血压的作用;有研究报道,花椒挥发油能改善豚鼠肝脏胆固醇和脂蛋白代谢,减轻肝脏脂肪样改变,减少脂质(TC和TG)在肝脏组织和主动脉壁中的沉积,有良好的抗动脉粥样硬化的作用。
迄今为止,有关对花椒中降脂调节物质少有研究报道。
本申请的发明人基于现有技术的现状,拟提供花椒中分离得到的主要化合物(简称ZYZ-772)在脂质调节方面的作用及进一步用于制备调节脂质代谢药物中的用途。
技术实现要素:
本发明的目的是提供花椒提取物化合物(简称ZYZ-772)的药物新用途,具体涉及花椒提取物化合物槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷(ZYZ-772)在脂质代谢调节中的应用,尤其是在制备防治脂质代谢相关疾病的药物中的用途。
本发明涉及的花椒提取物化合物槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷(ZYZ-772)的结构如下式所示:
本发明采用所述的化合物槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷(ZYZ-772)进行了体内和体外实验,结果显示所述化合物的脂质代谢调节作用,其作用效果优于其母核结构槲皮素;所述化合物能调节血脂水平,减少脂质在肝脏的聚集,对脂肪肝具有保护作用,尤其是通过增加低密度脂蛋白受体(LDLR)的活性,以及促进胆固醇调节元件结合蛋白-2(SREBP-2)的表达进行脂质调节,对脂质代谢具有明显的调节作用:
通过apoE基因敲除小鼠喂予高脂饲料,建立高脂动物模型观察化合物ZYZ-772的在体脂质调节活性;通过生化试剂、组织切片染色以及western-blotting的方法,检测动物血清中总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)、甘油三酯(TG)、谷丙转氨酶以及谷草转氨酶的水平,观察肝组织的HE及油红染色,同时检测肝组织中蛋白SREBP-2、LDLR、前蛋白转化酶枯草溶菌素9(PCSK9)、ATP-结合盒转运子G5/G8(ABCG5/ABCG8)的表达;结果表明,所述化合物ZYZ-772对血脂水平有良好的调节作用,对脂肪肝有很好的保护作用;
通过胆固醇与25-羟胆固醇诱导HepG2细胞建立细胞胆固醇过载模型,在细胞水平研究化合物ZYZ-772的胆固醇调节作用机制;通过MTT、生化试剂、FilipinⅢ染色,细胞Dil-LDL摄入研究、western-blotting以及RT-PCR的方法,检测细胞活力、总胆固醇、游离胆固醇在细胞内的聚集情况、胆固醇代谢相关蛋白(SREBP-2、LDLR、PCSK9、ABCG5/8)的表达、LDLR的活性、SREBP-2的信使RNA 表达水平,利用SREBP-2的成熟抑制剂4-(2-氨基乙基)苯磺酰氟盐酸盐(AEBSF)验证SREBP-2在化合物ZYZ-772胆固醇调节中的作用;结果表明,化合物ZYZ-772能有效的抑制胆固醇在细胞中聚集,对胆固醇过载的细胞具有保护作用,不仅可增加LDLR的表达,尤其可促进LDLR的活性,同时验证了所述的化合物ZYZ-772主要通过促进SREBP-2的表达发挥其生物学功能进行调节胆固醇代谢。
进一步,本发明的化合物槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷(ZYZ-772)可用于制备脂质代谢调节药物,尤其用于制备防治脂质代谢相关疾病的药物。
附图说明
图1是动物实验各组动物的体重变化,血清TC、HDL-c、LDL-c、TG的浓度水平结果,
其中,sim是辛伐他汀,HF是高脂饮食;#P<0.05,##P<0.01,###P<0.001与未处理组动物(control组)相比,*P<0.05,**P<0.01,***P<0.001与模型组动物(model组)相比。
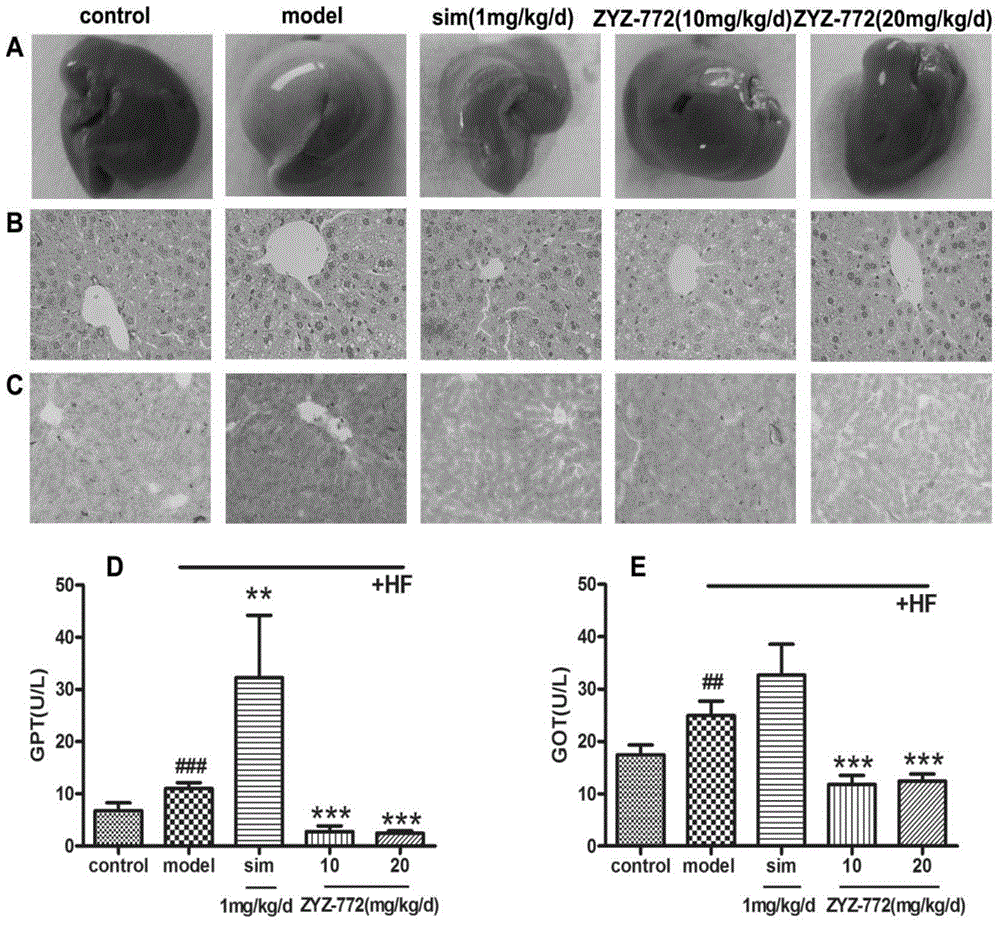
图2是各组动物肝组织形态、HE染色、油红O染色结果,以及血清谷丙转氨酶、谷草转氨酶的浓度水平,
其中,sim是辛伐他汀,HF是高脂饮食;#P<0.05,##P<0.01,###P<0.001与未处理组动物(control组)相比,*P<0.05,**P<0.01,***P<0.001与模型组动物(model组)相比。
图3是化合物ZYZ-772对HepG2细胞内总胆固醇(TC)聚集的影响,
其中,sim是辛伐他汀,que是槲皮素(化合物ZYZ-772的母核结构),25OH+cho是50μg/ml胆固醇+5μg/ml25-羟胆固醇;#P<0.05,##P<0.01,###P<0.001与未处理组细胞(control组)相比,*P<0.05,**P<0.01,***P<0.001与经胆固醇、25-羟胆固醇处理的细胞(model组)相比;B,C,D分别表示处理6h,12h,24h的实验结果。
图4是HepG2细胞MTT及细胞计数结果,
其中,sim是辛伐他汀,25OH+cho是50μg/ml胆固醇+5μg/ml25-羟胆固醇;#P<0.05,##P<0.01与未处理的细胞(control组)相比,*P<0.05,**P<0.01与经胆固醇、25-羟胆固醇处理的细胞(model组)相比。
图5是HepG2细胞游离胆固醇FilipinⅢ染色结果,
其中,A图是荧光共聚焦显微镜拍摄结果,B图是流式细胞仪检测结果,C图是流式细胞仪结果统计图。#P<0.05,与未处理的细胞(control组)相比,*P<0.05与经胆固醇、25-羟胆固醇处理的细胞(model组)相比。
图6是动物肝组织与HepG2细胞中蛋白ABCG5/8的表达结果,
其中,sim是辛伐他汀,25OH+cho是50μg/ml胆固醇+5μg/ml25-羟胆固醇;A、B图是细胞实验结果,C、D图是动物肝组织实验结果;#P<0.05与未处理的细胞或动物(control组)相比,*P<0.05与经胆固醇、25-羟胆固醇处理的细胞或高脂喂养的动物组(model组)相比。
图7是动物肝组织与HepG2细胞中蛋白LDLR和PCSK9的表达结果,以及LDLR的活性测定,
其中,sim是辛伐他汀,25OH+cho是50μg/ml胆固醇+5μg/ml25-羟胆固醇;A、B图是细胞实验结果,C、D图是动物肝组织实验结果,E是LDLR的活性测定结果;#P<0.05,##P<0.01,###P<0.001与未处理的细胞或动物(control组)相比,*P<0.05与经胆固醇、25-羟胆固醇处理的细胞或高脂喂养的动物组(model组)相比。
图8是动物肝组织中蛋白SREBP-2成熟形式的表达结果,和HepG2细胞浆与细胞核中蛋白SREBP-2成熟形式的表达结果,以及化合物ZYZ-772不同预处理时间下HepG2细胞中SREBP-2的mRNA水平,
其中,sim是辛伐他汀,25OH+cho是50μg/ml胆固醇+5μg/ml25-羟胆固醇;A图是动物实验结果,B图是细胞浆中的检测结果,C图是细胞核中的检测结果,#P<0.05,##P<0.01与未处理的细胞或动物(control组)相比,*P<0.05,**P<0.01与经胆固醇、25-羟胆固醇处理的细胞或高脂喂养的动物组(model组)相比。D图是细胞中SREBP-2的mRNA水平,**P<0.01与未处理细胞(control)相比。
图9是使用AEBSF后细胞内总胆固醇水平、蛋白SREBP-2及LDLR的表达水平的检测结果,
其中,25OH+cho是50μg/ml胆固醇+5μg/ml25-羟胆固醇;#P<0.05,##P<0.01与未处理组细胞(control组)相比,*P<0.05与经胆固醇、25-羟胆固醇处理的细胞(model组)相比。
具体实施方式
实施例1,化合物ZYZ-772在高脂动物模型中的脂质调节作用实验
28只apoE基因敲除小鼠随机平均分为模型组、阳性药组(辛伐他汀1mg/kg/d)、化合物ZYZ-772低剂量组(10mg/kg/d)、高剂量组(20mg/kg/d),并给予高脂饲料,腹腔给药38天;7只C57BL/6小鼠作为正常组,给予正常饲料,并且腹腔注射等体积的生理盐水38天;38天后检测血清总胆固醇、甘油三酯、HDL-c、LDL-c、谷丙转氨酶与谷草转氨酶水平,对肝组织进行H&E及油红染色,检测肝组织蛋白SREBP-2、LDLR、PCSK9、ABCG5与ABCG8的表达;
结果表明,化合物ZYZ-772可良好的调节血脂水平,对脂肪肝具有保护作用。
实施例2,ZYZ-772细胞毒性测定及细胞增殖情况
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于96孔板(1×104个/孔)中,设置control组、模型组、辛伐他汀组和各不同浓度给药组,12h后,各不同浓度给药组换成1%FBS的高糖DMEM培养基并分别加入0.1μM、0.5μM、2.5μM、5.0μM、25μM、50μM、100μM的ZYZ-772,辛伐他汀组换成含1μM辛伐他汀的1%FBS的高糖DMEM培养基,control与模型组只换成1%FBS的高糖DMEM培养基,设置预处理24h后,模型组、辛伐他汀组和各给药组换成含50μg/ml胆固醇+5μg/ml25-羟胆固醇的造模液,control组换成含1%FBS的DMEM高糖培养基,再作用24h后,PBS洗三遍,进行MTT实验,测定ZYZ-772不同作用浓度对细胞活力的损伤程度;
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于12孔板(10×104个/孔),设置control组、模型组和不同浓度给药组,12h后,各不同浓度给药组换成1%FBS的高糖DMEM培养基并分别加入0.1μM、2.5μM、5μM、10μM的ZYZ-772,control组与模型组换成只含1%FBS的高糖DMEM培养基,24h后,模型组和各给药组换成含50μg/ml胆固醇+5μg/ml25-羟胆固醇的造模液,control组换成含1%FBS的DMEM高糖培养基,再作用24h后,倾去培养基,用PBS清洗三遍,用胰酶消化细胞,加1ml含血清培养基进行吹打,取20μl细胞悬液加入计数板,放入细胞计数仪进行计数,重复三次,并记录数据。
实施例3,细胞水平上化合物ZYZ-772的胆固醇调节活性
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于24孔板(8×104个/孔),设置control组、模型组、辛伐他汀组、各不同浓度给药组以及槲皮素(ZYZ-772的母核结构)各浓度给药组,12h后,各不同浓度给药组换成1%FBS的高糖DMEM培养基并分别加入0.1μM、0.5μM、2.5μM、5.0μM的ZYZ-772,槲皮素各浓度给药组换成1%FBS的高糖DMEM培养基并分别加入0.1μM、1.0μM、5.0μM的槲皮素,辛伐他汀组换成含1μM辛伐他汀的1%FBS的高糖DMEM培养基,control与模型组只换成1%FBS的高糖DMEM培养基,设置预处理6h、12h、24h后,模型组、辛伐他汀组、不同浓度给药组以及槲皮素各浓度给药组换成含50μg/ml胆固醇+5μg/ml25-羟胆固醇的造模液,control组换成含1%FBS的DMEM高糖培养基,再作用24h后,PBS洗三遍,每孔加入50ul裂解液,充分裂解后,取细胞上清,利用酶法测定胞内总胆固醇含量。
实施例4,ZYZ-772对HepG2细胞内游离胆固醇聚集的影响
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于8孔荧光共聚焦培养皿(1×104个/孔),设置control组、模型组、不同浓度给药组,12h后,各不同浓度给药组换成1%FBS的高糖DMEM培养基并分别加入0.1μM、2.5μM的ZYZ-772,control组与模型组换成只含1%FBS的高糖DMEM培养基,24h后,模型组和各给药组换成含50μg/ml胆固醇+5μg/ml25-羟胆固醇的造模液,control组换成含1%FBS的DMEM高糖培养基,再作用24h后,倾去培养基,用PBS清洗三遍后,用4%多聚甲醛固定15min,再用PBS清洗三遍,加入100μlFilipinⅢ(50μg/ml),染色45min,然后用PBS清洗三遍,使用防荧光猝灭剂进行封片,在荧光共聚焦显微镜下拍照,激发光波长为405nm;
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于24孔板(8×104/孔),设置control组、模型组、不同浓度给药组,12h后,各不同浓度给药组换成1%FBS的高糖DMEM培养基并分别加入0.1μM、2.5μM的ZYZ-772,control组与模型组换成只含1%FBS的高糖DMEM培养基,24h后,模型组和各给药组换成含50μg/ml胆固醇+5μg/ml25-羟胆固醇的造模液,control组换成含1%FBS的DMEM高糖培养基,再作用24h后,倾去培养基,用PBS清洗三遍后,加入胰酶消化,消化后的细胞收集到EP管,1200g离心5min, 吸尽上清,加入适量4%多聚甲醛,固定15min后,使用PBS清洗3遍,再加入适量FilipinⅢ(50μg/ml)避光染色45min,然后用PBS清洗3遍,最后加入100μlPBS形成细胞悬液,利用流式细胞仪统计细胞荧光强度,激发光波长为405nm。
实施例5,ZYZ-772对相关蛋白表达的影响
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于6孔板(4×105/孔),设置control组、模型组、辛伐他汀组和不同浓度给药组,12h后,各不同浓度给药组换成1%FBS的高糖DMEM培养基并分别加入对应浓度的ZYZ-772,辛伐他汀组换成含1μM辛伐他汀的1%FBS的高糖DMEM培养基,control组与模型组换成只含1%FBS的高糖DMEM培养基,24h后,模型组和各给药组换成含50μg/ml胆固醇+5μg/ml25-羟胆固醇的造模液,control组换成含1%FBS的DMEM高糖培养基,再作用24h后,使用PBS清洗3遍,将细胞置于冰上,加入适量含PMSF(终浓度为1mM)的裂解液(或根据细胞核蛋白与细胞浆蛋白抽提试剂盒说明书进行核蛋白与胞浆蛋白的提取),充分裂解后,使用刮刀把细胞裂解物质集中,并转移到EP管中,然后进行低温离心(4℃,12000g),取上清即为总蛋白,然后进行western-blotting实验检测SREBP-2、LDLR、PCSK9、ABCG5/ABCG8蛋白的表达。
实施例6,ZYZ-772对LDLR活性的作用
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于24孔板(8×104/孔),设置control组、模型组、他莫昔芬组和2.5μM给药组,12h后,control组换成含只含1%FBS的高糖DMEM培养基,模型组换成含LDL-c(120μg/ml)的1%FBS的高糖DMEM培养基,他莫昔芬组换成含LDL-c(120μg/ml)与5μM他莫昔芬的1%FBS的高糖DMEM培养基,2.5μM给药组换成含LDL-c(120μg/ml)与ZYZ-772(2.5μM)的1%FBS的高糖DMEM培养基,24h后,所有组别换成含有DiI-LDL(20μg/ml)的10%LPDS的高糖DMEM培养基,在37℃孵育3h后,吸去含DiI-LDL的培养基,用PBS清洗三遍,将细胞消化转移到EP管中,再用PBS重悬,利用流式细胞仪统计细胞荧光强度,激发光波长为549nm,发射波长为565nm。
实施例7,ZYZ-772对SREBP-2,的mRNA表达的影响
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于6孔板(4×105/孔/孔),设置control组、ZYZ-772(2.5μM)不同时间给药组,12h后,给药组换成含2.5μM的1%FBS的高糖DMEM培养基,分别处理1h、4h、8h、12h、24h后提取RNA,control组换成只含1%FBS的高糖DMEM培养基处理24h后提取RNA,检测细胞SREBP-2的mRNA表达水平。
实施例8,验证ZYZ-772调节胆固醇代谢通过SREBP-2的生物学作用
对数生长期的HepG2细胞消化后,用含10%FBS的DMEM高糖培养基稀释后,接种于24孔板(8×104/孔)或者6孔板(4×105/孔),设置control组、模型组、ZYZ-772(2.5μM)给药组、AEBSF对照组、AEBSF抑制剂组,12h后,control组与模型组换成含1%FBS的高糖DMEM培养基,ZYZ-772(2.5μM)给药组换成含ZYZ-772(2.5μM)的1%FBS高糖DMEM培养基,AEBSF对照组换成含AEBSF(120μM)的1%FBS高糖DMEM培养基,AEBSF抑制剂组换成含ZYZ-772(2.5μM)与AEBSF(120μM)的1%FBS高糖DMEM培养基,作用24h后,直接提取蛋白确证SREBP-2表达的抑制情况或者模型组、ZYZ-772(2.5μM)给药组、AEBSF对照组和AEBSF抑制剂组换成含50μg/ml胆固醇+5μg/ml25-羟胆固醇的造模液,control组换成含1%FBS的DMEM高糖培养基,再作用24h后,使用PBS清洗3遍,用总胆固醇测定试剂盒测试胞内总胆固醇,或者用于提取总蛋白,进行western-blotting测定SREBP-2及LDLR的表达。
上述实验结果表明,所述化合物ZYZ-772对血脂水平有良好的调节作用,对脂肪肝有很好的保护作用;能有效的抑制胆固醇在细胞中聚集,对胆固醇过载的细胞具有保护作用,不仅可增加LDLR的表达,尤其可促进LDLR的活性,同时验证了所述的化合物ZYZ-772主要通过促进SREBP-2的表达发挥其生物学功能进行调节胆固醇代谢;所述的化合物槲皮素-3-O-(6”-O-α-L-鼠李糖)-β-D-葡萄糖-7-O-β-D-葡萄糖苷(ZYZ-772)可用于制备脂质代谢调节药物,尤其用于制备防治脂质代谢相关疾病的药物。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种再生纤维素纤维改性鼠李糖脂乳化沥青的制备方法与流程
- 一种玻璃纤维改性鼠李糖脂乳化沥青的制备方法与流程
- 一种秸秆纤维改性鼠李糖脂乳化沥青的制备方法与流程
- 一种乙基多杀菌素的化学合成方法与制造工艺
- 鼠李糖乳杆菌促进生态失调后肠道菌群多样性恢复的应用的制造方法与工艺
- 涉及具有牛乳蛋白过敏症的受试者的营养组合物的制造方法与工艺
- 改善的制备4‑(1‑(4‑(全氟乙氧基)苯基)‑1H‑1,2,4‑三唑‑3‑基)苯甲酰叠氮的方法与制造工艺
- 一种鼠李糖乳杆菌胞外多糖的制备及用途的制造方法与工艺
- 生产鼠李糖脂的方法与制造工艺
- 与多糖聚合物粘合剂缀合的鼠李糖乳杆菌RHT‑3201,及其用于预防或治疗特应性疾病的用途的制造方法与工艺