苦丁茶提取物的制备及抗阿尔兹海默症用途的制作方法
本发明属医药技术领域,具体涉及一种苦丁茶提取物及其活性组分和活性化合物的制备方法,以及其在预防及治疗阿尔兹海默症等神经退行性疾病中的食品和药品中的应用。
背景技术:
老年人口的快速增长,使得人们更加关心该群体的健康状况。据各国卫生组织统计,仅在欧美各国,有20%的人在一生之中会受到脑功能障碍类疾病的困扰,每年总支出高达2万亿美元,超过心血管疾病、癌症、糖尿病三者的总和,并且预计随着人类寿命的增加,这一数字还会继续增加。尤其是阿尔兹海默症(Alzeimer’s disease,AD),已经成为个人医疗支出增长的主要因素,为社会带来很大负担。在国际阿尔茨海默症协会年报告中指出:2015年,全世界约有4680万人患有痴呆症,预计2030年将达到7470万人,2050年更将突破1亿3150万人,其中约一半为AD患者。58%的痴呆症患者生活在现今的中低收入国家,在2030年这一数字将增加到63%,2050年则达到68%。2015年全球痴呆症照护成本总计为8180亿美元。短短3年,此金额将增加至1兆美元,2030年更会高达2兆美元。
我国阿尔兹海默症患者估计超过500万,约占世界总病例数的1/4;而且,随着我国人口老龄化进程的加快,这个数字将更为庞大,给社会稳定与发展带来重大的影响。据统计,中国阿尔兹海默症的发病率65岁以上是6.6%,年龄每增加5岁,患病率增长一倍,85岁以上则高达40%。再过20年,如今的中年人都将步入老年人的行列,阿尔兹海默症患者数量将急剧增加。因此,研究和开发有效的预防治疗阿尔兹海默症等神经退行性疾病的药物已成为全世界迫切需要解决的医学问题。
长期看来,AD是一种致死性的神经退行性疾病,发病后平均生存时间约为10年。AD是由神经退行性病变、脑血管病变、感染、外伤、肿瘤、营养代谢障碍等多种原因引起的一组症候群,是病人在意识清醒的状态下出现的持久的全面的智能减退,表现为记忆力、计算力、判断力、注意力、抽象思维能力、语言功能减退,情感障碍,日常生活能力和工作能力进行性减退直至丧失,并有各种神经精神症状和行为障碍。病理特征为淀粉样蛋白斑块和神经纤维缠结,在斑块附近存在大量的激活态小胶质细胞,同时脑内大量神经突触和神经元丢失。根据这些特征,目前主要学术假说有以下几种:1.β淀粉样多肽(Aβ)毒性及沉积;2.Tau蛋白过度磷酸化假说3.胆碱能缺失学说;4.神经退行性病变(Neurodegeneration);5.其它多种因素,如基因突变学说、氧化应激学说。
现今用于治疗AD的药物很多,主要有胆碱能药,其中乙酰胆碱酯酶(Acetylcholinesterase,AChE)抑制剂上市的药物有他克林(tacrine)、酒石酸卡巴拉汀(rivastigmine)、石杉碱甲(huperzine A)、多奈哌齐(donepezil)等;抗Aβ蛋白沉积的药物,主要有胰岛素样激素、结晶抑制剂和分泌酶抑制剂;神经兴奋性毒性抑制剂美金刚;脑代谢调节剂,如长春胺、尼莫地平、脑益嗪;影响自由基代谢的药物,如维生素C结合维生素E等。但AD是神经退行性疾病,病程中所造成的神经细胞的死亡是不可逆的,而这些治疗药物只能延缓病理进程,且随病情发展药物疗效逐渐降低,有副作用,因此,近年来寻找新的针对AD病因的治疗药物和方法,成为当今研究的热点和难点。
研究表明,神经营养因子对神经发育和成年神经系统的疾病过程都有重要的影响。在神经退行性病变动物模型中,发现神经生长因子(Nerve Growth Factor,NGF)能阻止或减少神经元的退变。NGF是人类发现的第一个神经营养因子,也是最重要的神经营养因子;是一种对神经细胞的生长、发育、分化和功能保持等方面有重要调控作用的生物活性多肽;对神经萎缩、神经变性、外伤修复等神经疾病的治疗有显著作用。研究发现,NGF一定程度可阻止AD进展,其促进神经生长和神经保护作用是长期的研究热点。然而,它是一个由100多个氨基酸组成的多肽;由于分子量大和极性强等原因,不能通过血脑屏障(Blood Brain Barrier),并且难以大规模制备等诸多因素,局限了它的实际临床应用。目前,NGF除脑内手术直接投药之外,还没有找到更好的治疗方法。因此,寻找具有拟NGF活性(NGF mimics)或能增强其活性(NGF enhancer)并且能通过血脑屏障的小分子化合物就自然成为了研究方向。由于PC12细胞(Pheochromocytoma cells,从大鼠肾上腺嗜铬细胞克隆得到)在NGF的作用下会停止分裂,长出突起,转化成神经元样细胞。因此,是一个很好的在细胞分子水平研究NGF的功能的细胞模型。目前,已经有NGF mimics在III期临床试验阶段。
中草药是中药学的物质基础,是天然活性有机化合物的主要来源。我国有着几千年的中医文明,且地大物博,有很多宝贵的道地药材,因为中药材资源的利用较方便,所以对其新的成分和新的活性的研究也就十分重要。研究表明,中药对阿尔兹海默症有显著疗效,其中最著名的是从蛇足石杉中提取的生物碱-石杉碱甲(huperzine A),它是中国科学院药物研究所开发的具有自主知识产权的创新药物,它不仅是一种高效高选择性的乙酰胆碱酯酶(AChE)抑制药,而且还能减少谷氨酸诱发的神经细胞死亡,保护神经细胞对抗β淀粉样多肽(Aβ)产生的氧化应激反应,具有明显的对抗过氧化氢、蛋白激酶C抑制剂等诱导的神经细胞凋亡的作用,是目前全球治疗阿尔兹海默症的最佳药物之一。
苦丁茶为冬青科冬青属苦丁茶Ilex kudingcha C.J.Tseng的叶,主要分布在西南地区(四川、重庆、贵州、湖南、湖北)及华南地区(江西、广东、福建、海南)等地,是纯天然保健饮料。具有清热消暑、明目益智、生津止渴、利尿强心、润喉止咳、降压减肥、抑癌防癌、抗衰老、活血脉等多种功效,素有“保健茶”、“美容茶”、“减肥茶”、“降压茶”、“益寿茶”等美称。
技术实现要素:
本发明的目的是提供一种苦丁茶提取物的制备方法,通过以下步骤实现:
(1)粉碎和浸提:
100g中药苦丁茶粉碎后,用1L甲醇室温下震荡浸提3次,每次24小时,所得滤液经浓缩干燥后,用水和乙酸乙酯交替萃取分离多次,得到酯层活性组分(A)7g;
(2)分离和纯化:
将活性组分(A)先经一次硅胶开口柱分离(200-300目,以下溶剂系统均按体积比),经正己烷:乙酸乙酯(100:0,70:30,50:50,0:100)洗脱,最后用甲醇冲洗,合并正己烷:乙酸乙酯70:30的洗脱流分,得到活性组分(b)2g;合并甲醇的洗脱流分,得到活性组分(B)2.2g。
活性组分(b)2g经硅胶开口柱分离,正己烷:氯仿3:7洗脱,得1g活性组分(c),继续经硅胶开口柱分离,合并正己烷:氯仿5:5洗脱流分得活性组分(d)0.45g,活性组分(d)经正己烷:氯仿7:3洗脱得活性组分(e)76mg;活性组分(e)用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为99%乙腈水溶液等度洗脱)得到化合物(1)10.3mg(tR=38min)、化合物(2)5.3mg(tR=57min)、活性组分(f)12.5mg;活性组分(f)继续用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为97%甲醇水溶液等度洗脱)得到化合物(3)3.7mg(tR=37min)、化合物(4)4.5mg(tR=35min)。经核磁共振谱、质谱确定化合物(1)-(4)为五环三萜类化合物。
活性组分(B)进一步用ODS开口柱分离(溶剂系统按体积比为甲醇:水=5:5,7:3,8:2,9:1,10:0),合并甲醇:水为8:2至9:1的洗脱流分,得到活性组分(C)350mg;活性组分(C)再次用硅胶开口柱分离(溶剂系统按体积比为氯仿:乙酸乙酯=95:5,90:10,80:20,70:30,60:40,50:50,40:60,30:70,20:80,90:10,100:0),合并甲醇:水为10:90至0:100的洗脱流分,得到活性组分(D)67mg;活性组分(D)用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为45%乙腈水溶液等度洗脱30分钟),得到活性组分(E)23mg,继续用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为63%甲醇水溶液等度洗脱50分钟)得到化合物(5)12.3mg,经核磁共振谱、质谱确定为新五环三萜皂苷类化合物。
本发明制备的活性组分(E),其中五环三萜类化合物(5)的总含量>50%。同时确定了化合物(1)为羽扇豆醇,化合物(2)为α-香树脂醇,化合物(3)为β-香树脂醇,化合物(4)为蒲公英赛醇,化合物(5)为3β-O-D-葡萄糖(1→3)-[α-L-鼠李糖(1→3)]-α-L-阿拉伯糖-坡模酸。(3-O-β-D–glucopyranosyl-(1→3)-[α-L-rhamnopyranosyl-(1→2)]-α-L-arabinopyranosyl)-pomolic acid)。
本发明的另一个目的是提供一种苦丁茶提取物在制备预防或治疗阿尔兹海默症等神经退行性疾病的药物和保健食品中的应用。所述的苦丁茶提取物为活性组分(A),(b)-(f),(B)-(E),和活性化合物(1)-(5)。
苦丁茶活性组分(A),(b)-(f),(B)-(E),活性化合物(1)-(5)具有显著的拟神经生长因子的活性,因此可将其作为有效成分,添加药学或食品可接受的载体或赋形剂,制备预防、治疗阿尔兹海默症等神经退行性疾病的保健食品和药物。所述的保健食品可接受的载体是指食品领域常规的载体,例如淀粉、蔗糖、微晶纤维素等填充剂,淀粉浆、羟丙纤维素、明胶、聚乙二醇等粘合剂,硬脂酸镁、微粉硅胶、聚乙二醇类等湿润剂,聚山梨脂、卵磷脂等吸收促进剂,伯洛沙姆、脂肪酸山梨坦、聚山梨脂等表面活性剂,另外还可以添加香味剂、甜味剂等其它辅剂。活性化合物(1)-(5)结构式如下所示:
所述的药学可接受的载体可参照现有技术。将所述的活性成分或化合物制成药品后,可以以单位剂量形式给用,给药途径可以为肠道或非肠道给药。
所述药物的剂型可以是固体制剂、液体制剂或半固体剂型,上述各种剂型可采用现有生产方法进行制备。
本发明进一步还提供一种预防阿尔兹海默症等神经退行性疾病的药物组合物,该药物组合物含有生理有效量苦丁茶活性组分(A),(b)-(f),(B)-(E),活性化合物(1)-(5)和药学上可接受的载体或稀释剂。
这里所述的药学上可接受的载体是指药学领域常规的药物载体,例如稀释剂、赋形剂如是等,填充剂如淀粉、蔗糖、微晶纤维素等;粘合剂如淀粉浆、羟丙纤维素、明胶、聚乙二醇等;湿润剂如硬脂酸镁、微粉硅胶、聚乙二醇类等;吸收促进剂聚山梨脂、卵磷脂等,表面活性剂伯洛沙姆、脂肪酸山梨坦、聚山梨脂等等,另外还可以在组合物中加入其它辅剂如香味剂、甜味剂等。
本发明所述的苦丁茶活性组分(A),(b)-(f),(B)-(E),活性化合物(1)-(5)可以以单位剂量形式给药,给药途径可为肠道和非肠道,包括口服、肌肉、皮下和鼻腔。
本发明所述的化合物给药途径可为静脉给药。注射包括静脉注射、肌肉注射、皮下注射和穴位注射。
本发明的药物组合物的各种剂型可以按照药学领域的常规生产方法制备,例如使活性成分与一种或多种载体或赋形剂混合,然后将其制成所需的剂型。
给药剂型可以是固体制剂、胶囊剂或液体制剂,包括片剂、胶囊剂、分散片、口服液、大输液、小针、冻干粉针、软膏、搽剂或栓剂。
用本发明制备的苦丁茶活性组分(A),(b)-(f),(B)-(E),活性化合物(1)-(5),具有显著的拟神经生长因子的活性,可以制备预防阿尔兹海默症等神经退行性疾病的药物和保健食品。本发明中的中药材苦丁茶廉价易得,且至今无其具有拟神经生长因子活性的相关报道。因此,本发明对该中药新的药理活性研究及开发具有重要意义。
本发明采用PC 12细胞作为有效的活性鉴定系统,发现苦丁茶甲醇提取物分离得到的活性组分及活性化合物,能诱导PC 12细胞神经突起伸长,具有显著的拟神经生长因子活性。此外,苦丁茶来源广泛,取材便利等优势。所以将苦丁茶开发为预防和治疗阿尔兹海默症等神经退行性疾病的新药和保健食品具有重要意义。
附图说明
图1是加入苦丁茶活性组分(A),(b)-(f),活性化合物(1)-(4),经48小时后PC 12细胞的神经突起分化率。
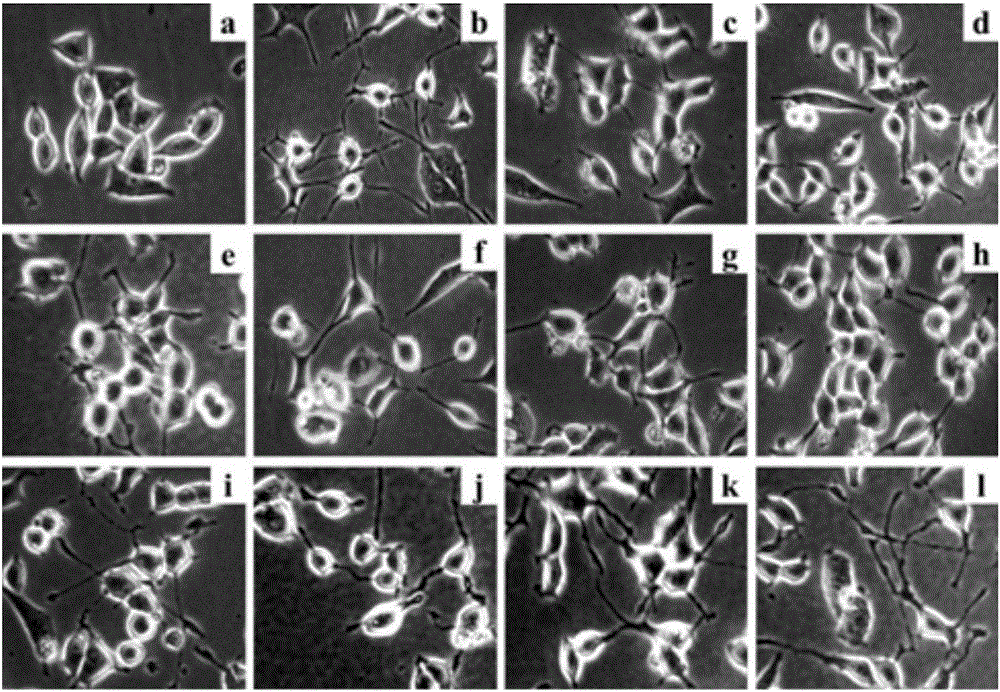
图2是加入苦丁茶活性组分(A),(b)-(f),活性化合物(1)-(4),经48小时后PC 12细胞显微镜图片。
图3是加入苦丁茶活性组分(A),(B)-(E),活性化合物(5),经48小时后PC 12细胞的神经突起分化率。
图4是加入苦丁茶活性组分(A),(B)-(E),活性化合物(5),经48小时后PC 12细胞显微镜图片。
具体实施方式
本发明结合附图和具体实施例作进一步的说明。
实施例1苦丁茶活性组分和活性化合物的制备
(1)粉碎和浸提:
100g中药苦丁茶粉碎后,用1L甲醇室温下震荡浸提3次,每次24小时,所得滤液经浓缩干燥后,用水和乙酸乙酯交替萃取分离多次,得到酯层活性组分(A)7g;
(2)分离和纯化:
将活性组分(A)先经一次硅胶开口柱分离(200-300目,以下溶剂系统均按体积比),经正己烷:乙酸乙酯(100:0,70:30,50:50,0:100)洗脱,最后用甲醇冲洗,合并正己烷:乙酸乙酯70:30的洗脱流分,得到活性组分(b)2g;合并甲醇的洗脱流分,得到活性组分(B)2.2g。
活性组分(b)2g经硅胶开口柱分离,正己烷:氯仿3:7洗脱,得1g活性组分(c),继续经硅胶开口柱分离,合并正己烷:氯仿5:5洗脱流分得活性组分(d)0.45g,活性组分(d)经正己烷:氯仿7:3洗脱得活性组分(e)76mg;活性组分(e)用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为99%乙腈水溶液等度洗脱)得到化合物(1)10.3mg(tR=38min),化合物(2)5.3mg(tR=57min),活性组分(f)12.5mg;活性组分(f)继续用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为97%甲醇水溶液等度洗脱)得到化合物(3)3.7mg(tR=37min),化合物(4)4.5mg(tR=35min)。经核磁共振谱、质谱确定为五环三萜类化合物。
活性组分(B)进一步用ODS开口柱分离(溶剂系统按体积比为甲醇:水=5:5,7:3,8:2,9:1,10:0),合并甲醇:水为8:2至9:1的洗脱流分,得到活性组分(C)350mg;活性组分(C)再次用硅胶开口柱分离(溶剂系统按体积比为氯仿:乙酸乙酯=95:5,90:10,80:20,70:30,60:40,50:50,40:60,30:70,20:80,90:10,100:0),合并甲醇:水为10:90至0:100的洗脱流分,得到活性组分(D)67mg;活性组分(D)用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为45%乙腈水溶液等度洗脱30分钟),得到活性组分(E)23mg,继续用HPLC纯化(色谱条件为:色谱柱流速3ml/min,检测波长210nm,流动相为63%甲醇水溶液等度洗脱50分钟)得到化合物(5)12.3mg,经核磁共振谱、质谱确定为新五环三萜皂苷类化合物。
实施例2
对实施例1所得化合物理化特征及化学结构的定性鉴定:
化合物(1)-(4)的结构经LC-MS、1H NMR、13C NMR和文献数据比对后确定。
化合物1:白色固体,C30H50O(HRESI-TOF-MS m/z(M+H)+calcd for 427.3934,C30H51O),1H-NMR(500MHz,CDCl3):δ0.76(s,3H),0.79(s,3H),0.83(s,3H),0.94(s,3H),0.97(s,3H),1.03(s,3H),1.68(s,3H),4.69(1H,d,J=1.98Hz,H-29a),4.57(1H,d,J=2.03Hz,H-29b)3.19(1H,dd,J=11.40,4.85Hz,3-H).
13C-NMR(125MHz,CDCl3):δ151.13,109.47,79.16,55.45,50.59,48.46,48.14,43.16,42.99,40.99,40.16,39.01,38.86,38.21,37.32,35.74,34.44,30.00,28.14,27.60,27.57,25.30,21.08,19.46,18.47,18.16,16.27,16.13,15.52,14.70.
化合物2:白色固体,C30H50O(HRESI-TOF-MS m/z(M+H)+calcd for 427.3934,C30H51O),1H-NMR(500MHz,CDCl3):δ0.80(m,9H),0.91(s,3H),0.95(s,3H),1.00(s,3H),1.01(s,3H),1.07(s,3H),5.13(1H,m,12-H)3.23(1H,dd,J=11.11,5.09Hz,3-H).
13C-NMR(125MHz,CDCl3):δ139.58,124.45,79.05,59.06,55.17,47.71,42.07,41.52,40.00,39.66,39.60,38.78,38.77,36.89,33.75,32.93,31.25,28.74,28.12,28.09,27.27,26.61,23.36,23.26,21.39,18.35,17.46,16.86,15.67,15.62.
化合物3:白色固体,C30H50O(HRESI-TOF-MS m/z(M+H)+calcd for 427.3934,C30H51O),1H-NMR(500MHz,CDCl3):δ0.79(s,3H),0.83(s,3H),0.87(s,6H),0.94(s,3H),0.97(s,3H),1.00(s,3H),1.07(s,3H),5.18(1H,m,12-H)3.22(1H,dd,J=11.22,4.59Hz,3-H).
13C-NMR(125MHz,CDCl3):δ145.34,121.85,79.18,55.28,47.75,47.34,46.95,41.84,39.91,38.91,38.70,37.27,37.07,34.86,33.49,32.77,32.63,31.23,28.55,28.23,27.35,27.05,26.28,26.14,23.83,23.66,18.51,16.93,15.73,15.65.
化合物4:白色固体,C30H50O(HRESI-TOF-MS m/z(M+H)+calcd for 427.3934,C30H51O),1H-NMR(500MHz,CDCl3):δ0.80(s,3H),0.82(s,3H),0.91(s,6H),0.93(s,3H),0.95(s,3H),0.98(s,3H),1.09(s,3H),5.53(1H,dd,J=8.19,3.26Hz,15-H)3.19(1H,dd,J=11.27,4.55Hz,3-H).
13C-NMR(125MHz,CDCl3):δ158.20,117.01,79.21,55.63,49.39,48.83,41.42,39.10,38.90,38.11,37.85,37.83,37.68,36.79,35.93,35.23,33.81,33.49,33.21,30.06,29.95,28.94,28.13,27.26,26.05,21.45,18.92,17.64,15.60,15.57.
化合物(5)的结构经LC-MS、1H NMR、13C NMR,HMBC测试后确定。
化合物5:白色固体;C47H76O17(HR ESI-TOF-MS m/z(M+Na)+calcd for 935.4975,C47H76O17Na);1H NMR(600MHz,pyridine-d5)δ5.60(1H,brt),3.31(1H,dd,J=3.82,11.55Hz),3.07(1H,s),1.22(3H,s),1.12(3H,s),0.86(3H,s),1.09(3H,s),1.44(3H,s),1.75(3H,s),1.12(3H,s),1.65(3H,d,J=5.98Hz),4.87(1H,d,J=5.30Hz),5.11(1H,d,J=7.80Hz),6.17(1H,brs)。
13C NMR(150MHz,pyridine-d5)δ38.88,27.5,88.66,39.94,56.45,18.99,33.87,40.71,48.09,37.38,24.33,128.36,140.29,42.46,29.68,26.76,48.67,54.97,73.07,42.72,26.99,39.4,28.46,17.12,15.97,17.38,25.06,181.13,27.3,17.55,105.09,74.36,82.48,68.52,65.17,102.26,72.76,72.87,74.28,70.38,18.93,105.01,75.32,78.58,71.81,78.92,62.89。
糖的比例及立体构型的确定
取化合物(5)3.0mg,1.25mL甲醇溶解后,加入250μL浓盐酸,80℃油浴回流4h,减压蒸馏干燥后,用水和氯仿交替萃取,所得水层悬干后得单糖混合物1.5mg,取200μg用160μL吡啶溶解,加入40μL 10mg/mL的L-半胱氨酸甲酯盐酸盐的吡啶溶液,60℃油浴1h后,再加入100μL含0.67μL邻甲苯异硫氰酸酯吡啶溶液,继续60℃油浴1h后取出,经氮吹干燥后,400μL甲醇复溶,取2μL进HR ESI-TOF-MS分析,糖的衍生物保留时间和标准糖衍生物进行比对,确定糖的绝对立体构型。标准糖衍生物的制备同上,其中由于标准D-鼠李糖无法购买得到,经查阅文献,将L-鼠李糖和D-半胱氨酸甲酯盐酸盐反应,其余条件不变,得到D-鼠李糖衍生物的保留时间。
化合物(5)的单糖衍生物保留时间(阿拉伯糖tR=6.900min,鼠李糖tR=7.493min和葡萄糖tR=6.713min)和标准糖衍生物L-半胱氨酸甲酯-D-阿拉伯糖(tR=6.780min),L-半胱氨酸甲酯-L-阿拉伯糖(tR=6.900min),L-半胱氨酸甲酯-D-葡萄糖(tR=6.720min),L-半胱氨酸甲酯-L-葡萄糖(tR=6.433min),L-半胱氨酸甲酯-L-鼠李糖(tR=7.513min),和D-半胱氨酸甲酯-L-鼠李糖(tR=6.140min)对比得到化合物(5)的单糖分别为L-阿拉伯糖,D-葡萄糖和L-鼠李糖。
另取化合物(5)的单糖混合物200μg,和200μL含100μg盐酸羟胺的吡啶溶液90℃油浴加热1h,取出冷却至室温,加4μL乙酸酐继续90℃油浴加热1h,氮吹干燥后,加400μL氯仿复溶,取0.2μL10:1分流进GC-MS分析,标准糖衍生物的制备同上,通过和标准糖的保留时间对比,确定糖的类型,再根据相应的GC-MS的峰面积确定糖的比例为1:1:1。
实施例3
中药苦丁茶活性组分(A),(b)-(f),(B)-(E),活性化合物(1)-(5)的生物活性。
在神经退行性病变动物模型中,研究发现NGF能阻止或减少神经元的退变,一定程度可阻止AD进展,具有促进神经生长和神经保护作用。由于PC12细胞具有神经细胞的一般特征,在NGF的作用下会停止分裂,长出突起,转化成神经元样细胞。因此,采用PC 12细胞作为有效的活性鉴定系统,筛选具有拟神经生长因子活性的化合物,有可能成为治疗阿尔兹海默症的有效药物。
实验方法:
1.PC 12细胞(大鼠肾上腺嗜铬瘤细胞株)的培养:在100mm的培养皿中,加入10mL含20×104个PC 12细胞DMEM培养基(其中含10%马血清、5%胎牛血清),两天后更换一次培养基,再过三天继代。继代时先用PBS(磷酸盐缓冲液)将细胞洗两次,再加入10mL PBS于培养皿中,在37℃,5%CO2的培养箱内静置10分钟后,取出吹洗,转移到15mL的一次性离心管,离心后血球计数板上计数。24孔细胞培养板每孔先加入1mL含血清的DMEM培养基,细胞计数后,每孔接2×104个细胞,CO2培养箱培养24小时后加样。
2.活性测试:以DMSO(二甲基亚砜)为阴性对照,NGF为阳性对照,将活性组分(A),(b)-(f),(B)-(E)及活性化合物(1)-(5)配置成不同浓度的DMSO溶液。用1mL含0.5%DMSO和不同浓度样品的DMEM溶液(不含血清)将24孔细胞板的每孔原培养基置换后,放入37℃,5%CO2的培养箱中培养。倒置显微镜下每隔24小时、连续4天观察细胞形态变化,记录细胞的神经突起分化率(神经突起长于胞体直径一倍的细胞数目与视野下总细胞数目的比值),每个视野下约100个细胞,随机选取3处,并统计作图分析。
3.实验结果:
在一定浓度下,加入苦丁茶酯层活性组分(A),(b)-(f),(B)-(E),活性化合物(1)-(5)后48小时,苦丁茶酯层活性组分(A),(b)-(f),(B)-(E),及活性化合物(1)-(5)均具有促PC 12细胞突起伸长的作用,显示出显著的拟神经生长因子活性。参见图1-4,以0.5%的DMSO作为阴性对照,样品活性组分(E)及化合物(4)和(5)的生物活性尤为突出。图1和图3中:0.5%DMSO为阴性对照;NGF:40ng/mL,阳性对照;***P<0.001。
图2和图4是加入苦丁茶酯层活性组分(A),(b)-(f),(B)-(E),活性化合物(1)-(5)后48小时PC 12细胞显微镜图片。从图2可以观察到苦丁茶酯层活性组分(A),(b)-(f)以及化合物(1)-(4)均能显著诱导PC 12细胞发生神经突起伸长的作用。图2中:a.阴性对照:0.5%DMSO;b.阳性对照:40ng/mL NGF;c.苦丁茶活性组分(A)100μg/mL;d.活性组分(b)30μg/mL;e.活性组分(c)30μg/mL;f.活性组分(d)10μg/mL;g.活性组分(e)10μg/mL;h.活性组分(f)10μg/mL;i.化合物(1)(1μM)。j.化合物(2)(1μM)k.化合物(3)(1μM)l.化合物(4)(1μM)。
图4中:a.阴性对照:0.5%DMSO;b.阳性对照:40ng/mL NGF;c.苦丁茶活性组分(A)100μg/mL;d.活性组分(B)30μg/mL;e.活性组分(C)10μg/mL;f.活性组分(D)10μg/mL;g.活性组分(E)10μg/mL;h.化合物(5)(3μM)。
- 还没有人留言评论。精彩留言会获得点赞!