一种多孔复合骨移植材料、其制备方法及应用与流程
本申请涉及多孔材料领域,特别是涉及一种多孔复合骨移植材料、其制备方法及应用。
背景技术:
自体红骨髓经皮注射治疗骨不连和骨缺损已取得一定成功,但应用直接注入的方法,局部干细胞密度低、容易流失,影响疗效。骨髓干细胞富集技术用于修复骨缺损和脊柱融合术,可获得与自体骨移植相当的效果,已成为骨修复研究领域的热点。其核心在适用于选择性细胞滞留技术的支架材料及其成骨效果的研究。
鉴于此,提高骨髓细胞的选择性滞留率成为本领域亟待解决的技术问题。
技术实现要素:
本申请主要解决的技术问题是提供一种多孔复合骨移植材料,能够提高骨髓细胞的选择性滞留率,适合作为骨髓干细胞富集材料,可满足创伤、骨病及急诊骨缺损对骨修复治疗技术和骨移植物的应用需求。
为解决上述技术问题,本发明实施例采用的一个技术方案是:提供一种多孔复合骨移植材料,与现有技术相比,其不同之处在于,该材料包括:
具有三维多孔网络结构的矿物基材;和
设于矿物基材表面的生物聚合物修饰层,所述生物聚合物分布在所述三维多孔网络的至少一部分内。
优选地,该材料通过用生物聚合物对具有三维多孔网络结构的矿物基材进行表面修饰而形成。
优选地,位于矿物基材孔隙中的生物聚合物修饰层具有二级多孔网络结构。
优选地,所述矿物基材为β-磷酸三钙,所述生物聚合物为多聚左旋赖氨酸。
优选地,所述β-磷酸三钙与所述多聚左旋赖氨酸的质量比为1000:(0.05~1)。
为解决上述技术问题,本发明实施例采用的另一个技术方案是:提供一种多孔复合骨移植材料的制备方法,包括如下步骤:
于水介质中,将矿物基材和生物聚合物混合形成浸泡液,使矿物基材和生物聚合物充分接触;
将所得浸泡液放置足够时间以实现生物聚合物对矿物基材的表面修饰;
于温度-42℃~-47℃、负压20~28Pa下,将所得浸泡液进行冷却;
将冷却的浸泡液进行冷冻干燥。
优选地,在冷却步骤之前还包括对浸泡液进行负压抽滤的步骤。
优选地,所述矿物基材为β-磷酸三钙,所述生物聚合物为多聚左旋赖氨酸。
优选地,包括如下步骤:
对β-磷酸三钙进行超声清洗;
将多聚左旋赖氨酸用双蒸水配制成浓度为0.01~0.2mg/ml的多聚左旋赖氨酸溶液,再将β-磷酸三钙置于多聚左旋赖氨酸溶液中,形成浸泡液,其中,β-磷酸三钙与多聚左旋赖氨酸溶液的比例为1g:5ml;
将所得浸泡液放置足够时间以实现多聚左旋赖氨酸对β-磷酸三钙的表面修饰;
将盛装有浸泡液的容器放置于分别连接负压抽滤瓶和负压抽滤机的无菌干燥皿中,密封好接头与无菌干燥皿盖口,于18℃~22℃下负压抽滤4~8小时,直至未见气泡从孔隙溢出;
于温度-42℃~-47℃、负压20~28Pa下,将所得浸泡液进行冷却;
将冷却的浸泡液进行冷冻干燥。
本发明还提供了上述的多孔复合骨移植材料作为用于骨和/或软骨再生的材料的应用。
本申请实施例的有益效果是:区别于现有技术的情况,本发明实施例的多孔复合骨移植材料通过用生物聚合物对具有三维多孔网络结构的矿物基材进行表面修饰而形成,对骨髓细胞的选择性滞留率高,与骨髓干细胞快速构建的骨移植材料具有良好的生物相容性和成骨活性,可满足作为用于创伤、骨病及急诊骨缺损对骨修复高成骨活性骨移植材料的应用需求。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对本申请实施例中所需要使用的附图作简单地介绍。显而易见地,下面所描述的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是本发明实施例1的材料的外观图。
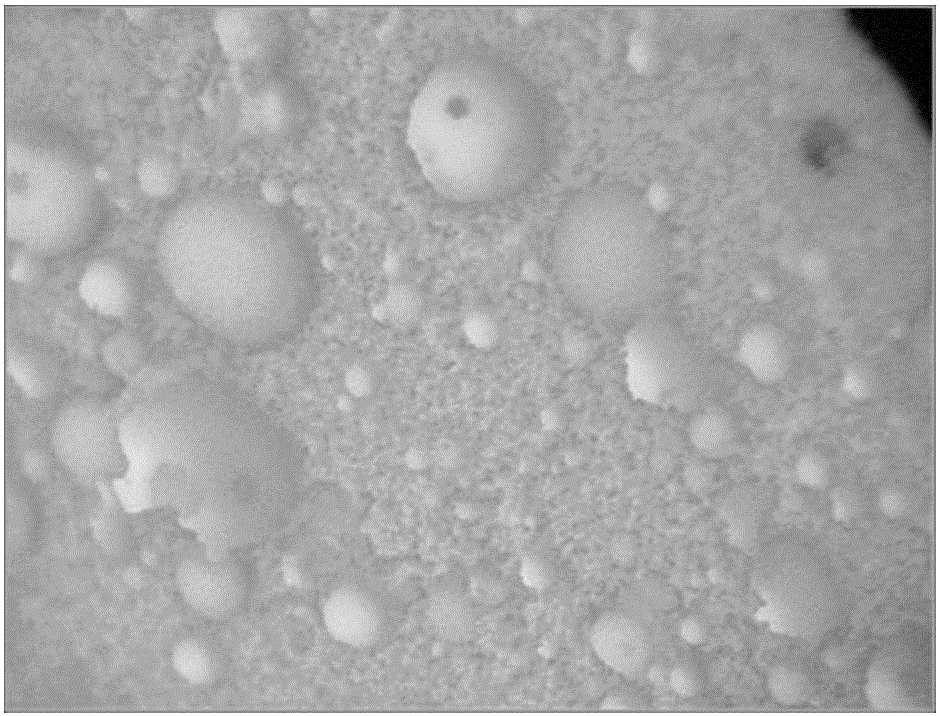
图2是本发明实施例1的材料的三维视频显微镜观察图。
图3是本发明实施例1的材料的扫描电镜图(×300倍)。
具体实施方式
为了使本申请的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本申请进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本申请,并不用于限定本申请。
本发明实施例的多孔复合骨移植材料,包括:具有三维多孔网络结构的矿物基材;和设于矿物基材表面的生物聚合物修饰层,所述生物聚合物分布在所述三维多孔网络的至少一部分内。该材料通过用生物聚合物对具有三维多孔网络结构的矿物基材进行表面修饰而形成,位于矿物基材孔隙中的生物聚合物修饰层具有二级多孔网络结构。
在本实施例的优选方案中,所述矿物基材为β-磷酸三钙,所述生物聚合物为多聚左旋赖氨酸;所述β-磷酸三钙与所述多聚左旋赖氨酸的质量比为1000:(0.05~1)。
需要说明的是,本说明书中,多聚左旋赖氨酸(PLL),英文为poly-L-lysine;β-磷酸三钙(β-TCP),英文为β-tricalcium phosphate,β-TCP不能由其它磷酸钙(例如由α-TCP)代替,所述α-TCP是完全不同于β-TCP的结晶形TCP;也不能由羟基磷灰石获得,所述羟基磷灰石是通常作为TCP销售的商品的主要成分。
该材料将多聚左旋赖氨酸(poly-L-lysine,PLL)与β-磷酸三钙(β-tricalcium phosphate,β-TCP)按优选的比例浸泡、负压抽滤和冷冻干燥,对β-磷酸三钙表面进行修饰及优化,促进人骨髓间充质干细胞(bone marrow stromal cells,BMSCs)的黏附、增殖与分泌基质等细胞功能,从而制备高成骨活性的骨移植材料。
本实施例的材料按照如下制备方法得到,首先,于水介质中,将β-磷酸三钙和多聚左旋赖氨酸混合形成浸泡液,使β-磷酸三钙和多聚左旋赖氨酸充分接触。其次,将所得浸泡液放置足够时间以实现多聚左旋赖氨酸对β-磷酸三钙的表面修饰。再次,于温度-42℃~-47℃、负压20~28Pa下,将所得浸泡液进行冷却。最后,将冷却的浸泡液进行冷冻干燥。
作为优选实施方式,在冷却步骤之前还包括对浸泡液进行负压抽滤的步骤。
具体地,本实施例的材料按照如下制备方法得到:
(1)对β-磷酸三钙进行超声清洗;
(2)将多聚左旋赖氨酸用双蒸水配制成浓度为0.01~0.2mg/ml的多聚左旋赖氨酸溶液,再将β-磷酸三钙置于多聚左旋赖氨酸溶液中,形成浸泡液,其中,β-磷酸三钙与多聚左旋赖氨酸溶液的比例为1g:5ml;
(3)将所得浸泡液放置足够时间以实现多聚左旋赖氨酸对β-磷酸三钙的表面修饰;
(4)将盛装有浸泡液的容器放置于分别连接负压抽滤瓶和负压抽滤机的无菌干燥皿中,密封好接头与无菌干燥皿盖口,于18℃~22℃下负压抽滤4~8小时,直至未见气泡从孔隙溢出;
(5)于温度-42℃~-47℃、负压20~28Pa下,将所得浸泡液进行冷却;
(6)将冷却的浸泡液进行冷冻干燥。
实施例1
本实施例提供了一种多孔复合骨移植材料,该材料为骨髓干细胞富集材料,是由β-TCP与PLL复合构成,其PLL的浓度为0.1%(0.1mg/ml),β-TCP的重量:PLL的体积=1g:5ml。所述PLL-β-TCP的制备方法步骤如下:
(1)β-TCP的清洗
取β-TCP置于超声波清洗机中,再次用无菌双蒸水洗涤3次,每2小时跟换双蒸水一次,至PH7.3±0.1(酸度计测定)。无菌操作台上沥干4h,,并置38℃恒温箱烘干24h,,称重封装并标记待用。
(2)PLL浸泡β-TCP
无菌操作下,用双蒸水与PLL配制0.1%的PLL并经0.22μm滤器过滤除菌。分别用上述配置好的PLL浸泡自制β-TCP(β-TCP重量:PLL体积=1g:5ml)15h,每3h震荡摇匀浸泡液,使PLL与β-TCP充分接触。
(3)负压抽滤
将上述浸泡容器置于连接负压抽滤瓶、负压抽滤机的无菌干燥皿中,密封好接头与干燥皿盖口,20℃持续负压抽滤5h,直至未见任何气泡自骨块表面孔隙溢出,取出浸泡容器置-20℃冰箱冷冻隔夜。
(4)冷冻干燥
将浸泡容器置于冷冻干燥机托盘,冷冻干燥机预置―42℃~―47℃,负压20-28Pa,预冷30min后开始抽真空,真空度100MT以下。冷冻干燥48h,见材料已完全显露,白色多聚赖氨酸已绝大部分吸附到材料中,材料边缘与瓶底仅余很少量多聚赖氨酸白色沉淀物,将材料称重并封装,贴上标签,外面再用一层聚乙烯袋封口。
(5)灭菌与保存
钴-60γ射线照射灭菌,常用剂量为15-25kGyCo,置-20℃低温冰箱保存待用。取少许β-TCP送需氧、厌氧菌、霉菌培养。
实施例2
本实施例提供了一种多孔复合骨移植材料,与实施例1相比,区别在于PLL的浓度为0.01%(0.01mg/ml)。
实施例3
本实施例提供了一种多孔复合骨移植材料,与实施例1相比,区别在于PLL的浓度为0.05%(0.05mg/ml)。
实施例4
本实施例提供了一种多孔复合骨移植材料,与实施例1相比,区别在于PLL的浓度为0.08%(0.08mg/ml)。
实施例5
本实施例提供了一种多孔复合骨移植材料,与实施例1相比,区别在于PLL的浓度为0.15%(0.15mg/ml)。
实施例6
本实施例提供了一种多孔复合骨移植材料,与实施例1相比,区别在于PLL的浓度为0.20%(0.20mg/ml)。
以实施例1所得产品为例进行产品验证:
结构特点和表征
PLL-β-TCP具有三维网孔结构,密度约为0.25~0.29g/ml,平均为(0.27±0.02)g/ml,孔隙率为(73±11)%。材料及孔隙表面有厚度约2~7μm的乳白色PLL覆盖,且在孔隙中形成更小的、孔径约20~65μm的网孔结构,大部分孔与孔之间有约100μm左右小孔贯通,三维视频显微镜观察可见材料整体及孔隙表面有均匀的乳白色PLL覆盖,拉曼光谱分析表明材料内外表面任一位点由β-TCP和多聚赖氨酸构成,组织学观察PLL-β-TCP在胶原孔状结构内表面有浅色PLL涂层与网孔结构,请参阅图1至图3所示,图中可见在β-磷酸三钙天然的网孔结构中形成了更细小的多聚左旋赖氨酸网孔。
PLL-β-TCP的细胞毒性检测
参照ISO10993及GB/T10886的有关标准,将PLL-β-TCP材料及其浸提液分别与人骨髓基质干细胞(BMSCs)体外共培养,于培养20h、3d、7d行细胞形态学观察,四甲基偶氮唑盐法测定培养1、3、5、7d的细胞增殖活性,应用分光光度法进行溶血试验。结果示:与PLL-β-TCP及其浸提液共培养的人BMSCs表现出更好的黏附与增殖特性,且随浸提液浓度增加而增加,细胞毒性为0~1级。浸提液组溶血指数为2.17%,达到标准要求。
PLL-β-TCP成骨效果检测
将成人骨髓干细胞通过骨髓富集装置复合PLL-β-TCP后植入裸鼠皮下,术后X线摄片和组织学检查均显示其成骨效果良好,与自体骨组比较无明显差异,并在各时间点与明显强于β-TCP组。
PLL-β-TCP选择性细胞滞留效果检测
①对骨髓有核细胞、血小板和骨髓干细胞的选择性滞留效果的观察:PLL-β-TCP对有核细胞选择性滞留的倍数为3.18±0.31倍,粘附率达53%±12%;对血小板选择性滞留的倍数为3.88±0.68倍,粘附率达34%±10%;对人骨髓干细胞选择性滞留的倍数为5.25±1.40倍,粘附率达73%±13%,选择率达1.41±0.34。②对促成骨生长因子的选择性滞留效果的观察:PLL-β-TCP与红骨髓富集处理后可以显著提高TGF-β1和PDGF含量。
综上所述,PLL-β-TCP是经多聚赖氨酸表面修饰的β-磷酸三钙,对骨髓细胞的选择性滞留率高,与骨髓干细胞快速构建的骨移植材料具有良好的生物相容性和成骨活性,可满足创伤、骨病及急诊骨缺损对骨修复高成骨活性骨移植物的需求。
以上所述仅为本申请的实施例,并非因此限制本发明的专利范围,凡是利用本申请说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本申请的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!