葡激酶抗原表位的聚乙二醇化修饰与应用的制作方法
本发明属于基因工程技术领域,尤其涉及一种聚乙二醇化葡激酶及其制备与应用。
背景技术:
天然葡激酶(staphylokinase,SAK)是金黄色葡萄球菌溶原性噬菌体合成的一种胞外蛋白质,由136个氨基酸残基组成,分子量为15.5KD。葡激酶本身没有蛋白酶活性,是一种“间接型”的纤溶酶原激活剂,通过与纤溶酶原(plasminogen,Flg)按1:1的比例特异性结合生成无活性的SAK-Flg复合物,在血栓表面痕量纤溶酶(plasmin,Flm)的作用下进一步转化成有活性的SAK-Flm复合物,催化另一分子纤溶酶原形成纤溶酶,从而激活纤溶系统。AK具有一定的纤维蛋白特异性、不会耗竭纤维蛋白酶原的优点,且对血小板为主的白色血栓作用相当明显,使其成为极具研究价值的溶栓药物。但是,在首次静脉注射2周后,血液中即开始出现大量的中和抗体,且这些抗体至少在体内存在7周以上。免疫原性是限制SAK临床应用的最主要因素。
SAK作为优秀的溶栓剂,由于该溶栓剂进入体内后会迅速诱导产生高滴度抗体的缺点,极大的限制了其在临床上的使用。因此如何降低其免疫原性成为了目前研究SAK的热点。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,提供一种聚乙二醇化葡激酶及其制备与应用。本发明的聚乙二醇化葡激酶与现有的同类产品比较,不仅有效降低了天然葡激酶的免疫原性,也保留了足够的溶栓活性。
为实现上述目的及其他相关目的,本发明采用如下技术方案:
本发明的第一方面,提供一种聚乙二醇化葡激酶,其结构中包括聚乙二醇和突变葡激酶,所述聚乙二醇和突变葡激酶相偶联。
优选地,所述聚乙二醇和突变葡激酶的摩尔比例为1:1。
优选地,所述聚乙二醇和突变葡激酶之间通过硫醚键相偶联。
优选地,所述突变葡激酶的氨基酸序列如SEQ ID NO.6所示。
优选地,所述聚乙二醇偶联在所述突变葡激酶的N端第82位半胱氨酸的巯基上。
优选地,所述聚乙二醇的分子量为5~40kDa。
本发明的第二方面,提供前述聚乙二醇化葡激酶的制备方法,包括:
(1)提供突变葡激酶;
(2)将突变葡激酶与马来酰亚胺修饰性聚乙二醇反应,获得聚乙二醇化葡激酶。
优选地,步骤(1)中,所述突变葡激酶的氨基酸序列如SEQ ID NO.6所示。
优选地,步骤(1),包括:构建含有突变葡激酶基因序列的表达载体,然后将含突变葡激酶基因序列的表达载体转化至宿主细胞中诱导表达,从表达产物中分离获得所述的突变葡激酶。进一步地,所述突变葡激酶基因序列如SEQ ID NO.5所示。
本发明第三方面,提供了前述聚乙二醇化葡激酶在制备抗凝、溶栓药物中的用途。
本发明第四方面,提供了一种低免疫原性抗凝、溶栓药物组合物,含有有效剂量的聚乙二醇化葡激酶及至少一种药学可接受的载体或赋形剂。
与现有技术相比,本发明的技术方案具有如下有益效果:
本发明首次制备了聚乙二醇化葡激酶,与现有的同类产品比较,不仅有效降低了天然葡激酶的免疫原性,也保留了足够的溶栓活性。
附图说明
图1:pcr实验验证突变质粒,其中,M泳道:蛋白Marker;1-6泳道:PCR验证。
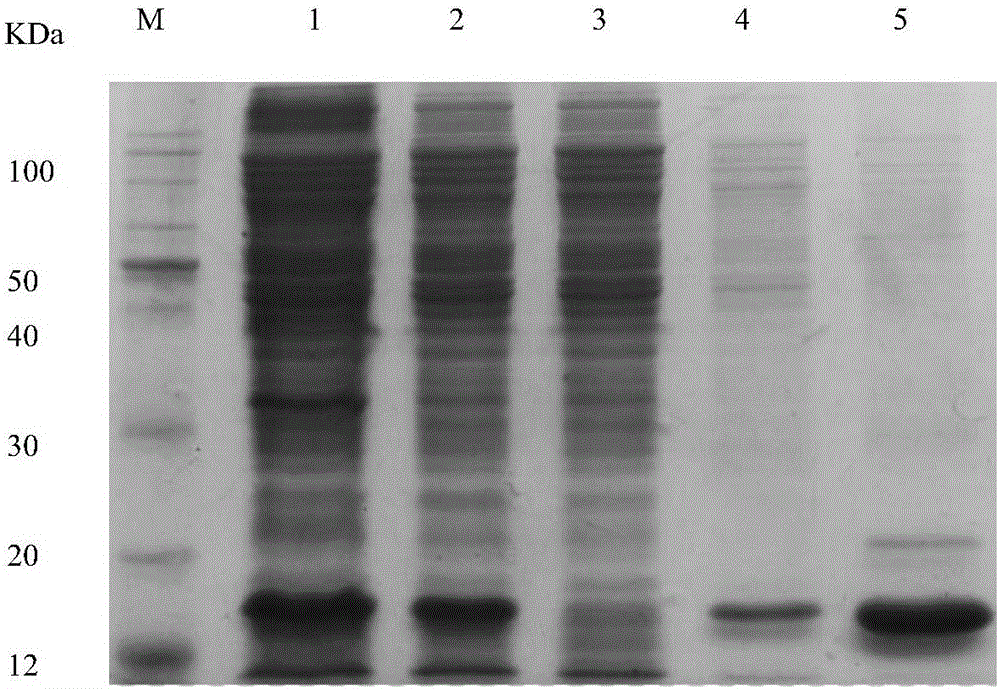
图2:突变蛋白SDS-PAGE电泳,其中,M泳道:蛋白Marker;1泳道:破菌液;2泳道:上清液;3泳道:穿透液;4:40mM咪唑浓度的洗脱液;5:500mM咪唑浓度的洗脱液。
图3:修饰蛋白碘染色与考马斯蓝染色对比结果,其中,A:聚乙二醇化葡激酶;B:维修时成功的葡激酶;C:游离聚乙二醇;1、6泳道:蛋白Marker;2、4泳道:通过考马斯兰复染的聚乙二醇修饰后的葡激酶蛋白混合液;3、5泳道:通过考马斯兰复染的未修饰的葡激酶蛋白;7、9泳道:通过碘染的聚乙二醇修饰后的葡激酶蛋白混合液;8、10泳道:通过碘染的葡激酶蛋白。
图4:溶圈实验验证活性结果,其中1号孔:未修饰的葡激酶10ul;2号孔:聚乙二醇化葡激酶10ul;3号孔:未修饰的葡激酶5ul;4号孔:聚乙二醇化葡激酶5ul;5号孔:链激酶10ul;6号孔:双蒸水10ul;7号孔:链激酶5ul。
图5:酶联免疫吸附测定实验结果。
具体实施方式
一、聚乙二醇化葡激酶
本发明的聚乙二醇化葡激酶,其结构中包括聚乙二醇和突变葡激酶,所述聚乙二醇和突变葡激酶相偶联。
所述聚乙二醇和突变葡激酶的摩尔比例为1:1。所述聚乙二醇和突变葡激酶之间通过硫醚键相偶联。例如,硫醇与C=C双键在马来酰亚胺环存在时,通过迈克尔加成生成生理稳定的键合。
在本发明较佳实施例中,所述突变葡激酶的氨基酸序列如SEQ ID NO.6所示。所述聚乙二醇偶联在所述突变葡激酶的N端第82位半胱氨酸的巯基上。
本发明,对于所述聚乙二醇的分子量没有特别的限制,只要不限制本发明的目的即可。例如,所述聚乙二醇的分子量范围可以是5~40kDa。在本发明较佳实施例中,所述聚乙二醇的分子量为10kda。
二、聚乙二醇化葡激酶的制备方法
本发明的聚乙二醇化葡激酶的制备方法,包括:
(1)提供突变葡激酶;
(2)将突变葡激酶与马来酰亚胺修饰性聚乙二醇反应,获得聚乙二醇化葡激酶。
本发明的一较佳实施例中,步骤(1)中,所述突变葡激酶的氨基酸序列如SEQ ID NO.6所示。
步骤(1),包括:构建含有突变葡激酶基因序列的表达载体,然后将含突变葡激酶基因序列的表达载体转化至宿主细胞中诱导表达,从表达产物中分离获得所述的突变葡激酶。本发明的一较佳实施例中,所述突变葡激酶基因序列如SEQ ID NO.5所示。
在上述制备方法中,硫醇与C=C双键在马来酰亚胺环存在时,通过迈克尔加成生成生理稳定的键合。
三、聚乙二醇化葡激酶的用途
本发明的聚乙二醇化葡激酶可以用于制备抗凝、溶栓药物。
四、低免疫原性抗凝、溶栓药物组合物
本发明的低免疫原性抗凝、溶栓药物组合物,含有有效剂量的聚乙二醇化葡激酶及至少一种药学可接受的载体或赋形剂。
本发明所提供的药物组合物可以多种剂型存在,如用于静脉注射等的注射剂,用于皮下注射、表皮外敷等的经皮吸收剂,用于喷鼻、喉、口腔、表皮、粘膜等的喷雾剂,用于滴鼻、眼、耳等的滴剂,用于肛肠等的栓剂、片剂、粉剂、粒剂、胶囊、口服液、膏剂、霜剂等多种形式,及肺部给药制剂及其他非肠道给药的组合物。上述各种剂型的药物均可以按照药学领域的常规方法制备。
所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。该药用组合物还可以加入香味剂、甜味剂等。
如上所述的药物制剂可对哺乳动物临床使用,包括人和动物,可以经静脉注射或者口、鼻、皮肤、肺吸入等途径给药。上述药物的优选周剂量为0.1-5mg/kg体重,优选的疗程为10至30天。一次性给药,或分次给药。无论采用何种给药方法,个体人的最佳剂量应根据具体的治疗而定。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULAR CLONING:A LABORATORY MANUAL,Second edition,Cold Spring Harbor Laboratory Press,1989and Third edition,2001;Ausubel等,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987and periodic updates;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,Third edition,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,Vol.304,Chromatin(P.M.Wassarman and A.P.Wolffe,eds.),Academic Press,San Diego,1999;和METHODS IN MOLECULAR BIOLOGY,Vol.119,Chromatin Protocols(P.B.Becker,ed.)Humana Press,Totowa,1999等。
实验材料
DpnI酶、primerStar premix酶、高保真rTaq酶、dNTP、DNA marker、质粒纯化试剂盒、分子量蛋白Marker、BCA蛋白浓度检测盒、ECL试剂盒等均购自TaKaRa公司,质粒提取试剂盒购自Promega公司。PreScission蛋白酶购自上海生物制品公司。凝血酶、纤溶酶原、纤维蛋白原、尿激酶标准品等均购自中国食品药品检定院。金属浴连接仪、水浴箱、PCR仪、温箱、凝胶成像仪、超声破碎仪、蛋白浓度检测仪、镍离子交换柱、交联葡聚糖凝胶层析柱、梯度杯、血栓弹力图等均系GE公司产品。ELISA试剂盒、I2、BaCl2等购自SIGMA公司,动物实验所用BALB/C小鼠(15只)均购自重庆医科大学动物实验中心。
实施例1重组葡激酶的表达及纯化
一、目的基因的扩增及突变质粒的构建
1.1引物合成
使用软件Premier 5设计SAK的突变引物。引物以全长SAK-PET28a为模板,以第82号基酸位点(表1)为中心双向扩增,得到突变SAK-PET28a质粒序列。引物由北京华大基因科技有限公司合成。
表1突变引物序列
1.2目的基因片段的扩增
SAK-cys-82-F、SAK-cys-82-R为SAK正反向引物,其中SAK-cys-82-F、SAK-cys-82-R中下划线部分即为SAK半胱氨酸突变位点。用引物对野生型SAK模板PCR扩增,反应条件为:94℃预变性5min,94℃变性30s,57℃退火1min,72℃延伸8min,进行18个循环。
1.3PCR产物转化及阳性菌筛选
将1μL DPN I酶加入PCR产物,并置于37℃恒温水浴箱中2h。将反应后产物加入100μL DH5α感受态中冰浴20min,于42℃水浴箱中热击1min,并再次冰浴5min,涂于卡那霉素抗性的平板上,于37℃孵箱中孵育12h。挑取位于平板中心的单独菌落,将菌接种至5mL LB液体培养基中,置于37℃摇床中培养6h,通过质粒抽提试剂盒从菌液中提取突变质粒,取实验室通用测序引物(序列为:TAATACGACTCACTATAGGG;SEQ ID NO.3)与(序列为:GCTAGTTATTGCTCAGCGG;SEQ ID NO.4)对突变质粒行菌液PCR验证,反应条件为:94℃预变性5min,94℃变性30s,52℃退火30s,72℃延伸1min,进行29个循环,通过琼脂糖凝胶电泳对PCR产物鉴定,结果如图1所示,于495bp处扩增出的单一特异性条带,与S预期的突变后的SAK片段大小相符。
此外,选取阳性的结果测序,测序结果显示SAK序列的第82号氨基酸已成功突变为半胱氨酸。
亦即,突变后的SAK的核苷酸编码序列如SEQ ID NO.5所示,具体为:
ATG CTG AAA CGC TCT CTG CTG TTC CTG ACG GTG CTG CTG CTG CTG TTC TCA TTC TCC TCC ATT ACC AAC GAA GTC TCC GCC TCC TCA AGT TTC GAT AAA GGC AAA TAC AAA AAA GGT GAT GAC GCC TCC TAT TTC GAA CCG ACC GGC CCG TAC CTG ATG GTT AAC GTC ACG GGC GTG GAC AGC AAG GGT AAT GAA CTG CTG TCT CCG CAT TAT GTT GAA TTT CCG ATT AAA CCG GGT ACC ACG ACA ACC AAA GAA AAA ATC GAA TAT TAC GTC GAA TGG GCA CTG GAT GCG ACG GCC TAC AAA GAA TTC CGT GTG GTT GAA CTG GAT CCG TCT GCT AAA ATCGAA GTT ACC TAC TAC GAC AAA AAC AAG AAA AAA GAA GAA ACC AAA TCA TTT CCG ATC ACG GAA AAA GGC TTC GTC GTG CCG GAT CTG TCG GAA CAC ATT AAA AAC CCG GGC TTC AAC CTG ATT ACG AAA GTG GTC ATC GAA AAG AAA TAA CTC GAG CAC CAC CAC CAC CAC CAC TGA GAT CCG。
1.4突变蛋白的表达
将测序正确的质粒转化入BL21(DE3)感受态细胞中,涂至卡那抗性的LB固体培养板上,于37℃孵箱中孵育12h。挑取平板中央的单个菌落转入4mL卡那霉素抗性的LB液体培养基中,于37℃摇床中120rpm培育,直至菌液的OD值0.6-0.8时将菌液转入300mL卡那霉素抗性的LB液体培养基中放大培养。当菌液的OD值为0.6-0.8时调节孵箱温度至20℃,并向其中加入0.2mM的IPTG诱导剂诱导蛋白表达14h。
1.5突变蛋白的镍离子亲和层析柱纯化
将诱导后的菌液倒入离心桶,在4℃,4000rpm条件下低速离心30min,弃掉上清液,加入100mmol/L的磷酸盐缓冲液重悬菌体,在冰水浴下超声破菌30min(超声on:4s,off:6s,振幅30%)至菌液透亮。将破菌液在4℃,12000rpm条件下离心30min,收取上清液,在10s/滴的流速条件下通过镍离子亲和层析柱纯化,用300mL Washing buffer(40mmol/L咪唑浓度的磷酸盐缓冲液)洗脱杂蛋白,以30mL的Elution buffer(500mmol/L咪唑浓度的磷酸盐缓冲液)洗脱目的蛋白。为尽可能保证蛋白活性,以上步骤均在4℃层析柜中进行。对各个步骤留下的样品通过SDS-PAGE电泳检测蛋白纯度。如图2所示,破菌液在泳道1中显示目的蛋白SAK-cys在E.coliBL21中大量表达,分子量为14.4KDa,与预期相符。
此外,通过测序验证突变蛋白的氨基酸序列正确。亦即,突变后的SAK的氨基序列如SEQ ID NO.6所示,具体为:
MLKRSLLFLTVLLLLFSFSSITNEVSASSSFDKGKYKKGDDASYFEPTGPYLMVNVTGVDSKGNELLSPHYVEFPIKPGTTTTKEKIEYYVEWALDATAYKEFRVVELDPSAKIEVTYYDKNKKKEETKSFPITEKGFVVPDLSEHIKNPGFNLITKVVIEKK。
1.6突变蛋白的peg修饰与鉴定
本实施例使用分子量为10Kda的聚乙二醇对突变蛋白进行修饰。
将SAK-cys与修饰剂以摩尔比1:5(突变蛋白:聚乙二醇)、温度20℃、修饰时间10h的条件进行修饰,并取修饰前、修饰后的蛋白样品进行SDS-PAGE电泳,用碘染色与考马斯兰染色法对比鉴定:将凝胶浸于15%浓度的BaCl2中浸泡震荡20min,通过蒸馏水漂洗3次,每次1min;取出漂洗后的凝胶置于I2-KI溶液中(2%I2,2.4KI)染色4h,用蒸馏水脱色直至能清晰观测结果,对图片进行保存。将脱色后的凝胶浸入考马斯亮蓝染剂中复染,再次脱色后通过蛋白Marker比对碘染与考马斯兰复染凝胶电泳图。通过碘染色法能特异性地将聚乙二醇染色而不会将单纯的突变蛋白质(SAK-cys)染色,通过碘染试剂染色后凝胶上携带peg修饰剂的peg-SAK-cys条带A与peg聚合物条带C(图3,7泳道、9泳道)被染色。而考马斯亮蓝染液复染后,单独的聚乙二醇聚合物条带C无法显色,而碘染色图中的被聚乙二醇条带所掩盖的未修饰SAK-cys条带B即显示出来(图3,2泳道、4泳道)。但修饰成功后的peg-SAK-cys条带A仍能保留在考马斯蓝染色图上,从二种染色的对比可推断突变蛋白成功得到修饰。
1.7修饰蛋白的分离纯化
使用sephadex G75型交联葡聚糖凝胶层析柱分离peg-SAK-cys与未修饰成功的SAK-cys。用10MM的磷酸盐缓冲液平衡层析柱,确保管道内无气泡、紫外吸收值OD为零时将修饰完成的蛋白超滤浓缩至1mL上样。将仪器调至收集状态,根据公式:Y=-0.01712X+6.05667;Y=logMW(Y为紫外吸收峰值,X为起峰时间)计算修饰蛋白起峰时间,从而收集高纯度的修饰蛋白。
1.8溶圈法验证修饰蛋白活性
用纤维蛋白平板溶圈法鉴定peg-SAK-cys的溶栓活性。配置纤维蛋白平板:将0.35g琼脂粉加入30mL 10mM的磷酸盐缓冲液(PH=7.0),加热融化至液体清亮无沉淀以及气泡,冷却混合液至35℃-40℃,迅速将350μL纤维蛋白原,170μL纤溶酶原,50μL 2M氯化钙加入混合液并混匀,后将10μL凝血酶加入混匀并倒入平板,将平板封口,并置于-4℃冰箱中静置1h。将冷凝后的凝胶通过打孔器打孔,将稀释后的peg-SAK-cys、野生型SAK以及尿激酶标准品加入孔中,置于37℃孵箱中孵育4h,测量比较平板上透明圈直径大小(图4)。以尿激酶的浓度与直径制作标准曲线,计算各样品的溶栓活性。
用BCA试剂盒测定各蛋白样品含量,用蛋白溶栓活性除以蛋白样品浓度计算出各样品比活性(表2)。比较各蛋白样品比活性的大小,结果显示SAK的溶栓活性为9.4×104IU/mg,与尿激酶标准品活性相当,peg-SAK-cys的活性为8.2×104IU/mg,仍保有相当的活性。
1.9血栓弹力图验证修饰蛋白活性
取正常人空腹静脉血4ml(用(3.8%(w/v))柠檬酸钠抗凝);分别取1ml血液添加稀释后的样品(10μl 200nmol/L)并孵育5min;取该混合溶液340μl,倒入含有CaCl2(200mmol/L)的检测杯内,通过血栓弹性图仪Thrombelastograph Analyzer TEG-5000对各项指标进行测定,包括:a.凝血反应时间(reactiontime,R);b.细胞凝集块形成时间(kineticsof clot development,K);c.血细胞凝集块形成速率(α角);d.最大血块强度(MA);e.血凝块稳定形成后30分钟内血栓溶解的比例(LY30%)。其中LY30%作为直接关联纤溶活性的指标,能较为直观的反应野生型SAK与peg-SAK-cys溶栓活性。
凝血功能相关指标R、K、angle、MA提示所用人血液凝血功能处于正常水平;LY30%作为检测样品溶栓活性的主要指标是血凝块稳定形成后三十分钟内溶解的百分比值,结果提示野生型SAK在血凝块稳定形成后三十分钟内能够将血栓溶解67.5%,而进行聚乙二醇修饰后的peg-SAK-cys可将血栓溶解41.5%(表2),这表明了在给予血栓模型等量的样品条件下,SAK的溶栓活性要高于peg-SAK-cys,但peg-SAK-cys仍保留了相当的溶栓活性。亦即,peg-SAK-cys的溶栓活性高达野生型SAK溶栓活性的62%。
表2血栓弹力图实验结果
1.10酶联免疫吸附验证修饰蛋白的免疫原性
取18g-23g雄性BALB/C小鼠15只(IVC级,重庆医科大学动物实验中心),随机分为野生型SAK,peg-SAK-cys组,生理盐水阴性对照3组,每组5只;于第0天,第4,11,18天,注射样品300ug/kg,于第20天以眼眶取血的方式收取小鼠血液并4000rpm/10min的条件低速离心,静止6h收取上清液。将SAK蛋白稀释至3ug添入酶标版,用ELISA法检测蛋白免疫原性,每组检测重复两次。
统计学处理:酶联免疫结果通过SPSS 17.0统计分析软件进行处理,其结果比较通过LSD-t法,检验水准α=0.05。
使用酶联免疫吸附试验测定peg-SAK-cys的免疫原性。结果经t检验如图(图5)显示,野生型的SAK组在BALB/C小鼠中诱导出较高的抗SAK-igG蛋白水平,而peg-SAK-cys组的抗SAK-igG蛋白相较野生型的SAK组有了明显下降(1:500稀释组检测结果显示吸光值均过高,而1:2000、1:4000稀释组的稀释比例较大,同样影响了吸光值的检测,组间差异过小不明显,此三组P>0.05;仅1:1000稀释组稀释比例合适,p=0.0002,检测结果有统计学差异),这表明使用聚乙二醇修饰SAK成功降低了SAK的免疫原性。亦即,使用聚乙二醇修饰SAK,使得SAK的免疫原性大概降低了1.5倍。
综上所述,本发明选取了巯基这一反应效率高、条件温和的侧链基团作为SAK聚乙二醇修饰的位点。由于野生型SAK蛋白本身不含游离巯基,因此,采用了定点突变技术,将远离蛋白功能区的82号氨基酸突变为半胱氨酸,从而成功的对SAK-cys进行了聚乙二醇修饰。修饰完成的peg-SAK-cys通过碘染色时,钡离子与聚乙二醇分子结合形成可溶性的氧鎓离子复合物,然后该复合物与碘离子结合形成不溶性沉淀而使条带染色碘染色结果显示,聚乙二醇修饰剂成功与SAK-cys相结合。采用了纤维蛋白溶圈法以及血栓弹力图测验评价了peg-SAK-cys的活性。纤维蛋白溶圈法结果显示,经计算得出活性8.2×104IU/mg,略低于野生型的SAK,但仍保留有相当的溶栓能力。血栓弹力图的LY30%值(30分钟内血栓溶解比例)提示,在同等活性单位下,peg-SAK-cys的溶栓能力(41.7%)要低于野生型的SAK(67.5%),但仍保留有了相当的溶栓活性。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
SEQUENCE LISTING
<110> 重庆医科大学
<120> 聚乙二醇化葡激酶及其制备与应用
<130> 163804
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 41
<212> DNA
<213> Artificial
<220>
<223> S-cys-82-F
<400> 1
gttgtcgtgg tacccggttt aatcggaaat tcaacataat g 41
<210> 2
<211> 40
<212> DNA
<213> Artificial
<220>
<223> S-cys-82-R
<400> 2
ccgattaaac cgggtaccac gacaaccaaa gaaaaaatcg 40
<210> 3
<211> 20
<212> DNA
<213> Artificial
<220>
<223> 引物
<400> 3
taatacgact cactataggg 20
<210> 4
<211> 19
<212> DNA
<213> Artificial
<220>
<223> 引物
<400> 4
gctagttatt gctcagcgg 19
<210> 5
<211> 525
<212> DNA
<213> Artificial
<220>
<223> 突变后的SAK的核苷酸编码序列
<400> 5
atgctgaaac gctctctgct gttcctgacg gtgctgctgc tgctgttctc attctcctcc 60
attaccaacg aagtctccgc ctcctcaagt ttcgataaag gcaaatacaa aaaaggtgat 120
gacgcctcct atttcgaacc gaccggcccg tacctgatgg ttaacgtcac gggcgtggac 180
agcaagggta atgaactgct gtctccgcat tatgttgaat ttccgattaa accgggtacc 240
acgacaacca aagaaaaaat cgaatattac gtcgaatggg cactggatgc gacggcctac 300
aaagaattcc gtgtggttga actggatccg tctgctaaaa tcgaagttac ctactacgac 360
aaaaacaaga aaaaagaaga aaccaaatca tttccgatca cggaaaaagg cttcgtcgtg 420
ccggatctgt cggaacacat taaaaacccg ggcttcaacc tgattacgaa agtggtcatc 480
gaaaagaaat aactcgagca ccaccaccac caccactgag atccg 525
<210> 6
<211> 163
<212> PRT
<213> Artificial
<220>
<223> 突变后的SAK的氨基序列
<400> 6
Met Leu Lys Arg Ser Leu Leu Phe Leu Thr Val Leu Leu Leu Leu Phe
1 5 10 15
Ser Phe Ser Ser Ile Thr Asn Glu Val Ser Ala Ser Ser Ser Phe Asp
20 25 30
Lys Gly Lys Tyr Lys Lys Gly Asp Asp Ala Ser Tyr Phe Glu Pro Thr
35 40 45
Gly Pro Tyr Leu Met Val Asn Val Thr Gly Val Asp Ser Lys Gly Asn
50 55 60
Glu Leu Leu Ser Pro His Tyr Val Glu Phe Pro Ile Lys Pro Gly Thr
65 70 75 80
Thr Thr Thr Lys Glu Lys Ile Glu Tyr Tyr Val Glu Trp Ala Leu Asp
85 90 95
Ala Thr Ala Tyr Lys Glu Phe Arg Val Val Glu Leu Asp Pro Ser Ala
100 105 110
Lys Ile Glu Val Thr Tyr Tyr Asp Lys Asn Lys Lys Lys Glu Glu Thr
115 120 125
Lys Ser Phe Pro Ile Thr Glu Lys Gly Phe Val Val Pro Asp Leu Ser
130 135 140
Glu His Ile Lys Asn Pro Gly Phe Asn Leu Ile Thr Lys Val Val Ile
145 150 155 160
Glu Lys Lys
- 还没有人留言评论。精彩留言会获得点赞!