一种干细胞制剂及其制备方法和应用与流程
本发明涉及生物治疗领域,特别涉及一种干细胞制剂及其制备方法和应用。
背景技术:
:间充质干细胞是多能干细胞的一种,具有多向分化的潜能,在体外诱导的条件下可以分化为肌肉、神经、骨、软骨、脂肪、心肌和类肝组织等多种组织和细胞。在长期传代后仍然具有增殖复制能力,是一种理想的组织器官工程的种子细胞。目前在临床上也有越来越多的人使用间充质干细胞应用于组织器官的修复和免疫系统调节。淋巴细胞(lymphocyte)也称淋巴球,是白细胞的一种,由淋巴器官产生,是机体免疫应答功能的重要细胞成分。淋巴细胞包括T细胞、B细胞和NK细胞等亚类,分别介导机体的细胞免疫、体液免疫和对肿瘤细胞和病毒感染细胞的杀伤作用等免疫学功能。由于肝硬化患者体内免疫功能亢进,间充质干细胞回输后仅能维持较短时间,需要频繁回输以达到治疗目的,并且在很多情况下并不能控制病情发展,治疗效果有限。因此,研究一种对肝硬化具有良好疗效的间充质干细胞制剂是本领域技术人员需要解决的技术问题。技术实现要素:有鉴于此,本发明公开了一种干细胞制剂及其制备方法和应用,所述干细胞制剂对肝硬化有良好的疗效。本发明公开了一种干细胞制剂,包括:间充质干细胞制剂和免疫细胞制剂;所述间充质干细胞制剂包括:间充质干细胞、白蛋白和溶剂;所述免疫细胞制剂包括:免疫细胞和溶剂。在本发明的一些技术方案中,所述间充质干细胞的含量为1×105~1×107个/ml。优选地,所述间充质干细胞的含量为1×106个/ml。在本发明的一些技术方案中,所述白蛋白含量为1%~8%(w/v)。优选地,所述白蛋白的含量为3%(w/v)。在本发明的一些技术方案中,所述免疫细胞的含量为1×105~1×107个/ml。优选地,所述免疫细胞的含量为5×106个/ml。优选地,所述免疫细胞为淋巴细胞。优选地,所述溶剂为生理盐水。本发明还公开了所述干细胞制剂的制备方法,包括以下步骤:a)、间充质干细胞、白蛋白和溶剂混合,得到所述间充质干细胞制剂;b)、免疫细胞和溶剂混合,得到所述免疫细胞制剂。优选地,所述间充质干细胞按照以下步骤获得:c1)、将骨髓进行离心分离,得到原代间充质干细胞;c2)、重悬所述原代间充质干细胞,进行培养;c3)、换液除去未贴壁细胞,加入培养基继续对所述原代间充质干细胞进行培养;c4)、对培养的细胞进行消化,得到所述间充质干细胞。优选地,所述免疫细胞按照以下步骤获得:d1)、将脐血进行离心分离,取中间白膜层;d2)、将所述白膜层接种到培养基中进行培养;d3)、收集培养的细胞,得到所述免疫细胞。本发明还公开了所述干细胞制剂或所述制备方法制得的干细胞制剂在制备治疗肝硬化药物中的应用。综上所述,本发明公开了一种干细胞制剂及其制备方法和应用,该干细胞制剂包括间充质干细胞制剂和免疫细胞制剂,通过将间充质干细胞制剂和免疫细胞制剂进行混合回输,可以诱导患者免疫耐受,从而使间充质干细胞不会受到免疫排斥,存活时间更长,效果维持的时间也更久,对肝硬化具有良好的疗效。附图说明图1示1周后实验组、对照组和对比例组的细胞数;图2示4周后实验组、对照组和对比例组的细胞数;图3示8周后实验组、对照组和对比例组的细胞数;图4示1周后实验组、对照组和对比例组的血清学检测结果;图5示4周后实验组、对照组和对比例组的血清学检测结果;图6示8周后实验组、对照组和对比例组的血清学检测结果。具体实施方式本发明公开了一种干细胞制剂及其制备方法和应用,该干细胞制剂能诱导患者免疫耐受,对肝硬化具有良好的疗效。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
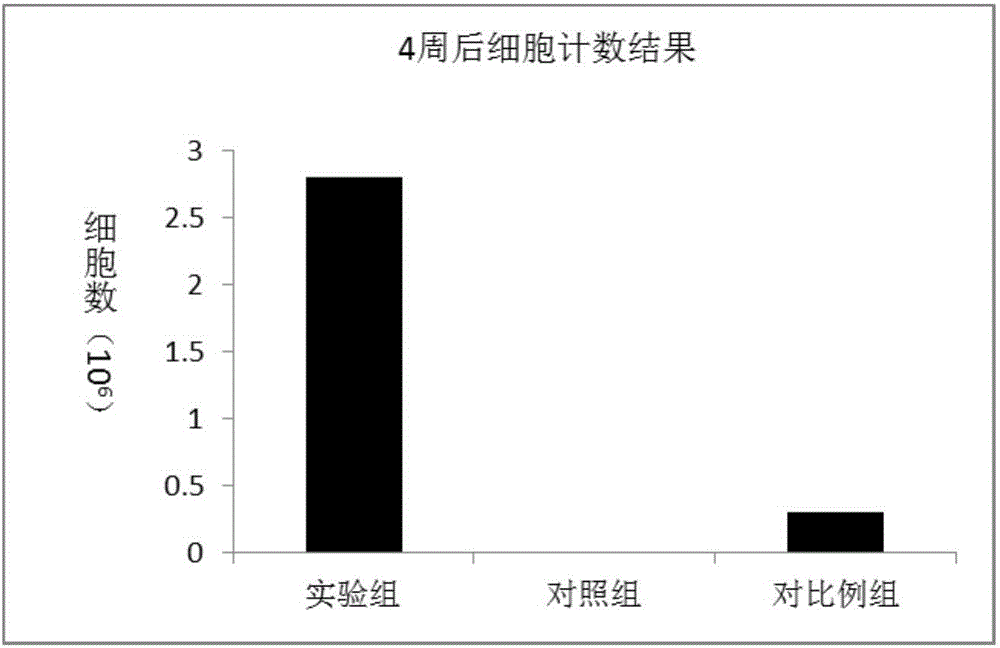
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明中所涉及原料均可由市场购得。其中,白蛋白购买自郑州莱士。下面结合实施例,进一步阐述本发明。实施例1间充质干细胞的分离培养和干细胞制剂的制备1、取无菌条件下抽取的小鼠骨髓10ml,加入等体积的DMEM-LG培养基(购买自gibco)稀释混匀后,1000r/min离心5min,去除上层的脂肪及上清;2、用含10%FBS和1×双抗的DMEM-F12培养基重悬细胞,并调整细胞密度为5×105/ml接种到15cm培养皿中,转移至5%CO2、37℃、饱和湿度为95%的CO2培养箱中培养;3、培养48h后换液除去未贴壁杂细胞,此后每隔2~3d换液1次;4、待细胞数达到1×108个后,将1/10细胞培养基体积的Hoechst染料溶液(购买自江苏凯基生物)加入细胞培养物中,在37℃培养细胞10~20分钟。5、弃去上清液,用PBS或合适的缓冲液洗细胞两次。加入8ml0.25%(质量体积比)的胰酶(购买自sigma)消化细胞;5、待细胞变圆松动后,加入两倍于胰酶体积的含10%FBS的DMEM-LG培养基终止消化;6、倒出细胞悬液,离心弃去上清,生理盐水清洗2遍,得到用于制备干细胞制剂的间充质干细胞(间充质干细胞表型鉴定为CD90+>95%,CD73+>95%,CD105+>95%,CD45+<0.2%,CD34+<0.2%);7、用含有3%白蛋白的生理盐水重悬步骤6制备的间充质干细胞,使细胞密度为5×106个/ml,制成干细胞制剂注射液。实施例2免疫细胞的分离培养和免疫细胞制剂的制备1、取10ml脐血,添加等体积的生理盐水稀释,稀释液添加至Ficoll分离液(按照稀释后的脐血体积的三分之一添加Ficoll分离液),700g离心20-30min,升降速降为零,吸取中间白膜层;2、将白膜层用生理盐水清洗两遍,对白膜层的细胞进行计数,根据计数结果加入含有10%FBS、20ng/mlIL-2的1640培养基,调整接种密度为1×106个/ml,放入5%CO2、37℃培养箱中培养;3、之后按照细胞数量补充含有10%FBS、20ng/mlIL-2的1640培养基,保持细胞密度在1×106个/ml;5、收集培养到14天的免疫细胞(流式鉴定为CD3+和CD56+>40%)用生理盐水重悬细胞密度为5×106个/ml,总共需要1ml的细胞悬液。实施例3动物试验将购买自广东省医学动物实验中心的肝硬化模型的36只昆明小鼠分为三组。组1为治疗组,治疗组用实施2制备的免疫细胞制剂0.2ml每次、多点注射(每次注射0.2ml,是注射5次共1ml)于小鼠的皮下,总共注射1ml。24小时后通过尾静脉注射1ml实施例1制备的干细胞制剂,每天注射一次,连续注射3天。组2为对照组,对照组用生理盐水0.2ml每次、多点注射于小鼠的皮下,总共注射1ml。24小时后通过尾静脉注射1ml生理盐水,每天注射一次,连续注射3天。组3为对比例组,通过尾静脉注射实施例1制备的干细胞制剂1ml,每天注射一次,连续注射3天。在治疗后1周、4周、8周每组各随机选取2只小鼠,抽血通过Elisa试剂盒检测AST、ALT指标(试剂盒购买自南京金益柏生物科技有限公司),然后处死取肝部组织制作石蜡切片,荧光显微镜下观察计数Hoechst荧光染料在该部位的细胞染色情况。1周后细胞数见表1、图1;4周后细胞数见表2、图2;8周后细胞数见表3、图3;1周后血清学检测结果见表4、图4;4周后血清学检测结果见表5、图5;8周后血清学检测结果见表6、图6。表11周后细胞数(106)实验组4.2**##对照组0对比例组2.2***示与对照组相比具有显著差异(P<0.05);**示与对照组相比具有极显著差异(P<0.01);#示与对比例组相比具有显著差异(P<0.05);##示与对照组相比具有极显著差异(P<0.01);1周后的实验组细胞数为4.2×106,而对照组为0,实验组明显多于对照组和对比例组,具有极显著差异(P<0.01),说明1周后体内存留的细胞数,实验组极显著大于对照组。表24周后细胞数(106)实验组2.8**##对照组0对比例组0.3***示与对照组相比具有显著差异(P<0.05);**示与对照组相比具有极显著差异(P<0.01);#示与对比例组相比具有显著差异(P<0.05);##示与对照组相比具有极显著差异(P<0.01);4周后的实验组细胞数为2.8×106,而对照组为0,实验组明显多于对照组和对比例组,具有极显著差异(P<0.01),说明4周后体内存留的细胞数,实验组极显著大于对照组和对比例组。表38周后细胞数(106)实验组1.5**##对照组0对比例组0*示与对照组相比具有显著差异(P<0.05);**示与对照组相比具有极显著差异(P<0.01);#示与对比例组相比具有显著差异(P<0.05);##示与对照组相比具有极显著差异(P<0.01);8周后的实验组细胞数为1.5×106,而对照组为0,实验组明显多于对照组和对比例组,具有极显著差异(P<0.01),说明8周后体内存留的细胞数,实验组极显著大于对照组和对比例组。表4*示与对照组相比具有显著差异(P<0.05);**示与对照组相比具有极显著差异(P<0.01);#示与对比例组相比具有显著差异(P<0.05);##示与对照组相比具有极显著差异(P<0.01);ALT和AST是检测肝功能的两项指标,数值的正常范围在0-40之间,在肝功能受损的情况下数值会升高,并且数值越高,表明肝功能受损越严重。从数据中可以得出实验组的肝功能水平要好于对照组合对比例组,而对比例组又要好于对照组,且均具有极显著差异(P<0.01)。表5*示与对照组相比具有显著差异(P<0.05);**示与对照组相比具有极显著差异(P<0.01);#示与对比例组相比具有显著差异(P<0.05);##示与对照组相比具有极显著差异(P<0.01);从数据中可以得出实验组的肝功能水平要好于对照组合对比例组,而对比例组又要好于对照组,且均具有极显著差异(P<0.01)。表6*示与对照组相比具有显著差异(P<0.05);**示与对照组相比具有极显著差异(P<0.01);#示与对比例组相比具有显著差异(P<0.05);##示与对照组相比具有极显著差异(P<0.01);从数据中可以得出实验组的肝功能水平要好于对照组合对比例组,而对比例组又要好于对照组,且均具有极显著差异(P<0.01)。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1