免疫耐受诱导剂的制作方法
技术领域
本发明涉及免疫耐受诱导剂,更详细而言,涉及适用于调节性树突状细胞的诱导、过敏性疾病、自身免疫性疾病等的免疫耐受诱导剂,其含有5-氨基乙酰丙酸(ALA)或其衍生物或它们的盐。本发明的免疫耐受诱导剂不仅可用于诱导调节性树突状细胞,并且还可用于对过敏性疾病、自身免疫性疾病等由不必要的免疫反应所引起的疾病的治疗或预防。
背景技术:
所谓免疫耐受,是指免疫系统对可能成为抗原的物质不进行攻击的状态。其包括:对于自身抗原不发生通常的免疫应答的“自身耐受”、和即使在非自身抗原的情况下也能通过一定的施予条件而诱导出的“获得性耐受”。可以认为,非自身抗原的情况下,涉及由调节性T细胞进行的主动抑制。关于针对其需要有免疫耐受性的疾病(例如过敏性疾病、自身免疫性疾病等),可作为对非自身或自身的免疫学无反应性发生崩溃的现象而被认知。
树突状细胞是具有树状突起的、系统标志物阴性且MHC II类阳性的抗原呈递细胞,其由造血干细胞经髓细胞(myeloid)系、淋巴细胞系分化途径分化成未成熟树突状细胞、进而成为成熟树突状细胞,树突状细胞作为分化体系、成熟阶段不同的多种多样的亚群而广泛存在于末梢非淋巴组织和淋巴组织中。在稳定状态(非炎症状态)下,未成熟树突状细胞占大部分,介由抗原呈递(可给予弱的抗原刺激和共刺激)而针对初始T细胞诱导克隆清除或不活化,同时诱导扩增具有免疫抑制能力的各种调节性T细胞。因此,一般认为未成熟树突状细胞介由对上述T细胞功能调节机制所参与的免疫耐受的诱导而在免疫恒常性的维持方面发挥着重要的作用。另一方面,在被微生物、病毒、异物等外来抗原侵入的炎症状态下,捕食了这些外来抗原的未成熟树突状细胞由于炎症刺激而分化成成熟树突状细胞。成熟树突状细胞(其作为最强的抗原呈递细胞)向初始T细胞给予抗原刺激和共刺激,分化诱导出抗原特异性效应T细胞从而诱导免疫应答。此外,调节性树突状细胞(有时也被称为耐受原性树突状细胞)作为在炎症状态下也能显示强的免疫耐受诱导能力的抗原呈递细胞而为人所知。
关于调节性树突状细胞,已知有下述技术,所述技术涉及:在体外将人树突状细胞或其祖细胞与至少包含IL-10及TGF-β的细胞因子类一起培养、从而诱导人免疫调节性树突状细胞的方法,通过该方法得到的人免疫调节性树突状细胞,以及包含该人免疫调节性树突状细胞的医药组合物(参见专利文献1);一种制作耐受原性树突状细胞的方法(包括将经分离的树突状细胞与足够使该树突状细胞感染的量的多核体呼吸器官病毒在下述引起细胞表面CD80high、CD86high、CD40high及CD83low的细胞表面表达的条件下进行孵育的工序)(参见专利文献2);以及包含调节性树突状细胞的、预防或治疗由炎性细胞因子的过量分泌所诱导的疾病(败血症等)的药剂、IL-10产生促进剂、细胞凋亡抑制剂等(参见专利文献3)。
ALA作为广泛存在于动物、植物和菌类中的四吡咯生物合成途径的中间体而为人所知,其通常由5-氨基乙酰丙酸合成酶从琥珀酰CoA和甘氨酸而被生物合成。还开发了使用ALA的光线力学疗法或光动力学治疗(以下也称为“ALA-PDT”),其作为侵入性低且能保持QOL的治疗方法而受到关注,报道了使用ALA等的肿瘤诊断·治疗剂等。此外,还已知ALA作为成人病、癌症、男性不育的预防改善剂或治疗剂是有用的(参见例如专利文献4~6)。
现有技术文献
专利文献
专利文献1:日本特开2004-298181号公报
专利文献2:日本特表2011-522837号公报
专利文献3:日本特开2006-290761号公报
专利文献4:国际公开WO2010/050179
专利文献5:日本特开2011-16753号公报
专利文献6:国际公开WO2009/139156
技术实现要素:
本发明的课题在于提供调节性树突状细胞的诱导剂,其安全并且与以往的药剂的作用机理不同,可应用于治疗免疫性疾病,本发明还提供过敏性疾病的预防·治疗剂、自身免疫性疾病的预防·治疗剂等免疫耐受诱导剂。
本申请的发明人不断进行着与ALA的医疗应用相关的各种各样的研究,发现了ALA单独、或含有ALA类和作为铁离子供给源的柠檬酸亚铁钠(SFC)等铁化合物的组合物具有诱导调节性树突状细胞的作用、过敏性疾病预防·治疗作用及自身免疫性疾病预防·治疗作用。
此外,还发现了铁化合物与ALA共同作用从而增强诱导调节性树突状细胞的作用、过敏性疾病预防·治疗作用及自身免疫性疾病预防·治疗作用。存在充足的铁化合物的情况、或通过其他途径摄取铁化合物的情况下,有时单独施予ALA也没有问题。日本人的红肉摄入量比其它各国少,因此,矿物质中,铁在日本人中很容易缺乏。因此,虽然在以日本人为对象中的一些实施例同时添加了铁,但在将储存铁充足的人作为对象的情况下则不必要。此外,ALA代谢为卟啉、通过光照射而显示PDT、PDD活性已广为人知,但本发明的诱导调节性树突状细胞的方法、过敏性疾病的预防·治疗方法和自身免疫性疾病的预防·治疗方法并不需要光。
本申请的发明人进一步对施予方法和施予量反复进行了锐意研究,确立了将ALA类单独、或ALA类和铁化合物作为有效成分的免疫耐受诱导剂,从而完成了本发明。
即,本发明如下所述。
[1]免疫耐受诱导剂,含有下述式(I)所示的化合物或其盐,
式(I)中,R1表示氢原子或酰基,R2表示氢原子、直链或支链烷基、环烷基、芳基或芳烷基。
[2]上述[1]所述的免疫耐受诱导剂,其特征在于,R1及R2为氢原子。
[3]上述[1]或[2]所述的免疫耐受诱导剂,其特征在于,还含有铁化合物。
[4]上述[3]所述的免疫耐受诱导剂,其特征在于,铁化合物为选自氯化铁、三氧化二铁、硫酸铁、焦磷酸亚铁、柠檬酸亚铁、柠檬酸铁钠、柠檬酸亚铁钠、柠檬酸铁铵、焦磷酸铁、乳酸铁、葡萄糖酸亚铁、二亚乙基三胺五乙酸铁钠、二亚乙基三胺五乙酸铁铵、乙二胺四乙酸铁钠、乙二胺四乙酸铁铵、二羧基甲基谷氨酸铁钠、二羧基甲基谷氨酸铁铵、富马酸亚铁、乙酸铁、草酸铁、琥珀酸亚铁、琥珀酸柠檬酸铁钠、血红素铁、右旋糖酐铁、三亚乙基四胺铁、乳铁蛋白铁、转铁蛋白铁、叶绿素铁钠、铁蛋白铁、含糖氧化铁、及硫化甘氨酸铁中的一种或两种以上的化合物。
[5]上述[3]所述的免疫耐受诱导剂,其特征在于,铁化合物为柠檬酸亚铁钠。
[6]上述[1]~[5]中任一项所述的免疫耐受诱导剂,其特征在于,适用于调节性树突状细胞的诱导。
[7]上述[1]~[5]中任一项所述的免疫耐受诱导剂,其特征在于,适用于过敏性疾病。
[8]上述[7]所述的免疫耐受诱导剂,其特征在于,过敏性疾病为特应性皮炎。
[9]上述[1]~[5]中任一项所述的免疫耐受诱导剂,其特征在于,适用于自身免疫性疾病。
[10]上述[9]所述的免疫耐受诱导剂,其特征在于,自身免疫性疾病为硬皮病。
[11]诱导免疫耐受的方法,其特征在于,向对象施予上述[1]~[10]中任一项所述的免疫耐受诱导剂。
[12]诱导调节性树突状细胞的方法,其特征在于,向对象施予上述[1]~[5]中任一项所述的免疫耐受诱导剂。
[13]诱导调节性树突状细胞的方法,其特征在于,用上述[1]~[5]中任一项所述的免疫耐受诱导剂及GM-CSF对从骨髓采集的细胞进行体外处理。
[14]经分离的调节性树突状细胞,其是采用上述[12]或[13]所述的方法诱导得到的。
[15]预防和/或治疗过敏性疾病的方法,其特征在于,向对象施予上述[1]~[5]中任一项所述的免疫耐受诱导剂。
[16]预防和/或治疗自身免疫性疾病的方法,其特征在于,向对象施予上述[1]~[5]中任一项所述的免疫耐受诱导剂。
[17]免疫耐受诱导试剂盒,包含:
a)下述式(I)所示的化合物或其盐,
式(I)中,R1表示氢原子或酰基,R2表示氢原子、直链或支链烷基、环烷基、芳基或芳烷基;
b)铁化合物。
[18]诱导免疫耐受的方法,其特征在于,向对象同时或先后施予下述物质:
a)下述式(I)所示的化合物或其盐,
式(I)中,R1表示氢原子或酰基,R2表示氢原子、直链或支链烷基、环烷基、芳基或芳烷基;
b)铁化合物。
[19]用于在体外诱导调节性树突状细胞的试剂盒,包含:
a)上述[1]~[5]中任一项所述的免疫耐受诱导剂;
b)GM-CSF。
[20]过敏性疾病预防·治疗剂的组合,所述组合包含:
a)上述[1]~[5]中任一项所述的免疫耐受诱导剂;
b)过敏性疾病治疗药。
[21]过敏性疾病预防·治疗剂的组合,所述组合包含:
a)下述式(I)所示的化合物或其盐,
式(I)中,R1表示氢原子或酰基,R2表示氢原子、直链或支链烷基、环烷基、芳基或芳烷基;
b)铁化合物;
c)过敏性疾病治疗药。
[22]自身免疫性疾病预防·治疗剂的组合,所述组合包含:
a)上述[1]~[5]中任一项所述的免疫耐受诱导剂;
b)自身免疫性疾病治疗药。
[23]自身免疫性疾病预防·治疗剂的组合,所述组合包含:
a)下述式(I)所示的化合物或其盐,
式(I)中,R1表示氢原子或酰基,R2表示氢原子、直链或支链烷基、环烷基、芳基或芳烷基;
b)铁化合物;
c)自身免疫性疾病治疗药。
作为上述发明的其他实施方式,可以举出以下实施方式。
[24]调节性树突状细胞的诱导剂,含有式(I)所示的化合物或其盐。
[25]上述[24]所述的调节性树突状细胞的诱导剂,其特征在于,还含有铁化合物。
[26]诱导调节性树突状细胞的方法,其特征在于,向对象施予上述[24]或[25]所述的调节性树突状细胞的诱导剂。
[27]用于在调节性树突状细胞的诱导中使用的式(I)所示的化合物或其盐。
[28]用于在调节性树突状细胞的诱导中使用的含有式(I)所示的化合物或其盐和铁化合物的组合物。
[29]式(I)所示的化合物或其盐在制备调节性树突状细胞的诱导剂中的应用。
[30]式(I)所示的化合物或其盐及铁化合物在制备调节性树突状细胞的诱导剂中的应用。
[31]过敏性疾病的预防和/或治疗剂,含有式(I)所示的化合物或其盐。
[32]上述[31]所述的过敏性疾病的预防和/或治疗剂,其特征在于,还含有铁化合物。
[33]预防和/或治疗过敏性疾病的方法,其特征在于,向对象施予上述[31]或[32]所述的过敏性疾病的预防和/或治疗剂。
[34]用于在对过敏性疾病的预防和/或治疗中使用的式(I)所示的化合物或其盐。
[35]用于在对过敏性疾病的预防和/或治疗中使用的含有式(I)所示的化合物或其盐和铁化合物的组合物。
[36]式(I)所示的化合物或其盐在制备过敏性疾病的预防和/或治疗剂中的应用。
[37]式(I)所示的化合物或其盐及铁化合物在制备过敏性疾病的预防和/或治疗剂中的应用。
[38]自身免疫性疾病的预防和/或治疗剂,含有式(I)所示的化合物或其盐。
[39]上述[38]所述的自身免疫性疾病的预防和/或治疗剂,其特征在于,还含有铁化合物。
[40]预防和/或治疗自身免疫性疾病的方法,其特征在于,向对象施予上述[38]或[39]所述的自身免疫性疾病的预防和/或治疗剂。
[41]用于在对自身免疫性疾病的预防和/或治疗中使用的式(I)所示的化合物或其盐。
[42]用于在对自身免疫性疾病的预防和/或治疗中使用的含有式(I)所示的化合物或其盐和铁化合物的组合物。
[43]式(I)所示的化合物或其盐在制备自身免疫性疾病的预防和/或治疗剂中的应用。
[44]式(I)所示的化合物或其盐及铁化合物在制备自身免疫性疾病的预防和/或治疗剂中的应用。
通过本发明的免疫耐受诱导剂,能够诱导可应用于治疗免疫性疾病的调节性树突状细胞。此外,通过本发明的免疫耐受诱导剂,能够进行对过敏性疾病的预防·治疗和对自身免疫性疾病的预防·治疗。由于本发明的免疫耐受诱导剂与以往的免疫抑制剂等的作用机理不同,因此,还可预期通过与现有药物联合使用能进一步提高效果。
附图说明
[图1]是表示树突状细胞特异性的表面标志物的表达结果的图。
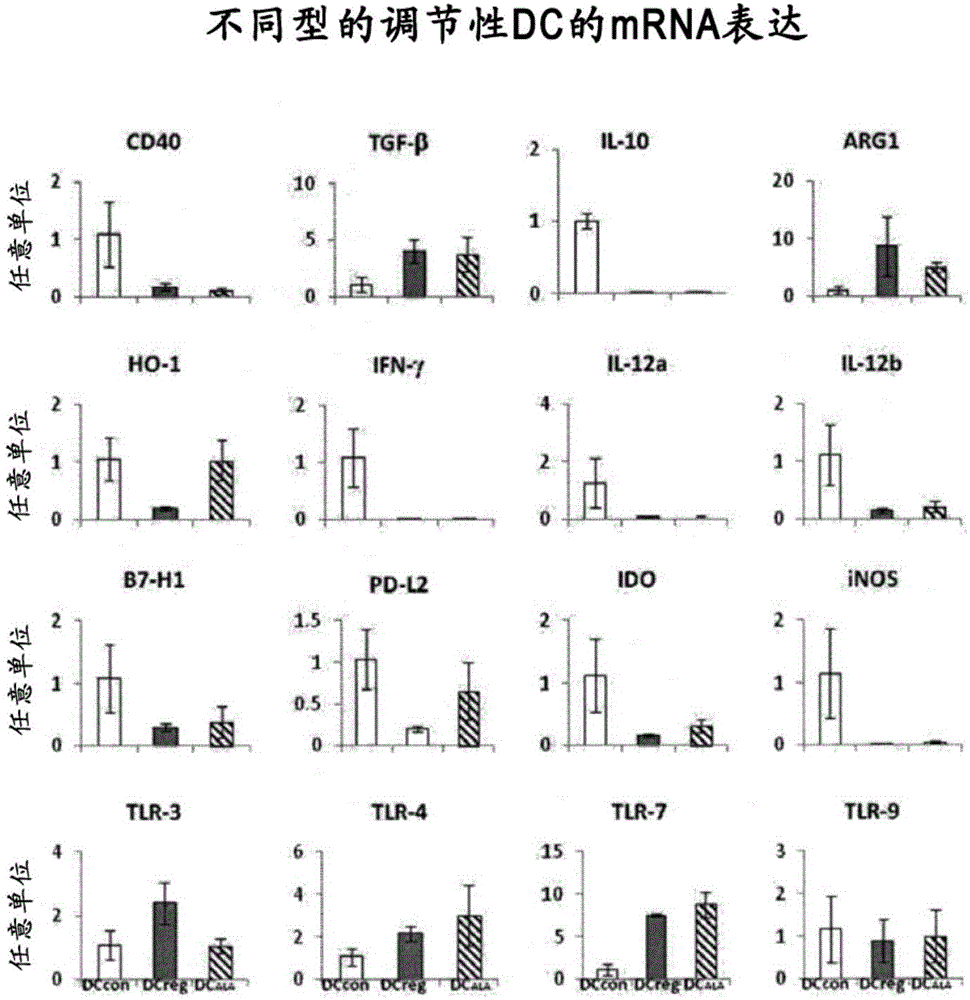
[图2]是表示树突状细胞特异性的免疫相关基因的表达结果的图。
[图3]是表示通过向从骨髓采集的细胞中添加ALA而诱导得到的树突状细胞(BM-DCALA)所产生的抑制效应T细胞增殖能力的效果的结果的图。
[图4]是表示BM-DCALA所产生的诱导调节性T细胞的能力的结果的图。
[图5]是表示BM-DCALA所产生的抑制效应T细胞增殖能力的效果的结果的图。
[图6]是表示单体BM-DCALA所产生的诱导调节性T细胞的能力的结果的图。
[图7]是表示本发明的免疫耐受诱导剂对特应性皮炎模型小鼠的症状改善效果的图。
[图8]是表示本发明的免疫耐受诱导剂对特应性皮炎模型小鼠的症状改善效果的照片。
[图9]是表示向硬皮病病态模型小鼠施予ALA而导致的对体重及存活时间的影响的图。
[图10]是表示ALA施予的情况下的硬皮病病态模型小鼠的外观的照片。
[图11]是表示对ALA施予的情况下的硬皮病病态模型小鼠的耳朵的HE染色切片的观察结果的图。
[图12]是表示对ALA施予的情况下的硬皮病病态模型小鼠的耳朵的Masson染色切片的观察结果的图。
[图13]是表示对ALA施予的情况下的硬皮病病态模型小鼠的皮肤的HE染色切片的观察结果的图。
[图14]是表示对ALA施予的情况下的硬皮病病态模型小鼠的皮肤的Masson染色切片的观察结果的图。
[图15]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肾脏·皮质周围的HE染色切片的观察结果的图。
[图16]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肾脏·皮质周围的Masson染色切片的观察结果的图。
[图17]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肾脏·髓质周围的HE染色切片的观察结果的图。
[图18]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肾脏·髓质周围的Masson染色切片的观察结果的图。
[图19]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肝脏的HE染色切片的观察结果的图。
[图20]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肝脏的Masson染色切片的观察结果的图。
[图21]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肺的HE染色切片的观察结果的图。
[图22]是表示对ALA施予的情况下的硬皮病病态模型小鼠的肺的Masson染色切片的观察结果的图。
[图23]是表示ALA施予的情况下的硬皮病病态模型小鼠的皮肤中的标志物基因的表达结果的图。
[图24]是表示ALA施予的情况下的硬皮病病态模型小鼠的脾脏中的标志物基因的表达结果的图。
[图25]是表示ALA施予的情况下的硬皮病病态模型小鼠的肾脏中的标志物基因的表达结果的图。
具体实施方式
本发明中所谓“免疫耐受的诱导”,是指对由ALA类或ALA类和铁化合物诱导产生的、对特定的抗原的免疫反应的抑制状态,即,诱导免疫反应水平的下降、免疫反应的发生或发展的延迟、和/或免疫反应所产生的风险的降低,作为本发明的免疫耐受诱导剂,只要含有上述式(I)所示的化合物或其盐(以下,有时也将它们统称为“ALA类”)作为有效成分即可,没有特别限定,优选地,除ALA类以外还含有铁化合物。通过将上述本发明的免疫耐受诱导剂、特别是含有ALA类和铁化合物的免疫耐受诱导剂施予至人、以及家畜·家禽类、宠物等对象,除了能够进行对免疫耐受的诱导和对调节性树突状细胞的诱导以外,还能够进行对过敏性疾病的预防和/或治疗、和对自身免疫性疾病的预防和/或治疗。需要说明的是,有时分别将本发明的免疫耐受诱导剂和免疫耐受诱导试剂盒称为“调节性树突状细胞诱导剂”和“用于在体外诱导调节性树突状细胞的试剂盒”(适用于调节性树突状细胞的诱导的情况下)、“过敏性疾病预防和/或治疗剂”和“过敏性疾病预防和/或治疗试剂盒”(适用于过敏性疾病的情况下)、“自身免疫性疾病预防和/或治疗剂”和“自身免疫性疾病预防和/或治疗试剂盒”(适用于自身免疫性疾病的情况下)。
作为本发明的免疫耐受诱导试剂盒,只要是以分开的药剂的形式含有ALA类和铁化合物作为有效成分的、可用于诱导免疫耐受的用途的试剂盒,则没有特别限定,使用所述免疫耐受诱导试剂盒的话,能够进行针对人、以及家畜·家禽类和宠物等对象的对免疫耐受的诱导、对调节性树突状细胞的诱导、对过敏性疾病的预防和/或治疗、对自身免疫性疾病的预防和/或治疗。
本发明中所谓“调节性树突状细胞”,只要是由ALA类或ALA类和铁化合物诱导产生的、具有诱导调节性T细胞(其为具有抑制可引起组织抑制的T细胞的活性的作用的调节性T细胞;例如CD4+CD25+Foxp3+调节性T细胞)的能力的与免疫耐受有关的树突状细胞的亚群即可,没有特别限定,可以是来自作为治疗对象的患者的细胞,也可以是来自患者以外的来源的细胞,但优选来自患者的细胞。本发明的调节性树突状细胞可通过例如使用免疫耐受诱导剂及GM-CSF对从骨髓采集的细胞进行体外处理来诱导·分离。
关于本发明的用于在体外诱导调节性树突状细胞的试剂盒,其包含上述本发明的免疫耐受诱导剂和GM-CSF,通常附有记载了用于在体外诱导调节性树突状细胞的内容的说明书。
作为上述过敏性疾病,可以举出特应性皮炎、过敏性鼻炎、过敏性结膜炎、支气管哮喘、花粉症、过敏性胃肠炎、食物过敏、荨麻疹等。通过例如使用特应性皮炎模型小鼠的下文所述实施例5中记载的实验,可确认本发明的过敏性疾病预防和/或治疗剂对于特应性皮炎的治疗是有效的。作为本发明的过敏性疾病预防和/或治疗剂,通常使用特别是含有ALA类和铁化合物的药剂。
作为上述自身免疫性疾病,可以举出类风湿性关节炎、系统性红斑狼疮、盘状红斑狼疮、多发性肌炎、硬皮病、混合结缔组织病、桥本甲状腺炎、原发性粘液性水肿、甲状腺毒症(thyrotoxicosis)、恶性贫血、肺出血-肾炎(Good-pasture)综合征、急进型肾小球肾炎、重症肌无力、寻常型天疱疮、水疱型类天疱疮、胰岛素拮抗性糖尿病(insulin resistant diabetes)、幼年型糖尿病、阿狄森氏病(Addison’s disease)、萎缩性胃炎、男性不育症、早发更年期(climacterium precox)、晶状体诱发性葡萄膜炎、交感性脉炎、多发性硬化症、溃疡性结肠炎、原发性胆汁性肝硬化、慢性活动性肝炎、自身免疫性溶血性贫血、阵发性睡眠性血红蛋白尿症、特发性血小板减少性紫癜、舍格伦综合征等。通过例如使用硬皮病模型小鼠的实验,可确认本发明的自身免疫性疾病预防和/或治疗剂对于硬皮病的治疗是有效的。
作为本发明的过敏性疾病预防·治疗剂的组合,只要是上文所述本发明的过敏性疾病预防和/或治疗剂与过敏性疾病治疗药的组合、或ALA类和铁化合物与过敏性疾病治疗药的组合,则没有特别限定,通过施予所述组合,能够预防和/或治疗过敏性疾病。作为上述过敏性疾病治疗药,可以举出曲尼司特(Tranilast)、富马酸氯马斯汀(Clemastine fumarate)、盐酸赛庚啶(Cyproheptadine hydrochloride)、苯海拉明(Diphenhydramine)、三聚氰胺(Melamine)、克立咪唑(Clemizole)、甲氧那明(Methoxyphenamine)等药品。本发明的过敏性疾病预防和/或治疗剂、和过敏性疾病预防和/或治疗试剂盒与现有的过敏性疾病治疗药的作用机理不同,因此,使用本发明的过敏性疾病预防·治疗剂的组合的话,可预期加合效果,根据情况可预期协同效果。
作为本发明的自身免疫性疾病的预防·治疗剂的组合,只要是上述本发明的自身免疫性疾病的预防和/或治疗剂与自身免疫性疾病治疗药的组合、或ALA类和铁化合物与自身免疫性疾病治疗药的组合,则没有特别限定,通过施予所述组合,能够预防和/或治疗自身免疫性疾病。作为上述自身免疫性疾病治疗药,可以举出皮质类固醇(Corticosteroid)、环磷酰胺(Cyclophosphamide)、他克莫司(Tacrolimus)、吗替麦考酚酯(Mycophenolate mofetil)、抗细胞因子单克隆抗体(anti-cytokine monoclonal antibody)、干扰素-β(Interferon-β)、共聚物-1(Copolymer-1)、柳氮磺吡啶(Sulfasalazine)、羟基氯喹(Hydroxychloroquine)、路弗龙胺(Leuflonamide)、强的松(Prednisone)、TNF-α拮抗剂(TNF-αantagonist)、依那西普(Etanercept)、英夫利昔单抗(Infliximab)等药品。本发明的自身免疫性疾病的预防和/或治疗剂、和自身免疫性疾病的预防和/或治疗试剂盒与现有的自身免疫性疾病治疗药的作用机理不同,因此,使用本发明的自身免疫性疾病的预防·治疗剂的组合的话,可预期加合效果,根据情况可预期协同效果。
作为可用作本发明的免疫耐受诱导剂的有效成分的化合物,可以举出式(I)所示的化合物或其盐(以下,有时也将它们统称为“ALA类”)。亦被称为δ-氨基乙酰丙酸的ALA是式(I)的R1及R2均为氢原子的情况,是一种氨基酸。作为ALA衍生物,可以举出下述ALA以外的化合物,其中,式(I)的R1为氢原子或酰基,式(I)的R2为氢原子、直链或支链烷基、环烷基、芳基或芳烷基。
上述ALA类中,可优选举出式(I)的R1及R2均为氢原子时的ALA或其盐。ALA是一种亦被称为δ-氨基乙酰丙酸的氨基酸。此外,作为ALA衍生物,可以举出下述ALA以外的化合物,其中,式(I)的R1为氢原子或酰基,式(I)的R2为氢原子、直链或支链烷基、环烷基、芳基或芳烷基。
作为式(I)中的酰基,可以举出甲酰基、乙酰基、丙酰基、丁酰基、异丁酰基、戊酰基、异戊酰基、特戊酰基、己酰基、辛酰基、苄基羰基等直链或支链的碳原子数为1~8的烷酰基,苯甲酰基、1-萘甲酰基、2-萘甲酰基等碳原子数为7~14的芳酰基。
作为式(I)中的烷基,可以举出甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、新戊基、己基、庚基、辛基等直链或支链的碳原子数为1~8的烷基。
作为式(I)中的环烷基,可以举出环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环十二烷基、1-环己烯基等饱和或可存在一部分不饱和键的、碳原子数为3~8的环烷基。
作为式(I)中的芳基,可以举出苯基、萘基、蒽基、菲基等碳原子数为6~14的芳基。
作为式(I)中的芳烷基,其芳基部分可与上述芳基同样地进行例示,烷基部分可与上述烷基同样地进行例示,具体而言,可以举出苯基甲基、苯基乙基、苯基丙基、苯基丁基、二苯基甲基、三苯基甲基、萘基甲基、萘基乙基等碳原子数为7~15的芳烷基。
作为上述ALA衍生物,R1为甲酰基、乙酰基、丙酰基、丁酰基等的化合物、上述R2为甲基、乙基、丙基、丁基、戊基等的化合物是优选的,对于上述R1和R2的组合,可优选举出甲酰基和甲基、乙酰基和甲基、丙酰基和甲基、丁酰基和甲基、甲酰基和乙基、乙酰基和乙基、丙酰基和乙基、丁酰基和乙基的组合等。
ALA类只要在生物体内以式(I)的ALA或其衍生物的状态作为有效成分而发挥作用即可,可以根据施予的形态以用于提高溶解性的各种盐、酯或可被生物体内的酶分解的前药(前体)的形式施予。例如,作为ALA及其衍生物的盐,可以举出药理学上容许的酸加成盐、金属盐、铵盐、有机胺加成盐等。作为酸加成盐,可以举出例如盐酸盐、氢溴酸盐、氢碘酸盐、磷酸盐、硝酸盐、硫酸盐等各种无机酸盐,甲酸盐、乙酸盐、丙酸盐、甲苯磺酸盐、琥珀酸盐、草酸盐、乳酸盐、酒石酸盐、乙醇酸盐、甲磺酸盐、丁酸盐、缬草酸盐、柠檬酸盐、富马酸盐、马来酸盐、苹果酸盐等各有机酸加成盐。作为金属盐,可以举出锂盐、钠盐、钾盐等各种碱金属盐,镁、钙盐等各种碱土金属盐,铝、锌等的各金属盐。作为铵盐,可以举出铵盐、四甲基铵盐等的烷基铵盐等。作为有机胺盐,可以举出三乙胺盐、哌啶盐、吗啉盐、甲苯胺盐等各种盐。需要说明的是,上述盐也可以在使用时作为溶液而使用。
上述ALA类中,优选的是ALA及ALA甲酯、ALA乙酯、ALA丙酯、ALA丁酯、ALA戊酯等各种酯类、以及它们的盐酸盐、磷酸盐、硫酸盐,可特别优选举出ALA盐酸盐和ALA磷酸盐。
上述ALA类可以通过化学合成、利用微生物的生产、利用酶的生产中的任意已知方法来制造。此外,上述ALA类可以形成水合物或溶剂合物,也可以单独使用任一种或适当组合两种以上使用。
作为上述铁化合物,为有机盐、无机盐均可,作为无机盐,可以举出氯化铁、三氧化二铁、硫酸铁、焦磷酸亚铁,作为有机盐,可以举出羧酸盐(例如作为羟基羧酸盐的、柠檬酸亚铁、柠檬酸铁钠、柠檬酸亚铁钠、柠檬酸铁铵等柠檬酸盐)、有机酸盐(焦磷酸铁、乳酸铁、葡萄糖酸亚铁、二亚乙基三胺五乙酸铁钠、二亚乙基三胺五乙酸铁铵、乙二胺四乙酸铁钠、乙二胺四乙酸铁铵、二羧基甲基谷氨酸铁钠、二羧基甲基谷氨酸铁铵、富马酸亚铁、乙酸铁、草酸铁、琥珀酸亚铁、琥珀酸柠檬酸铁钠等)、血红素铁、右旋糖酐铁、三亚乙基四胺铁、乳铁蛋白铁、转铁蛋白铁、叶绿素铁钠、铁蛋白铁、含糖氧化铁、硫化甘氨酸铁,其中,优选柠檬酸亚铁钠和柠檬酸铁钠。
上述铁化合物可以各自单独使用,也可以混合使用两种以上。作为铁化合物的施予量,相对于ALA类的施予量(以ALA换算)而言的摩尔比可以是0.01~100倍,优选为0.05倍~10倍,更优选为0.1倍~8倍。
本发明的诱导免疫耐受的方法、诱导调节性树突状细胞的方法、预防和/或治疗过敏性疾病的方法、以及预防和/或治疗自身免疫性疾病的方法中,联合使用并施予ALA类及铁化合物进行是优选的。特别是在预防和/或治疗过敏性疾病的方法中,联合使用并施予ALA类及铁化合物是优选的。在上述情况下,可以以含有ALA类和铁化合物的组合物的形式、或以各自单独的形式同时或先后施予。以各自单独的形式施予时,优选同时施予,但以各自单独的形式先后施予时,优选以使ALA类和铁化合物的施予能够实现加合效果、优选实现协同效果的方式施予。
作为本发明的免疫耐受诱导剂、调节性树突状细胞的诱导剂、过敏性疾病的预防和/或治疗剂、自身免疫性疾病的预防和/或治疗剂及它们的试剂盒的各成分的施予途径,可以举出经口施予(舌下施予也包括在内),或滴鼻施予、吸入施予、静脉内施予(包括滴注)、利用巴布剂等的经皮施予、通过栓剂或使用经鼻胃管、经鼻肠管、胃瘘管或肠瘘管的强制性经肠营养法进行施予等非经口施予等,优选经口施予。
关于本发明的免疫耐受诱导剂、调节性树突状细胞的诱导剂、过敏性疾病的预防和/或治疗剂、自身免疫性疾病的预防和/或治疗剂、及它们的试剂盒的各成分的剂型,可根据上述施予途径适当地确定,可以举出注射剂、滴鼻剂、滴注剂、片剂、胶囊剂、颗粒剂、散剂、液剂、溶解于糖浆等中的水剂、巴布剂、栓剂等。本发明的免疫耐受诱导剂、免疫耐受诱导试剂盒的各成分,除了医药用途以外,也可以以片剂或胶囊剂的补充剂的形态施予。此外,特别是对于吞咽困难的老年人和婴幼儿等,优选为在口中展现出快速崩解性的崩解片的形态、或适于经鼻胃管施予的液剂的形态。
为了制备本发明的免疫耐受诱导剂、调节性树突状细胞的诱导剂、过敏性疾病的预防和/或治疗剂、自身免疫性疾病的预防和/或治疗剂及它们的试剂盒,可根据需要添加药理学上可容许的载体、赋形剂、稀释剂、添加剂、崩解剂、粘合剂、包衣剂、润滑剂、增滑剂、滑润剂、风味剂、甜味剂、增溶剂、溶剂、凝胶化剂、营养剂等,具体而言,可以举出水、生理盐水、动物性脂肪及油、植物油、乳糖、淀粉、明胶、结晶性纤维素、胶质、滑石、硬脂磷酸镁、羟丙基纤维素、聚亚烷基二醇、聚乙烯醇、甘油。需要说明的是,将本发明的移植器官存活促进剂制备成水溶液时,为了防止ALA类的分解,需要注意不使水溶液成为碱性;成为碱性的情况下,也可通过除去氧来防止分解。
关于本发明的免疫耐受诱导剂、调节性树突状细胞的诱导剂、过敏性疾病的预防和/或治疗剂、自身免疫性疾病的预防和/或治疗剂及它们的试剂盒,如上文所述,除了人以外还可以在家畜·家禽类和宠物等兽医领域中使用。作为上述免疫耐受诱导剂等施予的量·频率·时期,在对象为人的情况下,根据年龄、体重、症状等而有所不同,作为ALA类的施予量,可以举出以ALA的摩尔数换算、成人每人为0.1~12mmol/日、优选为0.2~9mmol/日、更优选为0.3~6mmol/日、进一步优选为0.35mmol/日~4mmol/日,作为施予频率,可以举出一日单次~多次的施予或通过滴注等进行的连续施予。施予时期也可根据该技术领域的药理学者和临床医生已知的方法来确定。
以下,通过实施例对本发明进行更具体的说明,但本发明的技术范围并不限定于这些例示。
实施例1
使用ALA和SFC制作树突状细胞(DC),评价了实际制作得到的细胞是否诱导调节性T细胞、并且是否与利用转化生长因子-β(TGF-β)和IL-10(它们为由调节性T细胞分泌的炎症抑制性细胞因子)诱导得到的调节性DC具有同等的功能。
[利用向从骨髓采集的细胞中添加ALA而进行的对树突状细胞的诱导]
从8周龄的A/J(H2-KK)小鼠采集骨髓,通过溶血处理除去红细胞后,接种至培养皿上。使用以RPMI为原料的培养基(以下记为RPMI培养基)进行培养,从第二天开始施予10ng/ml的细胞因子GM-CSF,同时施予100μM的ALA盐酸盐、50μM的SFC,培养3天。将培养基更换为新鲜的RPMI培养基(其含有10ng/ml的GM-CSF、100μM的ALA盐酸盐、50μM的SFC),再培养3天,然后对得到的细胞进行回收。以下将通过该培养方法得到的细胞称为BM-DCALA。
[对作为对照组的成熟树突状细胞样细胞(BM-DCcon)及耐受原性树突状细胞样细胞(BM-DCreg)的诱导]
作为对照组,制作了从骨髓细胞诱导得到的BM-DCcon(已知其与成熟树突状细胞同样地具有效应T细胞活化能力,所述效应T细胞可引起免疫反应)、及从骨髓细胞诱导得到的BM-DCreg(已知其与调节性树突状细胞同样地具有调节性T细胞活化能力,所述调节性T细胞可抑制免疫反应)。关于BM-DCcon,对于通过上述同样的方法接种至培养皿上的细胞,与RPMI培养基一起添加GM-CSF(10ng/ml)和IL-4(10ng/ml)并培养5天。然后,向相同组成的新鲜培养基中新添加1μg/ml的脂多糖(LPS)抗原,再培养两天。需要说明的是,施予LPS的理由是由于为使树突状细胞成熟、需要存在作为抗原的物质。关于BM-DCreg,对于通过上述同样的方法接种至培养皿上的细胞,与RPMI培养基一起添加GM-CSF(20ng/ml)、IL-10(20ng/ml)及TGF-β(20mg/ml)并培养7天。
[关于得到的细胞是否为树突状细胞的研究]
作为前提,研究了通过上述3种方法得到的BM-DCALA、BM-DCcon、BM-DCreg是否为树突状细胞。即,使用流式细胞仪,对树突状细胞标志物CD11b、CD11c这两者进行染色,比较两方阳性的细胞(即树突状细胞)的数目。将结果示于图1(最左列)。结果可知,各组均大多数为CD11b、CD11c两方阳性,被诱导成了树突状细胞。接着,对该制作得到的树突状细胞的功能进行了研究。
实施例2
[树突状细胞特异性的表面标志物的表达]
针对通过ALA添加而诱导得到的树突状细胞是具有作为成熟树突状细胞的特征、还是具有作为耐受原性树突状细胞的特征,调查了树突状细胞特异性的表面标志物的表达。即,对于作为成熟树突状细胞标志物的CD80、CD86、CD40、I-A.I-E(MHC II类)的表达,使用流式细胞仪进行了分析。将结果示于图1(右侧的4列)。结果可知,如已经知道的那样,BM-DCcon表达了成熟树突状细胞标志物,而BM-DCreg与其相比表达有所下降。与之相对,关于BM-DCALA,各成熟树突状细胞标志物的表达与BM-DCreg同等程度地低。即,显示通过ALA添加能够制作与BM-DCreg非常相像的树突状细胞。
实施例3
[免疫相关基因的表达]
调查了通过ALA添加而诱导得到的树突状细胞是表达了与成熟树突状细胞相似的基因、还是表达了与耐受原性树突状细胞相似的基因。即,从BM-DCALA、BM-DCcon、BM-DCreg中提取mRNA,通过RT-PCR对与免疫诱导、免疫抑制相关的基因的表达进行了调查。将结果示于图2。结果,关于BM-DCALA,在很多基因表达中显示了与BM-DCreg类似的基因表达倾向(作为成熟树突状细胞标志物的CD40的表达低、TGF-β的表达高等)。另一方面,HO-1等基因显示了与BM-DCcon类似的基因表达。即,表明BM-DCreg和BM-DCALA的性质并不完全一致,但是是类似的。
实施例4
[利用MLR法的、对BM-DCALA的免疫耐受能力的研究]
利用MLR(Mixed Lymphocyte Reaction)法,对BM-DCALA是否通过与BM-DCreg同样的T细胞活化的抑制、即通过调节性T细胞的诱导来诱导免疫耐受(即,抑制效应T细胞增殖)进行了研究。在生物体内,识别了作为抗原的异物的成熟树突状细胞将该抗原呈递给T细胞。识别该抗原后的T细胞爆发性地增殖。由于在体外将T细胞和成熟DC与抗原一起混合培养时也能观察到T细胞的增殖,因此通过计测该增殖率来计测成熟DC的活性,这就是MLR法。此外,还已知将不同系统的成熟DC和T细胞混合的话,即使不存在抗原也能观察到增殖。
(关于BM-DCALA所产生的抑制效应T细胞增殖能力的效果的研究)
利用MLR法,对是否可通过BM-DCALA的存在来抑制诱导效应T细胞增殖的能力(其为成熟树突状细胞的功能)进行了研究。使用尼龙纤维柱从B6系统小鼠的脾脏分离T细胞,用Molecular Probes公司的Violet细胞增殖试剂盒(Violet Cell Proliferation Kit)染成紫色。将其以2×105个细胞/孔的量与1×104个细胞/孔的A/J小鼠的BM-DCcon(用作成熟树突状细胞的替代)一起在MPRI培养基中培养4天。此时,以2×104个细胞/孔的量添加BM-DCreg或BM-DCALA。培养后,使用流式细胞仪,对效应T细胞(CD4,CD8阳性)在T细胞整体(紫色)中所占的比例进行计数,以研究效应T细胞增殖的程度。需要说明的是,虽然调节性T细胞也是CD4阳性,但是其在T细胞整体中占的比例极低,因此可忽视。将结果示于图3。结果,与作为阴性对照的BM-DCcon和T细胞的两种细胞混合培养相比,添加了BM-DCALA的三种细胞混合培养时,CD4阳性、CD8阳性的T细胞各自的比例有所降低。即,BM-DCALA抑制了效应T细胞的增殖。该抑制能力与BM-DCreg(已知其具有效应T细胞增殖抑制能力)是同等的。
(关于BM-DCALA所具有的诱导调节性T细胞的能力的研究)
对BM-DCALA是否具有诱导调节性T细胞的能力(其为耐受原性树突状细胞的功能)进行了研究。采用与实施例4同样的方法从将FoxP3基因置换成了GFP基因的B6系统小鼠采集T细胞,进行染色,与BM-DCcon混合培养。此时,添加BM-DCreg或BM-DCALA。研究了在T细胞整体(紫色)中存在多少比例的GFP阳性细胞。将结果示于图4。结果,与BM-DCreg同样地,通过BM-DCALA的添加,T细胞中的GFP阳性细胞的比例有所增加。即,显示BM-DCALA能诱导调节性T细胞。
由于FoxP3不存在适于流式细胞仪的抗体,因此作为用流式细胞仪来确认FoxP3的表达的手段,使用了上述基因敲入(knock-in)小鼠。利用向调节性T细胞的分化信号使FoxP3表达时,取而代之地,GFP将表达。可通过计算紫色的T细胞中的GFP阳性细胞的比例来分析FoxP3阳性(本该成FoxP3阳性的)细胞的比例、即诱导能力。此外,图3和图5中所示的B6系统小鼠也是GFP基因敲入小鼠,已确认了其对CD4和CD8(想要调查的参数)没有影响。
(关于效应T细胞增殖能力抑制效果的研究)
对将BM-DCALA以单体的形态与T细胞混合培养时、BM-DCALA在效应T细胞增殖能力抑制效果方面是否显示与BM-DCreg相似的举动进行了研究。通过与实施例4同样的方法从B6系统小鼠采集T细胞并进行染色,与BM-DCALA混合培养。培养后,使用流式细胞仪,对效应T细胞在T细胞整体(被染成紫色的细胞)中所占的比例进行计数。将结果示于图5。结果,效应T细胞(CD4阳性、CD8阳性)的比例与和BM-DCcon的两种细胞混合培养时为同等程度。另一方面,与和BM-DCcon、BM-DCALA的混合培养时不同,BM-DCreg和T细胞的两种细胞混合培养时效应T细胞的比例低。即,在BM-DCALA单独培养的情况下,没有抑制效应T细胞增殖能力的效果,反倒具有促进增殖的作用(成熟树突状细胞样的作用)。由此,显示BM-DCALA并不是与BM-DCreg完全相同的细胞。
(关于单体BM-DCALA所具有的诱导调节性T细胞的能力的研究)
对将BM-DCALA以单体的形态与T细胞混合培养时、BM-DCALA在调节性T细胞的诱导方面是否显示与BM-DCreg相似的表现进行了研究。通过与实施例4同样的方法从将FoxP3基因置换为了GFP基因的B6系统小鼠采集T细胞并进行染色,与BM-DCALA混合培养。培养后,对在T细胞整体(被染成紫色的细胞)中存在多少比例的GFP阳性细胞进行了研究。将结果示于图6。结果,与BM-DCreg同样地,通过BM-DCALA的添加,T细胞中的GFP阳性细胞的比例增加。即,显示BM-DCALA在单独的情况下也能诱导调节性T细胞。
根据以上实施例1~4所示的结果,针对在体外使用ALA和SFC诱导得到的BMDC的细胞表面分子表达和抑制T细胞增殖、增加Treg的功能等而言,能够获得与使用TGF-β及IL-10诱导得到的调节性DC同样的结果。
实施例5
[特应性皮炎模型小鼠的制作]
作为小鼠,使用10周龄的雄性NC/Nga系统。使用2,4,6-三硝基氯苯(TNCB)作为致敏原,引起特应性皮炎症状。在第0天,剃去胸部、腹部、背部的毛,滴加150μl(胸部50μl、腹部50μl、背部50μl)的溶解在乙醇:丙酮(4:1)中的2%的TNCB及4%的十二烷基硫酸钠(SDS)。SDS施予是为了破坏由皮肤形成的对致敏原的屏障。然后,在第4、11、18天时不滴加SDS、而仅滴加1%的TNCB。
[免疫耐受诱导剂的施予]
每天用导管(sonde)经口施予ALA+SFC。该情况下,将浓度设定为以下两种条件:ALA盐酸盐(100mg/kg)+SFC(115mg/kg)、或ALA盐酸盐(10mg/kg)+SFC(11.5mg/kg)。
[ALA+SFC的症状改善效果]
作为特应性皮炎症状的评价体系,使用了皮炎评分和耳廓厚度。前者是通过目视确认的皮炎症状的判定。以红斑/出血、水肿、擦破/表皮脱落、疮痂/干燥这4个标准对脊背和两耳的皮肤损伤进行评分,然后算出各症状的得分的总值。级别分为0(无症状)、1(温和)、2(中等程度)、3(严重)。在第11、18、25天进行评分。将结果示于图7(左侧)。对于后者,将宰杀后的小鼠的两耳于4℃下在10%的中性福尔马林中浸渍24小时,进行固定。然后对组织进行石蜡固定,以厚度4μm进行切片。用H&E溶液对切片进行染色,通过显微镜观察来计测厚度。这里也同样地在第11、18、25天进行评分。将结果示于图7(右侧)。此外,将第18天的各施予组的小鼠的照片示为图8。
由图7及图8可知,在第11、18、25天对灭菌水施予组、ALA(100mg/kg)+SFC(115mg/kg)施予组、ALA(10mg/kg)+SFC(11.5mg/kg)施予组的皮炎进行评分的结果:与灭菌水施予组相比,在ALA(100mg/kg)+SFC(115mg/kg)施予组、及ALA(10mg/kg)+SFC(11.5mg/kg)施予组明显地观察到了改善。同样地,对耳廓厚度进行计测的结果:与灭菌水施予组相比,在ALA(100mg/kg)+SFC(115mg/kg)施予组、及ALA(10mg/kg)+SFC(11.5mg/kg)施予组明显地观察到了改善。
实施例6
[硬皮病病态模型的制作]
作为供体使用B10.D2雌性(7-8周龄)野生型小鼠,作为受体使用Rag-2/Balb/c雌性(7-8周龄)免疫缺陷小鼠。从供体小鼠将脾脏细胞以各组5×107个、或4×107个的量注射(移植)至受体中,由此制作硬皮病病态模型小鼠。由于受体为免疫缺陷,因此不会发生由受体侧引起的排斥反应,移植自供体的脾脏细胞也不会被受体侧的免疫系统除去,但是,对于从供体移植的脾脏细胞中包含的淋巴细胞而言,受体本身就是异物,因此来自供体的淋巴细胞会对受体的全身进行攻击。该反应所呈现出的全身性炎症、组织纤维化、广范的全身性硬化症等症状与人的硬皮病(硬皮症)非常相像,因此可作为硬皮病病态模型使用。
[免疫耐受诱导剂的施予]
在从刚刚进行过供体的脾脏细胞移植后开始的9周内,每天用导管施予一次ALA盐酸盐100mg/kg+SFC157mg/kg(以下记作“ALA”)。
实施例7
[由ALA施予而导致的对体重及存活时间的影响]
对由硬皮病发病而导致的体重减少是否通过ALA得以缓解、以及存活时间是否延长进行了研究。结果,如图9所示,观察到通过ALA施予、抑制体重减少的倾向。此外,还观察到通过ALA施予、至第9周为止的存活率高的倾向。另外,将各组的代表性的外观示于图10。可观察到通过ALA施予、脱毛症状得以缓解。需要说明的是,对照(control)是未移植来自供体小鼠的脾脏细胞的、Rag-2/Balb/c雌性(7-8周龄)免疫缺陷小鼠的数据。如上所述,观察到通过ALA施予、硬皮病的症状缓解的效果。
实施例8
[由ALA施予而导致的对组织的影响(组织染色)]
通过来自上述模型小鼠的组织染色,对硬皮病的症状、即纤维化和免疫细胞的聚集(炎症)是否通过ALA施予而得以缓解进行了确认。为了对炎症导致的耳朵、皮肤、肾脏、肝脏、肺的状况进行观察,制作各脏器的切片,进行用于确认T细胞的聚集的HE染色、及对具有胶原蛋白的结缔组织进行染色的Masson染色。在细胞移植前的初始(Naive)、ALA未施予第6周、ALA施予第6周这3个条件下,以×40、×100、×200、×400这4个倍率对HE染色切片及Masson染色切片进行观察,对通过ALA施予、症状是否得以缓解进行了确认。
[耳朵]
将HE染色切片的观察结果示于图11。结果,在HE染色切片中未观察到由ALA施予而导致的观察结果上的大的差异(中段和下段的比较)。同样地,将Masson染色切片的观察结果示于图12。结果,与未施予组相比,ALA施予组的胶原蛋白蓄积(以被染成深色的部分的密度表示)得以抑制(中段和下段的比较)。
[皮肤]
皮肤的纤维化是硬皮病的最具代表性的症状之一。将HE染色切片的观察结果示于图13。结果,在HE染色切片中未观察到由ALA施予而导致的观察结果上的大的差异(中段和下段的比较)。同样地,将Masson染色切片的观察结果示于图14。结果,ALA施予组的胶原蛋白蓄积与未施予组相比得以抑制(中段和下段的比较)。
[肾脏·皮质周围]
将HE染色切片的观察结果示于图15。结果,在HE染色切片中未观察到由ALA施予而导致的观察结果上的大的差异(中段和下段的比较)。同样地,将Masson染色切片的观察结果示于图16。结果,ALA施予组的胶原蛋白蓄积与未施予组相比得以抑制(中段和下段的比较)。
[肾脏·髓质周围]
将HE染色切片的观察结果示于图17。结果,在HE染色切片中未观察到由ALA施予而导致的观察结果上的大的差异(中段和下段的比较)。同样地,将Masson染色切片的观察结果示于图18。结果,ALA施予组的胶原蛋白蓄积与未施予组相比得以抑制(中段和下段的比较)。
[肝脏]
将HE染色切片的观察结果示于图19。结果,在HE染色切片中,在ALA未施予组中观察到细胞的聚集,但在ALA施予组中未观察到(中段和下段的比较)。同样地,将Masson染色切片的观察结果示于图20。结果,未观察到由ALA施予而导致的观察结果上的大的差异(中段和下段的比较)。
[肺]
将HE染色切片的观察结果示于图21。结果,在HE染色切片中未观察到由ALA施予而导致的观察结果上的大的差异(中段和下段的比较)。同样地,将Masson染色切片的观察结果示于图22。结果,未观察到由ALA施予而导致的观察结果上的大的差异(中段和下段的比较)。
实施例9
[由ALA施予而产生的对组织的影响(基因表达)]
通过分别在ALA施予3周后、6周后及9周后对来自上述模型小鼠的组织中的各种标志物基因的表达进行检测,对硬皮病的症状、即纤维化和炎症是否通过ALA施予而得以抑制进行了确认。使用通过RNeasy mini kit从皮肤、肾脏、脾脏组织中提取出的mRNA,通过RT-PCR对与炎症、纤维化等相关的基因的表达进行了调查。作为对照,使用Balb/c雄性(7-8周龄)小鼠。
对作为上述标志物基因的下述基因的表达进行了调查,所述基因为:HO-1(为抗氧化蛋白质,认为其可诱导regDC)基因、TGF-β(炎症抑制性细胞因子)基因、IFN-γ(促进、抑制炎症两方面作用均有的细胞因子)基因、胶原蛋白-1(纤维化标志物)基因、α-SMA(纤维化标志物)基因、IL-6(炎性细胞因子)基因、骨桥蛋白(OPN)(炎性细胞因子)基因、IL-21(已知其在自身免疫性疾病中被大量产生)基因、TNF-α(炎性细胞因子)基因、IL-10(炎症抑制性细胞因子)基因及FoxP3(调节性T细胞标志物)。
[皮肤]
皮肤的纤维化是硬皮病的最具代表性的症状之一。将皮肤的结果示于图23。在皮肤中,观察到通过ALA施予、作为纤维化标志物的胶原蛋白-1(图23的右侧最上方)、α-SMA(图23的右上方起第3个)明显降低,显示ALA施予缓解了作为硬皮病的症状的纤维化。
[脾脏]
将脾脏的结果示于图24。在脾脏中,观察到通过ALA施予、作为调节性T细胞标志物的FoxP3(图24的右上方起第3个)、作为调节性T细胞产生的炎症抑制性细胞因子的IL-10的上升倾向(图24的右侧最下方),显示由ALA引起的调节性T细胞的活化。
[肾脏]
将肾脏的结果示于图25。在肾脏中,观察到被认为可诱导免疫耐受的、由血红素诱导产生的HO-1的上升(图25的左侧最上方)、和作为纤维化标志物的胶原蛋白-1的降低倾向(图25的右上方起第2个)、作为炎性细胞因子的IL-6减少倾向、骨桥蛋白(OPN)的减少(图25的上方起第3个),显示ALA抑制炎症、预防了纤维化。
产业上的可利用性
本发明的调节性树突状细胞的诱导剂、过敏性疾病预防和/或治疗剂、自身免疫性疾病预防和/或治疗剂等免疫耐受诱导剂可在医药·医疗领域中有利地使用。
- 还没有人留言评论。精彩留言会获得点赞!