麝香酮制备治疗阿尔茨海默病药物的应用的制作方法
本发明属于生物制药技术领域,具体涉及化合物麝香酮(Muscone,简称Mus)作为制备治疗阿尔茨海默病药物的应用。
背景技术:
阿尔茨海默病(Alzheimer’s disease,简称AD)是一种进行性中枢神经系统退行性疾病,其主要临床特征为进行性记忆及认知功能障碍。65岁以上人群患病率约5%,85岁以上人群患病率则为20%,AD已成为仅次于心脏病、恶性肿瘤、中风的第四位死亡病因,给家庭和社会带来沉重的负担。
研究表明,学习与记忆相关的突触形成和重塑与染色质的重塑密切相关,其中组蛋白乙酰化在认知功能方面的重要作用越来越受关注。组蛋白乙酰化稳态受组蛋白乙酰基转移酶(Histone acetytransferases,HATs)和组蛋白去乙酰化酶(Histone deacetylases,HDACs)调控,HATs能够提高转录活性,而HDACs能抑制基因转录。文献研究提示AD患者脑内组蛋白乙酰化水平降低,非特异性HDAC抑制剂(HDACi)能促进组蛋白乙酰化,增强海马长时程增强(Long term potentiation,LTP)并增强突触可缩性,改善学习记忆功能。人类HDAC具有11种锌依赖的亚型,其中HDAC2是已被验证的与记忆形成和突触可塑性密切相关的HDAC亚型。HDAC2可结合于一系列与记忆相关的突触形成及突触重塑基因启动子,抑制相关基因表达,损害突触可塑性和记忆形成;相反,阻断HDAC2可改善突触可塑性并增强记忆功能,促进记忆形成。
目前临床治疗AD的药物主要分为两类:1)乙酰胆碱酯酶抑制剂;2)N-甲基-D-天冬氨酸(NMDA)受体拮抗剂。但上述药物可暂时缓解AD临床症状,并不能阻止AD病理进展。非特异性HDACi治疗AD已进入临床实验(II/III期)。但非特异性HDACi作用底物广,因此可能产生较严重的毒副作用。故针对AD的HDAC亚型靶向治疗药物有望为临床AD治疗提供新的理念和策略。
技术实现要素:
本发明的目的就在于克服上述缺陷,研制一种Mus作为制备治疗阿尔茨海默病药物的应用。
本发明的技术方案是:
麝香酮作为制备治疗阿尔茨海默病药物的应用,其主要技术特征在于将麝香酮制备成治疗阿尔茨海默病的注射制剂。
所述麝香酮的分子量为238.415Da。
所述麝香酮注射制剂为每次腹腔注射2mg/Kg。
所述麝香酮2%(v/v)乙醇和98%(v/v)生理盐水混合,按照500μg:1000ul,制成治疗阿尔茨海默病的注射液制剂。
所述注射液制剂体内腹腔注射2mg/Kg/天。
本发明的优点和效果在于治疗阿尔茨海默病时,由于麝香酮(以下简称Mus):
1.是一种小分子化合物,注射用药,可透过血脑屏障;
2.作用于AD的病理过程,符合当今研制治疗AD药物的决策;首先直接抑制Aβ神经毒性作用,减少神经元死亡;其次,抑制组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)表达,调节记忆功能和突触可塑性。
本发明的其他具体优点和效果将在下面继续说明。
本发明利用现代生物学技术和生物信息学分析对麝香酮在治疗阿尔茨海默病领域进行了研究,发现Mus能够抑制Aβ神经毒性作用,减少神经元死亡,可将麝香酮制备成治疗阿尔茨海默病的注射制剂,对阿尔茨海默病进行治疗。
附图说明
图1——MTT检测神经元细胞活力示意图:
A——不同浓度Mus处理原代神经元细胞活力图;
B——Mus抑制Aβ降低的神经元活力图。
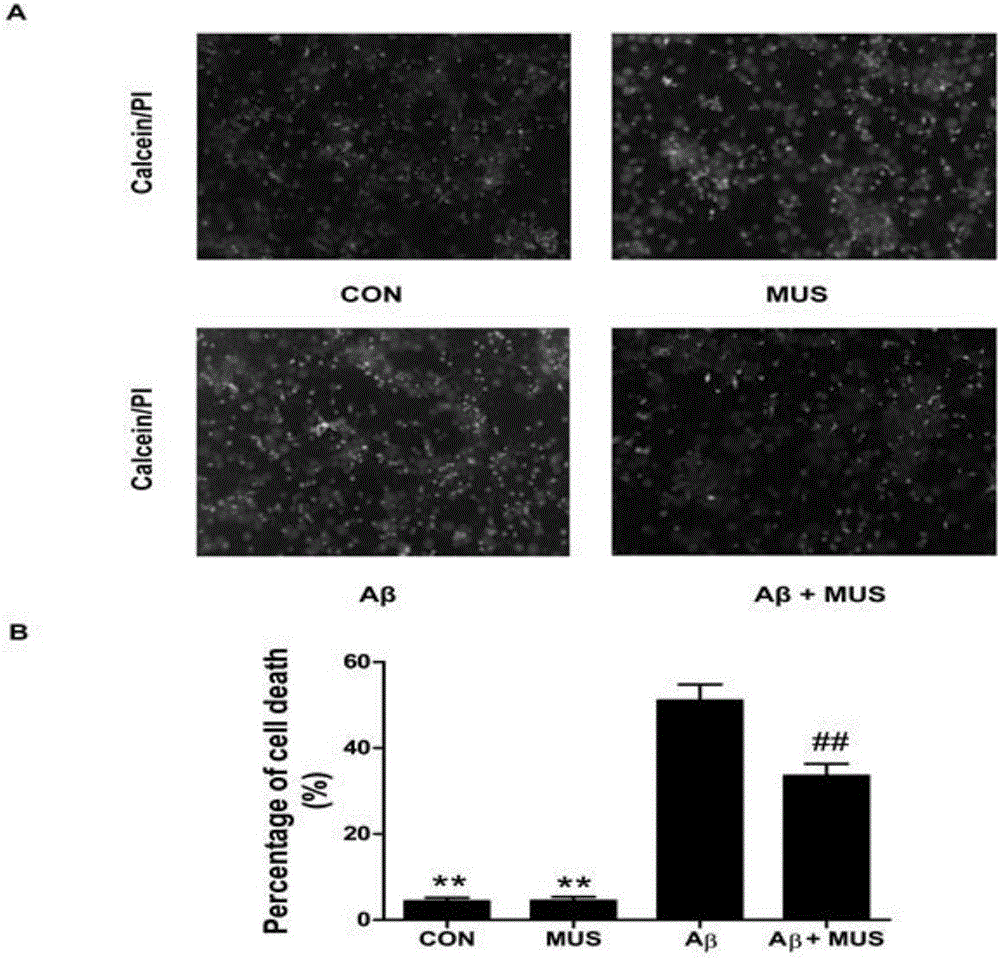
图2——Calcein-AM/PI双染检测Mus对Aβ诱导原代神经元细胞凋亡率的影响示意图:
A——正常对照组神经元、Mus单独处理组神经元、Aβ单独处理组神经元及Mus预处理后和Aβ共培养组神经元凋亡率示意图;
B——各组细胞凋亡率统计图。
图3——Western blot检测Mus对Aβ诱导原代神经元Bcl-2、Bax蛋白表达的影响示意图:
A——正常对照组神经元、Mus单独处理组神经元、Aβ单独处理组神经元及Mus预处理后和Aβ共培养组神经元Bax、Bcl-2、GAPDH蛋白条带示意图;
B——各组细胞蛋白表达变化统计图。
图4——APP/PS1小鼠morris水迷宫实验结果示意图:
A——Mus处理后小鼠水迷宫平均逃避潜伏期图;
B——第6天去平台,Mus处理后小鼠水迷宫穿越平台次数图;
C——第6天去平台,Mus处理后小鼠水迷宫目标象限停留时间图;
D——第6天去平台,Mus处理后小鼠水迷宫平均逃避潜伏期图;
E——第6天去平台,各组小鼠水迷宫游泳轨迹图。
图5——APP/PS1小鼠条件性恐惧实验结果示意图:
A——Mus处理后小鼠关联条件恐惧测试凝滞时间示意图;
B——Mus处理后小鼠暗示条件恐惧测试凝滞时间示意图。
图6——APP/PS1小鼠旷场实验结果示意图:
A——Mus处理后小鼠旷场中心区域停留时间示意图;
B——Mus处理后小鼠旷场四周拐角区域停留时间示意图;
C——Mus处理后小鼠在旷场内运动距离示意图。
图7——Golgi染色检测Mus对APP/PS1小鼠脑内海马神经元树突棘密度的影响示意图:
A——APP/PS1小鼠海马神经元树突棘密度示意图;
B——Mus处理后APP/PS1小鼠海马神经元树突棘密度示意图;
B——各组小鼠海马神经元树突棘密度统计图。
图8——Western blot检测Mus对APP/PS1小鼠海马HDAC2蛋白表达的影响示意图。
A——Mus处理后小鼠海马HDAC2蛋白条带示意图;
B——各组小鼠海马HDAC2蛋白表达变化统计图。
具体实施方式
本发明的技术思路是:
从体外到体内水平,系统探讨Mus对Aβ诱导的原代神经元凋亡的影响及Mus对APP/PS1小鼠行为学的影响及其分子机制,以证明Mus系一种治疗AD的新型药物。本发明首先,从体外角度,通过体外研究Mus抑制Aβ诱导的原代神经元细胞凋亡作用,从而证明Mus能抑制Aβ神经毒性;其次,从体内角度,行为学验证Mus能改善APP/PS1转基因小鼠认知功能,从而证明Mus对AD具有治疗作用;最后,用分子生物学等技术研究Mus对APP/PS1小鼠海马神经元树突棘密度的影响及Mus对APP/PS1小鼠海马HDAC2蛋白表达的影响,以证明Mus可制备为治疗AD新型药物的应用。
下面是本发明的具体实施例说明:
Muscone,分子量为238.415,棕褐色粉状,干燥避光密封保存于0-5℃;与2%(v/v)乙醇和98%(v/v)生理盐水混合,按照500μg:1000ul,制成治疗阿尔茨海默病的注射液制剂;体内Muscone腹腔注射2mg/Kg/次。该剂量范围内,Mus未见毒、副作用。
本发明应用过程及测试说明:
实施例1:
体外研究证明Mus抑制Aβ的神经毒性及其诱导的神经细胞凋亡对AD具有治疗作用:
1)材料和方法
原代皮层神经元培养:怀孕15-17d C57BL/6J(B6)小鼠,断颈处死后,取其胚胎,置于盛有预冷PBS的培养皿中,分离大脑皮层,1X胰酶消化后,置多聚赖氨酸包被的培养板中培养,1×105个细胞/ml,每2-3d部分换液,共培养8-10d。细胞培养在无血清、无酚红和无雌激素的培养液(Neurobasal加上Hepes、B27和谷氨酰胺)中,37℃,5%CO2培养箱。
神经元细胞活力检测:使用四甲基偶氮唑盐比色法(MTT法)检测细胞活力。向100μl培养液/孔中加入MTT,37℃,5%CO2的培养箱中继续培养4h,然后倾去全部培养液,每孔中加入100μl DMSO溶液,摇床上摇动至蓝紫色的结晶完全溶解,酶标计数仪测定各组OD值。
药物处理:筛选Mus处理原代神经元的安全浓度,Mus(0,0.1,1,2.5,5,10,20,40uM)处理神经元细胞24小时,随后MTT检测神经元细胞活力;筛选Mus抑制Aβ神经毒性的有效药物浓度,Mus(0,0.1,1,2.5,5,10uM)预处理神经元细胞2小时后,加入Aβ2uM处理上述神经元24小时,随后MTT检测神经元细胞活力。
Calcein-AM/PI双染:用1ml无水DMSO溶解1mg Calcein-AM,制备成1mmol/L的Calcein-AM储备液,-20℃下密闭冷冻保存。用1ml ddH2O溶解1mg PI,制备成1.5mmol/L的PI储备液(1mg PI/1ml H2O),-20℃下密闭冷冻保存。将Calcein-AM储备液和PI储备液放置于室温。加10μl Calcein-AM储备液和15μl PI储备液至5ml PBS中配制成染色溶液。37℃染色15min到30min可以用显微镜观察细胞。
2)结果
①MTT提示Aβ明显降低原代神经元的细胞活力,Mus能抑制Aβ的神经毒性:我们用不同浓度的Mus单独处理原代神经元,显示其对原代神经元细胞活力无明显影响(图1A);加入不同剂量Mus预处理神经元,随后加入Aβ2uM处理神经元24小时后,提示Aβ能显著降低细胞活力,Mus能提高神经元的细胞活力呈剂量依赖性(图1B)。
②Calcein-AM/PI双染结果提示Mus5μM单独处理神经元不会引起神经元细胞死亡,Aβ2μM处理原代神经元能够明显增加神经元死细胞比例,Mus5μM预处理原代神经元2小时后加入Aβ2μM共培养24小时,能够显著减少Aβ诱导的神经元死亡(图2B)。
实施例2:
体外研究证明Mus能抑制Aβ诱导的神经元细胞凋亡:
本部分研究为进一步证实Mus通过调控细胞凋亡调控因子Bcl-2、Bax的蛋白表达水平发挥抑制细胞凋亡的作用。
1)材料和方法
免疫印迹(Western blot)定量测定神经元细胞中Bcl-2、Bax含量:提取蛋白质,然后溶解在5Xloading Buffer中,煮沸5分钟。在4-20%聚丙烯酰胺凝胶上电泳,将蛋白转到PVDF膜上。以5%脱脂牛奶室温封闭1小时。分别加一抗抗体兔抗-Bcl-2(1:1000,Cell signaling technology)、兔抗-Bax(1:1000,Cell signaling technology)、兔抗-GAPDH(1:5000,Bioworld technology),4℃过夜,辣根过氧化酶标记二抗(1:5000,Bioworld)结合2小时,用增强的化学发光法测定其蛋白表达。
2)结果
①Western blot结果显示:Aβ处理后,下调神经元Bcl-2表达水平,上调神经元Bax表达水平,而Mus预处理后显著上调Bcl-2表达水平,下调Bax表达水平(图3)。
实施例3:
体内研究证明Mus对APP/PS1小鼠具有治疗作用:
以B6C3-Tg(APPswe/PSEN1dE9)转基因小鼠简称APP/PS1作为AD动物模型,予Mus腹腔注射治疗。通过行为学证明,Mus对AD具有治疗作用。
1)材料和方法
以B6C3-Tg(APPswe/PSEN1dE9)转基因小鼠简称APP/PS1作为AD动物模型,实验随机分成3组:APP/PS1同窝野生型小鼠,APP/PS1转基因小鼠,APP/PS1小鼠+Mus 2mg/kg腹腔注射,每日1次,治疗15天,每组8只小鼠。
行为学检测:水迷宫试验为用于检测动物学习记忆能力的公认方法,Morris水迷宫:圆形水池直径为122cm,高75cm,平台高度50cm,直径10cm,平台低于水面1cm,水温23±2℃。实验期间水迷宫外参照物保持不变。实验前1天,让小鼠熟悉水迷宫环境。实验历时5天,每天训练1次,分别从东、南、西、北4个点入水,入水时,小鼠面向池壁,记录小鼠找到平台所需时间即逃避潜伏期。于第6天撤去平台,将受试小鼠在西北象限池壁中点面向池壁放入水中,记录1min内小鼠穿越平台的次数作为小鼠的记忆成绩。
条件性恐惧实验可用于测定动物学习、记忆不悦经历和环境暗示之间的关联能力。实验设备包括条件恐惧箱、隔音箱和关联条件箱。条件恐惧箱包括箱底格栅地板相联的电击发生器(可产生0.1~1.0mA的各种强度的电击)、声音发生器,并与计算机相联。隔音箱装有一灯、一小风扇(用于通风和产生背景音)以及一个与声音发生器相联的扩音器。关联箱由透明有机玻璃制成,有可移动的格栅式地板,关联条件箱为26cm×21cm×10cm,格栅地板由不锈钢条组成(直径1.5mm,中央间距为0.5cm)。此外,还有电压计和声强计,用来检测刺激强度。实验分为训练和测试两个阶段。第一天为训练阶段,将小鼠放入条件恐惧箱适应3min,随后加以80Db声音刺激30s,紧接着给予一次0.7mA电击2s,随后无刺激1min,记录整个训练过程阶段动物凝滞时间以作为实验评价的基线,将小鼠移开操作箱,用70%的酒精彻底清洁操作箱,以备下一只动物训练。第二天为测试阶段,关联条件恐惧测试(contextual fear conditioning test)是将动物放入第一阶段中的环境中5min,记录小鼠在操作箱中的凝滞时间以评价海马依赖的记忆。暗示条件恐惧测试(cued fear conditioning test)是将小鼠放入经改造后的关联箱探索1min后,给予声音刺激30s,随后无刺激1.5min,记录小鼠在操作箱内的凝滞时间以评价杏仁核依赖的记忆。
旷场实验可用于观察小鼠自发性探索运动活性和焦虑行为,设备为底面积40cm×40cm,高50cm的白色开口有机玻璃盒,底面可平均分为16个10cm×10cm的小方格,正上方2m处架一数码摄像头,其视野可覆盖整个旷场内部。实验在安静的环境下进行,将小鼠放入箱内底面中心,同时进行10min观察,利用Any-maze动物行为分析系统统计每只小鼠在底面中心4个小方格及周围4个拐角方格的停留时间和运动距离。
2)结果
①行为学结果:Morris水迷宫试验结果提示,经过5天的训练,Mus明显减少APP/PS1小鼠找到平台的逃避潜伏期(图4A),第6天撤去平台,可见Mus明显增加APP/PS1鼠穿越平台的次数(图4B),并且显著提高APP/PS1小鼠在目标象限的停留时间(图4C),此外,Mus明显减少APP/PS1小鼠找到平台的潜伏期(图4D)。
②条件性恐惧实验结果提示,经过第一天的训练阶段,第二天的关联条件恐惧测试中APP/PS1小鼠较野生型小鼠凝滞时间显著减少,而Mus给药组小鼠较APP/PS1小鼠凝滞时间显著增加,提示Mus能够改善APP/PS1小鼠的海马依赖性记忆(图5A)。暗示条件恐惧测试中各组小鼠的凝滞时间未见明显差异,提示Mus未能改善APP/PS1小鼠的杏仁核依赖性记忆(图5B)。
③旷场实验结果提示,APP/PS1同窝野生型小鼠、APP/PS1小鼠及接受Mus治疗的APP/PS1小鼠,三组小鼠在旷场中心区域的停留时间未见明显差异(图6A),各组小鼠在旷场周围四个拐角的停留时间未见明显差异(图6B),此外,各组小鼠在旷场中的运动距离也没有差异(图6C),提示Mus不会影响小鼠的探索能力及焦虑状态。
实施例4:
体内研究证明Mus能增加APP/PS1小鼠海马内树突棘密度。
1)材料和方法
Golgi染色:利用FD快速高尔基染色试剂盒(FD Rapid GolgiStainTM Kit,PK401)进行染色,将小鼠麻醉后,快速取脑,用双蒸水快速冲掉组织表面血液,按试剂盒说明将组织浸泡于溶液A和溶液B等体积混合液中避光保存两周,浸泡12小时后更换新的浸渍液。转移组织到溶液C避光浸泡72小时。利用冰冻切片机将组织切成100-200μm厚的薄片,把样本转移到含有溶液C的明胶包被的载玻片上。用双蒸水冲洗切片两次,每次4min。将切片置于由1份溶液D,1份溶液E和2份双蒸水组成的混合液中10min。用蒸馏水冲洗切片2次,每次4min。用结晶紫对切片复染,在50%,75%和95%的乙醇中对切片进行脱水,每个浓度梯度脱水4min。在无水乙醇中对切片进行脱水4次,每次4min。在二甲苯中透明,3次,每次4min,并用树脂封片剂对盖玻片进行封片。
2)结果
①Golgi染色结果提示Mus给药组APP/PS1小鼠海马内树突棘密度较APP/PS1对照组小鼠明显增多,提示Mus能够增加APP/PS1小鼠脑内海马区突触的数量(图7)。
实施例5:
体内研究证明在APP/PS1小鼠AD模型中Mus能抑制HDAC2的表达:
1)材料和方法
Western Blot:方法同上,分别加第一抗体兔抗HDAC2(1:1000,Bioworld technology),及兔抗GAPDH(1:5000,Bioworld technology)抗体,4℃过夜,辣根过氧化酶标记二抗(1:5000,Bioworld technology)结合2小时,用增强的化学发光法测定其蛋白表达。
2)结果
①Western blot结果显示:与APP/PS1对照组相比,Mus给药组小鼠海马内HDAC2的表达显著降低,提示Mus能够抑制APP/PS1小鼠海马内HDAC2表达(图8)。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!