一种过氧化氢响应的脂质体纳米探针及其制备方法和应用与流程
本发明涉及生物医药技术领域,特别涉及一种过氧化氢响应的脂质体纳米探针及其制备方法和应用。
背景技术:
过氧化氢在调节各种生理过程包括细胞的生长、免疫应答和衰老中发挥着重要作用。过氧化氢分泌异常通常与很多疾病密切相关,如:癌症、糖尿病、炎症、心血管疾病及神经性疾病。因此,开发准确及灵敏的过氧化氢的检测探针将具有非常重要的临床价值,它不仅可以用于疾病的诊断,还能帮助医生很好地理解疾病的机制及发展。然而,由于生理环境下过氧化氢的浓度是相当低的(~<50μM),发展一种可用于临床体内过氧化氢检测的技术仍然是一项非常具有挑战性的任务。
近年来,已经有不少课题组探索了可用于过氧化氢检测的硼酸盐荧光探针,它主要是利用硼酸盐在过氧化氢下会转化成酚类,在可见光的激发下会产生荧光。此外,也有利用过氧化氢、过氧酸酯和荧光染料三者之间化学反应产生生物发光,用于体内过氧化氢的成像。然而,这些基于荧光成像或生物发光的纳米探针常常受到组织穿透深度的限制,无法实现深层组织中过氧化氢的检测。因此,迫切需要开发高特异性和灵敏度的新型纳米探针以实现深层组织和器官中过氧化氢的精准成像,从而提高疾病的检测灵敏度。
光声成像是基于光声转换现象的成像方法。在检测过程中,样品吸收入射激光的能量而发生热膨胀,伴随产生超声波,仪器将接收到的超声波转换为影像信息。样品对激光能量吸收的差异导致超声波强度的不同,从而形成影像的明暗差异。光声成像技术结合光学和超声两种成像技术的优点,能实现对组织体较大深度的高分辨率、高对比度的功能成像。目前,许多在近红外区有强吸收的纳米粒子被广泛用于肿瘤的光声成像。此外,对生理上的某些信号例如活性氧、酸碱性和酶响应的光声造影剂也被广泛用于疾病的检测。然而,利用光声成像技术对体内过氧化氢检测还鲜有报道。
技术实现要素:
有鉴于此,本发明提供了一种过氧化氢响应的脂质体纳米探针及其制备方法和应用。该脂质体纳米探针利用光声成像技术可实现对体内过氧化氢的检测。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种过氧化氢响应的脂质体纳米探针,包括脂质体(liposome)、辣根过氧化物酶(HRP)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS);该脂质体由二棕榈酰磷脂酰胆碱、胆固醇和二硬脂酰磷脂酰乙醇胺-聚乙二醇组成;脂质体的亲水空腔装载辣根过氧化物酶,所述脂质体的疏水层装载2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐。
本发明将2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)和辣根过氧化物酶(HRP)装载到脂质体(liposome),得到了过氧化氢响应的脂质体纳米探针(Lipo@HRP&ABTS),在近红外区具有非常好过氧化氢响应的吸收。在过氧化氢的存在下,无色的ABTS在HRP的催化下转化成在近红外区有强吸收的氧化形式,从而实现纳摩级别过氧化氢的检测。通过腹腔注射脂质体纳米探针后,可以通过光声成像准确检测到由脂多糖或细菌引起感染过程。此外,通过系统给药后,也能实现原发性肿瘤及淋巴转移瘤的光声成像。同时,利用过氧化氢响应的吸收,还能实现肿瘤特异性的光声成像。
本发明提供的脂质体纳米探针在近红外区具有非常好的光学吸收性能,同时具有较好的分散性及较长的血液循环时间,可在活体上平上实现炎症及肿瘤高灵敏度的检测。
在本发明提供的实施例中,二棕榈酰磷脂酰胆碱、胆固醇与二硬脂酰磷脂酰乙醇胺-聚乙二醇的摩尔比6:4:0.5。
在本发明提供的实施例中,过氧化氢响应的脂质体纳米探针的辣根过氧化物酶装载率为5%,2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐装载率为23.17%。
作为优选,过氧化氢响应的脂质体纳米探针的粒径为70~115纳米。
本发明还提供了一种过氧化氢响应的脂质体纳米探针的制备方法,包括如下步骤:
将二棕榈酰磷脂酰胆碱、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐溶解在甲醇中,然后通过旋转蒸发形成脂质膜;
然后将脂质膜与辣根过氧化物酶的磷酸盐缓冲溶液混合,并将混合液进行冻融;
将冻融后的混合液进行过滤、纯化,得到过氧化氢响应的脂质体纳米探针。
在本发明提供的实施例中,二棕榈酰磷脂酰胆碱、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇与2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐的摩尔比为6:4:0.5:12。
在本发明提供的实施例中,冻融为:将混合液在液氮中冷冻,然后在65℃条件下解冻。
作为优选,冻融的次数为5次。
作为优选,过滤为:将冻融后的混合液在200纳米的滤膜上过滤40~60次。
作为优选,纯化为:通过S-300的凝胶柱纯化除去游离的2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐和辣根过氧化物酶。
本发明还提供了本发明的过氧化氢响应的脂质体纳米探针在制备基于光声成像技术的炎症或肿瘤检测试剂中的应用。
本发明提供了一种过氧化氢响应的脂质体纳米探针及其制备方法和应用。该脂质体纳米探针包括脂质体(liposome)、辣根过氧化物酶(HRP)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS);该脂质体由二棕榈酰磷脂酰胆碱、胆固醇和二硬脂酰磷脂酰乙醇胺-聚乙二醇组成;脂质体的亲水空腔装载辣根过氧化物酶,脂质体的疏水层装载2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐。本发明与现有技术相比具有下列优点:
1.本发明制备的过氧化氢响应的脂质体纳米探针(Lipo@HRP&ABTS)具有非常好的过氧化氢响应性,可以实现纳摩级别过氧化氢的检测;跟传统的利用荧光或生物发光进行过氧化氢检测的技术相比,光声成像进行的检测能明显提高组织的穿透深度,实现深层组织的过氧化氢成像;利用Lipo@HRP&ABTS的光声成像能实时监测炎症的发生与发展。
2.本发明提供的过氧化氢响应的脂质体纳米探针(Lipo@HRP&ABTS),除了可以实现炎症的成像,还能与肿瘤微环境中过氧化氢反应实现肿瘤的光声成像。另外,该脂质体纳米探针可以有效地区分具有转移瘤的淋巴结和正常的淋巴结。
3.利用本发明制备的过氧化氢响应的脂质体纳米探针(Lipo@HRP&ABTS)除了有很好的过氧化氢检测性能,还是一个非常好的过氧化氢激活的光热试剂。脂质体纳米探针富集到肿瘤部位并在近红外光的照射下,能很好地将肿瘤消除,并且不会对其他的部位造成损失。
附图说明
图1示实施例1中Lipo@HRP&ABTS的透射电镜照片;
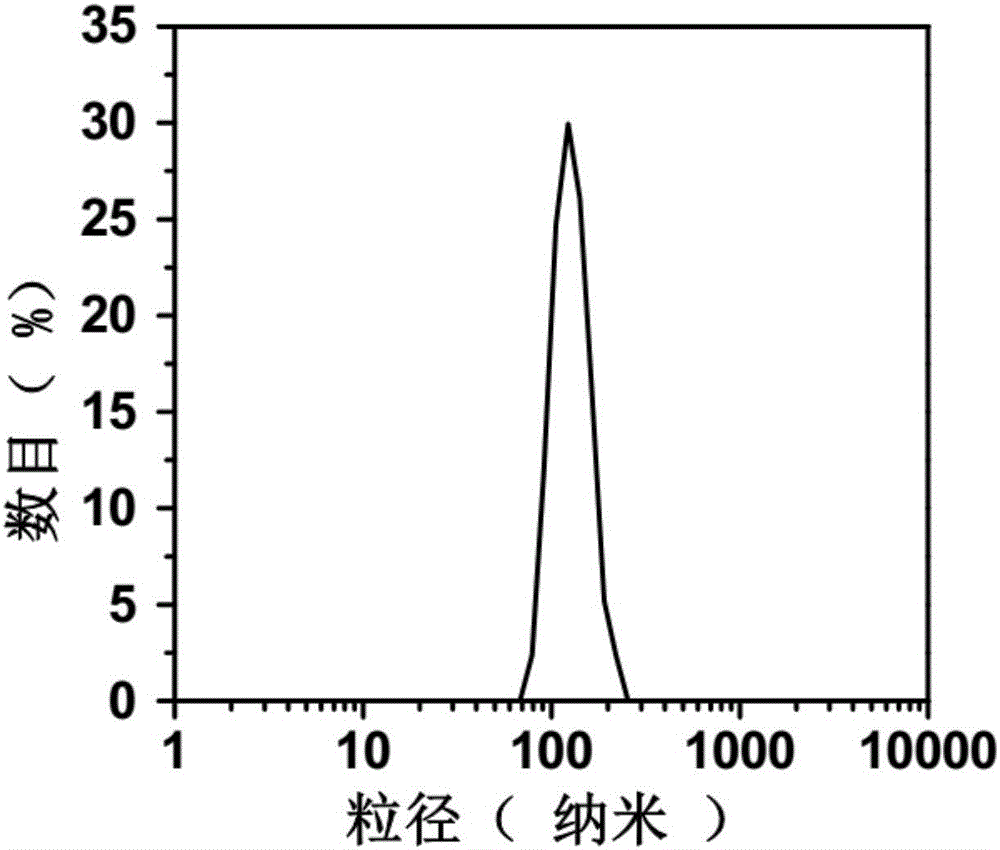
图2示实施例1中Lipo@HRP&ABTS的激光粒径分布;
图3示实施例2中Lipo@HRP&ABTS与不同活性氧孵育后的吸收;
图4示实施例3中Lipo@HRP&ABTS与不同浓度的过氧化氢孵育后的紫外吸收光谱图;其中,a示Lipo@HRP&ABTS与不同浓度的过氧化氢孵育后的紫外吸收光谱图;b示Lipo@HRP&ABTS与不同浓度的过氧化氢孵育后的800纳米处吸收;
图5示实施例3中Lipo@HRP&ABTS与不同浓度的过氧化氢孵育后的光声信号;
图6示实施例4中Lipo@HRP&ABTS用于脂多糖(LPS)诱导的炎症模型的检测;其中,a示Lipo@HRP&ABTS、LPS&Lipo@ABTS和LPS&Lipo@ABTS各组在不同时间点的小鼠腹部光声成像图;b为a的光声成像信号强度曲线图;
图7示实施例4中Lipo@HRP&ABTS用于脂多糖(LPS)诱导的炎症模型的实时监测;其中,a示Lipo@HRP&ABTS用于脂多糖(LPS)诱导后不同时间点的小鼠腹部光声成像图,及给予抗炎药(Celecoxib)再经脂多糖(LPS)诱导后不同时间点的小鼠腹部光声成像图;b为a的光声成像信号强度曲线图;
图8示实施例5中Lipo@HRP&ABTS用于皮下肿瘤的成像;其中,a示Lipo@ABTS、Lipo@HRP或者Lipo@HRP&ABTS通过尾静脉注射到携带有皮下肿瘤的小鼠体内,在不同时间点的光声成像图;b为a的光声成像信号强度曲线图;
图9示实施例5中Lipo@HRP&ABTS用于淋巴转移瘤的成像;a示将Lipo@HRP&ABTS注射到有转移瘤的淋巴结或正常淋巴结中的光声成像图;b为a的光声成像信号强度曲线图;
图10示实施例6中小鼠皮下肿瘤部位温度与激光照射时间的关系;其中,a示PBS、Lipo@ABTS、Lipo@HRP或者Lipo@HRP&ABTS各组的红外热成像图;b为各组肿瘤表面温度变化曲线图;
图11示实施例6小鼠肿瘤体积的变化图;
图12示实施例7中小鼠淋巴结位温度与激光照射时间的关系;其中,a示将Lipo@HRP&ABTS注射到有转移瘤的淋巴结或正常淋巴结中再进行激光照射后的红外热成像图;b为各组肿瘤表面温度变化曲线图。
具体实施方式
本发明公开了一种过氧化氢响应的脂质体纳米探针及其制备方法和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
说明书和实施例中所使用的缩写具体含义如下:
在本发明提供的过氧化氢响应的脂质体纳米探针的制备方法包括以下步骤:
将二棕榈酰磷脂酰胆碱(DPPC)、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)以及2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)以摩尔比6:4:0.5:12溶解在甲醇中,然后通过旋转蒸发形成脂质膜;
然后将其中加入0.2mg/ml的辣根过氧化物酶(HRP)磷酸盐缓冲溶液(PBS),并将混合液冷冻,然后在65℃下解冻;
将经过五次冻融后的溶液在200纳米的滤膜上过滤~50次,再通过S-300的凝胶柱纯化除去游离的2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)和辣根过氧化物酶(HRP)。
本发明提供的过氧化氢响应的脂质体纳米探针及其制备方法和应用中所用试剂、仪器或生物材料等均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1:制备过氧化氢响应的脂质体纳米探针(Lipo@HRP&ABTS):
以脂质体(liposome)为基底,在其亲水空腔中装载辣根过氧化物酶(HRP),疏水层用来装载2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),形成Lipo@HRP&ABTS。具体包括以下步骤:
将二棕榈酰磷脂酰胆碱(DPPC)、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)以及2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)以摩尔比6:4:0.5:12溶解在甲醇中,然后通过旋转蒸发形成脂质膜;然后将其中加入0.2mg/ml的辣根过氧化物酶(HRP)磷酸盐缓冲溶液(PBS)并将混合液在65℃下处理;将经过五次冻融后的溶液在200纳米的滤膜上过滤约50次,再通过S-300的凝胶柱纯化除去游离的2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)和辣根过氧化物酶(HRP)。然后,进行表征(透射、动态光散射)。
附图1是过氧化氢响应的脂质体纳米探针(Lipo@HRP&ABTS)的透射电镜照片,从图上可以看到Lipo@HRP&ABTS分布均匀并且粒径大约为~100nm。图2是上述Lipo@HRP&ABTS的激光粒径分布,如图2所示,Lipo@HRP&ABTS的水化半径约为100nm左右。进一步证明了本实施例成功合成了Lipo@HRP&ABTS。
实施例2:Lipo@HRP&ABTS的过氧化氢响应的特异性
为了研究Lipo@HRP&ABTS的过氧化氢响应的特异性,本实施例将Lipo@HRP&ABTS或Lipo@ABTS与不同的活性氧孵育,包括过氧化氢(H2O2),叔丁基过氧化氢(TBHP),次氯酸根(-OCl),羟自由基(·OH),叔丁基自由基(·OtBu),氧化氮自由基(NO·),过氧根(O2-)。
附图3是上述Lipo@HRP&ABTS与不同的活性氧孵育半小时后测得在800nm处的吸收。从图3中吸收数据,可以看到Lipo@ABTS几乎对所有的活性氧都不响应。Lipo@HRP&ABTS与过氧化氢孵育后在800nm处的吸收有明显的增强,而对其他类型的活性氧的响应并不是很强。因此,Lipo@HRP&ABTSS的确有非常好的过氧化氢响应的特异性。
实施例3:Lipo@HRP&ABTS过氧化氢浓度依赖的吸收
为了研究Lipo@HRP&ABTS的过氧化氢浓度依赖的近红外吸收,本实施例将Lipo@HRP&ABTS分散在不同浓度的过氧化氢溶液中(0.8-50.0μM),然后测其紫外可见光谱。结果如附图4所示,Lipo@HRP&ABTS在800nm处的吸光度与过氧化氢的浓度成比例增加。
由于Lipo@HRP&ABTS具有非常好的过氧化氢浓度依赖的近红外吸收,本实施例又对分散在不同浓度的过氧化氢溶液中Lipo@HRP&ABTS进行光声成像。结果如附图5所示,Lipo@HRP&ABT在800nm处的光声信号随过氧化氢浓度的增加而增加。因此,该过氧化氢Lipo@HRP&ABTS具有非常好的特异性和灵敏度。
实施例4:Lipo@HRP&ABTS用于脂多糖(LPS)诱导的炎症模型的检测
为了证明Lipo@HRP&ABTS纳米探针可用于活体过氧化氢的检测,本实施例通过腹腔注射脂多糖(LPS)来建立炎症模型。在模型建立24小时后,腹腔注射Lipo@HRP&ABTS和Lipo@ABTS后对小鼠腹部进行光声成像。
结果如图6所示,对建立了炎症模型的小鼠,在注射Lipo@HRP&ABTS后,小鼠腹部出现非常强的光声信号,而注射Lipo@ABTS后,小鼠腹部出现光声信号要弱很多。作为阴性对照,健康小鼠注射Lipo@HRP&ABTS后,小鼠腹部几乎没有光声信号。这些结果共同证明Lipo@HRP&ABTS可用于有炎症引起的体内过氧化氢的检测。从图中还能看到具有炎症的小鼠腹部的光声信号在注射Lipo@HRP&ABTS后20-30分钟内达到峰值,因此选择20分钟作为标准的成像时间。
另外,为了抑制LPS诱导的炎症,在LPS注射前连续给小鼠口服抗炎药(Celecoxib)三天。在LPS注射后的不同时间点,给小鼠腹腔注射Lipo@HRP&ABTS,并在20分钟后进行光声成像。结果如图7所示,小鼠腹部的光声信号从0小时到24小时逐渐增强。而Celecoxib提前处理的小鼠腹部的光声信号明显较弱,表面Celecoxib可以抑制炎症的进展。
实施例5:Lipo@HRP&ABTS用于肿瘤的成像
在癌细胞的生长过程中,炎症细胞和快速生长的肿瘤细胞会在肿瘤微环境中生成大量的过氧化氢。因此,过氧化氢响应的Lipo@HRP&ABTS纳米探针也许可以用于肿瘤的检测。将Lipo@ABTS、Lipo@HRP或者Lipo@HRP&ABTS通过尾静脉注射到携带有皮下肿瘤的小鼠体内,在不同时间点进行光声成像。实验结果如图8所示,注射了Lipo@HRP&ABTS小鼠肿瘤的光声信号随着时间而增强。
接下来,又进一步证明该纳米探针可用于淋巴转移瘤的成像。将癌细胞注射到小鼠的足部,大约12天后,小鼠的前哨淋巴结会有明显的转移瘤。然后,将Lipo@HRP&ABTS注射到足部的原发性肿瘤中,为了比较,将相同量的Lipo@HRP&ABTS注射到另一侧没有肿瘤的小鼠足部。在不同时间点,对小鼠的淋巴结进行光声成像。结果如图9所示,在有转移瘤的淋巴结中有非常明显的光声信号。因此,本发明的过氧化氢响应的纳米探针能非常准确的区分转移性淋巴结和正常的淋巴结。
实施例6:基于Lipo@HRP&ABTS的光热治疗
由于Lipo@HRP&ABTS有非常好的过氧化氢浓度依赖近红外吸收,因此Lipo@HRP&ABTS不仅是很好的过氧化氢探针,该探针也许可以作为过氧化氢激活的光热试剂。将PBS、Lipo@ABTS、Lipo@HRP或者Lipo@HRP&ABTS分别注射到携带有皮下肿瘤的小鼠体内。注射24小时后,在808nm激光器的照射10分钟,同时使用红外热成像仪来监测肿瘤部位的温度。结果如图10所示,注射了Lipo@HRP&ABTS的小鼠,其肿瘤表面温度从34℃快速升温至55℃。而对照组,在相同照射条件下,注射了其他纳米粒子小鼠肿瘤表面的温度几乎没有变化。
接下来,本实施例开展了光热治疗。选取5只背部带有4T1肿瘤的小鼠作为实验组,从尾静脉注射Lipo@HRP&ABTS,经过24小时后,然后将肿瘤部位暴露在808纳米激光下照射10min,激光功率为0.5W/cm2。另外三组背部带有肿瘤的小鼠(每组5只)做为对照组试验,分别注射磷酸盐缓冲液(PBS)、Lipo@ABTS或Lipo@HRP,并在相同功率的激光下照射10min。当处理完每组小鼠之后,小鼠背部的肿瘤体积每隔二天测量一次,体积的计算方法是:长*宽/2。试验结果如图11所示,小鼠注射了Lipo@HRP&ABTS并在808纳米激光照射下,其肿瘤几乎全部消除。
实施例7:基于Lipo@HRP&ABTS对淋巴转移瘤的光热效应
除了皮下肿瘤模型,本发明还研究了Lipo@HRP&ABTS在淋巴肿瘤模型上的光热效应。在小鼠的足部(有或者没有肿瘤)分布注射了Lipo@HRP&ABTS,4小时后,对小鼠的淋巴结进行激光照射5分钟,同时用热成像仪监测淋巴结的温度。结果如图12所示,有转移瘤的淋巴结的温度有明显的升高,而在相同照射条件下正常淋巴结表面的温度几乎没有变化。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!