具有经皮给药功能的金纳米棒‑脂质聚合物囊泡及其制备方法和应用与流程
本发明涉及医药技术领域,尤其涉及一种具有经皮给药功能的金纳米棒-脂质聚合物囊泡及其制备方法和应用。
背景技术:
透皮给药系统(transdermal therapeutic system,TTS)是指在皮肤表面给药,药物以恒定速度依次穿透角质层、表皮层、真皮层,最终进入体循环,产生全身或局部治疗作用的新兴制剂。与口服和注射给药相比,有以下3个优点:1.给药方式便捷,对人体影响较小并且在发生副作用时可以及时停止给药;2.能够避免肝脏产生的首过效应,提高药物生物利用度;3.有利于药物在一段时间内可控,缓慢的释放。然而,角质层在有效隔绝有害物质的同时,也阻碍了药物的经皮渗透,研究发现,仅有一些小分子药物能够在没有外界帮助的情况下穿透角质层或者通过汗腺、毛孔等途径直接进入皮肤。大多数药物,即使是剂量低、疗效高的一些药物,透皮速率也难以满足治疗需要,这成为研究开发TTS的最大障碍。如何保证足够量的药物透过皮肤进入体内达到治疗剂量,是TTS研究的重点,高新技术及方法的应用是解决问题的重要途径。
黑色素瘤是皮肤肿瘤中恶性程度最高的一种,临床上很难治愈。黑色素瘤极易发生转移,化学药物容易引起其耐药,导致对化学药物不敏感。黑色素瘤受到多种致癌基因的调控,与基因突变有着密切的联系。所以基因治疗黑色素瘤,可以从根源上改变黑色素瘤的基因表达。这种治疗策略理论上可以取得更加理想的抗肿瘤效果。黑色素瘤通常发病于皮肤表皮层与真皮层之间,直接通过经皮给药的方式能够直接将药物靶向的传递到肿瘤部位,更加高效的发挥抗肿瘤效果。
在众多促进透皮的策略中,使用纳米粒携载药物能够有效提高透皮的效率。纳米粒是指尺寸小于1000nm的颗粒。由于尺寸效应,纳米粒的颜色、磁性、光学、导热等许多特性与整体状态相比,均发生较大改变。近年来,针对这些纳米粒的制备工艺、表面修饰等研究取得了长足的进步,使纳米粒越来越广泛地应用在药物递送、成像(MRI、光声成像)以及诊断等生物医学领域。在透皮给药方面,纳米给药技术提高了药物在载体中的浓度,并能够使其在皮肤中缓慢可控的释放。纳米粒还能够携载不同物理性质的药物(亲水性和疏水性),提高它们的溶解度与体内生物利用度。使用纳米粒携载药物也能够促进药物的透皮效果,但是对于一些大分子药物,例如多肽,蛋白质,siRNA以及质粒DNA,它们由于自身的亲水性、较大的粒径和分子量,几乎无法穿透皮肤角质层。近年来,有许多研究者报道了促进这些大分子药物穿透皮肤的方法。这些方法包括超声波法、电离子导入法、微针和电穿孔法等。但是,绝大多数的此类研究都需要联合超声波或外加磁场来促进透皮效率,才能够达到理想的治疗效果,一些化学促渗剂虽然也可以提高药物的透皮效果,然而化学促渗剂往往会破坏皮肤的角质层结构,对皮肤产生一定的刺激性。
技术实现要素:
针对上述不足,本发明提供了具有经皮给药功能的金纳米棒-脂质聚合物囊泡及其制备方法和应用,该金纳米棒-脂质聚合物囊泡可以携载基因药物,促进基因药物进入皮肤真皮层,且在皮肤酸性PH条件下仍具有良好的稳定性和生物相容性,可以结合基因药物进行皮肤靶向经皮给药。
本发明解决技术问题所采用的技术方案如下:一种具有经皮给药功能的金纳米棒-脂质聚合物囊泡,所述纳米囊泡包括脂质聚合物囊泡及附着在脂质聚合物囊泡内的金纳米棒。
进一步的,所述金纳米棒的接枝率为1%-50%。
进一步的,所述金纳米棒的粒径为1-20nm。
本发明还提供一种具有经皮给药功能的金纳米棒-脂质聚合物囊泡的制备方法,该方法包括如下步骤:
取浓度为0.1-1mg/mL的脂质聚合物囊泡和浓度为0.1-1mg/mL的金纳米棒按照质量比1:1组成的混合物0.01-1重量份,加入到100重量份的浓度为1-10mg/mL十二烷基硫酸钠水溶液中,在超声作用下滴加水,滴加的水占滴加前的总体积百分分数为1%-10%,进行第一次乳化,随后将所得到的乳化液在超声作用下滴加到浓度为1-10mg/mL的聚乙烯醇水溶液中进行第二次乳化,直到反应溶液完全乳化并均匀分散在聚乙烯醇水溶液中,不出现分层,再放置于8000~14000Da透析袋中进行透析,即得负载金纳米棒-脂质聚合物囊泡。
进一步的,所述脂质聚合物囊泡的制备过程如下:
在脉冲超声下,将聚合物PSAA与超纯水按照质量比为1:1~1:10的比例混合搅拌,加入按任意比混合的二油酰磷脂酰乙醇胺和(2,3-二油酰基-丙基)-三甲胺作为表面活性剂,表面活性剂与聚合物PSAA和超纯水的混合溶液的质量比为0.01%-1%,制备得脂质聚合物囊泡。
进一步的,所述聚合物PSAA的分子量为1KDa-100KDa。
进一步的,所述聚合物PSAA制备过程如下:
将烯丙醇(AA)、过氧化二异丙苯(DCP)和苯乙烯(ST)加入到反应器中,以氮气为保护剂,其中烯丙醇和苯乙烯作为反应原料,两者质量配比为1:1~10:1,过氧化二异丙苯作为引发剂,加入量为反应原料质量的0.1%-10%,反应温度为50℃~150℃,反应时间为1h-10h,最终制得聚合物PSAA。
本发明的另一目的是提供一种携载药物的金纳米棒-脂质聚合物囊泡,包括药物和载体,所述载体为上述的金纳米棒-脂质聚合物囊泡,药物包裹在囊泡中。
进一步的,,所述金纳米棒-脂质聚合物囊泡的粒径为50nm-200nm。
进一步的,所述药物为DNA、siRNA或miRNA基因类药物,所述基因类药物优选为miRNA Let 7b、miRNA-221抑制基因、siRNA BRAF、siRNA VEGF、siRNAc-Myc、siRNA PGP中的一种或多种。
与现有技术相比,本发明具有以下有益效果:
(1)本发明首次将金纳米棒连接在脂质聚合物囊泡中,在近红外光的照射下,使其不仅可以促进药物释放,还能够加强纳米载体的透皮效果。
(2)使用具有透皮效果的脂质材料修饰了囊泡纳米粒,脂质材料对促进纳米粒透皮起到关键作用。
(3)基因药物通常是大分子亲水性药物,几乎不能穿透皮肤,而使用金纳米棒-脂质聚合物囊泡携载基因药物之后,使基因药物穿透皮肤的能力显著加强,高效的穿透了皮肤组织,实现皮肤的局部靶向给药。
(4)为增强药物的透皮效率和抗肿瘤效果,本发明使用具有光热效应的金纳米棒对脂质聚合物囊泡进行了修饰,最终形成金纳米棒-脂质聚合物囊泡。金纳米棒是一种具有较高光热转换效率的材料,将其涂抹在肿瘤部位,使其靶向聚集在肿瘤组织附近,并在近红外光的照射下将光能转化为热能,热能一方面可以促进金纳米棒-脂质聚合物囊泡的透皮效果,另一方面可以促进基因药物从载体中释放,并产生较高热量杀死癌细胞。
(5)本发明得制备了金纳米棒-脂质聚合物囊泡这一种全新的非病毒基因载体,其表面的可修饰性、高载药量、良好的生物相容性、并可以结合光热治疗使其成为了一种有创新的,有巨大应用潜力的药物载体,有望运用在经皮药物递送,抗肿瘤和基因治疗等多个方面。目前为止,还未见金纳米棒结合在脂质聚合囊泡的设计,而将其运用在透皮基因治疗皮肤黑色素的研究也未见报道。
附图说明
图1为金纳米棒-脂质聚合物囊泡制备前,所用金纳米棒的粒径图;
图2为金纳米棒-脂质聚合物囊泡合成前,脂质聚合物囊泡粒径图;
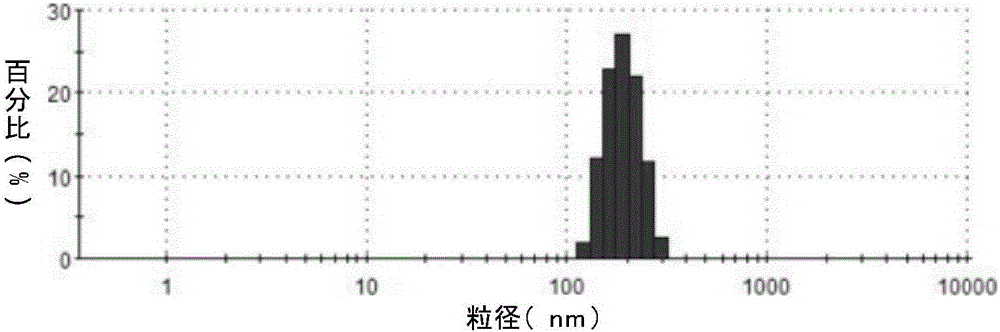
图3为金纳米棒-脂质聚合物囊泡的粒径图;
图4为得到金纳米棒的TEM电镜图;
图5为最终得到金纳米棒-脂质聚合物囊泡TEM电镜图;
图6为Transwell实验考察金纳米棒-脂质聚合物囊泡携载基因药物之后对肿瘤细胞迁移能力的影响图;
图7为MTT实验考察金纳米棒-脂质聚合物囊泡携载基因药物之后抗肿瘤的效果图;
图8为激光共聚焦显微镜考察金纳米棒-脂质聚合物囊泡携载绿色荧光基因药物之后的透皮效果图;
图9为不同样品给药后,肿瘤的生长曲线图;
图10为结束给药后,取出肿瘤后,对各个组肿瘤大小拍照;
图11为对肿瘤组织进行切片,使用TUNEL染色考察肿瘤内部细胞凋亡情况图。
具体实施方式
下面结合实施例和附图对本发明做进一步的说明。
实施例1:
金纳米棒-脂质聚合物囊泡的制备
(1)聚合物PSAA的制备
以高压反应釜为反应器,将烯丙醇(AA)、过氧化二异丙苯(DCP)和苯乙烯(ST)加入到反应器中,以氮气为保护剂,其中烯丙醇和苯乙烯作为反应原料,两者质量分别0.5g与0.5g,过氧化二异丙苯作为引发剂,加入量为1mg,反应温度为50℃,反应时间为1h,最终制得聚合物PSAA。
(2)脂质聚合物囊泡的制备
在脉冲超声下,将聚合物5gPSAA与5mL超纯水混合搅拌,加入按任意比混合的二油酰磷脂酰乙醇胺和(2,3-二油酰基-丙基)-三甲胺作为表面活性剂,表面活性剂的质量为1mg,制备得脂质聚合物囊泡。
(3)金纳米棒的制备
当光入射金纳米棒时,金属表面的自由电子与入射光的电磁场发生共振耦合,产生表面等离子体共振(SPR)。SPR可以导致了自由电子与金属核的电荷分离,进而使金纳米棒对光产生较强的吸收和散射,其对光的吸收和散射是荧光分子的105到106倍,并将吸收的光能快速的转化为热量,使金纳米棒本身产生较高的温度。激光照射可以引发金纳米棒产生光热效应,光热治疗的效果与激光照射功率和时间相关,激光照射功率为1w,时间为1min。
配制0.5mL 0.01mol/L的HAuCl4溶液和9.5mL 0.1mol/L的CTAB溶液,将两溶液混合搅拌,再加入1mL 0.01mol/L的NaBH4溶液,于室温下放置2h后,即得到金纳米棒种子溶液;将2mL 0.01mol/L的HAuCl4溶液、0.4mL 0.01mol/L的AgNO3溶液以及10mL 0.1mol/L的CTAB溶液混合,依次加入0.1mL 0.01mol/L抗坏血酸和0.1mL 1.0mol/L的盐酸,混合摇匀后,向其中加入已经制备好的金纳米棒种子溶液,将混合溶液均匀晃动1s后,再静置8h,即得金纳米棒。
(4)金纳米棒-脂质聚合物囊泡的制备
取2mL浓度为0.1mg/mL的脂质聚合物囊泡和2mL浓度为0.1mg/mL的金纳米棒搅拌均匀,加入到4mL浓度为1mg/mL的十二烷基硫酸钠水溶液中,在超声作用下继续滴加0.08mL超纯水,进行第一次乳化,随后将所得到的乳化液在超声作用下滴加到浓度为1mg/mL的聚乙烯醇水溶液中进行第二次乳化,直到反应溶液完全乳化并均匀分散在聚乙烯醇水溶液中,不出现分层,再放置于8000~14000Da透析袋中进行透析,即得负载金纳米棒-脂质聚合物囊泡。
(5)金纳米棒-脂质聚合物囊泡的携载基因药物的方法
提前将100μg基因药物混合在4mL浓度为1mg/mL十二烷基硫酸钠水溶液中,所述基因药物为DNA、siRNA或miRNA基因类药物,所述基因类药物优选为miRNA Let 7b、miRNA-221抑制基因、siRNA BRAF、siRNA VEGF、siRNAc-Myc、siRNA PGP中的一种或多种。取2mL浓度为0.1mg/mL的脂质聚合物囊泡和2mL浓度为0.1mg/mL的金纳米棒搅拌均匀,加入到含有基因药物的十二烷基硫酸钠水溶液中,在超声作用下继续滴加0.08mL超纯水,进行第一次乳化,随后将所得到的乳化液在超声作用下滴加到浓度为1mg/mL的聚乙烯醇水溶液中进行第二次乳化,直到反应溶液完全乳化并均匀分散在聚乙烯醇水溶液中,不出现分层,再放置于8000~14000Da透析袋中进行透析,即得携载基因药物的负载金纳米棒-脂质聚合物囊泡。
实施例2:
金纳米棒-脂质聚合物囊泡的制备
(1)聚合物PSAA的制备
以高压反应釜为反应器,将烯丙醇(AA)、过氧化二异丙苯(DCP)和苯乙烯(ST)加入到反应器中,以氮气为保护剂,其中烯丙醇和苯乙烯作为反应原料,两者质量分别5g与0.5g,过氧化二异丙苯作为引发剂,加入量为550mg,反应温度为150℃,反应时间为10h,最终制得聚合物PSAA。
(2)脂质聚合物囊泡的制备
在脉冲超声下,将聚合物5gPSAA与50mL超纯水混合搅拌,加入按任意比混合的二油酰磷脂酰乙醇胺和(2,3-二油酰基-丙基)-三甲胺作为表面活性剂,表面活性剂的质量为550mg,制备得脂质聚合物囊泡。
(3)金纳米棒的制备
当光入射金纳米棒时,金属表面的自由电子与入射光的电磁场发生共振耦合,产生表面等离子体共振(SPR)。SPR可以导致了自由电子与金属核的电荷分离,进而使金纳米棒对光产生较强的吸收和散射,其对光的吸收和散射是荧光分子的105到106倍,并将吸收的光能快速的转化为热量,使金纳米棒本身产生较高的温度。激光照射可以引发金纳米棒产生光热效应,光热治疗的效果与激光照射功率和时间相关,激光照射功率为5w,时间为10min。
配制0.5mL 0.05mol/L的HAuCl4溶液和9.5mL 0.5mol/L的CTAB溶液,将两溶液混合搅拌,再加入1mL 0.05mol/L的NaBH4溶液,于室温下放置2h后,即得到金纳米棒种子溶液;将2mL 0.05mol/L的HAuCl4溶液、0.4mL 0.05mol/L的AgNO3溶液以及100mL 0.5mol/L的CTAB溶液混合,依次加入0.5mL 0.01mol/L抗坏血酸和1mL 1.0mol/L的盐酸,混合摇匀后,向其中加入已经制备好的金纳米棒种子溶液,将混合溶液均匀晃动10s后,再静置8h,即得金纳米棒溶液。
(4)金纳米棒-脂质聚合物囊泡的制备
取2mL浓度为1mg/mL的脂质聚合物囊泡和2mL浓度为1mg/mL的金纳米棒搅拌均匀,加入到40mL浓度为10mg/mL的十二烷基硫酸钠水溶液中,在超声作用下继续滴加4.4mL超纯水,进行第一次乳化,随后将所得到的乳化液在超声作用下滴加到浓度为10mg/mL的聚乙烯醇水溶液中进行第二次乳化,直到反应溶液完全乳化并均匀分散在聚乙烯醇水溶液中,不出现分层,再放置于8000~14000Da透析袋中进行透析,即得负载金纳米棒-脂质聚合物囊泡。
(5)金纳米棒-脂质聚合物囊泡的携载基因药物的方法
将1mg基因药物混合在40mL浓度为10mg/mL十二烷基硫酸钠水溶液中,所述基因药物为DNA、siRNA或miRNA基因类药物,所述基因类药物优选为miRNA Let 7b、miRNA-221抑制基因、siRNA BRAF、siRNA VEGF、siRNAc-Myc、siRNA PGP中的一种或多种。取2mL浓度为1mg/mL的脂质聚合物囊泡和2mL浓度为1mg/mL的金纳米棒搅拌均匀,加入到含有基因药物的十二烷基硫酸钠水溶液中,在超声作用下继续滴加4.4mL超纯水,进行第一次乳化,随后将所得到的乳化液在超声作用下滴加到浓度为10mg/mL的聚乙烯醇水溶液中进行第二次乳化,直到反应溶液完全乳化并均匀分散在聚乙烯醇水溶液中,不出现分层,再放置于8000~14000Da透析袋中进行透析,即得携载基因药物的负载金纳米棒-脂质聚合物囊泡。
实施例3:
金纳米棒-脂质聚合物囊泡的验证
(1)对金纳米棒-脂质聚合物囊泡进行粒径测量
首先使用超纯水将实施例1合成好的金纳米棒调整至100μg/mL,在马尔文激光粒径仪下测量金纳米棒的尺寸,结果如图1所示。
使用超纯水将实施例1合成好的脂质聚合物囊泡调整至100μg/mL,在马尔文激光粒径仪下测量脂质聚合物囊泡的尺寸,结果如图2所示。
使用超纯水将实施例1合成好的金纳米棒-脂质聚合物囊泡调整至100μg/mL,在马尔文激光粒径仪下测量金纳米棒-脂质聚合物囊泡的尺寸,结果如图3所示。
(2)对金纳米棒进行形态观察
取实施例1金纳米棒溶液,滴加在专用铜网上,直接在透射电镜下观察粒子的大小和形态,结果如图4所示。
(3)对空载的金纳米棒-脂质聚合物囊泡进行形态观察
取实施例1空载的金纳米棒-脂质聚合物囊泡,滴加在专用铜网上,直接在透射电镜下观察粒子的大小和形态,结果如图5所示。
(4)考察金纳米棒-脂质聚合物囊泡携载基因后对细胞迁移的影响
用Transwell培养板(直径6.5mm,孔径8μm)考察B16F10的体外迁移能力。将B16F10细胞,按照每孔5×104个细胞的密度种在24孔板中,置于细胞培养箱培养24小时后,弃去培养液并用PBS洗两遍,每孔加入500μL不含血清的DMEM高糖培养液。用5wt%蔗糖水溶液稀释金纳米棒-脂质聚合物囊泡携载基因后形成的复合物。分别取10μL、20μL、40μL已配置好的携载基因药物的负载金纳米棒-脂质聚合物囊泡(基因药物的浓度为400μg/mL),分别加入30μL、20μL、0μL 5wt%的蔗糖溶液进行稀释,使终体积为40μL,每孔加入40μL上述复合物,使基因药物终浓度为4μg/mL、8μg/mL和12μg/mL。另取2μg游离的基因药物,使用5wt%蔗糖水溶液稀释至40μL后加入24孔板中。5wt%CO2条件下转染B16F10细胞,6小时后将每孔培养液替换成含10wt%胎牛血清的DMEM培养液,继续培养24小时后,对细胞进行饥饿处理:将不同药物处理过细胞的上层培养液替换为不含血清培养液,孵育过夜。将饥饿处理过的细胞以每孔3×104的浓度加入Transwell板的上层,下层加入600μL含有10wt%血清的培养液,继续培养48h,取出上层插件,用棉签轻轻擦去膜上层的细胞,迁移到下层的细胞用4wt%多聚甲醛固定20min,PBS洗三次,细胞用结晶紫染色。使用荧光显微镜观察细胞的迁移情况,结果如图6所示。
(5)考察金纳米棒-脂质聚合物囊泡携载基因后抗肿瘤效果
以每孔1×104个细胞的密度将对数生长的B16F10细胞种在96孔板中,置于细胞培养箱培养24小时后,除去培养液并用PBS洗两遍,每孔加入100μL不含血清的DMEM高糖培养液。用5wt%蔗糖水溶液稀释裸基因药物,空载金纳米棒-脂质聚合物囊泡载体,携载不同浓度基因药物的金纳米棒-脂质聚合物囊泡溶液。在37℃,5wt%CO2条件下转染B16F10细胞,6小时后将每孔培养液替换成含10wt%胎牛血清的DMEM培养液,继续培养24小时后,每孔加入20μL浓度为5mg/mL MTT溶液,孵育4h后除去培养液,每孔加入150μL DMSO,振摇使结晶完全溶解后,在酶标仪上于570nm下测定各组OD值。结果如图7所示。
(6)考察金纳米棒-脂质聚合物囊泡携载基因后透皮效果
取6周龄的Babl/c雌性小鼠,在实验前约24h,用5wt%水合氯醛麻醉小鼠。用手术剪刀将小鼠背部毛小心减掉,不可剪破皮肤。随后,用温水将小鼠背部润湿后,均匀涂抹脱毛膏,使整个背部与脱毛膏充分接触。室温下孵育10min,用温水将小鼠背部脱毛膏清洗干净,正常饲养。次日处死小鼠,取下背部皮肤,将皮肤剪至适合Franz透皮扩散池的大小,固定在供给池与接收池之间。在供给池中加入0.5mL提前制备的FITC标记的质粒DNA和携载FITC标记的质粒DNA的金纳米棒-脂质聚合物囊泡复合物。接收池加入PBS缓冲液(pH=7.4),透皮扩散池维持在37℃的水温,搅拌子转速为250rpm。在透皮结束后,将每组皮肤取下,用棉签小心擦去表面残留液体,PBS洗2遍,将其固定在载玻片上,置于激光共聚焦下进行竖直方向上的Z轴扫描,考察不同样品处理皮肤后,FITC标记的质粒DNA在皮肤中的分布。结果如图8所示。
(7)考察金纳米棒-脂质聚合物囊泡携载基因后的体内抗肿瘤效果
建立荷皮肤黑色素瘤的裸鼠模型:将100μL含1×106~1×107个B16F10细胞的PBS溶液皮下注射在裸鼠右前侧,待肿瘤生长至一定大小时,随机分为4组。将载基因药物的金纳米棒-脂质聚合物囊泡、载阴性对照基因的金纳米棒-脂质聚合物囊泡、空载金纳米棒-脂质聚合物囊泡提前制备好,使每只裸鼠每次的给药剂量包含1~100μg的基因药物,每次给药10~100μL。每天测量肿瘤体积的变化和裸鼠体重变化情况。其体内抗肿瘤结果如图9所示。给药结束后,取出肿瘤并拍照,肿瘤大小如图10所示。
给药结束后,取出肿瘤并制备成石蜡切片,使用TUNEL染色考察肿瘤内部细胞的凋亡情况,结果如图11所示。
- 还没有人留言评论。精彩留言会获得点赞!