预防和治疗柯萨奇病毒所致疾病的疫苗及其制备方法与应用与流程
本发明涉及生物技术领域中,预防和治疗柯萨奇病毒所致疾病的疫苗及其制备方法与应用。
背景技术:
柯萨奇病毒(coxsackievirus,cv)为单股正链rna病毒,属于小rna病毒科,肠道病毒属。柯萨奇病毒颗粒为二十面体立体对称,呈球形,直径约23~33nm,核衣壳裸露,无包膜和突起;柯萨奇病毒基因组只包含一个开放阅读框架(orf),编码一个较长的多聚蛋白前体。该orf依次分为p1、p2和p33个区,其中p1区编码病毒的结构蛋白vp1~vp4,组成病毒衣壳。p2和p3区编码非结构蛋白。
柯萨奇病毒是引起儿童手足口病(hfmd)的主要病原体,尤其是3岁以内的婴幼儿,能够导致其严重的神经系统并发症。引起hfmd的肠道病毒(evs)主要包括四种类型:ev-a、ev-b、ev-c和ev-d。柯萨奇病毒a6型(cva6)属于肠道病毒a组,共16个亚型,其中亚型a组11个和b组5个。根据基因型的不同,cva6划分为a~e五个分支,e基因型又分为e1和e2基因亚型。自2008年cva6首次爆发于芬兰以来,e2亚型成为世界范围内流行的主要基因型。临床数据表明,相比经典的hfmd病例,e2亚型cva6感染人后往往会导致更严重的呼吸系统和神经系统疾病。更重要的是,该病毒感染会导致严重的疱疹性咽峡炎,甚至引起新生儿的死亡。同时,该亚型病毒在流行季节很容易跟其它型肠道病毒混合感染,给疾病的治疗和诊断带来很多困难。
在2010年之前,hfmd主要由ev71和ca16两种类型肠道病毒引起,关于cva6的报道非常少。近几年,cva6在全世界范围内流行,尤其是泛太平洋地区,包括中国台湾、新加坡、日本和泰国等,很多地区cva6已取代ev71和ca16成为导致hfmd的主要流行株。自2011至2015年,欧洲和北美等其它国家和地区流行的肠道病毒也是cva6。目前,在中国大陆的很多城市cva6呈现爆发式流行,比如深圳、上海和青岛等地,其发病率和死亡率逐年升高。所以,e2型cva6已逐渐成为在全世界范围内流行且能导致严重并发症的hfmd病原体。
由于其它型肠道病毒(非ev71和非ca16)所引起的临床表现轻微,致病性较弱,并未引起人们对cva6的关注。最近的报告表明,近期流行的e2型cva6感染会导致严重的中枢神经系统(cns)急性并发症,如无菌性脑膜炎、脑干脑炎、和急性弛缓性麻痹等。目前关于手足口病的发病机制还不清楚,特别是cva6的致病机理尚未报道,筛选抗cva6药物和疫苗缺乏稳定的动物感染模型,抗cva6药物和疫苗的开发也受到制约。
技术实现要素:
本发明所要解决的技术问题是如何治疗和/或预防柯萨奇病毒a6型所致疾病。
为解决上述技术问题,本发明首先提供了一种预防和/或治疗柯萨奇病毒所致动物疾病疫苗的制备方法。
本发明所提供的预防和/或治疗柯萨奇病毒所致动物疾病疫苗的制备方法,包括:将柯萨奇病毒a6型毒株作为活性成分制备得到所述疫苗;
所述柯萨奇病毒a6型毒株可为在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为cgmccno.13393的毒株,该毒株的名称为wf057r。
上述方法中,所述柯萨奇病毒a6型毒株可为灭活的柯萨奇病毒a6型毒株。
上述方法具体可包括将所述柯萨奇病毒a6型毒株与免疫佐剂混合得到所述疫苗。
上述方法中,所述免疫佐剂可为完全弗氏佐剂或不完全弗氏佐剂。
上述方法中,所述疫苗可为预防和/或治疗柯萨奇病毒a6型所致动物疾病的疫苗。
为解决上述技术问题,本发明还提供了由所述的方法制备的疫苗。
为解决上述技术问题,本发明还提供了预防和/或治疗柯萨奇病毒所致动物疾病的产品,所述产品为下述1)或2):
1)含有所述柯萨奇病毒a6型毒株的产品;
2)利用所述柯萨奇病毒a6型毒株制备的抗血清。
所述产品可仅以上述a1)作为活性成分,还可以将a1)与其他具有相同功能的物质组合在一起作为活性成分。
上述1)所述产品可为药物或疫苗。
所述抗血清可为利用所述柯萨奇病毒a6型毒株免疫动物得到的抗血清。所述动物可为哺乳动物。所述哺乳动物具体可为小鼠(如icr小鼠)。
为解决上述技术问题,本发明还提供了所述方法在制备预防和/或治疗柯萨奇病毒所致动物疾病产品中的应用。
所述产品可为药物或疫苗。
为解决上述技术问题,本发明还提供了由所述的方法制备的疫苗在预防和/或治疗柯萨奇病毒所致动物疾病中的应用。
本发明中,所述动物可为哺乳动物。所述哺乳动物具体可为小鼠(如icr小鼠)。
本发明中,所述柯萨奇病毒所致动物疾病可为柯萨奇病毒a6型所致动物疾病,但不限于柯萨奇病毒a6型所致动物疾病。
本发明筛选了一株具有代表性的cva6毒株wf057r,利用该毒株制备的疫苗和cva6抗血清具有治疗和预防cva6所致疾病的作用,并且cva6毒株wf057r的母传抗体对新生乳鼠也具有保护作用。
生物材料保藏说明
生物材料的分类命名:柯萨奇病毒a6型(coxsackievirus)
生物材料的菌株编号:wf057r
生物材料的保藏单位名称:中国微生物菌种保藏管理委员会普通微生物中心
生物材料的保藏单位简称:cgmcc
生物材料的保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码:100101
生物材料的保藏日期:2016年12月26日
生物材料的保藏中心登记入册编号:cgmccno.13393
附图说明
图1为不同感染条件组合下接种cva6毒株wf057r乳鼠的临床表现、体重变化及生存率变化。a-c分别为5日龄乳鼠不同接种剂量和不同接种途径组合;d-f为不同剂量经im途径接种3、7、9日龄乳鼠。
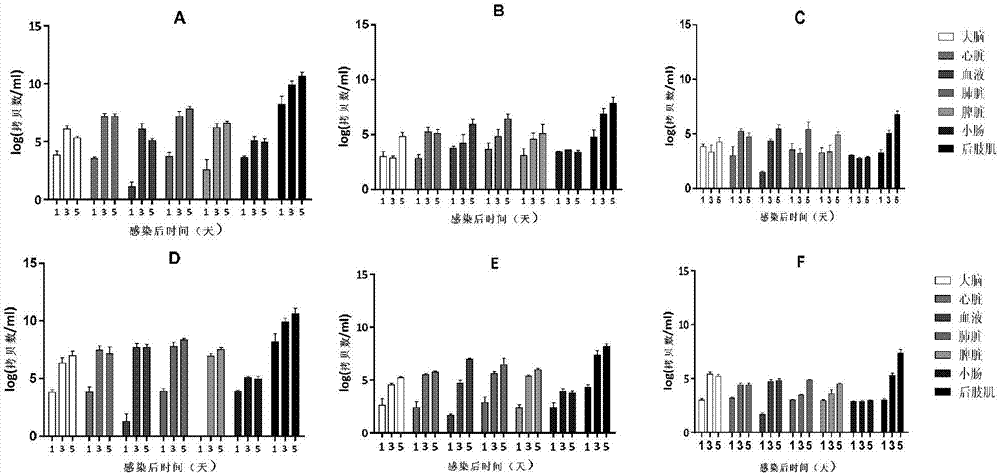
图2为5日龄乳鼠接种cva6后不同组织内病毒载量的变化。a-c的接种剂量均为105.5tcid50/只,a为5日龄乳鼠经肌肉注射感染cva6病毒后各组织病毒载量随感染天数变化情况,b为5日龄乳鼠经腹腔注射感染cva6病毒后各组织病毒载量随感染天数变化情况,c为5日龄乳鼠经脑内注射感染cva6病毒后各组织病毒载量随感染天数变化情况;d-f的接种剂量均为107tcid50/只,d为5日龄乳鼠经肌肉注射感染cva6病毒后各组织病毒载量随感染天数变化情况,e为5日龄乳鼠经腹腔注射感染cva6病毒后各组织病毒载量随感染天数变化情况,f为5日龄乳鼠经脑内注射感染cva6病毒后各组织病毒载量随感染天数变化情况。其中,log的底数均为10。
图3为5日龄乳鼠感染310ld50剂量cva6后1~5dpi外周血中炎性细胞因子的表达变化。cva6代表接毒组,nc代表未接毒组,纵坐标的c表示表达量。
图4为新生乳鼠感染cva6毒株wf057r后大脑组织的he染色和ihc结果。a:5dpi的he染色;b:he阴性对照;c:5dpi的ihc染色;d:ihc阴性对照。a和b放大200x,c和d放大400x。
图5为新生乳鼠感染cva6毒株wf057r后心脏组织的he染色和ihc结果。a:5dpi的he染色;b:he阴性对照;c:5dpi的ihc染色;d:ihc阴性对照。a~d放大200x。
图6为新生乳鼠感染cva6毒株wf057r后肺脏组织的he染色和ihc结果。a:5dpi的he染色;b:he阴性对照;c:5dpi的ihc染色;d:ihc阴性对照。a~d放大200x。
图7为新生乳鼠感染cva6毒株wf057r后骨骼肌的he染色和ihc结果。a:5dpi的he染色;b:he阴性对照;c:5dpi的ihc染色;d:ihc阴性对照。a~d放大200x。
图8为新生乳鼠感染cva6毒株wf057r后肠道的he染色和ihc结果。a:5dpi的he染色;b:he阴性对照;c:5dpi的ihc染色;d:ihc阴性对照。a~d放大200x。
图9为cva6抗血清在体内通过被动免疫对乳鼠的保护作用。
图10为cva6灭活全病毒免疫雌鼠母传抗体对乳鼠的保护作用。
图11为cva6抗血清体内对不同发病程度乳鼠的治疗效果。其中,cva6表示cva6对照组乳鼠。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中的rd细胞(陈国清,王瑶,许晓庆,邵荣标.肠道病毒ev71和cva6分离效果的影响因素分析[j].江苏预防医学,2015,26(4):4-5.)为人横纹肌瘤rd细胞(rhabdomyomacell),由山东省疾病预防与控制中心病毒性传染病防制所惠赠,经山东省疾病预防与控制中心病毒性传染病防制所同意后公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的mem维持液为gibco产品。
下述实施例中的乳鼠、雌鼠与成年鼠均为北京维通利华实验动物技术有限公司的spf级icr小鼠。其中,5日龄乳鼠的体重为4±0.5g。
下述实施例中的柯萨奇病毒的不同地方临床分离株
wh15066/shandong/china/2015、dy003r/shandong/china/2015、
dy005r/shandong/china/2015和lw03r/shandong/china/2015均为柯萨奇病毒a6型(cva6)毒株,其中wh15066/shandong/china/2015的基因组序列为将ncbi中的genbank号为ky126092.1的序列中的t替换为u得到的序列,
dy003r/shandong/china/2015的基因组序列为将ncbi中的genbank号为ky126089.1的序列中的t替换为u得到的序列,dy005r/shandong/china/2015的基因组序列为将ncbi中的genbank号为ky126090.1的序列中的t替换为u得到的序列,
lw03r/shandong/china/2015的基因组序列为将ncbi中的genbank号为ky126091.1的序列中的t替换为u得到的序列,公众可从申请人处获得这些生物材料,这些生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
实施例1、柯萨奇病毒a6型(cva6)毒株wf057r的分离与鉴定
发明人于2015年从山东省一名手足口患儿粪便中分离得到一柯萨奇病毒a6型(coxsackievirus)毒株,将该毒株命名为wf057r。柯萨奇病毒a6型(coxsackievirus)毒株wf057r已于2016年12月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmccno.13393。
实施例2、利用柯萨奇a6病毒毒株wf057r制备cva6感染动物模型
一、wf057r的培养
将rd细胞接种于培养基1(培养基1为向mem维持液中添加胎牛血清、青霉素和链霉素得到的液体,其中胎牛血清的质量百分浓度为10%,青霉素的质量百分浓度为1%,链霉素的质量百分浓度为1%)中,于温度为37℃、5%浓度co2的细胞培养箱中培养,得到rd细胞培养液。将实施例1的柯萨奇a6病毒毒株wf057r接种于rd细胞培养液中的rd细胞上,至细胞出现致细胞病变效应(cytopathiceffect,cpe)面积超过80%时,收集细胞培养液,得到cva6毒株wf057r病毒液,于96孔板通过有限稀释法进行病毒定量,测定病毒tcid50后分装于离心管中,保存于-80℃冰箱。
二、cva6感染动物模型的制备
通过肌肉注射(intramuscularinjection,im)、腹腔注射(intraperitonealinjection,ip)和颅腔注射(intracerebralinjection,ic)三种不同的感染途径分别与104、105.5、107tcid50/只三种不同的感染剂量相组合,探索建立3日龄乳鼠cva6感染模型最佳的接种途径和感染剂量。确定最佳接种途径后,再经此途径分别与105.5和107tcid50/只两种感染剂量组合探索cva6对大日龄(5、7、9日龄)乳鼠的致病情况,最终确定建立cva6模型的最佳日龄、接种途径和感染剂量,感染条件组合见表1。
利用文献(maoq,wangy,gaor,shaoj,yaox,langs,wangc,maop,liangz,wangj.aneonatalmousemodelofcoxsackievirusa16forvaccineevaluation.jvirol.2012;86(22):11967-76.)中的方法,依据reed&muench公式计算5日龄乳鼠的半数致死量ld50(reedlj,muenchh.asimplemethodofestimating50percentend-points.am.j.hyg.1938,27:493-497.)。乳鼠感染cva6毒株wf057r后1天(1daypostinfection,1dpi)~12dpi连续观察感染乳鼠的临床表现、体重变化及生存率变化。每组均设置阴性对照组(ns),即以相同的接种途径注射等体积的生理盐水。
注:肌肉接种,im;腹腔接种,ip;颅腔接种,ic;生理盐水,ns。
临床评分标准:为评价病毒株对乳鼠致病的严重程度,对不同的临床表现赋予不同的分值,本研究采用常用的临床评分标准(表2)。
表2、临床标准评分
结果显示,对照组相同日龄各小鼠的体重、生存率及临床得分均无显著差异。5日龄乳鼠经im、ip和ic感染剂量为104tcid50cva6毒株wf057r的实验组平均体重相对阴性对照组未表现出体重下降(图1中a),平均临床评分均呈现出一过性症状(图1中b,三种接种方式在10-12dpi的临床得分均为0),最终生存率分别为30%、50%和100%(图1中c),这表明不适合用104tcid50剂量感染5日龄乳鼠来建立cva6动物模型。5日龄乳鼠经im、ip感染剂量为105.5tcid50的实验组平均体重相对阴性对照组表现出显著下降,9dpi105.5tcid50-im组和105.5tcid50-ip组体重相对于阴性对照组体重分别下降了51.47%和22.42%(图1中a);105.5tcid50-im组和105.5tcid50-ip组约4dpi表现出后肌无力,随着感染天数增加依次出现单后肢瘫痪、双后肢肌瘫痪、濒死及极小部分乳鼠逐渐恢复健康等症状,而105.5tcid50-ic组平均临床评分仅表现出一过性后肌无力症状(图1中b);105.5tcid50-im组、105.5tcid50-ip组和105.5tcid50-ic组最终生存率分别为0、10%和40%(图1中c),这表明经im感染105.5tcid50剂量cva6毒株wf057r较为适合建立5日龄cva6感染模型。5日龄乳鼠经im、ip和ic感染剂量为107tcid50的实验组平均体重相对阴性对照组出现体重显著下降,于感染后6dpi~7dpi全部死亡,存活时间较短,不利于感染模型的建立(图1中c)。105.5tcid50(相当于310ld50)经im途径接种不同日龄(3、7、9)乳鼠后,3日龄乳鼠接种后症状明显,平均临床评分5(图1中e),存活时间短,感染后7天全部死亡(图1中f);7和9日龄乳鼠由于日龄大的缘故,相比对照组体重变化小(图1中d),死亡率低(图1中f),均不适合模型的建立。因此,选择经im途径接种5日龄乳鼠、剂量为105.5tcid50/只(310ld50)作为建立乳鼠感染模型的条件。重复性实验证明在该剂量、该途径条件下接种5日龄乳鼠后临床症状典型,平均临床得分为5,乳鼠感染后9天全部死亡,个体的发病时间和死亡率稳定,有非常高的可重复性。
三、核酸提取、病毒载量检测及病毒变异检测
对于5日龄乳鼠分别接种105.5tcid50和107tcid50剂量的乳鼠,感染后1dpi、3dpi、5dpi各组分别处死3只,取脑、心脏、肺脏、脾脏、后肢肌、肠道和血液,充分研磨后取0.01g上述各组织研磨物分别置于1.5ml无菌离心管中,加0.01mpbs至1ml,9000rpm4℃离心10min,取离心后上清液用trizol法提取病毒核酸,检测各组织中病毒载量随时间的变化,初步判断cva6毒株wf057r在体内的组织嗜性和载量变化。
trizol法提取病毒rna后经反转录获取cdna,反转录在abisimpliamptmthermalcyclerpcr仪上进行,使用takaraprimescripttmrtreagentkit(perfectrealtime),总体积为10μl,其中:5×primescriptbuffer(forrealtime)2μl,primescriptrtenzymemixi0.5μl,random6mers1μl以及待测样本rna6.5μl。反转录反应条件:42℃,45min(×1);85℃,5s(×1);4℃,∞。通过荧光定量pcr进行病毒载量的定量,于abi7500fast荧光定量pcr仪上进行,反应体系总体积为25μl,其中:goldstartaqmanmixture(cw2625m,北京康为世纪生物科技有限公司)12.5μl;cva6荧光定量特异性上游引物cva6-f(25μm)0.625μl;特异性下游引物cva6-r(25μm)0.625μl;cva6特异性探针(25μm)0.625μl;rnase-freewater8.625μl;待测cdna模板量2μl。荧光定量pcr反应条件:95℃,10min(×1);95℃,15s(×40);60℃,1min(×40),于每个循环60℃,1min结束后检测荧光。其中上游引物cva6-f序列:cctgaatgcggctaatcc;下游引物cva6-r序列:ttgtcaccatwagcagyca;探针序列:5’fam-ccgactactttgggwgtccgtgt-3’bhq1。将利用cva6-f与cva6-r对cva6毒株wf057r核酸进行pcr扩增得到的pcr产物(dsdna)与t载体构建质粒,检测质粒浓度作为标准品,10倍倍比稀释后备用。每次进行荧光定量pcr时载体标准品每个稀释度均设三个重复孔,取三个重复孔ct值的平均值作为对应稀释度的最终ct值。
为研究病毒在感染后不同感染阶段和在乳鼠体内不同器官内的载量分布,采用310ld50剂量(105.5tcid50/只)、经im途径感染5日龄乳鼠,1、3和5dpi检测病毒载量,发现感染后病毒载量在各组织中变化幅度较大。总体上呈现1~3dpi时间段内各组织病毒含量迅速升高而5dpi后病毒含量上升速度下降的趋势。1dpi血液中病毒核酸含量非常低,但3dpi很快达到峰值6log(拷贝数/ml血液),这一病毒血症的出现时间,与乳鼠的临床表现(包括行为、体重下降等)出现的时间是相对应的。5dpi心脏和肺脏中病毒含量高达7~8log(拷贝数/mg组织),病毒的高含量导致肺脏出现严重的病毒性肺炎。骨骼肌(后肢肌)中病毒含量最高达到10log(拷贝数/mg组织),是各时间点其它组织器官中病毒含量的102~104倍,表明骨骼肌是乳鼠体内病毒复制最为活跃的部位,也表明病毒经肌肉途径进入血液系统,通过血液流动迅速遍布全身。不同接种途径后肢肌中病毒含量最高,说明wf057r株有强烈的肌肉组织嗜性,也说明肌肉是病毒主要复制的场所(图2中a~c)。在均经im途径感染104ld50剂量(107tcid50/只)后,1~5dpi病毒在各组织中含量变化趋势与感染剂量310ld50剂量(105.5tcid50/只)变化趋势相似,但高剂量病毒接种后脑、血液、肺脏、脾脏中病毒载量显著升高(p<0.05),而ip和ic感染途径病毒载量与低剂量接种变化不显著(图2)。图2中,log的底数均为10;当样本为血液时,log(拷贝数/ml)表示log(拷贝数/ml血液);当样本为其他组织时,log(拷贝数/ml)表示log(拷贝数/mg组织)。
另外,为检测病毒感染5日龄乳鼠后在其体内是否会发生基因突变,pcr扩增cva6毒株wf057r感染乳鼠1、3和5dpi各组织中cva6病毒完整vp1片段,产物回收后测序,通过mega5.05软件进行序列比对,检测核苷酸及氨基酸序列是否发生突变。扩增vp1基因上游引物vp1-f为:5’-ggagatagggtggcagatgt-3’;下游引物vp1-r为:5’-aagggtggtgatcgatgtgc-3’。结果显示,各组织中病毒的序列均未发生变化。
四、感染模型血浆细胞因子表达水平变化情况
5日龄乳鼠经im感染310ld50(105.5tcid50/只)cva6毒株wf057r后采集1~5dpi外周血浆,通过细胞因子elisa检测试剂盒(杭州联科生物技术股份有限公司)检测不同感染阶段乳鼠模型血浆中ifn-γ、tnf-α、il-1β、il-4、il-6、il-10、il-13和il-18表达量的变化,以了解上述炎性细胞因子在重症cva6感染阶段发挥免疫病理损伤的作用。各细胞因子的检测下限分别为:ifn-γ(1.74pg/ml)、tnf-α(1.63pg/ml)、il-1β(1.03pg/ml)、il-4(0.22pg/ml)、il-6(1.17pg/ml),il-10(1.17pg/ml),il-13(1.17pg/ml),il-18(0.21pg/ml)。
研究表明,cva6毒株wf057r感染初期外周血中细胞因子ifn-γ、tnf-α、il-6、il-10、il-13和il-18(2dpi和3dpi除外)表达量相对于阴性对照组均有不同程度的高表达(图3)。其中,细胞因子ifn-γ和il-6表现出与人类相似的表达趋势(hanj,wangy,ganx,songj,sunp,dongxp.serumcytokineprofilesofchildrenwithhumanenterovirus71-associatedhand,foot,andmouthdisease.jmedvirol.2014.;linty,changly,huangyc,etal.differentproinflammatoryreactionsinfatalandnon-fatalenterovirus71infections:implicationsforearlyrecognitionandtherapy.actapaediatr.2002;91:632-5.),呈现爆发性增高,峰值超过2000pg/ml,且均呈现随感染天数的增加先升高后降低的现象。il-10表达量在感染初期(2dpi)即上升到最高40.13pg/ml,继而呈现平稳降低的趋势;同样,il-13表达量在感染初期高水平表达,但随着感染天数增加表达量快速降低。感染后期(5dpi),tnf-α表达量逐渐增高,达到102pg/ml;il-18在整个感染阶段表达量相对于阴性对照无显著差异(p>0.05);il-1β和il-4自始至终均无可检测的含量表达。以上数据说明,cva6毒株wf057r感染乳鼠后诱导了细胞因子——ifn-γ、il-6、tnf-α、il-10和il-13的表达,诱发乳鼠的免疫反应与炎症反应,ifn-γ和il-6可能是cva6乳鼠实验感染早期炎症反应的主要诱发因素,并且细胞因子tnf-α、il-10和il-13可能也在cva6毒株wf057r感染的免疫病理损伤中发挥重要作用。
五、病理学检查(he)及免疫组织化学检查(ihc)
在最终确定建立cva6感染模型最佳组合条件后,以此条件(im途径接种5日龄乳鼠、剂量为105.5tcid50/只(310ld50))建立乳鼠cva6感染模型,1~5dpi内每天处死3只wf057r感染乳鼠,取其脑、心脏、肺脏、脾脏、后肢肌、肠道和血液;血液常温10,000rpm离心10min后,取上层血浆保存于-20℃;其余脏器10%中性福尔马林固定48h后经石蜡包埋制作石蜡切片用以进行he染色和免疫组织化学(immunohistochemistry,ihc)检测。对于免疫组化检测,石蜡切片经过60℃烤片1h、酒精梯度脱蜡、edta抗原修复、脱水,一抗cva6多克隆抗体(1:200稀释)4℃孵育过夜,加二抗(1:1000稀释,北京中杉金桥生物技术有限公司)室温孵育30min后滴加dab显色,苏木素反蓝。阴性对照组切片一抗采用阴性血清。显微镜下检测结果。其中,一抗cva6多克隆抗体为利用cva6的vp1蛋白两次免疫8周龄icr成年鼠得到的多克隆抗体。
通过he染色对经肌肉注射感染cva6毒株wf057r的5日龄乳鼠的脑、心、肺脏、后肢肌和肠道进行病理学检查,发现感染晚期,出现了全身多脏器的损伤和炎症反应。
1)脑:病理学检查显示脑局部发生明显的病理变化,脑在3dpi开始出现局部脑膜及脑实质水肿(图1中a箭头所示)。脑免疫组化发现自3dpi开始脑皮质出现大量病毒抗原,随着感染天数的增长病毒抗原弥漫分布于脑皮质(图4中c),阴性对照组脑组织切片并未发现明显的病理变化(图4中b)和抗原染色(图4中d)。
2)心脏:he染色发现乳鼠感染cva65dpi心脏局部便出现血管扩张充血,局部淋巴浸润,心脏局部出现间质水肿,心肌纤维溶解,局部伴脂肪变性及毛细血管渗漏,并可见红细胞缺氧表现(图5中a箭头所示)。而免疫组化检查发现cva6抗原于心脏呈弥漫性分布(图5中c),阴性对照组心脏切片并未发现明显的病理变化(图5中b)和特异性抗原染色(图5中d)。
3)肺脏:he染色发现cva6感染会导致乳鼠发生病毒性肺炎,表现为弥漫性肺实质、肺泡和间质纤维化及大量淋巴细胞浸润和肺泡萎缩、塌陷(图6中a箭头所示)。免疫组化发现cva6抗原弥漫性分布与整个肺脏(图6中c),阴性对照组肺脏切片并未发现明显的病理变化(图6中b)和特异性抗原染色(图6中d)。
4)骨骼肌:he染色显示乳鼠感染cva63dpi骨骼肌出现少量淋巴细胞浸润、局部间质水肿和少量纤维组织增生,随着感染天数增加后肢肌出现大量淋巴细胞浸润、间质水肿及纤维组织增生范围扩大,并且开始出现局部坏死和肌束断裂(图7中a箭头所示)。免疫组化显示相对于阴性对照组(图7中d)cva6感染后3dpi后肢肌病毒开始增多且以点状分布为主,随感染天数的增加cva6在后肢肌程弥漫性分布(图7中c),阴性对照组后肢肌切片并未发现明显的病理变化(图7中b)。
5)肠道:he染色发现乳鼠经肌肉注射感染cva63dpi肠道开始出现间质水肿,随着感染天数的增加出现充血和淋巴细胞浸润(图8中a箭头所示),但未发现肠道坏死。免疫组化检查发现,经肌肉注射cva6在感染后期弥漫性分布于肠粘膜及肠绒毛(图8中c),阴性对照组肠道切片并未发现明显的病理变化(图8中b)和特异性抗原染色(图8中d)。
六、其他毒株的致病性
按照步骤一的方法,将柯萨奇a6病毒毒株wf057r与原始毒株km114057病毒、kp144344病毒和kj541157病毒分别接种rd细胞,接种量均为500tcid50,制备cva6不同毒株的病毒液。
其中,km114057病毒为含有序列a所示rna的柯萨奇病毒a6型,序列a为将ncbi中km114057.1(genebank号)中的t替换为u得到的序列;kp144344病毒为含有序列b所示rna的柯萨奇病毒a6型,序列b为将ncbi中kp144344.1(genebank号)中的t替换为u得到的序列;kj541157病毒为含有序列c所示rna的柯萨奇病毒a6型,序列c为将ncbi中kj541157.1(genebank号)中的t替换为u得到的序列。
结果发现,细胞分别感染这km114057、kp144344和kj541157病毒(500tcid50)后产生cpe的时间要长于毒株wf057r,感染后48小时细胞上清中病毒滴度分别为8.2×107、2.7×108和3.6×108tcid50/ml,低于同时期毒株wf057r病毒滴度1.8×109tcid50/ml,所以该三毒株对细胞的适应性低于毒株wf057r。
按照步骤二中cva6感染动物模型的制备方法,将柯萨奇a6病毒毒株wf057r分别替换为原始毒株km114057病毒、kp144344病毒和kj541157病毒,通过im途径注射105.5tcid50剂量的毒株制备cva6感染动物模型。
结果发现,通过im途径分别将105.5tcid50剂量的三株病毒感染5日龄乳鼠,感染后9天乳鼠的死亡率分别为80%、80%和100%。综合比较病毒的致病性,毒株wf057r在体内和体外实验中要优于km114057、kp144344和kj541157病毒。
实施例3、以灭活wf057r作为活性的cva6疫苗所产生抗血清可以保护小鼠和治疗cva6所致疾病
1、灭活cva6疫苗的制备
将实施例2的稀释后的cva6毒株wf057r病毒液(105tcid50/ml)按1:4000(v/v)的比例利用福尔马林稀释后得到病毒稀释液,将病毒稀释液于37℃孵育灭活病毒72小时,得到灭活病毒液;将灭活病毒液与完全弗氏佐剂等体积混合,制成完全乳化液,即为cva6疫苗,cva6疫苗中灭活病毒的含量为5×104tcid50/ml。采用微量滴定法检测cva6疫苗感染性滴度以观察其灭活效果。
病毒微量滴定法:每孔按1×104细胞/100μl培养液(该培养液中的细胞为rd细胞,培养基为实施例2的培养基1)将rd细胞接种于96孔平底细胞培养板,细胞长至每孔的90%以上,将上述cva6疫苗用含2%胎牛血清的mem培养基按10倍体积梯度稀释后(稀释倍数分别为10倍、102倍、103倍和104倍),以100μl/孔接种于rd细胞,每个稀释度接种8孔,每天观察记录细胞病变。
结果发现,接种不同稀释度cva6疫苗的rd细胞均未发生细胞病变,表明,上述cva6疫苗中的wf057r均已灭活。
2、cva6疫苗菌检
将步骤1的cva6疫苗在无菌条件下分别接种营养肉汤和营养琼脂平板,37℃温箱培养2天后观察,发现均无细菌生长,菌检均为阴性。
3、cva6疫苗安全性试验
3.1成年鼠安全性试验
实验重复三次,每次重复试验的具体步骤如下:
取8周龄健康成年鼠(雌雄随机)20只,随机分成实验组和对照组,每组10只。实验组乳鼠经皮下注射步骤1的cva6疫苗,共注射三次,每两次注射间隔时间均为1周,三次接种量均为200μl/只;对照组注射完全弗氏佐剂与pbs等体积混合得到的混合液,共注射三次,每两次注射间隔时间均为1周,三次接种量均为200μl/只。连续观察14天,观察成年鼠有无发病、死亡和体重变化。
经8周龄成年鼠安全性试验结果可见,3个实验组成年鼠分别经皮下1、2和3次不同免疫次数注射cva6疫苗,与对照组成年鼠体重无差异,均无发病、死亡,处死后均无肉眼可见病变。
3.2乳鼠安全性试验
实验重复三次,每次重复试验的具体步骤如下:
取5日龄龄健康乳鼠(雌雄随机)20只,随机分成实验组和对照组,每组10只。实验组乳鼠经皮下注射步骤1的cva6疫苗,共注射三次,每两次注射间隔时间均为1周,三次接种量均为50μl/只;对照组注射完全弗氏佐剂与pbs等体积混合得到的混合液(请核实对照组注射的液体),共注射三次,每两次注射间隔时间均为1周,三次接种量均为50μl/只。连续观察14天,观察乳鼠有无发病、死亡和体重变化。
经5日龄乳鼠安全性试验结果可见,3个组实验组新生乳鼠分别经皮下1、2和3次不同免疫次数注射cva6疫苗,与对照组乳鼠体重无差异,均无发病、死亡,处死后均无肉眼可见病变。
4、抗病毒血清的制备及效价测定
4.1cva6抗血清的制备
取8周龄健康成年鼠(雌雄随机),经皮下注射步骤1的cva6疫苗,注射量为200μl/只;cva6疫苗注射35天后采集血液,10,000rpm/min离心后取上清,即为cva6抗血清,无菌条件下分装,冻存于-80℃备用。采用微量中和实验测定抗血清的抗体滴度。
4.2微量细胞中和试验
将步骤4.1的cva6抗血清利用含2%胎牛血清的mem培养基从1:100起开始进行2倍梯度体积稀释,共10个稀释度,稀释比例分别为1:102、1:2×102、1:22×102、1:23×102、1:24×102、1:25×102、1:26×102、1:27×102、1:28×102和1:29×102,得到不同稀释度的cva6抗血清稀释液。
将实施例2的cva6毒株wf057r病毒液(500tcid50/ml)加至96孔板,50μl/孔,再分别加入上述不同稀释度的cva6抗血清稀释液,50μl/孔,每孔一个稀释度的稀释液,每种稀释度的稀释液三个复孔,37℃孵育1h;向每孔中接种rd细胞培养液(浓度为2×105个/ml),100μl/孔,37℃培养7d,观察细胞病变情况(cpe),采用reed-muench法计算中和抗体效价。
按照上述微量细胞中和试验方法对cva6抗血清的中和效价连续检测6次,计算平均提取方差值ave及变异系数cv,验证该方法的重复性。
在体外培养的rd细胞上对cva6抗血清进行2倍连续稀释,加入cva6毒株wf057r,通过rd细胞的病变计算得到cva6抗血清的抗体效价为1,024(ave>0.5,cv≤8%)。
5、cva6抗血清通过被动免疫对乳鼠的保护
为研究cva6抗血清在乳鼠的被动免疫保护作用,将步骤4.1的cva6抗血清利用生理盐水进行10倍连续稀释(1:10,1:100,1:1,000和1:10,000),将得到的不同cva6抗血清稀释液通过静脉注射的方式接种到4个实验组5日龄乳鼠(每组10只)体内,每个实验组注射一种稀释梯度的cva6抗血清稀释液,1个阴性对照组乳鼠(cva6,10只)注射等体积的分离自未接种cva6健康成年鼠的阴性对照血清,注射体积均为50μl,1h后将致死剂量310ld50(105.5tcid50)的cva6病毒毒株wf057r通过肌肉途径感染各组乳鼠,感染后1天(1dayspostinfection,1dpi)至12dpi连续观察感染乳鼠的临床表现、体重变化及生存率变化情况,采用表2的临床评分标准进行评分,将正常健康的5日龄乳鼠作为对照(nc)。依据实验组乳鼠的生存率,计算cva6抗血清在乳鼠体内的50%有效稀释度ed50i。
4个实验组先接种不同稀释度的抗体后再感染致死剂量的wf057r,发现1:10稀释的cva6抗血清能提供完全的保护能力,部分乳鼠出现轻微临床症状,评分为1(图9,四舍五入),很快恢复健康;注射1:100稀释的cva6抗血清的实验组乳鼠临床评分最高为3,最终生存率为60%;注射1:1000稀释的cva6抗血清的实验组乳鼠在接种病毒后3天开始出现临床症状,感染后10天评分为5,第11天全部死亡;与阴性对照组(图9中cva6曲线)相比,1:10,000稀释的cva6抗血清几乎无保护作用,乳鼠接种病毒后第10天全部死亡(图9)。1:10稀释的cva6抗血清能提供乳鼠100%的保护力,根据reed&muench公式(reedandmuench,1938)计算得到163倍稀释的cva6抗血清能提供50%的保护率,所以cva6抗血清在乳鼠体内预防作用的ed50i为1.63。
6、母源抗体对乳鼠的保护作用
为研究母传抗体对新生乳鼠的免疫保护作用,对8周龄雌鼠皮下多点、多次注射步骤1的cva6疫苗200μl进行第一次免疫,间隔2周后同样的方式注射步骤1的灭活病毒液与不完全弗氏佐剂等体积混合得到的完全乳化液200μl以加强免疫。第一次免疫后将雌乳鼠和雄乳鼠交配,第二次免疫后5~10天幼鼠出生。选取5日龄乳鼠分5个实验组(10只/组)。
另选取8周龄雌鼠,按照上述方法,将cva6疫苗与完全乳化液均替换为生理盐水,对雌鼠注射生理盐水,将其孕育的5日龄乳鼠分5个对照组(10只/组)。
将各组乳鼠分别经im途径注射致死剂量的310ld50(105.5tcid50)的cva6病毒毒株wf057r和不同地方临床cva6分离株wh15066/shandong/china/2015(300ld50)、dy003r/shandong/china/2015(300ld50)、dy005r/shandong/china/2015(300ld50)和lw03r/shandong/china/2015(300ld50),每个毒株的注射剂量均为310ld50,连续观察12d并记录其体重变化、临床评分(采用表2的临床评分标准进行评分)、生存率,以评价cva6母传抗体对新生乳鼠感染cva6的保护作用。采用mantel-coxlog-rank法比较实验组和对照组乳鼠的生存率。
未免疫母鼠组孕育的乳鼠在接种病毒后体重几乎没有增加,临床症状明显,第6天开始死亡,第9~10天全部死亡。免疫wf057r灭活疫苗的实验组母鼠孕育的乳鼠接种不同的临床分离株cva6(wf057r、wh15066、dy003r、dy005r和lw03r)后均无临床症状出现(图10中左图),其体重变化与未接毒组乳鼠无差异(p>0.05),最终生存率均为100%(图10中右图)。数据表明,本发明利用wf057r毒株制备的cva6疫苗的母传抗体能提供乳鼠对致死剂量不同地方分离毒株cva6的完全保护能力。
7、抗血清对发病乳鼠的临床治疗效果
为研究cva6抗血清对不同发病程度乳鼠的临床治疗效果,首先采用im途径对5日龄乳鼠接种致死剂量310ld50(105.5tcid50)的cva6病毒毒株wf057r,隔离饲养,具体操作同实施例2中cva6感染动物模型的制备。于感染后4天开始对感染乳鼠进行筛选,选择临床得分别为1~2和≥3的乳鼠分别作为发病早期和晚期2个实验组(n=10只/组)。采用静脉注射的方式将利用生理盐水按照1:1、1:10和1:50的体积比稀释的步骤4.1的cva6抗血清分别注射到3个不同发病程度的实验组乳鼠体内,注射体积均为50μl,每个实验组均注射不同稀释度的cva6抗血清,每组中一种稀释度的cva6抗血清注射10只乳鼠,1个cva6对照组乳鼠(仅接种cva6,未注射抗血清,10只)注射等体积的阴性对照血清(分离自未接种cva6健康成年鼠)作为对照,连续观察12d并记录其体重变化、临床症状和生存率,以评价cva6抗血清对发病乳鼠的临床治疗效果。将正常健康的5日龄乳鼠注射等体积的生理盐水(ns)作为对照。依据实验组乳鼠的生存率,计算步骤4.1的cva6抗血清在乳鼠体内治疗作用的50%有效稀释度ed50ii。采用mantel-coxlog-rank法比较实验组和对照组乳鼠的生存率。
结果发现,临床得分1~2的乳鼠(发病早期)紧急注射抗体后临床症状逐渐消失,评分降为0(图11),体重增加,1:1、1:10和1:50稀释度的实验组最终生存率为分别为100%、100%和40%(图11)。但临床得分超过3(发病晚期,即出现单后肢或双后肢瘫痪甚至濒死)的乳鼠各稀释度的cva6抗血清对其都没有任何保护作用,和发病后注射阴性血清组(cva6组)差异不显著(p>0.05),死亡率均为100%(图11)。根据reed&muench公式计算得到43倍稀释的cva6抗血清能提供50%的治愈率,所以cva6抗血清在乳鼠体内治疗作用的半数有效量ed50ii为23.81。数据表明,出现神经症状即后肢(单、双后肢)瘫痪的乳鼠各稀释度的cva6抗血清对其均没有任何保护作用。结合上面建立的乳鼠感染模型,评分超过3的乳鼠呈现全身多脏器的严重损伤和炎症反应,神经系统已经被破坏,大量神经元坏死,被吞噬细胞吞噬;后肢肌中病毒的含量高达10log,开始出现骨骼肌纤维坏死和肌束断裂。所以,此时cva6抗血清中的cva6抗体很难逆转乳鼠的重症发展,而对于发病初期的乳鼠,相比注射阴性血清组抗体的治疗效果非常显著(p<0.005),治疗后逐渐恢复健康。
8、其他cva6病毒疫苗的效果
按照步骤1灭活cva6疫苗的制备方法,将柯萨奇a6病毒毒株wf057r分别替换为实施例1的km114057病毒、kp144344病毒和kj541157病毒,其他步骤均不变,制备cva6疫苗,即km114057病毒疫苗、kp144344病毒疫苗和kj541157病毒疫苗。
将km114057病毒疫苗、kp144344病毒疫苗和kj541157病毒疫苗三种疫苗分别按照步骤4的方法经皮下接种8周龄成年鼠后35天采集血清,通过微量中和实验检测其抗体滴度分别为256、512和512(连续检测6次),低于毒株wf057r抗体滴度(1024)。
按扎偶步骤6的方法,分别利用km114057病毒疫苗、kp144344病毒疫苗和kj541157病毒疫苗三种疫苗免疫8周龄雌鼠,将其生产的5日龄乳鼠经im途径注射致死剂量的310ld50(105.5tcid50)的cva6病毒毒株wf057r,结果发现三种疫苗诱导母传抗体对乳鼠致死剂量(310ld50)wf057r的保护率为70~80%(死亡率为20%~30%),不能提供完全的保护。
基于前面工作基础,发明人在本次实验中对疫苗免疫组的乳鼠做了全面的病理学检查,尤其注意是否存在疫苗免疫动物在病毒攻击后所出现的免疫病理损伤。观察结果表明,疫苗免疫成年鼠和乳鼠在病毒感染后的不同时间点处,均未发现主要脏器病理组织学的明显改变,仅在后肢肌见到极个别的炎性细胞浸润点。这些极少量的炎性细胞浸润点的病理学现象经多重分析后,可以认为其是非特异的病理现象。同时,在神经系统和主要组织中均未见到特征性的病理改变,各组织中也几乎检测不到病毒核酸的存在。可以确认,在疫苗免疫母鼠后所形成的免疫保护效应,是可以完全抑制病毒在动物体内的增殖,并最终可以完全保护机体免受病毒感染所引起的病理损害。
- 还没有人留言评论。精彩留言会获得点赞!