溶菌酶交联葡聚糖缓释微球及其制备方法与流程
本发明涉及大分子药物的药物给药系统领域,具体涉及一种溶菌酶交联葡聚糖缓释微球及其制备方法。
背景技术:
溶菌酶(lysozyme)又称细胞壁溶解酶,是一种专门作用于微生物细胞壁的水解酶,能切断肽聚糖中位于n-乙酰胞壁酸(nam)和n-乙酰葡萄糖胺(nag)间的β-1,4糖苷键,破坏肽聚糖支架,在内部渗透压作用下细胞破裂,引起细胞裂解。溶菌酶是一种有效的抗菌剂,该酶对革兰氏阳性菌中的枯草芽孢杆菌、普通变形菌和副溶血性弧菌具有良好的抑制作用,对革兰氏阴性菌也有一定程度的溶解作用。此外,溶菌酶还具有抗病毒、增强免疫力的作用。在医疗上,溶菌酶首先适用于五官科的各种炎症,还可以用于治疗扁平疣、传染性软疣、异常性疣、尖锐湿疣、带状疱疹多种皮肤病。此外,溶菌酶还可用于小儿或乳儿哮喘性支气管炎、呼吸道内膜肿胀等。溶菌酶作为一种具有抗菌、消炎、抗病毒作用的天然蛋白,其在医疗方面的研发及应用将会越来越得到关注,但是其制剂临床上主要有溶菌酶含片。
交联葡聚糖微球(cross-linkeddextranmicrosphere)是由葡聚糖与交联剂环氧氯丙烷经交联反应制得的细小微珠,又名聚糖酐(dextranomer),经纯化灭菌后用于临床,现在已收载于欧盟药典第八版。该药在上世纪70年代首先由瑞士生产及应用,近年来欧洲一些国家及美国均采用。葡聚糖微球内部为三维网状结构,化学结构中含有丰富的羟基,因此具有很强的吸水性膨胀性和生物粘附性。临床上交联葡聚糖微球常单独使用,用于吸附炎症渗出物,清洁创面,促进渗出性创伤的愈合。但是,交联葡聚糖微球虽然可吸附创面上的细菌,降低创面的细菌密度但其本身并不具有抗菌、消炎的药理作用。由于伤口表面细菌的堆积,可能会引起伤口的再次感染,因此会对伤口的愈合造成不利的影响。
通过物理吸附载药法将溶菌酶载入交联葡聚糖微球中制备得到的溶菌酶缓释微球,具有良好吸水性能和生物粘附性以及药物缓释作用,可用于粘膜和皮肤给药,而且可用于口服给药,增加溶菌酶在粘膜(如口腔、鼻腔、肠道、直肠和阴道)和皮肤的滞留与作用时间,更好地发挥溶菌酶局部的消炎、抗菌、抗病毒能力。该缓释微球制备工艺简单,易于工业化生产。目前未见溶菌酶交联葡聚糖缓释微球报道。
技术实现要素:
本发明提供一种溶菌酶交联葡聚糖缓释微球及其制备方法。
本发明溶菌酶交联葡聚糖缓释微球由溶菌酶和交联葡聚糖微球组成。
本发明溶菌酶交联葡聚糖缓释微球中各组分质量百分含量为:
溶菌酶2%~15%
交联葡聚糖微球85%~98%
本发明溶菌酶交联葡聚糖缓释微球中药物溶菌酶为鸡蛋清溶菌酶或具有相似功能其他来源的溶菌酶,如鸟类蛋清溶菌酶,以及生物工程技术制备的溶菌酶,其中载药量为2%~15%。
本发明溶菌酶交联葡聚糖缓释微球中交联葡聚糖微球为葡聚糖经环氧氯丙烷交联反应而制得的粒径为100~300μm,膨胀度为2ml/g~15ml/g,辐射灭菌处理的微球。
本发明溶菌酶交联葡聚糖缓释微球采用物理吸附载药法制备,其制备方法是:称取一定量的溶菌酶加入到一定ph范围的纯化水中,溶解制备得到一定浓度的溶菌酶溶液,加入一定量的交联葡聚糖微球,在磁力搅拌器上充分搅拌使微球完全分散后,于室温下静置,过滤收集微球,真空冷冻干燥后得到溶菌酶交联葡聚糖缓释微球。
本发明特征在于采用物理吸附载药法,条件温和,工艺简单,对溶菌酶的活性不会产生影响,可保证溶菌酶制剂的疗效。
本发明特征在于:载溶菌酶交联葡聚糖缓释微球具有较高的载药量,且载药量可控,载药量在2%~15%之间,体外释放显示具有良好的缓释作用,可以使得该制剂长时间发挥抗菌作用。
本发明载溶菌酶交联葡聚糖缓释微球,具有强大的吸水性能和生物吸附能力(如吸附细菌),以及药物缓释作用,可保证充分发挥溶菌酶局部的抗菌、消炎、抗病毒作用。体外抑菌试验表明,其对革兰氏阳性菌枯草芽胞杆菌具有显著的抑制作用。
本发明还提供一种溶菌酶交联葡聚糖缓释微球的组合物,它是所述的溶菌酶交联葡聚糖缓释微球,加上医药学上可接受的辅料制备而成的药物组合物。
本发明提供的溶菌酶交联葡聚糖缓释微球的组合物,适用于粘膜和皮肤外用制剂以及口服制剂,发挥药物局部治疗作用。
溶菌酶交联葡聚糖缓释微球未见文献报道。
附图说明
图1溶菌酶交联葡聚糖缓释微球形态图。
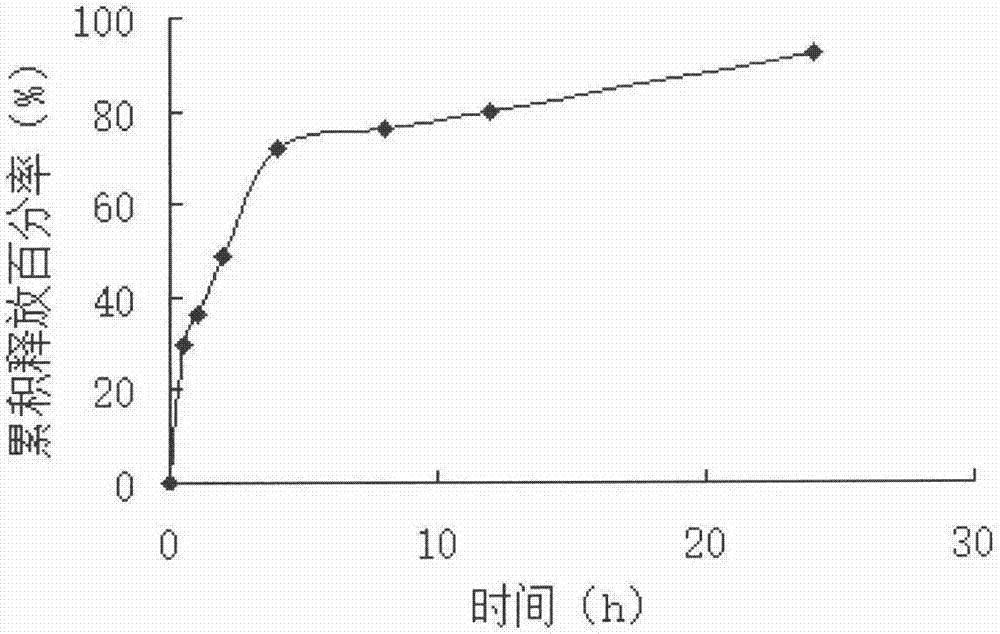
图2溶菌酶交联葡聚糖缓释微球体外释放曲线图。
具体实施方式
实施例1溶菌酶交联葡聚糖缓释微球制备
处方:溶菌酶0.05g
交联葡聚糖微球1.0g
纯化水10ml
制备方法:在洁净区内,取处方量溶菌酶溶解在纯化水中,加入处方量的交联葡聚糖微球,室温下搅拌至微球完全分散,静置吸附载药4h。过滤收集微球,真空冷冻干燥得到溶菌酶交联葡聚糖缓释微球,载药量为2.85%。
实施例2溶菌酶交联葡聚糖缓释微球制备
处方:溶菌酶0.225g
交联葡聚糖微球1.0g
纯化水15ml
制备方法:取处方量溶菌酶溶解在纯化水中,加入处方量的交联葡聚糖微球,室温下搅拌至微球完全分散,静置吸附载药12h。过滤收集微球,真空冷冻干燥得到溶菌酶交联葡聚糖缓释微球,载药量为7.80%。
实施例3溶菌酶交联葡聚糖缓释微球制备
处方:溶菌酶0.5g
交联葡聚糖微球2.0g
纯化水20ml
制备方法:取处方量溶菌酶溶解在纯化水中,加入处方量的交联葡聚糖微球,室温下在搅拌至微球完全分散,静置吸附载药24h。过滤收集微球,真空冷冻干燥得到溶菌酶交联葡聚糖缓释微球(见图1),载药量为13.25%,平均粒径为207um,膨胀度为8.9ml/g。
实施例4溶菌酶交联葡聚糖缓释微球制备
处方:溶菌酶0.5g
交联葡聚糖微球2.0g
ph4.5纯化水20ml
制备方法:取处方量溶菌酶溶解在ph4.5纯化水中,加入处方量交联葡聚糖微球,室温下在搅拌至微球完全分散,静置吸附载药24h。过滤收集微球,真空冷冻干燥得到溶菌酶交联葡聚糖缓释微球,载药量为12.9%。
实施例5溶菌酶交联葡聚糖缓释微球制备
处方:溶菌酶0.5g
交联葡聚糖微球2.0g
ph6.8纯化水20ml
制备方法:取处方量溶菌酶溶解在ph6.8纯化水中,加入处方量交联葡聚糖微球,室温下在搅拌至微球完全分散,静置吸附载药24h。过滤收集微球,真空冷冻干燥得到溶菌酶交联葡聚糖缓释微球,载药量为13.1%。
实施例6溶菌酶交联葡聚糖缓释微球体外释放考察
样品:实施例3溶菌酶交联葡聚糖缓释微球
释放方法:在满足漏槽条件的情况下,采用静态释放方法测定药物的释放行为。取实施例3溶菌酶交联葡聚糖缓释微球0.2g,加入10ml经脱气处理的37℃的纯化水,置37℃恒温水浴摇床中进行释放,分别在0.5h,1.0h,2.0h,4.0h,8.0h,12.0h,24h取样1ml至10ml容量瓶中,用纯化水稀释至刻度,同时补加1ml新鲜介质。测定溶菌酶释放量。由累积释放量-时间作图,见图2。由图2可知,溶菌酶交联葡聚糖微球制剂具有良好的缓释性能。
实施例7溶菌酶交联葡聚糖缓释微球体外抑菌效果试验
样品:
溶菌酶交联葡聚糖缓释微球:分别用5mg/ml,10mg/ml,15mg/ml,20mg/ml,25mg/ml的溶菌酶溶液,按实施例3的制备方法制得载药量不同的溶菌酶交联葡聚糖缓释微球。
溶菌酶溶液:6.625mg/ml溶菌酶溶液
空白微球:空白交联葡聚糖微球
无菌水:灭菌纯化水
亚硝酸钠溶液:0.3mg/ml亚硝酸钠溶液
实验方法:
体外抑菌圈试验-牛津杯法:在无菌条件下,将已灭菌的胰酪大豆胨琼脂培养基加热到完全融化,倒入培养皿中,每碟15ml(下层),待其凝固。另外,将融化的培养基冷却到50℃左右混入浓度为106cfu/ml的枯草芽胞杆菌菌液200ul,然后将混有菌液的培养基5ml倒入己凝固的培养基上(上层),待其凝固。然后在培养基表面垂直放置已灭菌的牛津杯,向每个牛津杯中分别加入制备的不同载药量的载溶菌酶葡聚糖微球制剂样品、空白葡聚糖微球各10mg,再向每个牛津杯中加入200ul无菌水。将接好菌的平皿置于35℃恒温箱中培养24h,测量抑菌圈大小。实验以无菌水作为阴性对照,以6.625mg/ml的溶菌酶溶液和0.3mg/ml亚硝酸钠溶液作为阳性对照。抑菌试验结果见表1。
表1抑菌试验结果
由实验结果可知载溶菌酶交联葡聚糖缓释微球对枯草芽胞杆菌具有抑制效果,随着载药量的增加,抑菌圈直径也逐渐增加,载溶菌酶交联葡聚糖缓释微球样品5与6.625mg/ml的溶菌酶溶液进行比较,抑菌圈大小分别为20mm和19mm,结果表明,具有相同溶菌酶浓度的缓释微球比溶菌酶溶液具有更好的抑菌效果,而空白葡聚糖微球、无菌水和0.3mg/ml亚硝酸钠溶液没有抑菌效果。另外,表1表明载药用溶菌酶浓度增加,缓释微球载药量增加。
以上对本发明的具体实施例进行了详细描述,但只是作为范例,本发明并不限制于以上描述的具体实施例。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 奶牛金黄色葡萄球菌乳房炎亚单位的疫苗及其制备方法和应用与流程
- 奶牛金黄色葡萄球菌乳房炎亚单位疫苗的组合物及其制备方法和应用与制造工艺
- 含水流动状组合物及其制造方法、以及溶菌酶加工品和/或其盐、及其制造方法与制造工艺
- 一种纳米材料/群体感应淬灭酶颗粒改性复合膜制备方法与制造工艺
- 一种检测泪液中乳铁蛋白的专用胶体金检测卡的制造方法与工艺
- 一种鸡溶菌酶和鸡β‑防御素7融合基因及其制备方法与制造工艺
- 一种制备治疗敏感菌感染性疾病的药物盐酸头孢他美酯组合物的方法与制造工艺
- 含有复合益生元溶菌酶功能性无糖软糖及其制备方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 用于制备结晶DTPMP的方法与制造工艺