一种三唑并吡嗪类化合物的新应用的制作方法
本发明属于医药技术领域,具体的涉及一种小分子化合物的医药应用领域
背景技术:
akr1b10属于醛酮还原酶超家族(aldo-ketoreductase,akr)的成员,akr是烟酰胺嘌呤二核苷酸nad(p)(h)依赖的氧化还原酶,主要催化醛或者酮的羰基还原成一级或者二级醇,是体内一级代谢酶。研究发现,akr1b10在多种肿瘤组织和细胞中异常表达:在84%的鳞状细胞肺癌(squamouscellpulmonarycarcinomas),70%的胰腺癌(pancreaticadenocarcinomas)及54%的有潜在肝硬化和病毒性肝炎的早期肝癌中过表达;另外,在子宫癌、胆管癌、胰腺癌、早期胃癌和食管癌肿瘤组织中,akr1b10的表达水平上调。实验表明,akr1b10表达上调可能会促进肿瘤的发生和发展。从220例乳腺癌患者的25年完整临床病理研究中观察到:akr1b10的表达水平与肿瘤组织大小、淋巴结转移程度是正相关的,而与患者生存期呈现负相关。sirna介导的akr1b10基因沉默可抑制肝癌hcc细胞、大肠癌、肺癌和乳腺癌bt-20细胞的生长,并可抑制乳腺癌雌裸鼠和肝癌移植小鼠的肿瘤生长。akr1b10可以催化多种醛酮类化合物,包括芳香醛(aromaticaldehydes),甲基乙二醛(methylglyoxal),4-羟基壬烯醛(4-hydroxynonenal),反式-2-己醛(trans-2-hexanal)等化合物。这些羰基类化合物具有高度亲电性,可以与蛋白质、dna等生物大分子结合,形成非特异性共价修饰耦合物,引起蛋白质功能紊乱和dna损伤,导致病理反应。
由于akr1b10在肿瘤组织中异常表达、促进肿瘤发生和发展,同时又具有被分泌到细胞外的特异性分泌机制,被认为是潜在的抗癌靶标和癌症诊断标记物,因此积极寻找和设计新的akr1b10抑制剂的肿瘤药物具有重要的理论意义和实际价值。目前,从天然产物中发现的akr1b10抑制剂如多酚类、五环三萜类和倒捻子素类化合物,以及内源性甾体激素类,胆汁酸及其代谢产物等对akr1b10有较强的抑制能力。甲酸类非甾体抗炎药对akr1b10有一定的抑制能力和明显的akr1b1选择性。基于akr1b10/tolrestat结构的虚拟筛选方法得到的色烯-3-甲酰胺类化合物和2-苯基亚氨基苯并吡喃类是已知活性最高的akr1b10抑制剂(最小ic50值为6nm),但对akr1b1也有高度抑制活性。
技术实现要素:
针对上述情况,本发明提供了一种小分子化合物——7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮或其可药用盐在制备用于治疗与akr1b10相关的癌症疾病的药物中的用途,其中所述7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮的结构式如下:
式i化合物或其药学可接受的盐在制备抑制akr1b10活性药物中的应用
本发明所述药学可接受的盐7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮与无机酸或有机酸中的一种或两种以上形成的药学上可接受的盐,该盐为酸加成盐。
本发明所述无机酸优选为盐酸、磷酸和硫酸。
本发明所述有机酸优选为醋酸、马来酸、枸橼酸、苯磺酸、甲基苯磺酸、富马酸和酒石酸。
本发明还提供一种药物,该药物由7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮或其药学可接受的盐和一种或多种药学上可接受的载体、稀释剂和赋形剂组成,所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。本发明药物可以制成注射液、片剂、粉剂、颗粒剂、胶囊、口服液、膏剂、霜剂等多种形式。上述各种剂型的药物均可以按照药学领域的常规方法制备。
本发明所述的药物在制备抑制akr1b10活性药物可通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其他物质混合或包裹后导入机体。
本发明提供的制备抑制akr1b10活性药物,该药物通过抑制akr1b10活性治疗或预防多种肿瘤。所述肿瘤包括鳞状细胞肺癌、胰腺癌、肝癌、子宫癌、胆管癌、胰腺癌、胃癌和食管癌。
本发明还提供一种akr1b10抑制剂,该抑制剂通过抑制akr1b10活性治疗或预防多种肿瘤。
本发明所述药物还具有治疗或预防,与akr1b10活性相关的肿瘤细胞的增殖和抗凋亡的作用。
本发明所述药物还具有通过抑制akr1b10活性治疗或预防肝硬化和\或病毒性肝炎的作用。
本发明对上述小分子化合物进行了生物学活性测定,发现其对akr1b10具有明显的抑制活性,ic50值达到了5.9μm,此外该分组对akr醛酮还原酶家族中的另一位成员akr1b1具有较弱的抑制活性,ic50值达到了31.47μm,因此该化合物可以作为akr1b10选择性抑制剂。
本发明中的小分子化合物7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮具备akr1b10抑制剂的功能,对与akr1b10相关的癌症疾病具有明显的抑制作用,可以用于制备与akr1b10相关的抗肿瘤药物。也可以用于制备akr1b10相关肝硬化和\或病毒性肝炎的药物。
附图说明
图1:为实施例1中化合物对akr1b10的酶抑制活性曲线。
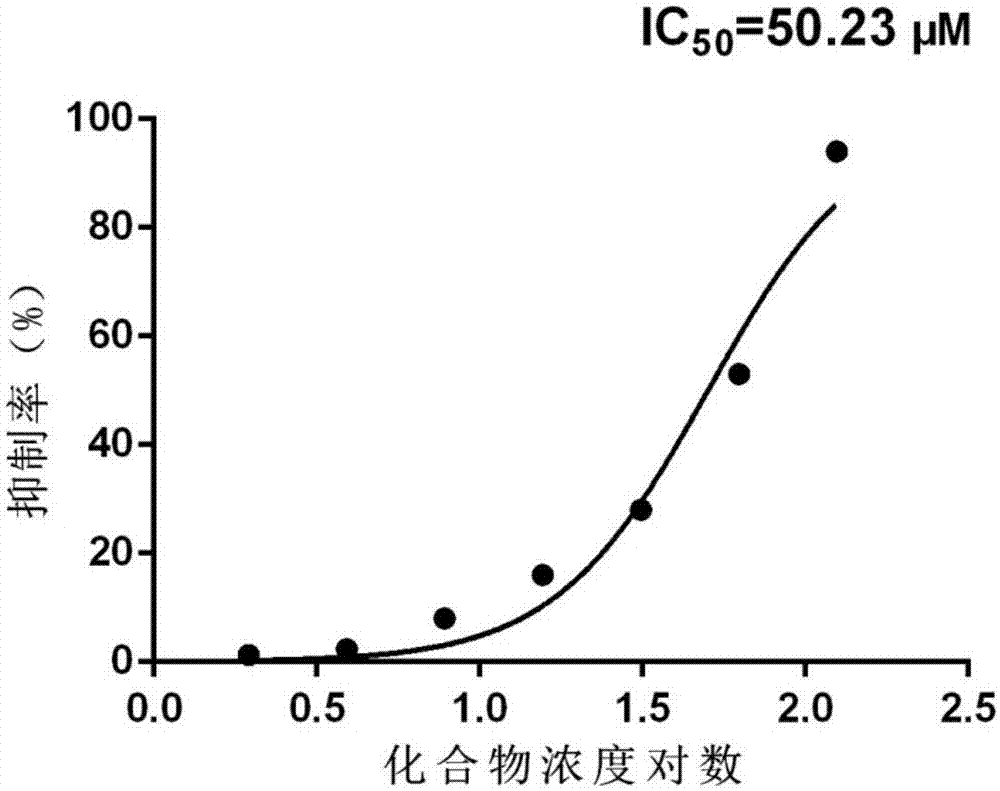
图2:为实施例2中化合物对akr1b1的酶抑制活性曲线。
图3:为实施例3中化合物对肝癌hcc细胞存活率抑制活性曲线。
具体实施方式
下面将结合附图及具体实施例对本发明做出进一步的描述。
实施例1:化合物对akr1b10的酶抑制活性实验。
实验原理:根据辅酶nadph随着akr1b10催化醛酮类底物还原反应的进行转化为nadp+这一特点设计。由于nadph在340nm处有特征最大紫外吸收峰值,而产物nadp+在此波长处吸收很弱,故可通过检测340nm的紫外吸收值降低来检测辅酶nadph的消减程度,从而获得酶催化反应的速度。在反应初始阶段,340nm处紫外吸收变化曲线理论应为直线(零级反应),斜率与反应速度成正比。
当加入化合物后,反应速度降低,证明化合物对akr1b10的催化有抑制作用。
实验试剂的准备:吡啶-3-醛、nadph、nadp+购自sigma-aldrich公司。
实验步骤:
1)配置反应液
用pbs-buffer(0.1mpotassiumphosphate,ph7.4)配制浓度0.15mm的nadph反应液;
2)确定酶akr1b10稀释比例
取930μlnadph反应液,加入20μl稀释后akr1b10,30℃恒温5min后,加50μl底物吡啶-3-醛启动反应。探索不同稀释比例,至340nm紫外吸收曲线为平直线且斜率数值约为0.2。最终固定酶akr1b10浓度为0.5μμ左右;
3)配置酶反应溶液
按照步骤2所得酶稀释比例,用nadph反应液稀释酶至反应浓度(0.5μμ),配成酶反应溶液;
4)化合物ic50测定
为了测试化合物对akr1b10酶活性的抑制效应,将浓度为15、7.5、3.75、1.875、0.9375、0.46875、0.234375μm的化合物分别添加到包含重组人类akr1b10的比色皿中。按照酶反应溶液:底物溶液=950:50体积比混合反应体系,测试过程先将酶反应溶液和化合物混合均匀后在30℃下恒温5min后,加50μl底物吡啶-3-醛启动反应。采用tecaninfinitem1000酶标仪在340nm波长下进行5min吸光度测试。
实验结果:将浓度为15、7.5、3.75、1.875、0.9375、0.46875、0.234375μm的7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮进行akr1b10的酶抑制活性实验,发现该化合物有很好的抑制活性,其半抑制浓度ic50为1.637μm/l(如图1所示)。
实施例2:化合物对akr1b1的酶抑制活性实验。
实验原理:根据辅酶nadph随着akr1b1催化醛酮类底物还原反应的进行转化为nadp+这一特点设计。由于nadph在340nm处有特征最大紫外吸收峰值,而产物nadp+在此波长处吸收很弱,故可通过检测340nm的紫外吸收值降低来检测辅酶nadph的消减程度,从而获得酶催化反应的速度。在反应初始阶段,340nm处紫外吸收变化曲线理论应为直线(零级反应),斜率与反应速度成正比。
当加入化合物后,反应速度降低,证明化合物对akr1b1的催化有抑制作用。
实验步骤:
1)配置反应液
用pbs-buffer(0.1mpotassiumphosphate,ph7.4)配制浓度0.15mm的nadph反应液;
2)确定稀释比例
取930μlnadph反应液,加入20μl稀释后akr1b1混合均匀后在30℃下恒温5min后,加50μl底物吡啶-3-醛启动反应。探索不同稀释比例,至340nm紫外吸收曲线为平直线且斜率数值约为0.2。最终固定酶akr1b1浓度为0.5μμ左右;
3)配置酶反应溶液
按照步骤2所得酶稀释比例,用nadph反应液稀释酶akr1b1至反应浓度0.5μm,配成酶反应溶液;
4)化合物ic50测定
为了测试化合物对akr1b10酶活性的抑制效应,将浓度为1、5、10、25、50和100μm的化合物分别添加到包含重组人类akr1b10的比色皿中。按照酶反应溶液:底物溶液=950:50体积比混合反应体系。测试过程先将酶反应溶液和化合物混合均匀后在30℃下恒温5min,加50μl底物吡啶-3-醛启动反应。采用tecaninfinitem1000酶标仪在340nm波长下进行5min吸光度测试。
实验结果:实验结果:将浓度为75、37.5、18.75、9.375、4.6875、2.34375、1.171875的7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮进行akr1b1的酶抑制活性实验,发现该化合物有较弱的抑制活性,其半抑制浓度ic50为50.23μm/l(如图2所示)。
实施例3:mtt法检测化合物体外对肝癌肿瘤细胞hcc存活率的影响。
实验原理:mtt,商品名噻唑蓝,全称为3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide。mtt比色法,是一种检测细胞生存活力的方法。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt还原为水不溶性的蓝紫色结晶甲瓒(formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(dmso)能溶解细胞中的甲瓒,用酶标仪在570nm波长处测定其光吸收值,可间接反映存活细胞的数量。在一定范围内,mtt结晶形成的量与细胞存活数成正比。
实验试剂的准备:肝癌肿瘤细胞hcc细胞株购自中国医学科学院基础医学研究所细胞中心,mtt购自sigma-aldrich公司。
实验步骤:
1)细胞培养
取对数生长期的细胞,按8×103个/孔接种于96孔板,放置于37℃,含5%co2的细胞培养箱中进行培养。
2)测定化合物对肝癌肿瘤细胞hcc的ic50。
待细胞适应生长12h后,加入100μl含不同浓度化合物的新鲜培养基(化合物的终浓度为150、75、37.5、18.75、9.375、4.6875、2.34375μm),每个剂量组至少设3个平行复孔,于37℃培养箱中继续培养24h后,每孔加入10μlmtt溶液(0.5mg/ml,pbs配制),继续培养4h。2000rmp离心5min,小心弃上清,每孔加入200μldmso溶解甲簪沉淀,微型振荡器振荡10min充分混匀后,用酶标仪在570nm波长下测定光密度值(od),并计算细胞存活率及ic50值。细胞存活率%=100%-(od对照组-od药物组)/od对照组×100%。根据计算,能够得在不同浓度的受试化合物作用下细胞的存活率,据此结果绘制曲线,计算该受试化合物诱导50%细胞死亡时的浓度,即为ic50值。
实验结果:将浓度为150、75、37.5、18.75、9.375、4.6875、2.34375μm的7-(3-氟苯基)-3-((2-(4-(2-甲氧苯基)哌嗪-1-基)-2-羰基乙基)硫代)-[1,2,4]三唑并[4,3-a]吡嗪-8(7h)-酮对肝癌肿瘤细胞hcc进行细胞存活率测试,发现该化合物有很好的抑制活性,其半抑制浓度ic50为112.5μm/l(如图3所示)。
- 还没有人留言评论。精彩留言会获得点赞!
- 作为β-分泌酶(BACE)抑制剂的4-氨基-6-苯基-5,6-二氢咪唑并[1,5-A]吡嗪-3(2H)-酮衍生物的制作方法
- 7-叔丁基-2-乙基-8-甲基-5,6-二氢咪唑[1,2-a]吡嗪-2,7(8H)-二羧酸的合成方法
- 一类咪唑并吡嗪类化合物及其药物组合物和用图
- 一种咪唑并[1,2-b]吡嗪-3-甲酸乙酯的合成方法
- 咪唑并吡嗪syk抑制剂的制作方法
- 具有咪唑并吡嗪酮骨架的pde9抑制剂的制作方法
- 作为蛋白酶活化受体4(par4)抑制剂用于治疗血小板聚集的咪唑并噻二唑和咪唑并吡嗪 ...的制作方法
- 用作依赖细胞周期蛋白的激酶抑制剂的新的咪唑并吡嗪的制作方法
- 用作激酶抑制剂的咪唑并吡啶和咪唑并吡嗪化合物的制作方法
- 作为蛋白激酶抑制剂的咪唑并吡嗪化合物的制作方法
- 一种紫外线吸收剂uv-234的制备方法
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑5-甲基间苯二甲酸锰配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑镉混配配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑间苯二甲酸镉配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑锌混配配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑三维锌配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑对苯二甲酸铜配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-双三唑均苯四酸铜配合物单晶与应用
- 一种4-苯基-3-((4,6-二甲基嘧啶-2-基硫代)甲基)-5-苄硫基三唑类化合物及其应用
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑二维铜配合物单晶与应用