一类通过调控YB-1磷酸化治疗单核细胞趋化蛋白-1参与的疾病的药物及其筛选方法与流程
本发明属于生物医药领域,具体涉及一类通过调控YB-1磷酸化治疗由单核细胞趋化蛋白-1参与的疾病的药物及其筛选方法。
背景技术:
Y区结合蛋白-1(Y-box-binding protein 1,YB-1)是一类特异性结合目的基因启动子和增强子内部Y-Box序列(一种高度保守的顺式的DNA序列)的转录因子,属于冷休克蛋白(Cold shock proteins)超家族中的一员,它含有的一段高度保守的冷休克区域(Cold shock domain,CSD),就是其与核酸的结合部位。YB-1的蛋白代号为:Protein Symbol:P67809-YBOX1_HUMAN,由324个氨基酸组成,分子量为35924道尔顿。YB-1广泛存在于微生物、植物、动物和人类中,在分子水平上,参与DNA修复,mRNA转录、剪接,调节mRNA的稳定性、翻译等生物学过程;在细胞水平上,YB-1在细胞增殖与分化、细胞应激反应、肿瘤细胞的转化上起重要作用;在临床病理方面,YB-1被证实,与多种疾病的发生有关联,例如,肿瘤,包括肝癌、乳腺癌、结肠腺癌、肺癌;肝纤维化;炎症;动脉粥样硬化;器官移植排异反应;再灌注损伤;YB-1也可作为肿瘤诊断,和/或预后的标志物。
趋化性细胞因子chemokine是一个蛋白质家族,由十余种结构有较大同源性、分子量多为8~10kD的蛋白组成。这些蛋白在氨基端多含有一个或两个半胱氨酸。根据半胱氨酸的排列方式,将趋化性细胞因子分为亚家族。两个半胱氨酸按Cys-X-Cys(半胱氨酸-任一氨基酸-半胱氨酸)方式排列的趋化性细胞因子属α亚家族,也称CXC趋化性细胞因子;以Cys-Cys方式排列的趋化性细胞因子属β亚家族,也称CC趋化性细胞因子。氨基端只有一个半胱氨酸的趋化性细胞因子称γ亚家族趋化性细胞因子,也称C趋化性细胞因子。趋化性细胞因子主要由白细胞和造血微环境中的基质细胞分泌,可作用于任何具有趋化性细胞因子受体的细胞,并对他们的靶细胞具有趋化和激活作用。IL-8是α亚家族系的代表,对中性粒细胞有趋化或富集作用。单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1或CCL-2)是β亚家族的代表,可趋化或富集单核细胞,嗜碱性粒细胞,记忆性T细胞,及树突状细胞。淋巴细胞趋化蛋白(lymphotactin)是γ亚家族的代表,对淋巴细胞有趋化或富集作用。MCP-1主要参与炎症的发生发展过程,包括动脉粥样硬化,系统性红斑狼疮,风湿性关节炎。目前为止,人类对上述疾病的治疗方法仍然十分有限且效果欠佳。
技术实现要素:
本发明基于本领域存在的上述缺陷和不足,提供一类治疗由单核细胞趋化蛋白-1参与的疾病的药物及该类药物的应用,用于为本领域治疗单核细胞趋化蛋白-1参与的上述各类疾病提供一种效果更好的药物以及新的用药选择。
本发明的技术方案如下:
用于治疗单核细胞趋化蛋白-1参与的疾病的药物,其特征在于,以YB-1为药物靶点;且所述药物的活性成分包括能直接或间接调控YB-1磷酸化的物质。
所述单核细胞趋化蛋白1参与的疾病包括:炎症、动脉粥样硬化、2型糖尿病,肿瘤,自身免疫病,肥胖、及脑病(痴呆,癫痫等)。
所述药物的活性成分包括直接或间接下调,和/或,直接或间接抑制YB-1磷酸化的物质;
进一步地,所述直接或间接下调,和/或,直接或间接抑制YB-1磷酸化的物质包括YB-1磷酸化抑制剂。
所述YB-1磷酸化抑制剂选自由下述物质中的任一种或任几种组成的组:促使YB-1脱磷酸化的物质、阻断或延缓YB-1磷酸化的物质、下调或抑制YB-1的蛋白激酶活性的物质、上调或激发YB-1磷酸化酶活性的物质。
与所述YB-1磷酸化抑制剂相对的是YB-1磷酸化增强剂;
所述YB-1磷酸化增强剂选自由下述物质中的任一种或任几种组成的组:阻断或延缓YB-1脱磷酸化的物质、上调或激发YB-1磷酸化的物质、上调或激发YB-1的蛋白激酶活性的物质、抑制或下调YB-1磷酸化酶活性的物质。
所述YB-1磷酸化抑制剂包括:如式I所示的物质:
地塞米松;和/或,
YB-1突变蛋白;
所述YB-1突变蛋白指,野生型YB-1蛋白的氨基酸序列的102位点丝氨酸突变后得到的突变蛋白。
所述药物的活性成分还包括所述YB-1磷酸化抑制剂的聚合物,和/或,所述YB-1磷酸化抑制剂在药学上可接受的盐类化合物;和/或,酯类化合物;和/或;增效类化合物。
所述药物还包括药学上可接受的辅料和/或载体。
用于治疗单核细胞趋化蛋白1参与的疾病的药物的筛选方法,其特征在于,采用可直接或间接调控YB-1磷酸化的物质做为候选药物进行病理实验,和/或,临床试验,和/或,治疗,筛选出具有效果,和/或产生疗效的物质用作所述药物的活性成分。
所述可直接或间接调控YB-1磷酸化的物质包括YB-1磷酸化抑制剂;
所述YB-1磷酸化抑制剂优选自:可促使YB-1脱磷酸化的物质,和/或,阻断或延缓YB-1磷酸化的物质,和/或,下调或抑制YB-1的蛋白激酶活性的物质,和/或,上调或激发YB-1磷酸化酶活性的物质。
可直接或间接调控YB-1磷酸化的物质在制备用于治疗单核细胞趋化蛋白1参与的疾病的药物方面的用途,其特征在于,将所述可直接或间接调控YB-1磷酸化的物质放置在标有单核细胞趋化蛋白1参与的疾病治疗用途的商品包装盒内;
在优选范围内,所述可直接或间接调控YB-1磷酸化的物质包括YB-1磷酸化抑制剂;
在更进一步优选范围内,所述YB-1磷酸化抑制剂选自:可促使YB-1脱磷酸化的物质,和/或,阻断或延缓YB-1磷酸化的物质,和/或,下调或抑制YB-1的蛋白激酶活性的物质,和/或,上调或激发YB-1磷酸化酶活性的物质。
本发明首先提供一类用于治疗单核细胞趋化蛋白1参与的疾病的药物,其特征在于,以YB-1为药物靶点;且所述药物的活性成分包括可直接或间接调控YB-1磷酸化的物质。
本发明开拓性地发现了上述药物治疗单核细胞趋化蛋白1参与的疾病的新的抗病机理:YB-1直接参与MCP-1mRNA稳定性的调控。非磷酸化的YB-1通过促进MCP-1mRNA的降解而下调MCP-1水平,从而减少单核细胞的聚集。非磷酸化的YB-1有利于结合UK114(核酸酶活性蛋白)而形成一种至少含有YB-1,UK114,和GR(糖皮质激素受体)的复合物,该复合物通过选择性降低细胞内单核细胞趋化蛋白-1(monocyte chemoattractant protein-1:MCP-1)的mRNA稳定性而下调MCP-1的表达。有关分子生物学实验结果见图4。YB-1对调控MCP-1的mRNA稳定性起主要作用。细胞内非磷酸化YB-1的温和性增加(产生于YB-1的脱磷酸化增强或磷酸化减弱,或二者的协同作用)即可显著抑制MCP-1的表达,进而抑制单核细胞在局部组织中的集聚,最终达到抑制,减轻,或预防由单核细胞趋化蛋白1参与的疾病。因而,调控YB-1磷酸化能有效调控MCP-1进而控制由MCP-1失调引起的疾病。本发明用转基因小鼠的动脉粥样硬化模型证实了该抗病机理的作用。
在本发明具体的实施例中,所述单核细胞趋化蛋白1参与的疾病包括:炎症、动脉粥样硬化、2型糖尿病,肿瘤,自身免疫病,肥胖、及脑病(痴呆,癫痫等)。
在本发明的一些实施例中,所述药物的活性成分包括直接或间接下调,和/或,直接或间接抑制YB-1磷酸化的物质;
在进一步的实施例中,所述直接或间接下调,和/或,直接或间接抑制YB-1磷酸化的物质包括YB-1磷酸化抑制剂。本发明在研究调控MCP-1的表达机理的过程中原创性地发现了YB-1磷酸化在调控MCP-1表达中的作用,以及YB-1磷酸化的抑制剂对MCP-1表达的抑制作用。
本文中的“单核细胞趋化因子1”、“单核细胞趋化蛋白1”、“单核细胞趋化蛋白-1”、“MCP-1”具有相同的本领域技术人员可常规理解的含义。
在一些具体的实施例中,所述YB-1磷酸化抑制剂选自由下述物质中的任一种或任几种组成的组:可促使YB-1脱磷酸化的物质、阻断或延缓YB-1磷酸化的物质、下调或抑制YB-1的蛋白激酶活性的物质、上调或激发YB-1磷酸化酶活性的物质。
尤其是那些高选择性直接导致YB-1脱磷酸化或高选择性直接阻断YB-1磷酸化的物质,以及高选择性下调YB-1的蛋白激酶(kinase)活性的物质及其高选择性上调YB-1的磷酸化酶(phosphatase)活性的物质。
蛋白激酶的作用是使目标蛋白磷酸化,而蛋白激酶的显著下降可导致蛋白激酶的总活性下降,下调或抑制蛋白激酶活性即可达到抑制或下调靶标蛋白磷酸化的目的;
相反,磷酸化酶的作用是脱磷酸化(去磷酸化),上调或激发靶标蛋白磷酸化酶的活性,即可使磷酸化酶的脱磷酸化作用强化,从而增强靶标蛋白的去磷酸化作用,进而起到抑制或下调靶标蛋白磷酸化的目的。
与所述YB-1磷酸化抑制剂相对的是YB-1磷酸化增强剂;
所述YB-1磷酸化增强剂选自由下述物质中的任一种或任几种组成的组:阻断或延缓YB-1脱磷酸化的物质、上调或激发YB-1磷酸化的物质、上调或激发YB-1的蛋白激酶活性的物质、抑制或下调YB-1磷酸化酶活性的物质。
因此,所述YB-1磷酸化抑制剂还可以是:与上述YB-1磷酸化增强剂起相反作用的物质,和/或,YB-1去磷酸化增强剂。
在进一步具体的实施例中,所述YB-1磷酸化抑制剂为如式I所示的物质:
在另一些实施例中,所述YB-1磷酸化抑制剂为地塞米松、或YB-1突变蛋白;所述YB-1突变蛋白指,野生型YB-1蛋白氨基酸序列的102位点丝氨酸经突变后得到的突变蛋白。所述野生型YB-1蛋白的序列如SEQ ID NO.1所示。
在进一步的实施例中,所述药物的活性成分还包括所述YB-1磷酸化抑制剂的聚合物,和/或,所述YB-1磷酸化抑制剂在药学上可接受的盐类化合物;和/或,酯类化合物;和/或;增效类化合物。
在更进一步的实施例中,所述的药物还包括药学上可接受的辅料和/或载体。
本发明的另一个方面提供了用于治疗单核细胞趋化蛋白1参与的疾病的药物的筛选方法,其特征在于,采用可直接或间接调控YB-1磷酸化的物质做为候选药物进行病理实验,和/或,临床试验,和/或,治疗,筛选出具有效果,和/或产生疗效的物质用作所述药物的活性成分。
在筛选方法的具体实施方案中,所述直接或间接调控YB-1磷酸化的物质包括YB-1磷酸化抑制剂;
进一步地,所述YB-1磷酸化抑制剂优选自:可促使YB-1脱磷酸化的物质,和/或,阻断或延缓YB-1磷酸化的物质,和/或,下调或抑制YB-1的蛋白激酶活性的物质,和/或,上调或激发YB-1磷酸化酶活性的物质。
本发明还请求保护可直接或间接调控YB-1磷酸化的物质在制备用于治疗单核细胞趋化蛋白1参与的疾病的药物方面的用途,其特征在于,将所述可直接或间接调控YB-1磷酸化的物质放置在标有单核细胞趋化蛋白1参与的疾病治疗用途的商品包装盒内;
优选地,所述可直接或间接调控YB-1磷酸化的物质包括YB-1磷酸化抑制剂;
更进一步优选地,所述YB-1磷酸化抑制剂选自:可促使YB-1脱磷酸化的物质,和/或,阻断或延缓YB-1磷酸化的物质,和/或,下调或抑制YB-1的蛋白激酶活性的物质,和/或,上调或激发YB-1磷酸化酶活性的物质。
在一些国家或地区的专利法允许的前提下,本发明还请求保护可直接或间接调控Y区结合蛋白-1(Y-box-binding protein 1:YB-1)磷酸化的物质在临床医疗中的适应症及其使用方法;
该发明关于YB-1磷酸化抑制剂的临床使用方法包括对上述适应症的个体使用该类物质以治疗,减轻,预防上述适应症。
该发明关于该发明所指物质的临床应用包括该发明所指物质的临床使用剂型和剂量。
除非另做说明,此处所有科技术语与该专利所涉及领域中科技常用术语具有相同意义。有机化学基本原理,及特殊官能团和反应参照Thomas Sorrell著《有机化学》,University Science Books,Sausalito:2006年版.
该发明的某些化合物或许以特定的几何或立体结构形式存在。该发明覆盖所有诸如此类的化合物,包括顺式,返式,R及S对应异构体,非对应异构体,(d)和(l)异构体,消旋混合物及该发明所覆盖的其他混合物。也包括非对称碳原子的替换,例如烷基中的替换。
异构混合物包括含有该发明异构体的任何比例的混合物。
该发明所指的“活性成份有效量”是指能足以产生所期待的生物学效应的剂量。此处所指的有效剂量可根据不同情况(例如给药途径,个体差异,不同化合物的药代,疾病的种类及治疗目标)而有所不同。
该发明所指的疾病的“治疗”包括治愈,减轻,延缓,或改善病情的方法,包括对病情的预防。治疗可能是针对疾病的一个或多个症状,或导致症状的病理学机制。相对于同等未接受治疗的对照组,此处所说的减轻或预防至少表现为10%的差异(用任何标准技术衡量)。
此处所指的“预防”包括防止,延缓,避免,或制止疾病或病情的发生,加重,或复发的方法。
此处所指的“药学上可接受的辅料”包括赋形剂,载体,溶剂,稀释剂,及用以在体内携带,转运该药的包裹材料。这些材料的实例诸如:糖,纤维素及其衍生物,西黄蓍蚀粉,滑石粉,明胶,油,醇类,琼脂,缓冲剂,二乙酯,乳化物,润滑剂,无热源水,藻酸,调色及调味剂,防腐剂,乳化剂,湿剂,润滑剂,抗氧化剂,缓释剂,及其他制药配方中所使用的相应物质。
本发明涉及的“分离的或纯化的”是指基本不含通常情况下的天然并存物的物质。纯度或均一性由诸如聚丙烯酰胺凝聚电泳或高效液相层析分析化学方法确定。
本发明所指的“个体”包括但不仅限于接受该治疗的人类,灵长类,啮齿类等。“个体”和“患者”可以互换用于人类。
本文所提及的“脱磷酸化”即“去磷酸化”,一般指磷酸基团的除去,在本文中的含义与本领域技术人员所理解的通常含义一致。
除非另有定义,本文使用的全部科技术语具有与本发明所属领域技术人员通常理解相同的含义。比如,所述“自身免疫病”指自身免疫性疾病,具体指机体对自身抗原发生免疫反应而导致自身组织损害所引起的疾病。许多疾病相继被列为自身免疫性疾病,值得提出的是,自身抗体的存在与自身免疫性疾病并非两个等同的概念,自身抗体可存在于无自身免疫性疾病的正常人特别是老年人,如抗甲状腺球蛋白抗体、甲状腺上皮细胞抗体、胃壁细胞抗体、细胞核DNA抗体等。有时,受损或抗原性发生变化的组织可激发自身抗体的产生,如心肌缺血时,坏死的心肌可导致抗心肌自身抗体形成,但此抗体并无致病作用,是一种继发性免疫反应。
本发明经动物实验证实,本发明请求保护的药物能十分显著地缓解单核细胞趋化蛋白1参与的疾病病症,具体地,本发明的所述药物能有效减少动物体内的病变动脉组织中的脂肪、炎性细胞及粥样硬化处间质层体积(面积及厚度),所述药物可高效抑制或减少动脉粥样硬化的形成。本发明针对动物的有效性试验结果证实本发明的药物对动物有效性可高达百分之百。
附图说明
图1.人动脉免疫组化染色,显示YB-1和磷酸化YB-1在人体动脉粥样硬化组织(AS)内的高表达,而在正常动脉管壁(Normal)中的表达量极低。
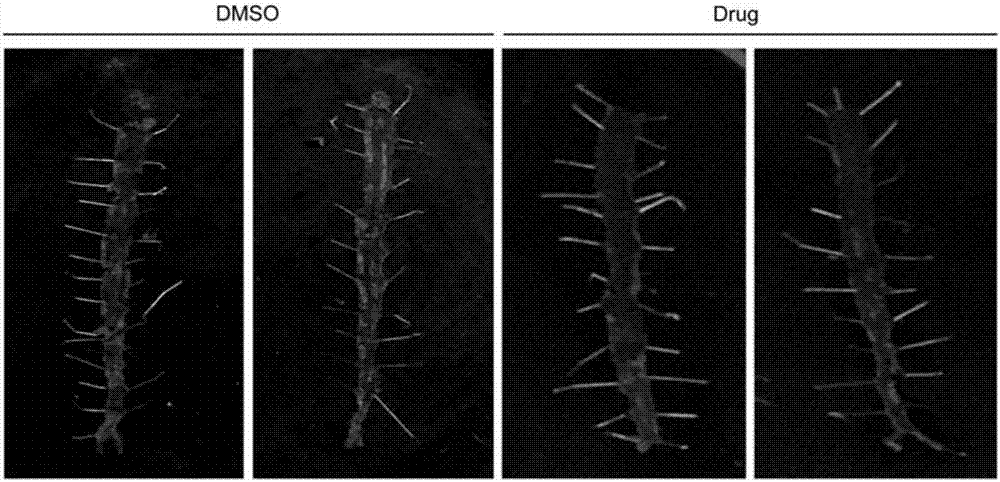
图2.小鼠动脉油红欧染色。与阴性对照组(DMSO)相比,显示MK2206显著抑制了动脉粥样硬化的形成。红色区域表示粥样硬化斑块中的脂肪。
图3.A图:免疫印迹杂交(IB)及反转录-聚合酶链式反应(RT-PCR),显示MK2206(MK,YB-1的蛋白激酶特异性抑制剂)能高效抑制血管平滑肌细胞内的YB-1磷酸化及MCP-1mRNA水平。(小鼠及人血管平滑肌细胞-SMC在含0.5微摩尔的MK2206培养液中孵育4小时,在无MK2206培养液中孵育的细胞做为对照-C。从上述细胞中提取蛋白及核糖核酸,用于IB及RT-PCR以检测其中的YB-1和MCP-1mRNA含量)。B图,模型雄鼠主动脉油红欧(Oil Red O)染色,显示MK2206高效抑制了模型雄鼠动脉粥样硬化的形成。(DMSO为无药组,6周龄雄性C57BL/6,N 9,ApoE-/-小鼠经高脂饲养10周;MK为给药组:6周龄雄C57BL/6,ApoE-/-鼠经高脂饲养同时给药10周,图中出现红色的区域为显示动脉血管壁粥样硬化病变中的脂肪)。C图,主动脉弓冰冻切片油红欧染色,显示了MK显著减小了在主动脉弓处的粥样硬化程度。D图,主动脉弓冰冻切片HE染色,显示了MK显著减小了粥样硬化处间质层面积。
E-H图,免疫组化染色,分别显示了MK显著减少了粥样硬化斑块中的MCP-1(E),巨噬细胞(F),及泡沫细胞(G),并且显著减少了磷酸化的YB-1(H)。(棕红色为阳性染色区)。
图4.A图:显示V5抗体(购于Invitrogen/Life Technologies,Grand Island,NY)在免疫沉淀实验中能选择性沉淀带有V5寡肽标记物的YB-1突变蛋白;(YBX是野生型YB-1的同义突变;3dS是102丝氨酸及其上游两个相邻氨基酸的缺失型),而野生型(WT)YB-1不含V5寡肽标记物,因此不能被V5抗体沉淀。
注:IP=免疫沉淀,IB=免疫印迹杂交,YB=YB-1,用于免疫印迹杂交的蛋白提取物分别源于野生型动脉管壁平滑肌细胞及稳定转染了YBX和3dS的动脉管壁平滑肌细胞株。
B图:从上至下4幅图片分别为图i、ii、iii、iv;其中,图i显示UK114蛋白(UK)只能与YB-1(YB)一起被A图中的V5抗体从蛋白提取物中纯化出来(图i,IB:UK免疫印迹杂交)。而且,在免疫沉淀中被纯化出的含有UK和YB的沉淀物具有降解MCP-1mRNA的活性。逆转录-聚合酶链式反应(RT-PCR)结果显示免疫沉淀所得到的UK含量与免疫沉淀物的生物活性(降解MCP-1mRNA的功能)成正比(图ii)。向该免疫沉淀复合中加入UK抗体能阻断上述降解MCP-1mRNA的这一生物活性(图iii),但对照PKCδ抗体则无阻断作用(图iv)。
注:Extract=蛋白提取物,rhUK=重组人源UK114
图5.A图为YB-1突变子的碱基变化示意图。YBmut=YB-1突变子。B图为逆转录-聚合酶链式(RT-PCR)反应结果:RNA来自YB-1突变子稳定转染的细胞株(未能获得S/A突变子的稳定转染细胞株)及野生型动脉平滑肌细胞。培养中的野生及含YB-1突变的细胞经10纳克/毫升PDGF(血小板源生长因子)孵育2小时,随后如图B选择性加入1微摩尔Dex(地塞米松)孵育2小时。源于以上细胞的RNA被用于RT-PCR。如前所述的YB-1,MCP-1,及YB-1突变子的特异性引物被用于RT-PCR。实验结果显示三种YB-1突变子均可被RT-PCR用特异性引物检出。三种突变子中只有3dS(丝氨酸缺失突变子)的MCP-1mRNA含量最低,而其他两个突变子的MCP-1mRNA与野生型没有显著差异。经地塞米松处理的野生型细胞与3dS一样只含有痕迹量MCP-1mRNA。地塞米松能活化细胞中的磷酸化酶,后者使YB-1脱磷酸化。因为地塞米松也是通过下调YB-1磷酸化来下调MCP-1(见图6),所以在该实验中被用作这一调控系统的阳性对照(地塞米松虽能下调MCP-1,但临床应用表明它有严重的副作用而不能长期使用)。该实验结果证明了YB-1在其100/102位点的磷酸化在调控细胞中的MCP-1水平过程中所扮演的重要角色。
图6.筛选地塞米松下调MCP-1作用的信号传导路。A图的RT–PCR结果:显示地塞米松(Dex)显著下调MCP-1mRNA(见第2泳道),而且该作用对所用的6种蛋白激酶抑制剂(详见表1)不敏感(见3至8泳道)。
B图的RT–PCR结果:显示地塞米松(Dex)显著下调MCP-1mRNA(见第2泳道),而且该作用能被一种磷酸化酶抑制剂(Cal)所有效阻断(6泳道),但对所用的其他5种磷酸化酶抑制剂(详见表1)不敏感(见3,4,5,7,8泳道)。该实验预示地塞米松通过磷酸化酶下调MCP-1。
C图的免疫印迹杂交结果:用YB-1和磷酸化YB-1的特异性抗体,通过免疫印迹杂交发现地塞米松显著下调磷酸化的YB-1(p-YB)水平(第2泳道)。
具体实施方式
下面通过具体实施例进一步对本发明的内容进行详细描述,但并不以此限制本发明的保护范围。如无特殊说明,下述实施例中使用的耗材均可商购获得;操作步骤均为常规操作。
生物材料的来源
本发明实施例和/或实验例中所使用的人体动脉组织源于北京协和医院的临床样本;ApoE敲除鼠(C57BL/6,ApoE-/-)、6周龄雄性C57BL/6,ApoE-/-小鼠均购自Vital River,China(北京维通利华实验动物技术有限公司);动脉管壁平滑肌细胞株可商购获得。
试剂与耗材
OCT复合物(Tissue-Tek,IL1-9302)购自Tissue-Tek公司;
YB-1抗体(Y0396)购自sigma公司;二抗(PV-6001)购于中杉金桥公司;AEC(AEC-0037)购自迈新生物公司;油红O染色试剂盒(ab150678)购自美国abcam公司(www.abcam.com)。
实验例3使用的总RNA提取试剂盒(RNeasy试剂盒)购自Qiagen Inc,Valencia,CA。
实验例4中使用的PKCδ抗体购于SigmaAldrich公司;抗YB1抗体(Y0396)购于Sigma Aldrich公司;人UK重组蛋白(rhUK,H00010247-P01)及其抗体(00010247-M01)购于Abnova(Littleton,CO);V5抗体购于Invitrogen/Life Technologies,Grand Island,NY。
实验例5中使用的地塞米松可商购获得。
第1组实施例:本发明的药物
本组实施例提供一种用于治疗单核细胞趋化蛋白1参与的疾病的药物。在本组所有的实施例中,所述药物都具有如下共同特征:所述药物以YB-1为药物靶点;且所述药物的活性成分包括可直接或间接调控YB-1磷酸化的物质。
本发明所提供的药物在治疗单核细胞趋化蛋白1参与的疾病的新的抗病机理如下:YB-1通过自身的磷酸化选择性降低细胞内核糖核酸(mRNA)稳定性来调控单核细胞趋化蛋白-1(monocyte chemotactic protein-1:MCP-1)的表达。YB-1对调控MCP-1的mRNA稳定性起主要作用。细胞内非磷酸化YB-1的温和性增加(产生于YB-1的脱磷酸化增强或磷酸化减弱,或二者的协同作用)即可显著抑制MCP-1的表达,进而抑制单核细胞在局部组织中的集聚,最终达到抑制,减轻,或预防由单核细胞趋化蛋白1参与的疾病。因而,调控YB-1磷酸化能有效调控MCP-1进而控制以由MCP-1失调引起的疾病。本发明用转基因小鼠的动脉粥样硬化模型证实了该抗病机理的作用。
在具体的一些实施例中,本文所提及的“单核细胞趋化蛋白1参与的疾病”的含义为:本领域技术人员根据本发明的申请日(优先权日)之前公布的现有技术中所记载的发病机理和发病过程中有单核细胞趋化蛋白1参与的各类疾病,具体地,包括:炎症、动脉粥样硬化、2型糖尿病,肥胖,自身免疫病,肿瘤,及脑病(痴呆,癫痫等);
而本文记载的上述各疾病类型“炎症、动脉粥样硬化、2型糖尿病,肥胖,自身免疫病,肿瘤,及脑病(痴呆,癫痫等)”,它们各自的含义与上述各疾病领域的普通技术人员所理解的通常含义和范围一致。
在本组实施例的另一些方案中,具体地,所述药物的活性成分包括直接或间接下调,和/或,直接或间接抑制YB-1磷酸化的物质;
在进一步的实施例中,所述直接或间接下调,和/或,直接或间接抑制YB-1磷酸化的物质包括YB-1磷酸化抑制剂。本发明在研究调控MCP-1的表达机理的过程中原创性地发现了YB-1磷酸化在调控MCP-1表达中的作用,以及YB-1磷酸化的抑制剂对MCP-1表达的抑制作用。
一些实施例中,所述YB-1磷酸化抑制剂选自由下述物质中的任一种或任几种组成的组:可促使YB-1脱磷酸化的物质、阻断或延缓YB-1磷酸化的物质、下调或抑制YB-1的蛋白激酶的物质、上调或激发YB-1磷酸化酶的物质。尤其是那些高选择性直接导致YB-1脱磷酸化或高选择性直接阻断YB-1磷酸化的物质,以及高选择性下调YB-1的蛋白激酶(kinase)活性的物质及其高选择性上调YB-1的磷酸化酶(phosphatase)活性的物质。
与所述YB-1磷酸化抑制剂相对的是YB-1磷酸化增强剂;
所述YB-1磷酸化增强剂选自由下述物质中的任一种或任几种组成的组:阻断或延缓YB-1脱磷酸化的物质、上调或激发YB-1磷酸化的物质、上调或激发YB-1的蛋白激酶活性的物质、抑制或下调YB-1磷酸化酶活性的物质。
因此,所述YB-1磷酸化抑制剂还可以是:与上述YB-1磷酸化增强剂起相反作用的物质,和/或,YB-1去磷酸化增强剂。
在上述实施例进一步的方案中,所述YB-1磷酸化抑制剂其中一个具体的实例为如式I所示的物质:
上述物质是本领域技术人员根据本发明的记载及上述式I可以通过人工合成得到的,或者,可以通过商购获得;上述式I所述物质在本文中也被称为MK或MK2206。
除了上述式I以外,所述YB-1磷酸化抑制剂还可以是目前临床应用的药物:地塞米松;地塞米松可以通过提高尚未被确定的磷酸化酶的活性来使YB-1脱磷酸化,从而减少细胞中的MCP-1。局部组织的MCP-1浓度是决定局部组织中单核/巨噬细胞数量的主要因素。小鼠动脉粥样硬化模型显示MCP-1缺陷可使动脉粥样硬化程度下降67%左右。
所述YB-1磷酸化抑制剂的另一个具体实例为YB-1突变蛋白;所述YB-1突变蛋白指,将野生型YB-1蛋白的氨基酸序列102位点的丝氨酸突变后所得的突变蛋白。由于丝氨酸含羟基,是常见的磷酸化位点。去除或替换该位点的丝氨酸会使YB-1失去在该位点被磷酸化的分子基础,所以该位点不再能被磷酸化。上述基于102位点丝氨酸的YB-1突变蛋白在细胞内有下调MCP-1的功能。此外,含102丝氨酸的YB-1多肽失去天然YB-1的功能,但能与天然YB-1竞争蛋白激酶,进而减少天然YB-1被磷酸化的概率。因此,本文中,这类突变的YB-1也被归属于YB-1磷酸化抑制剂,落入本发明YB-1磷酸化抑制剂的范畴。
在一些实施例中,所述药物的活性成分还包括所述YB-1磷酸化抑制剂的聚合物,和/或,所述YB-1磷酸化抑制剂在药学上可接受的盐类化合物;和/或,酯类化合物;和/或;增效类化合物。本领域技术人员,基于本发明记载的内容,可根据实际需求,例如,药物制作成本、药物剂型、原料获取便捷程度、药物除药效以为的其它性质(比如,稳定性、在体内的崩解性能等),选择适当的、能达到等同或相似药效的式I物质的衍生类物质。
在另一些实施例中,所述的药物还包括药学上可接受的辅料和/或载体。本领域技术人员,基于本发明记载的内容,可根据实际需求,例如,药物制作成本、药物剂型、原料获取便捷程度、药物除药效以为的其它性质(比如,稳定性、在体内的崩解性能、药物的保质期限等),选择适当的辅料,具体地,包括赋形剂,载体,溶剂,稀释剂,及用以在体内携带,转运该药的包裹材料。这些材料的实例诸如:糖,纤维素及其衍生物,西黄蓍蚀粉,滑石粉,明胶,油,醇类,琼脂,缓冲剂,二乙酯,乳化物,润滑剂,无热源水,藻酸,调色及调味剂,防腐剂,乳化剂,湿剂,润滑剂,抗氧化剂,缓释剂,及其他制药配方中所使用的相应物质。
第2组实施例:本发明药物的筛选方法
本组实施例提供了第1组实施例所提供的用于治疗单核细胞趋化蛋白1参与的疾病的药物的筛选方法。本组所有的实施例都具有如下共同特征:采用可直接或间接调控YB-1磷酸化的物质做为候选药物进行病理实验,和/或,临床试验,和/或,治疗,筛选出具有效果,和/或产生疗效的物质用作所述药物的活性成分。
本组其中的一些实施例中,所述可调控YB-1磷酸化的物质包括YB-1磷酸化抑制剂;
本组另一些实施例中,所述YB-1磷酸化抑制剂优选自:可促使YB-1脱磷酸化的物质,和/或,阻断或延缓YB-1磷酸化的物质,和/或,下调或抑制YB-1的蛋白激酶的物质,和/或,上调或激发YB-1磷酸化酶的物质。
与所述YB-1磷酸化抑制剂相对的是YB-1磷酸化增强剂;
所述YB-1磷酸化增强剂选自由下述物质中的任一种或任几种组成的组:阻断或延缓YB-1脱磷酸化的物质、上调或激发YB-1磷酸化的物质、上调或激发YB-1的蛋白激酶活性的物质、抑制或下调YB-1磷酸化酶活性的物质。
因此,所述YB-1磷酸化抑制剂还可以是:与上述YB-1磷酸化增强剂起相反作用的物质,和/或,YB-1去磷酸化增强剂。
具体地,筛选方法的具体操作可以按如下步骤进行:用某一具体A物质去处理动脉粥样硬化模型小鼠,并进行病理切片观察(例如,油红欧染色,或HE染色);同时采用免疫印迹杂交(IB)及反转录-聚合酶链式反应(RT-PCR)检测该A物质在分子水平和蛋白水平对MCP-1的影响。
如果A物质处理动脉粥样硬化模型小鼠的治疗结果的病理切片与对照小鼠的切片相比较,出现与图3的B图-H图类似的结果;同时,A物质对MCP-1与YB-1磷酸化的IB与RT-PCR结果出现与图3的A图、B图类似的结果,即可确定A物质可作为本发明的候选药物之一。
更具体的操作步骤详见实验例1-6的详细记载。
第3组实施例:本发明药物的制备方法
本组实施例提供了可下调YB-1磷酸化的物质在制备用于治疗单核细胞趋化蛋白1参与的疾病的药物方面的用途;或,第1组实施例所述的用于治疗单核细胞趋化蛋白1参与的疾病的药物的制备方法。本组所有的实施例都具有如下共同特征:将所述可下调YB-1磷酸化的物质放置在标有单核细胞趋化蛋白1参与的疾病治疗用途的商品包装盒内;
在本组优选的实施例中,所述可结合、激活、和/或上调YB-1的物质包括YB-1磷酸化抑制剂;
在更进一步的实施例中,所述YB-1磷酸化抑制剂选自:可使YB-1脱磷酸化的物质,和/或,阻断YB-1磷酸化的物质,和/或,下调YB-1的蛋白激酶的物质,和/或上调YB-1磷酸化酶的物质。
第4组实施例:本发明药物的使用方法
本组实施例提供第1组实施例所述药物,和/或第2组实施例筛选方法筛选得到的药物,和/或第3组实施例的制备方法制备得到的药物的使用方法。本组所有的实施例都具有如下特征:可直接或间接调控YB-1磷酸化的物质在预防和/或治疗由MCP-1参与的疾病方面的用途。
一些实施例中,具体提供YB-1磷酸化的抑制剂在临床医疗中的适应症及其使用方法;
另一些实施例中,所述使用方法包括,所述药物的临床应用,即,包括对上述适应症的个体使用该类物质以治疗,减轻,预防上述适应症。
在进一步的实施例中,所述药物的临床应用包括该发明所指物质的临床使用剂型和剂量。
实验例1、人动脉免疫组化染色试验
将人新鲜动脉组织包埋于OCT复合物中(Tissue-Tek,IL1-9302),液氮速冷后的冰冻切片保存于-80度。对6微米厚的切片进行标准的免疫组化染色。所述免疫组化染色方法的操作参考“cellsignal公司”官网公布的“Immunohistochemistry Protocol(Frozen)”操作方法(网址:https://www.cst-c.com.cn/contents/resources-protocols/immunohistochemistry-protocol-(frozen)/ihc-frozen)。另外,本实验采用羊血清(中杉金桥,ZLI-9056)封闭非特异性背景。一抗分别为抗YB-1抗体(sigma,Y0396)和抗磷酸化YB-1抗体(Cell Signaling,C34A2),用PBS稀释(1:100)后与切片组织在4度孵育过夜。二抗购于中杉金桥(PV-6001)。AEC(迈新试剂AEC-0037)用于显色,红色即为阳性区。
实验结果显示YB-1和磷酸化YB-1在人体动脉粥样硬化组织(AS)内的高表达,而在正常动脉管壁(Normal)中的表达量极低。
实验例2、小鼠动脉油红O染色试验
对本领域常用的动脉粥样硬化模型小鼠采用本发明第1组实施例任一所述的药物进行治疗,给药方式:腹腔注射85微克/天;对照组小鼠每天采用等量的DMSO;给药70天后,对治疗组的小鼠和对照组的小鼠的动脉组织分别采用油红O染色试剂盒进行染色,其染色方法为本领域显示冷冻切片组织中脂肪的最常用的标准方法,具体操作步骤按照购自美国abcam公司(www.abcam.com)的油红O染色试剂盒(ab150678)的产品说明书。
试验结果显示:如图2所示,与对照组(DMSO)相比,显示MK显著抑制了动脉粥样硬化的形成。红色区域表示粥样硬化斑块中的脂肪。
本文中的“动脉粥样硬化模型小鼠”、“模型小鼠”指经高脂饲养10周后的C57BL/6,N9,ApoE-/-小鼠。
实验例3、本发明药物防治动脉粥样硬化的效果
首先采用免疫印迹杂交(IB)及反转录-聚合酶链式反应(RT-PCR)检测MK在分子水平和蛋白水平对MCP-1的影响;具体操作为;小鼠及人血管平滑肌细胞(mSMC,hSMC)在含0.5微摩尔的MK2206培养液中孵育4小时,在无MK2206培养液中孵育的细胞做为对照(C)。从上述细胞中提取蛋白及核糖核酸,用于IB及RT-PCR以检测其中的YB-1和MCP-1mRNA含量;IB及RT-PCR的操作方法按本领域技术人员熟知的常规操作进行。其中逆转录-聚合酶链式反应(RT-PCR)的具体操作如下:
采用的引物分别为跨越MCP-1的145-595核酸编码区段及GAPDH的340-625核酸编码区段;引物长度均为20个碱基(大鼠MCP-1和GAPDH的核酸编码区序列可登录Genebank查询获知)。PCR产物分别是单核细胞趋化蛋白cDNA序列的145-595;GAPDH的340-625;YB-1的420-988;YB-1突变子的441-988。其中,YB-1突变子的正向引物为TGTGGAATTCGACGTCGTC,对应于野生型序TGTGAGTTTGATGTTGTT。除非另做说明,上述引物适用于本文的所有RT-PCR。
总RNA(Total RNA)用RNeasy试剂盒(Qiagen Inc,Valencia,CA)从大鼠细胞提取。大鼠平滑肌细胞分离及培养见Brock,1985,Hypertension,操作大体如下:200-300克雄性Sprague-Dawley大鼠的胸中动脉中的平滑肌细胞经酶解法分离获得。所有实验采用5-14代的培养细胞。细胞培养于含10%小牛血清的Dulbecco modified Eagle medium(DMEM;Gibco Laboratories,Gaithersburg,Md.)培养液中,于37度二氧化碳孵箱孵育。当培养皿中的细胞达到大约60%满时,细胞被用于制备RNA。细胞转染按Lipofectamine2000试剂制造商Ivitrogen的操作方法,Lipofectamine2000购于Invitrogen。转染时的细胞密度约为30%。每个逆转录-聚合酶链式反应使用200纳克RNA。反应体系采用Masterscript RT-PCR system(5PRIME Inc.,Gaithersbueg,MD)。RT-PCR反应程序为:54℃ 30分钟;94℃ 2分钟;以“94℃ 22秒,55℃ 22秒,73℃ 44秒”为1个循环,共进行27个循环;73℃ 6分钟。除非另做说明,以上参数适用于本文所有RT-PCR反应。
如无特殊说明,本文中的“YB-1突变子”一般指:所述“YB-1突变蛋白”对应的核苷酸序列。
检测结果如图3的A图所示:免疫印迹杂交(IB)及反转录-聚合酶链式反应(RT-PCR),显示MK2206(MK,YB-1的蛋白激酶特异性抑制剂)能高效抑制血管平滑肌和单核细胞内的YB-1磷酸化及MCP-1mRNA水平。
对动脉粥样硬化模型小鼠采用本发明第1组实施例任一所述的药物进行治疗,给药方式:对实验鼠高脂喂养的同时,腹腔注射85微克/天(约为小鼠模型中治疗肿瘤剂量的1/13。见Hirai等人发表的Mol Cancer Ther.2010 Jul;9(7):1956-67.);对照组小鼠每天采用等量的DMSO代替本发明的药物;给药10周后,对治疗组的小鼠和对照组的小鼠的动脉组织分别采用油红O染色和动脉HE染色,所述油红O染色的具体操作如实验例2所述;动脉HE染色指HE(苏木精-伊红)染色方法,其具体操作参照“protocolsonline”官网公布的“Haematoxylin Eosin(H&E)staining|Protocols Online”操作方法(官方网址:
http://www.protocol-online.org/cgi-bin/prot/view_cache.cgi?ID=2503)。HE染色是本领域最常用的标准组织学染色方法以显示组织的形态和结构(苏木精为深蓝或紫色,与核酸结合。伊红呈粉色,与氨基酸结合);本组试验的治疗效果如图3的B-D图所示:模型雄鼠主动脉油红O(Oil Red O)染色,显示MK2206高效抑制了模型雄鼠动脉粥样硬化的形成。(DMSO为无药组,6周龄雄性C57BL/6,ApoE-/-小鼠经高脂饲养10周;MK为给药组:6周龄雄C57BL/6,ApoE-/-鼠经高脂饲养同时给药10周,图中出现红色的区域为显示动脉血管壁粥样硬化病变中的脂肪)。C图,主动脉弓油红欧染色,显示了MK显著减小了在主动脉弓处的粥样硬化程度。D图,动脉HE染色,显示了MK显著减小了粥样硬化处间质层面积。
同时,本实验例还对本发明的药物降低炎症、减少炎性细胞方面的试验,对照组和给药组动物的治疗给药过程如上一段所描述,治疗结束后对对照组和给药组小鼠的动脉组织分别进行免疫组化染色,方法同实验例1;染色结果如图3的E-H图,免疫组化染色,分别显示了MK显著减少了粥样硬化斑块中的MCP-1(E),巨噬细胞(F),及泡沫细胞(G),并且显著减少了磷酸化的YB-1(H)。(棕红色为阳性染色区)。
动脉粥样硬化是由MCP-1介导的动脉血管壁的炎症。上述实验例以动脉粥样硬化为模型,验证了YB-1在炎症病理过程中的作用,以及通过用本发明的药物调控YB-1进而调控体内MCP-1水平所产生的抗炎效果。根据本发明药物的作用机理,本发明药物同样也能用于治疗由MCP-1介导发生的2型糖尿病,肿瘤,自身免疫病,肥胖、及脑病(痴呆,癫痫等)等病症,并能预期得到与本文实验例2和3类似的治疗效果。
实验例4、YB-1突变蛋白抑制MCP-1活性验证
首先通过免疫沉淀试验,采用V5抗体对带有V5寡肽标记物的YB-1突变蛋白进行选择性沉淀。具体操作如下:
YB-1突变蛋白通过如下方式获得:采用如实验例3所述的RT-PCR的具体操作(包括采用YB-1突变子引物、反应程序等),从而使大鼠YB-1(GEnBank accession no.NM031563)跨越起始和终止密码区的cDNA经逆转录-聚合酶链式反应获得,并克隆于pBluescript II KS(+)质粒的HindIII和XbaI之间。所有YB-1突变蛋白都采用聚合酶链式反应(PCR)生成或其它人工序列合成得到。这些YB-1突变子被亚克隆于pcDNA3.1/V5-His A质粒的Hind III和XbaI位点之间.起始密码上游都引入了Kozak sequence,GCCACC。YB-1 3‘端的终止密码被Xba I位点取代。质粒中所含的V5-His标记肽及终止密码按编码顺序紧随Xba I位点之后。克隆的PCR终产物都经DNA测序证实。
带有V5寡肽标记物的YB-1突变蛋白通过如下方式获得:pcDNA3.1/V5-His A载体质粒带有V5标记肽的DNA序列,将不带终止密码的YB-1突变体入框(in frame)克隆到V5的上游之后就得到杂交质粒。这种杂交质粒在细胞内能表达带有V5的YB-1突变蛋白。这种杂合的突变蛋白能与V5抗体特异性结合。
如实验例3所述的YB-1,MCP-1,及YB-1突变子的特异性引物以及RT-PCR反应程序被用于获得对应图5的B图所示的RT-PCR结果的RT-PCR试验中。
除非另做说明,本文中免疫沉淀、免疫印迹杂交的操作步骤均如下所示:每个样品使用30微升G蛋白珠悬液(Roche,Germany)。用预冷的S100缓冲液(10mM Tris[pH 7.4],1.5mM MgCl2,150mM KCl,0.5mM DTT,0.5mM PMSF)洗G蛋白珠3次。再用3微升V5-抗体与G蛋白珠在4℃孵育1小时,随后加1微升20%牛血清白蛋白(BSA Fraction V from Sigma Aldrich)继续孵育1小时。用预冷的S100缓冲液洗V5抗体包被好的G蛋白珠一次,然后用150微升冷S100缓冲液重悬于0.5毫升Eppendorf管中冰浴。加入30-50微升(10微克蛋白)胞浆抽提物(抽提方法参考Poon M,Liu B,Taubman MB.1999.Identification of a novel dexamethasone-sensitive RNA-destabilizing region on rat monocyte chemoattractant protein 1mRNA.Molecular and cellular biology 19:6471-6478)于4℃共孵育1小时(含有重组人类UK蛋白的样品,需要将50微升胞浆抽提物于1微升重组人UK蛋白于室温孵育5分钟,再与V5抗体包被的G蛋白珠孵育)。用110x g离心免疫沉淀反应物1分钟以收集G蛋白珠,用S100缓冲液洗所得G蛋白珠2次,重悬于30微升S100缓冲液以备用于RNA降解实验(5微升=1微克RNA与5微升G蛋白珠重悬液在室温共孵育5分钟,取2微升上清液用于20微升的逆转录-聚合酶链式反应中),或30微升上样缓冲液(22μl RIPA buffer plus 8μl 4×loading dye:160mM Tris pH 6.8,4%SDS,40%Glycerol,575mMβ-mecapital ethanol,20μl 2%Xylene Cyanol),继而用于免疫印迹杂交实验:95℃ 5分钟,洗脱液用于4-20%SDS-PAGE(聚丙烯酰胺凝胶电泳),电泳完成之后将凝胶中的蛋白转移到PVDF膜上,再用特异性抗体检测目的蛋白。
试验结果分别如图4和图5所示。图4的B图中的图iv中使用的对照PKCδ抗体是一种蛋白激酶,该抗体特异性结合人、小鼠、和大鼠的这种蛋白激酶,该抗体对MCP-1mRNA降解活性无阻断作用;YB-1的102位点的丝氨酸相当于大鼠100位点的丝氨酸。在大鼠YB-1中,该丝氨酸的缺失导致YB-1不能在该位点被磷酸化。该位点无磷酸化的YB-1与UK114(一种核糖核酸酶)和GR(糖皮质激素受体)结合成活性复合物,该活性复合物选择性降解MCP-1mRNA。在该位点磷酸化了的YB-1不利于结合UK114。
图5中的三种突变子中只有3dS(丝氨酸缺失突变子)的MCP-1mRNA含量最低,而其他两个突变子的MCP-1mRNA与野生型没有显著差异,该实验结果证明了YB-1在其100/102位点的磷酸化在调控细胞中的MCP-1水平过程中所扮演的重要角色。
实验例5、地塞米松抑制MCP-1活性以及下调YB-1磷酸化的验证
本实验例也是通过RT-PCR试验验证了地塞米松也是通过下调YB-1磷酸化来下调MCP-1。
RT-PCR试验中使用的引物和具体实验操作步骤如实验例3所述。而试验中使用的其他6种磷酸化酶抑制剂的信息详见下表1:
表1.用于筛选介导地塞米松下调MCP-1作用的信号传导路所使用的蛋白激酶和磷酸化酶抑制剂,以及这些试剂的使用浓度,靶分子,和抑制效果
注:上表中的浓度指各抑制剂在细胞培养基中的终浓度;+:完全抑制;+/-:部分抑制;-:不抑
试验结果如图6所示,结果表明:地塞米松(Dex)显著下调MCP-1mRNA,且地塞米松通过磷酸化酶下调MCP-1。
实验例6、本发明药物的动物实验有效性统计
采用24只模型小鼠,对照组和给药组各12只,按照如实验例3所示的给药方式和对照方式分别对给药组和对照组进行给药或等量DMSO,给药指对给药组的50只小鼠腹腔注射本发明第1组实施例任一实施例所述的药物;10周后,采用如实验例3所示的油红O(Oil RedO)染色和免疫组化染色分别对两组小鼠的动脉组织进行染色,最终得到实验例2-3的治疗结果(为节约篇幅,本文不再一一罗列相关的染色结果图和统计图表),给药组的每只小鼠的动脉粥样硬化的形成显著得到抑制、粥样硬化程度显著减小、粥样硬化处间质层体积(面积和厚度)显著减小、炎性细胞显著减少、炎症得到显著缓解,因此,本发明的药物在动物试验中的有效性为100%。
SEQUENCE LISTING
<110> 吉林众泰生物技术有限公司
<120> 一类通过调控YB-1磷酸化治疗单核细胞趋化蛋白1参与的疾病的药物及其筛
选方法
<130> P170770/JLZ
<150> 201710657706.9
<151> 2017-08-03
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 324
<212> PRT
<213> Artificial Sequence
<220>
<223> 野生型YB-1蛋白序列
<400> 1
Met Ser Ser Glu Ala Glu Thr Gln Gln Pro Pro Ala Ala Pro Pro Ala
1 5 10 15
Ala Pro Ala Leu Ser Ala Ala Asp Thr Lys Pro Gly Thr Thr Gly Ser
20 25 30
Gly Ala Gly Ser Gly Gly Pro Gly Gly Leu Thr Ser Ala Ala Pro Ala
35 40 45
Gly Gly Asp Lys Lys Val Ile Ala Thr Lys Val Leu Gly Thr Val Lys
50 55 60
Trp Phe Asn Val Arg Asn Gly Tyr Gly Phe Ile Asn Arg Asn Asp Thr
65 70 75 80
Lys Glu Asp Val Phe Val His Gln Thr Ala Ile Lys Lys Asn Asn Pro
85 90 95
Arg Lys Tyr Leu Arg Ser Val Gly Asp Gly Glu Thr Val Glu Phe Asp
100 105 110
Val Val Glu Gly Glu Lys Gly Ala Glu Ala Ala Asn Val Thr Gly Pro
115 120 125
Gly Gly Val Pro Val Gln Gly Ser Lys Tyr Ala Ala Asp Arg Asn His
130 135 140
Tyr Arg Arg Tyr Pro Arg Arg Arg Gly Pro Pro Arg Asn Tyr Gln Gln
145 150 155 160
Asn Tyr Gln Asn Ser Glu Ser Gly Glu Lys Asn Glu Gly Ser Glu Ser
165 170 175
Ala Pro Glu Gly Gln Ala Gln Gln Arg Arg Pro Tyr Arg Arg Arg Arg
180 185 190
Phe Pro Pro Tyr Tyr Met Arg Arg Pro Tyr Gly Arg Arg Pro Gln Tyr
195 200 205
Ser Asn Pro Pro Val Gln Gly Glu Val Met Glu Gly Ala Asp Asn Gln
210 215 220
Gly Ala Gly Glu Gln Gly Arg Pro Val Arg Gln Asn Met Tyr Arg Gly
225 230 235 240
Tyr Arg Pro Arg Phe Arg Arg Gly Pro Pro Arg Gln Arg Gln Pro Arg
245 250 255
Glu Asp Gly Asn Glu Glu Asp Lys Glu Asn Gln Gly Asp Glu Thr Gln
260 265 270
Gly Gln Gln Pro Pro Gln Arg Arg Tyr Arg Arg Asn Phe Asn Tyr Arg
275 280 285
Arg Arg Arg Pro Glu Asn Pro Lys Pro Gln Asp Gly Lys Glu Thr Lys
290 295 300
Ala Ala Asp Pro Pro Ala Glu Asn Ser Ser Ala Pro Glu Ala Glu Gln
305 310 315 320
Gly Gly Ala Glu
- 还没有人留言评论。精彩留言会获得点赞!