电子蛋白分级分离的制造方法与工艺
电子蛋白分级分离相关专利申请的交叉参考本申请要求2012年4月4日提交的美国临时专利申请号61/620,245以及2013年3月14日提交的美国专利申请号13/803,564的优先权,上述文献都通过引用纳入本文以用于所有目的。发明背景在多种情况下,需要进行蛋白纯化。然而,蛋白纯化通常是繁琐且耗时的。
技术实现要素:
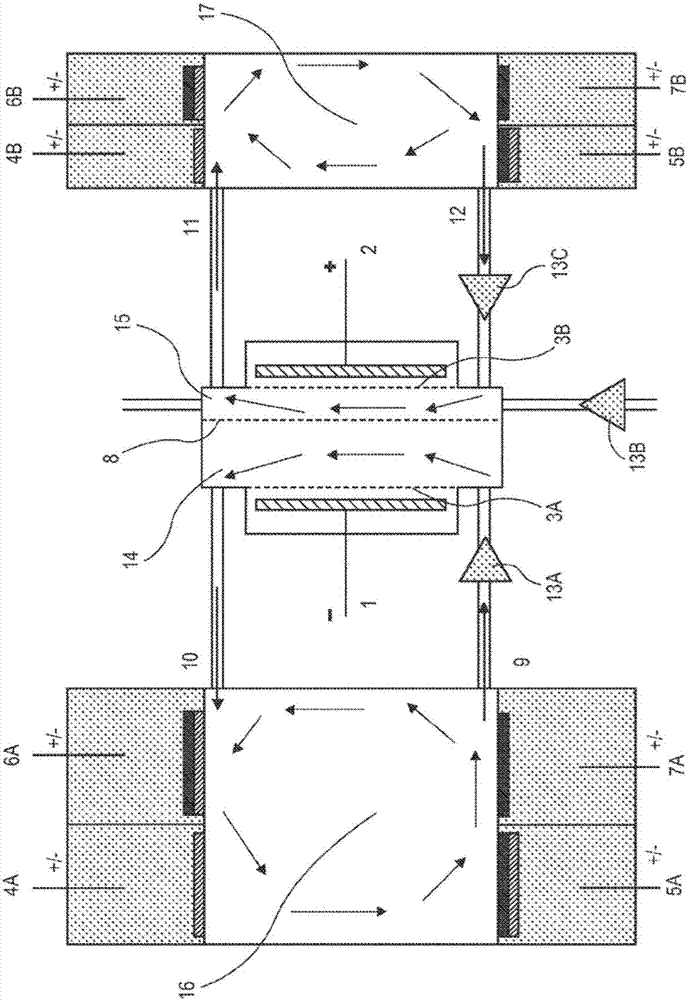
本发明的各方面描述于该文本中。在一些实施方式中,提供了设备。在一些实施方式中,所述设备包括:被隔膜分为第一子腔室和第二子腔室的腔室,所述隔膜阻断或基本阻断了第一和第二子腔室之间的液体流动;且其中第一子腔室与第一电极电连通;第二子腔室与第二电极电连通;第一子腔室与第一离子注射器/提取器流体连通;第二子腔室与第二离子注射器/提取器流体连通;且且第二子腔室包括出口。在一些实施方式中,第一电极与第一子腔室被第一分离膜分开且第二电极与第二子腔室被第二分离膜分开,所述分离膜能渗透小离子但不能渗透较大分子。在一些实施方式中,第一离子注射器/提取器包括第一电极且第二离子注射器/提取器包括第二电极。在一些实施方式中,第二子腔室小于第一子腔室。在一些实施方式中,第一电极是阳极且第二电极是阴极。在一些实施方式中,第一电极是阴极且第二电极是阳极。在一些实施方式中,注射器/提取器直接连接至对应的子腔室。在一些实施方式中,注射器/提取器经由管道或通道连接至对应的子腔室。在一些实施方式中,第二子腔室还包括一个或多个进口。在一些实施方式中,隔膜包括一层交联聚合物,从而抑制流体扩散。在一些实施方式中,隔膜含有孔,该孔允许小于分子截留值的肽通过但基本阻断大于所述分子截留值的肽通过。在一些实施方式中,分子截留值是约20kDa。在一些实施方式中,注射器/提取器各包括:a.与子腔室流体连通并通过阴离子选择性膜与子腔室分开的隔室;和/或b.与子腔室流体连通并通过双极膜与子腔室分开的隔室;和/或c.与子腔室流体连通并通过阳离子选择性膜与子腔室分开的隔室。在一些实施方式中,该设备包括:被隔膜分为第一子腔室和第二子腔室的腔室,该隔膜阻断或基本阻断了第一和第二子腔室之间的液体流动;且其中第一子腔室与第一电极电连通,第一电极通过第一分离膜与第一子腔室分开;第二子腔室与第二电极电连通,第二电极通过第二分离膜与第二子腔室分开,分离膜能渗透小离子但不能渗透较大分子。第一子腔室与第一质子/阴离子注射器/提取器和第一氢氧根/阳离子注射器/提取器流体连通;第二子腔室与第二质子/阴离子注射器/提取器和第二氢氧根/阳离子注射器/提取器流体连通;且且第二子腔室包括出口。在一些实施方式中,第二子腔室小于第一子腔室。在一些实施方式中,第一电极是阳极且第二电极是阴极。在一些实施方式中,第一电极是阴极且第二电极是阳极。在一些实施方式中,注射器/提取器直接连接至对应的子腔室。在一些实施方式中,注射器/提取器通过管或通道连接至对应的子腔室。在一些实施方式中,第二子腔室还包括一个或多个进口。在一些实施方式中,隔膜包括一层交联聚合物,从而抑制流体扩散。在一些实施方式中,隔膜含有孔,孔允许小于分子截留值的肽通过但基本阻断大于所述分子截留值的肽通过。在一些实施方式中,分子截留值是约10、15、20、25或30kDa,例如10-30kDa。在一些实施方式中,质子/阴离子注射器/提取器各包括a.与子腔室流体连通并通过阴离子选择性膜与子腔室分开的第一隔室;和b.与子腔室流体连通并通过双极膜与子腔室分开的第二隔室。在一些实施方式中,氢氧根/阳离子注射器/提取器各包括:a.与子腔室流体连通并通过阳离子选择性膜与子腔室分开的第三隔室;和b.与子腔室流体连通并通过双极膜与子腔室分开的第四隔室。还提供了包含本文所述设备的系统,该设备通过导线连接至电源,可选地,该系统还包括泵、UV检测器、pH计和/或电导计。还提供了从样品中纯化目标蛋白或肽的方法。在一些实施方式中,该方法包括:提供上文所述或本文他处所述设备;将样品加载至第一子腔室或第一和第二子腔室,加载后第一和第二子腔室含有流体;控制注射器/提取器以调节腔室中流体的pH使得样品的一些组分因pH调整而带电且一些组分不带电;在第一和第二电极之间施加电压,从而使至少一些带电组分移动至第二子腔室中;以及通过第二子腔室中的出口移除包含带电组分的第二腔室中的流体,从而将样品中的目标蛋白或肽与样品的至少一些其他组分分离。在一些实施方式中,一种或多种目标蛋白或肽是移动至所述第二子腔室的带电组分,并在移出后收集该目标蛋白或肽。在一些实施方式中,移动至第二子腔室的带电组分是污染物并弃去该污染物。在一些实施方式中,样品仅加载至所述第一子腔室。在一些实施方式中,样品加载至所述第一和第二子腔室。在一些实施方式中,第一电极是阴极(负电荷)且第二电极是阳极(正电荷),并且控制包括调节流体的pH使其低于目标蛋白或肽的pI,使得目标蛋白或肽具有整体正电荷且样品的至少一些其他组分带有负电荷;且施加电压导致带负电荷的组分移动至第二子腔室且目标蛋白或肽留在第一子腔室中;且从第二子腔室中移除流体,该流体包含移动的组分,并在第二子腔室中可选地使用新流体代替移除的流体;并且,随后控制注射器/提取器以调节腔室中流体的pH使其高于目标蛋白或肽的pI,使得目标蛋白或肽具有整体负电荷;在第一和第二电极之间施加电压,从而使带负电荷的目标蛋白或肽移动至第二子腔室中;以及通过第二子腔室中的出口移除并收集第二子腔室中的流体,该流体包含目标蛋白或肽,从而将样品中的目标蛋白或肽与样品的至少一些其他组分分离。在一些实施方式中,第一电极是阳极(正电荷)且第二电极是阴极(负电荷),并且控制包括调节流体的pH使其高于目标蛋白或肽的pI,使得目标蛋白或肽具有整体负电荷且样品的至少一些其他组分带有正电荷;且施加电压导致带正电荷的组分移动至第二子腔室且目标蛋白或肽留在第一子腔室中;且从第二子腔室中移除流体,该流体包含移动的组分,并在第二子腔室中可选地使用新流体代替移除的流体;并且,随后控制注射器/提取器以调节流体的pH使其低于目标蛋白或肽的pI,使得目标蛋白或肽具有整体正电荷;在第一和第二电极之间施加电压,从而使带正电荷的目标蛋白或肽移动至第二子腔室中;以及通过第二子腔室中的出口移除并收集第二子腔室中的流体,该流体包含目标蛋白或肽,从而将样品中的目标蛋白或肽与样品的至少一些其他组分分离。在一些实施方式中,样品包含蛋白且隔膜含有孔,该孔允许小于分子截留值的肽通过但基本阻断大于截留值的肽通过,且加载包括将样品加载至第一子腔室,可选地,控制包括控制注射器/提取器以调节第一子腔室中的流体的pH;向第一子腔室中加入第一蛋白酶,加入时的条件允许第一蛋白酶从蛋白中生成肽;在第一和第二电极之间施加电压,从而使至少一些大小低于所述分子截留值的带电的肽移动至第二子腔室中。在一些实施方式中,所述分子截留值是约10、15、20、25或30kDa,例如10-30kDa。在一些实施方式中,所述方法还包括,向第一子腔室中加入第二蛋白酶,加入时的条件允许第二蛋白酶从所述蛋白中生成肽;在第一和第二电极之间施加电压,从而使至少一些大小低于所述分子截留值的带电的肽移动至第二子腔室中。在一些实施方式中,所述方法包括,在加入第二蛋白酶之前或之后,调节第一子腔室中的流体的pH至对第二蛋白酶最优的pH。在一些实施方式中,在加入第一蛋白酶前或后,所述方法包括在第一和第二电极之间施加电压,从而使至少一些带电的肽(如果存在)从所述样品中移至第二子腔室中。在一些实施方式中,所述方法还包括在第二子腔室中收集肽。附图简要说明图1显示了本文所述设备的示例性实施方式。在两个电极(1和2)之间施加的电压可使带电分子朝合适的电极(阴极或阳极,取决于所带电荷)移动。可以移动带电分子,例如从第一子腔室(14)通过膜(8)至第二子腔室(15)。可使用4A、5A、6A、7A、4B、5B、6B和7B中描述的离子注射器/提取器调节并改变各子腔室的pH。其他膜(3A和3B)可保护子腔室中的溶液和组分,使其不接触电极。可选地,第一子腔室(14)可包括一个或多个出口(10)和进口(9)。类似地,第二子腔室(15)可包括一个或多个出口(11)和进口(12)。图2显示了本文所述设备的示例性实施方式。在两个电极(1和2)之间施加的电压可使带电分子朝合适的电极(阴极或阳极,取决于所带电荷)移动。可以移动带电分子,例如从第一子腔室(14)通过膜(8)至第二子腔室(15)。在这一实施方式中,可使用4A、5A、6A、7A、4B、5B、6B和7B中描述的离子注射器/提取器调节并改变储器(16和17)中溶液的pH。随后可将溶液从储器(16)通过进口(9)移动至第一子腔室(14)中并从储器(17)通过进口(12)移动至第二子腔室(15)中。需要时,泵(13A和13C)可移动溶液。需要时,出口(10和11)可使溶液循环回储器中。需要时,泵(13B)可从外部来源泵入新鲜溶液。其他膜(3A和3B)可保护子腔室中的溶液和组分,使其不接触电极。图3显示了质子注射器,包括与通道相邻的小隔室,其中浸有电极(例如Pt电极),和将隔室与通道分隔的双极膜。该图并不旨在显示完整的设备,而是仅仅显示质子注射器与子腔室相连的可能方式。图4显示了氢氧根注射器,包括与通道相邻的小隔室,其中浸有电极(例如Pt电极),和将隔室与通道分隔的双极膜。该图并不旨在显示完整的设备,而是仅仅显示氢氧根注射器与子腔室相连的可能方式。图5显示了向子腔室注射阴离子(所示的氯离子)和质子的隔室。该图并不旨在显示完整的设备,而是仅仅显示隔室与子腔室相连的可能方式。图6显示了向子腔室注射阳离子(所示的钠离子)和氢氧根离子的隔室。该图并不旨在显示完整的设备,而是仅仅显示隔室与子腔室相连的可能方式。图7显示了向子腔室注射质子同时从子腔室提取阳离子(所示的钠离子)的隔室。该图并不旨在显示完整的设备,而是仅仅显示隔室与子腔室相连的可能方式。图8显示了向子腔室注射氢氧根离子同时从子腔室提取阴离子(所示的氯离子)的隔室。该图并不旨在显示完整的设备,而是仅仅显示隔室与子腔室相连的可能方式。图9是实施例中所述设备的示意图。图10是实施例中所述系统的示意图。图11显示了用于移动带电分子通过如实施例中所述膜的设备。发明详述I.介绍提供了设备,该设备允许通过pH依赖的电荷对样品进行分级分离,从而完成样品组分的纯化。所述设备提供了被膜(称作“隔膜”)分成至少两个子腔室的腔室,该膜基本阻断了子腔室之间的流体流动但允许一些或全部样品组分(例如蛋白、核酸等)在电流存在的情况下跨膜移动。这两个子腔室各自与电极电连通,从而可在电极之间并因此横跨两个子腔室施加电压。可用样品加载一个或多个子腔室,并调节子腔室的pH使得样品中的一些组分带电。例如,组分的整体电荷取决于该组分的pI。如果pH高于pI,组分会具有整体负电荷,而如果pH低于pI,组分会具有整体正电荷。一旦跨电极施加电压,带正电荷的组分会朝负极(阴极)移动而带负电荷的组分会朝正极(阳极)移动。如果已知样品中目标分子的pI,可如本文详述的方法设计pH和电极以从样品的其他组分中纯化目标分子。本文所述实施方式的优势在于包括了离子“注射器/提取器”(在下文中进一步讨论),从而可以在不改变缓冲液等的情况下改变设备中溶液的pH。这将允许在纯化期间一次或多次改变pH,从而使用超过一次的pH“截留”对组分进行选择,或者在使用活性酶的实施方式中,将pH条件与酶进行匹配。不同组分的不同电荷允许使用电场通过电荷分离组分。因此,通过在该过程期间改变pH,可改变多种组分的电荷,从而进行多轮分离。例如,可将pH设置为略高于目标的pI(使得目标带负电荷)并使所有带正电荷的分子与目标分离。随后,可改变pH使其略低于目标的pI(使得目标带正电荷)并可除去所有带负电荷的组分,从而使除了与目标具有非常类似pI的任意组分之外的所有组分与目标分离。该方法可用于多种目的。例如,该方法可用于通过使用具有特定分子量大小限制的膜选择特定大小的肽,或者从具有较高和/或较低pI的分子中选择某些pI的分子。II.设备图1显示了本发明设备的实施方式的基本设计。两个子腔室(14和15)一起形成一个腔室,其间由膜(8)分开。为便于说明,左侧的子腔室称作“第一”子腔室而右侧的子腔室称作“第二”子腔室,但需要时可将两个子腔室的方向反转。通常,如本文所用,第二子腔室是组分最终移动至其中并从中收集目标分子和/或除去废物分子的子腔室。该设备可被设计用于接收第一子腔室或第一和第二子腔室中的样品,此时第二子腔室用于收集。因此,在一些实施方式中,整个腔室可以是顶部开放的,例如具有可移除或铰接盖。因此,在一些实施方式中,需要时可从顶部加载样品。或者,或联合使用,第一和/或第二子腔室可具有一个或多个进口以导入样品。在一些实施方式中,第一和/或第二子腔室可具有一个或多个出口以从第二子腔室中排出流体。膜(8)(即隔膜)将基本或完全阻断子腔室之间的流体流动,但允许样品组分和较小分子的跨膜移动,尤其在带电和存在电场时。例如,样品的蛋白和核酸组分可跨膜流动。膜的示例可包括,例如,低结合经修饰的纤维素膜(如聚磺酸酯膜)。在一些实施方式中,膜(8)可被一层交联的聚合物(如聚丙烯酰胺、琼脂糖等)覆盖以避免电场不存在时组分的跨膜扩散。如下所述,在一些实施方式中,膜可具有特定大小的孔以排除大于特定大小(“截留值”)的分子同时允许较小的分子通过。例如,在一些实施方式中,分子量截留值是约10、15、16、17、18、19、20、21、22、23、24、25kDa。第一电极与第一子腔室电连通且第二电极与第二子腔室电连通。“电连通”指第一和第二电极能够产生跨两个子腔室(14,15)和隔膜(8)的电压。例如,在一些实施方式中,第一电极位于第一子腔室中或与其相邻,且第二电极位于第二子腔室中或与其相邻。在一些实施方式中,一种膜(不同于分隔子腔室的膜(8),在本文中称作“分离膜”)可将电极与子腔室内流体分开,从而避免样品组分接触电极(接触则可能使其变性)...
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1