用于构建融合蛋白的连接肽的制作方法
本发明涉及融合蛋白领域,更具体地,涉及一种用于构建融合蛋白的连接肽。
背景技术:
近二十年,蛋白融合技术已广泛应用于构建双功能抗体、双功能酶和双功能蛋白等。然而,在构建融合蛋白过程中遇到了各种问题,例如在单独表达时能正确折叠的蛋白在融合蛋白中不能正确折叠;融合的两个蛋白因空间距离靠近从而导致活性位点被屏蔽;融合蛋白分子因不能正确折叠或其构象变化原因而容易被蛋白酶降解;原本具有一定柔性的蛋白催化域在融合之后失去了原有的功能等。这些问题的出现,往往导致融合蛋白活性降低甚至完全丧失。一般认为,构建融合蛋白后,原蛋白分子的活性会有一定程度的下降;一个有意义的融合蛋白是其各部分的活性保持在原蛋白分子的50%以上。为了解决以上问题,人们对融合蛋白的设计和构建进行了许多研究和探索,以期提高融合蛋白的活性。如通过改变融合蛋白的首尾顺序,变换不同的融合位点,采用不同的融合配体,或采用连接肽等方法。
相比于其它融合策略,使用连接肽(linker)具有多种优势。第一、组成连接肽的氨基酸具有多样性(20种常见氨基酸),而且连接肽长度也是重要可调参数,由此可带来连接肽丰富的多样性(20的n次方种,n是连接肽的氨基酸残基数),有利于对其进行工程改造;第二、连接肽能为两个待融合蛋白提供一定的空间间隔,以达到趋向于正确折叠而不相互干扰;第三、连接肽还能为两个待融合蛋白提供更多相互作用的可能性,促进相互间协同作用。
目前常用的连接肽有两种,螺旋形式的刚性连接肽(如A(EAAAK)nA)和由低疏水性、低电荷效应氨基酸组成的柔性连接肽。螺旋形式的刚性连接肽能有效分开融合蛋白的不同功能区。柔性连接肽的例子包括Huston设计的(GGGGS)3序列。另外,人绒毛膜促性腺激素(hCG)β链的羧基末端肽(以下称其为CTP)也有报道可以单独作为连接肽,主要用于连接同一个蛋白的不同亚基。例如,中国专利CN103539860A、CN103539861A、CN103539868A和CN103539869A公开的融合蛋白中,CTP作为接头,位于促卵泡激素的beta亚基和alpha亚基之间;专利WO2005058953A2公开的融合蛋白中,CTP作为接头,用于连接糖蛋白激素beta亚基和alpha亚基。但是,CTP因为具有延长某些蛋白体内半衰期的作用,因而在更多的专利文献中主要被公开作为融合蛋白中的延长半衰期部分,该部分可以选择使用免疫球蛋白Fc、CTP或其他能延长半衰期的融合配体。
有不少文献报道了连接肽序列对于融合蛋白构建和表达的影响。例如,在构建单链抗体1F7研究中,发现采用一个常规Genex212连接肽(GSTSGSGKSSEGKG)来连接其轻链和重链时,不能获得蛋白原有的催化活性,且蛋白不稳定;通过构建具有随机序列的连接肽(18个氨基酸残基)库进行筛选,才获得具有催化活性的单链抗体(Tang Y et al.,J Biol Chem.,1996,271(26):15682-15686)。Arai等在研究螺旋形式连接肽时,发现随着连接肽长度增加,从EBFP到EGFP的荧光共振能量转移减少,预示连接肽长度增加能有效分开两个功能区(Arai R等,Protein Engineering,2001,14(8):529-532)。另外,Luo等发现登革热病毒NS2B蛋白(N端为丝氨酸蛋白酶,C端为RNA解旋酶,连接肽为11个氨基酸残基的多肽),通过在原173和174位点之间插入甘氨酸,或将174位的脯氨酸替换成甘氨酸,均导致两端蛋白活性的显著下降,表明其天然连接肽所具有的长度和刚柔性是长期进化的结果,对该天然融合蛋白的功能发挥具有重要意义(Luo D等,J Biol Chem.,2010,285(24):18817-18827)。
本发明人发现,连接肽长度及其氨基酸组成、是否含有糖基化位点、连接肽与两个活性分子间的适配性等多个方面都会影响融合蛋白的功能及稳定性。本发明人认为,连接肽应该具备以下特性:1)能使所连接蛋白实现有效折叠,使其处于适当构型,不引起分子动力学变化,且最好选择非免疫原性的天然氨基酸;2)应具备防蛋白酶攻击能力;3)应尽量避免融合蛋白两端氨基酸序列的互相干扰。
在对设计和构建连接肽缺乏明确指导原则的情况下,本发明人根据自身的长期研究经验,尤其是在对Fc融合蛋白的研究中受到启发,开发了新的用于构建融合蛋白的连接肽,令人意外的是,其更利于保持蛋白或多肽的生物活性,而且具有广泛适用性和可移植性。
技术实现要素:
本发明的目的在于提供一种用于构建融合蛋白的新型连接肽。
本发明的第一个方面提供一种连接肽,由柔性肽和刚性肽组成,所述柔性肽包括1个或多个柔性单元,和所述刚性肽包括1个或多个刚性单元;其中,所述柔性单元包含2个或更多个选自Gly、Ser、Ala和Thr的氨基酸残基;和所述刚性单元包含人绒毛膜促性腺激素β亚基的羧基末端肽(本文中简称为CTP)。
优选地,所述连接肽是糖基化的。较优选地,糖基化位点位于所述CTP上。更优选地,所述糖基化过程通过在哺乳动物细胞(如,中国仓鼠卵巢细胞)或其他具有合适的糖基化修饰系统的表达载体中完成。
进一步地,组成本发明所述连接肽的刚性肽位于所述柔性肽的N末端或C末端;优选地,所述刚性肽位于柔性肽的C末端。具体地,本发明所述连接肽的结构通式可表示为F-R或R-F,其中,F和R分别代表柔性肽和刚性肽。进一步地,所述柔性肽优选地包含1,2,3,4或5个柔性单元,和所述刚性肽优选地包含1,2,3,4或5个刚性单元。
较佳地,所述柔性单元包含2个或更多个G和S残基。更优地,所述柔性单元的氨基酸序列通式为(GS)a(GGS)b(GGGS)c(GGGGS)d,其中a,b,c和d分别代表由G和S残基所组成结构单元的数目,且都是大于或等于0的整数,且a+b+c+d≥1。
示例性地,以Fi表示各柔性单元,且i=1,2,3,4,5......n,在本发明一些实施例中,所述柔性肽优选地包含但不限于如下柔性单元:
(i)F1:GSGGGSGGGGSGGGGS;
(ii)F2:GSGGGGSGGGGSGGGGSGGGGSGGGGS;
(iii)F3:GSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGS;
(iv)F4:GSGGGGSGGGGSGGGGS;
(v)F5:GGGSGGGSGGGSGGGSGGGS;
(vi)F6:GGSGGSGGSGGS。
其中,所述刚性单元选自由人绒毛膜促性腺激素β亚基羧基末端第113至145位氨基酸所组成的全长序列或其片段(以下简称CTP),具体地,所述刚性单元包含SEQ ID NO:1或其截短的序列。
优选地,所述CTP包含至少2个糖基化位点;例如,本发明的一优选实施例中,所述CTP包含2个糖基化位点,示例性地,所述CTP包含SEQ ID NO:1N端的10个氨基酸,即SSSS*KAPPPS*,或所述CTP包含SEQ ID NO:1C端的14个氨基酸,即S*RLPGPS*DTPILPQ;又如,另一实施例中,所述CTP包含3个糖基化位点,示例性地,所述CTP包含SEQ ID NO:1N端的16个氨基酸,即SSSS*KAPPPS*LPSPS*R;再如,另一些实施例中,所述CTP包含4个糖基化位点,示例性地,所述CTP包含28、29、30、31、32或33个氨基酸并开始于人绒毛膜促性腺激素β亚基的第113、114、115、116、117或118位,终止于第145位。具体地,所述CTP包含SEQ ID NO:1N端的28个氨基酸,即SSSS*KAPPPS*LPSPS*RLPGPS*DTPILPQ。在本文中,*代表糖基化位点。每种可能性都代表本发明的独立实施方式。
在另一些实施例中,本发明提供的刚性单元与天然CTP氨基酸序列至少70%同源;在另一些实施例中,本发明提供的刚性单元与天然CTP氨基酸序列至少80%同源;在另一些实施例中,本发明提供的刚性单元与天然CTP氨基酸序列至少90%同源;在另一些实施例中,本发明提供的刚性单元与天然CTP氨基酸序列至少95%同源。
示例性地,以Ri表示各刚性单元,且i=1,2,3,4,5......n,本发明一些实施例中所述刚性肽可优选地包含但不限于如下CTP刚性单元:
(i)R1:SSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(ii)R2:PRFQDSSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(iii)R3:SSSSKAPPPS;
(iv)R4:SRLPGPSDTPILPQ;
(v)R5:SSSSKAPPPSLPSPSR。
本发明所述刚性肽还可包含2个或3个上述CTP刚性单元,如本发明的一实施例中,所述刚性肽包含2个R3刚性单元:SSSSKAPPPSSSSSKAPPPS(表示为R3R3);本发明的另一实施例中,所述刚性肽包含3个R4刚性单元:SRLPGPSDTPILPQSRLPGPSDTPILPQSRLPGPSDTPILPQ(表示为R4R4R4)。
本发明一些优选实施例中,所述连接肽具有SEQ ID NO:2(GSGGGGSGGGGSGGGGSGGGGSGGGGSSSSSKAPPPSLPSPSRLPGPSDTPILPQ)所示的氨基酸序列(表示为F2-R1)。
本发明另一优选实施例中,所述连接肽具有SEQ ID NO:3(GSGGGSGGGGSGGGGSPRFQDSSSSKAPPPSLPSPSRLPGPSDTPILPQ)所示的氨基酸序列(表示为F1-R2)。
本发明另一优选实施例中,所述连接肽具有SEQ ID NO:4(GSGGGGSGGGGSGGGGSSSSSKAPPPSLPSPSRLPGPSDTPILPQ)所示的氨基酸序列(表示为F4-R1)。
本发明另一优选实施例中,所述连接肽具有SEQ ID NO:5(GGGSGGGSGGGSGGGSGGGSSSSSKAPPPSLPSPSR)所示的氨基酸序列(表示为F5-R5)。
本发明另一优选实施例中,所述连接肽具有SEQ ID NO:6(GSGGGGSGGGGSGGGGSSSSSKAPPPSSSSSKAPPPS)所示的氨基酸序列(表示为F4-R3R3)。
本发明另一优选实施例中,所述连接肽具有SEQ ID NO:7(GGSGGSGGSGGSSRLPGPSDTPILPQSRLPGPSDTPILPQSRLPGPSDTPILPQ)所示的氨基酸序列(表示为F6-R4R4R4)。
本发明另一方面,还提供一种包含所述连接肽的融合蛋白。所述融合蛋白包含两种生物活性分子及连接两种活性分子的连接肽。所述融合蛋白的结构通式表示为:K1-L-K2或K2-L-K1,其中K1是第一种生物活性分子;L是上述连接肽;K2是第二种生物活性分子,且组成所述融合蛋白的各部分自N端至C端首尾依次相连。进一步地,所述活性分子可选自蛋白或蛋白结构域、多肽、抗体或抗体片段,优选为蛋白或蛋白结构域、抗体或抗体片段。
示例性地,所述融合蛋白的活性分子K1包含具有生物学功能的蛋白或蛋白结构域、多肽,特别是可溶性或者膜信号分子、细胞因子、生长因子、激素、共刺激分子、酶、受体以及对于受体具有配体功能的蛋白或者多肽;和所述活性分子K2为延长循环半衰期的血清蛋白或蛋白结构域,例如,人血白蛋白(HSA)、转铁蛋白(TF)或抗体/免疫球蛋白Fc片段等。
示例性地,所述融合蛋白的活性分子K1包含毒素、酶、细胞因子、膜蛋白或免疫调节细胞因子;和所述活性分子K2包含抗体或抗体片段,且K1和K2通过所述连接肽连接形成抗体融合蛋白。例如,K2为抗体Fv段(VL或VH);又如,K2为单链抗体(ScFv)。
进一步地,所述生物活性分子K1包含但不限于腺苷A1受体、血管紧张素转换酶ACE、Activin家族、ADAM家族、ALK家族、α-1-抗胰蛋白酶、细胞程序性死亡相关蛋白家族、神经生长因子及受体家族、骨形态发生蛋白BMP及受体家族、补体因子、降钙素、癌症相关抗原、组织蛋白酶家族、CCL趋化因子及受体家族、CD超家族、CFTR、CXCL趋化因子及受体家族、EGF、表皮生长因子EGF及受体家族、凝血因子IIa、因子VII、因子VIII、因子IX、铁蛋白、成纤维细胞生长因子FGF及受体家族、促卵泡激素、FZD家族、HGF、胰高血糖素、心肌肌球蛋白、生长激素、Ig、IgA受体、IgE、胰岛素样生长因子IGF及结合蛋白家族、白细胞介素IL超家族及其受体超家族、干扰素INF家族、iNOS、整联蛋白家族、激肽释放酶家族、层粘连蛋白、L-选择蛋白、黄体生成素、MMP家族、粘蛋白家族、钙粘蛋白超家族、血小板衍生生长因子PDGF及受体家族、甲状旁腺激素、血清白蛋白、T-细胞相关受体超家族、TGF-α、转化生长因子TGFβ超家族、促甲状腺激素、促甲状旁腺激素、肿瘤坏死因子TNF超家族及其受体TNFRSF超家族、尿激酶、WNT信号通路蛋白家族、胸腺肽α1、胸腺肽β4、VEGF、血管内皮生长因子VEGF及其受体家族。
本发明的优选实施例中,所述活性分子K1为人凝血因子VII(FVII)、人凝血因子VIII(FVIII)、GLP-1类似物Exendin-4(Ex4)、人白介素7(IL-7)或人生长激素(hGH);所述融合蛋白的连接肽L如SEQ ID NO:2,3,4,5,6或7所示;所述活性分子K2选自人免疫球蛋白IgG、IgM、IgA的Fc片段;更优选自人IgG1、IgG2、IgG3或IgG4的Fc片段;进一步地,Fc可以是野生型或突变体,所述Fc突变体包含位于野生型人免疫球蛋白Fc中的至少一种氨基酸修饰,且变体具有降低的效应子功能(ADCC效应或CDC效应)和/或与新生儿受体FcRn的结合亲和力增强。进一步地,本发明的优选实施方式中,所述Fc突变体优选自下组:(i)vFcγ1:含有Leu234Val、Leu235Ala和Pro331Ser突变的人IgG1绞链区、CH2和CH3区域(如SEQ ID NO:8所示氨基酸序列);(ii)vFcγ2-1:含有Pro331Ser突变的人IgG2绞链区、CH2和CH3区域(如SEQ ID NO:9所示氨基酸序列);(iii)vFcγ2-2:含有Thr250Gln和Met428Leu突变的人IgG2绞链区、CH2和CH3区域(如SEQ ID NO:10所示氨基酸序列);(iv)vFcγ2-3:含有Pro331Ser、Thr250Gln和Met428Leu突变的人IgG2绞链区、CH2和CH3区域(如SEQ ID NO:11所示氨基酸序列);(v)vFcγ4:含有Ser228Pro和Leu235Ala突变的人IgG4绞链区、CH2和CH3区域(如SEQ ID NO:12所示氨基酸序列)。
更优选地,本发明的一实施例中,所述FVII-Fc融合蛋白从N端至C端依次含有FVII(具有如SEQ ID NO:13所示的氨基酸序列)、连接肽(具有如SEQ ID NO:2所示的氨基酸序列)和人IgG Fc(具有如SEQ ID NO:11所示的氨基酸序列)。
更优选地,本发明的一实施例中,所述FVIII-Fc融合蛋白从N端至C端依次含有FVIII(具有如SEQ ID NO:14所示的氨基酸序列)、连接肽(具有如SEQ ID NO:2所示的氨基酸序列)和人IgG Fc(具有如SEQ ID NO:11所示的氨基酸序列)。
更优选地,本发明的一实施例中,所述Exendin-4-Fc融合蛋白从N端至C端依次含有Exendin-4(具有如SEQ ID NO:15所示的氨基酸序列)、连接肽(具有如SEQ ID NO:2,3,5或7所示的氨基酸序列)和人IgG Fc(具有如SEQ ID NO:11所示的氨基酸序列)。
更优选地,本发明的一实施例中,所述IL-7-Fc融合蛋白从N端至C端依次含有IL-7(具有如SEQ ID NO:16所示的氨基酸序列)、连接肽(具有如SEQ ID NO:2所示的氨基酸序列)和人IgG Fc(具有如SEQ ID NO:11所示的氨基酸序列)。
更优选地,本发明的一实施例中,所述hGH-Fc融合蛋白从N端至C端依次含有hGH(具有如SEQ ID NO:17所示的氨基酸序列)、连接肽(具有如SEQ ID NO:2所示的氨基酸序列)和人IgG Fc(具有如SEQ ID NO:11所示的氨基酸序列)。
本发明的另一些优选实施例中,所述融合蛋白的活性分子K1为抗体的重链可变区(VH);和K2为抗体的轻链可变区(VL)。且K1和K2通过所述连接肽连接形成单链抗体(ScFv)。
本发明的另一些优选实施例中,所述融合蛋白的活性分子K1包含第一种抗体、或者抗体片段;和所述活性分子K2包含第二种抗体、或者抗体片段,且K1和K2通过所述连接肽连接形成双特异性抗体。
优选地,本发明的一实施例中,K1为Anti-CD20的完整双链抗体,K2为Anti-CD3的单链抗体,K1和K2通过所述连接肽连接形成双特异性抗体。更优选地,所述双特异性抗体包含的Anti-CD20双链抗体的重链具有如SEQ ID NO:18所示的氨基酸序列,且所述轻链具有如SEQ ID NO:19所示的氨基酸序列;和所述双特异性抗体包含的Anti-CD3单链抗体具有如SEQ ID NO:20所示的氨基酸序列;和所述连接肽具有如SEQ ID NO:4或6所示的氨基酸序列;且所述Anti-CD20双链抗体的重链通过所述连接肽与所述Anti-CD3单链抗体连接。
另一方面,本发明还提供了所述连接肽用于制备融合蛋白的方法,所述融合蛋白的结构通式表示为:K1-L-K2或K2-L-K1,其中K1是第一种生物活性分子;L是所述连接肽;K2是第二种生物活性分子,且组成所述融合蛋白的各部分自N端至C端首尾依次相连。其中,所述活性分子可选自蛋白或蛋白结构域、多肽、抗体或抗体片段,优选为蛋白或蛋白结构域、抗体或抗体片段。所述制备方法包括可以使K1和K2通过L相连接的步骤;本发明的优选实施例中,所述方法包括如下步骤:
(a)将编码所述融合蛋白的第一种活性分子K1和第二种活性分子K2的DNA序列通过连接肽L的DNA序列连接组成融合基因;
(b)将步骤(a)中获得的融合基因引入真核或原核表达宿主;
(c)培养步骤(b)筛选到的高产量表达宿主,表达融合蛋白;
(d)收获步骤(c)得到的发酵液,并分离纯化融合蛋白。
示例性地,所述连接肽用于连接活性蛋白/多肽和长循环半衰期的血清蛋白,例如抗体/免疫球蛋白Fc片段、人血白蛋白(HSA)、转铁蛋白(TF)等。本发明一优选实施例中,FVII-Fc融合蛋白的制备方法中包含使活性分子FVII和人IgG Fc通过所述连接肽(SEQ ID NO:2)连接的步骤;本发明一优选实施例中,FVIII-Fc融合蛋白的制备方法中包含使活性分子FVIII和人IgG Fc通过所述连接肽(SEQ ID NO:2)连接的步骤;本发明另一优选实施例中,Exendin4-Fc融合蛋白的制备方法中包含使活性分子Exendin4与人IgG Fc通过所述连接肽(SEQ ID NO:2、3、5或7)连接的步骤;本发明另一优选实施例中,IL-7-Fc融合蛋白的制备方法中包含使活性分子IL-7和人IgG Fc通过所述连接肽(SEQ ID NO:2)连接的步骤;本发明另一优选实施例中,hGH-Fc融合蛋白的制备方法中包含使活性分子hGH和人IgG Fc通过所述连接肽(SEQ ID NO:2)连接的步骤。
示例性地,所述连接肽用于双特异性抗体的构建。本发明优选实施例中,Anti-CD3XCD20的双特异性抗体的制备方法中包含使Anti-CD20的双链抗体和Anti-CD3的单链抗体通过所述连接肽(SEQ ID NO:4或6)连接的步骤。
本发明人发现,本发明技术效果可以概况如下:
1、本发明组成所述连接肽的CTP,它含有多个O-糖基侧链,能形成相对稳定的立体构象,因而具有刚性结构,能更有效地将融合蛋白的两部分隔离开,消除彼此间的空间位阻效应。由活性蛋白与Fc组成的一系列融合蛋白,例如FVII-Fc融合蛋白,连接肽中增加CTP刚性单元保证了N-端融合的活性蛋白不会影响Fc变体与FcRn的结合位点,从而影响半衰期;另外Fc的Protein A结合位点对于制备工艺中纯化步骤很重要,连接CTP刚性单元保证N-端融合的活性蛋白也不会“罩住”它与protein A的结合位点。另一方面,CTP刚性单元的添加也使得约25KD大小的Fc片段不会干扰N-端融合的活性蛋白的正确折叠,造成其生物学活性/功能的下降或丧失。本发明多个实施例中都表明CTP刚性单元的加入使得融合蛋白的生物学活性显著提高。这可能解释为具有多个糖基侧链的CTP刚性多肽,相对于(GGGGS)n这类柔性连接肽的无规则卷曲,它可以形成稳定的立体构象,这种构象能有效地拉开融合蛋白两个半分子间的空间距离,促使活性蛋白和Fc段独立折叠形成正确的三维构象而互不影响各自的生物活性,从而减少因活性蛋白错误折叠或构象变化而导致的活性降低甚至丧失或形成聚合体,以提高融合蛋白的生物活性。
2、本发明所述连接肽具有广泛适用性和可移植性,刚性单元和柔性单元的组合序列,则能赋予连接肽具有介于完全刚性和完全柔性之间的构象,多肽具体的刚性(或柔性)程度因两种序列之间的比例、排列而异。通过设计不同比例和排列的刚性单元和柔性单元的组合序列,能对连接肽的刚性进行细微调控,以满足融合蛋白构建中对连接肽刚性的不同要求。
3、CTP含有糖基化位点,带负电、高度唾液酸化的CTP能够抵抗肾脏对其清除作用,进一步延长融合蛋白的半衰期;改善药代动力学参数,如降低清除率、降低表观分布容积、增加AUC(0-t),使融合蛋白的生物利用度提高,可以预期其临床给药剂量也将降低。
4、CTP上连接的糖基侧链的保护作用可以降低连接肽对蛋白酶的敏感性,使融合蛋白不易在连接区被降解。
术语解释
“抗体片段”意即抗体的抗原结合片段及抗体类似物,其通常包含至少部分母体抗体(parental antibody)的抗原结合区或可变区(例如一个或多个CDR)。
“Fc”区含有包含抗体的CH2和CH3结构域的两个重链片段。两个重链片段由两个或多个二硫键并通过CH3结构域的疏水作用保持在一起。
“Fv区”包含来自重链和轻链二者的可变区,但缺少恒定区。
“单链Fv抗体”(或“ScFv抗体”)是指包含抗体的VH和VL结构域的抗体片段,其中这些结构域存在于单个多肽链中。一般而言,Fv多肽另外在VH和VL结构域之间包含多肽接头,该接头使得ScFv能形成用于抗原结合的所需结构。
“双特异性抗体”是指包含两个可变结构域或ScFv单位使得所得抗体识别两种不同抗原决定簇。
“抗体融合蛋白”是指利用基因工程技术将抗体片段与其他生物活性蛋白融合所得的产物。由于融合蛋白的不同,这种抗体融合蛋白具有多种生物学功能。
例如,含Fv段的抗体融合蛋白:将Fab或Fv与某些毒素、酶、细胞因子基因拼接,通过这些抗体的引导,可将其生物活性分子导向靶细胞特定部位,即所谓的“生物导弹”;
例如,嵌合受体:将ScFv与某些细胞膜蛋白分子融合,形成的融合蛋白,可表达于细胞表面,称为嵌合受体,赋予特定细胞结合某种抗原的能力;
例如,含Fc段的抗体融合蛋白:将抗体IgG恒定区Fc段与生物活性分子融合,形成Fc融合蛋白。Fc融合蛋白不仅可发挥活性分子的生物学活性,还赋予其类似抗体的特性,包括延长血浆半衰期以及Fc片段特有的一系列效应功能,例如,一方面Fc段在消灭病原体的免疫防御中起重要作用。Fc介导的IgG的效应子功能发挥通过两种机制:(1)与细胞表面Fc受体(FcγRs)结合,由吞噬作用或裂解作用或杀伤细胞通过抗体依赖性细胞毒性(ADCC)途径消化病原体,或(2)与第一补体成分C1的C1q结合,引发补体依赖性细胞毒性(CDC)途径,从而裂解病原体。另一方面,抗体Fc段与FcRn受体结合可以避免抗体进入溶酶体而被降解。包含Fc段的融合蛋白被表达FcRn的细胞内吞和保护。这些融合蛋白不被标记为降解,而是再次进入循环系统,因而增加了这些蛋白的体内半衰期。再一方面,FcRn在成年上皮组织中有活性,并且在肠腔、肺气管、鼻腔、阴道、结肠和直肠的上皮细胞中表达。由Fc段组成的融合蛋白可通过FcRn介导的胞转作用,有效地穿梭上皮屏障。
“hCG-β羧基末端肽(CTP)”是一段来自人绒毛膜促性腺激素(hCG)的β-亚基羧基末端的短肽。四种与生殖相关的多肽类激素促卵泡激素(FSH)、黄体生成素(LH)、促甲状腺素(TSH)和绒毛膜促性腺激素(hCG)含有相同的α-亚基和各自特异的β-亚基。与其它三种激素相比,hCG体内半衰期明显延长,这主要来源于其β-亚基上特有的羧基末端肽(CTP)。CTP含有37个氨基酸残基,它具有4个O-糖基化位点,糖侧链终端是唾液酸残基。带负电、高度唾液酸化的CTP能够抵抗肾脏对其的清除作用,从而延长蛋白在体内的半衰期(Fares FA等,Proc Natl Acad Sci USA,1992,89:4304-4308)。
附图说明
图1、HA小鼠等活性给予FP-A1和诺其1h和2h后出血时长比较。与HA-N-1h组相比,*P<0.05,***P<0.01;与C57-NS组相比,#P<0.05,###P<0.01。
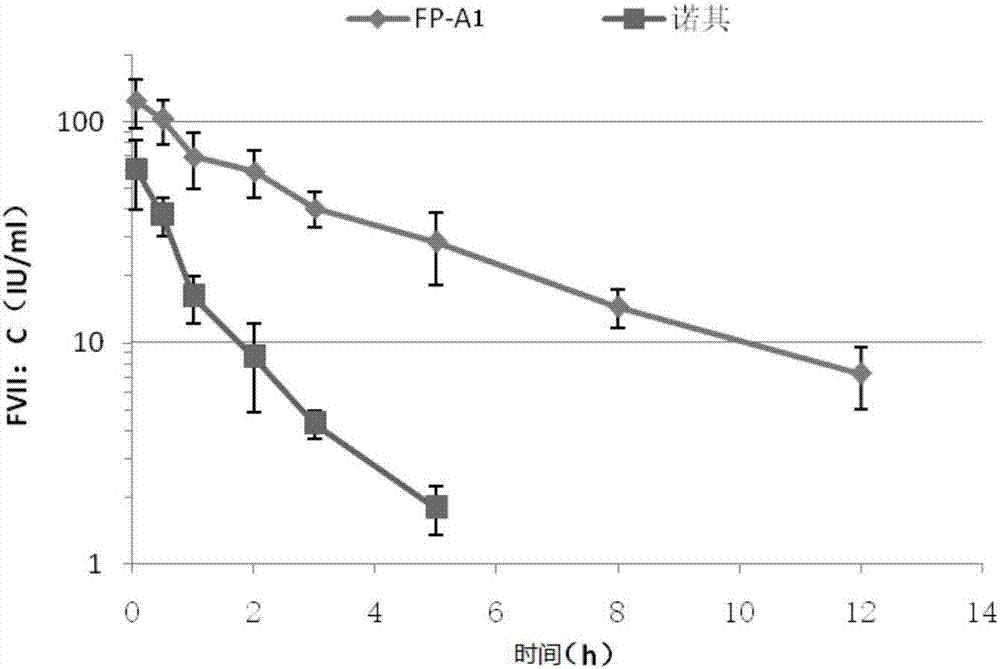
图2、FP-A1及诺其在华法林大鼠上的活性半衰期。
图3、db/db糖尿病小鼠单次注射FP-C1和FP-C5在0~216h间RBG值变化曲线。
图4、IL7-Fc融合蛋白FP-D1和FP-D2刺激小鼠单个核细胞增殖的能力。
图5、hGH-Fc融合蛋白FP-E1和FP-E2刺激Nb2细胞增殖的能力。
图6、hGH-Fc融合蛋白FP-E1和FP-E2血药浓度随时间变化曲线。
图7、hGH-Fc融合蛋白FP-E1给药后各组的生长曲线。
图8、Anti-CD3×CD20双特异性抗体FP-F1浓度依赖地活化人PBMC细胞分泌IFN-γ的检测结果。
图9、Anti-CD3×CD20双特异性抗体FP-F1浓度依赖地活化人PBMC结果。
图10、Anti-CD3×CD20双特异性抗体FP-F1杀伤皮下移植瘤的药效检测结果。
具体实施方式
实施例1、连接肽用于融合蛋白的构建
本发明人构建了一系列含连接肽的融合蛋白K1-L-K2。各融合蛋白的组成如表1所示。将编码所述融合蛋白活性分子K1和活性分子K2的DNA序列通过连接肽L的DNA序列相连组成融合基因序列。优选地,它们都是经人工优化过的CHO细胞偏爱密码子。优选地使用化学合成方法获得。为了便于将上述获得的融合基因目的片段插入表达载体的特定位点,在所合成片段5’和3’端各插入一个限制性酶切位点,分别为SpeI和EcoRI。经测序验证后的融合蛋白基因以相应的限制性内切酶酶切,然后插入到以PCDNA3.1为模板并改造后的表达质粒PXY1A1的相应酶切位点间,得到融合蛋白高表达质粒。PXY1A1质粒包含但不限于以下重要表达元器件:1)人巨细胞病毒早期启动子和哺乳动物细胞高外源表达所需增强子;2)双重筛选标记物,在细菌中具有卡那霉素抗性,在哺乳动物细胞中具有G418抗性;3)鼠二氢叶酸还原酶(DHFR)基因表达框,当宿主细胞为DHFR基因缺陷型时,氨甲蝶呤(MTX)能共扩增融合基因和DHFR基因(参见美国专利US 4,399,216)。将融合蛋白表达质粒转染入哺乳动物宿主细胞系,为了获得稳定高水平的表达,优选的宿主细胞系是DHFR酶缺陷型CHO细胞(参见美国专利US 4,818,679)。转染两天后,将培养基换成含0.6mg/mL G418的筛选培养基,细胞以一定浓度(5000-10000个活细胞/孔)接种在96孔培养板里,培养10-14天直至大的离散细胞克隆出现。用ELISA分析方法,筛选对选择用药具有抗性的转染子。通过极限稀释96孔培养板,亚克隆产生高水平融合蛋白的孔。对于多方验证效果良好的融合蛋白,为了实现更高水平表达,宜用受MTX药物抑制的DHFR基因进行共扩增。在含有递增浓度MTX的生长培养基中,用DHFR基因共扩增转染的融合蛋白基因。获得的高表达单克隆细胞株先在摇瓶或5升发酵罐中进行补料培养,再以Protein A亲和层析柱和其它离子交换层析柱纯化融合蛋白。
发明人构建了一系列含本发明所述柔性-刚性单元连接肽的融合蛋白,同时还构建了多种仅含不同长度柔性连接肽的融合蛋白作为对照。例如,FVII-Fc融合蛋白(含CTP的FP-A1;不含CTP的FP-A2和FP-A3)、FVIII-Fc融合蛋白(含CTP的FP-B1;不含CTP的FP-B2和FP-B3)、Exendin-4及其类似物Fc融合蛋白(含CTP的FP-C1、FP-C2、FP-C3、FP-C4;不含CTP的FP-C5)、IL7-Fc融合蛋白(含CTP的FP-D1;不含CTP的FP-D2)、hGH-Fc融合蛋白(含CTP的FP-E1;不含CTP的FP-E2)。此外,发明人还构建了Anti-CD20×CD3双特异性抗体(含CTP的FP-F1和FP-F2)。各融合蛋白组成如表1所示,各融合蛋白组成部分的氨基酸组成见序列表。
表1、各种融合蛋白组成(从N端至C端)
实施例2、凝血因子FVII-Fc融合蛋白制备、生物学活性和体内活性半衰期测定
2.1凝血因子FVII-Fc融合蛋白制备和鉴定
实施例1中获得的FP-A1、FP-A2和FP-A3CHO稳定表达细胞株,经过10-14天的摇瓶补料培养,经Protein A亲和层析、多维模式层析、阴离子交换层析和分子筛层析四个步骤进行纯化,然后再以溶液孵育自激活法活化融合蛋白。SDS-PAGE蛋白电泳检测显示,未活化的FP-A2在还原条件下,单链分子分别在70-85kDa和40kDa附近有两条明显条带,预示降解片段的存在,大约占20-30%;在非还原条件下,纯化蛋白迁移至约130kDa,并伴有部分>200kDa的条带,表明部分融合蛋白发生聚合。未活化的FP-A3在还原条件下,单链分子接近100kDa,无杂带,在非还原条件下,部分纯化蛋白迁移至>200kDa,表明FP-A3都是多聚体。未活化的FP-A1在还原条件下,单链分子100-110kDa,无明显杂带,在非还原条件下,纯化蛋白迁移至150kDa。活化的FP-A1在还原条件下呈现两条清晰条带,分别为74.3KDa的HC-L-CTP-Fc和约24.0KDa的LC,无其它杂带,在非还原条件下,纯化蛋白迁移至150kDa,表明融合蛋白FP-A1未发生明显降解且未出现明显的聚合现象,具有更高的热力学稳定性和更强的抗蛋白酶水解能力。该实施例表明,连接肽中含有CTP刚性单元,能够增加融合蛋白的稳定性,不易降解,并减少聚合体的形成。
2.2凝血法直接测定融合蛋白的生物学活性
凝血法测定FVIIa生物学活性是通过纠正FVIIa因子缺乏血浆所导致凝固时间延长的能力而获得的。采用法国STAGO公司生产的试剂盒FVII(Cat.No.00743)。检测方法首先是将稀释的已知FVII活性的正常人冻干血浆(Unicalibrator,Cat.No.00625)与乏VII基质血浆混合,测定凝血酶原时间(PT),建立标准曲线,再将待测血浆适度稀释后与乏FVII基质血浆混合,进行PT测定。通过标准曲线所拟合的活性百分比C(%)与PT时间t(s)的对数方程,可测得待测样本FVIIa的活性多少,其结果用正常血浆的百分比来表示(%),试剂盒中所提供的标准品百分比活性(%)与国际酶活单位IU的对应关系为100%=1IU,据此可求算出待测样品FVII的酶比活性大小,单位为IU/mg。结果显示,在最佳实验条件下,FP-A1、FP-A2和FP-A3的最高活性分别约20000IU/mg、4000IU/mg和7000IU/mg。如上实验结果表明,连接肽的类型和长度对于FVII-Fc的活性和稳定性影响都很大,含有刚性单元连接肽的融合蛋白FP-A1体外生物学活性远高于不含刚性单元的融合蛋白FP-A2和FP-A3,且表明仅靠延长柔性连接肽的长度,并不能有效的提高融合蛋白的活性。融合分子间的空间位阻效应影响融合蛋白的正确构象的形成,因而稳定性降低,易形成聚合体。该实施例表明连接肽中含有CTP刚性单元,能够降低Fc配体的空间位阻效应,提高融合蛋白的活性及稳定性。
2.3测定FVII-Fc融合蛋白的体内抑制出血作用
以FVIII因子基因剔除纯合子甲型血友病小鼠(hemophilia A,HA,购自上海南方模式生物研究中心)的断尾出血模型(tail vein transection(TVT)bleeding model)评估FVII-Fc融合蛋白的对血友病小鼠的止血作用。16-20周龄雄性HA小鼠适应性饲养一周后,随机分为3组,每组6只。其中两组给予300,000IU/kg的FP-A1,另一组给予300,000IU/kg的诺其(Novo Nordisk公司)。同时以16-20周龄,野生型雄性C57BL/6J小鼠(购自上海南方模式生物研究中心)作为正常对照组(n=6),尾静脉注射给予等体积剂量的生理盐水。给予FP-A1的两组HA小鼠分别于给药后1h和2h进行断尾试验;给予诺其的HA小鼠于给药后1h进行断尾试验;C57BL/6J正常对照组(C57-NS组)小鼠于注射后2h进行断尾试验。所有数据以均数±标准误(x±SEM)表示,各实验组间比较采用t-test检验分析,分析软件采用Graphpad Prism 5.0,p<0.05认为有统计学意义。
如图1所示,诺其组给药1h后,小鼠出血时间为30分钟,说明它已无促凝止血效果(HA-N-1h组),而给予FP-A1 1h(HA-F-1h组)和2h后(HA-F-2h组)仍然能有效止血,出血时间均比诺其组显著缩短(P<0.05)。这说明FP-A1相对于诺其具有显著延长的活性半衰期。
2.4.测定FVII-Fc融合蛋白的体内活性半衰期
本实验为考察FP-A1在华法林致大鼠凝血障碍模型上的活性半衰期。据文献报道的方法(Joe Salas等,Thrombosis Research,2015,135(5):970-976或Gerhard Dickneite等,Thrombosis Research,2007,119:643-651)进行实验,选取8-12周龄200-220g SD大鼠16只(购于北京维通利华实验动物技术有限公司),将大鼠随机分为2组,每组8只。以2.5mg/kg华法林(Orion Corporation,Finland,批号:1569755)灌胃,24h后分别静脉给予10,000IU/kg的FP-A1或诺其(Novo Nordisk公司)。FP-A1组于给药后0.05、0.5、1、2、3、5、8、12h采血;诺其组于给药后0.05、0.5、1、2、3、5h采血。血样以终浓度0.013M的柠檬酸钠为抗凝剂,3000rpm离心10min取上清,按2.2中的方法进行样品活性测定并计算活性半衰期。
如图2所示,计算得出FP-A1的活性半衰期为3.03±0.35h;诺其的活性半衰期为1.01±0.16h。相比等活性的诺其,FP-A1在大鼠体内活性半衰期延长了约3倍,单次注射FP-A1 3h后血浆凝血活性约40%,而等活性给药的诺其组3h后活性已降至3%;而FP-A1给药12h后血浆凝血活性仍保持在7%以上。
2.3和2.4的试验结果表明,由本发明所述连接肽(包含柔性单元和CTP刚性单元)所组成的融合蛋白,具有显著延长的功能半衰期,表明该连接肽消除了活性蛋白FVII对Fc与其受体FcRn结合位点的屏蔽效应,获得了显著延长的半衰期,同时也证明FVII因添加本发明所述连接肽而未受到C端融合的Fc位阻效应的影响,形成了正确的三维构象,保持了较高的生物学活性。
实施例3、凝血因子FVIII-Fc融合蛋白生产、生物学活性测定
3.1凝血因子FVIII-Fc融合蛋白生产和鉴定
实施例1中获得的FP-B1、FP-B2和FP-B3CHO稳定表达细胞株,经过7-12天的补料培养或半连续罐流培养,收获上清液立即进行Protein A和/或VIII-select(GE)亲和层析纯化。在最佳培养条件下,FP-B2收获的上清液经过Protein A和VIII-select(GE)两步亲和层析纯化,仍然含有多种组分。SDS-PAGE蛋白电泳检测显示,在还原条件下,显现180kDa的主带和多条40-100kDa大小的片段;在非还原条件下,绝大部分纯化蛋白迁移至>300kDa。表明FP-B2产物多以聚合体形式存在,且不稳定,易降解。在同样培养条件下,FP-B1收获的上清液经过Protein A和VIII-select(GE公司)两步亲和层析纯化,在还原条件下,显现清晰的三条带,分别为单链FVIII-Fc(190kDa)、轻链-Fc(105KDa)和重链(90KDa),无杂带;在非还原条件下,FP-B1和FP-B3纯化蛋白迁移至>200kDa,而FP-B3中大部分蛋白位于浓缩胶部位,预示着FP-B3也多以聚合体形式存在。
据报道FVIII 2303-2332区域的脂质结合区(Lipid binding region)对其功能至关重要,该区域极微小的构象变化即会引起蛋白的聚合,导致其活性丧失(Gilbert GE等,Biochemistry,1993,32(37):9577-9585)。该试验结果表明,含有CTP刚性单元的连接肽可以消除C端Fc对FVIII脂质结合区的位阻效应,使其空间构象几乎不受影响,从而减少蛋白的聚合,增强其稳定性,大大提高了FVIII-Fc融合蛋白的生物活性。
3.2凝血法直接测定FVIII-Fc融合蛋白的生物学活性
凝血法测定FVIII生物学活性是通过纠正FVIII因子缺乏血浆所导致凝固时间延长的能力而获得的。本发明采用法国STAGO公司生产的VIII因子(FVIII)测定试剂盒(凝固法)FVIII(Cat.No.00725)。检测方法是将稀释的已知凝血因子VIII活性的正常人冻干血浆(Unicalibrator(Cat No.00625))做活化部分凝血活酶时间(APTT)测定,测试仪器为STAGO公司系列血凝仪,先建立标准曲线,再将FVIII融合蛋白与乏VIII因子的基质血浆混合,测定其APTT值,通过标准曲线所拟合的活性百分比C(%)与APTT时间t(s)的对数方程,可测得待测样本FVIII的活性大小,其结果用正常血浆的活性百分比表示(%),试剂盒中所提供的标准品百分比活性(%)与国际酶活单位IU的对应关系为100%=1IU,据此可求算出待测样品FVIII的酶比活性大小,表示为IU/mg。结果显示,在最佳实验条件下,FP-B1、FP-B2和FP-B3的最高活性分别为10000IU/mg、150IU/mg和1300IU/mg。考虑到FP-B2蛋白分子中大部分为无活性的多聚体或降解片段,所以FP-B2和FP-B3中实际具有活性的分子比活并不一定差别很大,这预示着延长柔性连接肽长度对提高目的蛋白FVIII的活性作用有限。FP-B1与FP-B2的活性差异显著,充分表明连接肽中含有CTP刚性单元,能够降低Fc配体的空间位阻效应,提高FVIII-Fc融合蛋白的活性。
实施例4、Exendin4-Fc融合蛋白生产,生物学活性和体内半衰期测定
4.1体外生物学活性
实施例1中获得的FP-C1、FP-C2、FP-C3、FP-C4和FP-C5的CHO稳定表达细胞株,经过12-14天的摇瓶补料培养,以Protein A亲和层析柱纯化,两种融合蛋白纯度都在95%以上,分子大小也符合预期,然后用于活性分析。体外活性测定方法参照文献(Zlokarnik G等,Science,1998,279(5347):84-88)。方法简述如下:首先将带有人GLP-1R表达质粒和CRE-Luc报告基因的表达质粒PGL-4.29(Luc2P/CRE/Hygro)(Promega公司)共转染CHO-K1细胞,通过抗生素加压筛选获得共表达两种质粒的稳定细胞株。体外活性分析时,以16000个细胞/孔,每孔200μl接种到96孔细胞培养板中,用含10%FBS的DMEM培养基培养16~24小时,待细胞生长至覆盖板底90%以上面积时,用含10%FBS的DMEM培养基梯度稀释融合蛋白FP-C1、FP-C2、FP-C3、FP-C4和FP-C5,10μl/孔加入,浓度梯度设置为0.010、0.020、0.039、0.078、0.156、0.313、0.625、1.25和2.5nM,同时设置等浓度的杜拉鲁肽阳性对照组(Eli Lilly Company生产,货号:9301897)。在37℃,5%CO2条件下孵育5-6小时后,吸去上清,缓慢加入300μl PBS/孔洗涤细胞,随后吸去PBS,加入40μl裂解液,震荡15min,随后每孔加入40μl荧光素酶底物(荧光素酶(Luciferase)报告基因检测试剂盒,货号:GM-040501B,吉满生物有限公司产品),反应2分钟,以多功能酶标仪(SpectraMax M5system,Molecular Device公司)于波长560nm下测定荧光值,并根据荧光值绘制剂量反应曲线,计算出EC50值,结果见表2。FP-C1、FP-C2、FP-C3、FP-C4和FP-C5的EC50值约为0.03086nM、0.03156nM、0.03684nM、0.04012nM和0.03586nM,杜拉鲁肽EC50值约为0.02987nM,含CTP的FP-C1、FP-C2、FP-C3、FP-C4与不含CTP的FP-C5的体外生物学活性相当。发明人理解的原因可能是对于Exendin-4这类结构简单的小分子多肽,它与融合配体Fc相互间的空间位阻作用极小,因此CTP对消除位阻效应,提高融合蛋白活性方面的作用不显著。
表2、各融合蛋白的体外活性EC50值比较
4.2db/db糖尿病小鼠单次注射FP-C1和FP-C5的血糖变化情况
雌性糖尿病db/db小鼠(购自上海斯莱克实验动物有限责任公司),8周龄,体重42±2g,按体重随机分为3组,每组6只。受试药组按3mg/kg剂量皮下注射FP-C1和FP-C5,阳性组注射3mg/kg的杜拉鲁肽(Eli Lilly and Company生产,货号:9301897),模型组注射等体积剂量(10mL/kg)的PBS缓冲液。各组动物分别于给药前(0h)、给药后1h、2h、4h、6h、24h、48h、72h、96h、120h、144h、168h、192h和216h尾静脉采血,用血糖仪(三诺安准血糖仪)测定随机血糖值(Random blood glucose,RBG),并记录数据。血糖数据以均数±标准差(means±SD)形式表示,采用SPSS18.0统计软件分析数据。
在相同剂量下,FP-C1和FP-C5与阳性对照药杜拉鲁肽均有明显降血糖作用,如图3所示,从给药后9天内小鼠RBG值变化曲线图中可以看出,杜拉鲁肽降血糖作用仅能维持至第4天(P>0.05),在给药后第120小时,其血糖值与模型组相比已不具有统计学差异;而FP-C1能维持至给药后168小时,即第7天小鼠的血糖水平与模型组相比,仍具有统计学差异(P<0.05);FP-C5能维持至给药后144小时,即第6天小鼠的血糖水平与模型组相比,仍具有统计学差异。因而,可知FP-C1相对于FP-C5,在糖尿病小鼠模型中具有更长效的降血糖作用,表明连接肽CTP刚性单元可进一步延长Exendin-4的体内功能半衰期。
4.3Exendin4-Fc融合蛋白的在大鼠体内的药代动力学特征
雄性SPF级SD大鼠(购自上海必凯实验动物有限公司),预饲一周后单次皮下注射(sc)0.5mg/kg的FP-C1和FP-C5,每组4只,分别于给药前0h,给药后2h、8h、24h、32h、48h、56h、72h、96h、120h和144h眼眶取血,每次约0.3ml左右,分别记作:T0、T2、T8、T24、T32、T48、T56、T72、T96、T120和T144。取血后静置,再以5000rpm离心10min分离血清,于-70℃冷冻保存后合并检验。用双抗夹心ELISA测定时,以自制或市售的抗Exendin-4或GLP-1的NH2末端单克隆抗体(如Santa Cruz公司生产,货号SC-65389)包被、以自制或市售的辣根过氧化物酶标记的鼠抗人IgG Fc单抗(如北京义翘神州生物技术有限公司,货号:10702-MM01E-50)进行检测。后将数据输入分析软件PKSOLVER,得出待测药物在血液中T1/2,Cmax和AUC(0~t)等药代动力学参数。
如表3中结果显示,0.5mg/kg的FP-C5在大鼠体内的循环半衰期T1/2为14.9±1.29小时,而0.5mg/kg的FP-C1在大鼠体内的T1/2分别为21.4±2.51小时。FP-C1的最大血药浓度Cmax值显著高于FP-C5。另外,通过比较表3中不同采血时间点测得的AUC0~t(t=2h、5h、8h、24h、28h、32h或48h)可得知,在给药剂量相同的情况下,FP-C1的药物暴露量显著高于FP-C5,即FP-C1在大鼠体内的绝对生物利用度较不含CTP的FP-C5更高,可以预期其临床给药剂量也将降低。
表3、雄性SD大鼠单次皮下注射0.5mg/kg的FP-C1、FP-C5的药代动力学参数
实施例5、IL-7-Fc融合蛋白生产、生物学活性和体内半衰期测定
5.1体外生物学活性
实施例1中获得的FP-D1和FP-D2CHO稳定表达细胞株,经过12-14天的摇瓶补料培养,以Protein A亲和层析纯化,两种融合蛋白纯度都在95%以上,分子大小也符合预期,然后用于活性分析。IL-7及其融合蛋白的体外生物活性分析方法如下:小鼠脾脏来源的单个核细胞通过刀豆蛋白A(ConA)活化后,将100μL的细胞接种到96孔板中,之后加入一系列浓度梯度的FP-D1和FP-D2,37℃,5%CO2培养72小时后,加入20μL MTT试剂,继续培养4小时,吸出培养基后每孔加入100μL二甲基亚砜(DMSO),检测在492nm的吸光度,以此测定细胞的增殖情况。每个处理设三个重复,每个重复测定两次,以重组IL-7(hIL-7,购自北京义翘神州生物技术有限公司)作为阳性对照,以培养基作为阴性对照。图4显示了hIL-7、FP-D1和FP-D2融合蛋白刺激小鼠单个核细胞增殖的能力。根据绘制的剂量反应曲线,可获得FP-D1和FP-D2融合蛋白的半数有效浓度值(EC50)分别为0.039和0.048nM。按摩尔浓度计,重组融合蛋白表现出的体外生物活性优于E.coli表达的hIL-7(EC50值为0.08nM)。
5.2IL-7-Fc融合蛋白的药代动力学测定
雄性SPF级SD大鼠(购自上海必凯实验动物有限公司),预饲一周后分别单次静脉注射(iv)和皮下注射(sc)2mg/kg的FP-D1和FP-D2,每组3只,考察血药浓度随时间的变化规律。在注射后0、3、6、24、48、72、96、120、126、144以及172小时,通过眼眶采血,每次约0.3ml。取血后静置,之后5000转/分钟离心10分钟,取血清待测。采用对人IL-7特异的ELISA方法,测定每个时间点的融合蛋白浓度。通过软件PKSOLVER将得到的数据进行分析,计算T1/2,AUC(0-t)等药代动力学参数,结果见表4。
表4、融合蛋白的药代动力学参数
数据显示,FP-D2的消除相半衰期时间分别为12.86(iv)和13.81(sc)小时,二者接近,符合线性代谢动力学特征。FP-D1的消除相半衰期分别为18(iv)和19(sc)小时,稍长于FP-D2。静脉给药方式的总体清除率(Cl)FP-D1比FP-D2要低,说明FP-D1在FP-D2的基础上经过改造后,体内清除速率变慢了。除此之外,我们还发现由于引入了CTP结构,FP-D1的表观分布容积也降低,使其在组织中分布更少,血液中药物含量更高,导致体内暴露量更高。FP-D1在FP-D2的基础上增加了CTP的刚性结构,降低清除率、降低表观分布容积、增加AUC(0-t)。所以FP-D1的药效上可能优于FP-D2,生物利用度更高,可以预期其临床给药剂量也将降低。由此可见,FP-D1在生物学活性和药代动力学方面表现出优异的性能。该试验结果表明,连接肽中含有带负电、高度唾液酸化的CTP能够抵抗肾脏对其清除作用,进一步延长融合蛋白的半衰期,且提高融合蛋白的生物利用度。
实施例6、hGH-Fc融合蛋白生产、生物学活性和体内半衰期测定
6.1MTT法测定融合蛋白的体外生物学活性
实施例1中获得的FP-E1和FP-E2的CHO稳定表达细胞株,经过12-14天的摇瓶补料培养,以Protein A亲和层析纯化,三种融合蛋白纯度都在95%以上,分子大小也符合预期,然后用于活性分析。体外生物活性可以用转染子或纯化蛋白刺激大鼠淋巴瘤细胞Nb2细胞的增殖能力来测定。因Nb2细胞的增殖是受到hGH对细胞上的泌乳受体刺激而起反应,因而,Nb2细胞增殖能力测定可以用来评价生长激素的生物活性(参见,例如内田等人,J Mol Endocrinol.,1999,23:347-353)。
在含有10%胎牛血清的Fischer's培养基中正常培养小鼠淋巴瘤细胞Nb2-11(美国ATCC细胞库)。之后,使用无血清培养基稀释融合蛋白,从1000ng/ml 3倍稀释至8个梯度,每孔100μl,添加到96孔板中,最后一列以培养基为阴性对照。取对数期生长的细胞,用无血清培养基洗涤细胞,然后调整密度为每毫升3×106个细胞,每孔100μl加入到上述96孔板中。在37℃、5%CO2培养箱中继续培养48小时,使用CCK-8试剂盒(Cell Counting Kit,购自上海翊圣生物科技有限公司,货号:40203ES80)检测细胞增殖情况。用酶标仪测定在450nm处的吸光度,将OD读数相对于融合蛋白的浓度作图。由所得剂量反应曲线可测定融合蛋白的生物活性。
图5显示了hGH融合蛋白刺激Nb2细胞增殖的能力。表5为不同融合蛋白的EC50值。由于生长激素C端的氨基酸与其功能密切相关,Fc直接与hGH的C段连接会影响其生物活性。在hGH与Fc之间加入连接肽后,hGH融合蛋白的活性提高。由结果可以看出,FP-E1的活性与FP-E2相比,活性提高了近1倍。这可能由于CTP一方面发挥自身的功能,另一方面CTP刚性结构与柔性肽接头偶联作为连接Fc和目的蛋白的接头序列,这种新型肽接头有利于融合蛋白折叠成更良好的三维结构,因而提高了hGH的生物活性。
表5、hGH融合蛋白的EC50值
6.2体内循环半衰期
雄性SPF级SD大鼠(购自上海必凯实验动物有限公司),预饲一周后,体重约290g,按体重随机分组,每组3只,单次静脉注射给予0.176mg/kg的FP-E1和FP-E2,考察血药浓度和时间的变化规律。对照组和给药组分别在给药后0、0.5、1、2、3、4、5、8、10、24、48、72h经眼眶采血,血液在室温放置30min后5000r/min离心10min,分离出血清,-20℃保存。用针对hGH特异的ELISA方法测定各时间点血清中hGH含量。通过软件PKSOLVER,计算各组主要药代动力学参数。各组药代动力学参数结果如表6。
表6、hGH融合蛋白的药代动力学参数
由结果看出,FP-E1和FP-E2融合蛋白的体内半衰期分别为2.6和2.4小时,半衰期基本一致,这一点也可以从MRT参数中看出来,二者在体内停留的时间也接近。从图6的药时曲线上发现FP-E1的血药浓度一直比FP-E2高,推测可能是FP-E1结构的改变导致了其药代动力学的性质发生了变化。FP-E1的总体清除率只有FP-E2的一半,表明FP-E1的体内清除相对慢,而FP-E2的表观分布容积是FP-E1的两倍,说明FP-E2进入体内后迅速的分布到组织中,导致了其血药浓度低于FP-E1。FP-E1在FP-E2的基础上增加了CTP刚性结构,降低清除率并使AUC(0-t)增加,近一步降低了表观分布容积,使其在组织中分布更少,血液中药物含量更高,导致体内暴露量更高,所以FP-E1的结构优势不仅体现在优越的药代参数上,而且其药效可能也优于FP-E2。因FP-E1经过改造后血药浓度更高,意味着其生物利用度更高,所以FP-E1的药效好于FP-E2,可以预期其临床给药剂量也将降低。由此可见,FP-E1在生物学活性和药代动力学方面表现出更优异的性能。
6.3融合蛋白的体内生物学活性测定
选取4周龄SPF级雄性SD大鼠,体重60-80g,由中国食品药品检定研究院实验动物中心提供。
试验前2周清洁条件下手术摘除垂体,去垂体手术后2周为恢复期,给药前选择大鼠体重变化小于手术前体重±10%的合格健康动物,去垂体大鼠按体重均匀随机分为6组,5只/组。以短效rhGH(商品名norditropin,Novo Nordisk A/S生产)作为本实验的阳性参照药1(Y1),比活3IU/mg;以PEG-rhGH(长春金赛药业有限责任公司)作为阳性参照药2(Y2),比活6IU/mg;FP-E1低、中、高剂量设定分别为5mg/kg/14d、15mg/kg/14d和45mg/kg/14d。根据分子量大小和摩尔数,FP-E1的中剂量15mg/kg/14d与阳性参照药Y1和Y2相当。给药方式为颈部皮下注射,不同剂量FP-E1融合蛋白和Y2,每鼠于第1天和第8天各给药1次;Y1每天给药1次,连续14天。
给药后每只大鼠每天称重,第15天用二氧化碳窒息处死全部大鼠,称重。每只动物第i天(di)体重(bwi)与给药前即第1天(d1)体重(bw1)之差即增加的体重(必要时,实验结束后可进行尸检,切开蝶鞍区,肉眼检查有无垂体残留,剔除有垂体残存的动物)。体重增加计算公式:Δbw=bwi–bw1,其中:Δbw为体重增重;bw1为给药前d1体重;bwi为给药后第i天体重。计量资料以均数标准差表示,结果见表7。图7显示了给药后各组的生长曲线。
表7、hGH融合蛋白给药前后大鼠体重变化(n=7)
从结果可以看出,与模型组相比,在给药后第8天各给药组Δbw均显著增加,但各给药组间Δbw值差异不显著;而在给药后第15天,FP-E1对大鼠的体重增长具有非常显著的促进作用,高剂量FP-E1诱导垂体切除大鼠体重增加(Δbw值)是rhGH(Y1)和PEG-rhGH(Y2)组的约1.5倍;而中剂量FP-E1诱导的体重增加略优于Y1,与Y2基本一致。我们发现,FP-E1高剂量组在第2次给药后对大鼠体重增加,与PEG-rhGH组相比表现出更显著的促进作用,而在第1次给药后一周内,两组的Δbw值却不具有统计学差异。从这种差异性结果分析推测出FP-E1相比PEG-rhGH应具有更长的体内活性半衰期,因此重复给药后,这种体内蓄积效应使得FP-E1组在第2次给药后生长曲线的上升趋势更陡峭。
实施例7、Anti-CD3×CD20双特异性抗体的生产和生物学活性分析
7.1Anti-CD3×CD20双特异性抗体的制备和鉴定
实施例1中获得的FP-F1和FP-F2的CHO稳定表达细胞株,经过10-14天的摇瓶补料培养,以Protein A亲和层析纯化。两种融合蛋白纯度都在95%以上,分子大小也符合预期,然后进行活性分析。
7.2Anti-CD3×CD20双特异性抗体的体外活性测定
采用密度梯度离心法从人新鲜血液制备PBMC,用含10%热灭活的FBS培养基重悬为5×106个/ml,备用。使用完全培养基将抗体(Anti-CD3单抗OKT3或双特异性抗体FP-F1)稀释到2μg/ml,再按1:5倍率稀释至8个梯度,以每孔100μl加入到96孔板中,设三复孔。使用培养基作为阴性对照,并以ConA为阳性对照。上述制备的PBMC细胞悬液,以100μl/孔加入到96孔板中,37℃,5%CO2培养72h。孵育后,小心吸取96孔板培养上清,每孔100μl,并以IFN-γELISA kit(购自BD公司)检测上清中IFN-γ的含量(图8)。96孔板中各孔加入10μl CCK-8试剂,继续孵育4h。以抗体浓度作为X轴,492nm的吸光度值作为Y轴,拟合四参数S曲线,计算EC50值(图9)。结果显示,FP-F1活化T细胞产生IFN-γ的量与抗体浓度呈正相关,并且略低于对照抗体OKT3产生的量,表明组成双特异性抗体的Anti-CD3单链抗体功能良好;对照抗体OKT3活化人PBMC的EC50值为0.015nM,而FP-F1为0.233nM,活化能力下降约两个数量级,这有助于降低双特异性抗体的临床毒性。
本发明构建的另一个Anti-CD3×CD20双特异性抗体FP-F2在活化人PBMC细胞试验中,也同样呈浓度依赖性地活化T细胞,并产生IFN-γ,并且FP-F2活化人PBMC的EC50值为0.214nM,与FP-F1相当。
7.3Anti-CD3×CD20双特异性抗体FP-F1杀伤皮下移植瘤的药效试验
人Burkitt’s淋巴瘤细胞Raji(购自中国科学院典型培养物保藏委员会细胞库)与Matrigel(购自BD公司,货号354234)以1:1的比例共同接种于雌性SCID Beige小鼠(购自上海灵畅生物科技有限公司)皮下,接种密度为8×106个细胞。生长6天后,根据体重和肿瘤体积进行分组,每组7只,将培养好的LAK细胞以1×106细胞/50μL的量注射到肿瘤组织中,同时在当天进行给药,剂量分别为10、1和0.1mg/kg的FP-F1,一周两次尾静脉注射。对照组为:(1)阴性对照组:FP-F1溶剂PBS;(2)阳性对照组:(Anti-CD20抗体,Genentech公司),给药剂量为10mg/kg,一周两次尾静脉注射。每周测量小鼠体重和肿瘤体积两次,体积计算公式为1/2×长×宽×宽(mm3)。
在图10中,不同剂量的FP-F1显示出良好的抑制肿瘤生长的效果,其中10mg/kg给药组有2只小鼠肿瘤完全消失,1mg/kg给药组有1只小鼠肿瘤完全消失,0.1mg/kg给药剂量治疗组也显示出一定的抑制肿瘤生长的作用。阴性对照组肿瘤生长情况正常,在14天时达到400mm3。结果显示,FP-F1 1mg/kg剂量组与Rituxan 10mg/kg剂量组疗效相当,表明本发明构建的双特异性抗体FP-F1的体内抑制肿瘤生长的起效剂量仅为Anti-CD20单抗的1/10,可以预期其临床给药剂量也将大大降低。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!