新的抗MFI2抗体和使用方法与流程
申请的交叉引用本申请要求2014年9月5日提交的美国临时申请号62/046,610和2015年8月11日提交的美国临时申请号62/203,836的权益,其每一个均通过引用以其整体结合到本文中。序列表本申请含有通过efs-web以ascii格式提交的序列表,并通过引用以其整体结合到本文中。2015年8月20日创建的所述ascii副本名为s69697_1230wo_sequence_listing_08202015,大小为129,495字节。发明领域本申请总的来说涉及新的抗mfi2抗体或其免疫活性片段和包含所述抗体或片段的组合物(包括抗体药物缀合物),用于治疗、诊断或预防癌症及其任何复发或转移。本发明的精选实施方案提供所述抗mfi2抗体或抗体药物缀合物用于癌症治疗(包括降低致瘤细胞频率)的用途。发明背景干细胞和祖细胞的分化和增殖是在器官发生、细胞修复和细胞更替期间同时起支持组织生长的作用的不断进行的正常过程。该系统被严格调节以确保只根据生物体的需要产生合适的信号。细胞增殖和分化通常只发生在需要替换受损或死亡细胞或需要生长时。然而,可通过许多因素,包括各种信号传导化学物质的不足或过多、变化的微环境的存在、遗传突变或其组合,引发这些过程的中断。正常细胞增殖和/或分化的中断可导致各种病症,包括增殖性疾病,例如癌症。癌症的常规治疗性治疗包括化学疗法、放射疗法和免疫疗法。通常这些治疗是无效的,而手术切除术可能不提供切实可行的临床替代方法。现行医治标准的限制在其中患者进行一线治疗并且随后复发的那些病例中特别明显。在这类情况下,通常发生常常为侵袭性和无法治愈的难治性肿瘤。许多实体瘤的总体存活率至少部分由于现有疗法无法防止复发、肿瘤复发和转移而在多年来大多保持无改变。因此仍大量需要开发更定向和有效的针对增殖性病症的疗法。本发明满足了这一需要。发明概述在精选的实施方案中,本发明包含与结合细胞的分离抗体竞争结合的抗体,所述细胞表达具有seqidno:3的人mfi2,其中分离的抗体包含:(1)seqidno:21的轻链可变区(vl)和seqidno:23的重链可变区(vh);或(2)seqidno:25的vl和seqidno:27的vh;或(3)seqidno:29的vl和seqidno:31的vh;或(4)seqidno:33的vl和seqidno:35的vh;或(5)seqidno:37的vl和seqidno:39的vh;或(6)seqidno:41的vl和seqidno:43的vh;或(7)seqidno:45的vl和seqidno:47的vh;或(8)seqidno:49的vl和seqidno:51的vh;或(9)seqidno:53的vl和seqidno:55的vh;或(10)seqidno:57的vl和seqidno:59的vh;或(11)seqidno:61的vl和seqidno:63的vh;或(12)seqidno:65的vl和seqidno:67的vh;或(13)seqidno:69的vl和seqidno:71的vh;或(14)seqidno:73的vl和seqidno:75的vh;或(15)seqidno:77的vl和seqidno:79的vh;或(16)seqidno:81的vl和seqidno:83的vh;或(17)seqidno:85的vl和seqidno:87的vh;或(18)seqidno:89的vl和seqidno:91的vh。在另一个实施方案中,本发明包含与mfi2的tfld2结构域结合的抗体。在一些实施方案中,本发明的抗mfi2抗体与mfi2蛋白中的表位结合,其中表位包含氨基酸d460、h463和n566。在另一个实施方案中,本发明的抗mfi2抗体与表达具有seqidno:3的mfi2的肿瘤引发细胞结合。另一方面,本发明包含是嵌合、cdr移植、人或人源化抗体或其片段的抗mfi2抗体。在另一个实施方案中,本发明的抗mfi2抗体是内化抗体。一方面,本发明的抗mfi2抗体不与人运铁蛋白结合。在又一方面,本发明包含与mfi2结合的小鼠抗体,其包含轻链可变区和重链可变区,其中轻链可变区具有如seqidno:21、seqidno:25、seqidno:29、seqidno:33、seqidno:37、seqidno:41、seqidno:45、seqidno:49、seqidno:53、seqidno:57、seqidno:61、seqidno:65、seqidno:69、seqidno:73、seqidno:77、seqidno:81、seqidno:85或seqidno:89所示的轻链可变区的3个cdr;重链可变区具有如seqidno:23、seqidno:27、seqidno:31、seqidno:35、seqidno:39、seqidno:43、seqidno:47、seqidno:51、seqidno:55、seqidno:59、seqidno:63、seqidno:67、seqidno:71、seqidno:75、seqidno:79、seqidno:83、seqidno:87或seqidno:91所示的重链可变区的3个cdr。在又一个实施方案中,本发明包含与mfi2结合的人源化抗体,其包含轻链可变区和重链可变区,其中轻链可变区具有如seqidno:93、seqidno:99或seqidno:105所示的轻链可变区的3个cdr;重链可变区具有如seqidno:95、seqidno:97、seqidno:101、seqidno:103或seqidno:107所示的重链可变区的3个cdr。一方面,本发明包含编码本发明的抗mfi2抗体的核酸。在另一个实施方案中,本发明含有包含上述核酸的一个或多个的载体或包含所述载体的宿主细胞。在一个实施方案中,本发明包含式ab-[l-d]n的抗体药物缀合物(adc)或其药学上可接受的盐,其中:ab包含抗mfi2抗体;l包含任选的接头;d包含药物;n为1-20的整数。一方面,本发明的adc包含抗mfi2抗体例如上述抗mfi2抗体或其免疫活性片段。在其它实施方案中,本发明的adc包含选自卡奇霉素、吡咯并苯并二氮杂(pyrrolobenzodiazepine)、阿里他汀(auristatin)、倍癌霉素(duocarmycin)、类美登素(maytansinoid)或本文所述的其它治疗部分的细胞毒性化合物。在一个实施方案中,本发明含有包含上述adc的药物组合物。本发明的另一方面是治疗癌症的方法,所述方法包括将药物组合物例如本文所述药物组合物给予有需要的受试者。在一个方面,癌症选自乳腺癌(例如三阴性乳腺癌)、肺癌、结肠直肠癌或皮肤癌例如黑素瘤(例如表达野生型或突变的braf的皮肤癌)。在一个实施方案中,治疗上述癌症的方法包括给予受试者除上文所述药物组合物以外的至少一种其它治疗部分。在一个实施方案中,本发明包括减少肿瘤细胞群中的肿瘤引发细胞的方法,其中所述方法包括(例如体外或体内)使肿瘤引发细胞群与本文所述adc接触,从而降低肿瘤引发细胞的频率。在一个方面,本发明包括将细胞毒素递送至细胞的方法,所述方法包括使细胞与上述adc的任一种接触。在另一个方面,本发明包括检测、诊断或监测受试者的癌症(例如乳腺癌、肺癌、结肠直肠癌或皮肤癌)的方法,所述方法包括(例如体外或体内)使肿瘤细胞与mfi2检测剂接触并检测与肿瘤细胞结合的检测剂的步骤。在精选的实施方案中,检测剂应包含与mfi2基因型决定簇结合的抗mfi2抗体或核酸探针。上文是概述,因此必然含有细节的简化、泛化和省略;因此,本领域技术人员应认识到,概述只是说明性的,并且无意以任何方式予以限制。所述方法、组合物和/或装置的其它方面、特征和优势和/或本文所述其它主题在本文列出的教导内容中将是显而易见的。提供了概述以介绍简化形式的构思选择,将在下面的发明详述中对其作进一步描述。这种概述无意确立所要求保护的主题的关键特征或必要特征,也无意用作确定所要求保护主题的范围的辅助手段。附图简述图1a表示mfi2的表达水平,使用来源于患者来源的异种移植物(pdx)癌干细胞(csc)和非致瘤(ntg)肿瘤细胞的rna的全转录物组(solid)测序测量。图1b显示mfi2的表达水平,使用来源于pdxcsc和ntg肿瘤细胞的rna的全转录物组(illumina)测序测量。图2a是人mfi2的示意图,显示了长(hmfi2)和短(hδmfi2)同等型(isoform)两者。图2b表示mfi2转录物的相对表达水平,通过从正常组织和各种pdx肿瘤分离的rna样品的qrt-pcr测量。图2c表示mfi2转录物的相对表达水平,通过从各种正常组织和分离自各种pdx肿瘤的csc和ntg细胞分离的rna样品的qrt-pcr测量。图3显示mfi2转录物表达的归一化强度值,通过在正常组织和各种pdx细胞系中的微阵列杂交测量。图4a显示正常组织和来自癌症基因组图谱(thecancergenomeatlas,tcga)(一种可公开获得的数据集)的原发性肿瘤中mfi2转录物的表达。图4b表示基于来自tcga数据集的原发性黑素瘤中高和低的mfi2转录物表达的kaplan-meier生存曲线,其中阈值给定值利用rpkm值的算术平均值确定。图5显示示例性抗mfi2抗体的框并(binning)、结构域结合、同种型和大鼠交叉反应性特征。图6a-6j提供鼠和人源化抗mfi2抗体的注释的氨基酸和核酸序列。更具体地讲,图6a和6b显示示例性鼠和人源化抗mfi2抗体的轻链(图6a)和重链(图6b)可变区的连续氨基酸序列(seqidno:21-107,奇数)。图6c显示示例性鼠和人源化抗mfi2抗体的轻链和重链可变区的核酸序列(seqidno:20-106,偶数)。图6d显示人源化抗mfi2抗体的轻链和重链的全长氨基酸序列(seqidno:108-117)。图6e–6g表示按照kabat编号的sc57.5(图6e)、sc57.32(图6f)和sc57.43(图6g)鼠抗体的轻链和重链可变区的cdr,通过采用kabat、chothia、abm和contact方法测定。最后,图6h–6j提供sc57.5(图6h)、sc57.32(图6i)和sc57.43(图6j)的鼠和衍生人源化重链和轻链可变区的比对的氨基酸序列。图7显示采用电化学发光夹心elisa测定法测量的各种pdx细胞系中人mfi2的相对蛋白质表达。图8a显示应用免疫组织化学的各种pdx肿瘤样品中的膜hmfi2蛋白表达的h评分。图8b表示应用免疫组织化学的黑素瘤、乳腺癌和肺癌样品中细胞膜上的hmfi2蛋白表达的h评分。图9a和9b显示通过流式细胞术测定的黑素瘤(图9a)、肺和乳腺(图9b)pdx细胞系(黑色线)与同种型对照染色群(灰色实线)相比的mfi2的表面蛋白质表达。图10a–10d显示所选的抗mfi2鼠抗体(同与皂草素直接缀合的山羊抗小鼠抗体缔合)内化进入过量表达mfi2蛋白的hek293t细胞(图10a)或黑素瘤pdx细胞(图10b)并杀死所述细胞的能力。同样,图10c是显示了所选的与皂草素间接连接的抗mfi2人源化抗体内化进入过量表达mfi2蛋白的hek293t细胞并杀死所述细胞的能力的浓度相关曲线。最后,图10d比较框a-e中的示例性抗mfi2鼠抗体内化并杀死过量表达mfi2蛋白的hek293t细胞的能力。图11a和11b表示体外抗mfi2adc内化并杀死过量表达mfi2蛋白的hek293t细胞和内源表达mfi2的sk-mel-28黑素瘤细胞(图11a)或乳腺癌和黑素瘤pdx系(图11b)的能力。图12a和12b显示抗mfi2adc体内能够内化进入br(图12a)和lu和mel(图12b)肿瘤,并引起肿瘤体积显著而长期地缩小。图13显示mfi2与肿瘤引发细胞结合;表达mfi2的肿瘤细胞体内能够功能性重建肿瘤,而不表达mfi2的肿瘤细胞体内不能重建肿瘤。发明详述本发明以许多不同的形式体现。本文公开了举例说明其原理的本发明的非限制性说明性实施方案。本文所用的任何章节标题只是为了组织目的,不得解释为限制所述主题。对于本公开内容的目的,所有的识别序列登记号可见于ncbireferencesequence(refseq)数据库和/或ncbigenbank®档案序列数据库,除非另有说明。出人意料地发现,mfi2表达与许多肿瘤类型有关,并且作为决定因素可被用于治疗所述肿瘤。还意外地发现,mfi2表达与致瘤细胞有关,因此可被有效地用于抑制或清除所述细胞。已知致瘤细胞(下文将更详细地描述)显示对许多常规治疗有抗性。与现有技术的教导内容不同,所公开的化合物和方法有效地克服了这种固有抗性。本发明提供抗mfi2抗体(包括抗体药物缀合物)及其在各种mfi2相关癌症的预后、诊断、治疗诊断、治疗和/或预防的用途,而不论任何特殊的作用机制或特异性靶定的细胞或分子成分。i.fi2生理学黑素转铁蛋白(melanotransferrin)(mfi2;亦称为mtf1、cd228、map97和黑素瘤相关抗原p97)是一种细胞表面糖基磷脂酰肌醇(gpi)锚定糖蛋白,与非血红素铁结合蛋白的运铁蛋白家族的成员具有序列相似性(suryorahmanto等,2007;pmid:17452986)。代表性mfi2蛋白直向同源物(ortholog)包括但不限于人(np_005920)、黑猩猩(xp_003310242)、恒河猴(rhesusmonkey)(xp_001096034)、大鼠(np_001099342)和小鼠(np_038928)。在人中,mfi2基因由在染色体3q28-q29上跨越约28kbp的16个外显子组成。人mfi2基因座的转录产生至少2个已知的rna转录物,编码738个氨基酸前蛋白质(np_005920;图3a中的hmfi2)的较长的3.96kbp转录物(nm_005929)和被认为编码302个氨基酸前蛋白质(nm_201573;图3a中的h△mfi2)的可变剪接的较短的1.67kbp转录物(nm_033316)。对于任一个蛋白质同等型,预测前蛋白质的加工包括除去包含分泌信号肽的前19个氨基酸。在较长的738个氨基酸蛋白质同等型的情况下,除去后29个氨基酸作为加工以使成熟蛋白质通过gpi锚与细胞膜连接的部分。不清楚是否产生302个氨基酸蛋白质同等型,尽管可测序它被分泌出。在结构上,预测较长的同等型含有串联运铁蛋白样结构域(标为tfld1和tfld2,图3a),但只有第一结构域能够结合铁。绘制了3个n联糖基化位点—运铁蛋白样结构域的2个和第二运铁蛋白样结构域的1个。已在细胞培养上清液和血清中鉴定出黑素转铁蛋白的可溶形式,但是仍不清楚这种形式的生物起源。黑素瘤相关抗原p97是针对黑素瘤发现的最早的细胞表面标志物之一,并且根据其与运铁蛋白蛋白质的序列相似性,将其命名为黑素转铁蛋白。然而尽管与蛋白质的运铁蛋白家族的其它成员的序列保守性及其明显的结合铁的能力,但是各种细胞培养和体内实验表明黑素转铁蛋白不在铁转运或正常细胞或黑素瘤细胞的代谢中起重要作用(有关综述见suryorahmanto等,2012;pmid:21933697)。有可能该蛋白质因结构原因结合铁,而非介导转运功能。已表明其它离子,包括zn(ii),也结合黑素转铁蛋白。针对黑素转铁蛋白提出的其它功能包括血管生成、纤溶酶原活化的刺激及细胞增殖和迁移。最近,已将黑素转铁蛋白与果蝇的上皮隔膜连接装配(assemblyofepithelialseptaljunction)(在昆虫的上皮细胞间提供扩散屏障的结构,类似于存在于脊椎动物的上皮层中形成的紧密连接)。然而,仍不知道黑素转铁蛋白的确切生物功能。ii.癌干细胞按照现有模型,肿瘤包含非致瘤细胞和致瘤细胞。非致瘤细胞没有自我更新的能力并且不能够可再生地形成肿瘤,甚至当以过量的细胞数植入无免疫应答的小鼠中时。致瘤细胞,在本文亦称“肿瘤引发细胞”(tic),其构成肿瘤细胞群的0.1-40%(更通常0.1-10%),具有形成肿瘤的能力。致瘤细胞包括肿瘤永续性细胞(tpc)(可互换称为癌干细胞(csc))和肿瘤祖细胞(tprog)两者。csc,像支持正常组织中的细胞等级(cellularhierarchies)的正常干细胞一样,能够无限地自我复制同时保持多谱系分化的能力。csc能够产生致瘤性子代和非致瘤性子代两者,并能够完全重现亲代肿瘤的异质细胞组成,正如通过连续分离和移植少量分离的csc移至无免疫应答的小鼠中所证实的一样。tprog,像csc一样,具有在最初的移植物中激起肿瘤生长的能力。然而,与csc不同,它们不能够重现亲代肿瘤的细胞异质性,并且在随后的移植物中再开始肿瘤发生时不太有效,因为tprog通常只能够有限次数的细胞分离,正如连续移植少数高度纯化的tprog至无免疫应答的小鼠中所证实的一样。tprog可进一步分成早期tprog和晚期tprog,这可通过表型(例如细胞表面标志物)及其重现肿瘤细胞结构的不同能力区分。虽然两者都不能重现肿瘤至与csc一样的程度,但与晚期tprog相比,早期tprog具有重现亲代肿瘤特性的较大能力。尽管上述区别,但仍表明在极少情况下,一些tprog群获得通常归因于csc的自我更新能力,并自身可变成csc。与以下相比,csc显示更高的致瘤性,并且相对更不活动:(i)tprog(早期和晚期tprog两者);和(ii)非致瘤细胞例如肿瘤浸润细胞,例如可来源于csc和通常包含肿瘤块的成纤维细胞/间质、内皮和造血细胞。假定常规疗法和方案大部分被设计成缩小肿瘤和攻击快速增殖性细胞,则与较快增殖性tprog和其它团块肿瘤细胞群(例如非致瘤细胞)相比,csc对常规疗法和方案具有更大抗性。可使csc对常规疗法有相对化学抵抗性的其它特性为多药耐药转运蛋白表达增加、dna修复机制和抗凋亡基因表达提高。所述csc性质意味着在患有晚期瘤形成的患者中提供持久反应的标准治疗方案的失败,因为标准化学疗法无法有效靶向实际激起持续性肿瘤生长和复发的csc。出人意料地发现,mfi2表达与各种致瘤细胞亚群有关。本发明提供抗mfi2抗体,其可特别用于靶向致瘤细胞和可用于沉默、敏化、中和、降低频率、阻断、消除、干扰、降低、阻碍、遏制、控制、消耗、减轻、介导、减少、重编程、排除或以别的方式抑制(统称“抑制”)致瘤细胞,从而有利于治疗、管理和/或预防增殖性病症(例如癌症)。有利的是,可选择本发明的新的抗mfi2抗体,使得不论mfi2决定簇的形式(例如表型或基因型形式),在给予受试者时优选降低致瘤细胞的频率或致瘤性。致瘤细胞频率的降低可由以下而产生:(i)致瘤细胞的抑制或根除;(ii)控制致瘤细胞的生长、扩增或重现;(iii)中断致瘤细胞的引发、繁殖、维持或增殖;或(iv)另通过阻碍致瘤细胞的存活、再生和/或转移。在一些实施方案中,致瘤细胞的抑制可因一个或多个生理途径的改变而产生。途径的改变,不论是通过致瘤细胞的抑制,其潜能的更改(例如通过诱导的分化或小生境破坏),还是以别的方式干扰致瘤细胞影响肿瘤环境或其它细胞的能力,均允许通过抑制肿瘤发生、肿瘤维持和/或转移和复发,更有效地治疗mfi2相关病症。应进一步认识到,所公开的抗体的相同特征使之在治疗已证明对标准治疗方案有抗性或不起反应的复发性肿瘤时特别有效。可用于评价致瘤细胞频率的降低的方法,包括但不限于血细胞计数或免疫组织化学,优选通过体外或体内有限稀释分析(dylla等,2008,pmid:pmc2413402和hoey等,2009,pmid:19664991)。可通过将分级分离的或未分级分离的肿瘤细胞(例如分别来自治疗和未治疗肿瘤)在促进集落形成的固体培养基上培养,清点并表征生长的集落,来进行体外有限稀释分析。或者,可将肿瘤细胞连续稀释在具有含有液体培养基的孔的板上,可在接种后的任何时间但优选在接种后10天以上,针对集落形成将各孔计为阳性或阴性。体内有限稀释如下进行:将来自未治疗对照或暴露于所选治疗剂的肿瘤的连续稀释的肿瘤细胞移植入无免疫应答的小鼠中,随后针对肿瘤形成将每只小鼠计为阳性或阴性。这种计分可发生在可检出植入肿瘤后的任何时间,但优选在移植后60天或60天以上进行。测定致瘤细胞的频率的有限稀释实验结果的分析优选应用泊松分布统计学或评价预选确定的确定性事件(例如体内是否形成肿瘤的能力)的频率进行(fazekas等,1982,pmid:7040548)。流式细胞术和免疫组织化学也可用来测定致瘤细胞频率。两种技术均使用结合已知富集致瘤细胞的
技术领域:
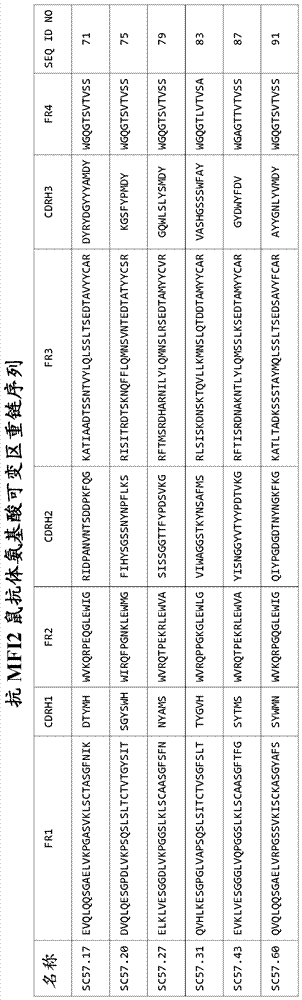
公知的细胞表面蛋白质或标志物的一种或多种抗体或试剂(参见wo2012/031280)。如本领域已知,流式细胞术(例如荧光激活细胞分选法(facs))也可用于表征、分离、纯化、富集或分选各种细胞群,包括致瘤细胞。流式细胞术通过穿过混合的细胞群悬浮在其中的流体流,经过能够测量每秒多达数千粒子的物理和/或化学性质的电子检测仪,来测量致瘤细胞水平。免疫组织化学提供其它信息,因为通过将组织样品用与致瘤细胞标志物结合的标记的抗体或试剂染色,能够使致瘤细胞原位(例如组织中)显现。因此,本发明的抗体可用于通过例如流式细胞术、磁激活细胞分选法(macs)、激光介导的分割或facs等方法,鉴定、表征、监测、分离、分割或富集致瘤细胞群或亚群。facs是一种用于根据特异性细胞表面标志物以超过99.5%纯度分离细胞亚群的可靠方法。用于致瘤细胞(包括csc)的表征和操作的其它可兼容的技术可见于u.s.p.n.12/686,359、12/669,136和12/757,649。下列是与csc群有关且被用于分离或表征csc的标志物:abca1、abca3、abcg2、adam9、adcy9、adora2a、afp、axin1、b7h3、bcl9、bmi-1、bmp-4、c20orf52、c4.4a、羧肽酶m、cav1、cav2、cd105、cd133、cd14、cd16、cd166、cd16a、cd16b、cd2、cd20、cd24、cd29、cd3、cd31、cd324、cd325、cd34、cd38、cd44、cd45、cd46、cd49b、cd49f、cd56、cd64、cd74、cd9、cd90、ceacam6、celsr1、cpd、crim1、cx3cl1、cxcr4、daf、饰胶蛋白聚糖、easyh1、easyh2、edg3、eed、egfr、enpp1、epcam、epha1、epha2、flj10052、flvcr、fzd1、fzd10、fzd2、fzd3、fzd4、fzd6、fzd7、fzd8、fzd9、gd2、gja1、gli1、gli2、gpnmb、gpr54、gprc5b、il1r1、il1rap、jam3、lgr5、lgr6、lrp3、ly6e、mcp、mf2、mllt3、mpzl1、muc1、muc16、myc、n33、nanog、nb84、巢蛋白、nid2、nma、npc1、抑癌蛋白m、oct4、opn3、pcdh7、pcdha10、pcdhb2、ppap2c、ptpn3、pts、rarres1、sema4b、slc19a2、slc1a1、slc39a1、slc4a11、slc6a14、slc7a8、smarca3、smarcd3、smarce1、smarca5、sox1、stat3、steap、tcf4、tem8、tgfbr3、tmepai、tmprss4、运铁蛋白受体、trka、wnt10b、wnt16、wnt2、wnt2b、wnt3、wnt5a、yy1和β-联蛋白。参见例如schulenburg等,2010,pmid:20185329;u.s.p.n.7,632,678和u.s.p.n.2007/0292414、2008/0175870、2010/0275280、2010/0162416和2011/0020221。同样,与某些肿瘤类型的csc有关的细胞表面表型的非限制性实例包括cd44hicd24low、aldh+、cd133+、cd123+、cd34+cd38−、cd44+cd24−、cd46hicd324+cd66c−、cd133+cd34+cd10−cd19−、cd138−cd34−cd19+、cd133+rc2+、cd44+α2β1hicd133+、cd44+cd24+esa+、cd271+、abcb5+以及本领域已知的其它csc表面表型。参见例如schulenburg等,2010,同上,visvader等,2008,pmid:18784658和u.s.p.n.2008/0138313。有关本发明的特别有益的是包含cd46hicd324+表型的csc制备物。“阳性”、“低”和“阴性”表达水平当它们应用于标志物或标志物表型时如下定义。具有阴性表达的细胞(即“-”)在本文定义为在标记在其它荧光发射通道中的其它目标蛋白质的完全抗体染色混合物存在下,表达小于或等于在荧光通道中用同种型对照抗体观察到的表达的第95百分位数的那些细胞。本领域技术人员应认识到,定义阴性事件的这种方法称为“荧光-1”或“fmo”染色。具有大于采用上述fmo染色方法用同种型对照抗体观察到的表达的第95百分位数的表达的细胞在本文定义为“阳性”(即“+”)。按本文的定义,有多种细胞群在广义上被定义为“阳性”。如果抗原的平均实测表达超过如上所述采用用同种型对照抗体的fmo染色测定的第95百分位数,则细胞定义为阳性。如果平均实测表达超过通过fmo染色测定的第95百分位数并且在第95百分位数的1标准差内,则阳性细胞可称为低表达细胞(即“lo”)。或者,如果平均实测表达超过通过fmo染色测定的第95百分位数并大于超过第95百分位数的1标准差,则阳性细胞可称为高表达细胞(即“hi”)。在其它实施方案中,第99百分位数可优选用作阴性和阳性fmo染色之间的分界点,而在一些实施方案中,百分位数可大于99%。cd46hicd324+标志物表型和紧接上文示例的那些可与标准流式细胞术分析和细胞分选技术结合使用以表征、分离、纯化或富集tic和/或tpc细胞或细胞群用于进一步分析。本发明的抗体降低致瘤细胞的频率的能力因此可采用上述技术和标志物测定。在一些情况下,抗mfi2抗体可降低致瘤细胞的频率达10%、15%、20%、25%、30%或甚至达35%。在其它实施方案中,致瘤细胞的频率的降低可约为40%、45%、50%、55%、60%或65%。在某些实施方案中,所公开的化合物可降低致瘤细胞的频率达70%、75%、80%、85%、90%或甚至95%。应认识到,致瘤细胞频率的任何降低可能导致瘤形成的致瘤性、持续、复发和侵袭性的相应降低。iii.抗体a.抗体结构抗体及其变体和衍生物,包括公认的命名和编号系统,大量描述于例如abbas等(2010),cellularandmolecularimmunology(第6版),w.b.saunderscompany或murphey等(2011),janeway’simmunobiology(第8版),garlandscience。“抗体”或“完整抗体”通常是指包含2条重链(h)和2条轻链(l)多肽通过共价二硫键和非共价相互作用保持在一起的y形四聚体蛋白质。每条轻链由一个可变结构域(vl)和一个恒定结构域(cl)组成。每条重链包含一个可变结构域(vh)和恒定区,其在igg、iga和igd抗体的情况下,包含称为ch1、ch2和ch3的3个结构域(igm和ige具有第4个结构域,ch4)。在igg、iga和igd类别中,ch1和ch2结构域被柔性铰链区分隔开,所述铰链区是长度可变(在不同的igg亚类中约10-约60个氨基酸)的富含脯氨酸和半胱氨酸区段。轻链和重链两者中的可变结构域通过约12个或更多个氨基酸“j”区与恒定结构域连接,重链也具有约10个额外氨基酸的“d”区。每个抗体类别另包含由成对半胱氨酸残基形成的链间和链内二硫键。本文所用术语“抗体”包括多克隆抗体、multiclonal抗体、单克隆抗体、嵌合抗体、人源化和灵长类动物源化抗体、cdr移植抗体、人抗体、重组产生的抗体抗体、胞内抗体、多特异性抗体、双特异性抗体、单价抗体、多价抗体、抗独特型抗体、合成抗体包括突变蛋白及其变体、免疫特异性抗体片段例如fd、fab、f(ab')2、f(ab')片段、单链片段(例如scfv和scfvfc);及其衍生物包括fc融合物和其它修饰和任何其它免疫活性分子,只要显示与决定簇优先缔合或结合。然而,除非通过上下文约束另有说明,否则该术语另包含抗体的所有类别(即iga、igd、ige、igg和igm)和所有亚类(即、igg1、igg2、igg3、igg4、iga1和iga2)。相当于不同抗体类别的重链恒定结构域通常分别用相应的小写希腊字母α、δ、ε、γ和μ表示。可根据其恒定结构域的氨基酸序列,将来自任何脊椎动物物种的抗体的轻链指派为称为kappa(κ)和lambda(λ)的两个明显不同类型之一。抗体的可变结构域显示从一种抗体到另一种抗体氨基酸组成的可观变化,并且主要负责抗原识别和结合。每条轻链/重链对的可变区形成抗体结合部位,使得完整igg抗体具有两个结合部位(即它是二价的)。vh和vl结构域包含极度变化性的3个区,其称为超变区,或更通常为互补决定区(cdr),被4个称为构架区(fr)的不太变化的区框住并分隔开。vh和vl区之间的非共价缔合形成fv片段(表示“可变片段”),它含有抗体2个抗原结合部位之一。scfv片段(表示单链可变片段)(其可通过基因工程获得),在被肽接头分隔开的抗体vh和vl区的单一多肽链中缔合。如本文所用,每个结构域、构架区和cdr中氨基酸的指派可依照以下提供的编号方案之一:kabat等(1991)sequencesofproteinsofimmunologicalinterest(第5版),usdept.ofhealthandhumanservices,phs,nih,nihpublicationno.91-3242;chothia等,1987,pmid:3681981;chothia等,1989,pmid:2687698;maccallum等,1996,pmid:8876650;或dubel主编(2007)handbookoftherapeuticantibodies,第3版,wily-vchverlaggmbhandco或abm(oxfordmolecular/msipharmacopia),除非另有说明。下面给出了包含由获自abysis网站数据库(见下文)的由kabat、chothia、maccallum(亦称为contact)和abm定义的cdr的氨基酸残基。表1kabatchothiamaccallumabmvhcdr131-3526-3230-3526-35vhcdr250-6552-5647-5850-58vhcdr395-10295-10293-10195-102vlcdr124-3424-3430-3624-34vlcdr250-5650-5646-5550-56vlcdr389-9789-9789-9689-97抗体序列中的可变区和cdr可按照本领域已开发的普通规则(如上文列示,例如kabat编号系统)或通过将序列与已知可变区数据库比对来鉴定。用于鉴定这些区的方法描述于kontermann和dubel编辑,antibodyengineering,springer,newyork,ny,2001和dinarello等,currentprotocolsinimmunology,johnwileyandsonsinc.,hoboken,nj,2000。抗体序列的示例性数据库描述于www.bioinf.org.uk/abs的“abysis”网站(由departmentofbiochemistry&molecularbiologyuniversitycollegelondon,london,england的a.c.martin维护)和描述于retter等,nucl.acidsres.,33(databaseissue):d671-d674(2005)的www.vbase2.org的vbase2网站,并可通过其存取。优选序列利用abysis数据库分析,该数据库将来自kabat、imgt和proteindatabank(pdb)的序列数据与来自pdb的结构数据整合。参见dr.andrewc.r.martin的书籍章节proteinsequenceandstructureanalysisofantibodyvariabledomains.载于:antibodyengineeringlabmanual(编辑:duebel,s.和kontermann,r.,springer-verlag,heidelberg,isbn-13:978-3540413547,也可在网站bioinforg.uk/abs中获得)。abysis数据库网站另包括已开发的用于鉴定可按照本文教导使用的cdr的普通规则。由此所附的图6e-6g显示呈示例性重链和轻链可变区的注释的所述分析的结果。除非另有说明,否则本文列出的所有cdr根据按kabat等人的abysis数据库网站推导。对于本发明论述的重链恒定区氨基酸位置,编号按照最早描述于eedelman等,1969,proc.natl.acad.sci.usa63(1):78-85的eu索引,该文献描述了骨髓瘤蛋白质eu的氨基酸序列,所述氨基酸序列据报道是测序的第一个人igg1。edelman的eu索引列于kabat等,1991(同上)。因此,在重链情况下,术语“kabat所列的eu索引”或“kabat的eu索引”或“eu索引”或“eu编号”是指基于如kabat等,1991(同上)所列的edelman等人的人igg1eu抗体的残基编号系统。用于轻链恒定区氨基酸序列的编号系统同样列于kabat等(同上)。下面立即列出可适于本发明的示例性κ轻链恒定区氨基酸序列:rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:1)。同样,下面立即列出适于本发明的示例性igg1重链恒定区氨基酸序列:astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seqidno:2)。可采用标准分子生物学技术,将所公开的恒定区序列或其变异物或衍生物与所公开的重链和轻链可变区有效缔合,以提供可原样使用或掺入本发明的全长抗mfi2adc的全长抗体。本发明的抗体或免疫球蛋白可从特异性识别任何相关决定簇或与之缔合的抗体产生。本文所用的“决定簇”或“靶标”意指与特定的细胞、细胞群或组织可识别地缔合或特异性存在于其中或其上的任何可检测的性状、性质、标志物或因子。决定簇或靶标在性质上可以是形态学、功能或生物化学的,并优选为表型的。在一些实施方案中,决定簇是由具体细胞类型或由细胞在某些条件下(例如在细胞周期的具体点上或特定小生境中的细胞)差异性表达(过量表达或表达不足)的蛋白质。对于本发明的目的,决定簇优选在异常的癌细胞中差异性表达,并可包含mfi2蛋白或其剪接变体、同等型、同系物或家族成员的任一种或其特定结构域、区或表位。“抗原”、“免疫原性决定簇”、“抗原决定簇”或“免疫原”意指当引入免疫活性动物中并被产生于免疫应答的抗体识别时可刺激免疫应答的任何蛋白质或其任何片段、区或结构域。本文预期的mfi2决定簇的存在与否可用于鉴定细胞、细胞亚群或组织(例如肿瘤、致瘤细胞或csc)。免疫球蛋白分子中有两种类型的二硫桥或二硫键:链间和链内二硫键。如本领域众所周知的,链间二硫键的位置和数目随免疫球蛋白类别和物种而变化。虽然本发明不限于抗体的任何具体的类别或亚类,但在整个本公开内容中应使用igg1免疫球蛋白用于说明目的。在野生型igg1分子中,有12个链内二硫键(每条重链上4个,每条轻链2个)和4个链间二硫键。链内二硫键一般略受保护,并且比链间键相对不太易还原。相反地,链间二硫键位于免疫球蛋白的表面上,易接近溶剂,并且通常相对易于还原。2个链间二硫键存在于重链间,1个从每条重链到其相应的轻链。已证实链间二硫键不是链缔合所必需的。igg1铰链区在重链中含有形成链间二硫键的半胱氨酸,其与有利于fab移动的柔性一起提供结构支持。重/重igg1链间二硫键位于残基c226和c229(eu编号),而igg1轻链和重链间(重/轻)的igg1链间二硫键在κ或λ轻链的c214和重链上铰链区的c220之间形成。b.抗体形成和产生本发明的抗体可采用本领域已知的各种方法产生。1.宿主动物中多克隆抗体的产生各种宿主动物中多克隆抗体的产生是本领域众所周知的(参见例如harlow和lane(编辑)(1988)antibodies:alaboratorymanual,cshpress和harlow等(1989)antibodies,ny,coldspringharborpress)。为了产生多克隆抗体,免疫活性动物(例如小鼠、大鼠、兔、山羊、非人灵长类动物等)用抗原性蛋白质或包含抗原性蛋白质的细胞或制备物免疫。在一段时间后,通过给动物放血或处死动物获得含多克隆抗体的血清。血清可按从动物中获得的形式使用,或抗体可部分或完全纯化以提供免疫球蛋白部分或分离的抗体制备物。抗原的任何形式或含有抗原的细胞或制备物可用来产生对决定簇有特异性的抗体。术语“抗原”以广义使用,可包含所选靶标的任何免疫原性片段或决定簇,包括单个表位、多个表位、单个或多个结构域或整个胞外结构域(ecd)。抗原可以是分离的全长蛋白质、细胞表面蛋白质(例如用在其表面表达的抗原的至少一部分的细胞免疫)或可溶性蛋白质(例如只用蛋白质的ecd部分免疫)。抗原可在遗传修饰的细胞中产生。前述抗原的任一种可单独使用或与本领域已知的一种或多种免疫原性增强佐剂联用。编码抗原的dna可以是基因组或非基因组的(例如cdna),并可编码足以引起免疫原性反应的ecd的至少一部分。任何载体可用来转化其中表达抗原的细胞,包括但不限于腺病毒载体、慢病毒载体、质粒和非病毒载体,例如阳离子脂质。2.单克隆抗体在精选的实施方案中,本发明考虑使用单克隆抗体。如本领域已知,术语“单克隆抗体”或“mab”是指获自一群基本均质的抗体的抗体,即除可能少量存在的可能突变(例如天然存在的突变)以外,包含群体的各抗体是相同的。可采用本领域已知的各种技术,包括杂交瘤技术、重组技术、噬菌体展示技术、转基因动物(例如xenomouse®)或其一些组合,制备单克隆抗体。例如,单克隆抗体可采用例如更详细描述于以下的杂交瘤和生物化学和基因工程技术制备:an,zhigiang(编辑)therapeuticmonoclonalantibodies:frombenchtoclinic,johnwileyandsons,第1版.2009;shire等(编辑)currenttrendsinmonoclonalantibodydevelopmentandmanufacturing,springerscience+businessmediallc,第1版.2010;harlow等,antibodies:alaboratorymanual,coldspringharborlaboratorypress,第2版.1988;hammerling等,载于:monoclonalantibodiesandt-cellhybridomas563-681(elsevier,n.y.,1981)。在与决定簇特异性结合的多种单克隆抗体产生后,可根据例如其对决定簇的亲和力或内化速率,通过不同的筛选方法,选择特别有效的抗体。如本文所述产生的抗体可用作“源”抗体,并进一步修饰以例如提高对靶标的亲和力,提高其在细胞培养中的产量,降低体内免疫原性,产生多特异性构建体等。下面和随附实施例中列出了单克隆抗体产生和筛选的更详细的描述。3.人抗体在另一个实施方案中,抗体可包含完全人抗体。术语“人抗体”是指具有相当于由人产生的抗体的氨基酸序列和/或采用下述制备人抗体的任何技术制备的抗体。可采用本领域已知的各种技术产生人抗体。在一个实施方案中,可利用噬菌体展示通过筛选所制备的重组组合抗体文库,分离重组人抗体。在一个实施方案中,文库是使用从分离自b细胞的mrna的人vl和vhcdna产生的scfv噬菌体或酵母展示文库。还可通过将人免疫球蛋白基因座引入转基因动物,例如其中内源免疫球蛋白基因部分或完全失活并引入人免疫球蛋白基因的小鼠,来制备人抗体。在攻击时,观察到人抗体产生,其在所有方面极类似于在人中所见的,包括基因重排、装配和完全人抗体库。该方法描述于例如u.s.p.n.5,545,807、5,545,806、5,569,825、5,625,126、5,633,425、5,661,016和有关xenomouse®技术的u.s.p.n.6,075,181和6,150,584;以及lonberg和huszar,1995,pmid:7494109)。或者,可通过产生针对靶抗原的抗体的人b淋巴细胞的永生化,制备人抗体(所述b淋巴细胞可从患有肿瘤性病症的个体中回收或可体外使之免疫)。参见例如cole等,monoclonalantibodiesandcancertherapy,alanr.liss,第77页(1985);boerner等,1991,pmid:2051030和u.s.p.n.5,750,373。如同其它单克隆抗体一样,所述人抗体可用作源抗体。4.衍生抗体:一旦如上所述产生、选择和分离源抗体,便将它们进一步改变以提供药物性质改进的抗mfi2抗体。优选源抗体采用已知的分子工程技术修饰或改变以提供具有所需治疗性质的衍生抗体。4.1.嵌合和人源化抗体本发明的精选实施方案包括与mfi2免疫特异性结合并被视为“源”抗体的鼠单克隆抗体。在精选的实施方案中,本发明的抗体可通过源抗体的恒定区和/或表位结合氨基酸序列的任选修饰而衍生自所述“源”抗体。在某些实施方案中,如果源抗体中所选的氨基酸通过缺失、突变、取代、整合或组合改变,则抗体“衍生”自源抗体。在另一个实施方案中,“衍生的”抗体是这样的抗体,其中源抗体的片段(例如一个或多个cdr或整个重链和轻链可变区)与接纳体抗体序列组合或掺入其中以提供衍生的抗体(例如嵌合或人源化抗体)。这些“衍生的”抗体可采用下述标准分子生物技术产生,例如以改进对决定簇的亲和力、提高抗体稳定性、提高细胞培养中的产量和收率、降低体内免疫原性、降低毒性、促进活性部分的缀合或产生多特异性抗体。所述抗体还可通过化学方法或翻译后修饰经成熟分子的修饰(例如糖基化形式或聚乙二醇化)从源抗体衍生。在一个实施方案中,本发明的抗体包含嵌合抗体,其衍生于来自至少两种不同的物种或类别的共价连接的抗体的蛋白质区段。术语“嵌合”抗体是指这样的构建体,其中重链和/或轻链的一部分与来自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的其余部分与来自另一物种或属于另一抗体类别或亚类的抗体以及所述抗体的片段的相应序列相同或同源(u.s.p.n.4,816,567;morrison等,1984,pmid:6436822)。在一些实施方案中,本发明的嵌合抗体可包含与人轻链和重链恒定区有效连接的所选鼠重链和轻链可变区的全部和所有。在其它精选实施方案中,抗mfi2抗体可“衍生”自本文公开的小鼠抗体。在其它实施方案中,本发明的嵌合抗体是“cdr移植”抗体,其中cdr(采用kabat、chothia、mccallum等人的定义)衍生自特定物种或属于特定抗体类别或亚类,而抗体的其余部分大多衍生自另一物种或属于另一抗体类别或亚类的抗体。用于人时,可将一个或多个所选的啮齿动物cdr(例如小鼠cdr)植入人接纳体抗体中,替换人抗体的天然存在的cdr的一个或多个。这些构建体一般具有提供完整规格人抗体功能的优势,例如依赖补体的细胞毒性(cdc)和依赖抗体的细胞毒性(adcc),同时降低受试者产生对抗体的不需要的免疫应答。在一个实施方案中,cdr移植抗体可包含掺入人构架序列的获自小鼠的一个或多个cdr。类似地cdr移植抗体是一种“人源化”抗体。如本文所用,“人源化”抗体是包含衍生自一个或多个非人抗体(供体或源抗体)的一个或多个氨基酸序列(例如cdr序列)的人抗体(接纳体抗体)。在某些实施方案中,可将“回复突变”引入人源化抗体中,其中受体人抗体可变区的一个或多个fr中的残基被来自非人物种供体抗体的相应残基置换。所述回复突变可有助于保持移植cdr的合适的三维构型,从而改进亲和力和抗体稳定性。可使用来自不同供体物种(包括而不限于小鼠、大鼠、兔或非人灵长类动物)的抗体。此外,人源化抗体可包含不在于受体抗体或供体抗体中的新的残基,以例如进一步精修抗体性能。提供了下面实施例中列出的包含来自源抗体的鼠组分和来自接纳体抗体的人组分的本发明相容的cdr移植和人源化抗体。可采用各种
技术领域:
公知的技术确定哪些人序列用作为接纳体抗体以提供本发明的人源化构建体。确定其作为接纳体序列的适合性的相容的人种系序列和方法的汇编公开于例如dubel和reichert(编辑)(2014)handbookoftherapeuticantibodies,第2版,wiley-blackwellgmbh;tomlinson,i.a.等(1992)j.mol.biol.227:776-798;cook,g.p.等(1995)immunol.today16:237-242;chothia,d.等(1992)j.mol.biol.227:799-817和tomlinson等(1995)emboj14:4628-4638)。还可利用v-base目录(vbase2–retter等,nucleicacidres.33;671-674,2005),其提供人免疫球蛋白可变区序列的综合目录(由tomlinson,i.a.等人编制,mrccentreforproteinengineering,cambridge,uk),以鉴定相容的接纳体序列。另外,还可证明描述于例如u.s.p.n.6,300,064的共有人构架序列是可按照本发明教导使用的相容的接纳体序列。一般来说,根据与鼠源构架序列的同源性连同对源抗体和接纳体抗体的cdr典型结构的分析,选择人构架接纳体序列。然后可采用
技术领域:
公知的技术,合成衍生抗体重链和轻链可变区的衍生序列。举例来说,cdr移植和人源化抗体及相关方法描述于u.s.p.n.6,180,370和5,693,762。更多详情参见例如jones等,1986,(pmid:3713831)以及u.s.p.n.6,982,321和7,087,409。cdr移植或人源化抗体可变区与人接纳体可变区的序列同一性或同源性可如本文所述测定,因此当测量时,可优选共有至少60%或65%序列同一性,更优选至少70%、75%、80%、85%或90%序列同一性,甚至更优选至少93%、95%、98%或99%序列同一性。优选不相同的残基位置因保守氨基酸取代而不同。“保守氨基酸取代”是这样的取代,其中氨基酸残基被有具有类似化学性质(例如电荷或疏水性)的侧链(r基团)的另一个氨基酸残基取代。一般来说,保守氨基酸取代不会实质性地改变蛋白质的功能性质。在其中两个或更多个氨基酸序列因保守取代彼此不同的情况下,可向上调节百分比序列同一性或相似度以校正取代的保守性质。应认识到,采用有专利权的abysis数据库,按照kabat等人定义在附图6a和6b中提供注释的cdr和构架序列。同样,图6h–6j的注释比对序列中所示cdr也按照kabat等人定义。然而,按本文所述和图6e–6g所示,按照chothia等、abm或maccallum等以及kabat等人提供的定义,本领域技术人员可容易地鉴定cdr。因此,包含上述系统任一个得到的一个或多个cdr的抗mfi2人源化抗体明确纳入本发明的范围内。4.2.位点特异性抗体本发明的抗体可经工程改造以促进与细胞毒素或其它抗癌剂的缀合(如下文更详细论述)。就细胞毒素在抗体上的位置和药物与抗体比率(dar)而言,对于抗体药物缀合物(adc)制备物有利的是包含均质adc分子群。根据本公开内容,本领域技术人员可容易地制备本文所述位点特异性改造的构建体。如本文所用“位点特异性抗体”或“位点特异性构建体”意指其中重链或轻链任一个中的至少一个氨基酸缺失、改变或取代(优选被另一个氨基酸取代)以提供至少一个游离半胱氨酸的抗体或其免疫活性片段。同样,“位点特异性缀合物”应是指包含位点特异性抗体和与未配对或游离半胱氨酸缀合的至少一种细胞毒素或其它化合物的adc。在某些实施方案中,未配对半胱氨酸残基可包含未配对链内残基。在其它实施方案中,游离半胱氨酸残基可包含未配对链间半胱氨酸残基。在另外其它的实施方案中,游离半胱氨酸可经改造至抗体的氨基酸序列中(例如ch3结构域中)。在任何情况下,位点特异性抗体可具有不同的同种型,例如igg、ige、iga或igd;并且在那些类别中,抗体可具有不同的亚类,例如igg1、igg2、igg3或igg4。对于igg构建体,抗体的轻链可包含分别掺入在精选的实施方案中由于igg1重链缺乏c220残基所致可能未配对的c214的κ或λ同种型。因此,本文所用术语“游离半胱氨酸”或“未配对半胱氨酸”可互换使用,除非文中另有说明,可意指抗体的任何半胱氨酸(或含有硫醇基)成分,不论天然存在的还是采用分子工程技术明确掺入选择残基位置。在某些精选的实施方案中,游离半胱氨酸可包含这样的天然存在的半胱氨酸,其天然的链间或链内二硫桥配偶体被取代、删除或以其它方式改变以在生理条件下改变天然存在的二硫桥从而提供适于位点特异性缀合的未配对半胱氨酸。在其它优选的实施方案中,游离或未配对半胱氨酸可包含选择性置于抗体重链或轻链氨基酸序列内预定部位的半胱氨酸残基。应认识到在缀合前,根据系统的氧化状态,游离或未配对半胱氨酸可作为硫醇基(还原的半胱氨酸)、作为加帽的半胱氨酸(氧化的)或作为与同一抗体上的另一个游离半胱氨酸的非天然分子内二硫键(氧化的)存在。如下文更详细论述,这种抗体构建体温和还原可提供可用于位点特异性缀合的硫醇基。在特别优选的实施方案中,游离或未配对半胱氨酸(不论是天然存在的还是掺入的)将进行选择性还原和随后的缀合以提供同质的dar组成。应认识到,就缀合位置和组成的绝对dar而言,在特异性指导缀合和大大限制所制备的缀合物的能力上至少部分预测了由所公开的工程改造的缀合物制备物显示的有利性质。与大多数常规adc制备物不一样,本发明不完全依赖于抗体的部分或完全还原以提供随机的缀合位点和dar物类的相对不受控制的产生。相反地,本发明通过对靶向抗体进行改造以破坏天然存在的(即“天然”)链间或链内二硫桥的一个或多个或在任何位置处引入半胱氨酸残基,提供一个或多个预定的未配对(或游离)半胱氨酸位点。为此应认识到,在精选的实施方案中,可采用标准分子工程技术,沿抗体(或其免疫活性片段)重链或轻链的任何位置掺入半胱氨酸残基或附在其上。在其它优选的实施方案中,可与随后可用作缀合位点的非天然半胱氨酸(其因此可包含游离半胱氨酸)组合实现天然二硫键的破坏。在一个实施方案中,工程改造的抗体包含链内或链间半胱氨酸残基的至少一个氨基酸缺失或取代。本文所用“链间半胱氨酸残基”意指涉及抗体的轻链和重链之间或抗体的2条重链之间的天然二硫键的半胱氨酸残基,而“链内半胱氨酸残基”是与同一重链或轻链的另一个半胱氨酸天然配对的半胱氨酸残基。在一个实施方案中,缺失或取代的链间半胱氨酸残基涉及轻链和重链之间二硫键的形成。在另一个实施方案中,缺失或取代的半胱氨酸残基涉及两条重链间的二硫键。在一个典型的实施方案中,由于抗体的互补结构,其中轻链与重链的vh和ch1结构域配对,且其中一条重链的ch2和ch3结构域与互补重链的ch2和ch3结构域配对,任一轻链或重链中的单一半胱氨酸的突变或缺失都将在工程改造的抗体中产生两个未配对半胱氨酸残基。在一些实施方案中,链间半胱氨酸残基缺失。在其它实施方案中,链间半胱氨酸用另一个氨基酸(例如天然存在的氨基酸)取代。例如,氨基酸取代可导致链间半胱氨酸被中性(例如丝氨酸、苏氨酸或甘氨酸)或亲水(例如甲硫氨酸、丙氨酸、缬氨酸、亮氨酸或异亮氨酸)残基置换。在一个实施方案中,链间半胱氨酸被丝氨酸置换。在本发明考虑的一些实施方案中,缺失或取代的半胱氨酸残基在轻链(κ或λ)上,从而在重链留下游离半胱氨酸。在其它实施方案中,缺失或取代的半胱氨酸残基在重链上,在轻链恒定区上留下游离半胱氨酸。在装配时应认识到,完整抗体的轻链或重链上单个半胱氨酸的缺失或取代导致两个未配对半胱氨酸残基的位点特异性抗体。在一个实施方案中,igg轻链(κ或λ)214位(c214)的半胱氨酸缺失或被取代。在另一个实施方案中,igg重链上220位(c220)的半胱氨酸缺失或被取代。在其它的实施方案中,重链上226位或229位的半胱氨酸缺失或被取代。在一个实施方案中,重链上的c220被丝氨酸(c220s)取代以在轻链上提供所需的游离半胱氨酸。在另一个实施方案中,轻链中的c214被丝氨酸(c214s)取代以在重链上提供所需的游离半胱氨酸。实施例15提供所述位点特异性构建体。紧随下面的表2中显示这些构建体的汇总,其中编号一般按照kabat所列eu索引,wt表示没有改变的“野生型”或天然恒定区序列,delta(△)标明氨基酸残基的缺失(例如c214△表明214位的半胱氨酸缺失)。表2本领域技术人员可容易地辨认对于在抗体或抗体片段上的相容位置处引入或添加一个或多个半胱氨酸残基以提供游离半胱氨酸(与破坏天然二硫键不同)。因此,在精选的实施方案中,可根据所需的dar、抗体构建体、所选的有效负荷和抗体靶标,将半胱氨酸引入ch1结构域、ch2结构域或ch3结构域或其任何组合中。在其它优选的实施方案中,可将半胱氨酸引入κ或λcl结构域中,而在特别优选的实施方案中,引入cl结构域的c端区。在各种情况下,最接近半胱氨酸插入位点的其它氨基酸残基可改变、除去或取代以利于分子稳定性、缀合效率或一旦连接便为有效负荷提供保护环境。在具体的实施方案中,取代的残基出现在任何可接近的抗体部位。通过将表面残基用半胱氨酸取代,使反应性硫醇基因此位于容易接近的抗体部位上,并且可按本文进一步描述选择性地还原。在具体的实施方案中,取代的残基出现在可接近的抗体部位上。通过将这些残基用半胱氨酸取代,使反应性硫醇基因此位于可接近的抗体部位,并可用于选择性地缀合抗体。在某些实施方案中,下列残基的任一个或多个可用半胱氨酸取代:轻链的v205(kabat编号)、重链的a118(eu编号)和重链fc区的s400(eu编号)。制备相容的位点特异性抗体的其它的取代位置和方法列于u.s.p.n.7,521,541,其以其整体结合到本文中。本文公开的用于产生具有药物负载的明确部位和化学计量的抗体-药物缀合物的策略广泛适用于所有抗mfi2抗体,因为它主要包括抗体的保守恒定结构域的工程改造。因为充分记载了抗体的各个类别和亚类的氨基酸序列和天然二硫桥,所以本领域技术人员无需过度实验便可容易地制备各种抗体的工程改造的构建体,因此,明确预期所述构建体在本发明的范围内。4.3.恒定区修饰和改变的糖基化本发明精选的实施方案还可包括产生具有包括但不限于以下性质的化合物的恒定区(即fc区)的取代或修饰(包括而不限于氨基酸残基取代、突变和/或修饰):药代动力学改变、血清半寿期延长、结合亲和力提高、免疫原性降低、产量增加、fc配体与fc受体(fcr)结合改变、adcc或cdc增加或降低、糖基化和/或二硫键改变和结合特异性改进。fc效应子功能改进的化合物可通过例如改变参与fc结构域和fc受体(例如fcγri、fcγriia和b、fcγriii和fcrn)之间的相互作用的氨基酸残基来产生,这可导致细胞毒性增加和/或药代动力学改变,例如血清半寿期延长(参见例如ravetch和kinet,annu.rev.immunol9:457-92(1991);capel等,immunomethods4:25-34(1994);以及dehaas等,j.lab.clin.med.126:330-41(1995)。在精选的实施方案中,可通过修饰(例如取代、缺失或加入)被鉴定为参与fc结构域和fcrn受体之间的相互作用的氨基酸残基来产生体内半寿期延长的抗体(参见例如国际专利申请号wo97/34631、wo04/029207、u.s.p.n.6,737,056和u.s.p.n.2003/0190311)。对于这类实施方案,fc变体可在哺乳动物(优选人)中提供大于5天、大于10天、大于15天、优选大于20天、大于25天、大于30天、大于35天、大于40天、大于45天、大于2个月、大于3个月、大于4个月或大于5个月的半寿期。半寿期延长导致较高的血清效价,因此降低抗体的给药频率和/或降低待给予的抗体的浓度。例如,可在表达人fcrn的转基因小鼠或转染的人细胞系中或在向其给予具有变异fc区的多肽的灵长类动物中,评价体内与人fcrn结合和人fcrn高亲和力结合多肽的血清半寿期。wo2000/42072描述了与fcrn结合提高或降低的抗体变体。另参见例如shields等,j.biol.chem.9(2):6591-6604(2001)。在其它实施方案中,fc变化可导致adcc或cdc活性升高或降低。正如本领域所知,cdc是指在补体存在裂解靶细胞,adcc是指细胞毒性的形成,其中与存在于某些细胞毒性细胞(例如天然杀伤细胞、嗜中性粒细胞和巨噬细胞)上的fcr结合的分泌的ig使这些细胞毒性效应细胞能够与携带抗原的靶细胞特异性结合,随后用细胞毒素杀死靶细胞。在本发明的情况下,提供fcr结合亲和力“改变”的抗体变体,所述抗体与亲本或未修饰抗体或与包含天然序列fcr的抗体相比结合提高或降低。显示结合降低的这类变体可几乎没有或没有可观的结合,例如与天然序列相比与fcr0-20%结合,例如通过本领域众所周知的技术测定。在其它实施方案中,与天然免疫球蛋白fc结构域相比,变体可显示结合提高。应认识到,这些fc变体类型可有利地用于提高所公开的抗体的有效抗瘤性质。在另外其它的实施方案中,这类变化导致结合亲和力提高、免疫原性降低、产量增加、糖基化和/或二硫键改变(例如用于缀合部位)、结合特异性改进、吞噬作用提高和/或细胞表面受体(例如b细胞受体;bcr)减量调节等。更有其它的实施方案包括一种或多种工程改造的糖形,例如,位点特异性抗体包含糖基化模式改变或与蛋白质(例如在fc结构域中)共价连接的糖组成改变。参见例如shields,r.l.等(2002)j.biol.chem.277:26733-26740。工程改造的糖形可用于各种目的,包括但不限于提高或降低效应子功能、提高抗体对靶标的亲和力或促进抗体的产生。在在需要效应子功能降低的某些实施方案中,可对分子进行改造以表达糖基化形式。可导致一个或多个可变区构架糖基化位点消除从而清除该位点处的糖基化的取代是众所周知的(参见例如u.s.p.n.5,714,350和6,350,861)。相反地,可通过改造一个或多个其它的糖基化位点,赋予含fc的分子提高的效应子功能或改进的结合。其它实施方案包括糖基化组成改变的fc变体,例如岩藻糖基残基的量减少的岩藻糖基化抗体或二等分glcnac结构增加的抗体。已证实糖基化模式的这类改变提高抗体的adcc能力。可通过本领域技术人员已知的任何方法,例如通过使用工程改造的表达品系或变异表达品系、与一种或多种酶(例如n-乙酰葡萄糖胺转移酶iii(gntiii))共表达、通过在不同的生物或来自不同的细胞系中表达包含fc区的分子或通过在表达包含fc区的分子后修饰糖,产生工程改造的糖形(参见例如wo2012/117002)。4.4片段不论选择哪一个抗体形式(例如嵌合、人源化等)实施本发明,都应认识到,可按照本文的教导单独或作为抗体药物缀合物的部分使用所述抗体免疫活性片段。“抗体片段”包含完整抗体的至少一部分。本文所用术语抗体分子的“片段”包括抗体抗原结合片段,术语“抗原结合片段”是指免疫球蛋白或抗体的多肽片段,其与所选抗原或其免疫原性决定簇免疫特异性结合或反应或与片段从其衍生的完整抗体竞争特异性抗原结合。示例性位点特异性片段包括:可变轻链片段(vl)、可变重链片段(vh)、scfv、f(ab')2片段、fab片段、fd片段、fv片段、单一结构域抗体片段、双抗体、线性抗体、单链抗体分子和从抗体片段形成的多特异性抗体。另外,有活性的位点特异性片段包含保留其与抗原/底物或受体相互作用的能力并以类似于完整抗体的方式(但是可能具有略少的效率)修饰它们的抗体的一部分。所述抗体片段可如本文所述经进一步的工程改造以包含一个或多个游离半胱氨酸。在其它实施方案中,抗体片段是这样的片段,其包含fc区并保留通常当以完整抗体存在时与fc区有关的生物功能的至少一种,例如fcrn结合、抗体半寿期调节、adcc功能和补体结合。在一个实施方案中,抗体片段是体内半寿期基本与完整抗体类似的单价抗体。例如,所述抗体片段可包含与包含能够赋予片段体内稳定性的至少一个游离半胱氨酸的fc序列连接的抗原结合臂。正如本领域技术人员众所周知的,可通过分子工程或通过完整或完全抗体或抗体链的化学或酶处理(例如木瓜蛋白酶或胃蛋白酶)或通过重组方法获得片段。有关抗体片段的详细描述参见例如fundamentalimmunology,w.e.paul编辑,ravenpress,n.y.(1999)。在精选的实施方案中,本发明的抗体片段可包含可以不同构型使用的scfv构建体。例如所述抗mfi2scfv构建体可用于过继免疫基因疗法以治疗肿瘤。在某些实施方案中,本发明的抗体(例如scfv片段)可用于产生与mfi2免疫选择性反应的嵌合抗原受体(car)。按照本公开内容,抗mfi2car是包含本发明的抗mfi2抗体或其免疫活性片段(例如scfv片段)、跨膜结构域和至少一个胞内结构域的融合的蛋白质。在某些实施方案中,可将经遗传改造表达抗mfi2car的t细胞、天然杀伤细胞或树突细胞引入患有癌症的受试者中以刺激受试者的免疫系统特异性地靶向表达mfi2的肿瘤细胞。在一些实施方案中,本发明的car可包含引发初级胞质信号传导序列(即通过t细胞受体复合体引发抗原依赖性初级活化的序列)的胞内结构域,例如来源于cd3ζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的胞内结构域。在其它实施方案中,本发明的car可包含引发二级或共刺激信号的胞内结构域,例如,来源于cd2、cd4、cd5、cd8α、cd8β、cd28、cd134、cd137、icos、cd154、4-1bb和糖皮质激素诱导的肿瘤坏死因子受体的胞内结构域(参见u.s.p.n.us/2014/0242701)。4.5.多价构建体在其它实施方案中,本发明的抗体和缀合物可以是单价或多价的(例如二价、三价等)。本文所用术语“价”是指与抗体缔合的可能的靶标结合部位的数目。每个靶标结合部位特异性结合一个靶标分子或靶标分子上的特定位置或部位。当抗体是单价时,分子的每个结合部位可与单个抗原位置或表位特异性结合。当抗体包含一个以上靶标结合部位(多价的)时,每个靶标结合部位可特异性地结合相同或不同的分子(例如可与不同的配体或不同的抗原或抗原的不同表位或位置结合)。参见例如u.s.p.n.2009/0130105。在一个实施方案中,抗体是双特异性抗体,其中两条链具有不同的特异性,如millstein等,1983,nature,305:537-539所述。其它实施方案包括具有额外特异性的抗体,例如三特异性抗体。u.s.p.n.2009/0155255以及wo94/04690;suresh等,1986,methodsinenzymology,121:210和wo96/27011列出了其它更复杂的相容性多特异性构建体及其制备方法。多价抗体可与所需的靶标分子的不同表位免疫特异性结合或可与靶标分子以及异源表位(例如异源多肽或固相支持体材料)两者免疫特异性结合。虽然精选实施方案只可结合两种抗原(即双特异性抗体),但本发明还包括具有额外特异性的抗体,例如三特异性抗体。双特异性抗体还包括交联的或“异型缀合”抗体。例如,异型缀合中的抗体之一可与抗生物素蛋白偶联,另一个与生物素偶联。例如,曾提出这类抗体使免疫系统细胞靶向不需要的细胞(u.s.p.n.4,676,980),并用于治疗hiv感染(wo91/00360、wo92/200373和ep03089)。异型缀合抗体可采用任何方便的交联方法制备。与许多交联技术一起,合适的交联剂是本领域众所周知的,公开于u.s.p.n.4,676,980。5.抗体的重组产生抗体及其片段可采用获自产抗体细胞的遗传物质和重组技术产生或修饰(参见例如dubel和reichert(编辑)(2014)handbookoftherapeuticantibodies,第2版,wiley-blackwellgmbh;sambrook和russell(编辑)(2000)molecularcloning:alaboratorymanual(第3版),ny,coldspringharborlaboratorypress;ausubel等(2002)shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology,wiley,john&sons,inc.;以及u.s.p.n.7,709,611)。本发明的另一方面涉及编码本发明的抗体的核酸分子。核酸可存在于完整细胞、细胞裂解物或部分纯化或基本纯的形式中。当通过标准技术,包括碱/sds处理、cscl显带、柱层析法、琼脂糖凝胶电泳和本领域众所周知的其它方法与其它细胞组分或其它污染物(例如其它细胞核酸或蛋白质)分离时,核酸是“分离的”或使之基本纯的。本发明的核酸可为例如dna(例如基因组dna、cdna)、rna及其人工变体(例如肽核酸),不论单链或双链或rna,并且可含有或不含内含子。在精选的实施方案中,核酸是cdna分子。本发明的核酸可采用标准分子生物学技术获得。对于由杂交瘤(例如按下文实施例所述制备的杂交瘤)表达的抗体,编码抗体轻链和重链的cdna可通过标准pcr扩增或cdna克隆技术获得。对于获自免疫球蛋白基因文库的抗体(例如采用噬菌体展示技术),可从文库中取得编码抗体的核酸。编码vh和vl区段的dna片段可通过标准重组dna技术进一步操作,例如将可变区基因转化成全长抗体链基因、fab片段基因或scfv基因。在这些操作中,vl或vh编码dna片段与编码另一种蛋白质的另一个dna片段(例如抗体恒定区或柔性接头)有效连接。在这种情况下使用的术语“有效连接”意指两个dna片段连接使得由这两个dna片段编码的氨基酸序列仍符合读框。可通过将vh编码dna与另一个编码重链恒定区(在igg1的情况下为ch1、ch2和ch3)的dna分子有效连接,将编码vh区的分离的dna转化成全长重链基因。人重链恒定区基因的序列是本领域已知的(参见例如kabat等(1991)(同上)),且包括这些区的dna片段可通过标准pcr扩增获得。重链恒定区可以是igg1、igg2、igg3、igg4、iga、ige、igm或igd恒定区,但最优选是igg1或igg4恒定区。seqidno:2列出示例性igg1恒定区。对于fab片段重链基因,vh编码dna可与只编码重链ch1恒定区的另一个dna分子有效连接。可通过将vl编码dna与编码轻链恒定区cl的另一个dna分子有效连接,将编码vl区的分离的dna转化成全长轻链基因(以及fab轻链基因)。人轻链恒定区基因的序列是本领域已知的(参见例如kabat等(1991)(同上)),且包括这些区的dna片段可通过标准pcr扩增获得。轻链恒定区可以是κ或λ恒定区,但最优选是κ恒定区。seqidno:1列出了示例性的相容κ轻链恒定区。本文考虑了显示与本发明的多肽有“序列同一性”、“序列相似性”或“序列同源性”的某些多肽(例如抗原或抗体)。例如,衍生的人源化抗体vh或vl结构域可显示与源(例如鼠)或接纳体(例如人)vh或vl结构域的序列相似性。“同源”多肽可显示65%、70%、75%、80%、85%或90%序列同一性。在其它实施方案中,“同源”多肽可显示93%、95%或98%序列同一性。如本文所用,2个氨基酸序列间的百分比同源性等同于2个序列间的百分比同一性。考虑需要引入用于2个序列的最佳比对的空位的数目和各空位的长度,2个序列间的百分比同一性随序列所共有的相同位置的数目而变(即,%同源性=相同位置数/位置总数×100)。序列的比较和2个序列间的百分比同一性的测定可应用下面的非限制性实例中描述的数学算法实现。可利用pam120权利残基表、12的空位长度罚分和4的空位罚分,应用并入align程序(2.0版)的e.meyers和w.miller的算法(comput.appl.biosci.,4:11-17(1988)),测定2个氨基酸序列的百分比同一性。另外,可利用blossum62矩阵或pam250矩阵;16、14、12、10、8、6或4的空位权重和1、2、3、4、5或6的长度权重,应用并入gcg软件包的gap程序(可获自www.gcg.com)的needleman和wunsch(j.mol.biol.48:444-453(1970))算法,测定2个氨基酸序列的百分比同一性。另外或备选,本发明的蛋白质序列可进一步用作“查询序列”以根据公共数据库进行检索,以鉴定例如相关序列。可应用altschul等(1990)j.mol.biol.215:403-10的xblast程序(2.0版)进行所述检索。可用xblast程序、评分=50、字长=3进行blast蛋白质检索以获得同源氨基酸序列。为了获得用于比较目的的带空位的比对,可按altschul等(1997)nucleicacidsres.25(17):3389-3402所述应用gappedblast。当应用blast和gappedblast程序时,可使用各个程序的默认参数(例如xblast和nblast)。不相同的残基位置可因保守氨基酸取代或非保守氨基酸取代而不同。“保守氨基酸取代”是这样的取代,其中氨基酸残基被具有带相似化学性质(例如电荷或疏水性)的侧链的另一个氨基酸残基取代。一般来说,保守氨基酸取代不会实质性地改变蛋白质的功能性质。在其中两个或更多个氨基酸序列因保守取代而彼此不同的情况下,百分比序列同一性或相似度可向上调节以校正取代的保守性质。在其中存在具有非保守氨基酸的取代的情况下,在实施方案中,显示序列同一性的多肽可保留本发明多肽(例如抗体)的所需的功能或活性。本文还考虑了显示与本发明的核酸有“序列同一性”、“序列相似性”或“序列同源性”的核酸。核酸分子的“同源序列”意指显示至少约65%、70%、75%、80%、85%或90%序列同一性的序列。在其它实施方案中,核酸的“同源序列”可显示与参比核酸有93%、95%或98%序列同一性。本发明还提供包含上述这类核酸的载体,所述核酸可与启动子(参见例如wo86/05807、wo89/01036和u.s.p.n.5,122,464)和真核分泌途径的其它转录调节和加工控制元件有效连接。本发明还提供携带这些载体的宿主细胞和宿主表达系统。本文所用术语“宿主表达系统”包括可经工程改造以产生本发明的核酸或多肽和抗体的任何类型的细胞系统。所述宿主表达系统包括但不限于用重组噬菌体dna或质粒dna转化或转染的微生物(例如大肠杆菌(e.coli)或枯草芽胞杆(b.subtilis));用重组酵母表达载体转染的酵母(例如酵母属(saccharomyces));或携带含有来源于哺乳动物细胞或病毒基因组的启动子(例如腺病毒晚期启动子)的重组表达构建体的哺乳动物细胞(例如cos、cho-s、hek293t、3t3细胞)。宿主细胞可用两种表达载体共转染,例如,编码重链衍生多肽的第一载体和编码轻链衍生多肽的第二载体。转化哺乳动物细胞的方法是本领域众所周知的。参见例如u.s.p.n.4,399,216、4,912,040、4,740,461和4,959,455。宿主细胞还可经工程改造以允许产生具有不同特性(例如修饰的糖形或具有gntiii活性的蛋白质)的抗原结合分子。对于重组蛋白的长期高产量生产,优选稳定的表达。因此,稳定表达所选的抗体的细胞系可采用标准
技术领域:
公知的技术进行工程改造,并形成本发明的部分。除含有病毒复制起点的表达载体以外,宿主细胞可用被合适的表达调控元件(例如启动子或增强子序列、转录终止子、聚腺苷酸化位点等)控制的dna和选择标记转化。可采用本领域众所周知的任何选择系统,包括谷氨酰胺合成酶基因表达系统(gs系统),其提供用于在选择条件下提高表达的有效方法。连同ep0216846、ep0256055、ep0323997和ep0338841和u.s.p.n.5,591,639和5,879,936一起,完整或部分论述了gs系统。另一个用于开发稳定细胞系的相容表达系统是freedom™cho-skit(lifetechnologies)。一旦本发明的抗体通过重组表达或任何其它所公开的技术产生,便可通过本领域已知方法纯化或分离,使得将其鉴定并从其天然环境分离和/或回收,且与可能干扰抗体或相关adc的诊断或治疗用途的污染物相分开。分离的抗体包括重组细胞内的原位抗体。这些分离的制备物可以可采用各种
技术领域:
公知的技术纯化,例如离子交换和大小排阻层析法、透析、渗滤和亲和层析法,特别是蛋白a或蛋白g亲和层析法。下面的实施例更全面地论述了相容的方法。6.生产后选择不论如何获得,产抗体细胞(例如杂交瘤、酵母集落等)可经选择、克隆和针对所需性质(包括例如健壮生长、高抗体产量和所需抗体性质例如对目标抗原的高亲和力)进一步筛选。杂交瘤体外在细胞培养中或体内在基因无免疫应答的动物中扩增。选择、克隆和扩增杂交瘤和/或集落的方法是本领域普通技术人员所熟知的。一旦鉴定出所需抗体,便可采用通用的
技术领域:
公知的分子生物学和生物化学技术分离相关遗传物质。通过幼稚文库产生的抗体(天然或合成)可能具有中等亲和力(约106-107m-1的ka)。为了提高亲和力,可通过构建抗体文库(例如通过使用易错聚合酶体外引入随机突变)并从那些二级文库中再选择对抗原有高亲和力的抗体(例如通过使用噬菌体或酵母展示),体外模拟亲和力成熟。wo9607754描述了在免疫球蛋白轻链的cdr中诱导诱变以产生轻链基因的文库的方法。各种技术可用来选择抗体,包括但不限于噬菌体或酵母展示,其中人组合抗体或scfv片段的文库在噬菌体或酵母中合成,筛选具有目标抗原或其抗体结合部分的文库,分离结合抗原的噬菌体或酵母,从中可获得抗体或免疫活性片段(vaughan等,1996,pmid:9630891;sheets等,1998,pmid:9600934;boder等,1997,pmid:9181578;pepper等,2008,pmid:18336206)。用于产生噬菌体或酵母展示文库的试剂盒是市购可获得的。还有可用于产生和筛选抗体展示文库的其它方法和试剂(参见u.s.p.n.5,223,409、wo92/18619、wo91/17271、wo92/20791、wo92/15679、wo93/01288、wo92/01047、wo92/09690和barbas等,1991,pmid:1896445)。这类技术有利地允许筛选大量的候选抗体,并提供相对容易的序列操作(例如通过重组改组)。iv.抗体的特性在某些实施方案中,产抗体细胞(例如杂交瘤或酵母集落)可经选择、克隆并针对有利性质(包括例如健壮生长、高抗体产量和下文更详细论述的所需位点特异性抗体特性)进一步筛选。在其它情况下,可通过选择特定抗原(例如特定的mfi2同等型)或靶抗原的免疫活性片段赋予抗体特性用于接种动物。在另外其它的实施方案中,所选的抗体可如上所述经工程改造以提高或精修免疫化学性质,例如亲和力或药代动力学。a.中和抗体在精选的实施方案中,本发明的抗体可以是“拮抗剂”或“中和”抗体,这意味着抗体可与决定簇缔合,并直接或通过防止决定簇与结合配偶体(例如配体或受体)缔合阻断或抑制所述决定簇的活性,从而中断否则可产生于分子的相互作用的生物应答。当过量的抗体降低与决定簇结合的结合配偶体的量达至少约20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%、99%或更高(例如通过靶标分子活性或在体外竞争结合测定法中测定)时,中和或拮抗剂抗体实质上可抑制决定簇与其配体或底物的结合。应认识到,改进的活性可直接采用
技术领域:
公知的技术测量或可通过影响下游活性的改变(例如肿瘤发生或细胞存活)来测量。b.内化抗体在某些实施方案中,抗体可包含内化抗体,使得抗体可与决定簇结合,并被内化(连同任何缀合的药物活性部分)入所选的靶细胞,包括致瘤细胞。内化的抗体分子的数目可足以杀死抗原表达细胞,尤其抗原表达致瘤细胞。根据抗体(或在一些情况下抗体药物缀合物)的效能,单一抗体分子摄入细胞可足以杀死抗体与之结合的靶细胞。对于本发明,有证据表明,表达的mfi2蛋白的主要部分仍与致瘤细胞表面缔合,从而允许所公开的抗体或adc的局部化和内化。在精选的实施方案中,这类抗体可与在内化时杀死细胞的一种或多种药物缔合或缀合。在一些实施方案中,本发明的adc可包含内化性位点特异性adc。如本文所用,“内化”的抗体是在与缔合的决定簇结合时被靶细胞摄取(连同任何缀合的细胞毒素一起)的抗体。内化的这类adc的数目将优选足以杀死决定簇表达细胞,尤其决定簇表达癌干细胞。根据细胞毒素或在一些情况下adc(整体来说)的效能,少量抗体分子摄入细胞足以杀死抗体与之结合的靶细胞。例如,某些药物(例如pbd或卡奇霉素)如此有效,使得与抗体缀合的毒素的少量分子的内化足以杀死靶细胞。可通过各种
技术领域:
公知的测定法,包括下面实施例描述的方法,测定在与哺乳动物细胞结合时抗体是否内化。检测抗体是否内化进入细胞的方法还描述于u.s.p.n.7,619,068。c.消耗抗体(depletingantibody)在其它实施方案中,本发明的抗体是消耗性抗体。术语“消耗性”抗体是指优选在细胞表面上或附近与抗原结合并诱导、促进或引起细胞死亡(例如通过cdc、adcc或细胞毒性剂的引入)的抗体。在实施方案中,所选的消耗性抗体可与细胞毒素缀合。优选消耗性抗体能够杀死至少20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%或99%的规定细胞群中的mfi2表达细胞。在一些实施方案中,细胞群可包含富集、切片、纯化或分离的致瘤细胞,包括癌干细胞。在其它实施方案中,细胞群可包含整个肿瘤样品或包含癌干细胞的异质肿瘤提取物。按照本文的教导内容,标准生物化学技术可用于监测和定量测定致瘤细胞的消耗。d.结合亲和力本文公开了对特定决定簇(例如mfi2)具有高结合亲和力的抗体。术语“kd”是指具体的抗体抗原相互作用的解离常数或表观亲和力。当解离常数kd(koff/kon)≤10-7m时,本发明的抗体可免疫特异性地结合靶抗原。当kd≤5x10-9m时,抗体以高亲和力特异性结合抗原,而当kd≤5x10-10m时以极高亲和力结合抗原。在本发明的一个实施方案中,抗体具有≤10-9m的kd和约1x10-4/sec的解离速率。在本发明的一个实施方案中,解离速率<1x10-5/sec。在本发明的其它实施方案中,抗体可以约10-7m和10-10m之间的kd与决定簇结合,而在另一个实施方案中,将以kd≤2x10-10m结合。本发明另外的其它精选实施方案包括kd(koff/kon)小于10-6m、小于5x10-6m、小于10-7m、小于5x10-7m、小于10-8m、小于5x10-8m、小于10-9m、小于5x10-9m、小于10-10m、小于5x10-10m、小于10-11m、小于5x10-11m、小于10-12m、小于5x10-12m、小于10-13m、小于5x10-13m、小于10-14m、小于5x10-14m、小于10-15m或小于5x10-15m的抗体。在某些实施方案中,与决定簇(例如mfi2)免疫特异性结合的本发明的抗体的结合速率常数或kon(或ka)速率(抗体+抗原(ag)kon←抗体-ag)可为至少105m-1s-1、至少2x105m-1s-1、至少5x105m-1s-1、至少106m-1s-1、至少5x106m-1s-1、至少107m-1s-1、至少5x107m-1s-1或至少108m-1s-1。在另一个实施方案中,与决定簇(例如mfi2)免疫特异性结合的本发明的抗体的结合速率常数或koff(或kd)速率(抗体+抗原(ag)koff←抗体-ag)小于10-1s-1、小于5x10-ls-1、小于10-2s-1、小于5x10-2s-1、小于10-3s-1、小于5x10-3s-1、小于10-4s-1、小于5x104s-1、小于10-5s-1、小于5x10-5s-1、小于10-6s-1、小于5x10-6s-1、小于10-7s-1、小于5x10-7s-1、小于10-8s-1、小于5x10-8s-1、小于10-9s-1、小于5x10-9s-1或小于10-10s-1。可采用本领域已知的各种技术,例如表面等离子体共振、生物层干涉量度法、双极化干涉量度法、静态光散射、动态光散射、等温滴定量热法、elisa、分析超速离心和流式细胞术,测定结合亲和力。e.框并和表位作图本文公开的抗体可通过它们与之缔合的离散表位来表征。“表位”是抗体或免疫活性片段与之特异性结合的决定簇的部分。免疫特异性结合可根据上文所述结合亲和力或通过抗体优先识别蛋白质和/或大分子的复杂混合物中的其靶抗原(例如在竞争测定法中)证实和确定。“线性表位”通过允许抗体免疫特异性结合的抗原中的连续氨基酸形成。甚至当抗原变性时,优先结合线性表位的能力通常仍保持。相反地,“构象表位”通常在抗原氨基酸序列中包含非连续氨基酸,但在抗原的二级、三级和四级结构的情况下,足够接近以被单一抗体同时结合。当具有构象表位的抗原变性时,抗体通常将不再识别抗原。表位(连续或非连续)通常在独特的空间构象中包括至少3个、更通常至少5或8-10或12-20个氨基酸。还可根据它们所属的组或“框(bin)”表征本发明的抗体。“框并(binning)”是指竞争抗体结合测定法鉴定不能够同时结合免疫原性决定簇的成对抗体,从而鉴定“竞争”结合的抗体的应用。竞争性抗体可通过其中所测试的抗体或免疫功能片段防止或抑制参比抗体与共同抗原特异性结合的测定法测定。通常,所述测定法包括使用与固体表面或细胞、未标记的试验抗体和标记的参比抗体结合的纯化的抗原(例如mfi2或结构域或其片段)。竞争抑制通过测量在试验抗体存在下与固体表面或细胞结合的标记的量来测量。本文的实施例提供有关用于测定竞争结合的方法的其它细节。通常,当竞争性抗体过量存在时,它将抑制参比抗体与共同抗原特异性结合达至少30%、40%、45%、50%、55%、60%、65%、70%或75%。在某些情况下,抑制结合达至少80%、85%、90%、95%或97%或更多。相反地,当参比抗体结合时,它将优选抑制随后加入的试验抗体(即mfi2抗体)的结合达至少30%、40%、45%、50%、55%、60%、65%、70%或75%。在某些情况下,试验抗体的结合被抑制达至少80%、85%、90%、95%或97%或更多。一般框并或竞争结合可采用各种
技术领域:
公知的技术测定,例如免疫测定法例如蛋白质印迹、放射免疫测定法、酶联免疫吸附测定法(elisa)、“夹心”免疫测定法、免疫沉淀测定法、沉淀素反应、凝胶扩散沉淀素反应、免疫扩散测定法、凝集测定法、补体结合测定法、免疫放射测定法、荧光免疫测定法和蛋白a免疫测定法。这类免疫测定法是常规的和本领域众所周知的(参见ausubel等编辑(1994)currentprotocolsinmolecularbiology,第1卷,johnwiley&sons,inc.,newyork)。另外,可采用交叉阻断测定法(参见例如wo2003/48731和harlow等(1988)antibodies,alaboratorymanual,coldspringharborlaboratory,edharlow和davidlane)。用于测定竞争抑制的其它技术(因此“框并”),包括:采用例如biacore™2000系统(gehealthcare)的表面等离子体共振、采用例如fortebio®octetred(fortebio)的生物层干涉量度法或采用例如facscantoii(bdbiosciences)或多重luminex™检测测定法(luminex)的流式细胞珠粒阵列。luminex是使得大规模多重抗体配对成为可能的基于珠粒的免疫测定平台。该测定法比较抗体对与靶抗原的同时结合方式。该对的一种抗体(俘获mab)与luminex珠粒结合,其中各俘获mab与不同的颜色的珠粒结合。另一种抗体(检测mab)与荧光信号(例如藻红蛋白(pe))结合。该测定法分析抗体与抗原的同时结合(配对),并将具有类似配对概况的抗体归类为一组。检测mab和俘获mab的类似概况表明2种抗体与相同或密切相关的表位结合。在一个实施方案中,可利用皮尔逊相关系数确定配对概况以鉴定与受测试的抗体组中的任何特定抗体最相关的抗体。在实施方案中,如果抗体对的皮尔逊相关系数为至少0.9,则确定试验/检测mab为在与参比/俘获mab相同框中。在其它实施方案中,皮尔逊相关系数为至少0.8、0.85、0.87或0.89。在进一步的实施方案中,皮尔逊相关系数为至少0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98、0.99或1。分析获自luminex测定法的数据的其它方法描述于u.s.p.n.8,568,992。luminex分析100种不同类型的珠粒(或更多)的能力同时提供几乎无限的抗原和/或抗体表面,导致抗体表位概况分析中的通量和分辨率相对于生物传感器测定法改进(miller等,2011,pmid:21223970)。同样,包含表面等离子体共振的框并技术与本发明相容。本文所用“表面等离子体共振”是指通过检测生物传感器矩阵内蛋白质浓度的变化,允许分析实时特异性相互作用的光学现象。采用市购可获得的装置例如biacore™2000系统,可容易地测定所选的抗体是否彼此竞争与规定的抗原结合。在其它实施方案中,可用于测定试验抗体是否与参比抗体“竞争”结合的技术是“生物层干涉量度法”,一种分析从以下两种表面反射的白光的干涉图样的光学分析技术:生物传感器触头上的固定化蛋白质层和内部参比层。与生物传感器触头结合的分子数目的任何改变可引起可实时测量的干涉图样的移位。所述生物层干涉量度测定法可如下采用fortebio®octetred机进行。参比抗体(ab1)被俘获在抗小鼠俘获芯片上,高浓度的非结合抗体然后用来封闭芯片,并采集基线。单体重组靶蛋白然后被特异性抗体(ab1)俘获,将触头浸入具有与对照相同的抗体(ab1)的孔或浸入具有不同的试验抗体(ab2)的孔中。如果无进一步的结合发生,如通过比较用对照ab1结合水平测定的,则确定ab1和ab2为“竞争性”抗体。如果用ab2观察到其它结合,则确定ab1和ab2不彼此竞争。使用代表唯一框的96孔板中一整排抗体,这种方法可扩展到筛选唯一抗体的大型文库。在实施方案中,如果参比抗体抑制试验抗体与共同抗原的特异性结合达至少40%、45%、50%、55%、60%、65%、70%或75%,则试验抗体将与参比抗体竞争。在其它实施方案中,结合被抑制达至少80%、85%、90%、95%或97%或更多。一旦限定了包括一组竞争性抗体的框,则可进行进一步表征以测定该抗体群与之结合的抗原上的特异性结构域或表位。结构域水平表位作图可采用改编cochran等,2004,pmid:15099763描述的方案进行。精细表位作图是一种测定包含抗体与之结合的决定簇的表位的抗原上的具体氨基酸的方法。在某些实施方案中,精细表位作图可采用噬菌体或酵母展示进行。其它可相容的表位作图技术包括丙氨酸扫描突变体、肽印迹(reineke,2004,pmid:14970513)或肽切割分析。另外,可使用酶例如蛋白水解酶(例如胰蛋白酶、蛋白内切酶(endoproteinase)glu-c、蛋白内切酶asp-n、胰凝乳蛋白酶等);化学剂例如琥珀酰亚胺基酯及其衍生物、含伯胺化合物、肼和碳酰肼、游离氨基酸等,采用例如抗原的表位切割、表位提取和化学修饰的方法(tomer,2000,pmid:10752610)。在另一个实施方案中,可根据各抗体与化学或酶法修饰的抗原表面的结合概况的相似性,采用修饰辅助概况分析(modification-assistedprofiling),亦称为基于抗原结构的抗体概况分析(asap),将针对相同抗原的大量单克隆抗体分类(u.s.p.n.2004/0101920)。一旦测定出抗原上的所需表位,有可能通过如采用本文所述技术,用包含所选表位的肽免疫,来产生抗该表位的其它抗体。v.抗体缀合物在一些实施方案中,本发明的抗体可与药物活性或诊断部分缀合形成“抗体药物缀合物”(adc)或“抗体缀合物”。术语“缀合物”以广义使用,意指不论缔合方法如何,任何药物活性或诊断部分与本发明抗体共价或非共价缔合。在某些实施方案中,缔合通过抗体的赖氨酸或半胱氨酸残基实现。在一些实施方案中,药物活性或诊断部分可通过一个或多个位点特异性游离半胱氨酸与抗体缀合。所公开的adc可用于治疗和诊断目的。本发明的adc可用于将细胞毒素或其它有效负荷递送于目标位置(例如致瘤细胞和/或表达mfi2的细胞)。本文所用术语“药物”或“弹头(warhead)”可互换使用,可指生物活性或可检测分子或药物,包括下文所述抗癌剂。“有效负荷”可包含与任选的接头化合物组合的药物或“弹头”。缀合物上的“弹头”可包含肽、蛋白质或体内代谢成活性剂的前药、聚合物、核酸分子、小分子、结合剂、模拟剂(mimeticagents)、合成药物、无机分子、有机分子和放射性同位素。在一个有利的实施方案中,所公开的adc将在释放和激活弹头之前呈相对不反应、无毒状态的所结合的有效负荷引导至靶位点。优选通过有效负荷的稳定缀合(例如通过抗体上的一个或多个半胱氨酸)和使过度缀合的有毒物类减至最小的相对均质的adc制备物组成,实现弹头的这种定向释放。与被设计成一旦递送至肿瘤位点便大量释放弹头的药物接头偶联,本发明的缀合物可大大降低不需要的非特异性毒性。这有利地在肿瘤位点提供相对高水平的活性细胞毒素,同时使非靶定细胞和组织的暴露降到最小从而提供高的治疗指数。应认识到,虽然本发明的一些实施方案包括掺入治疗部分(例如细胞毒素)的有效负荷,但掺入诊断剂和生物相容性调节剂的其它有效负荷可获益于由所公开的缀合物提供的定向释放。因此,涉及示例性治疗有效负荷的任何公开内容也适用于包括本文所述的诊断剂或生物相容性调节剂的有效负荷,除非文中另有说明。所选的有效负荷可与抗体共价或非共价连接,并且至少部分根据用于实现缀合的方法,而显示不同的化学计量摩尔比率。本发明的缀合物一般可通过下式表示:ab-[l-d]n或其药学上可接受的盐,其中:a)ab包含抗mfi2抗体;b)l包含任选的接头;c)d包含药物;和d)n为约1-约20的整数。本领域技术人员应认识到,上式的缀合物可采用许多不同的接头和药物制备,并且缀合方法将随组分的选择而变化。因此,与所公开的抗体的反应性残基(例如半胱氨酸或赖氨酸)缔合的任何药物或药物接头化合物与本文的教导内容相符合。同样,允许所选药物与抗体缀合(包括位点特异性缀合)的任何反应条件均在本发明的范围内。尽管以上所述,本发明的一些实施方案包括使用与本文所述温和还原剂组合的稳定剂使药物或药物接头与游离半胱氨酸选择性缀合。所述反应条件往往提供较少非特异性缀合和污染物的更均质的制备物和相应较少的毒性。a.有效负荷和弹头1.治疗剂本发明的抗体可与作为治疗部分或药物(例如抗癌剂)的药物活性部分缀合、连接或融合或以别的方式缔合,所述药物活性部分包括但不限于细胞毒性剂、细胞生长抑制剂、抗血管生成剂、肿瘤减灭剂(debulkingagent)、化疗剂、放射治疗剂、靶向抗癌剂、生物应答调节剂、癌症疫苗、细胞因子、激素疗法、抗转移剂和免疫治疗剂。示例性抗癌剂(包括其同系物和衍生物)包括1-去氢睾酮、安曲霉素、放线菌素d、博来霉素、卡奇霉素、秋水仙素、环磷酰胺、松胞菌素b、放线菌素d(旧称放线菌素)、二羟基炭疽菌素、二酮(dione)、倍癌霉素、依米丁、表柔比星、溴化乙锭、依托泊苷、糖皮质激素、短杆菌肽d、利多卡因、类美登素例如dm-1和dm-4(免疫原)、光神霉素、丝裂霉素、米托蒽醌、紫杉醇、普鲁卡因、普萘洛尔、嘌罗霉素、替尼泊苷、丁卡因和上述任一种的可药学可接受的盐或溶剂合物、酸或衍生物。其它相容的细胞毒素包括多拉司他汀和阿里他汀、包括单甲基阿里他汀e(monomethylauristatine、mmae)和单甲基阿里他汀f(mmaf)(seattlegenetics)、鹅膏蕈素例如α-鹅膏蕈素、β-鹅膏蕈素、γ-鹅膏蕈素或ε-鹅膏蕈素(heidelbergpharma)、dna小沟结合剂例如倍癌霉素衍生物(syntarga)、烷化剂例如修饰的或二聚的吡咯并苯并二氮杂(pbd)、氮芥、塞替派(thioepa)、苯丁酸氮芥、美法仑、卡莫司汀(bcnu)、洛莫司汀(ccnu)、环磷酰胺、白消安、二溴甘露醇、链脲佐菌素、丝裂霉素c和顺式二氯二胺合铂(ii)(ddp)顺铂、剪接抑制剂(splicinginhibitor)例如meayamycin类似物或衍生物(例如u.s.p.n.7,825,267中列出的fr901464)、微管结合剂(tubularbindingagent)例如埃坡霉素类似物和tubulysins、紫杉醇和dna损伤剂例如卡奇霉素和埃斯波霉素、抗代谢物例如甲氨蝶呤、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷和5-氟尿嘧啶、达卡巴嗪、抗有丝分裂剂例如长春碱和长春新碱和蒽环类例如柔红霉素(旧称道诺霉素)和多柔比星和上述任一种的可药学可接受的盐或溶剂合物、酸或衍生物。在一个实施方案中,本发明的抗体可与抗cd3结合分子缔合以募集细胞毒性t细胞,并使其靶向微致瘤细胞fuhrmann等(2010)annualmeetingofaacrabstractno.5625)。在进一步的实施方案中,本发明的adc可包括使用合适接头的缀合的治疗放射性同位素。可与这些实施方案相容的示例性放射性同位素包括但不限于碘(131i、125i、123i、121i)、碳(14c)、铜(62cu、64cu、67cu)、硫(35s)、氚(3h)、铟(115in、113in、112in、111in)、铋(212bi、213bi)、锝(99tc)、铊(201ti)、镓(68ga、67ga)、钯(103pd)、钼(99mo)、氙(133xe)、氟(18f)、153sm、177lu、159gd、149pm、140la、175yb、166ho、90y、47sc、186re、188re、142pr、105rh、97ru、68ge、57co、65zn、85sr、32p、153gd、169yb、51cr、54mn、75se、113sn、117sn、225ac、76br和211at。还可获得作为诊断和治疗剂的其它放射性核素,尤其能量范围为60-4,000kev的那些。在某些实施方案中,本发明的adc可包括作为弹头的pbd及其可药学可接受的盐或溶剂合物、酸或衍生物。pbd是通过与小沟中的dna共价结合并抑制核酸合成而发挥抗肿瘤活性的烷化剂。已表明pbd具有有效的抗肿瘤性质,同时显示最小骨髓抑制。与本发明相容的pbd可使用几种类型的接头(例如包含具有游离硫氢基的马来酰亚胺部分的肽基接头)与抗体连接,而在某些实施方案中为二聚体的形式(即pbd二聚体)。可与所公开的抗体缀合的相容的pbd(和任选的接头)描述于例如u.s.p.n.6,362,331、7,049,311、7,189,710、7,429,658、7,407,951、7,741,319、7,557,099、8,034,808、8,163,736、2011/0256157和pct文档wo2011/130613、wo2011/128650、wo2011/130616、wo2014/057073和wo2014/057074。下面显示了与本发明相容的pbd化合物的实例。更准确地说,在精选的实施方案中,本发明提供pbd二聚体,其包含在pbd部分的一个的位置上连接的并与mfi2抗体缀合的接头(如下所述)。通过仔细改造的构型,缀合物允许释放优选不保留接头的任何部分的活性pbd化合物。即,不存在可能不利影响pbd有效负荷的反应性的残端或接头残基。因此,所选的mfi2缀合物在接头切割时释放以下二聚pbd化合物:。应认识到,上述二聚pbd弹头的每一个优选会在被靶细胞内化和接头被破坏时释放。如下文更详细的描述,优选的接头可包含掺入允许活性释放pbd弹头而不保留接头的任何部分的自我牺牲部分的可切割接头。在释放时,pbd弹头随后与靶细胞的dna结合和交叉结合。所述结合显然阻断靶标癌细胞的分裂而不使其dna螺旋变形,因此可避免突发耐药性的常见现象。除了上述作用剂以外,本发明的抗体还可与生物应答调节剂缀合。例如,在一些实施方案中,药物部分可以是具有所需生物活性的多肽。这类蛋白质可包括例如毒素例如相思豆毒蛋白、蓖麻毒蛋白a、豹蛙抗癌酶(或另一种细胞毒性rna酶)、假单胞菌外毒素、霍乱毒素、白喉毒素;凋亡剂例如肿瘤坏死因子例如tnf-α或tnf-β、α-干扰素、β-干扰素、神经生长因子、血小板衍生生长因子、组织纤溶酶原激活物、aimi(wo97/33899)、aimii(wo97/34911)、fas配体(takahashi等,1994,pmid:7826947)和vegi(wo99/23105)、血栓生成剂、抗血管生成剂例如血管生长抑素或内皮生长抑素、淋巴因子例如白介素-1(il-1)、白介素-2(il-2)、白介素-6(il-6)、粒细胞巨噬细胞集落刺激因子(gm-csf)和粒细胞集落刺激因子(g-csf)或生长因子例如生长激素(gh)。2.诊断剂或检测剂在其它实施方案中,本发明的抗体或其片段或衍生物与可以是例如生物分子(例如肽或核苷酸)、小分子、荧光团或放射性同位素的诊断剂或检测剂、标志物或报道分子缀合。标记的抗体可用于监测增殖性病症的发生或进展或作为临床检测方法的一部分以测定包括所公开的抗体的具体疗法(即治疗诊断法)的功效或确定未来疗程。所述标志物或报道分子还可用于纯化所选的抗体、用于抗体分析学(例如表位结合或抗体框并)、分开或分离致瘤细胞或临床前程序或毒理学研究。所述诊断、分析和/或检测可通过使抗体与可检测物质连接来实现,所述可检测物质包括但不限于各种酶,包括例如辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶或胆碱酯酶;辅基,例如但不限于链霉抗生物素蛋白/生物素和抗生物素蛋白/生物素;荧光物质,例如但不限于伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺荧光素、丹磺酰氯或藻红蛋白;发光材料,例如但不限于鲁米诺;生物发光材料,例如但不限于萤光素酶、萤光素和水母发光蛋白;放射性物质,例如但不限于碘(131i、125i、123i、121i)、碳(14c)、硫(35s)、氚(3h)、铟(115in、113in、112in、111in)和锝(99tc)、铊(201ti)、镓(68ga、67ga)、钯(103pd)、钼(99mo)、氙(133xe)、氟(18f)、153sm、177lu、159gd、149pm、140la、175yb、166ho、90y、47sc、186re、188re、142pr、105rh、97ru、68ge、57co、65zn、85sr、32p、153gd、169yb、51cr、54mn、75se、113sn和117tin;采用正电子发射断层成像的正电子发射金属、非放射性顺磁金属离子和与特定放射性同位素缀合的分子。在这些实施方案中,合适的检测方法是本领域众所周知的,并可容易地获自许多商业来源。在其它实施方案中,抗体或其片段可与标记序列或化合物(例如肽或荧光团)融合或缀合以利于纯化或诊断或分析方法,例如免疫组织化学、生物层干涉量度法、表面等离子体共振、流式细胞术、竞争elisa、fac等。在一些实施方案中,标记包括例如尤其由pqe载体(qiagen)提供的组氨酸标签,其许多是市购可获得的。可用于纯化的其它肽标签包括但不限于血凝素“ha”标签,其相当于来源于流感血凝素蛋白的表位(wilson等,1984,细胞37:767)和“flag”标签(u.s.p.n.4,703,004)。3.生物相容性调节剂在精选的实施方案中,本发明的抗体可按需要与可用于调整、改变、提高或减少抗体特性的生物相容性调节剂缀合。例如,可通过连接相对高分子量聚合物分子(例如市购可获得的聚乙二醇(peg)或相似的生物相容性聚合物),产生体内半寿期延长的抗体或融合构建体。本领域技术人员应认识到,peg可以可选择的许多不同的分子量和分子构型获得以赋予抗体特异性性质(例如可设计半寿期)。可在有或没有多种接头的情况下,通过peg与所述抗体或抗体片段的n端或c端缀合或通过赖氨酸残基的ε-氨基,将peg与抗体或抗体片段或衍生物连接。可使用导致生物活性最小损失的线性或支化聚合物衍生化。可通过sds-page和质谱法密切监测缀合程度以确保peg分子与抗体分子的最佳缀合。可通过例如大小排阻层析法或离子交换层析法,将未反应的peg与抗体-peg缀合物分离开来。按类似方式,所公开的抗体可与白蛋白缀合以使抗体或抗体片段体内更稳定或体内具有较长的半寿期。该技术是本领域众所周知的,参见例如wo93/15199、wo93/15200和wo01/77137;以及ep0413622。其它生物相容性缀合物对于普通技术人员而言是显然的,并可容易地按照本文的教导内容鉴定。b.接头化合物可使用多种接头化合物以使本发明的抗体与相关弹头缀合。接头只需与抗体的反应性残基(优选半胱氨酸或赖氨酸)和所选的选择药物化合物共价结合。因此,与所选的抗体残基反应并且可用于提供相对稳定的本发明的缀合物(位点特异性或其它)的任何接头都符合本文的教导内容。相容的接头是亲核的还原半胱氨酸和赖氨酸有利地结合。涉及还原的半胱氨酸和赖氨酸的缀合反应包括但不限于硫醇基-马来酰亚胺、硫醇基-卤素(酰卤)、硫醇基-烯、硫醇基-炔、硫醇基-乙烯基砜、硫醇基-二砜、硫醇基-硫代磺酸盐、硫醇基-吡啶基二硫化物和硫醇基-对氟反应。如本文进一步论述,硫醇基-马来酰亚胺生物缀合由于其快的反应速率和温和的缀合条件因此是最广泛使用的方法之一。这种方法的一个问题是逆迈克尔反应(retro-michaelreaction)的可能性和马来酰亚胺连接的有效负荷丢失或从抗体转移到血浆中的其它蛋白质(例如人血清白蛋白)上。然而,在一些实施方案中,使用实施例18和19中所列的选择性还原和位点特异性抗体可用于稳定缀合物,并降低这种不需要的转移。硫醇基-酰卤反应提供无法进行逆迈克尔反应并因此更稳定的生物缀合物。然而,与基于马来酰亚胺的缀合相比,硫醇基-卤化物反应总的来说具有较慢的反应速率,因此在提供非期望的药物/抗体比率中不太有效。硫醇基-吡啶基二硫化物反应是另一种流行的生物缀合途径。吡啶基二硫化物与游离硫醇基进行快速交换,导致混合的二硫化物和吡啶-2-硫酮的释放。混合的二硫化物可在还原性细胞环境中裂解释放出有效负荷。在生物缀合中得到更多关注的其它方法是硫醇基-乙烯基砜和硫醇基-二砜反应,其每一个都与本文的教导内容相容,并明确包括在本发明的范围内。在一些实施方案中,相容的接头可在胞外环境中赋予adc稳定性,防止adc分子聚集,并保持adc自由溶于水性介质中和呈单体状态。在转运或递送至细胞中之前,adc优选是稳定的并保持完整,即抗体保持与药物部分连接。虽然接头在靶细胞以外是稳定的,但它们被设计成在细胞内以某种有效的速率裂解或降解。因此有效的接头可:(i)保持抗体的特异性结合性质;(ii)允许胞内递送缀合物或药物部分;(iii)保持稳定和完整,即不裂解或降解,直到缀合物被递送或转运至其靶定部位;和(iv)保持药物部分细胞毒性、细胞杀伤作用或细胞抑制作用(在某些情况下包括任何旁观者效应)。可通过标准分析技术例如hplc/uplc、质谱法、hplc和分离/分析技术lc/ms和lc/ms/ms,测量adc的稳定性。如上文所列,抗体和药物部分的共价连接需要接头具有2个反应性官能团,即在反应意义上为二价。可用于连接两个或更多个官能或生物活性部分(例如mmae和抗体)的二价接头试剂是已知的,已描述了提供其所得的缀合物的方法。与本发明相容的接头在广义上可归类为可切割和不可切割接头。可切割接头,其可包括酸不稳定接头、蛋白酶可切割接头和二硫化物接头,被内化入靶细胞中,并在细胞内的内体-溶酶体途径中切割。细胞毒素的释放和激活依赖于有利切割酸不稳定化学键例如腙或肟的内体/溶酶体酸性区室。如果溶酶体特异性蛋白酶切割位点被工程改造至接头,则细胞毒素将在胞内靶标附近释放。或者,含有混合的二硫化物的接头提供细胞毒性有效负荷籍以胞内释放的方法,因为它们在细胞的还原环境中选择性切割,但不在血流中的富氧环境中切割。相比之下,含有酰胺连接的聚乙二醇或烷基间隔基的相容的不可切割接头在靶细胞内的adc的溶酶体降解期间释放毒性有效负荷。在一些方面,接头的选择将取决于用于缀合物的具体药物、具体的适应症和抗体靶标。因此,本发明的某些实施方案包括可被存在于胞内环境(例如在溶酶体或内体或胞膜窖内)的切割剂切割的接头。接头可为例如被胞内肽酶或蛋白酶(包括但不限于溶酶体或内体蛋白酶)切割的肽基接头。在一些实施方案中,肽基接头为至少2个氨基酸长或至少3个氨基酸长。切割剂可包括组织蛋白酶b和d和纤溶酶,已知其每一种水解二肽药物衍生物,导致靶细胞内活性药物的释放。可被依赖硫醇基的蛋白酶组织蛋白酶-b切割的示例性肽基接头是包含phe-leu的肽,因为发现组织蛋白酶-b在癌组织中高表达。所述接头的其它实例描述于例如u.s.p.n.6,214,345。在具体的实施方案中,可被胞内蛋白酶切割的肽基接头是val-cit接头、val-ala接头或phe-lys接头。使用胞内蛋白水解性释放的治疗剂的一个优势是当被缀合且缀合物的血清稳定性相对高时,通常减少该治疗剂。在其它实施方案中,可切割接头是ph敏感的。通常,ph敏感的接头在酸性条件下可水解。例如,可使用在溶酶体中可水解的酸不稳定接头(例如腙、肟、缩氨基脲、缩氨基硫脲、顺式乌头酰胺、原酸酯、乙缩醛、缩酮等)(参见例如u.s.p.n.5,122,368、5,824,805、5,622,929)。所述接头在中性ph条件(例如血液中的ph)下相对稳定,但在低于ph5.5或为溶酶体的近似ph的5.0下不稳定(例如可切割)。在另外其它的实施方案中,接头在还原条件下可切割(例如二硫化物接头)。各种二硫化物接头是本领域已知的,包括例如可使用以下形成的那些:sata(n-琥珀酰亚胺基-s-乙酰基硫基乙酸酯)、spdp(n-琥珀酰亚胺基-3-(2-吡啶基联硫基)丙酸酯)、spdb(n-琥珀酰亚胺基-3-(2-吡啶基联硫基)丁酸酯)和smpt(n-琥珀酰亚胺基-氧基羰基-α-甲基-α-(2-吡啶基-联硫基)甲苯)。在另外其它具体的实施方案中,接头是丙二酸酯接头(johnson等,1995,anticancerres.15:1387-93)、马来酰亚胺苯甲酰基接头(lau等,1995,bioorg-med-chem.3(10):1299-1304)或3′-n-酰胺类似物(lau等,1995,bioorg-med-chem.3(10):1305-12)。在一些实施方案中(例如u.s.p.n.2011/0256157中列出的那些),相容的肽基接头可包含:其中星号表示与药物连接的点,cba(即细胞结合剂)包含抗mfi2抗体,l1包含接头和任选可切割接头,a是使l1与抗体上的反应性残基连接的连接基团(任选包含间隔基),l2是共价键或与-oc(=o)-一起形成自我牺牲的部分。应认识到,l1和l2(当存在时)的性质可大幅变化。根据其可通过缀合物所递送的部位的条件规定的切割特性选择这些基团。优选通过酶作用切割的那些接头,但是也可使用通过ph(例如酸或碱不稳定的)、温度的变化或在照射时(例如光不稳定的)可切割的接头。在还原或氧化条件下可切割的接头也用于本发明。在某些实施方案中,l1可包含氨基酸的连续序列。氨基酸序列可以是酶促切割的靶标底物,从而允许释放出药物。在一个实施方案中,l1是通过酶的作用可切割的。在一个实施方案中,酶是酯酶或肽酶。在另一个实施方案中,l1作为组织蛋白酶不稳定接头。在一个实施方案中,l1包含二肽。二肽可表示为-nh-x1-x2-co-,其中-nh-和-co-分别表示氨基酸基团x1和x2的n端和c端。二肽中的氨基酸可以是天然氨基酸的任何组合。在接头是组织蛋白酶不稳定接头时,二肽可以是组织蛋白酶介导的切割的作用部位。另外,对于分别具有羧基或氨基侧链官能团的氨基酸基团(例如glu和lys),co和nh可表示该侧链官能团。在一个实施方案中,二肽中的基团-x1-x2-、-nh-x1-x2-co-选自:-phe-lys-、-val-ala-、-val-lys-、-ala-lys-、-val-cit-、-phe-cit-、-leu-cit-、-ile-cit-、-phe-arg-和-trp-cit-,其中cit是瓜氨酸。优选二肽、-nh-x1-x2-co-中的基团-x1-x2-选自:-phe-lys-、-val-ala-、-val-lys-、-ala-lys-和-val-cit-。最优选二肽、-nh-x1-x2-co-中的基团-x1-x2-是-phe-lys-或-val-ala-或val-cit。在一个实施方案中,l2存在并与-c(=o)o-一起形成自我牺牲的接头。在一个实施方案中,l2是酶促活性的底物,从而允许弹头的释放。在一个实施方案中,当l1是通过酶的作用可切割的,且l2存在,则酶切割l1和l2之间的键。当存在时,l1和l2可通过选自以下的键连接:-c(=o)nh-、-c(=o)o-、-nhc(=o)-、-oc(=o)-、-oc(=o)o-、-nhc(=o)o-、-oc(=o)nh-和-nhc(=o)nh-。与l2连接的l1的氨基基团可以是氨基酸的n端或可来源于氨基酸侧链(例如赖氨酸氨基酸侧链)的氨基。与l2连接的l1的羧基可以是氨基酸的c端或可来源于氨基酸侧链(例如谷氨酸氨基酸侧链)的羧基。与l2连接的l1的羟基可来源于氨基酸侧链(例如丝氨酸氨基酸侧链的羟基。术语“氨基酸侧链”包括存在于以下的那些基团:(i)天然存在的氨基酸,例如丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸;(ii)次要氨基酸例如鸟氨酸和瓜氨酸;(iii)非天然氨基酸、β-氨基酸、天然存在的氨基酸的合成类似物和衍生物;和(iv)所有对映异构体、非对映异构体、同质异构富集、同位素标记形式(例如2h、3h、14c、15n)、保护形式及其外消旋混合物。在一个实施方案中,-c(=o)o-和l2一起形成基团:其中星号表示与药物或细胞毒性剂位置连接的点,波形线表示与接头l1连接的点,y为-n(h)-、-o-、-c(=o)n(h)-或-c(=o)o-,且n为0-3。亚苯基环被1、2或3个取代基任选取代。在一个实施方案中,亚苯基基团被卤素、no2、烷基或羟基烷基任选取代。在一个实施方案中,y为nh。在一个实施方案中,n为0或1。优选n为0。其中y为nh,n为0,自我牺牲接头可称为对氨基苄基羰基接头(pabc)。在其它实施方案中,接头可包括自我牺牲接头和二肽一起形成基团-nh-val-cit-co-nh-pabc-。在其它精选实施方案中,接头可包含基团-nh-val-ala-co-nh-pabc-,其如下示:其中星号表示与所选细胞毒性部分连接的点,波形线表示与可与抗体缀合的接头的其余部分(例如间隔基-抗体结合区段)连接的点。在酶促切割二肽时,自我牺牲接头将允许当远端位点被激活时完全释放受保护的化合物(即细胞毒素),沿途的过程显示如下:其中星号表示与所选细胞毒性部分连接的点,其中l*是包含新切割的肽基单位的接头的其余部分的激活形式。弹头的完全释放确保了可保留所需的毒性活性。在一个实施方案中,a为共价键。因此,l1和抗体直接连接。例如,其中l1包含连续氨基酸序列,序列的n端可与抗体残基直接连接。在另一个实施方案中,a为间隔基。因此,l1和抗体直接连接。在某些实施方案中,l1和可通过选自以下的键连接:-c(=o)nh-、-c(=o)o-、-nhc(=o)-、-oc(=o)-、-oc(=o)o-、-nhc(=o)o-、-oc(=o)nh-和-nhc(=o)nh-。正如下文将更详细地论述,本发明的药物接头可优选与半胱氨酸(包括游离半胱氨酸)上的反应性硫醇基亲核体连接。为此可通过用不同的还原剂(例如dtt或tcep)或本文列出的温和还原剂处理,使抗体的半胱氨酸有反应性用于与接头试剂缀合。在其它实施方案中,本发明的药物接头可优选与赖氨酸连接。优选接头含有与抗体上的亲核官能团反应的亲电子官能团。抗体上的亲核基团包括但不限于:(i)n端胺基,(ii)侧链胺基,例如赖氨酸,(iii)侧链硫醇基,例如半胱氨酸,和(iv)其中抗体被糖基化的糖羟基或氨基。胺、硫醇基和羟基是亲核的,并且能够与包括以下的接头部分和接头试剂上的亲电子基团反应形成共价键:(i)马来酰亚胺基团,(ii)活化二硫化物,(iii)活性酯例如nhs(n-羟基琥珀酰亚胺)酯、hobt(n-羟基苯并三唑)酯、卤代甲酸酯和酰基卤;(iv)烷基和苄基卤例如卤代乙酰胺;和(v)醛、酮和羧基。紧接下文显示了与本发明相容的示例性官能团:在一些实施方案中,半胱氨酸(包括位点特异性抗体的游离半胱氨酸)和药物接头部分之间的连接通过硫醇基残基和接头上存在的末端马来酰亚胺基团。在这些实施方案中,抗体和药物-接头之间的连接可为:其中星号表示与药物-接头的其余部分连接的点,波形线表示与抗体其余部分连接的点。在该实施方案中,s原子优选来源于位点特异性游离半胱氨酸。对于其它相容的接头,结合部分可包含可与抗体上的活化残基反应的末端碘乙酰胺以提供所需缀合物。在任何情况下,鉴于本公开内容,本领域技术人员可容易地将所公开的药物-接头化合物与相容的抗mfi2抗体(包括位点特异性抗体)缀合。按照本公开内容,本发明提供制备包含使抗mfi2抗体与选自以下的药物-接头化合物缀合的相容的抗体药物缀合物的方法:对于本申请的目的,dl可用作“药物-接头”的缩写,并可包含上文列出的药物接头1–5(即dl1、dl2、dl3、dl4和dl5)。应认识到,可采用
技术领域:
公知的技术,将附有末端马来酰亚胺部分(dl1–dl4)或碘乙酰胺部分(dl5)的接头与所选mfi2抗体上的游离硫氢基缀合。上述化合物的合成路线列于wo2014/130879(其通过引用结合到本文中),而缀合这类pbd的具体方法列于下面的实施例中。因此,在精选方面,本发明涉及与所公开的吡咯并苯并二氮杂缀合的mfi2抗体以提供紧接下文大量给出的adc1–5的mfi2免疫缀合物。因此,在某些方面,本发明涉及选自以下的缀合物其中ab包含抗mfi2抗体或其免疫活性片段。c.缀合应认识到,许多众所周知的不同反应可用于使药物部分和/或接头与所选抗体连接。例如,可将利用半胱氨酸的硫氢基的不同反应应用于缀合所需的部分。一些实施方案可包括如下详细论述的包含一个或多个游离半胱氨酸的抗体的缀合。在其它实施方案中,本发明的adc可通过药物与存在于所选抗体中的赖氨酸残基的暴露于溶剂的氨基缀合而产生。更有其它实施方案包括激活n端苏氨酸和丝氨酸残基,其之后可用于使所公开的有效负荷与抗体连接。所选的缀合方法优选可被设计成使与抗体连接的药物的数目最优化,并提供相对高的治疗指数。用于使治疗化合物与半胱氨酸残基缀合的各种方法是本领域已知的,并且对技术人员而言将是显而易见的。在碱性条件下,半胱氨酸残基将脱质子化以产生硫醇盐亲核体,其可与温和的亲电子试剂(例如马来酰亚胺和碘乙酰胺)反应。通常这类缀合的试剂可与半胱氨酸硫醇基直接反应以形成缀合的蛋白质或与接头-药物直接反应形成接头-药物中间体。在接头的情况下,利用有机化学反应、条件和试剂的若干路线为本领域技术人员所知,包括:(1)本发明的蛋白质的半胱氨酸基团与接头试剂反应,通过共价键形成蛋白质-接头中间体,接着与激活的化合物反应;和(2)化合物的亲核基团与接头试剂反应,通过共价键形成药物-接头中间体,接着与本发明的蛋白质的半胱氨酸基团反应。正如从上文看对技术人员而言将是显而易见的,双官能(或二价)接头可用于本发明。例如,双官能接头可包含用于与半胱氨酸残基共价连接的硫醇基修饰基团和用于与化合物共价或非共价连接的至少一个连接部分(例如第二硫醇基修饰部分)。在缀合之前,抗体可通过用还原剂例如二硫苏糖醇(dtt)或(三(2-羧乙基)膦(tcep)处理使之有反应性用于与接头试剂缀合。在其它实施方案中,可如下将其它亲核基团引入抗体中:通过使赖氨酸与试剂反应,所述试剂包括但不限于导致胺转化成硫醇基的2-亚氨基噻烷(traut试剂)、sata、satp或sat(peg)4)。至于这类缀合,半胱氨酸硫醇基或赖氨酸氨基是亲核的,并能够与接头试剂或化合物-接头中间体或药物上的包括以下的亲电子基团反应形成共价键:(i)活性酯例如nhs酯、hobt酯、卤代甲酸酯和酰基卤;(ii)烷基和苄基卤,例如卤代乙酰胺;(iii)醛、酮、羧基和马来酰亚胺基团;和(iv)通过硫化物交换的二硫化物,包括吡啶基二硫化物。化合物或接头上的亲核基团包括但不限于能够与接头部分和接头试剂上的亲电子基团反应形成共价键的胺、硫醇基、羟基、酰肼、肟、肼、缩氨基硫脲、肼羧酸酯和芳菲酰肼基团。缀合试剂包括马来酰亚胺、卤代乙酰基、碘乙酰胺琥珀酰亚胺基酯、异硫氰酸酯、磺酰氯、2,6-二氯三嗪基、五氟苯基酯和氨基亚磷酸基(phosphoramidite),虽然还可使用合适的其它官能团。在某些实施方案中,方法包括例如使用与半胱氨酸的硫醇基反应以产生与化合物有反应性的硫醚的马来酰亚胺、碘乙酰胺或卤代乙酰基/烷基卤、氮杂环丙烷、丙烯酰衍生物。游离硫醇基与活化吡啶基二硫化物的二硫化物交换也可用于产生缀合物(例如使用5-硫代-2-硝基苯甲(tnb)酸)。优选使用马来酰亚胺。如上标明的,赖氨酸还可用作反应性残基以实现本文列出的缀合。通常通过胺-反应性琥珀酰亚胺基酯,靶向亲核的赖氨酸残基。为了获得脱质子化赖氨酸残基的最佳数目,水性溶液的ph必须低于赖氨酸铵基的pka(其约为10.5),反应物的典型ph为约8和9。偶联反应的通用试剂为nhs-酯,其通过赖氨酸酰化机制与亲核赖氨酸反应。进行类似反应的其它相容的试剂包括可与本文的教导内容联用以提供adc的异氰酸酯和异硫氰酸酯。一旦激活赖氨酸,许多前述连接基团便可用于使弹头与抗体共价结合。用于使化合物与苏氨酸或丝氨酸残基(优选n端残基)缀合的方法也是本领域已知的。例如描述了这样的方法,其中羰基前体来源于丝氨酸或苏氨酸的1,2-氨基醇,其可通过高碘酸盐氧化作用选择性和快速地转化为醛形式。醛与待与本发明蛋白质连接的化合物中的半胱氨酸的1,2-氨基硫醇基反应形成稳定的噻唑烷产物。该方法特别可用于在n端丝氨酸或苏氨酸残基处标记蛋白质。在一些实施方案中,可通过引入1、2、3、4或更多个游离半胱氨酸残基,将反应性硫醇基引入所选的抗体(或其片段)中(例如制备包含一个或多个游离非天然半胱氨酸氨基酸残基的抗体)。所述位点特异性抗体或工程改造的抗体,允许至少部分由于提供工程改造的游离半胱氨酸位点和/或本文提出的新的缀合方法而显示稳定性提高和大体同质性的缀合物制备物。与完全或部分还原成链内或链间抗体二硫键以提供缀合部位(且与本发明完全相容)的常规缀合方法不同,本发明另外提供选择性还原某些制备的游离半胱氨酸位点并引导药物-接头至所述位点。通过工程改造的位点提高的缀合特异性和选择性还原允许在所需的位置处的高百分比的位点定向缀合。值得注意的是这些缀合部位中的一些,例如存在于轻链恒定区末端区的那些,通常难以有效地缀合,因为它们往往与其它游离半胱氨酸交叉反应。然而,通过所得游离半胱氨酸的分子工程和选择性还原,可获得有效的缀合速率,其大大降低不需要的高dar污染物和非特异性毒性。更概括地讲,工程改造的构建体和包含选择性还原的所公开的新的缀合方法提供药代动力学和/或药效学改进且治疗指数可能提高的adc制备物。在某些实施方案中,位点特异性构建体存在游离半胱氨酸,其在还原时包含是亲核的且能够与接头部分(例如上文公开的接头部分)上的亲电子基团反应形成共价键的硫醇基。如上所述,本发明的抗体可具有可还原的未配对链间或链内半胱氨酸或引入的非天然半胱氨酸,即提供所述亲核基团的半胱氨酸。因此,在某些实施方案中,还原游离半胱氨酸的游离硫氢基和所公开的药物-接头的末端马来酰亚胺或卤代乙酰胺基团的反应可提供所需缀合。在这类情况下,可通过用还原剂例如二硫苏糖醇(dtt)或(三(2-羧乙基)膦(tcep)处理,使抗体的游离半胱氨酸实现对与接头试剂缀合的反应性。各个游离半胱氨酸因此在理论上提供反应性硫醇基亲核体。虽然这类试剂是相容的,但应认识到,位点特异性抗体的缀合可使用本领域技术人员通常已知的各种反应、条件和试剂实现。此外,发现工程改造的抗体的游离半胱氨酸可被选择性地还原以提供提高的位点定向缀合和降低的不需要的潜在毒性污染物。更准确地说,发现“稳定剂”(例如精氨酸)调节蛋白质中的分子内和分子间相互作用,并且可与所选的还原剂(优选相对温和)联用,以选择性的还原游离半胱氨酸并促进本文所列的位点特异性缀合。本文所用术语“选择性还原”或“选择性地还原”可互换使用,可指游离半胱氨酸的还原而无实质性地破坏存在于工程改造的抗体中的天然二硫键。在精选的实施方案中,这可通过某些还原剂实现。在其它实施方案中,工程改造的构建体的选择性还原可包括使用与还原剂(包括温和还原剂)组合的稳定剂。应认识到,术语“选择性缀合”可指被选择性还原的工程改造抗体与本文所述细胞毒素的缀合。在这个方面,使用与所选还原剂组合的这类稳定剂可显著提高位点特异性合的效率,通过抗体重链和轻链的缀合程度和制备物的dar分布测定。有关所述方法和构建体,相容的抗体构建体和选择性缀合技术和试剂详尽公开于wo2015/031698。虽然不希望受任何特殊理论的束缚,但所述稳定剂可在所需的缀合部位起作用以调节静电微环境和/或调节构象变化,从而允许相对温和的还原剂(其不实质性地还原完整的天然二硫键)以促进在所需的游离半胱氨酸位点处的缀合。已发现所述稳定剂(例如某些氨基酸)形成盐桥(通过氢键结合和静电相互作用),并且可以如此方式调节蛋白质-蛋白质相互作用以赋予稳定作用,其可引起有利的构象变化和/或降低不利的蛋白质-蛋白质相互作用。然而,所述稳定剂可在还原后起抑制非预期的分子内(和分子间)半胱氨酸-半胱氨酸键形成因此促进所需的缀合反应的作用,其中工程改造的位点特异性半胱氨酸与药物(优选通过接头)结合。因为选择性还原条件不提供完整天然二硫键的显著还原,所以自然驱动游离半胱氨酸上相对少的反应性硫醇基(例如优选2个游离硫醇基/抗体)随后的缀合反应。正如之前所提及的,这类技术可用于可观地降低非特异性缀合的水平和按照本公开内容制备的缀合物制备物的相应杂质。在精选的实施方案中,与本发明相容的稳定剂一般可包含具有碱性pka的至少一部分的化合物。在某些实施方案中,该部分可包含伯胺,而在其它实施方案中,胺部分可包含仲胺。在另外其它的实施方案中,胺部分可包含叔胺或胍鎓基。在其它精选实施方案中,胺部分可包含氨基酸,而在其它相容的实施方案中,胺部分可包含氨基酸侧链。在另外其它的实施方案中,胺部分可包含蛋白原的氨基酸。在另外其它的实施方案中,胺部分包含非蛋白原的氨基酸。在一些实施方案中,相容的稳定剂可包含精氨酸、赖氨酸、脯氨酸和半胱氨酸。此外,相容的稳定剂可包括胍和具有碱性pka的含氮杂环。在某些实施方案中,相容的稳定剂包含具有pka大于约7.5的至少一种胺部分的化合物,在其它实施方案中,主题胺部分具有大于约8.0的pka,在另外其它的实施方案中,胺部分可具有大于约8.5的pka,而在另外其它的实施方案中,稳定剂可包含pka大于约9.0的胺部分。其它实施方案可包括稳定剂,其中胺部分可具有大于约9.5的pka,而某些其它实施方案可包括显示至少一种胺部分的pka大于约10.0的稳定剂。在另外其它的实施方案中,稳定剂可包含具有pka大于约10.5的胺部分的化合物,在其它实施方案中,稳定剂可包含具有pka大于11.0约的胺部分的化合物,而在另外其它的实施方案中,稳定剂可包含pka大于约11.5的胺部分。在另外其它的实施方案中,稳定剂可包含具有pka大于约12.0的胺部分的化合物,而在另外其它的实施方案中,稳定剂可包含pka大于约12.5的胺部分。本领域技术人员应了解,相关pka可采用标准技术容易的计算或测定,并可用来测定使用所选化合物作为稳定剂的适用性。所公开的稳定剂显示当与某些还原剂结合时在靶向与游离位点特异性半胱氨酸的缀合特别有效。对于本发明的目的,相容的还原剂可包括产生还原的游离位点特异性半胱氨酸用于缀合而不显著破坏工程改造的抗体的天然二硫键的任何化合物。在优选由所选稳定剂和还原剂的组合提供的这些条件下,激活的药物接头大多限于与所需的游离位点特异性半胱氨酸位点结合。特别优选相对温和的还原剂或以相对低的浓度使用的还原剂以提供温和条件。本文所用术语“温和还原剂”或“温和还原条件”应是指通过在游离半胱氨酸位点提供硫醇基而不显著破坏存在于工程改造的抗体中的天然二硫键的还原剂(任选在稳定剂存在下)的任何还原剂或由之引起的状态。即,温和还原剂或条件(优选与稳定剂组合)能够有效地还原游离半胱氨酸(提供硫醇基)而不显著破坏蛋白质的天然二硫键。所需的还原条件可通过建立选择性缀合的合适环境的许多基于硫氢基的化合物来提供。在实施方案中,温和还原剂可包含具有一个或多个游离硫醇基的化合物,而在一些实施方案中,温和还原剂可包含具有单个游离硫醇基的化合物。与本发明的选择性还原技术相容的还原剂的非限制性实例包括谷胱甘肽、n-乙酰基半胱氨酸、半胱氨酸、2-氨基乙烷-1-硫醇基和2-羟基乙烷-1-硫醇基。应认识到,上文提供的选择性还原方法在与游离半胱氨酸的定向缀合中特别有效。在这个方面,位点特异性抗体中与所需的靶位点缀合的程度(本文定义为“缀合效率”)通过各种
技术领域:
公知的技术测定。可通过评价靶标缀合部位(例如每条轻链c端上的游离半胱氨酸)上的缀合相对于所有其它缀合位点的百分比,来确定药物与抗体的位点特异性缀合的效率。在某些实施方案中,本文的方法提供药物与包含游离半胱氨酸的抗体的有效缀合。在一些实施方案中,缀合效率为至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或更多,通过靶标缀合相对于所有其它缀合部位的百分比测量。应进一步认识到,能够缀合的工程改造的抗体可含有包含在抗体产生或储存时被封闭或帽化的硫氢基的游离半胱氨酸残基。所述帽包括与硫氢基相互作用并防止或抑制缀合物形成的小分子、蛋白质、肽、离子和其它物质。在某些情况下,未缀合的工程改造的抗体可包含结合相同或不同抗体上的其它游离半胱氨酸的游离半胱氨酸。如本文所论述的,所述交叉反应性可在制备过程中产生各种污染物。在一些实施方案中,工程改造的抗体可能需要在缀合反应前去帽化。在具体的实施方案中,本文的抗体是未帽化的,并显示能够缀合的游离硫氢基。在具体的实施方案中,本文的抗体进行不干扰或重排天然存在的二硫键的去帽化反应。应认识到,在大多数情况下,去帽化反应可在正常还原反应(还原或选择性还原)期间发生。d.dar分布和纯化在精选的实施方案中,与本发明的位点特异性抗体缀合有利地提供产生包含dar分布窄的相对均质的adc制备物的能力。在这一方面,就在药物和工程改造的抗体之间的化学计量比而言和有关毒素位置,所公开的构建体和/或选择性缀合提供样品内adc物类的均质性。如上文简述,术语“药物与抗体比率”或“dar”是指药物与抗体的摩尔比率。在一些实施方案中,对于其dar分布,缀合物制备物可能是基本均质的,这意味着在adc制备物内是具有相对于负载位置(即在游离半胱氨酸上)也是均匀的具体dar(例如dar为2或4)的位点特异性adc的主要物类。在本发明的某些实施方案中,可通过使用位点特异性抗体和/或选择性还原和缀合实现所需均质性。在其它实施方案中,所需均质性可通过使用位点特异性构建体与选择性还原组合来实现。在另外其它的实施方案中,制备物可采用分析或制备型层析技术进一步纯化。在这些实施方案的每个中,可采用本领域已知的各种技术,包括但不限于质谱法、hplc(例如大小排阻层析法hplc、rp-hplc、hic-hplc等)或毛细管电泳,分析adc样品的均质性。对于adc制备物的纯化,应认识到可采用标准药物制备方法获得所需纯度。如本文所论述的,液相层析方法例如反相(rp)和疏水相互作用层析法(hic)可通过药物负载值分离混合物中的化合物。在某些情况下,还可采用离子交换(iec)或混合模式层析法(mmc)分离具有具体药物负载的物类。所公开的adc及其制备物可包含呈不同化学计量摩尔比率的药物和抗体部分,这取决于抗体的构型和至少部分取决于用于实现缀合的方法。在某些实施方案中,每adc的药物负载可包含1-20个弹头(即n为1-20)。其它精选实施方案可包含药物负载为1-15个弹头的adc。在另外其它的实施方案中,adc可包括1-12个弹头,或更优选1-10个弹头。在一些实施方案中,adc可包括1-8个弹头。虽然理论药物负载可相对高,但由于聚集体和其它污染物所致,实际限制例如游离半胱氨酸交叉反应性和弹头疏水性往往限制包含所述dar的均质制备物的产生。也就是说,较高的药物负载(例如>6或8),可引起聚集、不可溶性、毒性或某些抗体-药物缀合物的细胞渗透性丧失。鉴于这种顾虑,优选由本发明提供的实际药物负载的范围为每缀合物1-8个药物,即其中1、2、3、4、5、6、7或8个药物与每个抗体共价连接(例如对于igg1,其它抗体可具有不同的负载能力,这取决于二硫键的数目)。优选本发明组合物的dar可为约2、4或6个,而在一些实施方案中,dar可包含约2个。尽管本发明提供的相对高水平的均质性,所公开的组合物实际上包含具有各个药物化合物的缀合物的混合物(在igg1的情况下可能为1-8个)。因此,所公开的adc组合物包括缀合物的混合物,其中大多数的组分抗体与一个或多个药物部分共价连接,且(尽管由工程改造的构建体提供的相对缀合物特异性和选择性还原)其中药物部分可通过不同的硫醇基与抗体连接。也就是说,在缀合后,本发明的adc组合物可包含不同浓度的具有不同的药物负载(例如1-8个药物/igg1抗体)的缀合物的混合物(连同主要由游离半胱氨酸交叉反应性引起的某些反应污染物)。然而利用选择性还原和制备后纯化,可驱使缀合物组合物至其中含有单一主要的所需adc物类(例如药物负载为2个)而其它adc物类水平相对低(例如药物负载为1、4、6个等)的点。平均dar值表示作为整体的组合物(即以所有adc物类计)的药物负载的加权平均。由于所采用的定量方法的固有不确定性和难以完全除去商品化背景下的非主要adc物类,可接受的dar值或规格常常以平均数、范围或分布(即平均dar为2+/-0.5)呈现。优选包含在范围内(即1.5-2.5)的实测平均dar的组合物可用于制药情况。因此,在一些实施方案中,本发明可包含平均dar为1、2、3、4、5、6、7或8各自+/-0.5的组合物。在其它实施方案中,本发明可包含2、4、6或8+/-0.5的平均dar。最后,在精选的实施方案中,本发明可包含2+/-0.5或4+/-0.5的平均dar。应认识到,在一些实施方案中范围或偏差可小于0.4。因此,在其它实施方案中,组合物可包含1、2、3、4、5、6、7或8各自+/-0.3的平均dar;2、4、6或8+/-0.3的平均dar;甚至更优选2或4+/-0.3的平均dar或甚至2+/-0.3的平均dar。在其它实施方案中,igg1缀合物组合物可优选包含平均dar为1、2、3、4、5、6、7或8各自+/-0.4和相对低水平(即小于30%)的非主要adc物类的组合物。在其它实施方案中,adc组合物可包含2、4、6或8各自+/-0.4的平均dar与相对低水平(<30%)的非主要adc物类。在一些实施方案中,adc组合物可包含2+/-0.4的平均dar与相对低水平(<30%)的非主要adc物类。在另外其它的实施方案中,当针对其它dar物种测量时,主要的adc物类(例如2的dar或4的dar)可以大于65%的浓度、大于70%的浓度、大于75%的浓度、大于80%的浓度、大于85%的浓度、大于90%的浓度、大于93%的浓度、大于95%的浓度或甚至大于97%的浓度存在。如下文实施例的详细,来自缀合反应的adc制备物中每抗体的药物分布可通过常规方法(例如uv-vis分光光度法、反相hplc、hic、质谱法、elisa和电泳)表征。还可测定就每抗体的药物而言adc的定量分布。通过elisa,可测定adc的具体制备物中每抗体的药物的平均值。然而,通过抗体-抗原结合和elisa检测限制无法测出每抗体的药物值的分布。此外,用于检测抗体-药物缀合物的elisa测定法测不出药物部分与抗体连接的位置,例如重链或轻链片段或具体的氨基酸残基。vi.诊断和筛选a.诊断本发明提供用于检测、诊断或监测增殖性病症的体外和体内方法和筛选来自患者的细胞以鉴定肿瘤细胞(包括致瘤细胞)的方法。所述方法包括鉴定患有癌症的个体以治疗或监测癌症进程,该方法包括使患者或来自患者的样品(体内或体外)与能够特异性识别mfi2并与之缔合的检测剂(例如抗体或核酸探针)接触并检测样品中检测剂缔合存在与否或水平。在精选的实施方案中,检测剂可包含与本文所述可检测标记或报道分子缔合的抗体。在另外其它的实施方案(例如原位杂交或ish)中,可使用与基因组mfi2决定簇反应的核酸探针检测、诊断或监测增殖性病症。更概括地讲,可采用本领域普通技术人员可获得的用于蛋白质或核酸分析的许多技术的任一种,例如直接物理测量(例如质谱法)、结合测定法(例如免疫测定法、凝集测定法和免疫层析测定法)、聚合酶链反应(pcr、rt-pcr、rt-qpcr)技术、分支寡核苷酸技术、rna印迹技术、寡核苷酸杂交技术和原位杂交技术,测量mfi2决定簇的存在和/或水平。所述方法还可包括测量产生于化学反应的信号,例如光学吸光度的变化、荧光的变化、化学发光或电化学发光的产生、反射率的变化、折射率或光散射、来自表面的可检测标记的蓄积或释放、氧化或还原或氧化还原物类、电流或电势、磁场的变化等。合适的检测技术可如下检测结合事件:通过测量其光致发光(例如通过测量荧光、时间分辨荧光、隐失波荧光、升频转换磷光体、多光子荧光等)、化学发光、电化学发光、光散射、光学吸光度、放射性、磁场、酶促活性(例如通过经引起光学吸光度或荧光变化的酶促反应或引起发射化学发光测量酶活性)的标记,测量标记的结合试剂的参与。或者,可采用不需要使用标记的检测技术,例如基于测量分析物的质量(例如表面声波测量)、折射率(例如表面等离子体共振测量)或固有发光的技术。在一些实施方案中,检测剂与样品中的特定细胞或细胞组分的缔合表明样品可含有致瘤细胞,从而表示患有癌症的个体可用本文所述的抗体或adc有效地治疗。在某些优选的实施方案中,测定法可包含免疫组织化学(ihc)测定法或其变体(例如荧光、显色、标准abc、标准lsab等)、免疫细胞化学或其变体(例如直接、间接、荧光、显色等)或原位杂交(ish)或其变体(例如显色原位杂交(cish)或荧光原位杂交(dna-fish或rna-fish))。在这一方面,本发明的某些方面包括使用标记的mfi2用于免疫组织化学(ihc)。更具体地讲,mfi2ihc可用作辅助诊断各种增殖性病症和监测对治疗(包括mfi2抗体疗法)的可能反应的诊断工具。如本文所述和下文实施例所示,相容的诊断测定法可在经化学固定(包括但不限于:甲醛、戊二醛、四氧化锇、重铬酸钾、乙酸、醇、锌盐、氯化汞、四氧化铬和苦味酸)和包埋(包括但不限于:乙二醇甲基丙烯酸酯、石蜡和树脂)或通过冷冻保存的组织中进行。所述测定法可用于指导治疗决策和测定给药方案和时机。本发明的其它特别相容的方面包括采用原位杂交检测或监测mfi2决定簇。原位杂交技术或ish为本领域技术人员所熟知。简单地说,将细胞固定,将含有特定核苷酸序列的可检测探针加入固定的细胞中。如果细胞含有互补的核苷酸序列,则使可被检测的探针与之杂交。利用本文列出的序列信息,可设计探针以鉴定表达基因型mfi2决定簇的细胞。探针优选与相当于所述决定簇的核苷酸序列杂交。可通过非完全互补杂交,按常规使杂交条件优化以使背景信号减少到最小,但是优选探针优选与所选mfi2决定簇完全互补。在精选的实施方案中,探针用与通过标准荧光方法可容易检测的探针连接的荧光染料进行标记。相容的体内治疗诊断或诊断测定法可包含
技术领域:
公知的成象或监测技术,例如磁共振成象、计算机体层摄影(例如cat扫描)、正电子成像(例如pet扫描)放射照相术、超声等,正如本领域技术人员已知的。在某些实施方案中,本发明的抗体可用于检测和定量测定患者样品(例如血浆或血液)中特定决定簇(例如mfi2蛋白)的水平,其进而可用来检测、诊断或监测与相关决定簇有关的增殖性病症。在有关实施方案中,本发明的抗体可用于体内或体外检测、监测和/或定量测定循环的肿瘤细胞(wo2012/0128801)。在另外其它的实施方案中,循环的肿瘤细胞可包含致瘤细胞。在本发明的某些实施方案中,可在疗法或方案之前使用所公开的抗体评价或表征受试者或来自受试者的样品中的致瘤细胞以建立基线。在其它实例中,可评价来自经过治疗的受试者的样品的致瘤细胞。在另一个实施方案中,本发明提供体内分析癌症进程和/或发病机制的方法。在另一个实施方案中,体内分析癌症进程和/或发病机制包括测定肿瘤进程的程度。在另一个实施方案中,分析包括肿瘤的鉴定。在另一个实施方案中,肿瘤进程的分析在原发性肿瘤中进行。在另一个实施方案中,根据本领域技术人员已知的癌症类型随时间推移进行分析。在另一个实施方案中,进一步进行源自原发性肿瘤的转移细胞的继发肿瘤的体内分析。在另一个实施方案中,分析继发肿瘤的形状和大小。在一些实施方案中,进行进一步的离体分析。在另一个实施方案中,本发明提供分析体内癌症进程和/或发病机制的方法,所述方法包括测定细胞转移或检测和量化循环肿瘤细胞的水平。在又一个实施方案中,细胞转移的分析包括测定与原发性肿瘤不连续的部位的细胞的渐近生长。在另一个实施方案中,细胞转移部位分析包括肿瘤扩散的线路。在一些实施方案中,细胞可通过体腔内的血管、淋巴或其组合扩散。在另一个实施方案中,鉴于细胞迁移、散播、外渗、增殖或其组合,进行细胞转移分析。在某些实例中,可在治疗前使用所公开的抗体评价或表征受试者或来自受试者的样品中的致瘤细胞以建立基线。在其它实例中,样品来源于经治疗的受试者。在一些实施中,在受试者开始或终止治疗后至少约1、2、4、6、7、8、10、12、14、15、16、18、20、30、60、90天、6个月、9个月、12个月或>12个月,从受试者中获取样品。在某些实例中,在给予一定数目的剂量(例如在2、5、10、20、30或更多剂治疗)后评价或表征致瘤细胞。在其它实例中,在接受一种或多种疗法后1周、2周、1个月、2个月、1年、2年、3年、4年或更久后表征或评价致瘤细胞。b.筛选在某些实施方案中,本发明的抗体可用来筛选样品以鉴定通过与决定簇相互作用改变肿瘤细胞的功能或活性的化合物或作用剂(例如抗体或adc)。在一个实施方案中,使肿瘤细胞与抗体或adc接触,并使用抗体或adc筛选表达某些靶标(例如mfi2)的肿瘤细胞以鉴定所述细胞用于这样的目的,包括但不限于诊断目的,以监测所述细胞来测定治疗功效或富集所述表达靶标的细胞的细胞群。在又一个实施方案中,方法包括使肿瘤细胞与试验物质或化合物直接或间接接触,并测定试验物质或化合物是否调节决定簇相关肿瘤细胞的活性或功能,例如细胞形态或存活力的变化、标志物的表达、分化或去分化、细胞呼吸、线粒体活性、膜完整性、成熟、增殖、存活力、细胞凋亡或细胞死亡。直接相互作用的一个实例是物理相互作用,而间接相互作用包括例如组合物作用于中间分子,其进而作用于所提及的实体(例如细胞或细胞培养)。筛选方法包括高通量筛选,这可包括任选位于或放置在预定位置(例如培养皿、管、培养瓶、滚瓶或板中)的细胞阵列(例如微阵列)。高通量机器人或手工处理方法可探测化学相互作用并测定短时间内的许多基因的表达水平。已开发出利用分子信号例如通过荧光团或微阵列的技术(mocellin和rossi,2007,pmid:17265713)和以极快速率处理信息的自动化分析(参见例如pinhasov等,2004,pmid:15032660)。可筛选的文库包括例如小分子文库、噬菌体展示文库、完全人抗体酵母展示文库(adimab)、sirna文库和腺病毒转染载体。vii.药物制备和治疗用途a.制剂和给药途径可采用
技术领域:
公知的技术以多种方式配制本发明的抗体或adc。在一些实施方案中,本发明的治疗组合物可单纯地或与少量其它组分一起给予,而其它可任选配制成含有合适的药学上可接受的载体。如本文所用,“药学上可接受的载体”包括是本领域众所周知的并可获自商业来源用于药物制剂的赋形剂、溶媒、佐剂和稀释剂(参见例如gennaro(2003)remington:thescienceandpracticeofpharmacywithfactsandcomparisons:drugfactsplus,第20版,mackpublishing;ansel等(2004)pharmaceuticaldosageformsanddrugdeliverysystems,第7版,lippencottwilliamsandwilkins;kibbe等(2000)handbookofpharmaceuticalexcipients,第3版,pharmaceuticalpress)。合适的药学上可接受的载体包含是相对惰性的并且可促进抗体给药或可有助于活性化合物加工成在制药上经优化以递送至作用部位的制剂的物质。所述药学上可接受的载体包括可改变制剂的形式、稠度、粘度、ph、张度、稳定性、摩尔渗透压浓度、药代动力学、蛋白质聚集或溶解度的作用剂,包括缓冲剂、润湿剂、乳化剂、稀释剂、成胶囊剂和皮肤渗透促进剂。载体的某些非限制性实例包括盐水、缓冲盐水、葡萄糖、精氨酸、蔗糖、水、甘油、乙醇、山梨糖醇、葡聚糖、羧甲基纤维素钠及其组合。可配制用于全身给药的抗体用于肠内、胃肠外或局部给药。实际上,所有3种类型的制剂可同时使用以实现活性成分的全身给药。用于胃肠外和非胃肠外药物递送的赋形剂以及制剂列于remington:thescienceandpracticeofpharmacy(2000)第20版.mackpublishing。对于肠内给药的合适制剂包括硬或软明胶胶囊剂、丸剂、片剂包括包衣片剂、酏剂、混悬剂、糖浆剂或吸入剂及其控释形式。适于胃肠外给药(例如通过注射)的制剂,包括水性或非水性、等渗、无致热原的无菌液体制剂(例如溶液剂、混悬剂),其中活性成分溶解、悬浮或以别的方式提供(例如呈脂质体或其它微颗粒)。所述液体制剂另另含有其它药学上可接受的载体,例如抗氧化剂、缓冲剂、防腐剂、稳定剂、抑菌剂、助悬剂、增稠剂和使制剂与预期受体的血液(或其它相关体液)等渗的溶剂。赋形剂的实例包括例如水、醇、多元醇、甘油、植物油等。用于所述制剂合适的等渗的药学上可接受的载体的实例包括氯化钠注射液、林格氏液或乳酸盐林格氏液。对于胃肠外给药(例如静脉内注射)的相容的制剂可包括约10μg/ml-约100mg/ml的adc或抗体浓度。在某些精选的实施方案中,抗体或adc浓度可包括20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml、200μg/ml、300,μg/ml、400μg/ml、500μg/ml、600μg/ml、700μg/ml、800μg/ml、900μg/ml或1mg/ml。在其它实施方案中,adc浓度可包括2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、8mg/ml、10mg/ml、12mg/ml、14mg/ml、16mg/ml、18mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、45mg/ml、50mg/ml、60mg/ml、70mg/ml、80mg/ml、90mg/ml或100mg/ml。可通过包括但不限于以下的各种途径将本发明的化合物和组合物给予有需要的受试者体内:口服、静脉内、动脉内、皮下、胃肠外、鼻内、肌内、心脏内、心室内、气管内、口腔、直肠、腹膜内、皮内、局部、经皮和鞘内或否则通过植入或吸入。可将主题组合物配制成固体、半固体、液体或气体形式的剂型;包括但不限于片剂、胶囊剂、散剂、颗粒剂、软膏剂、溶液剂、栓剂、灌肠剂、注射剂、吸入剂和气雾剂。合适的制剂和给药途径可按照预期用途和治疗方案选择。b.剂量具体的剂量方案,即剂量、时机和重复将于具体的个体以及实证考量例如药代动力学(例如半寿期、清除率等)。可由本领域技术人员(例如主治医生),根据对情况的考量和待治疗病况的严重程度、待治疗的受试者的年龄和一般健康状况等,确定给药频率。可根据所选组合物和给药方案的功效的评价,在治疗进程中调节给药频率。例如可根据具体的疾病、病症或病况的标志物做出评价。在其中个体患有癌症的实施方案中,这些包括通过触诊或目测观察直接测量肿瘤大小;通过x射线或其它成像技术间接测量肿瘤大小;如通过直接肿瘤活检和肿瘤样品的显微镜检查评价的改善;按照本文所述方法鉴定的间接肿瘤标志物(例如前列腺的psa)或抗原的测量;增殖或致瘤细胞数目的减少,所述瘤性细胞减少的维持;瘤性细胞增殖的减少或转移发生的延迟。可以不同的范围给予本发明的mfi2抗体或adc。这些包括约5μg/kg体重-约100mg/kg体重/剂;约50μg/kg体重-约5mg/kg体重/剂;约100μg/kg体重-约10mg/kg体重/剂。其它范围包括约100μg/kg体重-约20mg/kg体重/剂和约0.5mg/kg体重-约20mg/kg体重/剂。在某些实施方案中,剂量为至少约100μg/kg体重、至少约250μg/kg体重、至少约750μg/kg体重、至少约3mg/kg体重、至少约5mg/kg体重、至少约10mg/kg体重。在精选的实施方案中,可以约10、20、30、40、50、60、70、80、90或100μg/kg体重/剂给予(优选静脉内)mfi2抗体或adc。其它实施方案可包括以约200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900或2000μg/kg体重/剂给予抗体或adc。在其它实施方案中,可以2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、9或10mg/kg给予所公开的缀合物。在另外其它的实施方案中,可以12、14、16、18或20mg/kg体重/剂给予缀合物。在另外其它的实施方案中,可以25、30、35、40、45、50、55、60、65、70、75、80、90或100mg/kg体重/剂给予缀合物。根据本文的教导内容,本领域技术人员可根据临床前动物研究、临床观察结果和标准医学和生物化学技术和测量值容易地确定各种mfi2抗体或adc的合适剂量。其它给药方案可按公开于u.s.p.n.7,744,877的体表面积(bsa)计算预测。众所周知,bsa利用患者高度和体重计算,并提供通过他或她的身体表面积表示的受试者尺寸的度量。在某些实施方案中,缀合物可以1mg/m2-800mg/m2、50mg/m2-500mg/m2的剂量和100mg/m2、150mg/m2、200mg/m2、250mg/m2、300mg/m2、350mg/m2、400mg/m2或450mg/m2的剂量给予。还要认识到,
技术领域:
公知的和实证技术可用于测定合适的剂量。可按具体方案给予抗mfi2抗体或adc。总的来讲,将mfi2缀合物的有效剂量一次或多次给予受试者。更具体地讲,将adc的有效剂量一月一次、一月一次以上或一月一次以下给予受试者。在某些实施方案中,可多次给予mfi2抗体或adc的有效剂量,包括持续至少1个月、至少6个月、至少1、至少2年或几年的一段时间。在另外其它的实施方案中,在给予所公开的抗体或adc之间可间隔几天(2、3、4、5、6或7天)、几周(1、2、3、4、5、6、7或8周)或几个月(1、2、3、4、5、6、7或8个月)或甚至1年或几年。在一些实施方案中,涉及缀合的抗体的疗程可包括在数周或数月的时间内给予多剂所选的药品。更准确地说,可每天一次、每两天一次、每4天一次、每周一次、每10天一次、每两周一次、每3周一次、每月一次、每6周一次、每两月一次、每10周一次或每3月一次给予本发明的抗体或adc。在这一方面,应认识到,可根据患者反应和临床实践改变剂量或调整间隔。本发明还考虑了不连续给药或每日剂量分成几个部分给予。本发明的组合物和抗癌剂可隔日或隔周交替给予;或可给予一系列抗体治疗,接着抗癌剂疗法的一次或多次治疗。在任何情况下,正如本领域技术人员理解的,化疗剂的合适剂量一般可接近已用于临床疗法中的那些,其中化学疗法单独或与其它化学疗法组合给予。在另一个实施方案中,本发明的mfi2抗体或adc可用于维持疗法以降低或消除在疾病最初出现后肿瘤复发的机会。优选病症将得以治疗,最初的肿瘤块消除、减小或否则改善,使得患者无症状或在缓解中。此时,可一次或多次给予受试者药用有效量的所公开的抗体,即使采用标准诊断方法也几乎没有或没有疾病迹象。在另一个优选的实施方案中,本发明的调节剂可预防性使用或用作辅助疗法以预防或降低肿瘤减灭方法(debulkingprocedure)后肿瘤转移的可能性。如本公开内容所用,“肿瘤减灭方法”意指缩小或改善肿瘤或肿瘤增殖的任何程序、技术或方法。示例性肿瘤减灭方法包括但不限于手术、放射治疗(即光束放射)、化学疗法、免疫疗法或消融。可在本领域技术人员根据本公开内容容易确定的任何合适时间,按临床、诊断或诊断治疗方法的建议给予所公开的adc以降低肿瘤转移。本发明另外的其它实施方案包括将所公开的adc给予无症状但有发生癌症风险的受试者。也就是说,本发明的adc可以真正的预防意义使用,并可给予经检查或检测且有一个或多个明显的风险因子(例如基因组指征、家族史、体内或体外检验结果等)但未发生瘤形成的患者。以实验为依据确定所公开的治疗组合物在一次或多次给药的个体中的剂量和方案。例如,可给予个体递增剂量的如本文所述生产的治疗组合物。在精选的实施方案中,可分别根据以实验为依据确定或观察到的副作用或毒性,逐渐增加或降低或减少剂量。为了评价所选组合物的功效,按之前所述跟踪特定疾病、病症或病况的标志物。对于癌症,这些包括通过触诊或目测观察直接测量肿瘤大小,通过x射线或其它成像技术间接测量肿瘤大小;通过肿瘤样品的直接肿瘤活检和显微镜检查评价的改进;按照本文所述方法鉴定的间接肿瘤标志物(例如前列腺的psa)或致瘤抗原的测量、疼痛或麻痹的减轻;言语、视力、呼吸或与肿瘤有关的其它失能的改进;食欲增强;或通过公认的试验测量的生命质量提高或生存期延长。对本领域技术人员将显然的是,剂量将随个体、瘤性病况的类型、瘤性病况的阶段、瘤性病况是否开始转移到个体的其它部位和所采用的过往治疗和现行治疗而变化。c.组合疗法组合疗法可用于预防或治疗癌症和防止癌症的转移或复发。本文所用“组合疗法”,意指给予包含至少一种抗mfi2抗体或adc和至少一种治疗部分(例如抗癌剂)的组合,其中组合优选相对于以下在癌症治疗中具有治疗协同作用或改善可测量的治疗作用:(i)单独使用的抗mfi2抗体或adc,或(ii)单独使用的治疗部分,或(iii)使用治疗部分与另一种治疗部分组合而未加入抗mfi2抗体或adc。本文所用术语“治疗协同作用”意指抗mfi2抗体或adc和一种或多种治疗部分的组合具有大于抗mfi2抗体或adc和一种或多种治疗部分的组合的相加效应的治疗作用。通过与对照或基线测量比较,量化所公开的组合的所需结果。如本文所用,相对术语例如“改善”、“增加”或“降低”表明相对于对照例如在开始本文所述治疗之前同一个体的测量或在本文所述抗mfi2抗体或adc不存在但其它治疗部分(例如治疗护理标准)存在时对照个体(或多个对照个体)的测量的值。代表性对照个体是患有与接受治疗的个体相同的癌症的个体,其年龄与接受治疗的个体大致相同(以确保在受治疗个体和对照个体中疾病的阶段相当)。在响应疗法时的变化或改善一般是统计上显著的。本文所用术语“显著性”或“显著的”涉及两个或更多个实体之间存在非随机相关的概率的统计分析。为了测定关系是否是“显著的”或具有“显著性”,可计算“p值”。降至用户定义的截止点以下的p-值被视为显著。小于或等于0.1、小于0.05、小于0.01、小于0.005或小于0.001的p值可视为显著的。协同治疗作用可以是由单一治疗部分或抗mfi2抗体或adc诱导的治疗作用或由指定组合的抗mfi2抗体或adc或单一治疗部分诱导的治疗作用总和的至少约2倍或至少约5倍、或至少约10倍、或至少约20倍、或至少约50倍、或至少约100倍的作用。协同治疗作用还可记述为与单一治疗部分或抗mfi2抗体或adc诱导的治疗作用或由指定组合的抗mfi2抗体或adc或单一治疗部分诱导的治疗作用总和相比,治疗作用提高至少10%、或至少20%、或至少30%、或至少40%、或至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或至少100%或更高。协同作用还可为当它们组合使用时允许治疗剂的剂量减少的作用。在实施组合疗法时,抗mfi2抗体或adc和治疗部分可使用相同或不同的给药途径以单一组合物或作为两个或更多个不同的组合物同时给予受试者。或者,用抗mfi2抗体或adc治疗可在治疗部分治疗之前或之后经过例如范围为数分钟至数周的间隔。在一个实施方案中,在彼此约5分钟-约2周内给予治疗部分和抗体或adc两者。在另外其它的实施方案中,给予抗体和治疗部分之间可间隔几天(2、3、4、5、6或7天)、几周(1、2、3、4、5、6、7或8周)或几月(1、2、3、4、5、6、7或8个月)。可按不同的时间表例如每日一次、两次或三次、每2天一次、每3天一次、一周一次、每两周一次、每月一次、每2个月一次、每3个月一次、每6个月一次给予组合疗法直到病况得以治疗、减轻或治愈,或可同时给予组合疗法。抗体和治疗部分可隔天或隔周给予;或可给予一系列抗mfi2抗体或adc治疗,接着用其它治疗部分的一次或多次治疗。在一个实施方案中,给予与一种或多种治疗部分组合的抗mfi2抗体或adc持续短的治疗周期。在其它实施方案中,给予组合治疗持续长的治疗周期。组合疗法可通过任何途径给予。在精选的实施方案中,本发明的化合物和组合物可与限制点抑制剂例如pd-1抑制剂或pdl-1抑制剂联用。pd-1,连同其配体pd-l1,是抗肿瘤t淋巴细胞应答的负调节剂。在一个实施方案中,组合疗法可包括抗mfi2抗体或adc连同抗pd-1抗体(例如lambrolizumab、nivolumab、pidilizumab)和任选一种或多种其它治疗部分。在另一个实施方案中,组合疗法可包括抗mfi2抗体或adc连同抗pd-l1抗体(例如mpdl3280a、medi4736、msb0010718c)和任选一种或多种其它治疗部分。在又一个实施方案中,组合疗法可包括给予在用其它抗pd-1和/或定向braf组合疗法(例如伊匹木单抗和vemurafenib或dabrafinib)治疗后继续发展的患者抗mfi2抗体或adc连同抗pd-1抗体(例如pembrolizumab)。在一些实施方案中,抗mfi2抗体或adc可与各种一线癌症治疗联用。在一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和细胞毒性剂(例如异环磷酰胺、丝裂霉素c、长春地辛、长春碱、依托泊苷、伊立替康、吉西他滨、紫杉烷类(taxanes)、长春瑞滨、甲氨蝶呤和培美曲塞)和任选一种或多种其它治疗部分。在另一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和基于铂的药物(例如卡铂或顺铂)和任选一种或多种其它治疗部分(例如长春瑞滨;吉西他滨;紫杉烷类,例如多西他赛或紫杉醇;伊立替康或培美曲塞)。在一个实施方案中,例如在br-erpr、br-er或br-pr癌症的治疗中,组合疗法包括使用抗mfi2抗体或adc和描述为“激素疗法”的一种或多种治疗部分。本文所用“激素疗法”是指例如他莫昔芬;促性腺激素或促性腺素释放素(gnrh或lhrh);依维莫司和依西美坦;托瑞米芬;或芳香酶抑制剂(例如阿那曲唑、来曲唑、依西美坦或氟维司群)。在另一个实施方案中,例如在br-her2的治疗中,组合疗法包括使用抗mfi2抗体或adc和曲妥珠单抗或ado-trastuzumabemtansine和任选一种或多种其它治疗部分(例如培妥珠单抗和/或多西他赛)。在一些实施方案中,例如在转移性乳腺癌的治疗中,组合疗法包括使用抗mfi2抗体或adc和紫杉烷类(例如多西他赛或紫杉醇)和任选其它治疗部分,例如蒽环类(例如多柔比星或表柔比星)和/或eribulin。在另一个实施方案中,例如在转移性或复发性乳腺癌或brca突变型乳腺癌的治疗中,组合疗法包括使用抗mfi2抗体或adc和甲地孕酮和任选其它治疗部分。在进一步的实施方案中,例如在br-tnbc的治疗中,组合疗法包括使用抗mfi2抗体或adc和聚adp核糖聚合酶(parp)抑制剂(例如bmn-673、奥拉帕利、rucaparib和veliparib)和任选其它治疗部分。在另一个实施方案中,例如在乳腺癌的治疗中,组合疗法包括使用抗mfi2抗体或adc和环磷酰胺和任选其它治疗部分(例如多柔比星、紫杉烷类、表柔比星、5-fu和/或甲氨蝶呤。在另一个实施方案中,用于治疗egfr-阳性nsclc的组合疗法包括使用抗mfi2抗体或adc和afatinib和任选一种或多种其它治疗部分(例如埃罗替尼和/或贝伐单抗)。在另一个实施方案中,用于治疗egfr-阳性nsclc的组合疗法包括使用抗mfi2抗体或adc和埃罗替尼和任选一种或多种其它治疗部分(例如贝伐单抗)。在另一个实施方案中,用于治疗alk-阳性nsclc的组合疗法包括使用抗mfi2抗体或adc和ceritinib和任选一种或多种其它治疗部分。在另一个实施方案中,用于治疗alk-阳性nsclc的组合疗法包括使用抗mfi2抗体或adc和crizotinib和任选一种或多种其它治疗部分。在另一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和贝伐单抗和任选一种或多种其它治疗部分(例如紫杉烷类,例如多西他赛或紫杉醇;和/或铂类似物)。在另一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和贝伐单抗和任选一种或多种其它治疗部分(例如吉西他滨和/或铂类似物)。在一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和基于铂的药物(例如卡铂或顺铂)类似物和任选一种或多种其它治疗部分(例如紫杉烷类例如多西他赛和紫杉醇)。在一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和基于铂的药物(例如卡铂或顺铂)类似物和任选一种或多种其它治疗部分(例如紫杉烷类,例如多西他赛和紫杉醇和/或吉西他滨和/或多柔比星)。在一个具体的实施方案中,用于治疗耐铂肿瘤的组合疗法包括使用抗mfi2抗体或adc和多柔比星和/或依托泊苷和/或吉西他滨和/或长春瑞滨和/或异环磷酰胺和/或亚叶酸调节的5-氟尿嘧啶和/或贝伐单抗和/或他莫昔芬;和任选一种或多种其它治疗部分。在另一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和parp抑制剂和任选一种或多种其它治疗部分。在另一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和贝伐单抗和任选环磷酰胺。组合疗法可包括抗mfi2抗体或adc和对包含突变或异常表达的基因或蛋白质(例如brafv600e)的肿瘤(例如黑素瘤)是有效的化学治疗部分。t淋巴细胞(例如细胞毒性淋巴细胞(ctl))在针对恶性肿瘤的宿主防御中起重要作用。ctl可被抗原呈递细胞上的肿瘤相关抗原的呈现激活。特异性主动免疫疗法是可用于通过给患者接种来源于已知癌相关抗原的肽来提高对癌症的t淋巴细胞应答的方法。在一个实施方案中,组合疗法可包括抗mfi2抗体或adc和针对癌相关抗原(例如黑素细胞谱系特异性抗原酪氨酸酶、gp100、melan-a/mart-1或gp75)的疫苗。在其它实施方案中,组合疗法可包括给予抗mfi2抗体或adc连同自体ctl或天然杀伤细胞的体外扩增、激活和过继再引入。ctl活化还可通过加强抗原呈递细胞的肿瘤抗原呈现的策略来促进。粒细胞巨噬细胞集落刺激因子(gm-csf)促进树突细胞募集和树突细胞激活交叉引动(cross-priming)。在一个实施方案中,组合疗法可包括与抗mfi2抗体或adc和任选一个或多个不同的治疗部分组合使用的抗原呈递细胞的分离、用刺激细胞因子(例如gm-csf)激活所述细胞、用肿瘤相关抗原引动,然后将抗原呈递细胞过继再引入患者中。在一些实施方案中,抗mfi2抗体或adc可与不同的一线黑素瘤治疗组合使用。在一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和达卡巴嗪和任选一种或多种其它治疗部分。在其它的实施方案中,组合疗法包括使用抗mfi2抗体或adc和替莫唑胺和任选一种或多种其它治疗部分。在另一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和基于铂的药物治疗部分(例如卡铂或顺铂)和任选一种或多种其它治疗部分。在一些实施方案中,组合疗法包括使用抗mfi2抗体或adc和长春花属生物碱治疗部分(例如长春碱、长春瑞滨、长春新碱或长春地辛)和任选一种或多种其它治疗部分。在一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和白介素-2和任选一种或多种其它治疗部分。在另一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和干扰素-α和任选一种或多种其它治疗部分。在其它实施方案中,抗mfi2抗体或adc可与辅助黑素瘤治疗和/或手术操作(例如肿瘤切除术)组合使用。在一个实施方案中,组合疗法包括使用抗mfi2抗体或adc和干扰素-α和任选一种或多种其它治疗部分。本发明还提供抗mfi2抗体或adc与放射疗法的组合。本文所用术语“放射疗法”意指在肿瘤细胞内局部诱导dna损伤的任何机制,例如γ-辐射、x射线、uv-辐射、微波、电子发射等。还考虑了使用放射性同位素定向递送至肿瘤细胞的组合疗法,且可组合地或作为本文公开的抗mfi2抗体的缀合物使用。通常在约1-约2周的时间内,脉冲式地给予放射疗法。任选可作为单剂量或作为多个连续剂量给予放射疗法。在其它实施方案中,抗mfi2抗体或adc可与下述化疗剂的一种或多种组合使用。d.抗癌剂本文所用术语“抗癌剂”或“化疗剂”是“治疗部分”的一个亚类,其进而是描述为“药物活性部分”的作用剂的亚类。更具体地讲,“抗癌剂”意指可用于治疗细胞增殖性病症例如癌症的任何作用剂,包括但不限于细胞毒性剂、细胞生长抑制剂、抗血管生成剂、肿瘤减灭剂、化疗剂、放射疗法和放射治疗剂、靶向抗癌剂、生物应答调节剂、治疗抗体、癌症疫苗、细胞因子、激素疗法、抗转移剂和免疫治疗剂。应认识到,在上述精选的实施方案中,这类抗癌剂可包含缀合物,并可在给药前与抗体缀合。在某些实施方案中,所公开的抗癌剂可与抗体连接以提供本文所述的adc。术语“细胞毒性剂”,其也可是抗癌剂,是指对细胞有毒性并降低或抑制细胞功能和/或引起细胞破坏的物质。通常,物质是来源于生活有机体的天然存在的分子(或合成产生的天然产物)。细胞毒性剂的实例包括但不限于小分子毒素或细菌(例如白喉毒素、假单胞菌内毒素和外毒素、葡萄球菌性肠毒素a)、真菌(例如α-帚曲霉素、局限曲菌素)、植物(例如相思豆毒蛋白、蓖麻毒蛋白、塑莲根毒蛋白、槲寄生毒蛋白、商陆抗病毒蛋白、皂草素、多花白树毒蛋白、单根菌素、天花粉蛋白、大麦毒素、油桐(aleuritesfordii)蛋白、石竹素蛋白、美洲商陆(phytolaccamericana)蛋白(papi、papii和pap-s)、苦瓜抑制物、麻风树毒蛋白、巴豆毒蛋白、肥皂草(saponariaofficinalis)抑制物、mitegellin、局限曲菌素、酚霉素、新霉素和单端胞菌毒素)或动物(例如细胞毒性rna酶,例如胞外胰腺rna酶;dnasei,包括其片段和/或变体)的酶促活性毒素。抗癌剂可包括抑制或被设计成抑制癌性细胞或可能变成癌性或产生致瘤性子代(例如致瘤细胞)的细胞的任何化学剂。所述化学剂常常指向细胞生长或分裂所必需的胞内过程,因此特别有效地针对一般快速生长和分裂的癌性细胞。例如长春新碱使微管解聚,因此抑制细胞进入有丝分裂。这类作用剂被经常给予,并且常常在组合(例如在制剂chop)中最有效。此外,在精选的实施方案中,所述抗癌剂可与所公开的抗体缀合以提供adc。可与本发明的抗体组合(或与之缀合)使用的抗癌剂的实例包括但不限于烷化剂、烷基磺酸酯、阿那曲唑、鹅膏蕈素、吖丙啶、乙烯亚胺和methylamelamines、acetogenins、喜树碱、bez-235、硼替佐米、苔藓抑素、callystatin、cc-1065、ceritinib、crizotinib、念珠藻环肽、多拉司他汀、倍癌霉素、艾榴素、埃罗替尼、pancratistatin、匍枝珊瑚醇、spongistatin、氮芥、抗生素、enediynedynemicin、二膦酸盐类、埃斯波霉素、色蛋白烯二炔类抗生素发光团、阿克拉霉素、放线菌素、authramycin、偶氮丝氨酸、博来霉素、c放线菌素、坎磷酰胺、carabicin、去甲柔红霉素、嗜癌霉素、chromomycinis、环磷酰胺、d放线菌素、柔红霉素、地托比星、6-重氮基-5-oxo-l-正亮氨酸、多柔比星、表柔比星、依索比星、依西美坦、氟尿嘧啶、氟维司群、依吉非替尼、伊达比星、拉帕替尼、来曲唑、氯那法尼、马赛罗霉素、醋酸甲地孕酮、丝裂霉素、麦考酚酸、诺拉霉素、橄榄霉素、帕唑帕尼、培洛霉素、紫菜霉素、嘌罗霉素、三铁阿霉素、雷帕霉素、罗多比星、索拉非尼、链黑霉素、链佐星、他莫昔芬、枸橼酸他莫昔芬、替莫唑胺、tepodina、替匹法尼、杀结核菌素、乌苯美司、凡德他尼、伏氯唑、xl-147、净司他丁、佐柔比星;抗代谢物、叶酸类似物、嘌呤类似物、雄激素、抗肾上腺素(anti-adrenals)、叶酸补充物例如frolinicacid、醋葡醛内酯、醛磷酰胺糖苷、氨基乙酰丙酸、恩尿嘧啶、安吖啶、bestrabucil、比生群、依达曲沙、defofamine、秋水仙胺、地吖醌、elfornithine、依利醋铵、埃坡霉素、依托格鲁、硝酸镓、羟基脲、香菇多糖、氯尼达明(lonidainine)、类美登素、米托胍腙、米托蒽醌、莫哌达醇、尼曲吖啶、喷司他丁、蛋氨氮芥、吡柔比星、洛索蒽醌、鬼臼酸、2-乙基酰肼、丙卡巴肼、多糖复合体、雷佐生、利索新、sf-1126、西佐喃、锗螺胺、细交链孢菌酮酸、三亚胺醌、2,2',2"-三氯三乙胺、单端孢菌霉素类(t-2毒素、verracurina、杆孢菌素a和anguidine)、乌拉坦、长春地辛、达卡巴嗪、甘露莫司汀、二溴甘露醇、二溴卫矛醇、哌泊溴烷、gacytosine、阿拉伯糖苷c、环磷酰胺、塞替派、紫杉醇类、苯丁酸氮芥(chloranbucil)、吉西他滨、6-硫鸟嘌呤、巯基嘌呤、甲氨蝶呤、铂类似物、长春碱、铂、依托泊苷、异环磷酰胺、米托蒽醌、长春新碱、长春瑞滨、诺安托、替尼泊苷、依达曲沙、道诺霉素、道诺霉素、希罗达、伊班膦酸盐、伊立替康、拓扑异构酶抑制剂rfs2000、二氟甲基鸟氨酸、类视黄醇、卡培他滨、康普瑞汀、亚叶酸、奥沙利铂、xl518、pkc-α抑制剂、raf、h-ras、降低细胞增殖的egfr和vegf-a和上述任一种的可药学可接受的盐或溶剂合物、酸或衍生物。该定义还包括对肿瘤起调节或抑制激素作用的抗激素剂,例如抗雌激素类和选择性雌激素受体抗体;抑制酶芳香酶的芳香酶抑制剂,其调节肾上腺中的雌激素产生;和抗雄激素;以及曲沙他滨(一种1,3-二氧杂环戊烷核苷胞嘧啶类似物);反义寡核苷酸、核酶例如vegf表达抑制剂和her2表达抑制剂;疫苗,proleukin®ril-2;lurtotecan®拓扑异构酶1抑制剂;abarelix®rmrh;长春瑞滨和埃斯波霉素和上述任一种的可药学可接受的盐或溶剂合物、酸或衍生物。抗癌剂包含市购或临床可获得的化合物例如埃罗替尼(tarceva®,genentech/osipharm.)、多西他赛(taxotere®,sanofi-aventis)、5-fu(氟尿嘧啶、5-氟尿嘧啶、cas编号51-21-8)、吉西他滨(gemzar®,lilly)、pd-0325901(cas编号391210-10-9,pfizer)、顺铂(顺式二氯二胺合铂(ii),cas编号15663-27-1)、卡铂(cas编号41575-94-4)、紫杉醇(taxol®,bristol-myerssquibboncology,princeton,n.j.)、曲妥珠单抗(herceptin®,genentech)、替莫唑胺(4-甲基-5-氧代-2,3,4,6,8-五氮杂二环[4.3.0]九-2,7,9-三烯-9-甲酰胺,cas编号85622-93-1,temodar®,temodal®,scheringplough)、他莫昔芬((z)-2-[4-(1,2-二苯基丁-1-烯基)苯氧基]-n,n-二甲基乙胺、nolvadex®、istubal®、valodex®)和多柔比星(adriamycin®)。其它市购或临床可获得的抗癌剂包含奥沙利铂(eloxatin®,sanofi),硼替佐米(velcade®,millenniumpharm.)、sutent(sunitinib®,su11248,pfizer)、来曲唑(femara®,novartis)、甲磺酸伊马替尼(gleevec®,novartis)、xl-518(mek抑制剂,exelixis,wo2007/044515)、arry-886(mek抑制剂,azd6244,arraybiopharma,astrazeneca)、sf-1126(pi3k抑制剂,semaforepharmaceuticals)、bez-235(pi3k抑制剂,novartis)、xl-147(pi3k抑制剂,exelixis)、ptk787/zk222584(novartis)、氟维司群(faslodex®,astrazeneca)、亚叶酸(亚叶酸)、雷帕霉素(西罗莫司、rapamune®,wyeth)、拉帕替尼(tykerb®、gsk572016,glaxosmithkline)、氯那法尼(sarasar™、sch66336,scheringplough)、索拉非尼(nexavar®,bay43-9006,bayerlabs)、依吉非替尼(iressa®,astrazeneca)、伊立替康(camptosar®、cpt-11,pfizer)、替匹法尼(zarnestra™,johnson&johnson)、abraxane™(cremophor-free)、紫杉醇的白蛋白工程改造纳米粒剂(americanpharmaceuticalpartners,schaumberg,il)、凡德他尼(rinn、zd6474、zactima®,astrazeneca)、苯丁酸氮芥(chloranmbucil)、ag1478、ag1571(su5271;sugen)、坦罗莫司(torisel®,wyeth)、帕唑帕尼(glaxosmithkline)、坎磷酰胺(telcyta®,telik)、塞替派和环磷酰胺(cytoxan®,neosar®)、长春瑞滨(navelbine®)、卡培他滨(希罗达®,roche)、他莫昔芬(包括nolvadex®、枸橼酸他莫昔芬、fareston®(枸橼酸托瑞米芬)、megase®(醋酸甲地孕酮)、aromasin®(依西美坦;pfizer)、福美坦(formestanie)、法倔唑(fadrozole)、rivisor®(伏氯唑)、femara®(来曲唑;novartis)和arimidex®(阿那曲唑;astrazeneca)。术语“药学上可接受的盐”或“盐”意指分子或大分子的有机或无机盐。酸加成盐可用氨基形成。示例性盐包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、单宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(即1、1′亚甲基二-(2-羟基3-萘甲酸盐))。药学上可接受的盐可包括另一分子例如乙酸根离子、琥珀酸根离子或其它反荷离子的纳入。反荷离子可以是稳定母体化合物的电荷的任何有机或无机部分。此外,药学上可接受的盐可在结构中具有一个以上带电原子。在多个带电荷原子是药学上可接受的盐的部分时,盐可具有多个反荷离子。因此,药学上可接受的盐可具有一个或多个带电原子和/或一个或多个反荷离子。“药学上可接受的溶剂合物”或“溶剂合物”是指一个或多个溶剂分子与分子或大分子的缔合。形成药学上可接受的溶剂合物的溶剂的实例包括但不限于水、异丙醇、乙醇、甲醇、dmso、乙酸乙酯、乙酸和乙醇胺。在其它实施方案中,本发明的抗体或adc可与存在于临床试验或市购可获得的许多抗体(或免疫治疗剂)的任一种组合使用。所公开的抗体可选自以下的抗体组合使用:abagovomab、阿德木单抗、afutuzumab、阿仑珠单抗、阿妥莫单抗、amatuximab、anatumomab、阿西莫单抗、atezolizumab、巴士昔单抗、贝妥莫单抗、贝伐单抗、比伐单抗、blinatumomab、brentuximab、cantuzumab、卡妥索单抗、西妥昔单抗、citatuzumab、cixutumumab、clivatuzumab、可那木单抗、daratumumab、drozitumab、duligotumab、dusigitumab、地莫单抗、dacetuzumab、dalotuzumab、依美昔单抗、elotuzumab、ensituximab、厄马索单抗、etaracizumab、farletuzumab、ficlatuzumab、figitumumab、flanvotumab、futuximab、ganitumab、吉妥珠单抗、girentuximab、glembatumumab、ibritumomab、伊戈伏单抗、imgatuzumab、indatuximab、inotuzumab、intetumumab、伊匹木单抗、伊妥木单抗、拉贝珠单抗、lambrolizumab、来沙木单抗、林妥珠单抗、lorvotuzumab、lucatumumab、马帕木单抗、马妥珠单抗、milatuzumab、minretumomab、米妥莫单抗、moxetumomab、narnatumab、naptumomab、necitumumab、尼妥珠单抗、nivolumab、奥法本单抗、obinutuzumab、ocaratuzumab、奥法本单抗、olaratumab、奥拉帕利、onartuzumab、oportuzumab、奥戈伏单抗、帕尼单抗、parsatuzumab、patritumab、pembrolizumab、pemtumomab、培妥珠单抗、pidilizumab、pintumomab、普立木单抗、racotumomab、radretumab、ramucirumab、rilotumumab、利妥昔单抗、robatumumab、沙妥莫单抗、selumetinib、西罗珠单抗、siltuximab、simtuzumab、solitomab、钇[90y]他珠单抗、taplitumomab、tenatumomab、teprotumumab、替加珠单抗、托西莫单抗、曲妥珠单抗、tucotuzumab、ublituximab、veltuzumab、vorsetuzumab、伏妥莫单抗、扎芦木单抗、cc49、3f8、mdx-1105和medi4736和其组合。其它实施方案包括使用获准用于癌症疗法的抗体,包括但不限于利妥昔单抗、吉妥珠单抗奥佐米星、阿仑珠单抗、替伊莫单抗、托西莫单抗、贝伐单抗、西妥昔单抗、patitumumab、奥法本单抗、伊匹木单抗和brentuximabvedotin。本领域技术人员能够容易地鉴定与本文的教导内容相容的其它抗癌剂。e.放射疗法本发明还提供抗体或adc与放射疗法(即在肿瘤细胞内局部诱导dna损伤的任何机制,例如γ-辐射、x射线、uv-辐射、微波、电子发射等)的组合。还考虑了使用将放射性同位素定向递送至肿瘤细胞的组合疗法,并且所公开的抗体或adc可与靶向抗癌剂或其它靶向方法联用。通常,在约1-约2周的一段时间内脉冲式地给予放射疗法。可将放射疗法给予患有头颈癌的受试者持续约6-7周。任选放射疗法可作为单剂量或作为多个连续剂量给予。viii.适应征本发明提供使用本发明的抗体和adc诊断、治疗诊断、治疗和/或预防各种病症,包括瘤性、炎性、血管生成性和免疫性病症和由病原体引起的病症。在某些实施方案中,待治疗的疾病包括瘤性病况(包含实体瘤)。在其它实施方案中,待治疗的疾病包括恶性血液病。在某些实施方案中,本发明的抗体或adc可用来治疗表达mfi2决定簇的肿瘤或致瘤细胞。优选待治疗的“受试者”或“患者”可为人,但本文所用术语明确适于包括任何哺乳动物物种。按照本发明治疗的瘤性病况受试者可以是良性或恶性的实体瘤或恶性血液病;可选自包括但不限于:肾上腺肿瘤、aids相关癌症、软组织腺泡状肉瘤、星形细胞、自主神经节肿瘤、膀胱癌(鳞状细胞癌和移行细胞癌)、囊胚腔病症、骨癌(成釉细胞瘤、动脉瘤性骨囊肿、骨软骨瘤、骨肉瘤)、脑和脊髓癌、转移性脑肿瘤、乳腺癌、颈动脉体肿瘤、宫颈癌、软骨肉瘤、脊索瘤、嫌色肾细胞癌、透明细胞癌、结肠癌、结肠直肠癌、良性皮肤纤维组织细胞瘤、促结缔组织增生性小圆细胞肿瘤、室管膜瘤、上皮病症、尤因瘤(ewing'stumor)、骨外粘液样软骨肉瘤、骨不完全性纤维发生、骨纤维结构不良、胆囊和胆管癌、胃癌、胃肠癌、妊娠滋养细胞疾病、生殖细胞瘤、腺体病症、头颈癌、下丘脑癌、肠癌、胰岛细胞瘤、卡波西肉瘤(kaposi'ssarcoma)肾癌(肾母细胞瘤、乳头状肾细胞癌)、白血病、脂肪瘤/良性脂肪瘤性肿瘤、脂肉瘤/恶性脂肪瘤性肿瘤、肝癌(肝胚细胞瘤、肝细胞癌)、淋巴瘤、肺癌(小细胞癌、腺癌、鳞状细胞癌、小细胞癌等)、巨噬细胞性病症、成神经管细胞瘤、黑素瘤、脑膜瘤、多发性内分泌肿瘤、多发性骨髓瘤、骨髓增生异常综合征、成神经细胞瘤、神经内分泌肿瘤、卵巢癌、胰腺瘤、乳头状甲状腺癌、甲状旁腺肿瘤、儿科癌症、外周神经鞘肿瘤、嗜铬细胞瘤、垂体肿瘤、前列腺、后葡萄膜黑色素瘤、罕见血液病症、肾转移癌、横纹肌样瘤、横纹肌肉瘤、肉瘤、皮肤癌、软组织肉瘤、鳞状细胞癌、胃癌、基质病症、滑膜肉瘤、睾丸癌、胸腺癌、胸腺瘤、甲状腺转移癌和子宫癌(宫颈癌、子宫内膜癌和平滑肌瘤)。在某些实施方案中,本发明的化合物和组合物可用作第一线疗法并给予之前未针对癌症病况治疗的受试者。在其它实施方案中,本发明的化合物和组合物可用来治疗之前已经治疗(用本发明的抗体或adc或其它抗癌剂)并且复发或确定为对之前的治疗不应的受试者。在精选的实施方案中,本发明的化合物和组合物可用于治疗有复发性肿瘤的受试者。在某些精选的实施方案中,待治疗的增殖性病症可包含实体瘤,包括但不限于肾上腺癌、肝癌、肾癌、膀胱癌、乳腺癌、胃癌、卵巢癌、宫颈癌、子宫癌、食道癌、结肠直肠癌、前列腺癌、胰腺癌、肺癌(小细胞和非小细胞两者)、甲状腺癌、癌、肉瘤、成胶质细胞瘤和各种头颈肿瘤。在其它精选实施方案中,且如下文实施例所述,所公开的抗体药物缀合物在治疗乳腺癌(包括三阴性乳腺癌)时特别有效。在某些实施方案中,乳腺癌包含br-基底样、br-her2、br-luma、br-lumb或br不明确的肿瘤,在一个实施方案中,患有乳腺癌的受试者是难治疗的、复发的或对用选自以下药物治疗有抗性:卡培他滨(例如希罗达)、卡铂(例如paraplatin)、顺铂(例如platinol)、环磷酰胺(例如neosar)、多西他赛(例如docefrez或taxotere)、多柔比星(例如adriamycin)、聚乙二醇化多柔比星脂质体(例如doxil)、表柔比星(例如ellence)、氟尿嘧啶(例如5-fu或adrucil)、吉西他滨(例如gemzar)、甲氨蝶呤、紫杉醇(例如taxol)、蛋白质结合的紫杉醇(例如abraxane)、长春瑞滨(例如navelbine)、eribulin(例如halaven)和伊沙匹隆(例如ixempra)。在其它实施方案中,受试者患有用选自以下一种或多种药物治疗后发生的复发性乳腺肿瘤:卡培他滨(例如希罗达)、卡铂(例如paraplatin)、顺铂(例如platinol)、环磷酰胺(例如neosar)、多西他赛(例如docefrez或taxotere)、多柔比星(例如adriamycin)、聚乙二醇化多柔比星脂质体(例如doxil)、表柔比星(例如ellence)、氟尿嘧啶(例如5-fu或adrucil)、吉西他滨(例如gemzar)、甲氨蝶呤、紫杉醇(例如taxol)、蛋白质结合的紫杉醇(例如abraxane)、长春瑞滨(例如navelbine)、eribulin(例如halaven)和伊沙匹隆(例如ixempra)。在另外其它的优选实施方案中,可将化合物或组合物给予患有黑素瘤的受试者。更概括地讲,本文公开的组合物和方法可用于诊断、监测、治疗或预防黑素瘤。本文所用术语“黑素瘤”包括所有类型的黑素瘤,包括但不限于原发性黑素瘤、恶性黑素瘤、皮肤黑素瘤、真皮外黑素瘤、浅表扩散性黑素瘤、息肉型黑素瘤、黑素癌、黑素上皮癌、黑素肉瘤、原位黑素瘤、结节性恶性黑素瘤、恶性雀斑样痣黑素瘤、雀斑性黑素瘤、雀斑性恶性黑素瘤、粘膜雀斑性黑素瘤、粘膜黑素瘤、肢端雀斑性黑素瘤、软组织黑素瘤、眼黑素瘤、侵润性黑素瘤、家族性非典型痣和黑素瘤(fam-m)综合征、促结缔组织增生性恶性黑素瘤或葡萄膜黑色素瘤。转移性黑素瘤可来源于黑素细胞、黑素细胞痣或发育不良痣,并且肿瘤进程的不同阶段发展(例如径向生长期或纵向生长期。黑素瘤可由染色体异常、变性性生长和/或发育障碍、促有丝分裂剂(mitogenicagent)、紫外放射疗法、病毒感染、致癌物、基因的各种遗传突变或异常表达引起。在其它实施方案中,所公开的抗体和adc在治疗肺癌(包括下列亚型)时尤其有效:小细胞肺癌和非小细胞肺癌(例如鳞状细胞非小细胞肺癌或鳞状细胞小细胞肺癌)。在精选的实施方案中,可将抗体和adc给予患者显示局限期疾病或广泛期疾病。在其它实施方案中,可将所公开的缀合抗体给予难治性患者(即在完成最初疗法的疗程期间或不久其疾病复发的患者);敏感患者(即在最初疗法后2-3个月以后复发的患者);或显示对基于铂的药剂(例如卡铂、顺铂、奥沙利铂)和/或紫杉烷类(例如多西他赛、紫杉醇、拉罗他赛或卡巴他赛)有抗性的患者。至于恶性血液病,应进一步认识到,本发明的化合物和方法在治疗包括以下在内的各种b细胞淋巴瘤时可特别有效:低级别/nhl滤泡细胞淋巴瘤(fcc)、套细胞淋巴瘤(mcl)、弥散性大细胞淋巴瘤(dlcl)、小淋巴细胞(sl)nhl、中等级别/滤泡性nhl、中等级别弥散性nhl、高级别免疫母细胞nhl、高级别成淋巴细胞nhl、高级别非核裂细胞细胞nhl、bulky疾病nhl、瓦尔登斯特伦巨球蛋白血症、淋巴浆细胞淋巴瘤(lpl)、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)、弥散性大细胞淋巴瘤(dlcl)、伯基特淋巴瘤(burkitt'slymphoma,bl)、aids相关淋巴瘤、单核细胞b细胞淋巴瘤、血管免疫母细胞性淋巴结病、小淋巴细胞、滤泡性、弥散性大细胞、弥散性小核裂细胞、大细胞免疫母细胞成淋巴细胞瘤、小非核裂、伯基特和非伯基特、滤泡性、主要大细胞;滤泡性、主要小核裂细胞;和滤泡性、小核裂和大细胞淋巴瘤。参见gaidono等,"lymphomas",载于cancer:principles&practiceofoncology,第2卷:2131-2145(devita等编辑,5.sup.thed.1997)。对本领域技术人员而言应是明显的是,因分类系统变化所致,这些淋巴瘤常常具有不同的名称,并且患有用不同名称分类的淋巴瘤的患者也可获益于本发明的组合治疗方案。ix.制品本发明包括包含一个或多个容器的药包和药盒,其中容器可包含本发明的抗体或adc的一个或多个剂量。在某些实施方案中,药包或药盒含有单位剂量,这意味着包含例如含或不含一种或多种其它药剂和任选一种或多种抗癌剂的本发明的抗体或adc的预定的量的组合物。本发明的药盒一般可在合适的容器中含有本发明的抗体或adc的药学上可接受的制剂和任选在相同或不同的容器中的一种或多种抗癌剂。药盒还可含有其它药学上可接受的制剂或装置用于诊断或组合疗法。诊断装置或仪器的实例包括可用来检测、监测、定量测定或概况分析与增殖性病症有关的细胞或标志物的那些(有关所述标志物的完整列表见上文)。在一些实施方案中,装置可用于体内或体外检测、监测和/或定量测定循环的肿瘤细胞(参见例如wo2012/0128801)。在另外其它的实施方案中,循环的肿瘤细胞可包含致瘤细胞。本发明考虑的药盒还可含有将本发明的抗体或adc与抗癌剂或诊断剂混合的合适试剂(例如参见u.s.p.n.7,422,739)。当药盒的组分以一种或多种液体溶液剂提供时,液体溶液剂可以是非水性的,然而,优选水性溶液剂,其中无菌水性溶液是其中的一类。药盒中的制剂还可作为在加入适当液体时可复溶的干粉或冻干形式提供。用于复溶的液体可包含在单独的容器中。这类液体制剂可包含无菌的药学上可接受的缓冲剂或其它稀释剂,例如注射用抑菌水、磷酸盐缓冲盐水、林格氏液或葡萄糖溶液。在药盒包含与其它治疗药或药剂组合的本发明的抗体或adc时,溶液可以摩尔当量组合或以一种组分超过另一种预先混合。或者,在给予患者前,本发明的抗体或adc和任何任选的抗癌剂或其它药剂可分别保存在不同的容器中。药盒可包含一个或多个容器和标签或包装说明书,其在容器中或附在容器上,表明所装组合物用于诊断或治疗所选的疾病状况。合适的容器包括例如瓶、小瓶、注射器等。容器可由各种材料(例如玻璃或塑料)制成。容器可包含无菌接口,例如容器可以是具有可被皮下注射针刺穿的塞子的静脉内溶液袋或小瓶。在一些实施方案中,药盒可含有籍以将抗体和任何任选的组分给予患者的工具,例如一个或多个针或注射器(预灌装或空的)、滴管、吸管或其它这类装置,可从中将制剂注射或引入受试者中或施用于机体的患病部位。本发明的试剂盒通常还可包括用于装小瓶的工具等,以及在封闭密封中用于市售的其它组分,例如将所需的小瓶和其它器械装入和保存在其中的吹塑塑料容器。x.其它除非本文另有定义,否则与本发明联用的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非文中另有要求,否则单数术语应包括复数形式,复数术语应包括单数形式。另外,说明书和随附权利要求书提供的范围包括终点和终点之间的全部点两者。因此,2.0-3.0的范围包括2.0、3.0及2.0和3.0之间的全部点。总的来讲,本文所述细胞和组织培养技术、分子生物学、免疫学、微生物学、遗传学和化学是众所周知的并常用于本领域。本文采用的与所述技术有关的命名法也常用于本发明。本发明的方法和技术一般按照本领域众所周知的和本说明书中引用的各种参考文献中描述的常规方法进行,除非另有说明。xi.参考文献本文引述的所有专利、专利申请和出版物及电子可获得资料(包括例如genbank和refseq的核苷酸序列提交和例如swissprot、pir、prf、pbd的氨基酸序列提交和来自genbank和refseq的中注释编码区的翻译)的完全公开内容均通过引用予以结合,不论与具体参考文献有关时是否使用短语“通过引用予以结合”。前面的详细描述和随后的实施例只为了清楚理解提供。不得理解为因此必受限制。本发明不限于所示和所描述的确切细节。对本领域技术人员而言是显然的变化包括由权利要求书限定的本发明中。本文使用的任何章节标题仅出于组织目的,不得解释为限制所述主题。xii.序列表概况本申请所附的为包含许多核酸和氨基酸序列的序列表。下表3提供所包括的序列的概况。表3seqidno描述1κ轻链恒定区蛋白2igg1重链恒定区蛋白3mfi2的氨基酸序列(登记号np_005920)4-19保留的20sc57.1vldna21sc57.1vl蛋白22sc57.1vhdna23sc57.1vh蛋白24-91其它鼠克隆92-95hsc57.5人源化克隆(dna和蛋白质)96-97hsc57.5v1人源化克隆vh(dna和蛋白质)98-101hsc57.32人源化克隆(dna和蛋白质)102-103hsc57.32v1人源化克隆vh(dna和蛋白质)104-107hsc57.43人源化克隆(dna和蛋白质)108hsc57.5全长轻链蛋白质(对于hsc57.5v1和hsc57.5ss1相同)109hsc57.5全长重链蛋白110hsc57.5v1ss1全长重链蛋白111hsc57.5v1全长重链蛋白112hsc57.32全长轻链蛋白(对于hsc57.32v1和hsc57.32ss1相同)113hsc57.32全长重链蛋白114hsc57.32ss1全长重链蛋白115hsc57.32v1全长重链蛋白116hsc57.43全长轻链蛋白(对于hsc57.43ss1相同)117hsc57.43全长重链蛋白118hsc57.43ss1全长重链蛋白119-121hsc57.5的cdrl1、cdrl2、cdrl3(对于hsc57.5v1和hsc57.5v1ss1相同)122hsc57.5的cdrh1(对于hsc57.5v1和hsc57.5v1ss1相同)123hsc57.5的cdrh2124hsc57.5v1的cdrh2(对于hsc57.5v1ss1相同)125hsc57.5的cdrh3(对于hsc57.5v1和hsc57.5v1ss1相同)126-128hsc57.32的cdrl1、cdrl2、cdrl3(对于hsc57.32ss1和hsc57.32v1相同)129-131hsc57.32的cdrh1、cdrh2、cdrh3(对于hsc57.32ss1和hsc57.32v1相同)132-134hsc57.43的cdrl1、cdrl2、cdrl3(对于hsc57.43ss1相同)135-137hsc57.43的cdrh1、cdrh2、cdrh3(对于hsc57.43ss1相同)xiii.实施例通过参照下面的实施例更容易理解上文概括描述的本发明,所述实施例通过举例说明提供,并无意限制本发明。实施例无意表示以下实验是所进行的全部或仅有的实验。除非另有说明,否则分数是以重量计的分数,分子量是重量平均分子量,温度以摄氏度为单位,而压力为大气压或接近大气压。pdx肿瘤细胞类型通过缩写词接着数字标示,其表示特定的肿瘤细胞系。受测样品的传代数通过样品名称所附p0-p#表示,其中p0表示直接获自患者肿瘤的未传代样品,p#表示肿瘤在测试前已通过小鼠传代的次数。如本文所用,如下由表4显示肿瘤类型和亚型的缩写词:表4肿瘤类型缩写词肿瘤亚型缩写词膀胱bd乳腺br基底样br-基底样雌激素受体阳性和/或黄体酮受体阳性br-erprerbb2/neu阳性br-erbb2/neuher2阳性br-her2三阴性tnbc管腔abr-luma管腔bbr-lumb三阴性的密蛋白亚型tnbc-cl密蛋白低br-cldn-低正常样br-nl宫颈cer结肠直肠cr直肠腺癌re-ad子宫内膜em食道es胃ga弥散性腺癌ga-ad-dif/muc肠腺癌ga-ad-int间质肿瘤ga-gist成胶质细胞瘤gb头颈hn肾kdy透明肾细胞癌kdy-cc乳头状肾细胞癌kdy-pap移行细胞或泌尿道上皮癌kdy-uro未知kdy-unk肝liv肝细胞癌liv-hcc胆管癌liv-chol淋巴瘤ln肺lu腺癌lu-ad类癌瘤lu-car大细胞神经内分泌lu-lcc非小细胞nsclc鳞状细胞lu-scc小细胞sclc梭形细胞lu-spc卵巢ov透明细胞ov-cc子宫内膜样ov-end混合亚型ov-mix恶性混合中胚层ov-mmmt粘蛋白性ov-muc神经内分泌ov-net乳头状浆液性ov-ps浆液性ov-s小细胞ov-sc移行细胞癌ov-tcc胰腺pa腺泡细胞癌pa-acc十二指肠癌pa-dc粘蛋白性腺癌pa-mad神经内分泌pa-net腺癌pa-pac腺癌外分泌类型pa-pace导管腺癌pa-pdac壶腹状腺癌pa-aac前列腺pr皮肤sk黑素瘤mel鳞状细胞癌sk-scc葡萄膜黑色素瘤uvm睾丸tes甲状腺thy髓质甲状腺癌mtc实施例1使用全转录物组测序鉴定mfi2表达为了表征实体瘤在存在于癌症患者中时的细胞异质性和在临床上鉴定相关治疗靶标,研发了大型pdx肿瘤库,并采用
技术领域:
公知的技术维持。通过使用最初获自受累于各种恶性实体瘤的癌症患者中的肿瘤细胞的多次传代,使包含大量不相关的肿瘤细胞系的pdx肿瘤库在无免疫应答的小鼠中增殖。低传代pdx肿瘤代表了在其天然环境中的肿瘤,为驱动肿瘤生长的基础机制和对现有疗法的抗性提供临床相关见解。可将肿瘤细胞大体分成细胞亚群的两个类型:非致瘤细胞(ntg)和肿瘤引发细胞(tic)。tic当植入无免疫应答的小鼠中时具有形成肿瘤的能力。癌干细胞(csc)是能够无限自我复制同时保持多谱系分化的能力的tic的亚型。ntg虽然有时体内能够生长,但当移植时不会形成重现原始肿瘤异质性的肿瘤。为了进行全转录物组分析,当来自肿瘤库的pdx肿瘤达到800-2,000mm3后,将其从小鼠中切除。采用
技术领域:
公知的酶促消化技术,将切下的pdx肿瘤解离成单细胞悬液(参见例如u.s.p.n.2007/0292414)。将解离的整块肿瘤细胞与4',6-二脒基-2-苯基吲哚(dapi)一起孵育以检测死细胞、与抗小鼠cd45和h-2kd抗体一起孵育以鉴定小鼠细胞、与抗人epcam抗体一起孵育以鉴定人细胞。此外,将肿瘤细胞与荧光缀合的抗人cd46和/或cd324抗体一起孵育以鉴定cd46hicd324+csc或cd46lo/-cd324-ntg细胞,然后采用facsaria细胞分选仪(bdbiosciences)分选(参见u.s.p.n2013/0260385、2013/0061340和2013/0061342)。通过将细胞在补充1%2-巯基乙醇的rltplusrna裂解缓冲液(qiagen)中裂解,从肿瘤细胞中提取rna,将裂解物在-80℃下冷冻,然后使用rneasy分离试剂盒(qiagen)使裂解物融化用于rna提取。使用nanodrop分光光度计(thermoscientific)和/或bioanalyzer2100(agilent技术)定量测量rna。正常组织rna购自不同来源(lifetechnologies、agilent、sciencell、biochain和clontech)。通过遗传测序和基因表达分析评价所得的总rna制备物。高质量rna的全转录物组测序使用不种不同的系统进行。通过oligoligation/detection(solid)4.5或solid5500xl新一代测序系统(lifetechnologies),采用appliedbiosystems(abi)测序分析某些br和skpdx肿瘤样品。采用illuminahiseq2000或2500新一代测序系统(illumina)分析lupdx肿瘤样品。采用针对低输入总rna设计的来自abi的改进的全转录物组方案或ovationrna-seqsystemv2™(nugentechnologies),由来自分选的br或整个sk肿瘤样品的1ngrna产生的cdna,进行solid全转录物组分析。使所得cdna文库片段化,加入条码衔接子(barcodeadapter)以允许在测序运行期间从不同的样品中合并片段文库。将应用已公布的人基因组的ncbihg19.2版通过solid平台产生的数据映射至用refseq47版注释的34,609个基因,并在大多数样品中提供可证实的rna水平测量值。使用映射至基因的外显子区的度量rpkm(readperkilobasepermillion),将来自solid平台的测序数据在名义上表示为转录物表达值,使得能够使基础基因表达分析归一化,并以rpkm_transcript列举。在下面的pdx系中,与ntg细胞和正常组织相比,mfi2mrna表达在brcsc中较高:br31和br25。在下面的pdx系中,与正常组织,包括黑素细胞相比,mfi2mrna表达在整块skpdx中较高:sk3和sk13(fig.1a)。在该实施例1中,使用从如上所述分离的ntg或csc肿瘤亚群中提取的5ng总rna产生的cdna,进行illumina全转录物组分析。文库使用truseqrnasamplepreparationkitv2(illumina)创建。使所得cdna文库片段化并条码化。使用映射至基因外显子区的度量fpkm(fragmentperkilobasepermillion),使来自illumina平台的测序数据在名义上表示为片段表达值,使得基础基因表达分析能够归一化,并以fpkm_transcript列举。与在两种正常细胞中的表达和在下列lu和crpdx肿瘤细胞系中与ntg细胞群相比,mfi2mrna表达在csc肿瘤细胞亚群中较高:lu120、lu128、lu152、lu244和cr4(图1b)。在br、sk、lu和crpdx肿瘤中鉴定出mfi2mrna表达升高表明作为潜在的诊断和免疫治疗靶标,mfi2值得进一步的评价。此外,与br、cr和lupdx肿瘤中的ntg相比,csc中mfi2表达的升高表明mfi2是这些肿瘤类型中致瘤细胞的良好标志物。实施例2采用qrt-pcr肿瘤中mfi2mrna的表达人mfi2基因编码2个转录物:2377bp的16个外显子的长同等型(genbankaccession:nm_005929)和1651bp的较短的7个外显子同等型(genbankaccession:nm_033316)。短和长同等型的前6个外显子是相同的。然而,短同等型的第7个即最后1个外显子包含产生截短蛋白质的符合读框的终止信号。mfi2蛋白的长同等型(“hmfi2”)是738个氨基酸的gpi膜锚定蛋白。短同等型(“hδmfi2”)具有302个氨基酸的预测长度,并没有gpi锚基序;因此被认为是分泌的蛋白质。图2a是hmfi2的示意图,显示了两种同等型。不论它们是否与短或长的同等型结合,本发明的抗mfi2抗体可用作有效的肿瘤治疗或诊断方法,然而,对于本发明的抗体特别有利的是结合长的膜锚定同等型以使抗体定位于肿瘤位置最优化并提高抗体内化。为了证实实施例1和2的结果,并且为了测定哪一个hmfi2同等型在不同的pdx肿瘤细胞系中表达。为了证实肿瘤细胞中的mfi2rna表达,按照行业的标准方案,利用fluidigmbiomark™hdsystem,在不同的pdx细胞系中进行了qrt-pcr。按实施例1所述,从整块pdx肿瘤细胞或分选的csc和ntg亚群中提取rna。按照生产商说明书,使用highcapacitycdnaarchive试剂盒(lifetechnologies),将1ng的rna转化成cdna。然后将采用mfi2长同等型特异性taqman测定法预先扩增的cdna材料用于随后的qrt-pcr实验。将正常组织(normtox或norm)中的表达与br、cr、em、lu、pa和skpdx肿瘤细胞系中的表达进行了比较(图2b;每个点表示每个个别组织或pdx细胞系的平均相对表达,小的水平线表示几何平均值)。“normtox”表示下面的不同正常组织的样品:肾上腺、动脉、结肠、背根节、食道、心脏、肾、肝、肺、胰腺、骨骼肌、皮肤、成纤维细胞、角质形成细胞、小肠、脾、胃、气管和静脉。命名为“norm”的另一组正常组织表示与“normtox”细胞相比推测的与adc类药物有关的毒性风险较低的下列正常组织的样品:外周血单核细胞和各种分选的亚群(b细胞、单核细胞、nk细胞、嗜中性粒细胞、t细胞)、脑、乳腺、黑素细胞、正常骨髓和各种分选的亚群和睾丸。图2b显示与norm和normtox组织相比,平均起来mfi2表达在乳腺(br-基底样);结肠直肠、肺(lu-ad、lu-lcc和lu-scc);胰腺和皮肤(sk-mel)肿瘤以及em肿瘤亚型中较高。该数据支持这样的早期研究结果,即与正常组织相比,mfi2在br、lu和skpdx中的表达升高。还测定了如上文实施例1所述的已分选为csc和ntg的不同pdx肿瘤细胞系中的mfi2表达。在下列肿瘤亚型中,与ntg相比,mfi2表达在csc中较高:br-基底样(br22,br31);br-cldn-low(br25);cr(cr4);lu-ad(lu123)和lu-scc(lu116和lu128)(图2c)。与前述lupdx肿瘤系形成对比,lu206显示mfi2的低表达(图2b)。这个研究结果稍后在测定lu206中的mfi2蛋白表达水平时得到证实(参见下文实施例16)。所述研究结果进一步支持所观察到的mfi2表达水平和不同的肿瘤亚型(包括br、cr和lu)之间的关系。实施例3使用微阵列测定肿瘤中mfi2mrna的表达进行了全长gpi锚定hmfi2同等型的微阵列实验,数据如下分析。大致如实施例1中所述,从br、cr、lu、pa和skpdx细胞系中提取1-2µg完整肿瘤总rna。采用agilentsureprintgehuman8x60v2微阵列平台,其含有针对人基因组中的27,958个基因和7,419个lncrna设计的50,599个生物探针,对样品进行了分析。采用标准行业实践归一化,并变换强度值以量化各样品的基因表达。图3中绘制了各样品中mfi2表达的归一化强度,从各肿瘤类型得出的几何平均值用有水平线条表示。图3显示与正常组织相比,mfi2的长同等型在br(br-基底样、br-cldn-low、br-her2、br-nl)、cr、lu(lu-ad、lu-scc)、pa和sk中表达。前述肿瘤类型中mfi2表达升高的观察结果证实了实施例1和2的结果。另外,显示了lu206不表达mfi2,证实了实施例16中描述的该特定pdx肿瘤系的流式细胞术结果。具体地讲,在所有3个平台上分析的br25、br31和cr4,当通过全转录物组rna测序(实施例1)、qrt-pcr(实施例2)和微阵列(实施例3)测量时,长同等型的mfi2表达升高。这些数据表明mfi2的长同等型在包括br、cr、lu、pa和sk在内的许多肿瘤亚型中表达,并且可以是用于研发这些适应征中基于抗体的治疗的良好靶标。实施例4使用癌症基因组图谱的肿瘤中的mfi2表达利用称为癌症基因组图谱(tcga)的大型可公开获得的原发性肿瘤和正常样品数据集,证实了不同肿瘤中hmfi2mrna的过量表达。来自illuminahiseq_rna酶qv2平台的hmfi2表达数据从tcgadataportal(https://tcga-data.nci.nih.gov/tcga/tcgadownload.jsp)下载,并分析以汇集每个基因的各个外显子的读取以产生每百万映射读取的每外显子千碱基对的单一值读取(rpkm)。图4a显示与正常组织相比,mfi2表达在以下pdx肿瘤系中升高:bd、br(br-tnbc);cr;re-ad、es、ga、lu(lu-ad、lu-scc);ov;pa和sk。这些数据证实mfi2mrna水平的升高可存在于上述肿瘤类型中,表明了抗mfi2抗体和adc可用于这些肿瘤的治疗法。图4b显示lu-adtcga肿瘤亚型的kaplanmeier生存曲线,其中可获得患者生存数据。在lu-ad肿瘤中根据mfi2mrna的高表达(即超过阈值给定值的表达)或mfi2mrna的低表达(即低于阈值给定值的表达),对患者分级。阈值给定值计算为rpkm值的算术平均,其计算为5.42。图下面所列的“有风险的数目”显示在每个患者最初确诊当日(第0天)之后每隔1000天仍保留在数据集中的生存患者的数目。通过log-rank(mantel-cox)检验(p=0.0002)或通过gehan-breslow-wilcoxon检验的p=0.0004,2个生存曲线显著不同。这些数据表明,与带有显示mfi2低表达的lu-ad肿瘤的患者相比,带有显示mfi2高表达的lu-ad肿瘤的患者具有短得多的生存时间。这表明了抗mfi2疗法治疗lu-ad的有用性和mfi2表达作为可根据其作出治疗决定的预后生物标志物的有用性。实施例5重组mfi2蛋白的克隆和表达及过量表达细胞表面mfi2蛋白的细胞系的工程改造人mfi2(hmfi2)。为了产生涉及hmfi2蛋白的本发明的全部分子和细胞材料,商品化人mfi2cdna克隆购自thermoscientific(image克隆100016036;登录号bc152832),其可读框通过blast分析以编码与hmfi2的refseq(登录号np_005920)100%同一性的蛋白质。使用bc152832cdna克隆以用于表达成熟hmfi2蛋白或其片段的构建体的所有后续工程改造。为了产生抗hmfi2蛋白的免疫反应性抗体,产生了嵌合融合基因,其中使hmfi2蛋白的胞外结构域(ecd)与组氨酸标签或人igg2fc标签符合读框地融合。这如下进行:采用标准分子技术,使编码hmfi2的ecd(残基g20–c709)的dna片段自bc152832cdna克隆pcr扩增,并符合读框且在免疫球蛋白κ(igk)信号肽序列下游和组氨酸标签或人igg2fccdna的上游亚克隆至cmv驱动的表达载体。cmv驱动的hmfi2表达载体允许在hek293t和/或cho-s细胞中高水平瞬时表达。使用聚乙烯亚胺聚合物作为转染试剂,将hek293t细胞的悬浮或贴壁培养物或悬浮cho-s细胞用编码hmfi2k-ecd-his或hmfi2ecd-fc蛋白的表达构建体转染。在转染后3-5天,分别使用akta探测器和nickel-edta(qiagen)或mabselectsure™proteina(gehealthcarelifesciences)柱,从澄清的细胞上清液中纯化hmfi2-ecd-his或hmfi2-ecd-fc蛋白。大鼠mfi2(rmfi2)。为了装配编码与组氨酸标签或人igg2fc标签符合读框融合的rmfi2的ecd的构建体,使用ncbi登录号nm_001105872中所含的序列设计3个重叠的合成dna片(gblocks,idt),然后按照生产商说明书,采用体外重组技术(in-fusion,clontech),将其符合读框且在igk信号肽序列的下游和在组氨酸标签或人igg2fccdna的上游克隆至cmv驱动的表达载体。如上文hmfi2蛋白所述,产生重组蛋白。细胞系工程改造采用
技术领域:
公知的技术,使用慢病毒载体构建过量表达hmfi2的工程改造细胞系以转导hek293t细胞系。首先,采用标准分子克隆技术引入编码igk信号肽接着pcdh-ef1-mcs-t2a-gfp(systembiosciences)的多克隆位点上游的dddk表位标签的核苷酸序列,产生载体pcemt。pcemt中的t2a序列促进肽键缩合的核糖体跳跃,导致2种独立蛋白质的表达:t2a肽上游编码的带dddk标签的细胞表面蛋白的高水平表达,与t2a肽下游编码的gfp标志物蛋白的共表达。如下使用pcemt产生不同的mfi2载体:使用bc152832cdna克隆作为模板,通过pcr扩增产生编码成熟hmfi2蛋白(残基g20-l738)的dna片段,其所得pcr产物符合读框地亚克隆至pcemt中的igk信号肽-dddk表位标签的下游。这得到pl120-hmfi2慢病毒载体。采用本领域技术人员熟知的标准慢病毒转导技术,使用该慢病毒载体产生过量表达hmfi2蛋白的稳定的基于hek293t的细胞系,接着mfi2-阳性细胞选择和高表达hek293t亚克隆的荧光激活细胞分选(facs)(例如对gfp和flag表位呈强阳性的细胞)。实施例6抗mfi2抗体的产生为了产生抗mfi2小鼠抗体,用10µghmfi2-his蛋白质连同合适的佐剂给1只balb/c小鼠接种。在初次接种后,给小鼠注射10µghmfi2-his蛋白质连同合适的佐剂每周2次达4周,其中最后一次接种使用10µghmfi2-his蛋白质连同合适的佐剂进行。将小鼠处死,切下引流淋巴结(腘、腹股沟和中髂骨)并用作产抗体细胞的来源。使用模式btxhybrimmunesystem(btxharvardapparatus),通过电子细胞融合以1:1的比率使b细胞的单细胞悬液(430x106个细胞)与非分泌性p3x63ag8.653骨髓瘤细胞(atcc#crl-1580)融合。将细胞重新悬浮于杂交瘤选择培养基(由补充偶氮丝氨酸、15%胎儿克隆i血清、10%bm条件培养基、1mm非必需氨基酸、1mmhepes、100iu青霉素-链霉素和50μm2-巯基乙醇的dmem培养基组成),并在4个t225培养瓶中于100ml选择培养基/培养瓶中培养。把培养瓶置于含有5%co2和95%空气的潮湿的37℃培养箱中6天。在融合后6天,从培养瓶中收集杂交瘤文库细胞,并将文库保存在液氮中。将冷冻小瓶融化至t75培养瓶中,次日将杂交瘤细胞以1个细胞/孔(使用facsariai细胞分选仪)接种在15falcon384孔板内的90μl补充的杂交瘤选择培养基(如上所述)中。使杂交瘤培养10天,并采用如下进行的流式细胞术,针对对hmfi2有特异性的抗体筛选上清液。将用hmfi2稳定转导的1x105个/孔的hek293t细胞与25μl杂交瘤上清液一起孵育30分钟。细胞用pbs/2%fcs洗涤,然后与在pbs/2%fcs中1:300稀释的每样品25μldyelight649标记的山羊-抗小鼠igg、fc片段特异性第二抗体一起孵育15分钟。细胞用pbs/2%fcs洗涤两次,重新悬浮于含dapi的pbs/2%fcs中,并通过流式细胞术分析超过用同种型对照抗体染色的细胞的荧光。将剩余的未使用的杂交瘤文库细胞在液氮中冷冻用于进一步的文库测试和筛选。hmfi2-his免疫活动得到与表达hmfi2的hek293t细胞的表面特异性结合的小鼠抗体。实施例7抗mfi2抗体的特性对于同种型、与大鼠mfi2的交叉反应性、对大鼠、食蟹猴和人mfi2的亲和力和表位框并,采用各种方法以表征实施例6中产生的抗mfi2小鼠抗体。图5是概括上述特性的表,其中“nd”表示“未测定”。按照生产商的方案,使用milliplex小鼠免疫球蛋白同种型分型试剂盒(millipore),测定了多个代表性抗体的同种型。独特的mfi2特异性抗体的结果可见于图5。如下用fortebiored生成的动力学曲线,定量测定抗hmfi2小鼠抗体对大鼠mfi2-his的亲和力。将8μg/ml纯化的抗mfi2抗体以3分钟的接触时间和1000rpm的振荡速率固定在抗小鼠fc俘获生物传感器上。来自基线的俘获的抗体负载在0.3-1单位下为常数。在抗体俘获和50秒钟基线后,将生物传感器浸入纯化的hmfi2-his或rmfi2-his蛋白的300nm溶液中在1000rpm的振荡速率下持续60秒钟结合期,接着60秒钟解离期。在每个循环后,通过将生物传感器浸入10mm甘氨酸(ph1.7)后再生。数据通过从具体的抗体反应中减去对照小鼠igg表面反应来处理,并将数据截取至结合和解离期。利用结合和解离曲线定量估计所选的抗体结合hmfi2和rmfi2的能力。所测抗体中,确定与筛选的其它抗体相比,8种抗体以高亲和力与rmfi2-his交叉反应(图5)。使用仪器(gehealthcare),通过表面等离子体共振,定量测定精选的小鼠和人源化抗hmfi2抗体对人、食蟹猴或大鼠mfi2蛋白的亲和力。使用抗体俘获试剂盒将小鼠或人源化抗mfi2抗体固定在cm5生物传感器芯片上。在每个抗原注射循环之前,以1分钟的接触时间和5μl/分钟的流速,使浓度为0.01-1μg/ml的小鼠或人源化抗体俘获在表面上。来自基线的俘获的抗体负载在80-120响应单位下为常数。在抗体俘获和1分钟基线,使不同深度的单体hmfi2-his抗原、cmfi2-his或rmfi2-his抗原以10μl/分钟的流速流过表面达1.5分钟结合期接着5分钟解离期。通过从特异性抗体表面反应减去对照非结合抗体表面反处理数据,并将数据截取至结合和解离期。应用biaevaluationsoftware3.1(gehealthcare),将所得反应曲线以1:1langmuir结合模型拟合以产生表观亲和力、kon和koff、动力学常数。所选的抗体显示对hmfi2、cmfi2和rmfi2的单位为纳摩尔范围的亲和力(图5)。采用多重竞争免疫测定法(luminex),将抗体分成框。将100μl浓度为10μg/ml的各独特的抗mfi2抗体(俘获mab)用与抗小鼠κ抗体(miller等,2011,pmid:21223970)缀合的磁珠(luminex)孵育1小时。俘获mab/缀合的珠粒复合体用pbsta缓冲液(含0.05%tween20的1%bsa/pbs)洗涤,然后合并。在除去残留的洗涤缓冲液后,将珠粒与2μg/mlhmfi2-his蛋白一起孵育1小时,洗涤,然后重新悬浮于pbsta中。将合并珠粒混合物分布到96孔板中,各孔含有独特的抗mfi2抗体(检测mab),在振荡时孵育1小时。在洗涤步骤后,将与pe缀合的抗小鼠κ抗体(与上文使用的相同)以5μg/ml的浓度加入孔中,孵育1小时。再次洗涤珠粒,并重新悬浮于pbsta中。平均荧光强度(mfi)值用luminexmagpix仪器测量。抗体配对可呈现为自抗体对的皮尔逊相关系数计算的距离矩阵的系统树图。以抗体对mfi值的系统树图和分析为基础确定框并。对mfi2的亲和力结合低且不能置于具体框中的抗体标明为在框x中。“nd”意指未进行相关抗体的框并实验。图5显示经筛选的抗mfi2抗体可分成hmfi2蛋白中的至少5个独特框(a-e)。实施例8抗mfi2抗体与运铁蛋白的交叉反应性hmfi2是一种运铁蛋白(tf)同系物,与人tf具有37-39%同源性。有两种形式的人tf,apo-tf(其不含铁)和holo-tf(其是铁结合的)。为了测定本发明的抗体是否与apo-tf或holo-tf交叉反应,采用elisa测定法。将板用含5μg/ml含纯化的hmfi2-his,holo-tf(rnd目录号2914-ht)或apo-tf(rnd目录号3188-at)的pbs缓冲液包被,在4℃下孵育过夜。然后将板用pbst(pbs加0.05%tween20)洗涤,并在37℃下用含3%bsa的pbs封闭1小时。将板洗涤,在室温下以1.4μg/ml加入10μl抗mfi2抗体持续1小时。按照生产商的方案,使用msd®sulf0-tagnhs酯将山羊抗小鼠igg检测抗体加磺基标签。msdsulfo-tagnhs-酯是一种胺反应性的n-羟基琥珀酰亚胺酯,其在温和的碱性条件下容易与蛋白质的伯胺基偶联形成稳定的酰胺键。将板洗涤,在室温下加入10μl/孔0.5μg/ml加磺基标签的山羊抗小鼠igg达30分钟。将板洗涤,将含表面活性剂的msdreadbuffert在水中稀释至1x,将35µl加入各孔中。在msdsectorimager2400上读板。强信号表示结合。在测试的60种小鼠抗mfi2抗体中,无一与apo-tf或holo-tf交叉反应。这些结果表明,本发明的抗体不与血浆中的游离运铁蛋白或表达tf的正常细胞交叉反应。实施例9mfi2抗体的测序如下所述对产生的抗mfi2小鼠抗体(实施例6)进行测序。按照生产商说明书,使用rneasyminiprepkit(qiagen),从所选的杂交瘤细胞中纯化总rna。每个样品使用104和105个细胞。将分离的rna样品保存在-80℃下备用。使用包含计成靶向完全小鼠vh库的86种小鼠特异性前导序列引物的两种5’引物混合物与对所有小鼠ig同种型有特异性3'小鼠cγ引物组合,扩增各杂交瘤的ig重链可变区。同样,含有64种设计成扩增vκ小鼠家族每一个的5'vκ前导序列的两种引物混合物与对小鼠κ恒定区有特异性的单一反向引物组合使用,以扩增κ轻链并测序。如下使用qiagenonesteprt-pcr试剂盒,从100ng总rna扩增vh和vl转录物。对于各杂交瘤运行共4个rt-pcr反应,vκ轻链2个,vh重链2个。pcr反应混合物包括1.5μlrna、0.4µl100μm重链或κ轻链引物(由idt承接合成)、5μl5xrt-pcr缓冲液、1μldntp和0.6μl含有反转录酶和dna聚合酶的酶混合物。循环变温加热器程序为室温步进50℃60分钟,95℃15分钟,接着35个循环(94.5℃30秒钟,57℃30秒钟,72℃1分钟)。然后在72℃下最后孵育10分钟。如上文针对可变区扩增所述,使用相同的可变区引物,对提取的pcr产物测序。将pcr产物送往提供pcr纯化和测序服务的外部测序商(mclab)。核苷酸序列应用imgt序列分析工具(http://www.imgt.org/imgtmedical/sequence_analysis.html)分析以鉴定具有最高序列同源性的种系v、d和j基因成员。利用专利抗体序列数据库,通过vh和vl基因与小鼠种系数据库的比对,将衍生序列与igv-和j-区的已知种系dna序列进行比较。图6a表示来自抗mfi2抗体的多个新的小鼠轻链可变区和衍生自代表性小鼠抗mfi2抗体的可变轻链的示例性人源化轻链可变区的连续氨基酸序列。图6b表示来自同一抗mfi2抗体的新的小鼠重链可变区和衍生自提供人源化轻链的同一小鼠抗体的人源化重链可变区的连续氨基酸序列。小鼠轻链和重链可变区氨基酸序列以seqidno:21-91奇数提供,而人源化轻链和重链可变区氨基酸序列以seqidno:93-107奇数提供。总之,图6a和6b提供以下若干小鼠抗mfi2抗体的注释序列:称为sc57.1(与sc57.2、57.23相同序列),具有seqidno:21的vl和seqidno:23的vh;sc57.3(与sc57.52、sc57.55同一序列),具有seqidno:25的vl和seqidno:27的vh;sc57.4(与sc57.16、sc57.18、sc57.25、sc57.28、sc57.37同一序列),具有seqidno:29的vl和seqidno:31的vh;sc57.5,具有seqidno:33的vl和seqidno:35的vh;sc57.6(与sc57.7、sc57.48同一序列),具有seqidno:37的vl和seqidno:39的vh;sc57.8,具有seqidno:41的vl和seqidno:43的vh;sc57.9,具有seqidno:45的vl和seqidno:47的vh;sc57.10(与sc57.29、sc57.30、sc57.32、sc57.35、sc57.38、sc57.40、sc57.45、sc57.47、sc57.51、sc57.54同一序列),具有seqidno:49的vl和seqidno:51的vh;sc57.11(与sc57.41、sc57.56同一序列),具有seqidno:53的vl和seqidno:55的vh;sc57.12(与sc57.46同一序列),具有seqidno:57的vl和seqidno:59的vh;sc57.14,具有seqidno:61的vl和seqidno:63的vh;sc57.15,具有seqidno:65的vl和seqidno:67的vh;sc57.17,具有seqidno:69的vl和seqidno:71的vh;sc57.20,具有seqidno:73的vl和seqidno:75的vh;sc57.27,具有seqidno:77的vl和seqidno:79的vh;sc57.31(与sc57.53、sc57.57同一序列),具有seqidno:81的vl和seqidno:83的vh;sc57.43,具有seqidno:85的vl和seqidno:87的vh;和sc57.60,具有seqidno:89的vl和seqidno:91的vh。另外,图6a和6b提供以下人源化抗体的注释序列:称为hsc57.5,具有seqidno:93的vl和seqidno:95的vh;hsc57.5v1(描述于实施例13),具有seqidno:93的vl和seqidno:97的vh;hsc57.32,具有seqidno:99的vl和seqidno:101的vh;hsc57.32v1(描述于实施例13),具有seqidno:99的vl和seqidno:103的vh和hsc57.43,具有seqidno:105的vl和seqidno:107的vh。标注氨基酸序列以鉴定按照kabat定义的构架区(即fr1–fr4)和互补决定区(即图6a中的cdrl1–cdrl3或图6b中的cdrh1–cdrh3)。可变区序列应用abysis数据库专利版分析以提供cdr和fr标识。虽然cdr按照kabat定义,但本领域技术人员应认识到,cdr和fr标识也可按照chothia、mccallum或任何其它公认的命名系统定义。图6c提供编码图6a和6b所示氨基酸序列的核酸序列(seqidno:20-106偶数)。图6d提供示例性全长抗体重链和轻链的氨基酸序列(seqidno:108–118)。图6e–6g显示通过kabat、chothia、abm和contact方法和按照kabat编号确定的sc57.5(图6e),sc57.32(图6f)和sc57.43(图6g)鼠抗体的轻链和重链可变区的cdr。同样,图6h–6j提供小鼠源抗体和衍生的人源化构建体(sc57.5–图6h,sc57.32–图6i和sc57.43–图6j)的重链和轻链可变区的比对的氨基酸序列,其中cdr按照kabat用方框标出。如图6a和6b所见,各个具体鼠抗体的重链和轻链可变区氨基酸序列的seqidno是连续的奇数。因此单克隆抗mfi2抗体sc57.1,分别包含轻链和重链可变区的氨基酸seqidno:21和23;sc57.3包含seqidno:25和27;sc57.4包含seqidno:29和31等等。各个鼠抗体氨基酸序列的相应的核酸序列包括在图6c中,并具有紧接相应氨基酸seqidno之前的seqidno。因此,例如sc57.1抗体vl和vh的核酸序列的seqidno分别为seqidno:20和22。实施例10位点特异性抗体的产生构建包含天然轻链(lc)恒定区和重链(hc)恒定区的工程改造的人igg1/κ抗mfi2位点特异性抗体,其中hc上铰链区中的半胱氨酸220(c220)(其与lc中的半胱氨酸214(c214)形成链间二硫键),被丝氨酸(c220s)取代。当装配时,hc和lc形成包含适于与治疗剂缀合的2个游离半胱氨酸的抗体。除非另有说明,否则恒定区残基的全部编号均按照kabat等人提出的eu编号方案。如下产生工程改造的抗体。编码全长人源化抗mfi2抗体hsc57.5v1hc(seqidno:111)或hsc57.32(seqidno:113)的表达载体用作模板用于pcr扩增和位点定向诱变。按照生产商说明书,利用quick-change®系统(agilenttechnologies)进行位点定向诱变。编码hchsc57.5v1、hsc57.32或hsc5757.43的突变型c220s的载体分别用hsc57.5v1(其与hsc57.5的lc相同(seqidno:108))或hsc57.32(seqidno:112)或hsc57.43(seqidno:116)的天然全长κlc在cho-s细胞中共转染,并使用哺乳动物瞬时表达系统表达。含有c220s突变体的工程改造的抗mfi2位点特异性抗体称为hsc57.5v1ss1和hsc57.32ss1。hsc57.5v1ss1(seqidno:108和110)、hsc57.32ss1(seqidno:112和114)和hsc57.43ss1(seqidno:116和118)位点特异性抗体的全长lc和hc的氨基酸序列见图6d。lc中的反应性半胱氨酸用下划线表示,同样hc中220位的天然或突变的残基也用下划线表示。工程改造的抗mfi2抗体通过sds-page表征以证实已产生了正确的突变体。在还原剂例如dtt(二硫苏糖醇)存在或不存在下,在来自lifetechnologies的预制的10%tris-甘氨酸微型凝胶上进行sds-page。在电泳后,凝胶用胶态考马斯溶液染色。在还原条件下,观察到相当于游离lc和游离hc的2条带(数据未显示)。这种图案是在还原条件下igg分子特有的。在非还原条件下,条带图案不同于天然igg分子,表明了在hc和lc之间没有二硫键。观察到在98kd附近相当于hc-hc二聚体的条带。另外,还观察到相当于游离lc的微弱条带和在48kd附近相当于lc-lc二聚体的主条带。预期由于每个lcc端的游离半胱氨酸所致,形成一定量的lc-lc物类。实施例11嵌合和人源化抗mfi2抗体的产生如下采用
技术领域:
公知的技术,产生嵌合抗mfi2抗体。采用描述于实施例1的方法从产抗mfi2抗体的杂交瘤中提取总rna,对rna进行pcr扩增。从本发明的抗mfi2抗体的核酸序列(图6c)获得有关小鼠抗体vh和vl链的v、d和j基因区段的数据。使用以下限制位点设计对抗体vh和vl链的构架序列有特异性的引物组:用于vh片段的agei和xhoi和用于vl片段的xmai和draiii。pcr产物用qiaquickpcr纯化试剂盒(qiagen)纯化,接着用于vh片段的限制性内切酶agei和xhoi和用于vl片段的xmai和draiii消化。将vh和vl消化的pcr产物纯化,并分别连接至igh或igκ表达载体。在含200ut4-dna连接酶(newenglandbiolabs)、7.5μl消化和纯化的基因特异性pcr产物和25ng线性化载体dna的10μl总体积中进行连接反应。感受态大肠杆菌dh10b细菌(lifetechnologies)通过在42℃下的热激用3μl连接产物转化,并以100μg/ml的浓度铺于氨苄西林板中。在扩增的连接产物纯化和消化后,将vh片段克隆至包含huigg1(pee6.4huigg1)的pee6.4表达载体(lonza)的agei-xhoi限制位点中,并将vl片段克隆至包含人κ轻链恒定区(pee12.4hu-κ)的pee12.4表达载体(lonza)的xmai-draiii限制位点中。通过用pee6.4huigg1和pee12.4hu-κ表达载体共转染cho-s细胞来表达嵌合抗体。将2.5μgpee6.4huigg1和pee12.4hu-κ载体dna的每一种加入含15μgpei转染试剂的400µlopti-mem中。使混合物在室温下孵育10分钟,并加入到细胞中。转染后3-6天收获上清液。通过以800xg离心10分钟,使含有重组嵌合抗体的培养上清液从细胞碎片中澄清,并保存在4℃下。重组嵌合抗体用蛋白a珠粒纯化。此外,如下采用专利计算机辅助cdr移植方法(abysisdatabase,uclbusiness)和标准分子工程技术,使小鼠抗mfi2抗体人源化。根据人种系抗体序列的构架序列和cdr典型结构与相关小鼠抗体的构架序列和cdr的最高同源性,设计可变区的人构架区。对于分析目的,按照kabat等人编号,完成cdr结构域每个的氨基酸排布。可变区一经选择,便由合成基因区段(integrateddnatechnologies)产生。采用针对嵌合抗体的上文所述分子方法,克隆并表达人源化抗体。人源化抗体hsc57.5(seqidno:93和95)、hsc57.32(seqidno:99和101)、hsc57.43(seqidno:105和107)的vl和vh氨基酸序列分别衍生自相应的小鼠抗体c57.5(seqidno:33和35)、sc57.32(seqidno:49和51)和sc57.43(seqidno:85和87)的vl和vh序列。下表5和图6h–6j显示相对少的构架变化对保持抗体的有利性质是必需的。产生hsc57.5的变化,其中引入vhcdrh2的g55a突变以产生hsc57.5v1抗体(seqidno:93和97)。hsc57.5v1的vl与hsc57.5的vl(seqidno:93)相同。hsc57.5v1ss1具体与hsc57.5v1相同的vh和vl。将3个构架变化引入hsc57.32和hsc57.32ss1抗体中:2个在vh中:m69f和t71a,1个在vl中:f71y。在hsc57.32v1中,引入2个构架变化:1个在vh中:t71a,1个在vl中:f71y。将单点突变s30g引入hsc57.43和hsc57.43ss1抗体的vh构架区中。人源化抗体hsc57.5、hsc57.5v1、hsc57.5v1ss1、hsc57.32、hsc57.32v1、hsc57.32ss1、hsc57.43和hsc57.43ss1的全长轻链和重链的氨基酸序列见图6d。表5实施例12抗mfi2抗体的结构域-水平表位作图为了表征所公开的抗mfi2抗体与之缔合的表位,采用对由cochran等(2004,pmid:15099763)所述方案进行修改的用酵母展示的结构域的基于facs的方法,进行结构域水平表位作图。产生酵母展示质粒构建体用于包含氨基酸20-357的hmfi2tf样结构域1(tld1)和包含氨基酸366-709的tf样结构域2(tld2)的表达。两个结构域的编号包括氨基酸1-19,hmfi2的前导序列。有关结构域信息一般参见uniprotkb/swiss-prot数据库条目p08582。hmfi2的长同等型包含tld1和tld2两者,而hmfi2的短同等型只包含tld1而无tld2。因此,与tld2结合的这些抗体对hmfi2的长的gpi锚定同等型有特异性。将酵母展示质粒转化至酵母中,然后如cochran等(同上)所述使之生长并诱导。为了测试与特定构建体的结合,200,000个表达所需构建体的诱导酵母细胞用含1mg/mlbsa的pbs(pbsa)洗涤两次。使酵母细胞在50µl含1µg/ml鸡抗c-myc(lifetechnologies)抗体和50ng/ml纯化的抗mfi2抗体的pbsa中在冰上孵育90分钟,然后在pbsa中洗涤两次。然后将细胞在50µl含各1µg/ml的alexa488缀合的抗鸡和alexa647缀合的山羊抗小鼠抗体(bothlifetechnologies)的pbsa中孵育。在冰上孵育20分钟后,将细胞用pbsa洗涤两次,并在facscantoii(bdbiosciences)上进行分析。图5显示测试的抗体中大部分与tld2结合,表明了大多数抗体对mfi2的长的gpi锚定同等型有特异性。值得注意的是,仅框e(参见实施例8;图5)中的那些抗体与tld1结合,而在框a-d中的抗体与tld2结合。图5中的“nd”表示“未测定”,这意味着未对所述特异性抗体进行实验。为了将表位归类为构象(例如不连续)或线性,使展示hmfi2结构域的酵母在80℃下热处理30分钟,然后在冰冷的pbsa中洗涤2次。然后如上所述,使展示变性抗原的酵母(变性酵母)进行相同的染色方案和流式细胞术分析。将与变性和天然酵母两者结合的抗mfi2抗体归类为与线性表位结合,而将结合天然酵母但不结合变性酵母的抗mfi2抗体归类为构象特异性的。发现所测的大多数抗体是构象特异性的,其中结合线性表位的sc57.2、sc57.7、sc57.31、sc57.53和sc57.57除外。实施例13抗mfi2抗体的精细表位作图采用酵母展示方法(chao等,natprotoc.1(2):755-768,2007),对所选的抗mfi2抗体进一步进行精细表位作图。简单地说,使用核苷酸类似物8-氧代-2’脱氧鸟苷-5’-三磷酸和2’-脱氧-对核苷-5’三磷酸(两者来自trilinkbio)的易错pcr以每克隆1个氨基酸突变的靶标诱变速率,产生hmfi2ecd突变体的文库。将这些转化成酵母展示形式。采用上述用于结构域-水平作图的技术,针对在50nm下的c-myc和抗mfi2抗体结合,使文库染色。采用facsaria(bd),使显示与野生型hmfi2ecd相比丧失结合的克隆再生长,并针对与靶标抗体结合的丧失进行另一轮的facs分选。使用zymoprepyeastplasmidminiprep试剂盒(zymoresearch),分离各个ecd克隆并测序。必要时,使用quikchange位点定向诱变试剂盒(agilent),对突变进行重整成为单突变型ecd克隆。接下来筛选各个单一突变型ecd克隆以测定结合的丧失是否是因表位的突变或引起错折叠的突变所致。由于错折叠突变的高概率,因此自动弃去涉及半胱氨酸、脯氨酸和终止密码子的突变。然后针对与各种非竞争性构象特异性抗体的结合,筛选ecd克隆。断定丧失与非竞争性构象特异性抗体结合的ecd克隆含有错折叠突变,而断定与野生型hmfi2ecd同等结合的ecd克隆是正常折叠的。断定后一组中ecd克隆的突变在表位中。不同抗体作图的结果见下表6,其中标出了特定突变以及主题抗体结合突变的mfi2同系物的能力。在表7中,作为表位所涉及的那些残基用在突变残基之前的#标示。表6框dbfccahmfi2突变体丧失与sc57.4结合丧失与sc57.5结合丧失与sc57.9结合丧失与sc57.32结合丧失与sc57.41结合丧失与sc57.43结合#d460a无无无部分部分无s461a无无无无无无s462a无无无无无无#h463a无无无完全完全无f465a无无无无无无#n566a无无无部分部分无v570a无无无无无无#-涉及作为表位组分根据来源于突变同系物的数据,将sc57.32和sc57.41的潜在表位组分列于紧接的下表7中。表7抗体克隆表位相关残基sc57.32d460,h463,n566sc57.41d460,h463,n566实施例14肿瘤中的mfi2蛋白表达鉴于与实施例1-3中所述肿瘤有关的mfi2mrna转录物水平升高,进行了研究以测试mfi2蛋白表达是否也在pdx肿瘤中升高。为了检测和定量测定mfi2蛋白表达,利用msddiscoveryplatform(mesoscalediscovery),开发了电化学发光mfi2夹心elisa测定法。从小鼠中切除pdx肿瘤,在干冰/乙醇上速冻。将蛋白质提取缓冲液(biochaininstitute)加入解冻肿瘤片中,使用tissuelyser系统(qiagen)将肿瘤粉碎。裂解物通过离心(20,000g,20分钟,4℃)澄清,使用二辛可宁酸定量测定各裂解物中的总蛋白质浓度。然后使蛋白质裂解物归一化至5mg/ml,并保存在-80℃下备用。正常组织购自市售来源。使用实施例5所述产生的纯化的重组mfi2-his蛋白绘制标准蛋白质浓度曲线,从该曲线内推的值求出来自裂解物样品的mfi2蛋白浓度。mfi2蛋白标准曲线和蛋白质定量测定法如下进行:将msd标准板用15µl含2µg/mlsc57.2俘获抗体的pbs中在4℃下包被过夜。将板在pbst中洗涤,在振荡的同时,在35µlmsd3%封阻剂a溶液中封闭1小时。将板再次在pbst中洗涤。将10µl在含10%蛋白质提取缓冲液的msd1%封阻剂a中10x稀释的裂解物(或连续稀释的重组mfi2标准物)加入孔中,在振荡同时孵育2小时。将板再次在pbst中洗涤。然后按照生产商的方案,使用msd®sulf0-tagnhs酯,对sc57.10检测抗体加磺基标签。在振荡同时,将10µl的0.5µg/ml加标签的sc57.10抗体/msd1%封阻剂a在室温下加入洗涤的板中1小时。将板在pbst中洗涤。将含表面活性剂的msdreadbuffert在水中稀释至1x,将35µl加入各孔中。将板在应用集成软件分析程序的msdsectorimager2400上读数以通过自标准曲线的内插推导pdx样品中的mfi2浓度。然后将值除以总蛋白质浓度,得到毫微克mfi2/毫克总裂解物蛋白质。所得浓度列于图7,其中每个点表示从单一pdx肿瘤系推导的mfi2蛋白浓度。虽然每个点从pdx系中推导,但在大多数情况下,测试来自相同pdx系的多个生物样品,对值取平均以提供数据点。图7显示bd、br(br-基底样、br-her2、br-luma、br-lumb、br不明确的)、em、cr、lu、ga、liv、ov、pa、sk肿瘤样品的代表性样品显示高的mfi2蛋白表达。各个样品的mfi2蛋白表达水平以ng/mg总蛋白质提供,针对各肿瘤类型推导的中值用水平线条表示。测试的正常组织包括肾上腺、动脉、结肠、食道、胆囊、心脏、肾、肝、肺、外周神经和坐骨神经、胰腺、骨骼肌、皮肤、小肠、脾、胃、气管、红细胞和白细胞和血小板、膀胱、脑、乳腺、眼、淋巴结、卵巢、脑垂体、前列腺和脊髓。mfi2蛋白的可检测水平只见于脊髓、rbc浓厚液和外周血白细胞。几个bd、br、cr、lu、pa和skpdx肿瘤样品显著高于平均正常组织。这些数据结合上文所列mfi2表达的mrna转录数据有力地证实了mfi2是用于基于抗体的治疗干预的有吸引力的靶标的见解。实施例15免疫组织化学在pdx肿瘤和原发性人肿瘤组织切片中进行了免疫组织化学(ihc)以评价肿瘤细胞中mfi2的表达和位置。为了鉴定ihc-相容的抗mfi2抗体,使用本发明的多种抗mfi2抗体,在hek293t亲代细胞沉淀或mfi2表达hek293t细胞沉淀中进行ihc。与所测的本发明的其它抗mfi2抗体(数据未显示)相比,抗mfi2抗体c57.5、sc57.11、sc57.30、sc57.32、sc5735、sc5736和sc57.47能够更有效地特异性检测过量表达mfi2的hek293t细胞沉淀。这些抗体特异性检测mfi2的能力通过竞争实验来证实,其中将相关抗mfi2抗体与5x摩尔比率过量的hmfi2-his蛋白混合,然后与福尔马林固定的表达mfi2的hek293t和石蜡包埋(ffpe)的切片一起孵育。没有阳性染色表明,hmfi2-his蛋白干扰抗mfi2抗体与过量表达mfi2的hek293t细胞的结合(数据未显示)。如下所述,在正如是本领域的标准的福尔马林固定和石蜡包埋的(ffpe)组织中进行ihc。切取组织的平面切片,铺在玻璃显微镜载片上。在二甲苯脱蜡后,将5µm切片用抗原回收溶液(antigenretrievalsolution)(dako)在99℃下预处理20分钟,冷却至75℃,然后用含0.3%过氧化氢的pbs处理,接着用抗生物素蛋白/生物素封闭溶液(vectorlaboratories)处理。ffpe载片然后用含10%马血清的3%bsa/pbs缓冲液封闭,用在3%bsa/pbs中稀释至10µg/ml的本发明的第一抗mfi2抗体在室温下孵育30分钟。ffpe载片用在3%bsa/pbs中稀释至2.5µg/ml的生物素缀合的马抗小鼠抗体(vectorlaboratories)在室温下孵育30分钟,接着在链霉抗生物素蛋白-hrp(abcelitekit;vectorlaboratories)中孵育。然后按照来自tsa扩增试剂盒(tsaamplificationkit;perkinelmer)的生产商说明书,将原发性人肿瘤的ffpe载片在生物素酪酰胺中孵育,接着在链霉抗生物素蛋白-hrp中孵育。显色检测用3,3’-二氨基联苯胺(thermoscientific)在室温下显现5分钟,组织用meyer苏木精(ihcworld)复染,用酒精洗涤,并浸入二甲苯中。pdx肿瘤不进行tsa扩增。然后通过明视场显微镜观察切片,通过h评分记录肿瘤上皮上的mf12膜表达。h评分通过下式得到:3x强染色核的百分比+2x中等染色核的百分比+弱染色核的百分比,得到0-300的范围。图8a列出在不同的br、lu和skpdx系中通过ihc得到的膜hmfi2蛋白表达的h评分值。图8b表示由ihc得到的人原发性乳腺癌、肺癌和黑素瘤组织样品中的mfi2表达。显示了通过ihc,mfi2在50%三阴性乳腺癌患者样品、在61%肺腺癌样品、85%肺鳞状细胞癌样品和61%转移性黑素瘤患者样品中表达。实施例16采用流式细胞术检测hek293t细胞和肿瘤上的mfi2表达采用流式细胞术评价本发明的抗mfi2抗体特异性检测sk、br和lupdx肿瘤细胞系表面上人mfi2蛋白存在的能力。另外,还测定了br和lucsc表面上mfi2的表达。收获pdx肿瘤,并采用
技术领域:
公知的酶促组织消化技术解离,得到pdx肿瘤细胞的单细胞悬液(参见例如u.s.p.n.2007/0292414)。使pdx肿瘤单细胞悬液与4',6-二脒基-2-苯基吲哚(dapi)一起孵育以检测死细胞,与抗小鼠cd45和h-2kd抗体孵育以鉴定小鼠细胞,并与抗人epcam抗体孵育以鉴定人癌细胞。所得单细胞悬液包含包括ntg细胞和csc两者的肿瘤细胞的整批样品。为了将整批lupdx肿瘤细胞群原液分配到ntg和csc亚群中,使pdx肿瘤细胞与抗人cd46和/或cd324和esa抗体一起孵育(参见u.s.p.n.2013/0260385、2013/0061340和2013/0061342)。通过流式细胞术,使用bdfacscantoii流式细胞仪,用sc57.43(一种与人mfi2蛋白的长同等型上的运铁蛋白样结构域2(tfld2)结合的抗mfi2抗体)针对hmfi2的表达,分析整批或分选的肿瘤细胞。图9a显示sc57.43抗体检测出与igg同种型对照抗体(灰色实心)相比,部分活的未分选的人sk肿瘤细胞系(例如sk3、sk11、sk13、sk40、sk44、sk62、sk66、sk71)(黑色线)中hmfi2的较高表面表达水平。部分skpdx系表达突变的braf蛋白(v600e)(例如sk3、sk11、sk13),而其它表达野生型braf(sk40、sk44、sk62、sk66、sk71)。这些结果表明,本发明的抗mfi2抗体可用于诊断和治疗黑素瘤,并还可用于治疗表达野生型或突变braf的黑素瘤。图9b显示抗hmfi2抗体c57.43在整批lu和brpdx肿瘤细胞的表面上检出hmfi2的表达。在所有的样品中,抗mfi2抗体(黑色线)检出与igg同种型对照抗体(灰色实心)相比mfi2的表达升高。对于lu-ad(lu58和lu206)以及lu-scc(lu85),实体黑色线表示抗mfi2抗体的整批人肿瘤细胞的染色,显示了在lu58和lu85中但未在lu206pdx系中检出mfi2的表达。pdx肿瘤样品lu123(lu-ad)、lu120(lu-scc)、br31和br86(两者均br-基底样)显示与igg同种型对照抗体(灰色实心)相比,csc(实体黑色线)及lu和brpdx肿瘤细胞的ntg亚群(虚线)中的hmfi2表达升高。这表明mfi2在许多lu肿瘤亚型(lu-ad和lu-scc)的csc以及br肿瘤中表达。表达可量化为与用同种型对照抗体染色的同一肿瘤相比用抗mfi2抗体染色的肿瘤细胞表面上所观察到的几何平均荧光强度(δmfi)的改变。图9a和9b中以插图显示了概括所分析的每个肿瘤细胞系的δmfi的表。该数据证实了上述实施例15的ihc结果,其中乳腺癌pdx系br31和br86及黑素瘤pdx系sk3和sk40,通过ihc和流式细胞术也显示阳性染色。通过流式细胞术,lu206不显示hmfi2的表达,根据上文实施例1、2和3提供的低rna表达数据,这是预料之中的;并且进一步证实了抗mfi2抗体结合的特异性。总的来说,该数据表明作为gpi锚定的mfi2的长形式在sk、lu和brpdx肿瘤细胞中表达,使这些成为用抗mfi2抗体药物缀合物定向疗法的良好指示。实施例17抗mfi2抗体有利于细胞毒性剂的体外递送为了测定本发明的抗mfi2抗体是否能够内化以介导细胞毒性剂递送至肝肿瘤细胞,使用所选的抗mfi2抗体和与皂草素连接的第二抗小鼠抗体fab片段,进行了体外细胞杀死测定法。皂草素是一种使核糖体失活、从而抑制蛋白质合成并导致细胞死亡的植物毒素。皂草素是在细胞内有机会接近核糖体、但不能够独立内化的唯一的细胞毒素。因此,在这些测定法中皂草素介导的细胞毒性表明抗小鼠fab-皂草素构建体在结合和内化时缔合的抗mfi2小鼠抗体内化进入靶细胞的能力。将过量表达hmfi2的hek293t细胞的单细胞悬液以500个细胞/孔接种到bd组织培养板(bdbiosciences)上。一天后,将不同浓度的纯化的抗mfi2抗体(鼠或人源化)连同固定浓度的2nm抗小鼠iggfab-皂草素构建体(advancedtargetingsystems)(用于测试小鼠抗体)或2nm抗人iggfab-皂草素缀合物(用于测试人源化抗体)加入培养物中。在孵育96小时后,按照生产商说明书,使用celltiter-glo®(promega)清点活细胞数。将使用含有仅与第二fab-皂草素缀合物孵育的细胞的培养物的原始发光计数设为100%参考值,所有其它计数计算为参考值的百分比。大部分的抗mfi2抗体-皂草素缀合物在100pm的浓度下以不同的功效有效杀死过量表达hmfi2的hek293t细胞(图10a),而相同浓度下的小鼠igg1同种型对照抗体不能杀死。使用黑素瘤pdx肿瘤细胞系(sk43)重复上述实验。skpdx肿瘤从小鼠中收获,并使用生物素化抗小鼠cd45和h-2kd抗体和链霉抗生物素蛋白包被的亚铁珠磁性消耗小鼠细胞。肿瘤然后采用
技术领域:
公知的酶促组织消化技术解离,得到细胞的单细胞悬液(参见例如u.s.p.n.2007/0292414)。将细胞以2,500个细胞/孔接种至本领域已知的dmem培养基中。将250pm纯化的抗mfi2抗体连同固定浓度的2nm抗小鼠iggfab-皂草素构建体加入培养物中。在孵育几天后,按照生产商说明书,使用celltiter-glo®清点活细胞数。将含有仅与第二fab-皂草素缀合物一起孵育的细胞的培养物的原始发光计数设为100%参考值,所有其它计数计算为参考值的百分比。图10b显示抗mfi2小鼠抗体-皂草素缀合物有效杀死sk43pdx肿瘤细胞的有效数。最后,抗mfi2人源化抗体(hsc57.32、hsc57.32v1和hsc57.43)有效杀死过量表达mfi2的hek-293t细胞。人源化抗体显示与嵌合抗体(在hsc57.32和hsc57.43的情况下)以及它们从中衍生的鼠抗体(在hsc57.43的情况下)相当的功效(图10c)。上述结果表明抗mfi2抗体介导缀合的细胞毒性有效负荷的内化的能力,支持抗mfi2抗体可作为adc的靶向部分而具有治疗效用的设想。需要的是确定在(i)本发明的抗mfi2抗体介导内化和杀死细胞的能力和(ii)所述抗mfi2抗体与之结合的mfi2蛋白的表位之间是否有相关性。这类信息能够设计或选择特别有效的抗体。为此,在使用过量表达mfi2的hek293t细胞完成上述体外细胞杀死测定法之后,将活细胞的百分比针对所使用的抗mfi2抗体作图。将抗体分到通过实施例7所述框并实验确定的框中。框c和d中的抗体在内化和介导细胞死亡时特别有效,而框b中的抗体不太有效(图10d)。框a和e中的大部分抗体能够介导内化和杀灭,但程度低于框c和d中的抗体。如上述实施例7中所述,框a、b、c和d中的所有抗体与运铁蛋白样结构域2(tfld2)结合,而框e中的抗体与tfld1结合。这些结果表明,在框c和d中的抗体与之结合的tfld2结构域内可能有特定的表位,其使得抗体比例如框b中的抗体与之结合的tfld2中的表位a和b相比更有效。因此,框c和d中的抗体(例如sc57.32)和与这类抗体竞争的任何抗体包含由于其内化和杀死细胞的极佳能力所致在不同肿瘤的治疗中可能特别有效的一组抗mfi2抗体。实施例18抗mfi2抗体与吡咯并苯并二氮杂(pbd)的缀合使7种鼠抗mfi2抗体(sc57.4、sc57.5、sc57.9、sc57.32、sc57.41、sc57.43和sc57.46)和2种人源化位点特异性抗mfi2抗体(hsc57.32ss1和hsc57.43ss1)通过具有游离硫氢基的末端马来酰亚胺部分与吡咯并苯并二氮杂(pbd1)缀合以产生称为hsc57.32ss1pbd1和hsc57.43ss1pbd1的adc。鼠抗mf12抗体药物缀合物(adc)如下制备。抗mf12抗体的半胱氨酸键用预选确定的摩尔浓度添加的mol三(2-羧乙基)-膦(tcep)/mol抗体在含5mmedta的磷酸缓冲盐水(pbs)中在室温下部分还原90分钟。然后将所得部分还原的制备物通过马来酰亚胺接头与pbd1(在本说明书的上文中提供了pbd1的结构)在室温下缀合最少30分钟。然后使用在水中制备的10mm原液,加入与接头-药物相比过量的n-乙酰基半胱氨酸(nac),猝灭反应。在最少20分钟的猝灭时间后,加入0.5m乙酸调节ph至6.0。使用30kda膜通过渗滤,将adc的制备物进行缓冲液交换至渗滤缓冲液中。用蔗糖和聚山梨醇酯-20将渗滤的抗mfi2adc配制成最终的目标浓度。针对蛋白质浓度(通过测量uv)、聚集(sec)、通过反相hplc(rp-hplc)的药物与抗体比率(dar)和体外细胞毒性,分析所得的抗mfi2adc。采用改进的部分还原方法,使位点特异性人源化抗mfi2adc缀合。所需产物是这样的adc,其使在各个lc恒定区上的未配对半胱氨酸(c214)最大缀合,且使药物与抗体比率(dar)大于2(dar>2)的adc降到最低同时使dar为2(dar=2)的adc增到最大。为了进一步改进缀合的特异性,在与接头-药物缀合之前,采用包括稳定剂(例如l-精氨酸)和温和还原剂(例如谷胱甘肽)的方法,使抗体选择性地还原,接着渗滤和制备步骤。下面详细地描述了该方法。将各抗体的制备物在含有1ml-精氨酸/5mmedta与预选确定浓度的还原谷胱甘肽(gsh)的缓冲液(ph8.0)中在室温下部分还原最少2小时。然后使用30kda膜(milliporeamiconultra),使所有制备物进行缓冲液交换至20mmtris/3.2mmedta(ph7.0)缓冲液中以除去还原缓冲液。然后使所得部分还原的制备物通过马来酰亚胺接头与pbd1(在本说明书上文中提供了pbd1的结构)在室温下缀合最少30分钟。使用在水中制备的10mm原液,加入与接头-药物相比过量的nac,将反应猝灭。在最少20分钟的猝灭时间后,加入0.5m乙酸调节ph至6.0。使用30kda膜通过渗滤,将adc的制备物进行缓冲液交换至渗滤缓冲液中。用蔗糖和聚山梨醇酯-20将渗滤的抗mfi2adc配制成最终的目标浓度。针对蛋白质浓度(通过测量uv)、聚集(sec)、通过反相hplc(rp-hplc)的药物与抗体比率(dar)和体外细胞毒性,分析所得的抗mfi2adc。实施例19抗mfi2抗体与卡奇霉素的缀合使抗mfi2抗体(hsc57.32ss1)通过具有游离硫氢基的末端马来酰亚胺部分与卡奇霉素(cal)化合物缀合,以得到称为hsc57.32ss1cal的adc。所需产物是这样的adc,其在各lc恒定区的未配对半胱氨酸(c214)上最大缀合,且使具有大于2(dar>2)的药物与抗体比率(dar)的adc减至最低,同时使具有dar为2(dar=2)的adc增到最大。为了改进缀合的特异性,在与接头-药物缀合之前,使用包括稳定剂(例如l-精氨酸)和温和还原剂(例如谷胱甘肽)的方法,使抗体选择性还原,接着通过渗滤和制备步骤。下面详细地描述了该方法。在含有1ml-精氨酸/5mmedta与预选确定浓度的还原谷胱甘肽(gsh)的缓冲液(ph8.0)中使各抗体的制备物在室温下部分还原最少2小时。然后使用30kda膜(milliporeamiconultra),将所有制备物进行缓冲液交换至20mmtris/3.2mmedta(ph7.0)缓冲液中,以除去还原缓冲液。然后使在所得部分还原的制备物通过马来酰亚胺接头与卡奇霉素在室温下缀合最少120分钟。使用在水中制备的10mm原液,加入与接头-药物相比过量的nac,将反应猝灭。在最少20分钟的猝灭时间后,加入0.5m乙酸调节ph至6.0。通过使用30kda膜渗滤,将adc的制备物进行缓冲液交换至渗滤缓冲液。用蔗糖和聚山梨醇酯-20将渗滤的抗mfi2adc配制成最终的目标浓度。针对蛋白质浓度(通过测量uv)、聚集(sec)、通过反相hplc(rp-hplc)的药物与抗体比率(dar)和体外细胞毒性,分析所得的抗mfi2adc。实施例20抗mfi2抗体药物缀合物促进细胞毒性剂的体外递送为了测定本发明的全长抗mfi2adc是否能够内化以介导细胞毒性剂递送至活的肿瘤细胞中,使用抗mfi2adc、hsc57.32ss1pbd1和hsc57.43ss1pbd1(按上述实施例18所述产生)和hsc57.32ss1cal(按上述实施例19所述产生)进行了体外细胞杀死测定法。将过量表达hmfi2的hek293t细胞、内源表达mfi2的sk-mel-28细胞或幼稚hek293t细胞的单细胞悬液以500个细胞/孔接种在bd组织培养板(bdbiosciences)上。将来源于pdx肿瘤的br22和sk19细胞的单细胞悬液以2500个细胞/孔接种在primeria板中。一天后,不同浓度的纯化的adc或与pbd1或卡奇霉素缀合的人igg1对照抗体加入培养物中。将细胞孵育96小时或在pdx来源的肿瘤系的情况下孵育7天。在孵育后,按照生产商说明书,使用celltiter-glo®(promega)清点活细胞数。将使用含有未处理细胞的培养物的原始发光计数设为100%参考值,所有其它计数计算为参考值的百分比。图11a和11b显示与人igg1对照抗体相比,所有处理的细胞对抗mfi2adc敏感得多。此外,与过量表达mfi2的hek293t细胞相比,adc对不过量表达mfi2的幼稚hek293t细胞具有极小作用,表明了adc对mfi2抗原的特异性(图11a)。图11b显示包含不同毒素(pbd和卡奇霉素)的抗mfi2adc有效杀死br和sk肿瘤的能力。上述结果表明抗mfi2adc特异性介导内化和递送细胞毒性有效负荷至表达mfi2的细胞(包括黑素瘤和乳腺肿瘤细胞)的能力。实施例21抗mfi2抗体药物缀合物体内抑制肿瘤生长测试了按上文实施例18所述产生的抗mfi2adc以表明在免疫缺陷型小鼠中抑制br、lu和sk肿瘤生长的能力。采用
技术领域:
公知的技术,使表达mfi2的pdx肿瘤系(例如sk44、lu92、br22和br86)和显示较低mfi2表达水平的肿瘤系(例如lu134)在雌性nod/scid小鼠两肋皮下生长。每周一次或两次监测肿瘤体积和小鼠重量。当肿瘤体积达到150-250mm3时,把小鼠随机分配到治疗组。在对荷有br肿瘤的小鼠进行的研究中,用单剂量的20mg/kg多西他赛或紫杉醇(医治标准)、单剂量的0.8mg/kghsc57.32ss1pbd1或抗半抗原对照人igg1pbd1或单剂量的溶媒对照给小鼠腹膜内注射(图12a)。在对荷有黑素瘤或肺肿瘤的小鼠进行的研究中,用单剂量的2mg/kghsc57.43pbd1(在图12b中标示为抗mfi2adc)或抗半抗原对照人igg1pbd1或单剂量的溶媒对照给小鼠腹膜内注射(图12b)。在治疗后,监测肿瘤体积和小鼠重量直到肿瘤超过800mm3或小鼠生病。除了免疫缺陷型荷瘤nod/scid小鼠中常见的那些以外,用抗mfi2adc治疗的小鼠不显示任何不良健康作用。给予抗mfi2adc,在sk44、lu92、br22和br86肿瘤中导致显著的肿瘤抑制持续超过100天,而给予对照adcigg1pbd1(在br86的情况下,医治标准,紫杉醇和多西他赛)不引起肿瘤体积缩小。相反地,在具有低得多的mfi2表达水平的lu134肿瘤中,抗mfi2adc显示对肿瘤体积缩小具有极小的作用,通过化学发光测定法(实施例14)和流式细胞术(实施例11)测量。抗mfi2adc特异性杀死表达mfi2的肿瘤细胞和体内显著抑制肿瘤生长持续一段长时间的能力进一步证实抗mfi2adc在癌症和特别是乳腺癌tnbr亚型的治疗性治疗中的用途。更感兴趣的是,如具有2种医治标准药物的图12a所示,br86是耐药肿瘤细胞系,因此结果还表明,抗mfi2adc在缩小耐药肿瘤的肿瘤体积中有效。实施例22癌干细胞群mfi2表达的富集可将肿瘤细胞宽泛地分成2种类型的细胞亚群:非致瘤细胞(ntg)和肿瘤引发细胞或致瘤细胞。致瘤细胞当植入无免疫应答的小鼠中时具有形成肿瘤的能力,而非致瘤细胞没有这种能力。癌干细胞(csc)是一类致瘤细胞,并且能够无限地自我复制同时保持多谱系分化的能力。为了测定肿瘤中mfi2的表达是否会与致瘤性提高有关,进行了下列研究。使人sk-melpdx肿瘤样品在无免疫应答的小鼠中生长,在肿瘤达到800-2,000mm3后切除。采用
技术领域:
公知的酶促消化技术,将肿瘤解离成单细胞悬液(参见例如u.s.p.n.2007/0292414)。将人sk-melpdx肿瘤细胞用小鼠抗cd45或抗h2kd抗体染色以区分人肿瘤细胞和小鼠细胞。还将肿瘤用抗mfi2抗体(sc57.43)染色,然后采用facsaria™流式细胞仪(bdbiosciences)分选。将人tnbrpdx肿瘤细胞分离成表达mfi2的细胞群(mfi2-hi)和不表达mfi2的细胞群(mfi2-neg),正如平行同种型染色对照样品界定的。给5只雌性nod/scid无免疫应答的小鼠皮下注射50mfi2-hisk-mel肿瘤细胞;并给5只小鼠注射200mfi2-negsk-mel肿瘤细胞。在每周基础上测量肿瘤体积4个月。图13显示mfi2-hi肿瘤细胞体内能够再形成有功能的肿瘤,而mfi2-neg肿瘤不能够。因此,表达mfi2的肿瘤细胞的致瘤性比不表达mfi2的那些肿瘤细胞大得多,表明了mfi2蛋白在功能上限定人肿瘤内的致瘤亚群,并支持这样的构思,即所选的抗mfi2adc可用来靶向肿瘤细胞的致瘤亚群,这可导致显著的肿瘤消退并防止肿瘤复发。实施例23通过抗mfi2抗体-药物缀合物降低肿瘤引发细胞频率如实施例1、2和16所表明的,mfi2的表达与致瘤细胞有关。因此,为了证实用抗mfi2adc治疗降低已知是耐药的且激起肿瘤复发和转移的tic的频率,例如基本如下所述,进行了体内有限稀释测定法(lda)。使pdx肿瘤(例如乳腺、肺肿瘤或黑素瘤)在免疫缺陷型小鼠皮下生长。当肿瘤体积大小平均为150mm3–250mm3时,将小鼠随机分成两组。一组腹膜内注射与药物缀合的人igg1作为阴性对照;另一组腹膜内注射抗mfi2adc(例如按实施例18所述制备)。在给药后一周,使来自各组的代表性小鼠安乐死,收获其肿瘤,分散为单细胞悬液。然后按之前的实施例1所述,收获来自各治疗组的肿瘤细胞,合并且分散。将细胞用fitc缀合的抗小鼠h2kd和抗小鼠cd45抗体标记以检测小鼠细胞;用epcam标记以检测人细胞;用dapi标记以检测死细胞。使用bdfacscantoii流式细胞仪通过facs分选所得悬液,并分离和收集活的人肿瘤细胞。给多组小鼠注射1250、375、115或35个分选的来自用抗mfi2adc治疗的肿瘤的活的人细胞。作为阴性对照,给每组相同数目的小鼠移植1000、300、100或30个分选的来自用对照igg1adc治疗的肿瘤的活的人细胞。每周测量受体小鼠中的肿瘤,在肿瘤达到1500mm3前,使各个小鼠安乐死。将受体小鼠计为阳性或阴性肿瘤生长。阳性肿瘤生长定义为超过100mm3的肿瘤生长。应用泊松分布统计学(l-calc软件,stemcelltechnologies)计算各群中tic的频率。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1