靶向IL13Rα2的共刺激嵌合抗原受体T细胞的制作方法
发明背景
已经研究了基于肿瘤特异性t细胞的免疫疗法,包含使用工程化改造的t细胞的疗法用于抗肿瘤治疗。在一些情况下,用于该疗法的t细胞在体内维持不了足够长时间的活性。在一些情况下,t细胞的肿瘤特异性相对低。因而,本领域需要具有较长期抗肿瘤功能发挥的肿瘤特异性癌症疗法。
恶性神经胶质瘤(malignantgliomas,mg),其包含多形性成胶质细胞瘤(aa-iii级)和成胶质细胞瘤(gbm-iv级),在美国每年具有大概20,000例诊断的新病例的发生率。根据美国脑肿瘤协会(americanbraintumorassociation),基于美国2010人口普查数据,遭受恶性脑肿瘤的个体的总体患病率粗略地为140,000人。尽管mg是稀有疾病,但是在其恶性行为方面其为高度攻击性并且是异质的,并几乎一律致命。目前用于高级mg的护理标准疗法仅产生短期益处,并且这些脑肿瘤事实上是不能治愈的。的确,即使利用现代手术和放射治疗技术(其经常加剧通过定位于中枢神经系统(cns)强加的早已严重的发病率),5年的存活率也是非常低的。此外,对于复发疾病的大多数患者,存在很少的治疗选择。因此,明显需要更有效的疗法,特别用于已经在一线疗法后复发/进展的那些患者,并且保证该患者群体参与临床试验。
利用嵌合抗原受体(car)工程化改造的t细胞的过继性t细胞疗法(act)可以提供安全且有效的方式来减少mg的复发率,因为cart细胞可以被工程化改造以特异识别抗原不同的肿瘤群体(cartellieri等2010jbiomedbiotechnol2010:956304;ahmed等2010clincancerres16:474;sampson等2014clincancerres20:972;brown等2013clincancerres201218:2199;chow等2013molther21:629),并且t细胞可以通过脑实质迁移以靶向并杀死浸润性恶性细胞(hong等2010clincancerres16:4892;brown等2007jimmunol179:3332;hong等2010clincancerres16:4892;yaghoubi2009natclinpractoncol6:53)。临床前研究已经证明靶向il13rα2的car+t细胞针对干细胞样和分化型神经胶质瘤细胞显示有效的不依赖主要组织相容性复合体(mhc)的il13rα2-特异性细胞溶解活性,并且在体内诱导建立的神经胶质瘤异种移植物的消退(kahlon等2004cancerres64:9160;brown等2012clincancerres18:2199)。
发明概述
本文描述的是嵌合跨膜免疫受体(嵌合抗原受体或“car”),其包含胞外域、跨膜区和胞内信号传导域。胞外域由结合白介素-13rα2(il13rα2)的il-13配体,和任选地,间隔物(包含例如部分人fc域)构成。跨膜部分包含cd4跨膜域、cd8跨膜域、cd28跨膜域、cd3跨膜域或4ibb跨膜域。胞内信号传导域包含来自人cd3复合体的ζ链(cd3ζ)的信号传导域和一个或多个共刺激域,例如4-1bb共刺激域。当在t细胞表面上表达时,胞外域使得car能够指导t细胞活性导向表达il13rα2的那些细胞,所述il13rα2是在肿瘤细胞,包含神经胶质瘤的表面上表达的受体。重要的是,car的il13rα2结合部分包含氨基酸修饰,如e13y突变,其增加结合特异性。胞内区中包含串联cd3ζ的共刺激域,如4-1bb(cd137)共刺激域使得t细胞能够接受共刺激信号。可以工程化改造t细胞,例如患者特异的自体t细胞以表达本文所述的car并且可以扩大工程化改造的细胞并将其用于act。可以使用各种t细胞亚群。此外,可以在其他免疫细胞,如nk细胞中表达car。在利用表达本文所述的car的免疫细胞治疗患者时,所述细胞可以是自体或同种异体t细胞。在一些情况中,所用的细胞是cd4+和cd8+中央记忆型t细胞(tcm),其是cd45ro+cd62l+,并且使用此类细胞相比于使用其他类型的患者特异性t细胞可以提高过继性转移后细胞的长期存活。
本文描述的是编码嵌合抗原受体(car)r的核酸分子,其中所述嵌合抗原受体包含:人il-13或其具有1-10(例如1或2)个氨基酸修饰的变体;跨膜域,其选自:cd4跨膜域或其具有1-10(例如1或2)个氨基酸修饰的变体、cd8跨膜域或其具有1-10(例如1或2)个氨基酸修饰的变体、cd28跨膜域或其具有1-10(例如1或2)个氨基酸修饰的变体,和cd3ζ跨膜域或其具有1-10(例如1或2)个氨基酸修饰的变体;共刺激域;和cd3ζ信号传导域或其具有1-10(例如1或2)个氨基酸修饰的变体(cd3ζsignalingdomainofavariantthereofhaving1-10(e.g.,1or2)aminoacidmodifications)。
在多个实施方案中,共刺激域选自:cd28共刺激域或其具有1-10(例如1或2)个氨基酸修饰的变体、4-ibb共刺激域或其具有1-10(例如1或2)个氨基酸修饰的变体和ox40共刺激域或其具有1-10(例如1或2)个氨基酸修饰的变体。在某些实施方案中,存在4ibb共刺激域或其具有1-10(例如1或2)个氨基酸修饰的变体。
另外的实施方案,car包含:人il13的变体,其具有增加对il13rα2相对于il13rα1的结合特异性的1-10个氨基酸修饰;人il-13或其变体是il-13变体,其包含seqidno:3的氨基酸序列,具有1-5个氨基酸修饰,条件是seqidno:3的位置11上的氨基酸不是e;两个不同的共刺激域,其选自:cd28共刺激域或其具有1-10(例如1或2)个氨基酸修饰的变体、4ibb共刺激域或其具有1-10(例如1或2)个氨基酸修饰的变体和ox40共刺激域或其具有1-10(例如1或2)个氨基酸修饰的变体;两个不同的共刺激域,其选自:cd28共刺激域或其具有1-2个氨基酸修饰的变体、4ibb共刺激域或其具有1-2个氨基酸修饰的变体和ox40共刺激域或其具有1-2个氨基酸修饰的变体;人il-13或其具有1-2个氨基酸修饰的变体;跨膜域,其选自:cd4跨膜域或其具有1-2个氨基酸修饰的变体、cd8跨膜域或其具有1-2个氨基酸修饰的变体、cd28跨膜域或其具有1-2个氨基酸修饰的变体,和cd3ζ跨膜域或其具有1-2个氨基酸修饰的变体;共刺激域;和cd3ζ信号传导域或其具有1-2个氨基酸修饰的变体;定位在il-13或其变体与跨膜域之间的间隔物区(例如,间隔物区包含选自seqidno:4、14-20、50和52的氨基酸序列);间隔物包含igg铰链区;间隔物区包含10-150个氨基酸;4-1bb信号传导域包含seqidno:6的氨基酸序列;cd3ζ信号传导域包含seqidno:7的氨基酸序列;和定位在共刺激域与cd3ζ信号传导域或其变体之间的3-15氨基酸的接头。在某些实施方案中,在存在两个共刺激域的情况下,一个是4-ibb共刺激域,另一个是选自cd28和cd28gg的共刺激域。
在一些实施方案中:核酸分子表达包含选自seqidno:10、31-48和52的氨基酸序列的多肽;嵌合抗原受体包含il-13/igg4/cd4t/41-bb区(其包含seqidno:11的氨基酸)和cd3ζ信号传导域(其包含seqidno:7的氨基酸序列);并且嵌合抗原受体包含seqidno:10、31-48和52的氨基酸序列。
还公开的是通过包含编码嵌合抗原受体的表达盒的载体转导的人t细胞群,其中嵌合抗原受体包含:人il-13或其具有1-10个氨基酸修饰的变体;跨膜域,其选自:cd4跨膜域或其具有1-10个氨基酸修饰的变体、cd8跨膜域或其具有1-10个氨基酸修饰的变体、cd28跨膜域或其具有1-10个氨基酸修饰的变体,和cd3ζ跨膜域或其具有1-10个氨基酸修饰的变体;共刺激域;和cd3ζ信号传导域或其具有1-10个氨基酸修饰的变体。在多个实施方案中:人t细胞群包含表达嵌合抗原受体的载体,所述嵌合抗原受体包含选自seqidno:10、31-48和52的氨基酸序列;人t细胞群包含中央记忆型t细胞(tcm细胞)(例如,至少20%、30%、40%、50%、60%、70%、80%的细胞是tcm细胞;至少15%、20%、25%、30%、35%的tcm细胞是cd4+,并且至少15%、20%、25%、30%、35%的tcm细胞是cd8+)。
还描述的是在患者中治疗癌症的方法,其包含施用通过包含编码嵌合抗原受体的表达盒的载体转导的自体或同种异型(allogeneic)人t细胞(例如,包含tcm细胞的自体或同种异型t细胞,例如,至少20%、30%、40%、50%60%、70%、80%的细胞是tcm细胞;至少15%、20%、25%、30%、35%的tcm细胞是cd4+并且至少15%、20%、25%、30%、35%的tcm细胞是cd8+细胞),其中嵌合抗原受体包含选自seqidno:10、31-48和52的氨基酸序列。在多个实施方案中:人t细胞群包含中央记忆型t细胞;所述癌症是成胶质细胞瘤;并且转导的人t细胞通过下述方法制备,所述方法包含从患者获得t细胞,处理t细胞以分离中央记忆型t细胞,并利用包含编码嵌合抗原受体的表达盒的病毒载体转导中央记忆型细胞的至少部分,其中嵌合抗原受体包含选自seqidno:10、31-48和52的氨基酸序列。
还描述的是:核酸分子,其编码包含与选自seqidno:10和seqidno:10、31-48和52的氨基酸序列具有至少95%同一性(atleast95%identical)的氨基酸序列的多肽;核酸分子,其编码包含与选自seqidno:10、31-48和52的氨基酸序列相同的氨基酸序列的多肽,除了存在不超过5个氨基酸取代、缺失或插入;核酸分子,其编码包含与选自seqidno:10和seqidno:10、31-48和52的氨基酸序列相同的氨基酸序列的多肽,除了存在不超过5个氨基酸取代;和核酸分子,其编码包含与选自seqidno:10和seqidno:10、31-48和52的氨基酸序列相同的氨基酸序列的多肽,除了存在不超过2个氨基酸取代。
本文所述的某一car,例如il13(eq)bbζcar和il13(eq)cd28-bbζcar相比于某一其他il13-靶向性car具有某些有益的特征。例如,它们具有对il13rα的提高选择性,引发较低的th2细胞因子产生,特别是较低的il13产生。
表达靶向il13rα2的car的t细胞可以用于治疗癌症,如成胶质细胞瘤,以及表达il13rα2的其他癌症,其包含但不限于成神经管细胞瘤、乳腺癌、头与颈癌、肾癌、卵巢癌和卡波西(kaposi)肉瘤。因此,该公开内容包含使用表达本文所述的car的t细胞治疗癌症的方法。
该公开内容还包含编码本文所述的任何car的核酸分子(例如,包含编码cars之一的核酸序列的载体)和表达本文所述的任何car的分离的t淋巴细胞。
本文所述的car可以包含定位在il13域和跨膜域之间的间隔物区。可以使用多种不同的间隔物。它们中的一些包含人fc区的至少部分,例如人fc区的铰链部分或ch3域或其变体。下文表1提供了可以用于本文所述的car的多个间隔物。
表1:间隔物的实例
一些间隔物区包含整个或部分的免疫球蛋白(例如,igg1、igg2、igg3、igg4)铰链区,即落在免疫球蛋白的ch1和ch2域之间的序列,例如,igg4fc铰链或cd8铰链。一些间隔物区包含免疫球蛋白ch3域或ch3域和ch2域两者。免疫球蛋白来源的序列可以包含一个或多个氨基酸修饰,例如,1、2、3、4或5个取代,例如,减少脱靶结合的取代。
“氨基酸修饰”指蛋白质或肽序列中的氨基酸取代、插入,和/或缺失。“氨基酸取代”或“取代”指亲本肽或蛋白质序列中特定位置上的氨基酸被另一氨基酸替换。可以进行取代用于以非保守方式(即,通过将密码子从属于具有特定大小或特征的氨基酸分组的氨基酸改变成属于另一分组的氨基酸)或以保守方式(即,通过将密码子从属于具有特定大小或特征的氨基酸分组的氨基酸改变成属于相同分组的氨基酸)来改变所得蛋白质中的氨基酸。该保守改变一般导致所得蛋白质结构和功能的较少改变。以下是氨基酸多个分组的实例:1)具有非极性r基团的氨基酸:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸;2)具有不带电的极性r基团的氨基酸:甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺;3)具有带电的极性r基团的氨基酸(在ph6.0时带负电):天冬氨酸、谷氨酸;4)碱性氨基酸(在ph6.0时带正电):赖氨酸、精氨酸、组氨酸(在ph6.0)。另一分组可能是具有苯基的那些氨基酸:苯丙氨酸、色氨酸,和酪氨酸。
在某些实施方案中,间隔物来源于igg1、igg2、igg3或igg4,其包含用与未修饰间隔物中存在的氨基酸残基不同的氨基酸残基取代的一个或多个氨基酸残基。所述一个或多个取代的氨基酸残基选自,但不限于位置220、226、228、229、230、233、234、235、234、237、238、239、243、247、267、268、280、290、292、297、298、299、300、305、309、218、326、330、331、332、333、334、336、339上的一个或多个氨基酸残基,或其组合。在该编号体系中,在下文更详细地描述,表1中igg4(l235e、n297q)间隔物中的第一个氨基酸是219,并且表1中igg4(hl-ch3)间隔物中的第一个氨基酸是219,其是表1中igg铰链序列和igg4铰链接头(hl)序列中的第一个氨基酸。
在一些实施方案中,修饰的间隔物来源于igg1、igg2、igg3或igg4,其包含,但不限于一个或多个以下氨基酸残基取代:c220s、c226s、s228p、c229s、p230s、e233p、v234a、l234v、l234f、l234a、l235a、l235e、g236a、g237a、p238s、s239d、f243l、p247i、s267e、h268q、s280h、k290s、k290e、k290n、r292p、n297a、n297q、s298a、s298g、s298d、s298v、t299a、y300l、v305i、v309l、e318a、k326a、k326w、k326e、l328f、a330l、a330s、a331s、p331s、i332e、e333a、e333s、e333s、k334a、a339d、a339q、p396l,或其组合。
在某些实施方案中,修饰的间隔物来源于igg4区,其包含利用与未修饰区域中存在的氨基酸残基不同的氨基酸残基取代的一个或多个氨基酸残基。一个或多个取代的氨基酸残基选自,但不限于位置220、226、228、229、230、233、234、235、234、237、238、239、243、247、267、268、280、290、292、297、298、299、300、305、309、218、326、330、331、332、333、334、336、339上的一个或多个氨基酸残基或其组合。
在一些实施方案中,修饰的间隔物来源于igg4区,其包含,但不限于以下氨基酸残基取代的一个或多个:220s、226s、228p、229s、230s、233p、234a、234v、234f、234a、235a、235e、236a、237a、238s、239d、243l、247i、267e、268q、280h、290s、290e、290n、292p、297a、297q、298a、298g、298d、298v、299a、300l、305i、309l、318a、326a、326w、326e、328f、330l、330s、331s、331s、332e、333a、333s、333s、334a、339d、339q、396l或其组合,其中未修饰间隔物中的氨基酸被所指示位置上的上文鉴定的氨基酸取代。
对于本文讨论的免疫球蛋白中的氨基酸位置,根据eu索引或eu编号体系(kabat等1991sequencesofproteinsofimmunologicalinterest,第5版,unitedstatespublichealthservice,nationalinstitutesofhealth,bethesda,由此以其整体作为参考并入)进行编号。eu索引或kabat或eu编号体系中的eu索引指eu抗体的编号(edelman等1969procnatlacadsciusa63:78-85)。
多种跨膜域可以用于针对il13ra2的car。表2包含合适跨膜域的实例。当存在间隔物域时,跨膜域定位在间隔物域的羧基末端。
表2:跨膜域的实例
本文所述的许多car包含一个或多个(例如两个)共刺激域。共刺激域定位在跨膜域和cd3ζ信号传导域之间。表3包含与cd3ζ信号传导域的序列一起的合适的共刺激域的实例。
表3:共刺激域的实例
附图简述
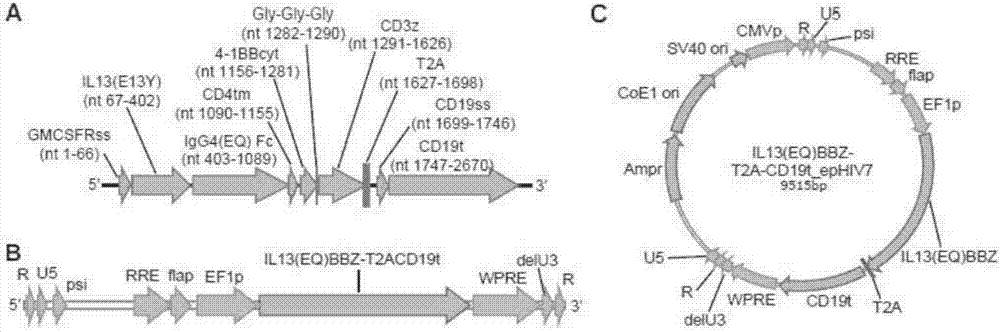
图1是il13(e13y)-zetakinecar(左)的示意性描述,所述il13(e13y)-zetakinecar由所指示的il13rα2-特异性人il-13变体(huil-13(e13y))、人igg4fc间隔物(huγ4fc)、人cd4跨膜(hucd4tm),和人cd3ζ链胞质(hucd3ζcyt)部分组成。还描述的是il13(eq)bbζcar,其与il13(e13y)-zetakine相同,除了定位在igg4间隔物的ch2域中红色指示的两个点突变l235e和n297q,并添加了共刺激4-1bb胞质域(4-1bbcyt)。
图2a-c描述了某些载体可读框。a是2670个核苷酸il13(eq)bbz-t2acd19t构建体的cdna可读框的图表,其中指示了il13(eq)bbzcar的il13rα2-特异性配体il13(e13y)、igg4(eq)fc铰链、cd4跨膜、4-1bb胞质信号传导、三甘氨酸接头,和cd3ζ胞质信号传导域,以及t2a核糖体跳跃(skip)和截短的cd19序列。还指示了人gm-csf受体α和驱动il13(eq)bbζcar和cd19t表面表达的cd19信号序列。b是侧翼为将整合至宿主基因组中的长末端重复(由‘r’指示)的序列的图表。c是il13(eq)bbz-t2a-cd19t_ephiv7质粒图。
图3描述了phiv7的构建。
图4描述了phiv7的元件。
图5描述了il13(eq)bbζ/cd19t+tcm的产生图解。
图6a-c描述了表面转基因和t细胞标志物表达的流式细胞检测分析的结果。il13(eq)bbζ/cd19t+tcmhd006.5和hd187.1被抗il13-pe和抗cd8-fitc共染色以检测cd8+car+和cd4+(即,cd8阴性)car+细胞(a),或被抗cd19-pe和抗cd4-fitc共染色以检测cd4+cd19t+和cd8+(即,cd4阴性)car+细胞(b)。il13(eq)bbζ/cd19t+tcmhd006.5和hd187.1被荧光色素缀合的抗cd3、tcr、cd4、cd8、cd62l和cd28(灰色柱状图)或同种型对照(黑色柱状图)染色(c)。在所有情况中,百分比基于高于同种型染色的有活力的淋巴细胞(dapi阴性)。
图7a-b描述了il13(eq)bbz+tcm的il13rα2-特异性效应器功能的体外功能表征。il13(eq)bbz/cd19t+tcmhd006.5和hd187.1在使用10:1e:t比例基于cd19t表达的6-小时51cr释放测定中用作效应器。将il13rα2阳性肿瘤靶标是k562工程化改造的,以表达il13rα2(k562-il13rα2)和原代神经胶质瘤系pbt030-2,并且il13rα2阴性肿瘤靶标对照是k562亲本系(a)。在与il13rα2阳性和阴性靶标以10:1e:t比例过夜共培养后评估il13(eq)bbz/cd19t+tcmhd006.5和hd187.1的抗原依赖性细胞因子产生。使用bio-plexpro人细胞因子th1/th2测定试剂盒测定细胞因子水平并报道了inf-γ(b)。
图8a-c描述了研究结果,其证明在il13(eq)bbζ/cd19t+tcm过继性转移后建立的神经胶质瘤肿瘤异种移植物的消退。将egfp-ffluc+pbt030-2肿瘤细胞(1×105)立体定向植入nsg小鼠的右前脑中。在第5天,小鼠接受2x106个il13(eq)bbζ/cd19t+tcm(1.1x106car+;n=6)、2x106个模拟tcm(无car;n=6)或pbs(n=6)。来自各组的代表性小鼠,其显示使用xenogenlivingimage的相对肿瘤负荷(a)。ffluc流量(光子/秒)的定量显示il13(eq)bbζ/cd19t+tcm与模拟转导的tcm和pbs相比诱导肿瘤消退(#p<0.02,*p<0.001,重复测量anova)(b)。kaplanmeier存活曲线(n=6/组),证明利用il13(eq)bbζ/cd19t+tcm处理的小鼠的存活显著提高(p=0.0008;时序检验)(c)。
图9a-c描述了比较il13(eq)bbztcm和il13-zetakinectl克隆的抗肿瘤效果的研究结果。将egfp-ffluc+pbt030-2tss(1×105)立体定向植入nsg小鼠的右前脑中。在第8天,小鼠接受1.6x106个模拟tcm(无car)、1.0×106car+il13(eq)bbζtcm(1.6×106全部t细胞;63%car)、1.0x106il13-zetakinecd8+ctlcl.2d7(克隆car+),或没有处理(n=6/组)。来自各组的代表性小鼠使用xenogenlivingimage显示相对肿瘤负荷(a)。ffluc流量(光子/秒)的自然对数随时间的线性回归线,p-值通过时间相互的比较用于组(p-valuesareforgroupbytimeinteractioncomparisons)(b)。kaplanmeier存活分析(n=6/组)证明与il13-zetakinecd8+ctlcl.2d7相比,利用il13(eq)bbζtcm处理的小鼠的存活显著提高(p=0.02;时序检验)(c)。
图10a-c描述了比较il13(eq)bbζtcm和il13-zetakinectl克隆的抗肿瘤效果的研究结果。将egfp-ffluc+pbt030-2tss(1×105)立体定向植入nsg小鼠的右前脑中。在第8天,小鼠接受1.3x106模拟tcm(无car;n=6)、1.0、0.3或0.1x106car+il13(eq)bbζtcm(78%car+;n=6-7)、1.0、0.3或0.1x106个il13-zetakinecd8+ctlcl.2d7(克隆car+;n=6-7),或无处理(n=5)。来自各组的代表性小鼠的xenogen成像显示相对肿瘤负荷(a)。ffluc流量(光子/秒)的自然对数的线性回归线显示与第一代il13-zetakinectlcl.2d7、模拟tcm和仅肿瘤相比,il13(eq)bbζtcm实现卓越的肿瘤消退。肿瘤注射后第27天的平均流量/组证明0.1x106个il13(eq)bbζtcm剂量胜过高10倍剂量的1.0x106个il13-zetakinecd8+ctlcl.2d7(p=0.043;welch两样品t-检验)(c)。
图11描述了研究结果,其证明与il13-zetakinectl克隆相比il13(eq)bbζtcm展示提高的持续性。cd3免疫组织化学在t细胞输注后7天在肿瘤位点上评估t细胞持续性。检测il13(eq)bbζtcm的显著数量的t细胞(上图)。相反,检测到极少的有活力的cd3+il13-zetakinet细胞(下图)。
图12a-d描述了比较用于大的建立肿瘤的car+t细胞递送途径(i.c.相对于i.v.)的实验结果。将egfp-ffluc+pbt030-2tss(1×105)植入nsg小鼠的右前脑中。在第19天和第26天,利用5x106个car+il13(eq)bbζ+tcm(11.8x106总细胞;n=4),或模拟tcm(11.8x106细胞;n=4)通过尾静脉i.v.注射小鼠。或者,在第19、22、26和29天,利用1x106个car+il13(eq)bbζ+tcm(2.4x106个总细胞;n=4),或模拟tcm(2.4x106个细胞;n=5)i.c.注射小鼠。随时间的平均ffluc流量(光子/秒)显示i.c.递送的il13(eq)bbζtcm介导第19天肿瘤的肿瘤消退。通过比较,i.v.递送的t细胞与未处理的或模拟tcm对照相比不显示肿瘤负荷的减少(a)。kaplanmeier存活曲线证明与利用i.v.施用的car+tcm处理的小鼠相比利用il13(eq)bbztcmi.c.处理的小鼠的存活提高(p=0.0003时序检验)(b)。利用il13(eq)bbz+tcmi.v.(c)相对于i.c.(d)处理的小鼠的代表性h&e和cd3ihc。仅在i.c.处理组中检测到cd3+t细胞,对于i.v.处理的小鼠,在肿瘤或周围脑实质中没有检测到cd3+细胞。
图13a-b描述了研究结果,其显示颅内、瘤内(i.c.t.)或心室内(i.c.v.)注射的car+t细胞可以运输到对面半球上的肿瘤中。将egfp-ffluc+pbt030-2tss(1×105)立体定向植入nsg小鼠的右前脑和左前脑中。在第6天,利用1.0x106il13(eq)bbζ+tcm(1.6x106总细胞;63%car;n=4)在右边肿瘤位点i.c.注射小鼠。多病灶神经胶质瘤实验模型的示意图(a)。cd3ihc显示t细胞浸润右边和左边肿瘤位点二者(b)。
图14a-c描述了评估il13rα2-特异性car的共刺激域的一系列研究的结果。il13ra2-特异性car构建体的示意图,其比较多个胞内内(endo)/信号传导域,包含缺少共刺激的第一代cd3zcar,相对于掺入4-1bb或cd28的第二代car,相对于含有cd28和41bb的第三代car。所有car盒也含有t2a核糖体跳跃和截短的cd19(cd19t)序列作为用于转导细胞的标志物(a)。通过慢病毒转导cd4和cd8tcm并且通过抗cd19免疫磁性富集表达car的t细胞。如通过流式细胞术所测定的cd19和il13(即,car)表达水平(b)。通过用car(il13)平均荧光强度(mfi)除以转导标志物(cd19t)的平均荧光强度测定各car构建体的稳定性(c)。含有4-1bb的car证明与cd19t转导标志物相比最低的表达水平。
图15a-b描述了研究结果,其证明含有4-1bb共刺激域的il13rα2-特异性car产生较少的th1和th2细胞因子。在指示的效应器:靶标比例的4小时51cr释放测定中测定所指示的模拟-转导的或表达car的t细胞杀死表达il13rα2的pbt030-2肿瘤细胞靶标的能力。描述了一式三份孔的均值%铬释放+s.d.(a)。如预期,模拟转导的t细胞不有效裂解靶标。相反,所有表达car的t细胞以相似的方式裂解肿瘤细胞。所指示的模拟转导的或表达car的t细胞与表达il13rα2的pbt030-2肿瘤细胞以10:1比例共培养过夜并且通过细胞测定珠阵列分析上清液中il-13和ifn-γ水平(b)。描述了一式三份孔的均值+s.d.。有趣的是,表达ζ、41bb-ζ或cd28-41bb-ζcar的t细胞比表达cd28-ζcar的t细胞展示更低的抗原刺激的细胞因子产生。
图16a-c描述了il13rα2-特异性car的体内效果的一系列研究结果。nsg小鼠在第0天接受ffluc+pbt030-2肿瘤细胞的颅内注射,并在第8天随机化到6个组中(n=9-10小鼠/组)用于pbs(仅肿瘤)、模拟转导的t细胞或表达指示的il13rα2-特异性car的t细胞的i.c.处理。然后进行定量生物发光成像以监测肿瘤随时间的生长。各组中代表性小鼠的生物发光图像(a)。各组中萤光素酶活性随时间的总体流量水平的均值+s.e.(b)。在第27天各小鼠的流量水平。除了利用表达cd28-car的t细胞处理的那些组,利用il13rα2-特异性cart细胞处理的所有组与利用模拟转导的t细胞处理的小鼠相比在肿瘤体积上显示统计学上显著的减少(c)
图17描述了il13(eq)bbζ/cd19t+的氨基酸序列(seqidno:10)。
图18描述了il13(eq)41bbζ[il13{eq}41bbζt2a-cd19t_ephiv7;pf02630](seqidno:12)与cd19rop_ephiv7(pj01683)(seqidno:13)的序列比较。
图19描述了il13(emy)-cd8h3-cd8tm2-41bbζ的氨基酸序列(具有gmscfra信号肽的seqidno:31;没有gmscfra信号肽的seqidno:39)。
图20描述了il13(emy)-cd8h3-cd28tm-cd28gg-41bb-ζ的氨基酸序列(具有gmscfra信号肽的seqidno:32;没有gmscfra信号肽的seqidno:40)。
图21描述了il13(emy)-igg4(hl-ch3)-cd4tm-41bb-ζ的氨基酸序列(具有gmscfra信号肽的seqidno:33;没有gmscfra信号肽的seqidno:41)。
图22描述了il13(emy)-igg4(l235e,n297q)-cd8tm-41bb-ζ的氨基酸序列(具有gmscfra信号肽的seqidno:34;没有gmscfra信号肽的seqidno:42)。
图23描述了il13(emy)-linker-cd28tm-cd28gg-41bb-ζ的氨基酸序列(具有gmscfra信号肽的seqidno:35;没有gmscfra信号肽的seqidno:43)。
图24描述了il13(emy)-hl-cd28m-cd28gg-41bb-ζ的氨基酸序列(具有gmscfra信号肽的seqidno:36;没有gmscfra信号肽的seqidno:44)。
图25描述了il13(emy)-igg4(hl-ch3)-cd28tm-cd28gg-41bb-ζ的氨基酸序列(具有gmscfra信号肽的seqidno:37;没有gmscfra信号肽的seqidno:45)。
图26描述了il13(emy)igg4(l235e,n297q)-cd28tm-cd28gg-41bb-ζ的氨基酸序列(具有gmscfra信号肽的seqidno:38;没有gmscfra信号肽的seqidno:46)。
图27描述了il13(emy)-cd8h3-cd8tm-41bbζ的氨基酸序列(具有gmscfra信号肽的seqidno:47;没有gmscfra信号肽的seqidno:48)。
发明详述
下文描述的是多个il13rα2-特异性嵌合抗原受体的结构、构建和表征。嵌合抗原(car)是这样的重组生物分子,其最少含有胞外识别域、跨膜区,和胞内信号传导域。因此,术语“抗原”不限于结合抗体的分子,还指可以特异性结合靶标的任何分子。例如,car可以包含特异性结合细胞表面受体的配体。胞外识别域(还称作胞外域或简单地由其含有的识别元件所指)包含特异性结合靶细胞的细胞表面上存在的分子的识别元件。跨膜区锚定膜中的car。胞内信号传导域包含来自人cd3复合体的ζ链的信号传导域并任选地包含一个或多个共刺激信号传导域。car可以既结合抗原又转导t细胞激活,其不依赖于mhc限制。因此,car是“通用”免疫受体,其可以治疗具有抗原阳性肿瘤的患者群体,不论其hla基因型如何。使用表达肿瘤特异性car的t淋巴细胞的过继性免疫疗法可以是用于治疗癌症的强大治疗策略。
本文所述的一个il13rα2-特异性car称作il13(eq)bbζ。该car包含多个重要特征,包含:具有氨基酸改变的il13α2配体,所述氨基酸改变提高与il13α2结合的特异性;cd137(4-1bb)的域与cd3ζ串联以提供有益的共刺激;和igg4fc区,其在ch2区内的两个位点上以减少被fc受体(fcr)结合的方式被突变(l235e;n297q)。本文所述的其他car含有第二个共刺激域。
在一些情况中,可以使用载体产生本文所述的car,包含il13(eq)bbζcar,在所述载体中car可读框后接t2a核糖体跳跃序列和截短的cd19(cd19t),其缺少胞质信号传导尾部(在第323位氨基酸上被截短)。在该排列中,cd19t的共表达提供惰性的非免疫原性表面标志物,其允许精确测定基因修饰的细胞,并使得能够阳性选择基因修饰的细胞,以及有效的细胞运输和/或在过继性转移后体内治疗性t细胞成像。cd19t的共表达提供用于使用临床可得的抗体和/或免疫毒素试剂在体内免疫靶向转导细胞以选择性删除治疗细胞,并由此作为自杀开关起作用的标志物。
神经胶质瘤表达il13受体,特别是高亲和力il13受体。然而,不像il13受体,神经胶质瘤细胞过表达独特的il13rα2链,其能够不依赖对il4rβ或γc44的需要而结合il13。与其同系物il4相似,il13在cns外具有多效(pleotropic)的免疫调节活性。il13和il4均刺激b淋巴细胞产生ige并抑制巨噬细胞产生促炎症细胞因子。
使用利用放射标记的il13的放射自显影技术的详细研究已经证明在所研究的几乎所有恶性神经胶质瘤组织上大量的il13结合。该结合在肿瘤切片和单细胞分析中是高度同质的。然而,对il13rα2mrna特异的分子探针分析不检测神经胶质瘤特异性受体通过正常脑元件的表达,并且利用放射标记的il13的放射自显影技术也不能检测正常cns中的特异性il13结合。这些研究提示共有的il13rα1/il4β/γc受体在正常的cns中不可被检测地表达。因而,il13rα2是神经胶质瘤非常特异的细胞表面靶标并且是被设计用于治疗神经胶质瘤的car的合适靶标。
然而,基于il13的治疗分子与广泛表达的il13rα1/il4β/γc受体复合体结合具有向cns外的正常组织介导不想要的毒性的潜力,并因此限制这些试剂的全身施用。il13α螺旋a第13位氨基酸上酪氨酸对天然谷氨酸的氨基酸取代选择性地降低了il13对il13rα1/il4β/γc受体的亲和力。然而,该突变体(称为il13(e13y))与il13rα2的结合相对于野生型il13是增加的。因此,该最低限度改变的il13类似物同时增加了il13对神经胶质瘤细胞的特异性和亲和力。因而,本文所述的car包含在第13位氨基酸(根据debinski等1999clincancerres5:3143s的编号)上含有突变(e变成y或e变成一些其他氨基酸如k或r或l或v)的il13。然而,也可以使用具有天然序列的il13,并且可以特别可用于下述情况,其中有待如通过直接注射到肿瘤块中局部施用所述修饰的t细胞。
可以通过本领域已知的任何手段产生本文所述的car,尽管优选使用重组dna技术产生它。可以通过本领域已知的便利分子克隆的标准技术(基因组文库筛选、pcr、引物-辅助的连接、定点诱变等)制备编码嵌合受体的几个区域的核酸并将其装配成完整的编码序列。将所得的编码区优选插入表达载体中并用于转化合适的表达宿主细胞系,优选t淋巴细胞细胞系,并最优选自体t淋巴细胞细胞系。
可以利用用于car表达的载体转导从患者分离的多个t细胞亚群,包含未选择的pbmc或富集的cd3t细胞或富集的cd3或记忆型t细胞亚群。中央记忆型t细胞是一种有用的t细胞亚群。可以通过选择cd45ro+/cd62l+细胞,使用例如
实施例
实施例1:il13rα2-特异性car的构建和结构
在下文描述了有用的il13rα2-特异性car的结构。密码子优化的car序列含有在单个位点上突变(e13y)以减少与il13rα1的可能结合的膜栓系il-13配体、含有极大减少fc受体介导的识别模型的两个突变(l235e;n297q)的igg4fc间隔物、cd4跨膜域、共刺激4-1bb胞质信号传导域,和cd3ζ胞质信号传导域。t2a核糖体跳跃序列将该il13(eq)bbζcar序列与cd19t分隔开,所述cd19t是惰性的非免疫原性细胞表面检测/选择标志物。该t2a连接导致il13(eq)bbζ和cd19t从单个转录本协同表达。图1a是编码il13(eq)bbz-t2acd19t构建体的2670个核苷酸的可读框的示意图。在该图中,il13(eq)bbzcar的il13rα2-特异性配体il13(e13y)、igg4(eq)fc、cd4跨膜、4-1bb胞质信号传导、三甘氨酸接头,和cd3ζ胞质信号传导域,以及t2a核糖体跳跃和截短的cd19序列均被指出。也指出了驱动il13(eq)bbzcar和cd19t表面表达的人gm-csf受体α和cd19信号序列。因此,il13(eq)bbz-t2acd19t构建体包含il13rα2特异性的铰链优化的共刺激嵌合免疫受体序列(命名为il13(eq)bbz)、核糖体跳跃t2a序列,和cd19t序列。
通过融合人gm-csf受体α前导肽与il13(e13y)配体5l235e/n297q-修饰的igg4fc铰链(其中双突变干扰fcr识别)、cd4跨膜、4-1bb胞质信号传导域,和cd3ζ胞质信号传导域序列来产生il13(eq)bbz序列。在密码子优化后从头合成该序列。从消化含t2a的质粒获得t2a序列。从横跨含cd19的质粒的前导肽序列与跨膜组分(即,碱基对1-972)获得cd19t序列。将所有三个片段,1)il13(eq)bbz,2)t2a,和3)cd19t克隆到ephiv7慢病毒载体的多克隆位点中。当转染到适当的细胞中时,载体整合图1b中示意描述的序列到宿主细胞基因组中。图1c提供9515个碱基对的il13(eq)bbz-t2a-cd19t_ephiv7质粒自身的示意图。
如图2中示意所示,il13(eq)bbzcar与先前描述的il13rα2-特异性car(称作il13(e13y)-zetakine)在几个重要方面不同(brown等2012clinicalcancerresearch18:2199)。il13(e13y)-zetakine由所示的il13rα2-特异性人il-13突变蛋白(huil-13(e13y))、人igg4fc间隔物(huγ4fc)、人cd4跨膜(hucd4tm),和人cd3ζ链胞质(hucd3ζcyt)部分组成。相反,il13(eq)bbζ)具有两个点突变l235e和n297q,其定位在igg4间隔物的ch2域中,和共刺激4-1bb胞质域(4-1bbcyt)。
实施例2:用于表达il13rα2-特异性car的ephiv7的构建和结构
phiv7质粒是这样的亲代质粒,在cityofhope(coh)的tcelltherapeuticsresearchlaboratory(tctrl)中从所述亲代质粒衍生临床载体il13(eq)bbz-t2a-cd19t_ephiv7。从phiv7载体产生用于表达car的ephiv7载体。重要的是,该载体使用人ef1启动子以驱动car的表达。载体的5'和3'序列都来源于如先前来源于hxbc2前病毒的pv653rsn。聚嘌呤区dna瓣(flap)序列(cppt)来源于来自nihaidsreagentrepository的hiv-1菌株pnl4-3。先前描述了土拨鼠(woodchuck)转录后调节元件(wpre)序列。
在图3中示意描述了phiv7的构建。简言之,如下将pv653rsn亚克隆至pbluescript中,所述pv653rsn含有来自gag-pol的653bp加上5’和3’长末端重复(ltrs)与居间sl3-新霉素磷酸转移酶基因(neo):在步骤1中,从5’ltr到rev-响应元件(rre)的序列构成了p5’hiv-151,然后通过去除tata盒上游的序列修饰5'ltr,并首先连接cmv增强子,然后连接sv40复制起始区(p5'hiv-2)。在步骤2中,将3'ltr克隆到pbluescript中以制备p3’hiv-1,在3'ltr增强子/启动子中进行400-bp缺失以去除hivu3中的顺式调节元件并形成p3'hiv-2。在步骤3中,连接从p5'hiv-3和p3'hiv-2分离的片段以制备phiv-3。在步骤4中,通过去除额外的上游hiv序列进一步修饰p3'hiv-2来产生p3’hiv-3,并将含有wpre的600-bpbamhi-sali片段添加到p3’hiv-3来制备p3'hiv-4。在步骤5中,通过pcr在大小上减少phiv-3rre并将其连接到来自phiv-3的5’片段(未显示)和p3’hiv-4中,以制备phiv-6。在步骤6中,从pnl4-3扩增含有来自hiv-1pnl4-3(55)的cpptdna瓣序列的190-bpbglii-bamhi片段并置于phiv6中的rre与wpre序列之间来制备phiv-7。该亲代质粒phiv7-gfp(gfp,绿色荧光蛋白)用于使用四质粒系统包装亲代载体。
将病毒基因组有效包装到载体中需要包装信号psiψ。rre和wpre增强rna转录本转运和转基因的表达。已经证明瓣序列与wpre组合增强哺乳动物细胞中慢病毒载体的转导效率。
将产生病毒载体所需的辅助功能分到三个独立质粒中以减少通过重组产生能够复制的慢病毒的可能性:1)pcgp编码病毒载体装配所需的gag/pol蛋白;2)pcmv-rev2编码rev蛋白,其作用于rre序列上以辅助病毒基因组转运用于有效的包装;和3)pcmv-g编码水疱-口炎病毒(vesiculo-stomatitisvirus,vsv)的糖蛋白,其为病毒载体的传染性所需。
在phiv7编码的载体基因组与辅助质粒之间存在最小的dna序列同源性。同源区域包含大概600个核苷酸的包装信号区,其定位在pcgp辅助质粒的gag/pol序列中;所有三个辅助质粒中的cmv启动子序列;和辅助质粒pcgp中的rre序列。非常可能的是由于这些区域中的同源性可产生能够复制的重组病毒,因为其需要多个重组事件。此外,任何所得的重组子均可能会丢失功能性ltr和tat序列,其为慢病毒复制所需。
cmv启动子被ef1α-htlv启动子(ef1p)替换,并将新的质粒命名为ephiv7(图4)。ef1p具有563bp并使用nrui和nhei将其引入到ephiv7中,在切掉cmv启动子后。
已经从该系统去除了慢病毒基因组,不包含gag/pol和rev,其为野生型病毒的病原性所必需并且为靶细胞的有效感染所需。此外,il13(eq)bbz-t2acd19t_ephiv7载体构建体不含有完整的3’ltr启动子,所以靶定细胞中所得的表达的和反向转录的dna前病毒基因组将具有无活性的ltr。由于该设计,没有hiv-i来源的序列从前病毒转录并且仅治疗序列将从其各自启动子表达。预期sin载体中ltr启动子活性的去除显著减少了宿主基因无意激活的可能性(56)。表4概述了il13(eq)bbz-t2acd19t_ephiv7中存在的多个调节元件。
实施例3:产生用于转导患者t细胞的载体
对于每个质粒(il13(eq)bbz-t2a-cd19t_ephiv7;pcgp;pcmv-g;和pcmv-rev2),产生种子库,其用于接种发酵罐以产生足够量的质粒dna。测试质粒dna的身份(identity)、无菌性(sterility)和内毒素,之后在生成慢病毒载体中使用它。
简言之,从293t工作细胞(wcb)扩增细胞,所述293t工作细胞已经被测试以验证无菌性和病毒污染的缺乏。融化来自293twcb的293t细胞的小瓶。培养细胞并扩增直至存在足够数量的细胞以平铺适当数量的10层细胞工厂(cellfactories,cf)用于载体产生和细胞培养(celltrain)维持。可以使用细胞的单培养(singletrain)用于生产。
在高达10个cf的分批中产生慢病毒载体。可以在同一周产生两个分批,导致产生大概20l的慢病毒上清液/周。在下游加工期间集中从所有分批产生的材料,以产生一批产物。将293t细胞平铺在293t培养基(具有10%fbs的dmem)中的cf中。将工厂放置在37℃温育箱中并水平放平以在cf的所有层上获得平均细胞分布。两天后,利用上述四个慢病毒质粒,使用capo4方法转染细胞,其包含tris:edta、2mcacl2、2xhbs和四个dna质粒的混合物。转染后第3天,收集、纯化并浓缩含有分泌的慢病毒载体的上清液。从cf去除上清液后,从各cf收集生产终末期细胞。从各工厂胰蛋白酶处理(trypsinize)细胞并通过离心收集。将细胞重悬浮在冰冻的培养基中并冷藏保存。这些细胞稍后用于能够复制的慢病毒(rcl)测试。
为了纯化并配制载体,通过膜过滤澄清粗上清液以去除细胞碎片。通过内切核酸酶消化
通过使用高速离心技术完成病毒产物的进一步浓缩。使用sorvallrc-26plus离心机在6oc下以6000rpm(6,088rcf)沉淀慢病毒的各分批16-20小时。然后利用pbs中4%的乳糖在50ml体积中重构来自各分批的病毒沉淀。在该缓冲液中重构的沉淀代表用于病毒制备的最终制剂。完整的载体浓缩过程导致大概200倍体积减少。完成所有分批后,接着将材料放置在-80oc中,同时测试来自各分批的样品的无菌性。验证样品无菌性后,将分批在37oc频繁搅拌快速溶解。然后收集材料并手工平分到病毒载体组(suite)中的ii类a/b3型生物安全箱中。使用无菌usp六级,外部螺纹的o-环冷冻管中1ml浓缩慢病毒的填充构造。coh的应用技术开发中心(centerforappliedtechnologydevelopment)(catd)的质量系统(qualitysystems)(qs)根据关于cbg的政策和标准操作规程(policiesandstandardoperatingproceduresforthecbg)并顺应目前的良好制造实践(goodmanufacturingpractices)(cgmps)释放所有材料。
为了保证慢病毒载体制剂的纯度,对它测试残留宿主dna污染物,以及残留的宿主和质粒dna的转移。在其他测试中,通过rt-pcr评估载体身份以保证存在正确的载体。对于旨在用于该研究的载体,满足所有的释放标准。
实施例4:制备适合用于act中的t细胞
通过白细胞分离法从患者获得t淋巴细胞,并将适当的同种异型或自体t细胞亚群,例如中央记忆型t细胞(tcm)遗传改变以表达car,然后通过任何临床可接受的手段向患者回向施用,以实现抗癌症治疗。
在图8中描述了用于tcm的制造策略的概要(用于il13(eq)bbζ/cd19t+tcm的制造方案)。尤其是,将从知情的研究参与者获得的血浆分离置换(apheresis)产物聚蔗糖化(ficoll)、洗涤并温育过夜。然后使用gmp级别的抗cd14、抗cd25和抗cd45ra试剂(miltenyibiotec)和clinimacstm分离设备消减细胞的单核细胞、调节性t细胞和幼稚t细胞群。消减后,在clinimacstm分离设备上使用dreg56-生物素(coh临床级别)和抗生物素微珠(miltenyibiotec)为cd62l+tcm细胞富集阴性级分细胞。
富集后,在完整的x-vivo15加50iu/mlil-2和0.5ng/mlil-15中配制tcm细胞并将其转移到teflon细胞培养袋中,其中利用dynalclinextmvivocd3/cd28珠刺激它们。刺激后高达5天,利用il13(eq)bbz-t2a-cd19t_ephiv7慢病毒载体以1.0-0.3的多重性感染(moi)转导细胞。在添加如细胞扩增所需的完整x-vivo15和il-2以及il-15细胞因子的情况下将培养物维持高达42天(保持细胞密度在3x105-2x106个活细胞/ml之间,并且在培养的每周一、周三和周五维持细胞因子补给)。细胞通常在这些条件下在21天内扩增至大概109个细胞。在培养期结束时,收集细胞,洗涤两次并配制在临床级别的冷藏保存培养基(cryostorecs5,biolifesolutions)中。
在t细胞输注当天里,将冷藏保存的和释放的产物融化、洗涤并配制用于再次输注。从液氮存储取出含有释放的细胞产物的冷藏保存管、融化、冷却并利用pbs/2%人血清白蛋白(hsa)洗涤缓冲液进行洗涤。离心后,去除上清液并将细胞重悬于无防腐剂的生理盐水(pfns)/2%hsa输注稀释液中。取出样品用于质量控制测试。
使用上述制造平台在从健康供体获得的细胞上进行两次量化运行。为各临床前量化运行产物分配人供体(hd)编号-hd006.5和hd187.1。重要的是,如表5中所示,这些量化运行在28天内扩大>80倍并且扩增的细胞表达il13(eq)bbγ/cd19t转基因。
表5:来自临床前量化运行产物的表达数据的概括
实施例5:il13(eq)bbγ/cd19t+tcm中表面转基因和t细胞标志物表达的流式细胞术分析
在实施例4中描述的两份临床前量化运行产物用于如下所述的临床前研究。图6a-c描述了表面转基因和t细胞标志物表达的流式细胞术分析结果。il13(eq)bbγ/cd19t+tcmhd006.5和hd187.1与抗il13-pe和抗cd8-fitc共染色以检测cd8+car+和cd4+(即,cd8阴性)car+细胞(图6a),或与抗cd19-pe和抗cd4-fitc共染色以检测cd4+cd19t+和cd8+(即,cd4阴性)car+细胞(图6b)。利用荧光色素缀合的抗cd3、tcr、cd4、cd8、cd62l和cd28(灰色柱状图)或同种型对照(黑色柱状图)染色il13(eq)bbγ/cd19t+tcmhd006.5和hd187.1。(图6c)。在图6a-c的各图中,所指示的百分比基于活的淋巴细胞(dapi阴性)染色的上述同种型。
实施例6:il13(eq)bbγ/cd19t+tcm的效应器活性
评估il13(eq)bbζ/cd19t+tcm的效应器活性并在图7a-b中描述该分析结果。简言之,il13(eq)bbγ/cd19t+tcmhd006.5和hd187.1在基于cd19t表达的使用10e:1t比例的6小时51cr-释放测定中用作效应器。将il13rα2阳性肿瘤靶标是k562工程化改造的,以表达il13rα2(k562-il13rα2)和原代神经胶质瘤系pbt030-2,并且il13rα2-阴性肿瘤靶标对照是k562亲本系(图7a)。如上所述与相同的il13rα2-阳性和阴性靶标以10e:1t比例过夜共培养后评估il13(eq)bbγ/cd19t+hd006.5和hd187.1的抗原依赖性细胞因子产生。使用bio-plexprohumancytokineth1/th2测定试剂盒测定细胞因子水平并描述inf-γ水平(图7b)。
实施例7:il13(eq)bbγ/cd19t+tcm的体内抗肿瘤活性
下述研究证明在体内小鼠模型中il13(eq)bbγ/cd19t+tcm展示抗肿瘤效果。尤其是,我们已经评估了il13(eq)bbγ/cd19t+tcm针对il13rα2+原代低传代成胶质细胞瘤肿瘤球系pbt030-2的抗肿瘤潜能,已经改造了所述原代低传代成胶质细胞瘤肿瘤球系pbt030-2以表达egfp和萤火虫萤光素酶(ffluc)报告基因二者(pbt030-2egfp:ffluc)(6)。来自患者成胶质细胞瘤样本的一组原代系(pbt)在无血清培养基中生长为肿瘤球(ts)。这些扩增的ts系展示干细胞样特征,包含干细胞标志物的表达、多谱系分化和在免疫受损的小鼠(nsg)中以低细胞数目起始原位肿瘤的能力。pbt030-2egfp:fflucts起始的异种移植模型(0.1x106细胞;5天移植物移入)先前已经用于评估nsg小鼠中表达il13rα2-特异性car的t细胞的体内抗肿瘤活性,由此显示2周期间三次注射2x106细胞溶解性t淋巴细胞(ctl)降低肿瘤生长。然而,在那些实验中,大多数pbt030-2肿瘤最终复发。通过比较,单次注射il13(eq)bbγ/cd19t+tcm(1.1x106car+tcm;2x106总tcm)展示针对pbt030-2egfp:fflucts-起始的肿瘤(0.1x106细胞;5天移植物移入)的强的抗肿瘤活性,如图8a-c中所示。与利用pbs或模拟转导的tcm(无car)处理的nsg小鼠相比,il13(eq)bbγ/cd19t+tcm显著减少ffluc流量(>18天,p<0.001)并显著提高存活(p=0.0008)。
简言之,将egfp-ffluc+pbt030-2肿瘤细胞(1×105)立体定向植入nsg小鼠的右前脑中。在第5天,小鼠接受2x106个il13(eq)bbγ/cd19t+tcm(1.1x106car+;n=6)、2x106个模拟tcm(无car;n=6)或pbs(n=6)。图8a描述了来自各组的代表性小鼠,使用xenogenlivingimage显示相对肿瘤负荷。ffluc流量(光子/秒)的定量显示与模拟转导的tcm和pbs相比,il13(eq)bbζ/cd19t+tcm诱导肿瘤消退(#p<0.02,*p<0.001,重复测量anova)(图8b)。如图8c中所示,kaplanmeier存活曲线(n=6/组)证明利用il13(eq)bbγ/cd19t+tcm处理的小鼠存活显著提高(p=0.0008;时序检验)。
实施例8:il13(eq)bbζ+tcm和非tcmil13-zetakinecd8+ctl克隆在抗肿瘤效果和t细胞持续性中的比较
下述研究比较了il13(eq)bbζ+tcm与先前产生的il13rα2-特异性人cd8+ctl(il13-zetakinecd8+ctl(描述于brown等2012clincancerres18:2199和kahlon等2004cancerres64:9160)。il13-zetakine使用cd3ζ刺激域,缺少共刺激域并使用与il13(eq)bbζ+相同的il13变体。
产生了来自患者成胶质细胞瘤样本的一组原代系(pbt),其在无血清培养基中生长为肿瘤球(ts)(brown等2012clincancerres18:2199;brown等2009cancerres69:8886)。这些扩增的ts系展示干细胞样特征,包含干细胞标志物的表达、多谱系分化和在免疫受损的小鼠(nsg)中以低细胞数目起始原位肿瘤的能力。il13rα2+原代低传代成胶质细胞瘤ts系pbt030-2用于下文概括的实验,已经改造所述il13rα2+原代低传代成胶质细胞瘤ts系pbt030-2以表达egfp和萤火虫萤光素酶(ffluc)报告基因二者(pbt030-2egfp:ffluc)(brown等2012clincancerres18:2199)。
首先,单剂量(1x106cart细胞)的il13(eq)bbζ+tcm产物与针对第8天pbt030-2egfp:ffucts-起始的异种移植物(0.1x106细胞)评估的il13-zetakinecd8+ctl克隆进行比较。尽管两个il13rα2-特异性cart细胞(il13-zetakinectl和il13(eq)bbζtcm)与未处理的和模拟tcm(car-阴性)对照相比,证明针对建立的pbt030-2肿瘤的抗肿瘤活性(图9a和9b),il13(eq)bbz+tcm与我们的第一代il13-zetakinecd8+ctl克隆相比介导显著提高的存活和持久的肿瘤消退,小鼠存活大于150天(图9c)。
为了进一步比较这两个il13rα2-cart细胞产物的治疗效果,进行针对第8天pbt030-2egfp:ffucts-起始的肿瘤的1.0、0.3和0.1x106cart细胞的剂量滴定(图10a-c)。如在6只动物中的3只中通过xenogenflux所测定,最高剂量(1x106)的il13-zetakinecd8+ctlcl.2d7介导抗肿瘤应答(图10c),但是在较低cart细胞剂量没有观察到明显的抗肿瘤应答。通过比较,在大多数小鼠中在所有剂量水平上,包含利用尽可能少的0.1x106cart细胞的处理,注射il13(eq)bbζ+tcm产物介导完整的肿瘤消退。这些数据证明il13(eq)bbζ+tcm比il13-zetakinecd8+ctl克隆在抗肿瘤效果上至少更有效10倍。提高的抗肿瘤效果是由于肿瘤微环境中提高的t细胞持续性。i.c.注射后7天评估cd3+t细胞揭示了肿瘤微环境中显著数量的il13(eq)bbζ+tcm,然而存在非常少的第一代il13-ζctl(图11)。
实施例9:用于处理大的ts起始pbt肿瘤的cart细胞递送途径的比较
下文描述的是这样的研究,其比较在针对侵入性原代pbt系的抗肿瘤活性上静脉内(i.v.)或颅内(i.c.)的递送途径。在初步研究中(数据未显示),出乎预料到观察到与用于处理小的(第5天)pbt030-2egfp:ffluc肿瘤的pbs相比,i.v.施用的il13(eq)bbζ+tcm没有提供治疗益处。这与利用i.c.施用的car+t细胞观察到的强治疗效果相反。推理第5天的pbt030-2肿瘤可能已经太小了以致于不能从外周募集治疗性t细胞,对在针对较大的第19天的pbt030-2egfp:ffluc肿瘤的i.v.相对于i.c.递送进行比较。对于这些研究,利用两次i.v.输注(5x106car+tcm;第19天和第26天)或四次i.c.输注(1x106car+tcm;第19、22、26和29天)il13(eq)bbz+tcm,或模拟tcm(无car)处理pbt030-2移入的小鼠。此处没有如通过对i.v.施用的car+t细胞xenogen成像或kaplan-meier存活分析所监测到的治疗益处(图12a和12b)。相反,对i.c.施用的il13(eq)bbζ+tcm观察到有效的抗肿瘤活性(图12a-b)。然后,收集来自t细胞注射后7天的一组小鼠的脑并通过ihc评估cd3+人t细胞。令人惊讶的是,对于利用模拟tcm或il13(eq)bbζtcmi.v.处理的小鼠,在肿瘤或其中人t细胞通常存在的其他小鼠脑区域(即,柔脑膜)中没有可检测的cd3+人t细胞(图12c),提示肿瘤向性的缺乏。这与在i.c.处理的小鼠中检测到显著数量的t细胞相反(图12d)。
肿瘤来源的细胞因子,特别是mcp-1/ccl2在将t细胞募集到肿瘤中是重要的。因此,评估pbt030-2肿瘤细胞并发现该系产生与u251t细胞相当的高水平的mcp-1/ccl2(数据未显示),所述u251t细胞是先前显示吸引静脉内施用的效应器cd8+t细胞到颅内移入的肿瘤的神经胶质瘤系。恶性神经胶质瘤是高度侵入性肿瘤并且在表现上经常是多病灶的。上述研究确定il13bbztcm可以消除浸润的肿瘤如pbt030-2,并且介导长期持久的抗肿瘤活性。也检查了颅内递送的cart细胞运输到多病灶疾病的能力。对于该研究,将pbt030-2egfp:fflucts植入左半球和右半球(图13a)并仅在右边肿瘤位点上注射car+t细胞。令人鼓舞的是,对于所评估的所有小鼠(n=3),我们通过在注射位点(即,右边肿瘤),以及左半球的肿瘤内在t细胞输注后7天通过cd3ihc检测t细胞(图13b)。这些发现提供了这样的证据,即car+t细胞能够运输到并浸润远位点上的肿瘤灶。在使用u251t神经胶质瘤细胞系的第二个肿瘤模型中也观察到类似的发现(数据未显示)。
实施例10:共刺激域的比较
进行一系列研究以评估多个共刺激域。在图14a中示意性描述了所评估的多个car并且其包含缺少共刺激域的第一代cd3ζcar,掺入了4-1bb共刺激域或cd28共刺激域的第二代cars,和含有cd28共刺激域和41bb共刺激域的第三代car。所有car构建体还含有t2a核糖体跳跃序列和截短的cd19(cd19t)序列作为标志物用于转导的细胞。
经慢病毒转导cd4和cd8tcm并通过抗cd19免疫磁性富集表达car的t细胞。通过流式细胞术测定cd19和il13(即,car)表达水平。在图14b中显示了结果。通过将car(il13)平均荧光强度(mfi)除以转导标志物(cd19t)的平均荧光强度测定各car构建体的稳定性(图14c)。包含4-1bb共刺激域的两个car与cd19t转导标志物相比展示最低表达水平。
在指示的效应器:靶标比例的4小时51cr-释放测定中测定指示的模拟转导的或表达car的t细胞杀死表达il13rα2的pbt030-2肿瘤细胞靶标的能力。在图15a中显示了该研究的结果(描述了一式三份孔的均值%铬释放±s.d.)。如预期,模拟转导的t细胞未有效裂解靶标。相反,所有表达car的t细胞以相似的方式裂解肿瘤细胞。图15b描述了这样的研究结果,其中指示模拟转导的或表达car的t细胞与表达il13rα2的pbt030-2肿瘤细胞以10:1的比例共培养过夜并且通过细胞测定珠阵列分析上清液的il-13和ifn-γ水平。有趣的是,表达ζ、41bb-ζ或cd28-41bb-ζcar的t细胞比表达cd28-ζcar的t细胞展示更低的抗原刺激细胞因子产生。
如下检查多种car的体内效率。简言之,nsg小鼠在第0天接受颅内注射ffluc+pbt030-2肿瘤细胞,并被随机化到6个组中(n=9-10小鼠/组)用于在第8天利用pbs(仅肿瘤)、模拟转导的t细胞或表达指示的il13rα2-特异性car的t细胞进行颅内处理。然后进行定量生物发光成像以监测肿瘤随时间的生长。各组中代表性小鼠的生物发光图像(图16a)。第27天各小鼠的流量水平(图16b)。除了利用表达cd28-car的t细胞处理的那些组,利用il13rα2-特异性cart细胞处理的所有组相比于利用模拟转导的t细胞处理的小鼠在肿瘤体积上显示统计学上显著的减小(图16c)。
实施例11:il13(eq)bbζ/cd19t的氨基酸序列
在图17中描述了il13(eq)bbζ/cd19t的完整氨基酸序列。整条序列(seqidno:1)包含:22个氨基酸的gmcsf信号肽(seqidno:2)、112个氨基酸的il-13序列(seqidno:3;粗体显示的氨基酸取代e13y);229个氨基酸的igg4序列(seqidno:4;具有粗体显示的氨基酸取代l235e和n297q);22个氨基酸的cd4跨膜序列(seqidno:5);42个氨基酸的4-1bb序列(seqidno:6);3个氨基酸的gly接头;112个氨基酸的cd3ζ序列(seqidno:7);24个氨基酸的t2a序列(seqidno:8);和323个氨基酸的cd19t序列(seqidno:9)。
成熟的嵌合抗原受体序列(seqidno:10)包含:112个氨基酸的il-13序列(seqidno:3;粗体显示的氨基酸取代e13y);229个氨基酸的igg4序列(seqidno:4;具有粗体显示的氨基酸取代l235e和n297q);22个氨基酸的cd4序列(seqidno:5);42个氨基酸的4-1bb序列(seqidno:6);3个氨基酸的gly接头;和112个氨基酸的cd3ζ序列(seqidno:7)。在该car序列(seqidno:10)中是il-13/igg4/cd4t/41-bb序列(seqidno:11),其包含112个氨基酸的il-13序列(seqidno:3;粗体显示的氨基酸取代e13y);229个氨基酸的igg4序列(seqidno:4;具有粗体显示的氨基酸取代l235e和n297q);22个氨基酸的cd4序列(seqidno:5);和42个氨基酸的4-1bb序列(seqidno:6)。il13/igg4/cd4t/4-1bb序列(seqidno:11)可以通过接头如glyglygly接头连接到112个氨基酸的cd3ζ序列(seqidno:7)中。car序列(seqidno:10)前面可以是22个氨基酸的gmcsf信号肽(seqidno:2)。
图18描述了il13(eq)41bbζ[il13{eq}41bbζt2a-cd19t_ephiv7;pf02630](seqidno:12)与cd19rop_ephiv7(pj01683)(seqidno:13)的序列比较。
实施例12:il13(eq)bbζ/cd19t的氨基酸序列
图19-26描述了除了定位在某些胞内域之间的glyglygly间隔物外在多个域被标记的各种情况中针对il13rα2的额外car的氨基酸序列。每一个包含glu变成tyr的人il13(seqidno:3;强调突出显示的氨基酸取代e13y)。在用于表达这些car的表达载体中,所表达的氨基酸序列可以包含24个氨基酸的t2a序列(seqidno:8);和323个氨基酸的cd19t序列(seqidno:9)以允许在表达car的细胞表面上协同表达截短的cd19序列。
如在72小时共培养测定中评估,测试一组car的介导il13ra2-特异性杀死的能力,所述car包含人il13(e13y)域、cd28tm域、cd28gg共刺激域、4-1bb共刺激域,和cd3ζ域car骨架并包含hl(22个氨基酸)间隔物、cd8铰链(48个氨基酸)间隔物、igg4-hl-ch3(129个氨基酸)间隔物或igg4(eq)(229个氨基酸)间隔物。除了在该系统中看起来具有弱car表达的hl(22个氨基酸)外,其他均为活性的。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺