苯并咪唑衍生物的新型结晶形式及其制备方法与流程
本发明涉及一种由特定的x射线粉末衍射图定义的苯并咪唑衍生物的新型结晶形式及其制备方法。
背景技术:
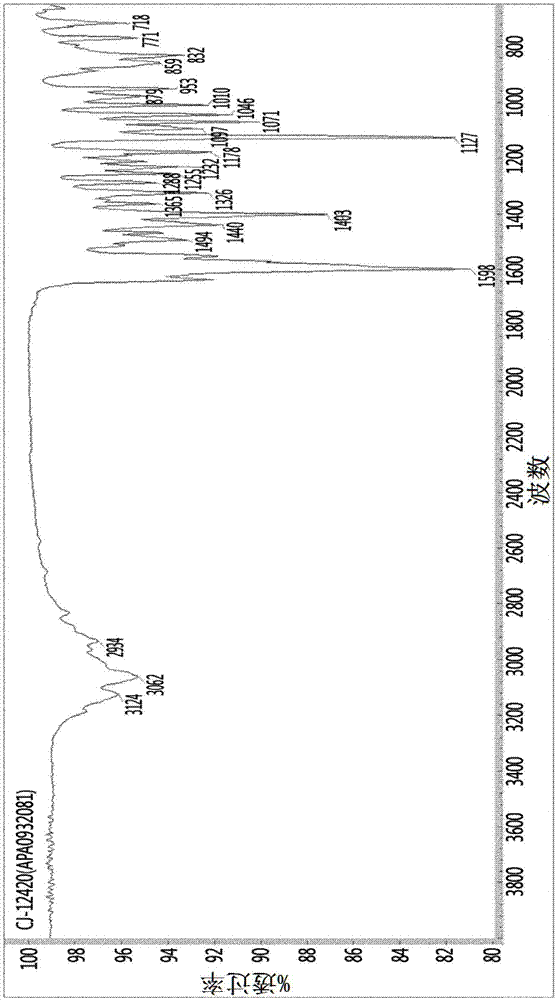
:通常,当药物以包括非晶形式、一种或多种结晶形式等的各种形式存在时,在本领域中显而易见的是,药学上重要的因素(例如溶解度、溶出特性和生物利用度)可以随它们形式而改变。特别地,在可以存在光学异构体的化合物中,每种异构体不仅在物理化学性质上具有差异,而且在药理活性和毒性方面也可能表现出差异。因此,以高纯度制造和/或分离具有高药理活性和低毒性的光学异构体是非常重要的。具体地,关于多晶型形式,如果由于多晶型形式发生变化而在整个制剂程序完成时混合多种类型的结晶形式,则可能导致最终药物的药物性质发生变化,从而导致无法预期的药代动力学反应。因此,获得纯的单晶形式的化合物是非常重要的,以确保药物的再现性。此外,在从各种结晶形式或结晶形式和非结晶形式之间进行选择时,非结晶形式由于其通常的高溶解度而具有增加药物功效和表现出速效性的优点。然而,非结晶形式由于不稳定性而具有保质期短和难以调节药物的释放速度和血中浓度的缺点。相比之下,结晶形式虽然溶解度低,并因此每单位重量的生物利用度低,但具有确保稳定性和制备能够长效释放的制剂的优点。因此,由于结晶形式比非结晶形式具有更高的稳定性和更低的溶解度,当稳定性被赋予最高优先级时,有必要牺牲溶解度,而当首先考虑溶解度时可能会牺牲稳定性,因此在如何同时满足稳定性和溶解度上难以做出决定。技术实现要素:技术问题本发明人为了出于制剂目的利用作为已知具有酸泵抑制活性的苯并咪唑衍生物之一的4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺(以下称为“化学式1的化合物”),已经努力开发了具有长期储存稳定性和工业实用性的化合物形式。作为结果,发现上述化合物的具有特定x射线粉末衍射图的结晶形式a在长期光应力条件下也不改变性质,吸湿性低,并且静电诱导能力极低,因此有利于被制剂化,并且由于晶体本身的优异稳定性,其对于化合物的长期储存是非常有用的,从而完成了本发明。[化学式1]技术方案本发明的目的是提供一种容易制备并具有优异稳定性的化学式1的化合物的新型结晶形式。有益效果与非结晶化合物相比,本发明的由下述化学式1表示的化合物的结晶形式a在长期光应力条件下也不改变特性,吸湿性低,并且静电诱导能力极低,因此有利于被制剂化,并且由于晶体本身的优异稳定性,其对于化合物的长期储存是非常有用的。附图说明图1示出了根据本发明的示例性实施方式的化学式1的化合物的新型结晶形式a的x射线衍射图。图2示出了根据本发明的示例性实施方式的化学式1的化合物的新型结晶形式a的ir光谱。图3示出了根据本发明的示例性实施方式的化学式1的化合物的新型结晶形式a通过dsc(差示扫描量热法)而形成的温谱图。具体实施方式为了实现上述目的,本发明提供了一种由下列化学式1表示的化合物的结晶形式a,在x射线粉末衍射图中,其在衍射角为8.1°、10.0°、12.6°、14.9°、15.6°、16.5°、17.2°、19.6°、23.1°、24.2°、28.1°、30.2°和31.6°(2θ±0.2°)处具有峰。[化学式1]在本发明中提供的新型结晶形式可以如下文所述进一步说明。例如,由化学式1表示的化合物的结晶形式a的特征在于,在利用差示扫描量热法测量时,其在220℃至225℃的温度下具有吸热峰。此外,由化学式1表示的化合物的结晶形式a的特征在于,在ir光谱中,其在832cm-1、1071cm-1、1127cm-1、1326cm-1、1403cm-1、1440cm-1、1598cm-1、2934cm-1、3062cm-1和3124cm-1处具有特征吸收峰。另一方面,本发明提供了一种制备由化学式1表示的化合物的结晶形式a的方法,其包括:将任意形式的由化学式1表示的化合物悬浮于乙腈或水中;加热所得溶液然后并搅拌1小时至24小时;以及将所得溶液冷却至室温,然后搅拌1小时至48小时以使晶体熟化。其中,加热然后搅拌的步骤可以通过将温度升高到50℃至120℃来进行。另一方面,本发明提供了一种制备由化学式1表示的化合物的结晶形式a的方法,其包括:将任意形式的由化学式1表示的化合物溶解在c1-4醇或丙酮中;向所得溶液中加入抗溶剂使该化合物结晶化;以及在室温下搅拌6小时至24小时以使晶体熟化。其中,c1-4醇可以是甲醇,并且抗溶剂可以是水或异丙醚,但不限于此。本文所用的术语“抗溶剂”是指对目标化合物表现出低溶解度或不溶性的溶剂,并且可以通过将抗溶剂加入溶解有目标化合物的溶液中来沉淀目标化合物。因此,在制备本发明的结晶形式a的方法中,考虑到溶剂类型和化合物在溶剂中的溶解度等,可以通过向已溶解有化合物的溶液中加入适当的抗溶剂来实现化合物的结晶化。其中产生的晶体可以具有上述x射线粉末衍射图、吸热峰和/或ir特征吸收峰。此外,为了通过移除杂质、剩余溶剂等来获得高纯度的产品,该方法还包括过滤或干燥。过滤和/或干燥可以使用本领域已知的方法而不受限制。实施例在下文中,将参考以下实施例更详细地描述本发明。然而,这些实施例仅用于说明目的,本发明不应受这些实施例的限制。实施例1:使用乙腈制备结晶形式a将50g(-)-4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺加入到400ml乙腈中,加热混合溶液至其内部温度达到60℃。将混合溶液在相同温度下搅拌3小时,然后缓慢冷却至室温。通过搅拌混合溶液另外3小时使晶体熟化,并将所得固体过滤。将收获的固体在40℃下真空干燥,得到45g目标化合物,即化学式1的化合物的结晶形式a(产率:90%,熔点:222±3℃)。实施例2:使用甲醇制备结晶形式a将50g(-)-4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺加入到100ml甲醇中并溶解。将混合溶液缓慢滴加到900ml纯净水中使化合物结晶化。通过在室温下搅拌混合溶液12小时使晶体熟化,并将所得固体过滤。将收获的固体在40℃下真空干燥,得到46g目标化合物,即化学式1的化合物的结晶形式a(产率:92%,熔点:222±3℃)。实施例3:使用纯净水制备结晶形式a将50g(-)-4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺加入到250ml纯净水中,加热混合溶液至其内部温度达到100℃。将混合溶液在相同温度下搅拌12小时,然后缓慢冷却至室温。通过搅拌混合溶液另外36小时使晶体熟化,并将所得固体过滤。将收获的固体在40℃下真空干燥,得到49g目标化合物,即化学式1的化合物的结晶形式a(产率:98%,熔点:222±3℃)。实施例4:使用丙酮制备结晶形式a将50g(-)-4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺加入到250ml丙酮中并溶解。将混合溶液缓慢滴加到500ml异丙醚中使化合物结晶化。通过在室温下搅拌混合溶液12小时使晶体熟化,并将所得固体过滤。将收获的固体在40℃下真空干燥,得到45g目标化合物,即化学式1的化合物的结晶形式a(产率:90%,熔点:222±3℃)。比较例1:制备非结晶化合物根据日本授权专利第4481344号公开的实施例2的方法制备非结晶化合物1。实验例1:结晶形式a的x射线衍射光谱分析为了对根据上述实施例1至4制备的4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺的结晶形式a进行x射线粉末衍射分析,使用stoe公司的掠入射衍射测定装置(x射线波长:至扫描速度/秒:0.02)测定和分析光谱,其结果如图1所示。具体地,确认了实施例1至4中制备的本发明的4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺的结晶形式a在x射线衍射图中至少在衍射角为8.1°、10.0°、12.6°、14.9°、15.6°、16.5°、17.2°、19.6°、23.1°、24.2°、28.1°、30.2°和31.6°(2θ±0.2°)处都具有特征峰(图1)。实验例2:结晶形式a的ir光谱分析对实施例1至4中制备的化学式1的化合物的结晶形式a进行ir光谱分析。使用傅立叶红外光谱仪(bruker公司)进行光谱测量和分析,其结果如图2所示。从图2中可以看出,确认本发明的实施例1至4中制备的化学式1的化合物的所有结晶形式a在ir光谱中在832cm-1、1071cm-1、1127cm-1、1326cm-1、1403cm-1、1440cm-1、1598cm-1、2934cm-1、3062cm-1和3124cm-1处具有特征吸收峰。实验例3:结晶形式a的差式扫描量热法对实施例1至4中制备的化学式1的化合物的结晶形式a进行差式扫描量热法(dsc)。使用tainstruments公司的dsc热分析仪分析dsc热分析图,其结果如图3所示。从结果可以确认,本发明的实施例1至4中制备的化学式1的化合物的所有结晶形式a在220℃至225℃的温度下具有吸热峰。从上述实验例可以确认,实施例1至4中制备的化学式1的化合物的所有结晶形式a具有相同的特性。因此,在下列实验例中代表性地使用实施例1中制备的化学式1的化合物的结晶形式a进行进一步的实验。实验例4:在光应力条件下的结晶形式a的稳定性试验为了检查实施例1中制备的化学式1的化合物的结晶形式a在光应力条件下的稳定性,将化合物暴露于给定的测试条件下(即1200000lux以上和200w/m2以上),并测量其外观、光学纯度和杂质含量的变化。另外,用肉眼观察颜色的变化,结果示于下表1中。[表1]如表1所示,与非结晶形式相比,化学式1的化合物的结晶形式a显示出优异的光学纯度。此外,即使在暴露于光应力条件下4周后,仍未在晶体形式a中检测到光学异构体,即保持100%的光学纯度,而光学异构体的含量在非结晶形式增加至10倍以上,从而显著降低其光学纯度。此外,当用肉眼观察时,非结晶形式显示为纯化合物的白色,但由于暴露于光而逐渐变黄,而在相同条件下在结晶形式a中没有观察到显著的颜色变化。此外,结晶形式a其自身和在光应力条件下处理4周后都显示杂质的含量保持在0.1%(这是药物批准的标准值)以下,而非结晶形式显示化合物自身的杂质含量为0.16%,高于前述标准值,其杂质的含量在暴露于光4周后增加至3倍以上。从这些结果可以看出,考虑到从制造到分销到客户的常规药物需要一年以上的保质期,光学纯度和杂质含量变化在两种形式之间将会有明显的差异。该结果表明,根据本发明的4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺的结晶形式a与比较例1中制备的非结晶形式的相同化合物相比具有优异的光稳定性。实验例5:结晶形式a的吸湿性试验具有低吸湿性的化合物在制备制剂中是有利的,并且也有利于储存。此外,具有高吸湿性的化合物难以被制剂化,即使制剂化成功地实现也难以获得可重现的结果。在这方面,测量4-[((4s)-5,7-二氟-3,4-二氢-2h-色烯-4-基)氧基]-n,n,2-三甲基-1h-苯并咪唑-6-甲酰胺的结晶形式a的吸湿性,并与非结晶化合物的吸湿性进行比较,结果示于下表2中。[表2]如表2所示,初期阶段的非结晶化合物的吸湿性为1.32,4周后测定的吸湿性随着相对湿度的增加而明显增加。相比之下,结晶形式a化合物本身没有显示任何吸湿性,但分别在33%、75%和93%相对湿度的条件下储存4周后,其吸湿性稍微增加,但这些值仍然低至0.3以下,相当于非结晶化合物的5%至9%。从这些结果可以确认,化合物的结晶形式a具有比非结晶形式的相同化合物显著更低的吸湿性,因此可用于制备制剂和储存。实验例6:结晶形式a的静电诱导试验考虑到在制药技术条件下,特别是在常规工业生药的药理条件下,静电诱导性高的材料通常难以处理,也不容易实现为具有均匀含量的药物,检测本发明的化学式1的化合物的结晶形式a的静电诱导性,并将其与非结晶形式的相同化合物的静电诱导性进行比较,结果示于下表3中。[表3]*卡尔指数(ci):≤30值-流动性好如表3所示,与非结晶化合物相比,本发明的化学式1的化合物的结晶形式a显示具有较高的堆积密度(bd)和振实密度(td)。通过以下等式从这些参数获得的ci值在24%至29%的范围内,远低于非结晶化合物的41%至42%的ci值,因此确认了本发明的化学式1化合物的结晶形式a与非结晶化合物相比,具有显著更低的静电诱导性和优异的流动性。ci=100×(1-bd/td)从上述可知,与由于其低密度和高静电导电性而难以被制剂化的非结晶化合物相比,本发明的化学式1的化合物的结晶形式a具有降低的静电诱导性和改善的流动性,因此提高在被制剂化时的制备便利性,并且具有有利的物理化学性质以提高被制剂化期间的含量均匀性。实验例7:结晶形式a的结晶稳定性试验最后,进行结晶稳定性试验来检查结晶形式本身的稳定性,结果示于下表4中。[表4]api形式结晶形式dsc(℃)初始阶段结晶形式a223四周后结晶形式a223如表4所示,由化学式1表示的化合物的结晶形式a在严酷的稳定性试验条件(60±2℃,80±5%rh)下进行4周处理后也与初始相同地显示出将结晶形式a保持为活性药物成分(api)的形式。这表明即使在长期储存之后,由化学式1表示的化合物的结晶形式a也能保持其物理化学性质而没有任何结晶特性的变化,因此具有能够长期储存的优点。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 苯并吲唑类衍生物及其制备方法、应用与制造工艺
- 一种二苯并环庚烷衍生物的制备方法与制造工艺
- Atropurpuran的苯并咪唑基和吗啉基衍生物组合物用于防治胰腺纤维化的制造方法与工艺
- 一种苯并咪唑衍生物镉配合物及其制备方法和应用
- 一种咪唑并吡啶巯乙酸类衍生物及其制备方法与应用
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 吡唑衍生物及其作为大麻素受体介体的用途的制造方法与工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- Schiglautone A衍生物的组合物用于制备抗缺氧药物的制作方法
- Schiglautone A衍生物的组合物用于制备抗红细胞低下性贫血药物的制作方法
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- 一种新型罗汉果醇衍生物单体的制作方法
- Schiglautone A衍生物的组合物用于制备抗鼻炎药物的制作方法
- Schiglautone A衍生物的组合物用于制备防治肾纤维化药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗心衰药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Schiglautone A 衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备防治胰腺纤维化药物的制作方法