壳多糖、水解产物和借助于酶促水解的方式用于从昆虫生产一种或多种期望的产物的方法与流程
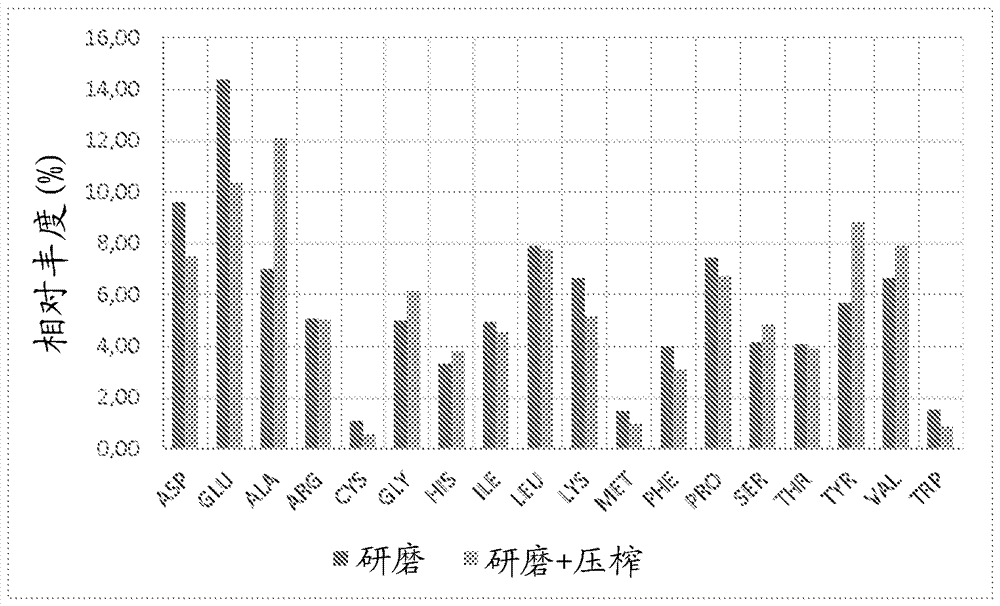
本发明涉及用于从昆虫生产至少一种目标产物的方法。更具体地,本发明涉及通过昆虫角质层的酶促水解用于生产壳多糖和/或脱乙酰壳多糖的方法。它还涉及具体的壳多糖和水解产物。根据本发明,“壳多糖”意指任何类型的壳多糖衍生物,即包含n-乙酰葡糖胺单元和d-葡糖胺单元的任何类型的多糖衍生物,特别是壳多糖-多肽共聚物(有时称为“壳多糖/多肽复合物”)。壳多糖被认为是生物世界中排在纤维素之后的第二大合成聚合物。事实上,壳多糖由生物世界中的许多物种合成:它构成甲壳类和昆虫类的外骨骼以及围绕并保护真菌的侧壁的部分。更具体地,在昆虫中,壳多糖因此构成其外骨骼的3至60%。根据本发明的“脱乙酰壳多糖”意指壳多糖脱乙酰作用的产物。脱乙酰壳多糖与壳多糖之间的通常限制是由乙酰化的程度决定:乙酰化程度小于50%的化合物称为脱乙酰壳多糖,并且乙酰化程度大于50%的化合物称为壳多糖。壳多糖和/或脱乙酰壳多糖被用于许多应用中:化妆品(化妆品组合物)、医学和药物(药物组合物、烧伤治疗、生物材料、角膜敷料、缝合材料)、营养学和食品加工、技术(特别是用于水过滤和净化的过滤剂、组织形成剂、絮凝剂或吸附剂)等。事实上,壳多糖和/或脱乙酰壳多糖是生物相容的、可生物降解的和无毒的材料。传统上,壳多糖以化学方法从甲壳类、头足类,以及更特别地真菌中提取。化学途径使用大量的试剂(如盐酸、氢氧化钠和漂烫剂),所述试剂具有使壳多糖结构(例如其以天然状态存在,例如如存在于甲壳类的壳中)变性的作用,。此外,大多数化学试剂对人类和环境都有害,并且生成大量必须处理的废水。最后,源于甲壳类的壳多糖和/或脱乙酰壳多糖可在敏感人群中产生过敏反应。用于提取壳多糖的另一种途径是酶促途径。该途径被视为较温和,因此使得能够更好地保存壳多糖和/或脱乙酰壳多糖。然而,通过该途径获得的壳多糖是呈褐色的,需要纯化步骤以便获得可销售的粉末,即白色粉末。现有的方法因此一般包括用于从壳多糖中去除杂质的一个或多个步骤,例如在酶促水解之前进行的用酸脱矿物质的步骤、和/或在酶促水解之后进行的用氧化剂漂烫壳多糖的步骤。不幸的是,用于纯化壳多糖的这两个步骤均具有改变壳多糖的化学结构的作用。由本发明人开展的工作证实通过在水解之前进行机械处理的步骤,即压榨昆虫角质层的步骤,能够获得更纯化并且结构更接近于壳多糖的原始结构的壳多糖。本发明因此涉及用于从昆虫生产至少一种目标产物的方法,其包括下述步骤:(i)压榨昆虫角质层,并随后(ii)用蛋白水解酶酶促水解昆虫角质层。“目标产物”更具体地意指壳多糖和/或脱乙酰壳多糖和/或水解产物。“水解产物”指示可通过蛋白质的酶促水解获得的,包含蛋白质、水解蛋白质、肽、氨基酸和/或衍生自蛋白质的其他化合物的产物。一种或多种目标产物从昆虫获得。“昆虫”意指在任何发育阶段的昆虫,如成虫期、幼虫期或若虫期。优选地,根据本发明的方法中使用的昆虫是可食用的。更具体地,昆虫可以选自鞘翅目(coleoptera)、双翅目(diptera)、鳞翅目(lepidoptera)、等翅目(isoptera)、直翅目(orthoptera)、膜翅目(hymenoptera)、蜚蠊目(blattoptera)、半翅目(hemiptera)、异翅目(heteroptera)、蜉蝣目(ephemeroptera)和长翅目(mecoptera),优选选自鞘翅目、双翅目、直翅目和鳞翅目。优选地,昆虫选自黄粉虫(tenebriomolitor)、黑水虻(hermetiaillucens)、蜡螟(galleriamellonella)、黑菌虫(alphitobiusdiaperinus)、大麦虫(zophobasmorio)、blatterafusca、赤拟谷盗(triboliumcastaneum)、红棕象甲(rhynchophorusferrugineus)、家蝇(muscadomestica)、大头金蝇(chrysomyamegacephala)、飞蝗(locustamigratoria)、沙漠蝗(schistocercagregaria)、家蟋蟀(achetadomesticus)和樗蚕(samiaricini)。更优选地,昆虫选自黄粉虫、黑水虻、蜡螟、黑菌虫、大麦虫、blatterafusca、家蝇、大头金蝇、飞蝗、沙漠蝗、家蟋蟀和樗蚕,且甚至更优选地,黄粉虫。在根据本发明的方法中可以使用一个或多个昆虫物种,优选单一的昆虫物种。如果使用几个物种,则有利地选择两个密切相关的物种,例如黑水虻和家蝇。昆虫优选是被养殖的,而不是从自然中获取。例如,昆虫在昆虫农场养殖。在专门农场繁殖昆虫使得不仅能够控制和消除与昆虫传播疾病相关的风险,还可以限制由于例如杀虫剂的存在而与衍生自昆虫的食物产品的毒性相关的风险。此外,养殖使得能够控制昆虫供应的质量并且限制供应的成本。“昆虫角质层”不仅意指它们已从昆虫分离出的角质层,角质层还意指包括昆虫的其他组成成分中的一些或全部,包括整个昆虫。事实上,能够将根据本发明的方法应用于整个昆虫,如磨碎的昆虫,或仅应用于包含角质层的昆虫的部分,例如天然分离并且通过合适方法收集的昆虫的蜕皮和/或脱皮。角质层是由昆虫表皮分泌的外层(或外骨骼)。一般地,它由三层组成:-上表皮,其为角质层最薄的最外层(小于4μm);该层是不透水的,并且包含一层防水蜡、以及较少量的蛋白质和壳多糖;-外角质层,其为角质层的中间层;它基本上由通过鞣制硬化并且负责角质层的刚性的蛋白质;壳多糖和任选的黑色素组成;和-内角质层,其为由蛋白质和壳多糖的混合物构成的薄的柔性层。压榨昆虫角质层的主要目的是去除富含脂肪的压榨汁和/或富集压榨饼以产生用于水解的底物。在根据本发明的方法中,压榨昆虫角质层使得能够获得包含油(或脂质)含量小于或等于20%,优选小于或等于15%,更优选小于或等于12%,甚至更优选小于或等于10%的压榨饼。在本申请中,值的范围被理解为是包含性的。此外,当“大约”或“约”在数字之前时,这等价于这个数值的正或负10%。同样地,为了使压榨饼富集成用于水解的底物,压榨昆虫角质层使得能够获得具有干物质含量包含在30%至60%之间,优选包含在40%至55%之间,且更优选包含在45%至50%之间的压榨饼。可以使用任何压榨系统用于进行昆虫角质层的压榨,例如单螺杆或双螺杆压榨机(angel型双螺杆压榨机)、压滤机(choquenet型压滤机)、压板式挤压机等。这些系统是本领域技术人员众所周知的,所述本领域技术人员能够确定压榨条件以便获得上述的油和/或水含量。在根据本发明的方法中,压榨昆虫角质层随后为酶促水解。优选地,用至少一种蛋白水解酶,优选蛋白酶进行酶促水解。在本申请中,名称或后缀“肽酶”和“蛋白酶”被无差别地用于指示引起蛋白质的肽键裂解的酶。有利地,这在40至60℃,优选45至55℃的温度下,以及在包含在6至8之间,优选在6.5至7.5之间的ph下进行4至8小时,优选4至5小时的时间。酶促水解可以用单一蛋白酶或可选地含有至少一种蛋白酶的酶混合物进行,更优选含有几种蛋白酶的酶混合物,例如含有内切蛋白酶和外切蛋白酶、或蛋白酶和多糖酶的混合物。优选地,蛋白酶选自氨肽酶、金属羧肽酶、丝氨酸内肽酶、半胱氨酸内肽酶、天冬氨酸内肽酶、金属内肽酶。有利地,酶可以选自下述:*n.a.:不适用。有利地,用于水解中的酶是天冬氨酸内肽酶,例如prolyvenp。这类酶使得能够在获得的壳多糖的纯度方面获得非常良好的结果,尤其是当这类酶应用于从鞘翅目,且更特别地从黄粉虫获得的压榨饼的水解中时。酶或酶的混合物以范围为按估计的干物质的重量计0.2至10%,优选按重量计0.4至8%,且更优选0.5至2%的量引入。“估计的干物质的重量”意指更特别地来自昆虫或昆虫部分的干物质的重量,例如可以在进入酶促水解步骤时估计。在酶促活性方面,所引入的酶或酶混合物的量等价于每100g待转化的底物(即昆虫或含水的昆虫部分,具有30至70%的含水量)的湿重包含2000至5000sapu的活性(下文实施例5中描述的“分光光度法酸性蛋白酶单位”),优选3000至4000sapu。有利地,酶促水解步骤在水例如淡水的存在下进行。酶促水解中使用的水量如下确定:以ml计的水体积与以g计的昆虫重量的比率优选包含在0.3至10之间,更优选在0.5至5之间,甚至更优选在0.7至3之间,甚至更优选约1。应当注意,该比率也相当于水重量与昆虫重量的比率,水的密度在常温和常压条件下为1.0g/ml。根据本发明的方法使得能够获得纯度(或重量分析纯度)包含在40至90%之间,优选在50至90%之间,更优选包含在60至85%之间,且甚至更优选约80%的壳多糖(参见实施例2和图2)。此外,根据本发明的方法使得能够获得具有一定量的有利性质的水解产物,特别是在消化率、脂质和/或蛋白质含量、蛋白质或氨基酸组合物的大小方面。优选地,根据本发明的方法包括在压榨步骤之前的研磨步骤。本发明的一个特别优选的实施方案因此涉及用于从昆虫生产至少一种目标产物的方法,其包括下述步骤:(i)研磨昆虫的角质层,(ii)压榨昆虫的角质层,随后(iii)用蛋白水解酶酶促水解昆虫的角质层。该研磨步骤的目的是将角质层和/或昆虫粉碎成颗粒,以便在酶促水解期间促进酶对底物的接近。当它随后为压榨步骤时,该步骤还使得能够促进压榨汁的去除和固体物质的分离。该研磨步骤还使得能够改善源于压榨的压榨饼和压榨汁之间的来自昆虫的脂质分布。事实上,如图4所示,与来自仅包括压榨的方法的压榨饼相比,源于包括研磨和压榨两者的方法的压榨饼具有降低的脂肪含量。更具体地,在根据本发明的方法中,昆虫角质层的研磨和压榨使得能够获得包含小于或等于15%,优选小于或等于12%,甚至更优选小于或等于10%的脂质(或油)含量的压榨饼。研磨可以有利地用混合机-研磨机,例如刀磨机进行。优选地,在研磨结束时,昆虫颗粒的尺寸小于1cm(使用显微镜可观察到的最大粒度),优选小于0.5cm,甚至更优选包含在300μm至0.5cm之间的尺寸,优选500μm至0.5cm,且甚至更优选在500μm至1mm之间。可以加入一定量的水以促进研磨。该水量如下确定:以ml计的水体积与以g计的昆虫重量的比率优选包含在0.3至10之间,更优选在0.5至5之间,甚至更优选在0.7至3之间,甚至更优选约1。有利地,根据本发明的方法还包括在压榨和/或研磨步骤之前杀死昆虫的步骤。该杀死步骤可以通过常规方法在冷血动物和/或小型动物(甲壳类、鱼类、蜗牛等)的养殖中进行,例如冷(冷冻)、热(热烫)、去氧等。有利地,昆虫杀死步骤通过热烫进行。热烫不仅可以杀死昆虫,还可以降低微生物负荷(降低变质风险和健康风险),并且使可以触发自溶且因此触发其快速褐变的昆虫内部酶失活。这种热烫以尽可能快地促使死亡的方式进行,以便尊重动物福利,并且根据科学的建议。可选地,可以通过漂烫进行杀死。漂烫具有与上述热烫相同的优点。有利地,昆虫例如通过热烫或漂烫被杀死,随后在被压榨之前研磨。优选地,热烫步骤在水例如淡水中,在95至105℃,优选约100℃的温度下进行2至20分钟,优选5至15分钟的时间。在该热烫步骤中引入的水量如下确定:以ml计的水体积与以g计的昆虫重量的比率优选包含在0.3至10之间,更优选在0.5至5之间,甚至更优选在0.7至3之间,甚至更优选约1。可选地,漂烫步骤用包含在80℃至130℃之间,优选在90℃至120℃之间的温度下的蒸汽和/或水进行。根据本发明的方法可以进一步包括在酶促水解之前用氧化剂处理昆虫角质层的步骤。优选地,在根据本发明的方法中,用于角质层处理中的氧化剂选自过氧化氢、高锰酸钾、臭氧和次氯酸钠,甚至更优选过氧化氢。有利地,当氧化剂是过氧化氢时,引入用于处理昆虫角质层的这种试剂的量是这样的,其使得过氧化氢含量包含在基于昆虫的总重量按重量计1至33%之间,优选基于昆虫的总重量按重量计2至12%之间,优选按重量计约6%。优选地,用氧化剂处理昆虫角质层在水例如淡水的存在下进行。有利地,用于处理角质层中的水量如下确定:以ml计的水体积与以g计的昆虫重量的比率优选包含在0.3至10之间,更优选在0.5至5之间,甚至更优选在0.7至3之间,甚至更优选约1。用氧化剂处理昆虫角质层可以在下述步骤的一个或多个期间进行:-伴随着热烫和/或在热烫步骤之后,更优选伴随着热烫。可选地,伴随着漂烫和/或在漂烫步骤之后,更优选伴随着漂烫。更具体地,当在热烫或漂烫期间进行昆虫角质层的处理时,可以有利地将氧化剂加入用于热烫昆虫的水中。-在研磨之前、伴随着研磨和/或在研磨之后。更具体地,当在研磨期间进行昆虫角质层的处理时,可以有利地将氧化剂加入用于研磨的水中。-在压榨之前和/或伴随着压榨。-在昆虫角质层处理的特殊步骤期间。有利地,酶促水解随后可以为热失活的步骤,用于使酶促水解中使用的酶或酶混合物失活。在根据本发明的方法结束时,壳多糖可以通过压榨或酶促水解反应混合物的离心来回收。在这个阶段,也回收了壳多糖副产物,即水解产物。下文更详细地描述根据本发明的方法的优选实施方案。特别地,该优选实施方案描述了用于根据本发明的方法的各个有利步骤,例如壳多糖的温和纯化步骤:第二次压榨、洗涤操作、任选的过滤和干燥。最后,由于壳多糖一般以粉末的形式销售,所以也可以进行第二次研磨。后者也可以进行以促进脱乙酰化反应,用于从壳多糖制备脱乙酰壳多糖。脱乙酰化反应的条件在下文详细描述的优选实施方案的步骤10中更全面地描述。用于从昆虫角质层生产壳多糖的特别有利的方法包括下述步骤:a)杀死昆虫,b)研磨昆虫,c)压榨昆虫,d)用蛋白水解酶酶促水解昆虫角质层,e)回收壳多糖,其中在步骤d)之前可以任选地用氧化剂处理昆虫角质层。各个步骤a)至e)的优选实施方案以及用氧化剂的处理如上所述或在下文优选实施方案的相应步骤中描述。本发明还涉及壳多糖,例如可通过根据本发明的方法获得的壳多糖。由于根据本发明的方法使用的温和条件,该壳多糖具有的结构接近于壳多糖的那种,因为它在昆虫角质层中以天然状态出现,同时具有高纯度,例如包含在40至90%之间,优选在50至90%之间,更优选包含在60至85%之间,且甚至更优选约80%的纯度。根据本发明的壳多糖具有下述有利性质中的至少任何一种:-灰分含量基于干物质的总重量按重量计小于4%,优选小于3.5%,更优选小于或等于2.5%(尤其当壳多糖由素食昆虫制备时),更优选小于2%,且甚至更优选小于或等于1.5%(尤其当壳多糖由黄粉虫制备时),且甚至更优选小于1%,-包含在40至90%之间,优选在50至90%之间,更优选包含在60至85%之间,且甚至更优选约80%的纯度(或重量分析纯度),-具有(c-o)/(c-h)比包含在0.30至0.56之间,优选在0.31至0.53之间的官能团表面丰度,-脂质含量基于干物质的总重量按重量计≤14%-当从非飞行昆虫制备壳多糖时,脂质含量≤5%-总氨基酸≤45%-当从非飞行昆虫制备壳多糖时,总氨基酸≤16%-来自ala、gly、leu、pro、ser、tyr、val的至少任何3种氨基酸的相对丰度≤10%,-当从黄粉虫制备壳多糖时,leu、pro、val的相对丰度≤10%,-当从黄粉虫制备壳多糖时,ala的相对丰度≤12%,-比色纯度≥40%,-当在酶促水解中用酶prolyvenp制备壳多糖时,比色纯度≥50%,-差异纯度≥45%,优选≥49%,-当从黄粉虫制备壳多糖时,差异纯度≥52%,-当从飞行昆虫制备壳多糖时,差异纯度≥70%,-乙酰化程度≥70%并且结晶度≤0.61,-乙酰化程度≥70%并且结晶度≥0.42。壳多糖包含小于或等于45%的氨基酸含量,小于或等于3.5%,优选小于或等于2.5%的灰分含量,以及大于或等于45%,优选大于或等于49%的差异纯度。优选地,壳多糖具有所有上述性质。上述特点的所有单位和测量方法在实施例中,且更具体地在实施例5中进行描述。用于从昆虫角质层生产水解产物的特别有利的方法包括下述步骤:a)杀死昆虫,b)研磨昆虫,c)压榨昆虫,d)用蛋白水解酶酶促水解昆虫角质层,e)回收水解产物,其中在步骤d)之前可以任选地用氧化剂处理昆虫角质层。各个步骤a)至e)的优选实施方案以及用氧化剂的处理如上所述或在下文优选实施方案的相应步骤中描述。本发明还涉及水解产物,例如可通过根据本发明的方法获得的水解产物。根据本发明的水解产物具有下述有利性质中的至少任何一种:-灰分含量基于干物质的总重量按重量计小于4%,优选小于3%(尤其当从素食昆虫制备水解产物时)-优异的消化率,特别是胃蛋白酶消化率大于95%,优选大于或等于96%,且更优选大于或等于98%,且更特别大于或等于99%,胃蛋白酶消化率已根据遵循decision72/188/eec的方法进行测量;-蛋白质/肽含量大于或等于70%,优选大于或等于71%,且更优选大于或等于75%,且更优选大于或等于80%(特别当水解产物由非飞行昆虫制备时);-大于12,400g/摩尔的水溶性蛋白质含量基于水溶性蛋白质的总重量按重量计小于20%,优选小于18%;-脂质含量小于14%,优选小于10%,更优选小于或等于5%(尤其当水解产物由非飞行昆虫制备时),更优选小于或等于2%,且甚至更优选小于或等于1%;-其中最丰富的氨基酸是脯氨酸、丙氨酸、亮氨酸、天冬氨酸、谷氨酰胺和/或缬氨酸的组合物。“最丰富的”意指组合物中氨基酸的相对量基于氨基酸的总重量按重量计大于5%,优选大于7%。高脯氨酸含量证明是特别有利的;-选自asp、glu、ala、gly、leu、pro、tyr、val、lys的至少任何5种氨基酸的相对丰度≥6%;-选自asp、glu、ala、leu、pro、tyr、val的至少任何3种氨基酸的相对丰度≥8%。更具体地,“水溶性蛋白质”意指蛋白质(或粗蛋白质)中可溶于水溶液中的那些,所述水溶液的ph包含在6至8之间,有利地在7.2至7.6之间。优选地,水溶液是缓冲溶液,其ph包含在6至8之间,有利地在7.2至7.6之间。优选地,缓冲溶液是磷酸盐缓冲nacl溶液,其ph等于7.4±0.2。水解产物包含至少40%的蛋白质,最多10%,优选最多8%的灰分,以及小于50%,优选小于43%的大于12,400g/摩尔的水溶性蛋白质含量。“素食昆虫”意指在其通常的饮食中不含动物蛋白质的昆虫。作为素食昆虫的例子,可以提到鞘翅目、鳞翅目或直翅目。“飞行昆虫”意指能够在成年时飞行的昆虫,与被称为“非飞行”的昆虫相反。作为飞行昆虫的例子,可以提到鳞翅目或双翅目。作为非飞行昆虫的例子,可以提到鞘翅目或直翅目。上述特点的所有单位和测量方法在实施例中,且更具体地在实施例5中进行描述。优选地,水解产物具有所有上述性质。特别要注意的是,根据本发明的水解产物可以通过其葡糖胺含量和/或其衍生物(优选n-乙酰葡糖胺)区别于任何其他类型的水解产物,更特别地,基于水解产物的干物质的总重量按重量计大于或等于0.01%,优选大于或等于0.08%的含量。在本申请中,对规定或指令的任何提及涉及如对本申请的提交日期有效的所述规定或所述指令。水解产物可有利地补充有添加剂以平衡其营养特性,以便使其适合于不同类型的动物。水解产物可以有利地浓缩随后干燥,以便获得干燥的水解产物。可选地,水解产物可以是液体形式。这些水解产物可以用作特别用于动物的食品或食物成分,或可选地它们可以加工,例如以分离氨基酸。用于从昆虫角质层生产脱乙酰壳多糖的特别有利的方法包括下述步骤:a)杀死昆虫,b)研磨昆虫,c)压榨昆虫,d)用蛋白酶酶促水解昆虫角质层,e)回收壳多糖,f)所回收的壳多糖的脱乙酰化,g)回收脱乙酰壳多糖,其中在步骤d)之前可以任选地用氧化剂处理昆虫角质层。各个步骤a)至g)的优选实施方案以及用氧化剂的处理如上所述或在下文优选实施方案的相应步骤中描述。本发明还涉及可通过根据本发明的方法获得的脱乙酰壳多糖。可通过根据本发明的方法获得的壳多糖和/或脱乙酰壳多糖可以有利地用于各种应用中:-在化妆品、药物、营养或饮食组合物中,-作为用于处理烧伤的生物材料,作为第二皮肤,用于制备角膜敷料或缝合材料,-作为过滤剂、组织形成剂、絮凝剂和/或吸附剂,特别是用于水过滤和纯化。根据本发明的优选实施方案,该方法包括在图1中示意性描述的下述步骤。应当注意,在该优选实施方案中,某些步骤被指示为任选的。●步骤1:杀死昆虫这种杀死步骤1使得能够在降低微生物负荷(降低变质风险和健康风险),并且通过使昆虫内部酶失活的同时杀死昆虫,所述昆虫内部酶可以触发自溶且因此触发其快速褐变。杀死可以通过热烫进行。昆虫,优选幼虫,因此用水热烫2至20分钟,优选5至15分钟。优选地,水在包含在95至105℃之间,优选100℃的温度下。在该热烫步骤1中引入的水量如下确定:以ml计的水体积与以g计的昆虫重量的比率优选包含在0.3至10之间,更优选在0.5至5之间,甚至更优选在0.7至3之间,甚至更优选约1。可选地,杀死可以通过漂烫进行。优选地,昆虫用包含在80至130℃之间,优选在90至120℃之间,更优选在95至105℃之间,甚至更优选98℃的温度下的蒸汽(蒸汽喷嘴或床),或包含在95至105℃之间,优选100℃(通过喷嘴)的温度下的水,或包含在80至130℃之间,优选在90至120℃之间,更优选在95至105℃之间的温度下的混合模式(水+蒸汽)进行漂烫。在漂烫室中的停留时间包含1至15分钟之间,优选在3至7分钟之间。在该步骤中,还能够根据下文中间步骤中指出的细节,使用包含氧化剂的热烫或漂烫水来处理昆虫角质层。●中间步骤(任选的):用氧化剂处理角质层可以在该方法中引入用氧化剂处理角质层的专门步骤。有利地,处理角质层的该中间步骤在杀死步骤1和研磨步骤2之间进行。该中间步骤优选用选自过氧化氢(h2o2)、高锰酸钾(kmno4)、臭氧(o3)和次氯酸钠(naclo)的氧化剂,更优选过氧化氢进行。根据第一个实施方案,在步骤1结束时,当后者通过热烫进行后,在将热烫水任选冷却至约40至60℃,优选约50℃的温度之后,将氧化剂直接引入热烫罐内。如销售的过氧化氢通常为水溶液的形式,例如基于水的总重量按重量计30%的溶液。引入用于处理的过氧化氢的量是这样的,其使得过氧化氢含量包含在基于昆虫的总重量按重量计1至33%之间,优选基于昆虫的总重量按重量计2至12%,优选按重量计约6%。根据第二个实施方案,将昆虫从热烫罐中取出,筛分并且重新引入罐内。随后将过氧化氢以稀释水溶液的形式引入罐内,过氧化氢含量随后包含在基于水的重量按重量计1至33%之间,优选基于重量的水按重量计2至12%,且优选按重量计约6%。●步骤2:研磨将昆虫从热烫罐或处理罐或者漂烫室中取出,随后将其筛分,并且放置在研磨机例如刀磨机中,使得能够将昆虫粉碎成颗粒。为了促进研磨,可以添加一定量的水。该水量类似于在热烫步骤1期间引入的水量:以ml计的水体积与以g计的昆虫重量的比率优选包含在0.3至10之间,更优选在0.5至5之间,甚至更优选在0.7至3之间,甚至更优选约1。还能够保留热烫水和/或产生于中间步骤的水,以便进行该步骤。这种水可能含有氧化剂。在这种情况下,角质层的处理可以在热烫步骤1和研磨步骤2期间或者在角质层处理的中间步骤期间和在研磨步骤期间发生。优选地,在研磨完成时,昆虫颗粒的尺寸小于1cm(使用显微镜可观察到的最大粒度),优选小于0.5cm。优选地,颗粒的尺寸包含在500μm至0.5cm之间,且甚至更优选在500μm至1mm之间。无需过度减小粒子的尺寸,例如至小于250μm的尺寸。该研磨步骤2促进酶对其底物的接近。在该步骤中,能够将氧化剂引入研磨机,以便根据前述中间步骤中所示的方法处理角质层。当角质层的处理不伴随着研磨进行时,在该步骤期间,能够添加通常用于产物保存和稳定性的抗氧化添加剂。●步骤3:压榨昆虫角质层随后将源于研磨步骤2的湿糊剂根据程序放置在压榨机中,所述程序使得能够压榨且分离包含脂肪级分和蛋白质级分两者的汁。优选地,压榨步骤使得能够获得包含油含量小于或等于20%,优选小于或等于15%,更优选小于或等于12%,甚至更优选小于或等于10%的压榨饼。类似地,压榨步骤使得能够获得干物质含量包含在30%至60%之间,优选包含在40%至55%之间,且更优选包含在45%至50%之间的压榨饼。任何压榨系统可以用于进行压榨步骤,例如单螺杆或双螺杆压榨机(angel型双螺杆压榨机)、压滤机(choquenet型压滤机)、压板式挤压机等。这些系统是本领域技术人员众所周知的,所述本领域技术人员能够确定压榨条件以便获得上述的油和/或水含量。如果用包含氧化剂的水获得来自研磨步骤2的湿糊剂,则在压榨步骤3之前去除该氧化剂的至少一部分可以是有利的。该压榨步骤3可以任选地从热烫的昆虫开始在研磨步骤2之前进行。然而,在研磨步骤2之后执行压榨步骤3是有利的。该压榨步骤3因此使得能够获得压榨汁和压榨饼。●步骤4:酶促水解将源于研磨步骤2的湿糊剂或源于压榨步骤3的压榨饼放置在具有水的水解罐中。任选地,且如下所述,源于分离步骤12的蛋白质级分可以通过将其与压榨饼混合而在该酶促水解步骤4中重新引入。任选地,且在热烫水不含氧化剂的情况下,可以回收热烫水并且在水解步骤中重新引入。事实上,这种水含有通过这种热烫的动作已溶解的昆虫级分,并且通过在水解中使用后者能够减少损失。任选地,来自热烫的这种水可以脱脂,因为某些蜡可以溶解在水中。在该酶促水解步骤4中引入的水量类似于在热烫步骤1中引入的水量:以ml计的水体积与以g计的昆虫重量的比率优选包含在0.3至10之间,更优选在0.5至5之间,甚至更优选在0.7至3之间,甚至更优选约1。在6至8,更特别地6.5至7.5的ph下,在40至60℃,更特别地45至55℃的温度下,酶的水解用蛋白酶如商业蛋白酶进行4至8小时,更特别地4至5小时。在水解步骤中引入的酶的量基于进入水解的干物质的估计总重量按重量计小于10%,优选小于6%,更优选约2%。蛋白酶解水解导致含有肽、葡糖胺和寡聚壳多糖的可溶相,以及由壳多糖主要是壳多糖-多肽共聚物形成的固体残余物。●步骤5:热失活为了停止反应的酶的活性并且稳定水解的可溶相,通过将该汁在80至105℃之间加热10至25分钟,优选15至20分钟来进行热失活。根据一种程序,根据农业食品工业的通常灭菌技术进行该热失活步骤5。根据另一种程序,通过在ir或uv辐射下加热或通过微波加热进行酶失活。●步骤6:压榨主要由壳多糖组成的固体残余物被回收,随后在压榨机中压榨用于使该残余物的排出最大化,以便将该压榨物重新注入可溶相内。因此形成的压榨残余物基本上由壳多糖组成,主要以壳多糖-多肽共聚物的形式。●步骤7和8(任选的):洗涤和干燥随后将固体残余物洗涤、过滤、再次洗涤、随后通过本领域技术人员已知的常规技术干燥。有利地,干燥系统被设计成保护壳多糖-多肽共聚物的结构:控制液体比重测定法、通风和空气的组成。有利地,干燥可以在通风炉中在60至80℃,优选约70℃的温度下进行。任选地,这些步骤可以包括最终的脱脂步骤:用hcl处理固体残余物,以去除最后的脂质残留物,特别是角质层蜡。接下来的步骤9至11用于将壳多糖转化为脱乙酰壳多糖,并且因此仅在所需产物为脱乙酰壳多糖时使用。●步骤9(任选的):研磨随后例如在切割(刀)磨机中,将主要包含壳多糖的干燥的固体残余物研磨。通过脱乙酰反应从壳多糖生产脱乙酰壳多糖在很大程度上取决于壳多糖颗粒的大小。因此,脱乙酰化之前干燥固体残留物的非常细的研磨使得可能显著增加产率和脱乙酰化反应的速率,如下表1所示:研磨30秒研磨45秒研磨60秒研磨120秒50%的颗粒<174µm<117µm<95µm<67µm90%的颗粒<310µm<244µm<157µm<159µmda*99%90%85%80%表1:根据壳多糖的先前研磨脱乙酰化的效率*乙酰化程度da的测量。在表1中报道的测试中进行的脱乙酰化条件如下:反应时间4小时,100℃,以30体积%在水溶液中的naoh,估计的壳多糖:naoh溶液的比率等于1:20。因此,固体残余物优选研磨成小于200μm,更优选小于160μm的粒度。●步骤10:脱乙酰化随后将任选在步骤9中研磨的固体残余物置于反应器中,向其中加入浓缩氢氧化钠溶液共4至24小时,且优选6至18小时。含量范围为30%至40%的在水溶液中的氢氧化钠以g研磨的壳多糖的重量/以ml水溶液中的氢氧化钠的体积的比率加入,所述比率包含在1:50至1:10之间,优选约1:20。随后将罐加热,脱乙酰化温度在80至150℃之间,优选在90至120℃之间,且更优选在100℃下。脱乙酰壳多糖因此以粉末形式获得。随后,脱乙酰壳多糖可以经历本领域技术人员已知的任何操作,允许其被官能化,特别是通过加入自由基(羧基化、羟基化等)。●步骤11(任选的):干燥随后将脱乙酰壳多糖粉末在30至80℃之间,优选在50至70℃之间,优选在约60℃下干燥,以便获得干物质含量大于85%,更特别地大于90%的粉末。接下来的步骤用于从压榨步骤3中获得的汁中回收脂肪级分和蛋白质级分,并且因此仅在需要这种回收时使用。●步骤12:分离压榨汁经历一个或多个分离步骤,以便使脂肪级分(昆虫油)与蛋白质级分(昆虫血淋巴蛋白)分离。这些步骤可以通过本领域技术人员众所周知的任何油分离技术进行,例如离心、倾析、通过反渗透分离、超滤、超临界co2等、或这些技术中的几种的组合。考虑到昆虫中存在非常不同组成的油,脂肪级分的分离可能是复杂的,并且脂肪酸可以具有短链(c2-c5)以及非常长的链(例如,对于蜡:>c25)。在离心过程中将温度升高到高于这些油的熔点(大约38℃)使得能够溶解该膏状物,并且促进脂肪级分与汁的剩余部分的分离。离心液随后经历根据(滗析器或tricanter型)的程序的倾析,用于油和蛋白质的最佳可能分离。因此,这些步骤使得能够获得脂肪级分。一旦与脂肪级分分离,蛋白质级分就可以紧在水解步骤4之前与源于压榨步骤3的压榨饼混合。事实上,在压榨步骤3中,通常多于20%的蛋白质在汁中损失,因此回收该级分并且使其经受水解步骤有益。●步骤13(任选的):浓缩根据一种程序,通过水性部分的真空蒸发进行浓缩。浓缩物具有大于10%,优选大于20%的干提取物。该操作促进干燥,并且可以在该步骤中添加通常用于产物保存和稳定性的添加剂。●步骤14(任选的):干燥浓缩物最终通过本领域技术人员已知的技术进行干燥,例如喷雾/雾化(“喷雾干燥”),这使得能够获得提取物,即富含浓缩肽和葡糖胺的浓缩物的干粉,所述葡糖胺特别源于通过h2o2(基本上)的壳多糖部分水解。参考附图,通过作为举例说明的下述实施例,本发明的其他特点和优点将变得清楚,所述附图分别表示:-图1是根据本发明的方法的优选实施方案的流程图,-图2是比较通过酶促方法获得的壳多糖的纯度的图表,所述酶促方法包括研磨和压榨的一个或多个初步步骤,-图3是比较在从其中提取壳多糖的中间产物的不同级分中测量的脂质含量的图表,-图4显示了通过酶促方法获得的压榨汁和压榨饼中的脂质分布,所述酶促方法包括研磨和压榨的初步步骤或压榨的初步步骤,-图5是显示了根据其在本发明的水解产物和压榨汁中的摩尔质量(以%)的蛋白质/肽分布的图表,-图6是显示了构成根据本发明的水解产物的氨基酸的相对分布的图表,-图7是显示了壳多糖中的氨基酸的相对丰度的图表;-图8:压榨对水解产物中的灰分含量的作用-不同昆虫,-图9:压榨对水解产物中的灰分含量的作用-不同酶,-图10:使用研磨+压榨方法的水解产物中的灰分含量-不同昆虫,-图11:根据用prolyve进行水解的不同方法和不同昆虫的大蛋白质的相对丰度,-图12:根据应用于黄粉虫的不同方法和不同酶的大蛋白质的相对丰度,-图13:压榨对水解产物的蛋白质含量的作用-不同酶,-图14:压榨对水解产物的蛋白质含量的作用-不同昆虫,-图15:压榨对水解产物的脂质含量的作用-不同酶,-图16:压榨对水解产物的脂质含量的作用-不同昆虫,-图17:所获得的水解产物的胃蛋白酶消化率-临时的,-图18:tm+prolyve:水解产物中的氨基酸的相对丰度,-图19:tm+sumizyme:水解产物中的氨基酸的相对丰度,-图20:tm+novozyme:水解产物中的氨基酸的相对丰度,-图21:tm+中性蛋白酶:水解产物中的氨基酸的相对丰度,-图22:hi+prolyve:水解产物中的氨基酸的相对丰度,-图23:gm+prolyve:水解产物中的氨基酸的相对丰度,-图24:ad+prolyve:水解产物中的氨基酸的相对丰度,-图25:压榨对壳多糖中的灰分含量的作用-不同酶,-图26:来自不同昆虫的壳多糖中的灰分含量,-图27:壳多糖中的脂质含量,-图28:壳多糖中的氨基酸含量,-图29:tm+prolyve:壳多糖中的氨基酸的相对丰度,-图30:tm+sumizyme:壳多糖中的氨基酸的相对丰度,-图31:tm+novozyme:壳多糖中的氨基酸的相对丰度,-图32:tm+中性蛋白酶:壳多糖中的氨基酸的相对丰度,-图33:hi+prolyve:水解产物中的氨基酸的相对丰度,-图34:gm+prolyve:水解产物中的氨基酸的相对丰度,-图35:ad+prolyve:水解产物中的氨基酸的相对丰度,-图36:根据应用于黄粉虫的不同方法和不同酶的壳多糖的重量分析纯度,-图37:根据使用prolyve的不同方法和不同昆虫的壳多糖的重量分析纯度,-图38:根据使用黄粉虫的不同方法和不同酶的壳多糖的比色纯度,-图39:根据使用prolyve的不同方法和不同昆虫的壳多糖的比色纯度,-图40:壳多糖的差异纯度,-图41:通过用于黄粉虫的方法获得的壳多糖的乙酰化程度,-图42:通过使用prolyve的方法获得的壳多糖的乙酰化程度,-图43:通过双光子荧光显微镜检查的角质层的成像,-图44:所获得的壳多糖的结晶度,和-图45:水解产物中的蛋白质大小。实施例1:根据本发明的方法的实施例将600g黄粉虫幼虫引入烧杯内,置于在100℃下的水浴中,其含有预先煮沸的600ml水。5分钟后,将烧杯从水浴中取出,将幼虫排干,随后与600ml体积的水混合。在下述条件下,用angel型的双螺杆压榨机压榨由此获得的液体:-速度=82转/分;-w(能量)=3hp(马力)或2.68x106j;-孔隙率(近似)=第一部分中的0.5mm和最后部分中的0.2mm。由此获得了压榨汁和136.49±4.48g湿重的压榨饼,其中100.22±0.22g用于下一个步骤中。然而,可以使用任何其他类型的压榨机,条件是它允许提取和获得在水含量和/或脂质含量方面基本上相似的压榨饼。例如,使用具有下述特点的choquenet类型的压滤机进行其他测试:-池的过滤表面积=50cm²;-压力=2至8巴;-温度=20至80℃,-孔隙率=25至80μm;-在过滤结束时的流速=100至250ml/小时。将压榨饼转移到含有600ml以1%(相对于压榨饼的湿重)的蛋白酶(prolyvenpconc)溶液的锥形瓶中,并且将整体置于在45℃下的磁力搅拌4小时(在大约6.5的ph下)。随后将锥形瓶置于在90℃下的水浴中15分钟,以便使酶失活,随后将溶液在0.45-0.5μm下热过滤。由此获得的壳多糖在70℃下干燥24小时。因此,通过该方法获得16.99±1.77g壳多糖。在这些条件下,水解产物(水解后获得的滤液)代表609.98±10.9g,干物质含量为5.05%,其在冻干后使得能够获得30.8±0.55g干水解产物。实施例2:在酶促水解之前的机械步骤对获得的壳多糖纯度的影响测试不同类型的机械预处理:单独的研磨(“研磨1”)、研磨随后为压榨、研磨随后为压榨和第二次研磨(“研磨2”)、以及单独的压榨。对于压榨,使用实施例1所述的angel型的压榨机。1.材料与方法使用一次研磨的壳多糖生产将200g黄粉虫幼虫引入烧杯内,并且置于100℃下的水浴中,其含有预先煮沸的200ml水。5分钟后,将烧杯从水浴中取出,将幼虫排干,随后与200ml体积的水混合。将由此获得的液体转移到含有2g蛋白酶(prolyve)的锥形瓶中,并且将整体置于在45℃下的磁力搅拌4小时(在大约6.5的ph下)。随后将锥形瓶置于在90℃下的水浴中15分钟,以便使酶失活,随后将溶液在0.45-0.5μm下热过滤。由此获得的壳多糖在70℃下干燥24小时。因此,通过该方法获得8.13±0.27g壳多糖。使用研磨随后为压榨的壳多糖生产将200g黄粉虫幼虫引入烧杯内,并且置于100℃下的水浴中,其含有预先煮沸的200ml水。5分钟后,将烧杯从水浴中取出,将幼虫排干,随后与200ml体积的水混合。将由此获得的液体传送到双螺杆型压榨机内。将30g由此获得的压榨饼转移到含有150ml水和0.3g蛋白酶(prolyve)的锥形瓶中,并且将整体置于在45℃下的磁力搅拌4小时(在大约6.5的ph下)。随后将锥形瓶置于在90℃下的水浴中15分钟,以便使酶失活,随后将溶液在0.45-0.5μm下热过滤。由此获得的壳多糖在70℃下干燥24小时。因此,通过该方法获得4.71±0.11g壳多糖。使用第一次研磨(“研磨1”)随后为压榨和第二次研磨(“研磨2”)的壳多糖生产将200g黄粉虫幼虫引入烧杯内,并且置于100℃下的水浴中,其含有预先煮沸的200ml水。5分钟后,将烧杯从水浴中取出,将幼虫排干,随后与200ml体积的水混合。将由此获得的液体传送到双螺杆型压榨机内。使由此获得的压榨饼在70℃的烘箱中干燥24小时,随后研磨至250μm。将10g由此获得的粉末转移到含有50ml水和0.1g蛋白酶(prolyve)的锥形瓶中,并且将整体置于在45℃下的磁力搅拌4小时(在大约6.5的ph下)。随后将锥形瓶置于在90℃下的水浴中15分钟,以便使酶失活,随后将溶液在0.45-0.5μm下热过滤。由此获得的壳多糖在70℃下干燥24小时。因此,通过该方法获得4.93±0.12g壳多糖。仅使用压榨的壳多糖生产将200g黄粉虫幼虫引入烧杯内,并且置于100℃下的水浴中,其含有预先煮沸的200ml水。5分钟后,将烧杯从水浴中取出,将幼虫排干,随后传送到双螺杆型压榨机内。将90g由此获得的压榨饼转移到含有450ml水和0.9g蛋白酶(prolyve)的锥形瓶中,并且将整体置于在45℃下的磁力搅拌4小时(在大约6.5的ph下)。随后将锥形瓶置于在90℃下的水浴中15分钟,以便使酶失活,随后将溶液在0.45-0.5μm下热过滤。由此获得的壳多糖在70℃下干燥24小时。因此,通过该方法获得6.48±0.28g壳多糖。通过化学途径的壳多糖生产将50g黄粉虫幼虫引入烧杯内,并且置于100℃下的水浴中,其含有预先煮沸的50ml水。5分钟后,将烧杯从水浴中取出,将幼虫排干,随后与60ml体积的水混合。将由此获得的液体转移到1-l容器中,并且加入500ml1mhcl溶液。将整体置于在90℃下的搅拌1小时。随后过滤内容物,并且将固体残余物转移到含有500ml1mnaoh溶液的1l瓶中;将整体置于在90℃下的搅拌24小时。随后过滤残余物,并且置于在70℃下的通风炉中24小时。因此,获得0.944±0.005g化学纯化的壳多糖。纯度的计算壳多糖的纯度通过比较获得的干燥残余物的重量相对于产生于化学提取的重量来确定,初始干物质的大约5%。脂质含量的测量将2g样品置于烧杯中,向其中加入0.2gna2so4和15mlchcl3/meoh(2/1v/v)。将整体置于磁力搅拌下20分钟,随后过滤溶液,并将残留物再次置于具有10mlchcl3/meoh(2/1v/v)的烧杯中。将整体置于磁力搅拌下15分钟,随后过滤溶液,将溶剂相合并且蒸发至恒重。脂质含量测定为相对于样品的初始重量(2g)在提取-蒸发后按重量计的百分比。2.结果从由图2可以看出的,该方法对所获得的壳多糖纯度具有影响,使用最小的压榨获得最好的结果。最好的结果使用研磨随后为压榨获得,即纯度为78%的壳多糖,并且最差的结果使用单独的研磨获得,即纯度为48%的壳多糖。由其提取壳多糖的中间产物的更精细分析显示低脂质含量促进所获得的壳多糖的更大纯度(图3)。“中间产物”意指进入酶促水解的产物,即源于水解前的最后一步,即根据上述生产方法,研磨步骤1或2或压榨步骤。壳多糖和水解汁中的脂质含量的分析事实上显示,根据中间产物中存在的初始脂质含量,壳多糖中的脂质含量相对稳定,为7至15%,而水解产物中的脂质含量从11%到47%不等(图3)。更具体地,如果中间产物具有35%的脂质含量,则:-产生于水解的壳多糖仅为50%纯的,并且将含有10%的脂质,和-水解产物的脂质含量本身将接近于40%。然而,如果中间产物的脂质含量为7%,则:-水解后获得的壳多糖将具有80%的纯度,并且将具有8%的脂质含量,并且水解产物也将具有约10%的低脂质含量。这指示当初始脂质含量很高,大于12%时,负责水解的酶不仅促使水解蛋白质,还通过催化多功能性(catalyticpromiscuity)水解脂质。因此,在初始脂质分别为35%和7%的情况下,获得壳多糖中类似的脂质含量,即8.6和7.9%。然而,壳多糖的纯度在这种情况下分别从48%到84%。因此,一方面52%的杂质和另一方面16%,平均8%是由于脂质,并且仍附着至壳多糖的蛋白质的量因此比更多脂质存在于经受水解的中间产物中的情况下高38个点。最后,也可以研究压榨上游的研磨的重要性(图4)。因此,可以清楚地看出,当进行初步研磨时,饼和压榨汁之间的脂质分布远远更有效,12.9相对于87.1,针对42.7相对于57.3。实施例3:水解产物的分析对实施例1中获得的水解产物进行详细分析。1.葡糖胺含量在甲醇分解和甲硅烷基化之后,通过气相色谱分析水解产物中的葡糖胺和某些其他糖的含量。程序:将10mg样品和50μg内部标准在110℃(或在130℃下,24小时)下置于500μl甲醇/3n盐酸混合物中4小时。随后将混合物用ag2co3中和。加入50μl乙酸酐以便重新乙酰化存在的任何糖胺。在环境温度下在黑暗中保持过夜后,将样品离心(15分钟,3000rpm),并且蒸发上清液。随后将化合物溶解在100μl吡啶中,并且在环境温度下与100µlbstfa(supelco)一起温育过夜。随后将试剂蒸发,并且将残余物吸收在700μlch2cl2中且注入gc中。温度程序:在120℃下1分钟,1.5℃/分钟的梯度至180℃,随后2℃/分钟直至200℃。检测:fid柱:hp-5ms(30m,0.25mm内径)内部标准:肌醇以两种不同的方式测量和计算各种含量(表2)。可以看出葡糖胺以按重量计0.1-0.15%的含量,以及相对于葡萄糖0.04-0.05的比率包含在水解产物中。表2:水解产物中的葡糖胺、甘露糖和葡萄糖分布。2.蛋白质的大小通过hplc,shimadzu20a仪器,在环境温度下,在superdexpeptide10/300gl柱上,在乙腈(acn)30%、三氟乙酸(tfa)0.1%的缓冲液中,以0.4ml/分钟的流速,评价水解产物中蛋白质/肽的大小。检测在205nm处进行,并且注入的样品体积为20μl。此外,为了比较的目的,也在相同的条件下估计实施例1中制备的压榨汁中的蛋白质/肽的大小。压榨汁和水解产物之间的蛋白质大小的比较(图5)清楚地显示,存在于水解产物中的大量76%的肽具有包含在130至900da之间的摩尔质量。然而,低消化率的蛋白质(摩尔质量大于1300da)的比例从31%降低到2%。同样,具有苦味特征的肽(摩尔质量小于130da)的比例从38%降低到15%。消化率和适口性的标准因此通过所提出的酶处理得到改善。3.消化率水解产物的胃蛋白酶消化率水平估计为总蛋白质的99.6%。它由外部实验室测量,所使用的方法遵循directive72/199/eec,并且不进行脱脂。4.蛋白质含量水解产物的蛋白质含量估计为84.8%。它由外部实验室,通过凯氏定氮法,使用6.25的校正系数测量。所使用的方法遵循ecregulation152/2009。5.脂质含量水解产物中的脂质含量估计为0.7±0.5%。它由外部实验室通过由ecregulation152/2009(方法b)改编的所谓“水解”方法测量。6.氨基酸组成在用各种酶处理后获得的水解产物就其氨基酸组成进行分析(图6)。这显示了脯氨酸的优势,连同某些生物例如甲壳类中羟脯氨酸(hyp)-脯氨酸的代谢产物的存在和氨基酸的不存在。现在,脯氨酸及其代谢产物羟脯氨酸在代谢中起重要作用,特别是通过允许合成其他氨基酸如精氨酸和谷氨酸盐。虽然大多数哺乳动物能够合成脯氨酸,但这种氨基酸通过新生儿、鸟类和鱼类的生产是不足的,这就是为何有时用脯氨酸和羟脯氨酸的补充用于增加某些动物的生长。此外,脯氨酸是哺乳动物乳中含有的第一大类氨基酸,其中它以12%的含量存在,但它在植物蛋白中的含量远远更少,在大豆中仅2.9%并且在玉米中0.8%。因此,发现这种水解产物具有与牛奶中一样高的脯氨酸含量,并且远远高于植物蛋白质中发现的脯氨酸含量。以大量存在的其他氨基酸是丙氨酸、亮氨酸和谷氨酸盐(含谷氨酰胺)。它们的相对量大于9%。然而,含硫氨基酸如半胱氨酸和甲硫氨酸以低量存在,约0.5%。用于测定这些结果的方法(酸水解)不能检测氨基酸如色氨酸和精氨酸。此外,天冬酰胺完全转化为天冬氨酸,并且谷氨酰胺完全转化为谷氨酸,并且在asp和glu峰下观察到的事实上分别是最初存在于水解产物中的一方面天冬氨酸和天冬酰胺的总和,以及另一方面谷氨酸和谷氨酰胺的总和。实施例4:壳多糖的分析对实施例1中获得的壳多糖进行详细的氨基酸分析。氨基酸的总含量为32.3g/100g共聚物(测定为氨基酸的总和)。存在的氨基酸主要是缬氨酸、甘氨酸、丙氨酸和酪氨酸(图7)。分析进行转包,并且结果通过用于色氨酸的方法nfeniso13904和用于其他氨基酸的nfeniso13903来获得。实施例5:根据所使用的生产方法表征水解产物和壳多糖i.材料与方法a)材料昆虫研究了各种昆虫:-鞘翅目:黄粉虫(黄粉虫或tm),-鳞翅目:蜡螟(蜡螟或gm),-双翅目:黑水虻(黑水虻或hi),和-直翅目:家蟋蟀(家蟋蟀或ad)。酶在水解步骤中使用各种酶。酶促活性的这种测量基于在通过蛋白水解酶的酪蛋白水解期间在275nm处的酪氨酸释放的测量原理(通过karenpratt的valleyresearchsapuassay方法)。sapu/g=蛋白酶的一个分光光度计单位δa=相关吸光度i=在原点处的y轴11=最终反应体积m=校正曲线的斜率30=反应时间(分钟)c=所加入的酶溶液中的酶浓度(g/ml)1=所加入的酶溶液的1ml体积校正曲线通过测量在磷酸盐缓冲液(0.2m,ph7)中不同浓度的酪氨酸溶液的吸光度而获得。使5ml酪蛋白溶液(0.7%w/v,磷酸盐缓冲液0.2m,ph7,在90℃下加热30分钟并且具有加入的3.75g/l溶液)与待测试的1ml酶溶液(在100ml甘氨酸缓冲液中0.15g,0.05m)一起在37℃下温育30分钟。随后加入5mltca溶液(18gtca,11.35g无水乙酸钠,21ml冰乙酸,用脱矿物质的水补足为1升溶液),在涡旋下混合,过滤并测量在275nm处的吸光度。将对照相同地制备但不添加酶,而是加入1ml脱矿物质的水以便具有相同的反应体积。因此对于所使用的各种酶(prolyvenp、novozyme37071、中性蛋白酶和sumizyme)测量的活性列于表3中。表3.所使用的酶的活性和酶质量的对应关系。b)生产方法仅使用研磨的生产方法(在图中指示为“研磨”)将600g新鲜昆虫(在黄粉虫、蜡螟或黑水虻的情况下的幼虫;在家蟋蟀的情况下的蟋蟀)引入腔室内,在其中它们用蒸汽杀死(115℃,5分钟)。随后将昆虫引入混合器内,并且加入75ml水/100g昆虫,随后将整体混合。随后将由此获得的100g(湿重)的产物引入配备有冷凝器和机械搅拌器的三颈烧瓶内,随后加入具有等价于3789sapu的活性的蛋白水解酶。随后将反应加热至45℃共4小时。随后将温度升高到90℃共15分钟,并且最后过滤反应混合物(0.40-0.45μm)。残余物在70℃下干燥24小时:这因此是通过纯化的酶促途径获得的壳多糖;将滤液冷冻且冻干:这因此是水解产物。无论研究何种昆虫或酶,方法是相同的。使用研磨随后为压榨的生产方法(图中指定为“研磨+压榨”)将600g新鲜昆虫(在黄粉虫、蜡螟或黑水虻的情况下的幼虫;或在家蟋蟀的情况下的蟋蟀)引入腔室内,在其中用蒸汽(115℃,5分钟)杀死它们。随后将昆虫引入混合器内,并且加入75ml水/100g昆虫,随后将整体混合且压榨(双螺杆压榨机、或压滤机或其他压榨系统)。随后将由此获得的100g(湿重)的产物引入配备有冷凝器和磁力搅拌器的三颈烧瓶内,加入500ml水以及具有等价于3789sapu的活性的蛋白水解酶。随后将反应在45℃下加热4小时。随后将温度升高到90℃共15分钟,并且最后过滤反应混合物(0.40-0.45μm)。残余物在70℃下干燥24小时:这因此是通过酶促途径的纯化获得的壳多糖;将滤液冷冻且冻干:这因此是水解产物。无论研究何种昆虫或酶,方法是相同的。c)分析灰分含量的测量灰分含量通过基于日期为27-01-2009的ecregulation152/2009的方法确定。蛋白质大小的测量将100mg样品引入10ml磷酸盐/nacl缓冲液(ph7.4,0.137mm)内。将样品搅拌1分钟(涡旋),在900g下离心1分钟,随后通过0.45μm膜过滤。使用nucleogelgfc-300柱,在空间排阻色谱系统上进行分析,所使用的洗脱剂为磷酸盐/nacl缓冲液(ph7.4,0.137mm),流速为1.0ml/分钟,其中检测通过uv检测器在280nm处。蛋白质含量的测量蛋白质含量通过dumas法获得,转换因子为6.25,由标准nfeniso16634-1改编。脂质含量的测量脂质含量通过由ecregulation152/2009–方法b–sn改编的方法获得。胃蛋白酶消化率胃蛋白酶消化率通过directive72/199/ec中描述的方法测量。氨基酸的相对丰度氨基酸的丰度通过衍生自日期为27-01-2009-sn的ecregulation152/2009的方法测定。色氨酸含量通过由日期为27-01-2009的ecregulation152/2009–sn改编的方法分开测定。通过将每个氨基酸的含量与氨基酸含量相关联来计算相对丰度。氨基酸含量氨基酸含量通过将对于每种氨基酸(包括色氨酸)获得的各个值加在一起来确定。重量分析纯度通过比较获得的干燥残余物的重量相对于产生于化学提取的重量,确定重量分析纯度,后者在大约5%的初始干物质下进行评估。比色纯度通过使用imagej软件,根据三种颜色红色、绿色和蓝色(rgb)分析样品的照片来估计样品的颜色,它们的平均值表示对真实颜色的评价。采取通过chitine法国销售的对虾壳多糖样品作为标准(100%纯度),并且所生产样品的比色纯度计算为该颜色的百分比(样品颜色与标准颜色的比率)。差异纯度对于该测量,从绝对纯度(100%)的值中减去已知杂质(氨基酸、脂质和灰分)的量,以获得由差异估计的纯度值;即含有30%蛋白质、10%脂质和1%灰分的样品因此被指定为100-30-10-1=59%的纯度。结晶度根据waxs(广角x射线散射)技术,在配备有lynxeyexe检测器的brukerd8advance仪器(a25davinci设计)上进行测量。结果遵循loelovich,m.res.rev.:j.chem.2014,3,7-14中所述的方法加以解释。乙酰化程度测量使用配备有800mhz磁体的13cnmrcp/mas(bruker)仪器进行。结果如simionattoguinesi,l.;gomescavalheiro,e.t.thermochimicaacta2006,444,128-133和heux,l.;brugnerotto,j.;desbrières,j.;versali,m.-f.;rinaudo,m.biomacromolecules2000,1,746-751中所述进行分析。原子和官能团表面丰度的测量使用配备有rxkaa1源(1486.6ev)、单色仪和磁透镜的xpsescolab250(vgscientific)仪器进行测量。将预先粉碎成粉末的样品置于真空下48至72小时,随后分析。通过双光子荧光显微镜检查的角质层成像在disco仪器(synchrotronsoleil)上的多光子显微镜检查。λexc=810nm,功率18%,绿松石蓝和赭色滤光器406/15(shg),蓝色滤光器460/60,绿色滤光器550/88。ii.水解产物a)灰分压榨对所得到的水解产物的灰分含量具有非常显著的影响,无论研究何种昆虫(图8)。事实上,灰分含量的降低可以达到52%,并且无论昆虫是否天然富含矿物质,比例下降也是非常相似的。因此,在黑水虻的情况下,灰分含量从使用具有研磨的方法时的7.5g/100g干物质变成加入压榨步骤时的3.8g/100g干物质,即49%的降低;在黄粉虫的情况下,它从5g/100g变成2.4g/100g,即52%的降低。压榨也对所得到的水解产物的灰分含量有显著的作用,无论使用何种酶(图9)。特别地,注意到,对于黄粉虫,无论酶如何,当使用具有压榨的方法时,水解产物中的灰分含量小于3%。水解产物(通过研磨+压榨方法获得)中的灰分含量小于4g/100g干物质,无论研究何种昆虫(图10)。b)水解产物中的蛋白质大小使用压榨步骤清楚地使得能够改善蛋白水解酶的性能,无论使用何种昆虫(图11)或酶(图12)。相对于仅包括研磨步骤的方法,大蛋白质的相对丰度因此显著降低,在水解用prolyve进行的情况下,最终的水解产物包括不超过其最大10.3%,无论何种昆虫;并且在黄粉虫水解的情况下不超过17.5%,无论使用何种酶。c)蛋白质含量水解产物的蛋白质含量高度依赖于所使用的方法。因此,当单独应用研磨时,蛋白质仅代表来自由此获得的黄粉虫的水解产物的53.59±1.5%干物质,无论使用何种酶(图13)。然而,当研磨随后为压榨时,水解产物中的蛋白质含量变为84.58±1.4%,,它因此经历53-62%的增加,取决于所使用的酶。如果昆虫最初在蛋白质中较差,则这种增加更大,因此在蜡螟的情况下,蛋白质含量从41.25%变成71%,经历接近86%的增加,并且在黑水虻的情况下,增加甚至为118%,因为它从34.2%变成74.5%(图14)。d)脂质含量压榨对水解产物的脂质含量具有重大影响,无论研究何种酶(图15)或昆虫(图16)。事实上,脂质含量急剧下降51.4-97.7%,因此在黑水虻的情况下从28.6变成13.9%(51.4%的降低),并且在黄粉虫与novozyme的情况下从33.85变成0.9%(97.3%的减少)。e)胃蛋白酶消化率由此获得的水解产物的胃蛋白酶消化率非常高,大于96%,无论研究何种酶或昆虫(图17)。f)氨基酸丰度压榨步骤的使用使得能够获得角质层中存在的其他氨基酸例如丙氨酸和酪氨酸的更好提取,以及在较小程度上缬氨酸、丝氨酸和甘氨酸的提取,无论研究何种酶或昆虫(图18-24)。还应该将这些结果与酶促纯化的壳多糖中存在的氨基酸相关的结果进行比较(图29-35)。注:尽管某些氨基酸(特别包括天冬氨酸和谷氨酸盐)的相对丰度降低,但在某些情况下,它们的量保持相同或甚至略有增加,因为通过具有压榨步骤的方法提取的氨基酸的总量增加(参见水解产物中的蛋白质含量)。iii.壳多糖a)灰分壳多糖中的灰分含量也受到压榨步骤的影响,尽管比水解产物更小的程度。因此观察到根据所使用的酶范围为25%至28.6%的降低(图25)。壳多糖(通过研磨+压榨方法获得)中的灰分含量极低,无论研究何种昆虫(图26)。因此,在黄粉虫的情况下,最大灰分含量为1.05g/100g干物质,并且甚至对于天然富含矿物质的昆虫,它也保持小于3.5g/100g干物质。b)壳多糖中的脂质含量尽管与水解产物相比,程度稍微小一些,但当将压榨步骤加入该方法中时,壳多糖中的脂质含量也降低(图27)。效率基本上取决于酶,从关于sumizyme的15%直到关于novozyme的60%。无论何种昆虫,当反应用prolyve进行时,这种降低位于在黑水虻的情况下的50%和在黄粉虫的情况下的58%之间。对于所有的昆虫,脂质含量小于12%,并且对于非飞行昆虫,它甚至≤6%。c)壳多糖中氨基酸的含量和相对丰度压榨步骤使得能够消除更大比例的附着到壳多糖的蛋白质。由于壳多糖的实际结构中存在的酰胺官能团,蛋白质含量的直接测量变得困难,所以该蛋白质含量通过氨基酸的总和近似(图28)。因此,可以看出,当将压榨步骤加入方法中时,无论研究何种酶或昆虫,氨基酸的总和降低5至54%。氨基酸的相对丰度几乎不受压榨步骤的影响,尽管一些氨基酸包括丙氨酸看起来在进行压榨步骤时被更好地提取(图29至35)。然而,可以说对于所有昆虫,丙氨酸、酪氨酸和脯氨酸以及较少程度的缬氨酸、甘氨酸、亮氨酸和丝氨酸是主要与壳多糖附着的氨基酸,它们的含量平均包含在所有氨基酸的23至40%之间,并且当将压榨步骤加入方法中时,在壳多糖中观察到这些氨基酸的最大降低并且在水解产物中观察到这些氨基酸的最大增加的这些氨基酸中(达到7-30%的最大值)(图18-24)。d)重量分析纯度不管研究何种酶(图36)或昆虫(图37),通过使用压榨步骤改善了重量分析纯度。因此,在黄粉虫与prolyve的情况下,它从48.7%变成77.1%,并且在黑水虻与prolyve的情况下,它从33.7%变成87.9%。e)比色纯度当压榨步骤构成方法的部分时,无论研究何种酶或昆虫(图38和39),也观察到比色纯度中的改善,虽然不如比重纯度明显。f)差异纯度由于在使用压榨的方法后获得的壳多糖中的脂质、灰分和氨基酸含量中的降低,对于这种壳多糖的差异纯度显著增加,从黑水虻的情况下的13%直到黄粉虫与prolyve的情况下的74%,无论研究何种昆虫或酶(图40)。g)壳多糖的乙酰化程度通过向该方法添压榨步骤显著影响乙酰化程度(图41和42)。事实上,从血淋巴中去除脂质和氨基酸允许酶对角质层的表面的更大接近,这促成与壳多糖结合的蛋白质肽键的切割中的改善,以及通过催化多功能性,壳多糖酰胺键的切割中的改善。因此,产生于该方法的黄粉虫的壳多糖的乙酰化程度包含在76%至79%之间,而在不存在压榨步骤的情况下,它是91%,并且甚至在温度和试剂的苛刻条件下进行的化学水解导致85%的乙酰化程度。对于所考虑的其他昆虫,特别是蜡螟和家蟋蟀,乙酰化程度也受到该方法的影响,因此它分别在一种情况下从83变成74%,并且在另一种情况下从100变成95%。由于壳多糖的溶解度和加工性与其乙酰化程度特别相关,所以壳多糖的n-乙酰氨基葡萄糖单元的酰胺键的这种伴随水解是在这些条件下进行的酶促水解的出乎意料的积极效应。h)原子和官能团表面丰度随着纯化进展,壳多糖表面上的原子分布显示相对氧含量中的增加和相对碳含量中的降低(表4)。此外,表面上的碳原子的键趋于从占优势的烃类型(c-h、c-c)的键转到醇型(c-o)或羰基型(c=o)的键。酰胺型(n-c=o)的键中也存在降低。然而,看起来最具代表性的是醇键/烃键比(c-o/c-h),并且在酶促纯化的壳多糖的情况下,该比率包含在0.31至0.56之间,但更具体地在0.39至0.41之间。在表4中:-“原始角质层”意指通过解剖从昆虫提取后直接分析的,以天然状态的角质层的壳多糖;-“酶促纯化的壳多糖(novozyme)”意指产生于在酶novozyme37071的存在下,包括研磨+压榨和酶促水解的方法的壳多糖;-“酶促纯化的壳多糖(prolyve)”意指产生于在酶prolyvenp的存在下,包括研磨+压榨和酶促水解的方法的壳多糖;-“酶促纯化的壳多糖”意指产生于在酶prolyve的存在下,包括研磨+压榨和酶促水解的方法的壳多糖;-“纯壳多糖”意指通过化学纯化获得的壳多糖,等同于用于测定昆虫中的壳多糖量的那种表4.壳多糖表面上的某些原子和键的分布。i)通过双光子荧光显微镜检查的角质层成像与化学纯化相比,通过根据本发明的方法通过酶促途径的壳多糖部分纯化通过保存壳多糖结构的蛋白质“填充”,同时去除在结构外部上的蛋白质超负荷,使得能够维持整体的柔韧性(参见图43)。图43中使用的术语与上述节段iiih)中定义的那种相同。j)结晶度无论研究何种昆虫或酶,所获得的壳多糖的结晶度,即结晶面积和无定形面积的比率包含在0.42至0.61之间。一般地,文献中使用术语结晶度指数,即峰高(而不是面积)的比率。这种测量具有很大的错误风险。然而,为了比较的目的,还测量了样品的结晶度指数,并且它对于所有昆虫位于88至95%之间,并且对于鞘翅目和鳞翅目,甚至大于90%。实施例6:根据本发明的方法回收源于压榨汁的蛋白质级分i.材料与方法a)材料昆虫研究了下述昆虫:-鞘翅目:黄粉虫(黄粉虫或tm)。酶prolyve用于水解。b)生产方法使用研磨随后为压榨的生产方法(图中指定为“研磨+压榨”)将几个分批转化如下:将600g新鲜的黄粉虫幼虫引入腔室内,在其中用蒸汽(115℃,5分钟)杀死它们。随后将昆虫引入混合器内,并且加入75ml水/100g昆虫,随后将整体混合且压榨(双螺杆压榨机、或压滤机或其他压榨系统)。随后将压榨饼在70℃下干燥过夜。另一方面,压榨汁用3000g的力离心30分钟,并且回收固体部分-血淋巴的不溶性蛋白质。随后将125g压榨饼和125g(湿重,大约按干重计的30%)不溶性血淋巴蛋白引入配备有冷凝器和磁力搅拌器的三颈烧瓶内,加入1250ml水以及具有等价于9500sapu的活性的蛋白水解酶。随后将反应在45℃下加热4小时。随后将温度升高到90℃共15分钟,并且最后过滤反应混合物(0.40-0.45μm)。残余物在70℃下干燥24小时:这因此是通过酶促途径通过纯化获得的壳多糖;将滤液冷冻且冻干:这因此是水解产物。c)分析如实施例5中进行灰分含量的测量、脂质含量的测量、氨基酸的相对丰度和蛋白质大小的测量。ii.所获得的产物的表征所获得的产物、壳多糖和水解产物进行分析和表征(表5,图45)。n.a.:不适用表5:表征当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1