抗CD89细胞毒素的复合物的制作方法
本文提供的技术涉及适于靶向和杀死人靶细胞的新型复合物,所述复合物包含具有结合结构的第一多肽和具有毒性效应结构域的第二多肽,所述结合结构用于将所述复合物与存在于人靶细胞的细胞表面的细胞表面受体cd89相结合;还涉及编码所述复合物的核酸分子、载体、含有核酸的宿主细胞和用于制备和产生此类复合物的方法;以及使用所述复合物用于治疗疾病,特别是如白血病等癌症的组合物和方法。
背景技术:
在治疗肿瘤、自身免疫性疾病、过敏和组织排斥反应方面,目前可用的药物,如化疗剂(goodin,s.,amjhealthsystpharm,2007,64:p.15-24)皮质类固醇(stanbury,r.m.&graham,e.m.,brjophthalmol,1998,82:p.704-708)和免疫抑制剂等(stucker,f.&ackermann,d.,therumsch,2011,68:p.679-686),由于其相关的非特异性,缺点在于具有潜在的有时相当大的副作用。已经尝试通过各种治疗方案来改善这种情况。特别是使用免疫治疗剂这种方法,其增加了特别是在肿瘤治疗方面的药物的特异性。
免疫毒素(it)是最初开发用于治疗恶性疾病的蛋白。它们包含毒性效应结构域和肿瘤细胞特异性结合组分,其通常是抗体或其衍生物。最初,抗体组分来自小鼠,而毒素来自细菌或植物,例如,铜绿假单胞菌外毒素a(eta)(ribbert,t.,etal.,brjdermatol,2010;163:p.279-86)、白喉毒素(dt)(potala,s.,etal.,drugdiscoverytoday,2008,13:p.807-15)或蓖麻a毒素(rt)(thepent.,etal.,naturebiotechnology,2000,18:p.48-51.)。与传统化疗相比,it的主要优势在于其具有针对靶细胞的特有的特异性。
由与人毒性效应结构域(如促细胞凋亡酶)融合的疾病特异性结合组分(如scfv、细胞因子或肽配体)构成的融合蛋白被称为“人溶细胞融合蛋白”(hcfp),并已经在几个应用中证明了它们的潜力(stahnke,b.,etal.,molcancerther,2008.7(9):p.2924-32;huhn,m.,etal.,cancerres,2001.61(24):p.8737-42;krauss,j.,etal.,brjhaematol,2005.128(5):p.602-9;schiffer,s.,etal.,antibodies,2013.2(1):p.9-18;hristodorov,d.,etal.,brjcancer,2014.109(6):p.1570-1578)。
在临床使用中大多数抗癌药物的治疗活性受到其对增殖细胞(包括一些正常细胞)的一般毒性的限制。虽然化学家持续开发具有独特作用机制的新型细胞毒剂,但是许多这些化合物仍然缺乏肿瘤选择性,不具有治疗用途。抗体或其切除片段也意味着it和hcfp与癌细胞表面的特异性标记结合,其提供了一种对肿瘤具有高度特异性因此具有更低毒性的取代疗法(chari,rv,accountsofchemicalresearch,2008,41:p.98-107)。
然而,为了获得期望的it和/或hcfp的细胞毒性作用,靶细胞中的一些处理步骤至关重要。在it-或hcfp-抗原复合物进行必要的结合和内化之后,随后的细胞内途径和胞质递送是对活性的关键影响(berges,n.,etal.antibodies,2014,3(1):p.92-115)。
一个例子是使用免疫疗法治疗白血病,其需要在原始细胞表面上靶向特异性抗原。已经对fcγ受体(fcvri,cd64)进行了详细研究。cd64靶向免疫疗法已经在急性骨髓性白血病(aml)和慢性骨髓性白血病(cml)细胞的靶向消融中显示出所希望的功效。到目前为止,cd64是唯一被认为适合作为致癌和炎性疾病的免疫治疗的靶标的fc受体。然而,许多缺乏cd64表达的恶性肿瘤的临床病例(schiffer,s.,etal.,intjcancer,2014,135:p.1497-508))排除了进行有效cd64靶向治疗的可能性。
此外,it或hcfp的细胞毒性功效关键依赖于在it-或hcfp-抗原复合物内化之后所使用的scfv和随后的细胞内途径。因此,所选择的scfv以及所述毒性效应结构域,需要满足多个要求以获得it或cfp细胞毒性。
结果,非常有利的是包含新结合部分的新型it或人溶细胞融合蛋白的可用性涵盖所有的要求。
技术实现要素:
在第一方面,本公开属于适于靶向和杀死人靶细胞,特别是人类癌细胞的选定的和特异性复合物,其包含具有结合结构的第一多肽和具有毒性效应结构域的第二多肽,所述结合结构用于将所述复合物与存在于人靶细胞的细胞表面的细胞表面受体cd89相结合。
因此,本公开的实施例提供了细胞毒性重组体it和人溶细胞融合蛋白(hcfp),例如其适合于诱导人细胞凋亡,包括靶细胞特异性结合组分和毒性效应结构域,其中所述结合组分包含具有与细胞表面受体cd89结合的抗原结合位点的抗体或抗体片段。
在另一方面,本公开的实施例提供了编码复合物的核酸,特别是本文公开的重组融合蛋白,以及包含该核酸的载体和宿主细胞。
在其他方面,本公开涉及包含本公开的复合物的组合物,特别是本文所述的重组融合蛋白,其中所述复合物可用作(usefulfor)或用于(usedin)治疗、化妆品和/或诊断的应用。在有利的实施例中,所述组合物用作用于癌症的治疗特别是用于治疗白血病的治疗组合物。
在另一方面,本公开的实施例提供了药物或药物组合物,其包含本公开的复合物、以及药理学上可接受的载体、稀释剂、稳定剂或制剂。
在另一方面,本公开的实施例涉及用于产生复合物的方法,特别是用于通过用dna构建体转化宿主细胞来产生宿主细胞中的重组融合蛋白,其有利地是包括在宿主细胞中具有转录活性的启动子,在合适的培养基中培养转化的宿主细胞以允许所述融合蛋白的表达并产生所述融合蛋白。该方法还可以包括分离/纯化所产生的融合蛋白。
另一方面属于治疗恶性疾病、过敏、自身免疫反应、组织排斥反应或慢性炎症反应的方法,包括给有需要的患者施加有效剂量的本发明的复合物或药物组合物。
另一方面涉及适用于检测cd89的多肽,其中所述多肽包含seqidno:1的氨基酸序列,或其同源多肽、变体或突变(mutation)或其片段,所述同源多肽、变体或突变具有与seqidno:1的氨基酸序列至少85%、优选90%、更优选95%相同的氨基酸,通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基而产生。
本公开的另一方面属于用于检测样品中所含的cd89的方法,包括:
(a)将样品与根据权利要求16至21中任一项所述的多肽接触,并与将融合标签与所述多肽特异性地结合的融合标签特异性荧光团接触;
(b)通过与融合标签特异性荧光团相关联的荧光信号检测样品中cd89的存在。
因此,本公开某些方面还涉及用于诊断cd89+恶性肿瘤的方法,其包括向患者施用本文中所述的适于检测cd89的多肽或将取自患者的生物样本与本文所述的适于检测cd89的多肽接触。
在详细描述公开内容之前,应当理解,本公开不限于本公开中描述的特定复合物,特别是it和hcfp以及生产方法。还应当理解,本文使用的术语仅用于描述特定实施例的目的,而不是限制性的。必须指出的是,如在说明书和所附权利要求中所使用的单数形式“a”、“an”和“the”包括单数和/或复数指示物,除非上下文另有明确规定。此外,应当理解,在由数值限定的参数范围被给定的情况下,该范围被认为包括这些限制值。
附图说明
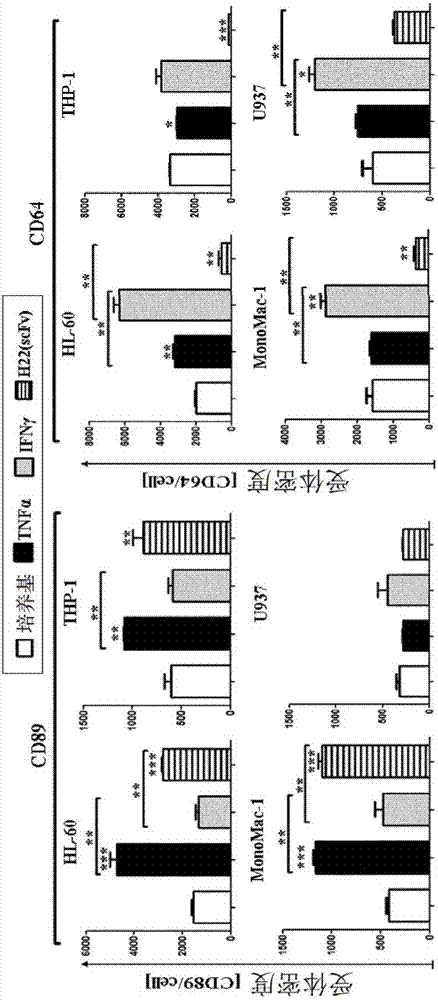
图1是显示人类急性髓性白血病和u937组织细胞淋巴瘤细胞的cd89和cd64表达谱的图。测量前,将人类急性髓性白血病细胞(hl-60,thp-1和mono-mac-1)、组织细胞淋巴瘤细胞(u937)和伯基特淋巴瘤细胞(ramos)仅用培养基孵育或在100u/mlifnγ或1000u/mltnfα下刺激24小时。对cd64和cd89进行双重着色,并对同种型对照采用斑点印迹法。所有检测抗体在含有1%(v/v)阻断人血清的pbs中制备。红色:门控的活细胞种群。
图2是显示人类急性髓性白血病和u937组织细胞淋巴瘤细胞上的cd89和cd64密度的图。测量前,将hl-60、thp-1、mono-mac-1和u937细胞仅与培养基一起孵育,或在100u/mlifnγ或1000u/mltnfα下刺激24小时。将人类急性髓性白血病细胞与在含有1%(v/v)阻断人血清的pbs中的pe标记的检测抗体一起孵育。使用注册商标为facscaliburd的(也称为facscaliburtm)的流式细胞分析仪测量结合抗体的mfi信号。使用来自注册商标为qifikit(也称为
图3(a)示出了cd89(scfv)-eta’载体的设计。pelb:周质转运的前导序列;his-标签:多组氨酸标签;cd89(scfv):包含由(g4s)4接头分离的vl和vh序列的单链可变片段;eta’:含有结构域ib、ii和iii的假单胞菌外毒素a的截短型。图3(b)和图3(c)分别显示了gbr201k-cd89(scfv)载体和cd89(scfv)-angggrr或maptau载体的设计。igk前导:将蛋白质分泌到细胞培养上清液中的前导序列;egbr201k:人源颗粒酶b的突变体形式;angggrr:人源血管生成素的突变体形式;maptau:人源性微管相关蛋白tau。
图4(a)示出了sds-聚丙烯酰胺凝胶。将cd89-eta’从ni/nta基质中洗脱,然后进行大小排阻和将缓冲液换成pbs。左侧泳道显示用考马斯亮蓝(coo)着色的sds-聚丙烯酰胺凝胶。右侧泳道显示用小鼠抗eta’初级mab(tc1)和ap共轭的山羊抗小鼠二级mab探测的相应的免疫印迹(wb)。图4(b)、4(c)和4(d)分别显示了在用考马斯亮蓝(coo)着色的sds-聚丙烯酰胺凝胶,并用小鼠抗聚组氨酸一级mab和ap共轭的山羊抗小鼠二级mab探测的相应的免疫印迹(wb)分析了cd89(scfv)-angggrr[47kda]、cd89(scfv-maptau[80kda]和egbr201k-cd89(scfv)[59kda]。
图5(a)是显示cd89(scfv)-eta’与未刺激的cd89+hl-60和cd89-ramos细胞的特异性结合,该细胞在100u/mlifnγ或1000u/mltnfα下被刺激,和通过流式细胞术使用alexa488偶联的小鼠抗多组氨酸mab进行分析的图。图5(b)显示了使用alexa488偶联的小鼠抗多组氨酸mab通过流式细胞术分析的cd89(scfv)-融合蛋白与tnfα刺激的cd89+hl-60和cd89-ramos细胞的特异性结合。
图6(a)示出了egbr201k-cd89(scfv)和肠激酶消化型-gbr201k-cd89(scfv)的酶活性。基于合成颗粒酶b底物ac-ietd-pna,通过所述比色测定法测量活化蛋白的蛋白水解活性。在elisa平板计数器中,记录动力学1小时,间隔为2分钟,在37℃下,波长为405nm。图6(b)示出了rnase体外切割测定。用几种浓度的cd89(scfv)-angggrr在37℃下孵育酵母trna1.5小时(使用100ng的rnasea作为阳性对照,并将不含有rnase的水加入到阴性对照样品中)。为了可视化剂量依赖性降解过程,通过1%无rnase的琼脂糖凝胶电泳分离样品,并在紫外光下检测片段条带。
图7显示了cd89(scfv)-融合蛋白对hl-60细胞的细胞毒性。通过用未刺激的或受ifnγ或tnfα刺激的hl-60细胞来孵育cd89(scfv)-融合蛋白从而进行细胞毒性测定。图7(a)示出了以pbs作为对照或用15nm(约1μg/ml)cd89(scfv)-eta’进行孵育后,膜联蛋白(annexin)v/pi着色的hl-60细胞(100u/mlifnv或1000u/mltnfa)-eta’的斑点印迹。图7(b)示出了增加cd89(scfv)-eta’浓度时点印迹的定量分析。细胞死亡显示为通过膜联蛋白(annexin)v/pi着色测量的早期和晚期凋亡/坏死细胞的总和。图7(c)显示了使用膜联蛋白(annexin)v/pi着色测量在300u/mlifnγ刺激下300nmcd89(scfv)-angggrr和300nmgbr201k-cd89(scfv)对hl60细胞(cd89+)和ramos细胞(cd89-)的凋亡作用。数据表示三重测定的标准偏差的平均值。统计学显著性通过双尾不配对的学生t检验确定:(*):p<0.05,**:p<0.01,(***):p<0.001。
图8(a)示出了用xtt测定法测定的cd89(scfv)-eta’对不同条件hl-60细胞的细胞毒性作用。图8(b)使用xtt测定法获得cd89(scfv)-angggrr,gbr201k-cd89(scfv)和cd89(scfv)-maptau对hl-60细胞(在200u/mlifnγ刺激下)的细胞毒性作用。数据表示三重测定的标准偏差的平均值。
图9示出了cd89(scfv)-eta’的细胞毒性是抗原特异性的并且由内化决定。细胞死亡显示为通过膜联蛋白(annexin)v/pi着色测量的早期和晚期凋亡/坏死细胞的总和。图9(a)示出了使用10nm(约700ng/ml)的cd89(scfv)-eta’处理未刺激的癌细胞以及在100u/ml的ifnγ或1000u/ml的tnfα刺激下的所述细胞,从而进行凋亡测定。在暴露于it72小时后测定死亡细胞的数量。图9(b)示出了仅通过添加50倍摩尔过量的cd89(scfv)-snap而没有对照物h22(scfv)-snap来阻断通过tnfα刺激的hl-60细胞(1000u/ml)中的10nm的cd89(scfv)-eta’诱导的凋亡。图9(c)示出了在37℃和4℃下用50nmcd89(scfv)-snap-bg-
图10示出了使用所述cfp,cd89(scfv)靶向有效的杀死cd89+原发性白血病细胞。将衍生自白血病患者外周血的初级单核细胞用200nm融合蛋白在37℃下孵育13小时。使用膜联蛋白(annexin)v/pi着色测量cd89(scfv)-eta’(a)、cd89(scfv)-angggrr(b)、cd89(scfv)-maptau(c)和gbr201k-cd89(scfv)(d)的促凋亡作用。通过计数膜联蛋白(annexin)v/pi阴性细胞来计算活细胞数量,并将未处理的对照标准化至100%。数据表示双重测定的标准偏差的平均值。统计学显著性通过双尾不配对的学生t检验确定:(*):p<0.05,**:p<0.01,(***):p<0.001。
图11和图12示出了本公开的序列实施例。
具体实施方式
本公开提供了有效的新型免疫治疗剂,特别是适合于cd89特异性靶向和杀死/破坏人类癌细胞的复合物。
根据本公开内容,第一次示出了fcɑri(cd89)作为由不同癌细胞如骨髓白血病细胞群所表达的新靶标多肽免疫毒素靶抗原用于免疫毒素(it)或人溶细胞融合蛋白(hcfp)的治疗潜力。本公开的一些实施例属于分离的重组融合蛋白,其包含抗人cd89单链片段变量(scfv)和表征良好的有效假单胞菌外毒素a(eta’)的截短型。
这些新颖的治疗方法实现在0.2-3nm范围内的体外ec50值,其取决于所施用的刺激,即干扰素γ(ifnγ)或肿瘤坏死因子α(tnfα)。
考察了剂量依赖性的细胞凋亡介导的细胞毒性,其导致在72小时内消除多达90%的靶细胞。这些发现也通过使用例如来自外周血样品的白血病原生细胞的间接体内疗法得到了证实。
可以在体外实现白血病细胞系的cd89特异性靶向,并且白血病原生细胞的有效消除支持cd89-eta’作为有效的新型免疫治疗剂的潜力。
因此,在第一方面,本公开内容涉及适于靶向和杀死人靶细胞,特别是人体癌细胞的选定的和特异性的复合物,其包含具有结合结构的第一多肽和具有毒性效应结构域的第二多肽,所述结合结构用于将所述复合物与存在于人靶细胞的细胞表面的细胞表面受体cd89相结合。
本公开的有利实施例涉及适于杀死靶细胞如人体癌细胞,例如诱导细胞凋亡的免疫毒素(it)和重组人溶细胞融合蛋白(hcfp),其包含靶细胞特异性结合组分(结合结构)和毒性效应结构域,其中所述结合组分包含其具有结合到存在于所述靶细胞表面的细胞表面受体cd89上的抗原结合位点的抗体或抗体片段。
在有利的实施例中,将复合物或至少毒性效应结构域转移到靶细胞中。因此,在与cd89蛋白结合后,毒性效应结构域优选的可转移到靶细胞中。
术语“多肽”、“肽”或“蛋白质(protein)”在本文中可互换使用,表示通过相邻残基的α-氨基和羧基之间的肽键而彼此连接的线性系列氨基酸残基。氨基酸残基优选为天然的“l”异构体形式。然而,可以将“d”异构体形式的残基取代为任何l-氨基酸残基,只要多肽保留所需的功能性质。此外,除20个“标准”氨基酸外,所述氨基酸还包含改进的和不常用的氨基酸。
如上所述,本公开涉及分离/纯化的复合物,特别是分离的重组融合蛋白,其包含至少一种组分a(结合结构)和至少一种组分b(毒性效应结构域),其特征在于组分a具有存在于靶细胞表面上的细胞表面受体cd89的结合活性,组分b是具有细胞毒性和/或细胞溶解活性的化合物。
术语“重组融合蛋白”和“融合蛋白”在本文中可互换使用,表示例如通过重组技术产生的蛋白质,其包含来自异源的如不同蛋白质或不同生物体的片段即氨基酸序列。这些片段通过肽键直接或间接彼此连接。通过间接连接是指在形成融合蛋白的片段之间插入中间氨基酸序列,例如肽接头。重组融合蛋白由核苷酸序列编码,其通过遗传地连接衍生自一个基因的不同区域的核苷酸序列和/或通过连接衍生自两个或更多个单独基因的核苷酸序列获得。
此外,编码核苷酸序列可以在体外合成,例如通过从数字遗传序列的寡核苷酸合成和随后的所得片段进行退火,而不需要初始模板dna样品。所需的蛋白质序列可以“反向翻译”,例如使用适当的软件工具。由于普遍遗传密码的简并性,开放阅读框内的同义密码子(即重组蛋白编码区)可以以不同的方式进行交换,例如:去除顺式作用的不稳定性元素(例如,auuua),去除、引入或改进二级和三级mrna结构(例如假核素,茎环.....),避免可能引发转录后基因沉默(pgts)的自身互补区域,改变整体at:gc内容,或调整密码子使用到表达式主机。可以手动或通过使用适当的软件工具或通过组合来设计这些更改。
如本领域已知的,包含对存在于cd89表达靶细胞表面的细胞表面受体cd89具有结合活性的第一多肽和包含毒性效应结构域的第二多肽的复合物可以是使用重组dna方法并在合适宿主细胞中的表达来制备的重组产物(参见例如(sambrook,j.&russell,d.,molecularcloning:alaboratorymanual,2001,3rded))。
在有利的实施例中,分离本公开的复合物,特别是重组融合蛋白。当术语“分离”与核酸或蛋白质关联使用时,是指从与其天然来源通常相关的至少一种污染物(分别为核酸或蛋白质)鉴定和分离的核酸序列或蛋白质。分离的核酸或蛋白质以与天然的核酸或蛋白质不同的形式或设置存在。相比之下,非分离的核酸或蛋白质以天然存在的状态被发现。
根据本公开,包含结合结构(组分a)的第一多肽和包含毒性效应结构域(组分b)的第二多肽优选在复合物中彼此连接。“连接”是指两个或多个分子之间的非共价键或共价键。连接可能是直接或间接的。当两个分子通过连接分子(接头)连接时,两个分子间接连接。当没有连接它们的中间分子时,两个分子是直接连接的。如上所述,分离的蛋白质结构域直接或间接地彼此连接,优选通过肽键或二硫键连接。间接共价连接的一个实例是在形成融合蛋白的片段之间并列插入中间氨基酸序列,例如肽接头。
在一些实施例中,组分a和b彼此直接连接。在其它实施例中,组分通过接头彼此间接连接,其中在一些实例中,连接体是具有小于或等于20个氨基酸,特别是2-6个氨基酸的多肽。
本文中使用的术语“结合结构”包括对细胞表面受体cd89,特别是cd89(seqidno.6)细胞外部分具有结合活性的多肽。例如,多肽包含细胞靶向部分(moiety),其是仅通过选定的细胞群例如表达胞受体cd89的细胞结合和/或内化的部分。这样的细胞靶向部分可以例如包含结合cd89的抗体、生长因子、激素、细胞因子、适体或亲和力多聚体。包含在配体中的结合部分的例子是亲和性物质或亲和性物质的亲和部分,其全部选自抗体、抗体片段、受体配体、酶底物、凝集素、细胞因子、淋巴因子、白细胞介素、血管生成或毒力因子、过敏原、肽过敏原、重组变应原、过敏原特异性抗体、自身免疫引发结构、组织排斥诱导结构、免疫球蛋白恒定区及其衍生物、突变体或其组合。特别地,靶细胞特异性结合组分特异性结合cd89。
在有利的实施例中,结合结构是选自由单克隆抗体fab、scfv、单结构域或其片段、双scfv、fab2、fab3、微体、双体、三体、四抗体和tandab组成的组中的抗体或抗体片断。
如果抗体优先于其它抗原结合特定的抗原,该抗体特异性地特异于特定的抗原。特别地,抗体可能不显示与该特定抗原以外的分子的任何显著的结合,并且特异性可以通过靶抗原和其它非靶抗原的亲和力的差异来定义。抗体也可以特异于特定的抗原表位,其可以被许多抗原携带,在这种情况下,抗体能够结合携带该表位的各种抗原。例如,当抗体和抗原的二聚体复合物的解离常数为1μm、优选为100nm、最优选为1nm或更低时,可能存在特异性结合。
如本文中,“抗体”是指由基本上由免疫球蛋白基因或免疫球蛋白基因片段编码的一种或多种多肽组成的蛋白质。公认的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及多种免疫球蛋白可变区基因。轻链分为κ或λ。重链分为γ、μ、α、δ或ε,其又反过来分别限定免疫球蛋白类别,igg、igm、iga、igd和ige。
已知典型的免疫球蛋白(抗体)结构单元包含四聚体。每个四聚体由两对相同的多肽链组成,每对具有一个“轻”(约25kda)链和一个“重”链(约50-70kda)。每个链的n末端限定了主要负责抗原识别的约100至110个或更多个氨基酸的可变区。术语可变轻链(vl)和可变重链(vh)分别指这些轻链和重链。
抗体作为完整的免疫球蛋白存在,或作为通过用各种肽酶消化产生的许多表征良好的片段存在。因此,例如,胃蛋白酶在铰链区域中消化二硫键以下的抗体以产生f(ab)’2,其是fab的二聚体,本身是通过二硫键连接到v.sub.h-c.sub的轻链。f(ab)’2可以在温和条件下减少,以破坏铰链区中的二硫键,从而将(fab’)2二聚体转化为两个fab’单体。fab’单体基本上是具有部分铰链区的fab(paul,we.,fundamentalimmunology,1993,3rded)。虽然各种抗体片段根据完整抗体的消化来定义,但是本领域技术人员理解,这种fab’片段可以通过化学方法或通过利用重组dna技术从头合成。因此,本文中的术语“抗体”还包括通过所有抗体修饰产生或通过使用重组dna技术从头合成的抗体片段。优选的抗体包括单链抗体(作为单个多肽链存在的抗体),更优选单链fv抗体(scfv),其中可变重链和可变轻链连接在一起(直接或通过肽接头)以形成连续多肽。单链fv抗体是共价连接的vh-vl异二聚体,其可以用包括直接连接或通过肽编码连接头连接的vh-和vl-编码序列的核酸来表达(huston,js.,etal.,procnatlacadsciusa,1988,85:p.5879-83)。尽管vh和vl作为单个多肽链连接,vh和vl结构域非共价键合。
抗体或抗体片段中的“抗原结合位点”或“结合部分”是指参与抗原结合的免疫球蛋白分子的部分。抗原结合位点由重(“h”)和轻(“l”)链的n端可变(“v”)区的氨基酸残基形成。在重链和轻链的v区内的三个高度发散的延伸区被称为“高变区”,其插入被称为“框架区”或“fr”的更保守的侧翼延伸区之间。因此,术语“fr”是指在免疫球蛋白中的高变区之间天然存在或在邻近的免疫球蛋白中的高变区的氨基酸序列。在抗体分子中,轻链的三个高变区和重链的三个高变区在三维空间中相对于彼此设置以形成抗原结合“表面”。该表面介导靶抗原的识别和结合。每个重链和轻链的三个高变区被称为“互补决定区”或“cdr”,其特性在kabat等人的《免疫学的蛋白序列》,第四版,美国卫生和人类服务部,公共卫生服务局,马里兰州,贝塞斯达(1987)中进行了描述。
因此,术语抗体包括但不限于多克隆抗体、单克隆抗体、单链抗体、人源化抗体、微抗体、双抗体、三体抗体以及抗体片段,例如fab’,fab,f(ab’)2、单结构域抗体。在有利的实施例中,抗体是人抗体,抗体片段是人抗体片段。
因此,如上所述,结合结构优选为选自由单克隆抗体fab、scfv、单结构域或其片段、双scfv、fab2、fab3、微体、双体、三体、四抗体和tandab组成的组中的抗体或抗体片断,其能够结合存在于所述人靶细胞的细胞表面的细胞表面受体cd89。
靶向部分的结合活性可以使用在适当阶段中的所述人靶细胞和适于所述分析的适当检测抗体通过流式细胞术辅助测定来检验。
在有利的实施例中,本公开的复合物包含cd89特异性单链可变片段(scfv),其作为将复合物与存在于人靶细胞的细胞表面上的细胞表面受体cd89结合的结合结构。
在本文中,术语“单链抗体片段”(scfv)是指通过测定结合抗体的结合结构域(重链和轻链)并提供连接部分制备的抗体,其允许保留结合功能。这本质上形成了一个根本上缩略的抗体,只具有结合抗原所必需的那部分可变结构域。单链抗体的测定和构建在ladner等的第4946778号的美国专利中进行了描述。
在有利的实施例中,结合结构是人或人源化抗体或抗体片段。在本文中,术语“人抗体”或“人抗体片段”是指免疫球蛋白或免疫球蛋白片段的构架区源自人免疫球蛋白序列。在有利的实施例中,结合结构是人或人源化抗体或抗体片段。
用语“特异性结合cd89”是指结合反应,其在蛋白质和其他生物制剂的异质群存在下决定了cd89蛋白的存在。因此,在指定的免疫测定条件下,指定的抗体或抗体片段与cd89结合,并且不以显著的量与样品中存在的其它蛋白质结合。在这种条件下与蛋白质的特异性结合可能需要根据其对cd89的特异性选择的抗体或抗体片段。
靶向部分的结合活性可以使用在适当阶段中的所述人靶细胞和适于所述分析的适当检测抗体通过流式细胞术辅助测定来检验。
在本文中,术语“cd89”是指人表面fcα-受体(fcαr,cd89)。在正常生理条件下,fcα受体存在于单核细胞、嗜中性粒细胞、巨噬细胞和嗜酸性粒细胞上。其生物学功能是与iga调理靶标相互作用,引发几种免疫防御过程,例如,吞噬作用、抗体依赖性细胞介导的细胞毒性和炎症介质的刺激(morton,hc.&brandtzaeg,p..,archimmunoltherexp12001;49:217-29)。在许多人组织中,大多数cd89+细胞是嗜中性粒细胞和单核细胞/巨噬细胞。此外,尽管血液中的单核细胞表达相对较高水平的cd89,但大多数组织巨噬细胞(特别是位于固有层中的那些)往往不能在表面上表达cd89,并且cd14平行下调(hamre,r.,etal.,scandjimmunol,2003,57:p.506-16)。这表明cd89的丰度取决于骨髓细胞的分化阶段。在骨髓前体细胞成熟期间cd89下调的生物相关性是未知的。
另一方面,血液中骨髓细胞异常数量的存在表示几种骨髓性血液恶性肿瘤,其中aml和cml是最常见的(horner,mjrl,etal.,nationalcancerinstitute,2009)。使用法国-美国-英国(fab)系统将不同形式的骨髓性白血病分类为八个亚型(m0-m7),世界卫生组织(who)使用相似的标准(sander,ca.,etal.,clinlymphoma2001,2:p86-100)。一个标准的标记面板用于详细的诊断和分类,包括不同程度的存在于aml亚型m0-m5上的fcγri(cd64)(dunphy,ch.andtangw.,archivesofpathology&laboratorymedicine,2007,131:p.748-54)。到目前为止,没有证据表明其他fc受体可以用作aml或其他形式的骨髓性白血病的诊断抗原或治疗靶标。
在本文中,表述“杀死人靶细胞”应理解为暗示抑制蛋白质合成或诱导细胞凋亡导致了这些细胞的消除或死亡;可以使用各种分子机制;例如,可以使用改变细胞功能的机制,改变细胞的基因表达模式或者直接影响细胞活性的机制。
在本文中,“杀死人靶细胞”还可以包括抑制细胞生长(例如,参照细胞),旨在包括与本公开的抗cd89复合物不接触的相同细胞的生长相比,与本公开的抗cd89复合物接触时任何可测量的细胞生长的降低,例如,抑制至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或100%的细胞生长。
在本文中,表述“cd89表达细胞”是指具有cd89作为表面抗原的细胞。可以设想细胞表达cd89的任何类型用于本公开的细胞毒性/细胞溶解复合物的治疗。
“靶细胞”是指特征在于靶分子cd89的表达或过表达的细胞或细胞型,其例如是一些肿瘤细胞如包括骨髓性白血病细胞的白血病细胞的特征。cd89(fcɑr)最初在几种人类吞噬细胞的表面鉴定,包括嗜中性粒细胞、单核细胞和巨噬细胞。cd89表达免疫细胞在免疫系统中具有保护功能,但也参与不同疾病的发病机制。例如,嗜中性粒细胞在多种自身免疫性疾病(例如系统性红斑狼疮)、炎性疾病、中性粒细胞胞外捕网(neutrophilextracellulartraps,net)化和囊性纤维化中起了作用。
“靶细胞”意指可以由本公开的复合物或多肽靶向的受试者(例如,人或动物)中的任何不需要的细胞。在一个实施例中,靶细胞是表达或过表达cd89的细胞。在另一实施例中,靶细胞包括肿瘤细胞。可以被靶向的肿瘤细胞是任何类型的癌症的肿瘤细胞,包括乳腺、卵巢、前列腺、睾丸、肺、结肠、直肠、胰腺、肝、中枢神经系统、肾脏、头部、颈部、骨头、血液和淋巴系统的癌症。除了肿瘤细胞之外,效应细胞可以被靶向产生自身抗体的淋巴细胞,用于治疗自身免疫疾病,或靶向产生ige的淋巴细胞,用于治疗过敏。靶标也可以是微生物(细菌或病毒)或可溶性抗原(如类风湿因子或其他自身抗体和毒素)。微生物旨在包括病原体,例如病毒、细菌、真菌、原生动物。
因此,本公开的复合物可用于不同的适应症,例如治疗恶性疾病,例如急性骨髓性白血病、过敏、慢性炎性疾病、自身免疫性疾病,包括移植物抗宿主,巨噬细胞活化综合征,关节炎,类风湿性关节炎,青少年关节炎和消除骨髓来源的抑制细胞。特别地,本公开的复合物可用于治疗白血病、嗜中性白细胞增多症、急性和慢性嗜中性白血病(cnl)、慢性粒细胞白血病(cml)。
因此,本公开的复合物适于靶向和杀死人cd89表达细胞(人靶细胞),所述人cd89表达细胞包含具有将复合物和存在于人靶细胞的细胞表面的细胞表面受体cd89结合的结合结构第一多肽和含有毒性效应结构域的第二多肽。
可以在以下测定中的一个或两个中,测试化合物或物质的毒性作用:基于xtt的比色细胞活性测定(roehm,nw.,etal.,jimmunolmethods,1991,142:p.257-)和膜联蛋白(annexin)v/pi凋亡测定(vermes,i.,etal.,jimmunolmethods1995;184:39-51)。
包含在复合物中的“毒性效应物结构域”,这里也称为“靶细胞杀伤结构域”,是在靶细胞中具有毒性活性的肽或多肽,可以选自由人蛋白酶、人丝氨酸蛋白酶例如颗粒酶b、细菌来源的毒素蛋白如铜绿假单胞菌外毒素a、人水解酶如血管生成素、人细胞骨架相关的蛋白如微管相关蛋白tau、光敏剂或植物来源的毒素如蓖麻毒素a组成的组,或其变体或功能片段。
进一步的实施例包括adp核糖基化酶,如假单胞菌外毒素a、白喉、霍乱弧菌、百日咳杆菌和肉毒杆菌毒素,以及核糖体灭活蛋白,如二唾液酸(diathin)、皂草素、异株泻根毒蛋白(bryodin)、白树毒素、蓖麻毒蛋白、相思豆毒素或限释片。此外,核糖核酸酶(phosphodiesterases)rnaseh、血管生成素、嗜酸性粒细胞衍生的神经毒素(edn)、嗜酸性阳离子蛋白、豹蛙酶和牛蛙血凝素。另外的例子是前体药物活化酶,如卡培西林、葡萄糖氧化酶、羧肽酶、碱性磷酸酶、胞嘧啶葡萄糖苷酶、β-糖苷酶、β-葡糖醛酸酶、β-内酰胺酶、硝基还原酶、胸腺嘧啶蛋白酶或嘌呤核苷磷酸化酶。此外还有,组织蛋白酶、颗粒酶和组合以及前述蛋白质家族的可能变种。优选的实施例是经验证的毒素如蓖麻毒素a、α-丝氨酸(凝集素家族)、二倍体毒素和假单胞菌外毒素a,因为这些毒素是几项临床研究的对象,并且其功效被很好地记录。在有利的实施例中,本公开的复合物包含选自作为毒性效应结构域的由铜绿假单胞菌外毒素a(eta)、颗粒酶b或其包含取代物r201k(ep2758527中公开的gbr201k)的变体、血管生成素或其包含取代物ggrr(angggrr)的变体、和微管相关蛋白tau(maptau)组成的组的第二多肽。
在一些有利的实施例中,本公开的复合物是如上所述的免疫毒素(it)或人溶细胞融合蛋白(hcfp)。
在本文中,术语“免疫毒素”是指其中细胞结合单克隆抗体或其片段化学偶联或遗传融合至细菌(例如eta)或基于植物蛋白质毒素(例如rt)的嵌合分子。免疫毒素本身以及它们的结构是本领域技术人员公知的。
在本文中,术语“人溶细胞融合蛋白”或“hcfp”是指完全人免疫毒素,其中细胞结合人配体或其片段化学偶联或遗传融合于人类酶(例如颗粒酶b等)、抑制蛋白(例如map)或其至少部分序列,所述部分序列保持了与微管的结合功能。
在一些进一步有利的实施例中,本公开的复合物是包含cd89特异性单链可变片段(scfv)和作为毒素效应结构域的铜绿假单胞菌外毒素a(eta)的免疫毒素,特别是作为重组融合蛋白。
根据本公开的分离的复合物和多肽的特征在于特异性氨基酸并由特异性核酸序列编码。应当理解,序列包含通过重组或合成方法产生的类似物和变体,其中通过取代、插入、添加或删除重组多肽中的氨基酸残基中的一个或多个来修饰这些多肽序列,这样的本公开的复合物仍然适于结合和杀死人类癌细胞。取代物优选是“保守的”。取代物优选是密码子使用中的沉默取代物,其不会引起氨基酸序列的任何变化,但可以引入以增强蛋白质的表达。
在一些有利的实施例中,本公开的复合物包含用于将复合物与细胞表面受体cd89结合的结合结构,seqidno:1的氨基酸序列或其同源多肽或其片段,所述同源多肽具有与seqidno:1的氨基酸序列至少85%、优选90%、更优选95%相同的氨基酸,其通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基产生。
在一些有利的实施例中,本公开的复合物包含seqidno:2的氨基酸序列或其同源多肽或其片段,其通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基产生。
在一些有利的实施例中,本公开的复合物包含seqidno:3的氨基酸序列或其同源多肽或其片段,其通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基产生。
在一些有利的实施例中,本公开的复合物包含seqidno:4的氨基酸序列或其同源多肽或其片段,其通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基产生。
在一些有利的实施例中,本公开的复合物包含seqidno:5的氨基酸序列或其同源多肽或其片段,其通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基产生。
此外,本公开的复合物包含选自由seqidno:2、seqidno:3、seqidno:4和seqidno:5组成的组中的氨基酸序列,或其同源多肽、变体或突变或其片段,所述同源多肽、变体或突变具有与seqidno:2、seqidno:3、seqidno:4和seqidno:5的氨基酸序列至少85%、优选90%、更优选95%相同的氨基酸,通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基产生。
相对于两个氨基酸或多核苷酸序列,“百分比序列同一性”是指当序列最佳对齐时两个序列的残基的百分比相同。因此,80%的氨基酸序列同一性意味着两个最佳对齐的多肽序列中的80%的氨基酸序列是相同的。百分比同一性例如可以通过直接比较两个分子之间的序列信息,通过对齐序列,计数两个对齐序列之间的确切匹配数,除以较短序列的长度,并将结果乘以100来确定。易于使用的计算机程序可用于帮助分析,如华盛顿特区国家生物医学研究基金会,align14,其适应smith和waterman的本地同源性算法进行肽分析。可在威斯康辛序列分析软件包版本8(可从遗传学计算机组,麦迪逊,wi获得)中获得用于确定核苷酸序列同一性的程序,例如bestfit、fasta和gap程序,其也依赖于smith和waterman算法。这些程序已经与制造商推荐的默认参数5一起使用,并且在上述威斯康辛序列分析包中被描述。适用于确定序列相似性的算法的一个例子是之前描述的blast算法。用于进行blast分析的软件可通过国家生物技术信息中心(http://www.ncbi.nlm.nih.gov/)公开获得。同样,用于确定百分比同源性的计算机程序也很容易获得。
术语“突变”是指单个或多个核苷酸三联体的取代或替换,一个或多个密码子的插入或缺失,不同基因的同源或异源重组,编码序列的任一端的附加编码序列的融合,或其他编码序列的插入,或这些方法的任何组合,其导致多核酸序列编码所需蛋白质。
因此,术语“突变”也指由通过一个或多个上述变化修饰的多核酸序列编码的多肽序列的所有变化。
术语“变体”是指氨基酸序列已被修饰,但保留相同的功能特征,特别是对人癌细胞的结合和破坏作用。变体具有与母体氨基酸序列至少70%或优选至少80%、85%、90%、95%、97%或99%的序列同一性。
术语“变体”还指具有通过功能侧基团的反应化学衍生的一个或多个残基的多肽。这样的衍生分子包含例如那些其中游离氨基已被衍生化形成胺盐酸盐、对甲苯磺酰基、苄氧羰基、叔丁氧基羰基、氯乙酰基或甲酰基的分子。游离羧基可被衍生化形成盐、甲基和乙酯或其它类型的酯或酰肼。游离羟基可被衍生化以形成o-酰基或o-烷基衍生物。组氨酸的咪唑氮可被衍生化以形成n-im-苄基组氨酸。还包括作为衍生物的那些肽,其含有二十个标准氨基酸的一个或多个天然存在的氨基酸衍生物。例如:4-羟基脯氨酸可以代替脯氨酸,5-羟赖氨酸可以代替赖氨酸,3甲基组氨酸可以代替组氨酸,高丝氨酸可代替丝氨酸,鸟氨酸也可以代替赖氨酸。
上述融合蛋白还可以在单链序列之前的n-末端上包括:用于周质转运的pelb前导序列,用于亲和纯化的his10-标签和用于纯化后缺失标签的肠激酶切割位点。
为了在重组表达系统中表达本公开的融合蛋白,可将dna编码融合蛋白或其一部分插入表达载体中,使得该基因与转录和翻译控制序列可操作地连接。在本文中,术语“可操作地连接”是指将蛋白质基因连接到载体中,使得载体内的转录和翻译控制序列实现调节蛋白质基因的转录和翻译的期望功能。选择表达载体和表达控制序列与所用表达宿主细胞相容。分离的蛋白质结构域序列通常插入相同的表达载体中。通过标准方法将蛋白质基因插入到表达载体中。另外,重组表达载体可以编码促进新生多肽链共翻译转移到内质网(er)中的信号肽。折叠的多肽(本公开的重组融合蛋白)可以从宿主细胞分泌或者可以保留在宿主细胞内。细胞内保留或靶向可以通过使用合适的靶向肽(例如c末端kdel标签用于er检索)来实现。
通常,本领域技术人员能够很好地构建重组基因表达的载体和设计方案。更多细节参见例如molecularcloning:alaboratorymanual:2ndedition,sambrooketal.,1989,coldspringharborlaboratorypress(或此后的版本)andcurrentprotocolsinmolecularbiology,secondedition,ausubeletal.eds.,johnwiley&sons,1992,其通过引用并入本文。
此外,本公开涉及编码这种融合蛋白的核酸分子或核酸,以及包含核酸分子的载体和包含编码所述融合蛋白的核酸分子的宿主细胞或包含所述载体的载体。本公开还涉及在重组表达系统中制造所述重组融合蛋白的方法。
术语“载体”包括能够转运与其连接的另一个核酸的核酸分子。一种载体是“质粒”,其是指可连接另外的dna区段的环状双链dna环。另一种类型的载体是病毒载体,其中另外的dna区段可以连接到病毒基因组中。某些载体能够在引入它们的宿主细胞中自主复制(例如具有细菌复制起点和附加型哺乳动物载体的细菌载体)。其它载体(例如非附加型哺乳动物载体)可以在引入宿主细胞后整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够指导基因的表达,这些载体可操作地连接基因表达。这样的载体在本文中称为“重组表达系统”或“重组表达载体”(或简称为“表达载体”)。通常,在重组dna技术中使用的表达载体通常是质粒的形式。在本说明书中,“质粒”和“载体”可以互换使用,因为质粒是最常用的载体形式。然而,本公开旨在包括其它形式的表达载体,例如具有相同功能的病毒载体(例如复制缺陷型逆转录病毒、腺病毒和腺相关病毒)。
本公开还涉及具有包含本公开的重组融合蛋白的载体的宿主细胞。短语“重组宿主细胞”(或简称“宿主细胞”)包括其中已导入重组表达载体的细胞。应当理解,这些术语旨在不仅指特定的受试细胞,而是指这种细胞的后代。由于突变或环境影响,因此可能产生后代的某些修饰,所以这种后代实际上可能不与亲本细胞相同,但是仍然包括在本文所用的术语“宿主细胞”的范围内。
宿主细胞包括单个宿主细胞的后代,并且由于自然、意外或故意的突变和/或变化,后代可能不一定与原始亲本细胞完全相同(形态学或总dna补充)。宿主细胞包括由本发明的重组载体或多核苷酸在体内或体外转染或感染的细胞。包含本公开的重组载体的宿主细胞也可以称为“重组宿主细胞”。
术语“宿主细胞”是指可在纯化本公开的重组蛋白质的方法中使用的细胞。这种宿主细胞携带具有重要意义的蛋白质(poi)。宿主细胞也可以称为蛋白质表达细胞。根据本发明,宿主细胞可以是但不限于原核细胞、真核细胞、古细菌、细菌细胞、昆虫细胞、酵母、哺乳动物细胞和/或植物细胞。设想作为宿主细胞的细菌可以是革兰氏阴性或革兰氏阳性,例如:大肠杆菌、欧文氏菌属、克雷伯氏菌属、乳杆菌属或枯草芽孢杆菌。典型的酵母宿主细胞选自酿酒酵母、多形汉逊酵母和巴斯德毕赤酵母。在一些有利的实施例中,宿主细胞是hek293t细胞。
本公开的复合物可以与“药学上可接受的载体”一起使用,其包括本领域普通技术人员已知的任何和所有溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如抗菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、凝胶、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料、类似物质及其组合。
因此,在本文中,“药学上可接受的载体”包括生理上相容的任何和所有溶剂、分散介质、包衣、抗细菌和抗真菌剂,等渗和吸收延迟剂等。优选地,载体适合于静脉内、肌肉内、皮下、肠外、脊髓或表皮给药(例如通过注射或输液)。取决于给药途径、活性化合物即抗体、双特异性和多特异性分子,可以涂覆在材料中以保护化合物免受可能使化合物失活的酸和其它天然条件的影响。
本公开的复合物可以与“药学上可接受的盐”一起使用,其包括任何保留母体化合物的所需生物活性并且不会产生任何不期望的毒理作用的盐(参见例如berge,s.m.,etal.(1977)j.pharm.sci.66:1-19)。这些盐的实例包括酸加成盐和碱加成盐。酸加成盐包括那些衍生自无毒无机酸的如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸、磷等,以及衍生自无毒有机酸的,如脂族单羧酸和二羧酸、苯基取代的链烷酸酸、羟基链烷酸、芳族酸、脂族和芳族磺酸等。碱加成盐包括那些衍生自碱土金属的如钠、钾、镁、钙等,以及衍生自无毒有机胺的如n,n’-二苄基乙二胺、n-甲基葡糖胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、普鲁卡因等。
施用于受试者的本公开的复合物或组合物的实际剂量可以通过物理和生理因素如体重、严重程度、待治疗的疾病的类型、先前或同时的治疗干预、患者的特发性和给药途径来决定。在任何情况下,负责给药的实践者将决定组合物中活性成分的浓度和个体受试者的适当剂量。
本公开的复合组合物可以通过本领域已知的多种方法来施用。本领域技术人员可以理解,给药途径和/或模式将根据期望的结果而不同。活性化合物可以用保护化合物免受快速释放的载体制备,例如控制释放制剂,包括植入物、透皮贴剂和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备这些制剂的许多方法是已授权的专利或者本领域技术人员通常已知的。参见例如sustainedandcontrolledreleasedrugdeliverysystems,j.r.robinson,ed.,marceldekker,inc.,newyork,1978。
为了通过某些给药途径施用本公开的复合物或组合物,可能需要对复合化合物或共同给药化合涂覆物一种材料以防止其失活。例如,所述化合物可在合适的载体如脂质体或稀释剂中,施用给试对象。药学上可接受的稀释剂包括盐水和水缓冲溶液。脂质体包括水包油包水cgf乳剂以及常规脂质体(strejanetal.(1984)jneuroimmunol.,7:27)。
药学上可接受的载体包括无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。使用这种介质和试剂用于药物活性物质是本领域已知的。除了当前的任何常规介质或试剂与活性化合物不相容之外,其在本发明的药物组合物中的用途是可预期的。补充的活性化合物也可以并入组合物中。
治疗组合物通常在制造和储存条件下必须是无菌和稳定的。该组合物可以配制成适合于高阻力浓度的溶液、微乳液、脂质体或其它有序结构。载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)的溶剂或分散介质及其合适的混合物。例如,使用诸如卵磷脂的涂层,在分散体的情况下维持所需的粒度和通过使用表面活性剂,可以维持合适的流动性。在许多情况下,优选在组合物中包括等渗剂,例如糖、多元醇如甘露糖醇、山梨糖醇或氯化钠。可以通过在组合物中包含延迟吸收的试剂例如单硬脂酸盐和明胶来实现可注射组合物的延长吸收。
通过将在适当的溶剂中的所需量的活性化合物与上述所列成分的一种或其组合进行组合,并根据需要进行消毒微量过滤来制备无菌可注射溶液。通常,通过将活性化合物掺入含有碱性分散介质的无菌载体和来自上面列举的所需的其它成分来制备分散体。在用于制备无菌注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥(冻干),其从预先无菌过滤的溶液中产生活性成分加上任何另外的所需成分的粉末。
调整剂量方案以提供最佳期望的反应(例如治疗反应)。例如,可以进行单次推注,可以随着时间施用几个分开的剂量,或者可以根据表现的治疗情况的紧急程度按比例减少或增加剂量。为了方便给药和剂量均匀,以剂量单位形式配制肠外组合物是特别有利的。本文所用的剂量单位形式是指用于治疗对象的适合作为单位剂量的物理上离散的单位;每个单位含有预定量的活性化合物,其经过计算能产生与所需药物载体相关联的所需治疗效果。本发明的剂量单位形式的说明书由下述条件决定并直接依赖于下述条件:(a)活性化合物的独特特征和要实现的特定治疗效果,(b)复合这种治疗个体敏感性的活性化合物的技术中的固有限制。药学上可接受的抗氧化剂的实例包括:(1)水溶性抗氧化剂,如抗坏血酸、半胱氨酸盐酸盐、硫酸氢钠、偏亚硫酸氢钠、亚硫酸钠等;(2)油溶性抗氧化剂,如抗坏血酸棕榈酸酯、丁基化羟基苯甲醚(bha)、丁基化羟基甲苯(bht)、卵磷脂、没食子酸丙酯、α-生育酚等;和(3)金属螯合剂,如柠檬酸、乙二胺四乙酸(edta)、山梨糖醇、酒石酸、磷酸等。
可以改变本公开的药物组合物中活性成分的实际剂量水平,以获得其对于特定患者、组合物和给药方式能有效地达到期望的治疗反应的一定量的活性成分,而对患者没有毒性。所选择的剂量水平将取决于各种药代动力学因素,包括所用本发明的具体组合物的活性、或其酯、盐或酰胺、给药途径、施用时间、使用的具体化合物的排泄速率、治疗的持续时间、与所使用的具体组合物组合使用的其它药物、化合物和/或材料、所治疗的患者的年龄、性别、体重、条件、一般健康状况和先前病史、以及如医学领域众所周知的因素。
本领域普通技术人员的医师或兽医可以容易地确定和开出所需药物组合物的有效量。例如,医师或兽医可以从低于为达到所需治疗效果而要求的药物组合中使用的本发明化合物的水平的剂量开始,并逐渐增加剂量直到达到所需效果。通常,本发明组合物的合适的日剂量是产生治疗效果的最低剂量的化合物的量。这种有效剂量通常将取决于上述因素。优选的是静脉内、肌内、腹膜内或皮下给药,优选施用在靶的位点附近。如果需要,治疗组合物的有效日剂量可以分两次、三次、四次、五次、六次或更多次分剂量,全天适当间隔单独的施用,可选地以单位剂量形式施用。虽然本发明的化合物可以单独施用,但优选将化合物作为药物制剂(组合物)进行给药。
在有利的实施例中,本公开的重组人细胞溶解融合蛋白用于治疗恶性疾病、过敏、自身免疫疾病、组织排斥反应或慢性炎症反应。
本公开的其它实施例涉及适用于检测cd89的多肽,其中所述多肽包含seqidno:1的氨基酸序列,或具有与氨基酸序列seqidno.1至少85%、优选90%、更优选95%相同的氨基酸序列的同源多肽、变体或突变体,其通过重组或合成方法取代、插入、添加或缺失一个或多个氨基酸残基或其片段产生。
在另外的实施例中,适用于检测cd89的所述多肽的同源多肽、变体或突变体显示了与母体氨基酸序列至少70%或优选至少80%、85%、90%、95%、97%或99%的序列同一性。
在一些实例中,多肽与可检测的标记如亲和标记偶联。在本文中,术语“亲和标记”是指物质、分子或生物分子,其通过例如表达的方式与适合于检测cd89的多肽偶联以形成“融合标签”或“亲和标签”,并且其还能够特异性结合荧光标记。特别地,融合标签是融合标签蛋白。融合标签蛋白的实例是snap标签,clip标签,lumio标签或halo标签。
在一些实施例中,可检测的cd89-蛋白呈递在人靶细胞或其片段如破坏的靶细胞的细胞膜的部分上。
在另外的实施例中,本公开涉及用于检测样品中包含的cd89的方法,包括:
(a)将样品与本公开所诉的适合于检测cd89的多肽接触并且与将融合标签与所述多肽特异性结合的融合标签特异性荧光团接触;和
(b)通过与融合标签特异性荧光团相关联的荧光信号检测样品中cd89的存在。
在本文中,术语“荧光标记”、“荧光团”、“染料”和“荧光分子”在本发明中可以具有相同或相似的含义,并且可在整个本发明中互换。例如,术语“荧光团”、“荧光染料”或“发色团”如本文中所用的是指在光激发时可以重新发光的荧光化学化合物。荧光团通常可以包含几个组合的芳族基团,或具有几个π键的平面或环状分子。
荧光团有时可以,作为流体中的示踪剂、作为用于染色某些结构的染料、作为酶的底物、或作为探针或指示剂(当其荧光受环境例如极性、离子等影响时)单独使用。但更一般地,荧光团可以共价键合大分子,作为仿射(affine)或生物活性试剂(抗体,肽,核酸等)的标记物(或染料或标签或报告物)。荧光团可以显著地在各种分析方法即荧光成像和光谱学中用来染色组织、细胞或材料。
亲和标签可以是任何能够特异性连接到一个荧光分子作为荧光团(荧光标记)的分子或生物分子。具体地,亲和标签可以是具有自杀性酶活性的蛋白质,也称为自杀酶。自杀酶是其酶活性被特异性突变修饰的蛋白质,允许它们快速、共价和不可逆地结合底物,因为这些酶仅可以各自结合一个荧光分子,并且酶的进一步结合活性被底物的结合阻断。
荧光团或荧光标记可以是任何荧光分子或染料。具体地,荧光团或荧光标记可以是与所使用的荧光检测设备相容的染料。这些染料的一些实例可以在下面看到。所有这些染料作为用于融合标签的荧光底物可以在市场上买到,并且各自共价结合到不同的标签。多数开发的融合标签可以具有配体的许多荧光变化以覆盖大部分的紫外光谱。任何合适的荧光分子或染料可用于本发明。在本发明的优选实施例中,诸如labchip系统(可从caliper获得)的微流系统可以配备635nm激发光源和700nm发射滤光器,当选择在labchip系统上使用的荧光团时,使得在这些波长附近具有激发和发射最大值的染料是理想的选择。任何具有在所需波长附近具有合适的的激发和发射最大值的荧光分子或染料可用于本发明。
在本公开的有利实施例中,本公开中所述的适用于检测cd89的多肽可用于诊断cd89+恶性肿瘤。诊断可以在体内或体外进行。因此,本公开还涉及用于诊断cd89+恶性肿瘤的方法,其包括向患者施用适合于本公开所述的cd89检测的多肽,或者将取自患者的生物样本与本公开中所述的适合于检测cd89的多肽接触。
有利的实施例是指检测样品中cd89或表达cd89的细胞的存在的方法,其包括:在允许形成多肽和cd89的复合物的条件下,使样品与本公开所述的适于检测cd89的多肽接触;并检测复合物的形成。
本公开的另外的实施例涉及在体外或体内检测样品中cd89的存在的方法,例如用于诊断与cd89相关的疾病。在一个实施例中,在允许形成多肽和cd89的复合物的条件下,其通过将待测试样品,可选地和对照样品一起与在本公开中所述的适于检测cd89的多肽接触来实现。然后检测复合物形成(例如使用elisa)。当与测试样品一起使用对照样品时,在两个样品中检测复合物,并且在样品的复合物形成上的任何统计学显著差异表明测试样品中cd89的存在。
提供以下方法和示例仅用于说明,并不旨在以任何方式限制本公开的范围。
方法和实例
应当理解,以下实施例仅用于说明目的,而不应被解释为以任何方式限制本公开。本文引用的所有出版物、专利和专利申请作为整体引用。
对于特异性靶向和杀伤,构建了包含抗人cd89单链片段变量(scfv)和假单胞菌外毒素a(eta’)的复合物(重组融合蛋白)。
此外,通过将cd89特异性scfv与人源作用结构域融合,来产生人溶细胞的融合蛋白;人源作用结构域例如为包含取代r201k(gbr201k,在ep2758527公开)的颗粒酶b变种、血管生成素变异ggrr(angggrr)(cremer,c.,etal.,journalofimmunotherapy,2014)、或微管相关蛋白tau(maptau)。
在以下实施例中表明,fcɑr(cd89)由白血病细胞的子集表达,并且不仅可以用作诊断标记,而且可以用作新的免疫治疗靶。已证明,cd89特异性融合蛋白可以体外消除源自不同aml亚型的骨髓细胞系,以及aml和cmml离体细胞。
描述了来自aml和cmml患者的aml衍生细胞系和原代细胞上cd89的丰度。cd89是针对血液恶性肿瘤的合适的免疫治疗靶,因为在多能干细胞或cd34+造血祖细胞上没有发现它,所以正常fcɑr+免疫效应细胞的体内平衡和治疗干预后造血系统的恢复不受影响。早期治疗骨髓恶性肿瘤的免疫治疗方法包括吉妥单抗(go),其为一种与抑制细胞生长药物卡其霉素化学偶联的人源化cd33特异单克隆抗体(albo,c,etal.haematologica,2004,89(7):p.845-851)。由于其在临床试验中仅表现出有限的效力,2001年go退出了市场。尽管如此,go在最近的临床阶段ii-iii研究中显示出有希望的结果,强调了其作为aml治疗中的取代物的重要性。除了该抗体-药物偶联物(adc)之外,目前正在研究各种重组免疫治疗剂,例如双特异性/三特异性scfv,具有嵌合抗原受体(car)的t细胞,以及免疫毒素。在这里,我们专注于特异于cd89的重组的基于scfv的免疫毒素和人溶细胞融合蛋白的产生和表征。scfv相比于超过全尺寸mab的一个优点是缺乏fc区。因此,scfv显示出较低的免疫原性并且不与fc-受体表达细胞结合,从而避免了快速清除免疫毒素。在过去的十多年,已经开发了几种重组的eta’基免疫毒素,靶向和减少包含cd7+,cd33+,cd64+和cd123+细胞的各种骨髓恶性肿瘤(gasiorowski,re.etal.,brjhaematol,2014,164:p.481-95,monnier,p.,etal.,antibodies,2013,2:p.193-208,schwemmlein,m.,etal.,brjhaematol,2006,133:p.141-151,stein,c,etal.,brjhaematol,2010,148:p.879-889,thorpe,s.j.,etal.,scandjimmunol2003,57:p.85-92,tur,mk.,etal.,cancerres,2003;63:p.8414-9)。此外,文献中已经描述了对消除cd64+靶细胞和骨髓恶性肿瘤的特异性的不同hcfp(schiffer,s.,etal.,intjcancer,2014,135:p.1497-508,hristodorov,d.,etal.,brjcancer,2013,109:p.1570-8,cremer,c,etal.,journalofimmunotherapy,2014)。
本公开第一次分别描述了cd89(scfv)-eta’it的构建以及成功的体外和离体消除来自不同aml亚型和骨髓恶性肿瘤的细胞。
1.cd89(scfv)-融合蛋白的克隆和表达
抗人cd89(scfv)(guettinger,y.,etal.,jimmunol,2010,184:p.1210-1217)的开放阅读框(orf)使用适配的pcr引物用5’sfil和3’notl限制位点封端,并且产物连接到已含有使用sfil和notl位点的eta’序列的pmt载体(berges,etal2014)。将质粒克隆到大肠杆菌菌株dh5α(newenglandbiolabs,uk)中,通过测试消化和测序证实克隆成功。cd89(scfv)-eta’融合蛋白,如前述的h22(scfv)-eta’一样,在大肠杆菌菌株bl21(de3)中表达、纯化并被表征(ribbert,t.,etal.,brjdermatol,2010;163:p.279-86,tur,mk.,etal.,cancerres,2003;63:p.8414-9)。
对于人溶细胞融合蛋白(hcfp),将pmt载体系统转移到上述的使用克隆sfil和notl作为限制位点的pms载体系统。pms载体模板含有效应蛋白的序列:微管相关蛋白tau(maptau)、血管生成素的突变体(angggrr)或颗粒酶b(egbr201k)的突变形式。类似于cd89(scfv)-eta’,将成功克隆的构建体转化到大肠杆菌dh5ɑ中,并通过测序验证构建体的序列。
如先前由stocker等人描述的,在hek293t细胞中暂时进行基于pms构建体(cd89(scfv)-angggrr,cd89(scfv)-maptau和egbr201k-cd89(scfv))的表达。对cd89(scfv)-eta’进行所述的纯化和表征程序。
融合蛋白cd89(scfv)-eta’的构建、表达和结合特征
我们生成一种源自人源化全尺寸抗人cd89的单抗体a77的cd89特异性scfv与截短的毒素eta’的融合(图3(a))。重组it在细菌中表达并通过靶向his6标签的亲和层析被纯化,通过sds-page测定获得纯度大于90%的产量为3mg/l的培养上清液,并用考马斯亮蓝染色。使用eta特异性mab通过蛋白质印迹验证重组蛋白的身份。在变性条件下,sds-page显示出约70kda的预期分子量的条带(图4(a))。产生由cd89特异性scfv和人效应结构域(gbr201k、angggrr或maptau)组成的hcfp,并在hek293t细胞中暂时表达。对cd89(scfv)-eta’进行所述的纯化并获得高达640μg/l的产量。通过使用蛋白质印迹上的抗多聚组氨酸抗体的特异性检测来检验融合蛋白的身份。cd89(scfv)-angggrr的理论质量为46.8kda,egbr201k-cd89(scfv)的理论质量为58.8kda,cd89(scfv)-maptau的理论质量为80kda,并且在考马斯染色的变性sds-paa凝胶和相应的蛋白质印迹膜上的检测此大小的条带(图4(b)、图4(c)和图4(d))。
2.患者样本和细胞系
aml细胞系hl-60(fab,amlm2;dsmzno.acc3)、mono-mac-1(fab,amlm5;dsmzno.acc252),thp-1(fab,amlm5(martino,etal2006)、dsmzno.acc16)、组织细胞淋巴瘤细胞系u937(dsmzno.acc5)和burkitt淋巴瘤细胞系ramos(dsmzno.acc603)在37℃,5%的co2和100%湿度下,在补充有10%(v/v)胎牛血清(biochrom)、50μg/ml青霉素和100μg/ml链霉素(gibco)的标准rpmi1640培养基(invitrogen)中生长。在流式细胞术和细胞毒性测定之前,用ifnγ或tnfɑ刺激细胞24小时。通过使用biocoll分离溶液(biochromag)的密度梯度离心法来分离初级单核细胞。在收到知情同意书并经亚琛大学临床研究伦理委员会批准后,从预处理白血病患者的外周血中分离细胞(基于who分类的诊断见表1)。在上述条件下培养来自amlcmml患者的细胞。
3.cd64和cd89表达和受体密度的分析
通过流式细胞术分析不同细胞系的cd64和cd89表达。将细胞与含有2mmedta和1%(w/v)人阻断血清(biochrom)的pbs(ph7.4)中的150ng荧光团标记的mab在冰上孵育30分钟,然后用pbs洗涤两次。用50nm的h22(scfv)抗体片段(hristodorov,d.,etal.,mabs,2014,6:p.1283-1289)阻断cd64。然后在facscaliburtm流式细胞仪(bectondickinson)上分析荧光。使用以下抗体进行检测:小鼠抗人cd64[10.1]:apc(ebioscience)和小鼠抗人cd89[mip8]:fitc(abdserotec)。使用
确认aml细胞系中cd64和cd89表达和受体密度
使用双染法评估不同aml细胞系中cd64和cd89的表达水平,以确定在正常条件下和用ifnγ或tnfa刺激后表达cd64和cd89的细胞的数量。在正常条件下和ifnγ和tnfα存在下,在所有aml细胞系上(hl-60>90%;mono-mac-1>30%和thp-1>25%)cd64和cd89的表达是可检测的(图1)。在tnfα的存在下观察到强烈的上调,其在所有aml细胞系中将cd64+和cd89+细胞的数量增加至>80%。研究了组织细胞系u937中两种受体的表达谱。在正常条件(~52%)和刺激后(ifnγ~24%和tnfα~35%),在细胞表面检测到cd89。在burkitt淋巴瘤ramos细胞上未检测到cd64或cd89。
使用
4.流式细胞仪进行细胞结合分析
我们用含有2mmedta和0.5%(w/v)牛血清白蛋白的pbs(ph7.4)中的100ngcd89(scfv)-eta’和500ngcd89(scfv)-融合蛋白在冰上孵育5×105个细胞30分钟,然后用pbs洗涤两次。然后在用pbs再洗涤两次之前,在冰上用0.125ng抗his5-alexafluor488mab(qiagen)在黑暗中孵育细胞30分钟。
cd89靶向融合蛋白的结合确认
通过流式细胞术检测纯化的cd89(scfv)-融合蛋白的细胞结合活性,并且可以如图5所示成功验证。此外,cd89(scfv)-eta’也特异性结合cd89+amlm5细胞系mono-mac-1和thp-1以及组织细胞系u937(未显示数据)。
5.cd89(scfv)-angggrr和gbr201k-cd89(scfv)的体外功能
进行核糖核酸酶(也称为rnase)测定以检查cd89(scfv)-angggrr融合蛋白的体外功能。因此,将不同浓度的蛋白质与600ng酵母trna在含有30mmnacl的测定缓冲液(30mmtris-hcl缓冲液(ph7.5))中在37℃下孵育1.5小时。使用100ng的rnasea作为阳性对照,用不含有rnase的tris-hcl样品缓冲液(ph7.5)孵育trna,作为阴性对照。以1:6的稀释比例加入6x负载染料((48%(v/v)甲醛、48%(v/v)甘油、0.25%(v/v)溴酚蓝、20mm磷酸钠(ph7.5))来停止反应。然后,在100v下使用不含有rnase的1%琼脂糖凝胶分析trna的降解7分钟,并通过紫外照射显现条带。
通过切割模拟促胱天蛋白酶3切割位点的200μm比色合成底物ac-ietd-pna(calbiochem/merck,darmstadt)来检测肠激酶消化后的gbr201k-cd89(scfv)活性。使用颗粒酶b标准品作为阳性对照,并以90ng的浓度施用。对于阴性对照,将测定缓冲液(100mmnacl、50mmhepes、10mmdtt、1mmedta、10%(v/v)甘油、0.1%(w/v)chaps、ph7.4)与底物孵育。在微板读数器中的96孔板中以405nm,在37℃下,以2分钟的时间间隔监测反应1小时。之后,将时间相对于吸光度作图,因此可以评估活性的差异。
确认cd89(scfv)-angggrr和gbr201k-cd89(scfv)的功能
我们可以确认融合蛋白的rnase活性。检测trna的浓度依赖性降解,而使用1μg、500ng和250ng的cd89(scfv)-angggrr分别将所用得trna的uv信号降低至15、25%和50%(图6(b))。
使用上述比色动力学测量,随时间增加吸光度来证实gbr201k-cd89(scfv)的颗粒酶b部分的活性(图6(a))。
6.细胞凋亡测定
使用膜联蛋白(annexin)v/碘化丙啶(pi)测定法来测量cd89(scfv)-eta’的促凋亡活性。我们在37℃下,5%的co2和100%湿度条件下,在24孔板(greiner,德国)中用不同浓度的cd89(scfv)-eta’孵育5x105个细胞/ml。ramos细胞(cd89)作为对照。孵育后,细胞用pbs(ph7.4)洗涤两次,并在室温下的黑暗环境中用膜联蛋白(annexin)v结合缓冲液(10mmhepes/naoh、ph7.4、140mmnacl、2.5mmcacl2)中的膜联蛋白(annexin)v-fitc(ebioscience)染色30分钟。最后,如上所述来洗涤细胞,重悬于含有10μg/mlpi的膜联蛋白(annexin)v缓冲液中,并通过流式细胞术进行分析。
cd89融合蛋白的抗原特异性剂量依赖性体外细胞毒性
包含在it中的细胞毒素效应物蛋白应优选诱导凋亡而不是坏死或焦亡(pyrotosis),因为前者不引起不期望的炎性反应。因此,cd89(scfv)-eta’诱导不同aml细胞系凋亡的能力通过在处理72小时后用膜联蛋白(annexin)v和pi双染色进行测试。因此,无论是否有刺激或刺激的性质如何,cd89(scfv)-eta’引发hl-60细胞凋亡,但不影响cd89-ramos细胞。定量实验证实了剂量依赖关系,即无论是否有刺激或刺激的性质如何,更高浓度的cd89(scfv)-eta’增加了hl-60细胞凋亡的效率(图7(a)和图7(b)),cd89(scfv)-eta’的细胞毒活性与可比较条件下的ki4(scfv)-eta和h22(scfv)-eta’所述的细胞毒活性相似(barths.,etal.,appliedandenvironmentalmicrobiology,2000,66:p.1572-9;barths.,etal.,blood2000,95:p.3909-14)。cd89(scfv)-angggrr和gbr201k-cd89(scfv)的细胞毒作用分别可以估计为40%和60%(图7(c))。
cd89(scfv)-eta’的抗原特异性促凋亡活性
我们还调查了其他aml细胞系和u937组织细胞淋巴瘤细胞中it介导的细胞死亡率(图9(a))。使用竞争测定,证实了抗原依赖性cd89(scfv)-eta’细胞毒性的统计学显著性。证明了在与无毒snap蛋白融合的50倍摩尔过量的cd89(scfv)的存在下细胞毒性的剂量依赖性降低了(amoury,etal2013)。与cd89(scfv)或h22(scfv)融合的含有cd30特异性ki4(scfv)(barths.,etal.,blood2000,95:p.3909-14)(数据未显示)的非特异性eta’融合蛋白和snap均未显示对我们测试的细胞系具有细胞毒性的证据(图9(b))。
对cd89+白血病细胞的离体细胞毒性
测试了从被诊断患有三种不同形式的骨髓性白血病的三个患者获得的原代细胞:(#1)aml和(#2,#3)cmml。测试了分离的原代细胞是否存在cd89,我们发现aml患者的阳性细胞百分比为75%,两个cmml患者的阳性细胞百分比分别为69%和73%(表1)。我们使用膜联蛋白(annexin)v/pi染色测定法监测cd89(scfv)-eta’,cd89(scfv)-angggrr,gbr201k-cd89(scfv)和/或cd89(scfv)-maptau诱导的细胞凋亡(图10)。当用每种融合蛋白处理原代细胞的所有三个样品时,活细胞的数量减少。膜联蛋白(annexin)v染色显示了cd89(scfv)-eta’it介导的细胞毒性作用消除了约25%的aml原代细胞,约25%的cmml#2原代细胞和约20%的cmml#3原代细胞(图10(a))。此外,cd89(scfv)-angggrr可以消除约60%的aml,约50%的cmml#2和约25%的cmml#3原代细胞(图10(b))。cd89(scfv)-maptau消除了约20%的aml原代细胞,约20%的cmml#2原代细胞和约15%的cmml#3原代细胞(图10(c)),并且gbr201k-cd89(scfv)示出了消除约35%的cmml#2原代细胞和约15%的cmml#3原代细胞的细胞毒性作用(图10(d))。
7.比色细胞增殖试验
通过测量xtt转化为水溶性橙色甲臜染料来确定不同it和hcfp的细胞毒性作用。(roehm,etal1991)。我们将5×105个细胞/孔接种到96孔微量滴定板中,并在37℃下,5%co2和100%湿度下,用不同稀释度的重组蛋白质孵育72小时。我们向每个孔中加入50μl的100:1的xtt/苯磺胺甲基硫酸盐(phenanzinemethosulfate)(serva和sigma-aldrich),并将板孵育2-4小时。使用epoch微板分光光度计(epochmicroplatespectrophotometer,biotek)来测量450-630nm处的吸光度。通过分别将10μg/ml博来霉素处理的细胞和未处理的细胞设置为100%和0%的值来规范化数据。所有实验都进行三次。
通过cd89(scfv)-融合细胞毒素蛋白以在体外抑制细胞增殖
针对hl-60细胞的cd89(scfv)-eta’的ec50值是刺激依赖性的,即在不存在刺激的情况下其为>1μm,在ifnγ存在时其为约0.2nm,在tnfα存在其下为约3nm(图8a))。cd89(scfv)-eta’的细胞增殖的抑制活性与在可比较条件下对之前所述的h22(scfv)-eta’的抑制活性相似(barths.,etal.,blood2000,95:p.3909-14;barths.,etal.,appliedandenvironmentalmicrobiology,2000,66:p.1572-9)。对于被刺激的hl-60细胞,计算cd89(scfv)-angggrr的ec50值为约47nm,cd89(scfv)-maptau的ec50值为约42nm,gbr201k-cd89(scfv)的ec50值为约48nm(图8(b))。
8.内化分析
cd89(scfv)-snap蛋白通过hek293t细胞中的分泌表达产生,并根据制造商的说明书(neb)与
cd89依赖性内化
使用cd89(scfv)-snap-bg-vista*green证明了cd89特异性的高效的内化到hl60细胞中,揭示了在37℃下孵育30分钟后标记蛋白质的细胞内积累。在4℃下没有检测到内化。当我们测试作为阴性对照的cd89-ramos细胞时,结合和内化均未被发现(图9(c))。
9.统计分析
使用graphpadprismv5(graphpadsoftware,usa)进行统计分析和ec50值计算。ec50定义为标准化至未处理的对照细胞和博莱霉素处理的细胞的代谢活性降低50%所需的浓度。数据表示为平均值±标准偏差(sd)。使用双尾不配对的学生t检验进行统计学比较:*p≤<0.05,**p≤0.01,***p≤0.001。
表1:三例白血病患者的实验室参数
*对特定患者不进行计算(n.e.)。
根据标准临床方案,在上述表格中记录患者信息(例如性别和年龄)、基于who分类的诊断,以前的治疗状态和一般实验室参数(例如白细胞的量(wbc)和其单核细胞百分比、血红蛋白量和血小板数)。数据由亚琛大学诊所相应的成员根据道德政策提供。
参考文献:
albo,c.,delafuente,j.,ares,c,alonso,c.&feteira,e.(2004)kineticsandimmunophenotypiccharacterizationofcirculatinghematopoieticprogenitorcellsafterperipheralbloodstemcelltransplantation.haematologica,89,845-851.
barth,s.,huhn,m.,matthey,b.,tawadros,s.,schnell,r.,schinkothe,t.,diehl,v.&engert,a.(2000)ki-4(scfv)-eta’,anewrecombinantanti-cd30immunotoxinwithhighlyspecificcytotoxicactivityagainstdisseminatedhodgkintumorsinscidmice.blood,95,3909-3914.
becker,n.&benhar,i.(2012)antibody-basedimmunotoxinsforthetreatmentofcancer.antibodies,1,39-69.
berges,n.,hehmann-titt,g.,hristodorov,d.,melmer,g.,thepen,t.&barth,s.(2014)humancytolyticfusionproteins:modifiedversionsofhumangranzymebandangiogeninhavethepotentialtoreplacebacterialtoxinsintargetedtherapiesagainstcd64+diseases.antibodies,3,92-115.
chari,r.v.(2008)targetedcancertherapy:conferringspecificitytocytotoxicdrugs.accchemres,41,98-107.
cremerc,vierbuchent.,heinl,fischerr.,barths.,nachreinert.-angiogeninmutantsasnoveleffectormoleculesforthegenerationoffusionproteinswithincreasedcytotoxicpotential,journalofimmunotherapy,(acceptedforpublication,dec2014).
dunphy,c.h.&tang,w.(2007)thevalueofcd64expressionindistinguishingacutemyeloidleukemiawithmonocyticdifferentiationfromothersubtypesofacutemyeloidleukemia:aflowcytometricanalysisof64cases.archpathollabmed,131,748-754.
gasiorowski,r.e.,clark,g.j.,bradstock,k.&hart,d.n.(2014)antibodytherapyforacutemyeloidleukaemia.brjhaematol,164,481-495.
goodin,s.(2007)oralchemotherapeuticagents:understandingmechanismsofactionanddruginteractions.amjhealthsystpharm,64,s15-24.
guettinger,y.,barbin,k.,peipp,m.,bruenke,j.,dechant,m.,horner,h.,thierschmidt,d.,valerius,t.,repp,r.,fey,g.h.&stockmeyer,b.(2010)arecombinantbispecificsingle-chainfragmentvariablespecificforhlaclassiiandfcalpharl(cd89)recruitspolymorphonuclearneutrophilsforefficientlysisofmalignantblymphoidcells.jimmunol,184,1210-1217.
hamre,r.,farstad,i.n.,brandtzaeg,p.&morton,h.c.(2003)expressionandmodulationofthehumanimmunoglobulinafcreceptor(cd89)andthefcrgammachainonmyeloidcellsinbloodandtissue.scandjimmunol,57,506-516.
hornermj,r.l,krapchom,neymann(2009)surveillanceepidemiologyandendresults(seer)"cancerstatisticsreview,1975-2006".nationalcancerinstitute.
hristodorov,d.,mladenov,r.,brehm,h.,fischer,r.,barth,s.&thepen,t.(2014)recombinanth22(scfv)blockscd64andpreventsthecaptureofanti-tnfmonoclonalantibody.mabs,6,1283-1289.
hristodorov,d.,mladenov,r.,huhn,m.,barth,s.&thepen,t.(2012)macrophage-targetedtherapy:cd64-basedimmunotoxinsfortreatmentofchronicinflammatorydiseases.toxins,4,676-694.
hristodorov,d.,r.mladenov,a.pardo,a.t.pham,m.huhn,r.fischer,t.thepenands.barth(2013)."microtubule-associatedproteintaufacilitatesthetargetedkillingofproliferatingcancercellsinvitroandinaxenograftmousetumourmodelinvivo."brjcancer109(6):1570-1578.
monnier,p.,vigouroux,r.&tassew,n.(2013)invivoapplicationsofsinglechainfv(variabledomain)(scfv)fragments.antibodies,2,193-208.
morton,h.c.&brandtzaeg,p.(2001)cd89:thehumanmyeloidigafcreceptor.archimmunoltherexp(warsz),49,217-229.
paul,we.,fundamentalimmunology,1993,3rdedition.
potala,s.,sahoo,s.k.&verma,r.s.(2008)targetedtherapyofcancerusingdiphtheriatoxin-derivedimmunotoxins.drugdiscovtoday,13,807-815.
ribbert,t.,thepen,t.,tur,m.k.,fischer,r.,huhn,m.&barth,s.(2010)recombinant,eta’-basedcd64immunotoxins:improvedefficacybyincreasedvalency,bothinvitroandinvivoinachroniccutaneousinflammationmodelinhumancd64transgenicmice.brjdermatol,163,279-286.
roehm,n.w.,rodgers,g.h.,hatfield,s.m.&glasebrook,a.l(1991)animprovedcolorimetricassayforcellproliferationandviabilityutilizingthetetrazoliumsaltxtt.jimmunolmethods,142,257-265.
schiffer,s.,letzian,s.,jost,e.,mladenov,r.,hristodorov,d.,huhn,m.,fischer,r.,barth,s.&thepen,t.(2013)granzymemasanoveleffectormoleculeforhumancytolyticfusionproteins:cd64-specificcytotoxicityofgm-h22(scfv)againstleukemiccells.cancerlett,341,178-185.
schiffer,s.,rosinke,r.,jost,e.,hehmann-titt,g.,huhn,m.,melmer,g.,barth,s.&thepen,t.(2014)targetedexvivoreductionofcd64-positivemonocytesinchronicmyelomonocyticleukemiaandacutemyelomonocyticleukemiausinghumangranzymeb-basedcytolyticfusionproteins.intjcancer,135,1497-1508.
schwemmlein,m.,peipp,m.,barbin,k.,saul,d.,stockmeyer,b.,repp,r.,birkmann,j.,oduncu,f.,emmerich,b.&fey,g.h.(2006)acd33-specificsingle-chainimmunotoxinmediatespotentapoptosisofculturedhumanmyeloidleukaemiacells.brjhaematol,133,141-151.
stahnke,b.,thepen,t.,stocker,m.,rosinke,r.,jost,e.,fischer,r.,tur,m.k.&barth,s.(2008)granzymeb-h22(scfv),ahumanimmunotoxintargetingcd64inacutemyeloidleukemiaofmonocyticsubtypes.molcancerther,7,2924-2932.
stanbury,r.m.&graham,e.m.(1998)systemiccorticosteroidtherapy-sideeffectsandtheirmanagement.brjophthalmol,82,704-708.
stein,c.,kellner,c.,kugler,m.,reiff,n.,mentz,k.,schwenkert,m.,stockmeyer,b.,mackensen,a.&fey,g.h.(2010)novelconjugatesofsingle-chainfvantibodyfragmentsspecificforstemcellantigencd123mediatepotentdeathofacutemyeloidleukaemiacells.brjhaematol,148,879-889.
stucker,f.&ackermann,d.(2011)[immunosuppressivedrugs-howtheywork,theirsideeffectsandinteractions].therumsch,68,679-686.
thepen,t.,huhn,m.,melmer,g.,tur,m.k.&barth,s.(2009)fcgammareceptor1(cd64),atargetbeyondcancer.currpharmdes,15,2712-2718.
thepen,t.,vanvuuren,a.j.,kiekens,r.c.,damen,c.a.,vooijs,w.c.&vandewinkel,j.g.(2000)resolutionofcutaneousinflammationafterlocaleliminationofmacrophages.natbiotechnol,18,48-51.
thorpe,s.j.,turner,c,heath,a.,feavers,i.,vatn,i.,natvig,j.b.&thompson,k.m.(2003)clonalanalysisofahumanantimouseantibody(hama)response.scandjimmunol,57,85-92.
tur,m.k.,huhn,m.,thepen,t.,stocker,m.,krohn,r.,vogel,s.,jost,e.,osieka,r.,vandewinkel,j.g.,fischer,r.,finnern,r.&barth,s.(2003)recombinantcd64-specificsinglechainimmunotoxinexhibitsspecificcytotoxicityagainstacutemyeloidleukemiacells.cancerres,63,8414-8419.
vermesi,haanenc,steffens-nakkenh,reutelingspergercp.anovelassayforapoptosis.flowcytometricdetectionofphosphatidylserineexpressiononearlyapoptoticcellsusingfluoresceinlabelledannexinv.jimmunolmethods.1995;184:39-51.
序列表
<110>弗劳恩霍夫应用研究促进协会
亚琛工业大学
<120>抗cd89细胞毒素的复合物
<160>6
<170>siposequencelisting1.0
<210>1
<211>260
<212>prt
<213>artificialsequence
<220>
<223>cd89(scfv)
<220>
<221>misc_feature
<222>(227)..(227)
<223>xaacanbeanynaturallyoccurringaminoacid
<220>
<221>unsure
<222>(227)..(227)
<223>the'xaa'atlocation227standsforgln,arg,pro,orleu.
<400>1
metalaasptyrlysaspvalvalmetthrglnthrproleuthrleu
151015
serilethrileglyglnproalaserilesercyslyssersergln
202530
serleuleuaspseraspglylysthrtyrleuasntrpleuleugln
354045
argproglyglnserprothrargleuiletyrleuvalserlysleu
505560
aspserglyvalproaspargphethrglyserglyserglythrasp
65707580
phethrleulysileserargvalglualagluaspleuglyiletyr
859095
tyrcystrpglnglyalahispheproglnthrpheglyglyglythr
100105110
lysleugluleulysargglyglyglyglyserglyglyglyglyser
115120125
glyglyglyglyserglyglyglyglysergluvalglnleuglngln
130135140
thrglyprogluleuvallysproglyalaservallysilesercys
145150155160
lysalaserglytyrserphethrasptyrileilephetrpvallys
165170175
glnserhisglylysserleuglutrpthrglyasnileasnprotyr
180185190
tyrglyserthrsertyrasnleulysphelysglylysalathrleu
195200205
thrvalasplysserserserthralatyrmetglnleuasnserleu
210215220
thrserxaaaspseralavaltyrtyrcysvalargglyvaltyrtyr
225230235240
tyrglysersertyrglualapheprotyrtrpglyglnglythrleu
245250255
valthrvalser
260
<210>2
<211>637
<212>prt
<213>artificialsequence
<220>
<223>cd89(scfv)-eta
<220>
<221>misc_feature
<222>(232)..(232)
<223>xaacanbeanynaturallyoccurringaminoacid
<220>
<221>unsure
<222>(232)..(232)
<223>the'xaa'atlocation232standsforgln,arg,pro,orleu.
<400>2
metalaglnproalametalaasptyrlysaspvalvalmetthrgln
151015
thrproleuthrleuserilethrileglyglnproalaserileser
202530
cyslysserserglnserleuleuaspseraspglylysthrtyrleu
354045
asntrpleuleuglnargproglyglnserprothrargleuiletyr
505560
leuvalserlysleuaspserglyvalproaspargphethrglyser
65707580
glyserglythraspphethrleulysileserargvalglualaglu
859095
aspleuglyiletyrtyrcystrpglnglyalahispheproglnthr
100105110
pheglyglyglythrlysleugluleulysargglyglyglyglyser
115120125
glyglyglyglyserglyglyglyglyserglyglyglyglyserglu
130135140
valglnleuglnglnthrglyprogluleuvallysproglyalaser
145150155160
vallysilesercyslysalaserglytyrserphethrasptyrile
165170175
ilephetrpvallysglnserhisglylysserleuglutrpthrgly
180185190
asnileasnprotyrtyrglyserthrsertyrasnleulysphelys
195200205
glylysalathrleuthrvalasplysserserserthralatyrmet
210215220
glnleuasnserleuthrserxaaaspseralavaltyrtyrcysval
225230235240
argglyvaltyrtyrtyrglysersertyrglualapheprotyrtrp
245250255
glyglnglythrleuvalthrvalseralaalaalagluleualaser
260265270
glyglyprogluglyglyserleualaalaleuthralahisglnala
275280285
cyshisleuproleugluthrphethrarghisargglnproarggly
290295300
trpgluglnleugluglncysglytyrprovalglnargleuvalala
305310315320
leutyrleualaalaargleusertrpasnglnvalaspglnvalile
325330335
argasnalaleualaserproglyserglyglyaspleuglygluala
340345350
ilearggluglnprogluglnalaargleualaleuthrleualaala
355360365
alaglusergluargphevalargglnglythrglyasnaspgluala
370375380
glyalaalaasnalaaspvalvalserleuthrcysprovalalaala
385390395400
glyglucysalaglyproalaaspserglyaspalaleuleugluarg
405410415
asntyrprothrglyalaglupheleuglyaspglyglyaspvalser
420425430
pheserthrargglythrglnasntrpthrvalgluargleuleugln
435440445
alahisargglnleuglugluargglytyrvalphevalglytyrhis
450455460
glythrpheleuglualaalaglnserilevalpheglyglyvalarg
465470475480
alaargserglnaspleuaspalailetrpargglyphetyrileala
485490495
glyaspproalaleualatyralatyralaglnaspglngluproasp
500505510
alaargglyargileargasnglyalaleuleuargvaltyrvalpro
515520525
argserserleuproglyphetyrargthrserleuthrleualaala
530535540
proglualaalaglygluvalgluargleuileglyhisproleupro
545550555560
leuargleuaspalailethrglyprogluglugluglyglyargleu
565570575
gluthrileleuglytrpproleualagluargthrvalvalilepro
580585590
seralaileprothraspproargasnvalglyglyaspleuasppro
595600605
serserileproasplysgluglnalaileseralaleuproasptyr
610615620
alaserglnproglylysproproarggluaspleulys
625630635
<210>3
<211>506
<212>prt
<213>artificialsequence
<220>
<223>egbr201k(granzymebmutant)-cd89(scfv)
<220>
<221>misc_feature
<222>(472)..(472)
<223>xaacanbeanynaturallyoccurringaminoacid
<220>
<221>unsure
<222>(472)..(472)
<223>the'xaa'atlocation472standsforgln,arg,pro,orleu.
<400>3
aspaspaspasplysileileglyglyhisglualalysprohisser
151015
argprotyrmetalapheleumetiletrpaspglnlysserleulys
202530
argcysglyglypheleuileargaspaspphevalleuthralaala
354045
hiscystrpglyserserileasnvalthrleuglyalahisasnile
505560
lysgluglngluprothrglnglnpheileprovallysargalaile
65707580
prohisproalatyrasnprolysasnpheserasnaspilemetglu
859095
thrleuleuglnleugluarglysalalysargthrargalavalgln
100105110
proleuargleuproserasnlysalaglnvallysproglyglnthr
115120125
cysservalalaglytrpglyglnthralaproleuglylyshisser
130135140
histhrleuglngluvallysmetthrvalglngluasparglyscys
145150155160
gluseraspleuarghistyrtyraspserthrilegluleucysval
165170175
glyaspprogluilelyslysthrserphelysglyaspserglygly
180185190
proleuvalcysasnlysvalalaglnglyilevalsertyrglylys
195200205
asnasnglymetproproargalacysthrlysvalserserpheval
210215220
histrpilelyslysthrmetlysargtyralagluhisgluglyasp
225230235240
alaalaglnproalametalaasptyrlysaspvalvalmetthrgln
245250255
thrproleuthrleuserilethrileglyglnproalaserileser
260265270
cyslysserserglnserleuleuaspseraspglylysthrtyrleu
275280285
asntrpleuleuglnargproglyglnserprothrargleuiletyr
290295300
leuvalserlysleuaspserglyvalproaspargphethrglyser
305310315320
glyserglythraspphethrleulysileserargvalglualaglu
325330335
aspleuglyiletyrtyrcystrpglnglyalahispheproglnthr
340345350
pheglyglyglythrlysleugluleulysargglyglyglyglyser
355360365
glyglyglyglyserglyglyglyglyserglyglyglyglyserglu
370375380
valglnleuglnglnthrglyprogluleuvallysproglyalaser
385390395400
vallysilesercyslysalaserglytyrserphethrasptyrile
405410415
ilephetrpvallysglnserhisglylysserleuglutrpthrgly
420425430
asnileasnprotyrtyrglyserthrsertyrasnleulysphelys
435440445
glylysalathrleuthrvalasplysserserserthralatyrmet
450455460
glnleuasnserleuthrserxaaaspseralavaltyrtyrcysval
465470475480
argglyvaltyrtyrtyrglysersertyrglualapheprotyrtrp
485490495
glyglnglythrleuvalthrvalserala
500505
<210>4
<211>382
<212>prt
<213>artificialsequence
<220>
<223>cd89(scfv)-angggrr(angiogeninmutant)
<220>
<221>misc_feature
<222>(219)..(219)
<223>xaacanbeanynaturallyoccurringaminoacid
<220>
<221>unsure
<222>(219)..(219)
<223>the'xaa'atlocation219standsforgln,arg,pro,orleu.
<400>4
metthrglnthrproleuthrleuserilethrileglyglnproala
151015
serilesercyslysserserglnserleuleuaspseraspglylys
202530
thrtyrleuasntrpleuleuglnargproglyglnserprothrarg
354045
leuiletyrleuvalserlysleuaspserglyvalproaspargphe
505560
thrglyserglyserglythraspphethrleulysileserargval
65707580
glualagluaspleuglyiletyrtyrcystrpglnglyalahisphe
859095
proglnthrpheglyglyglythrlysleugluleulysargglygly
100105110
glyglyserglyglyglyglyserglyglyglyglyserglyglygly
115120125
glysergluvalglnleuglnglnthrglyprogluleuvallyspro
130135140
glyalaservallysilesercyslysalaserglytyrserphethr
145150155160
asptyrileilephetrpvallysglnserhisglylysserleuglu
165170175
trpthrglyasnileasnprotyrtyrglyserthrsertyrasnleu
180185190
lysphelysglylysalathrleuthrvalasplysserserserthr
195200205
alatyrmetglnleuasnserleuthrserxaaaspseralavaltyr
210215220
tyrcysvalargglyvaltyrtyrtyrglysersertyrglualaphe
225230235240
protyrtrpglyglnglythrleuvalthrvalseralaalaalaleu
245250255
gluserargglnaspasnserargtyrthrhispheleuthrglnhis
260265270
tyraspalalysproglnglyargaspaspargtyrcysgluserile
275280285
metargargargglyleuthrserprocyslysaspileasnthrphe
290295300
ilehisglyasnlysargserilelysalailecysgluasnlysasn
305310315320
glyasnprohisarggluasnleuargileserlysserserphegln
325330335
valthrthrcyslysleuhisargargserprotrpproprocysgln
340345350
tyrargalathralaglypheargasnvalvalvalalacysgluasn
355360365
glyleuprovalhisleuaspglnserilepheargargpro
370375380
<210>5
<211>647
<212>prt
<213>artificialsequence
<220>
<223>cd89(scfv)-maptau
<220>
<221>misc_feature
<222>(222)..(222)
<223>xaacanbeanynaturallyoccurringaminoacid
<220>
<221>unsure
<222>(222)..(222)
<223>the'xaa'atlocation222standsforgln,arg,pro,orleu.
<400>5
aspvalvalmetthrglnthrproleuthrleuserilethrilegly
151015
glnproalaserilesercyslysserserglnserleuleuaspser
202530
aspglylysthrtyrleuasntrpleuleuglnargproglyglnser
354045
prothrargleuiletyrleuvalserlysleuaspserglyvalpro
505560
aspargphethrglyserglyserglythraspphethrleulysile
65707580
serargvalglualagluaspleuglyiletyrtyrcystrpglngly
859095
alahispheproglnthrpheglyglyglythrlysleugluleulys
100105110
argglyglyglyglyserglyglyglyglyserglyglyglyglyser
115120125
glyglyglyglysergluvalglnleuglnglnthrglyprogluleu
130135140
vallysproglyalaservallysilesercyslysalaserglytyr
145150155160
serphethrasptyrileilephetrpvallysglnserhisglylys
165170175
serleuglutrpthrglyasnileasnprotyrtyrglyserthrser
180185190
tyrasnleulysphelysglylysalathrleuthrvalasplysser
195200205
serserthralatyrmetglnleuasnserleuthrserxaaaspser
210215220
alavaltyrtyrcysvalargglyvaltyrtyrtyrglysersertyr
225230235240
glualapheprotyrtrpglyglnglythrleuvalthrvalserala
245250255
alaalametalagluproargglngluphegluvalmetgluasphis
260265270
alaglythrtyrglyleuglyasparglysaspglnglyglytyrthr
275280285
methisglnaspglngluglyaspthraspalaglyleulysalaglu
290295300
alaglyileglyaspthrproserleugluaspglualaalaglyhis
305310315320
valthrglnalaargmetvalserlysserlysaspglythrglyser
325330335
aspasplyslysalalysglyalaaspglylysthrlysilealathr
340345350
proargglyalaalaproproglyglnlysglyglnalaasnalathr
355360365
argileproalalysthrproproalaprolysthrproproserser
370375380
glygluproprolysserglyaspargserglytyrserserprogly
385390395400
serproglythrproglyserargserargthrproalaleuprothr
405410415
proprothrarggluprolyslysvalalavalvalargthrpropro
420425430
lysserproserseralalysserargleuglnthralaprovalpro
435440445
metproaspleulysasnvallysserlysileglyalathrgluasn
450455460
leulyshisglnproglyglyglylysvalglnileileasnlyslys
465470475480
leuaspleuserasnvalglnserlyscysglyserlysaspasnile
485490495
lyshisvalproglyglyglyservalglnilevaltyrlysproval
500505510
aspleuserlysvalthrserlyscysglyserleuglyasnilehis
515520525
hislysproglyglyglyglnvalgluvallysserglulysleuasp
530535540
phelysaspargvalglnserlysileglyserleuaspasnilethr
545550555560
hisvalproglyglyglyasnlyslysilegluthrhislysleuthr
565570575
phearggluasnalalysalalysthrasphisglyalagluileval
580585590
tyrlysserprovalvalserglyaspthrserproarghisleuser
595600605
asnvalserserthrglyserileaspmetvalaspserproglnleu
610615620
alathrleualaaspgluvalseralaserleualalysglnglyleu
625630635640
prolyslyslysarglysval
645
<210>6
<211>206
<212>prt
<213>homosapiens
<400>6
glngluglyasppheprometpropheileseralalysserserpro
151015
valileproleuaspglyservallysileglncysglnalailearg
202530
glualatyrleuthrglnleumetileilelysasnserthrtyrarg
354045
gluileglyargargleulysphetrpasngluthraspprogluphe
505560
valileasphismetaspalaasnlysalaglyargtyrglncysgln
65707580
tyrargileglyhistyrargpheargtyrseraspthrleugluleu
859095
valvalthrglyleutyrglylyspropheleuseralaasparggly
100105110
leuvalleumetproglygluasnileserleuthrcysserserala
115120125
hisilepropheaspargpheserleualalysgluglygluleuser
130135140
leuproglnhisglnserglygluhisproalaasnpheserleugly
145150155160
provalaspleuasnvalserglyiletyrargcystyrglytrptyr
165170175
asnargserprotyrleutrpserpheproserasnalaleugluleu
180185190
valvalthraspserilehisglnasptyrthrthrglnasn
195200205
- 还没有人留言评论。精彩留言会获得点赞!