细胞因子融合蛋白的制作方法
本发明涉及细胞因子融合蛋白和编码这样的细胞因子融合蛋白的核酸分子。本发明还涉及细胞、非人生物体、包含所述细胞因子融合蛋白或编码所述细胞因子融合蛋白之核酸分子的药物组合物和药盒、及其作为药物的用途。
背景技术:
肿瘤坏死因子(tumornecrosisfactor,tnf)超家族的配体在包括凋亡、免疫细胞功能的调节和其他细胞类型特异性应答的正常发育过程中具有重要作用。其还在包括癌症和自身免疫病的多种获得性和遗传性疾病中发挥重要作用。
tnf配体家族的特征为称作tnf同源结构域(tnfhomologydomain,thd)的保守胞外c末端结构域(bodmer,j.l.等(2002),trendsinbiochemicalsciences,27(1):19-26)。thd共享有几乎相同的三级折叠并且表现出家族成员间约20%至30%的序列同一性,负责受体结合并且非共价地相互作用以形成随后被其特异性受体识别的(同-)三聚体复合物。虽然大多数配体被作为膜结合蛋白、更特别是ii型(即,胞内n末端和胞外c末端)跨膜蛋白合成,但是包含thd的胞外结构域的蛋白水解切割可产生可溶性细胞因子(bodmer,j.l.等(2002),trendsinbiochemicalsciences,27(1):19-26)。
本发明的一个目的是提供多官能,特别是双官能或双重作用的包含至少两种不同细胞因子的细胞因子融合蛋白。本发明的另一个目的是提供编码这样的细胞因子融合蛋白的核酸分子,特别是rna分子。
发明概述
在一个方面中,本发明涉及细胞因子融合蛋白,其包含(i)形成第一同三聚体的肿瘤坏死因子(tnf)超家族之第一配体的三个胞外结构域或者其片段或变体,所述第一同三聚体能够与所述第一配体的受体结合;和(ii)形成第二同三聚体的tnf超家族之第二配体的三个胞外结构域或者其片段或变体,所述第二同三聚体能够与所述第二配体的受体结合,其中所述第一配体与所述第二配体不同,并且其中所述第一同三聚体与所述第二同三聚体共价连接,优选地通过一个或更多个肽接头共价连接。
在一个实施方案中,第一配体的三个胞外结构域或者其片段或变体和/或第二配体的三个胞外结构域或者其片段或变体共价连接。
在一个实施方案中,细胞因子融合蛋白包含具有以下通式的分子/结构:
n’-a-la-a-la-a-l-b-lb-b-lb-b-c’(式i),
其中a包含第一配体的胞外结构域或者其片段或变体,并且b包含第二配体的胞外结构域或者其片段或变体,并且
其中l包含肽接头,并且
la和lb在每次出现时独立地选自共价键和肽接头。
在一个实施方案中,l还包含允许细胞因子融合蛋白多聚化、优选二聚化的多聚化结构域、优选二聚化结构域。
在一个实施方案中,二聚化结构域选自ige重链结构域2(ehd2)、igm重链结构域2(mhd2)、igg重链结构域3(ghd3)、iga重链结构域3(ahd2)、igd重链结构域3(dhd3)、ige重链结构域4(ehd4)、igm重链结构域4(mhd4)、fc结构域、子宫珠蛋白二聚化结构域(uteroglobindimerizationdomain)以及前述任一种的功能变体。
在一个实施方案中,细胞因子融合蛋白作为多聚体复合物、优选二聚体复合物存在。
在另一个实施方案中,细胞因子融合蛋白包含至少一个、优选三个具有以下通式亚基:
n’-a-l-b-c’(式ii),
其中a包含第一配体的胞外结构域或者其片段或变体,并且b包含第二配体的胞外结构域或者其片段或变体,
其中l包含肽接头,并且
其中,优选地,三个亚基形成所述细胞因子融合蛋白。
在另一个方面中,本发明涉及细胞因子融合蛋白,其包含第一区段和第二区段,所述第一区段包含共价连接的肿瘤坏死因子(tnf)超家族之第一配体的三个胞外结构域或者其片段或变体,所述第二区段包含共价连接的tnf超家族之第二配体的三个胞外结构域或者其片段或变体,其中所述第一配体与所述第二配体不同,并且其中所述第一区段与所述第二区段共价连接。
在一个实施方案中,第一配体的三个胞外结构域或者其片段或变体形成能够与所述第一配体的受体结合的第一同三聚体,并且第二配体的三个胞外结构域或者其片段或变体形成能够与所述第二配体的受体结合的第二同三聚体。
在一个实施方案中,第一配体的三个胞外结构域和/或第二配体的三个胞外结构域和/或第一区段与第二区段通过肽接头共价连接。
在一个实施方案中,细胞因子融合蛋白包含具有以下通式的分子/结构:
n’-a-la-a-la-a-l-b-lb-b-lb-b-c’(式i),
其中a包含第一配体的胞外结构域或者其片段或变体,并且b包含第二配体的胞外结构域或者其片段或变体,并且
其中l包含肽接头,并且
la和lb在每次出现时独立地选自共价键和肽接头。
在一个实施方案中,l还包含允许细胞因子融合蛋白多聚化、优选二聚化的多聚化结构域、优选二聚化结构域。
在一个实施方案中,二聚化结构域选自ige重链结构域2(ehd2)、igm重链结构域2(mhd2)、igg重链结构域3(ghd3)、iga重链结构域3(ahd2)、igd重链结构域3(dhd3)、ige重链结构域4(ehd4)、igm重链结构域4(mhd4)、fc结构域、子宫珠蛋白二聚化结构域以及前述任一种的功能变体。
在一个实施方案中,细胞因子融合蛋白作为多聚体复合物、优选二聚体复合物存在。
在另一个方面中,本发明涉及细胞因子融合蛋白,其包含肿瘤坏死因子(tnf)超家族之第一配体的胞外结构域或者其片段或变体和tnf超家族之第二配体的胞外结构域或者其片段或变体,其中所述第一配体与所述第二配体不同,并且其中所述胞外结构域或者其片段或变体共价连接。
在一个实施方案中,胞外结构域通过肽接头共价连接。
在一个实施方案中,细胞因子融合蛋白包含具有以下通式的分子/结构:
n’-a-l-b-c’(式ii),
其中a包含第一配体的胞外结构域或者其片段或变体,并且b包含第二配体的胞外结构域或者其片段或变体,并且
其中l包含肽接头。
在一个实施方案中,细胞因子融合蛋白作为三聚体复合物存在,其中第一配体的三个胞外结构域或者其片段或变体形成能够与所述第一配体的受体结合的第一同三聚体,并且第二配体的三个胞外结构域或者其片段或变体形成能够与所述第二配体的受体结合的第二同三聚体。
根据本发明,本文中提及的第一配体和第二配体优选地选自cd40l、cd27l、4-1bbl、ox40l、april、cd30l、eda-a1、eda-a2、fasl、gitrl、light、lt-α、tl1a、tnf-α、trail、rankl和tweak,更优选地选自cd40l、cd27l、4-1bbl和ox40l。
在一个实施方案中,
-第一配体为cd40l,并且第二配体为cd27l;
-第一配体为cd27l,并且第二配体为cd40l;
-第一配体为cd40l,并且第二配体为4-1bbl;
-第一配体为4-1bbl,并且第二配体为cd40l;
-第一配体为cd27l,并且第二配体为4-1bbl;
-第一配体为4-1bbl,并且第二配体为cd27l;
-第一配体为cd40l,并且第二配体为ox40l;
-第一配体为ox40l,并且第二配体为cd40l;
-第一配体为cd27l,并且第二配体为ox40l;
-第一配体为ox40l,并且第二配体为cd27l;
-第一配体为ox40l,并且第二配体为4-1bbl;或者
-第一配体为4-1bbl,并且第二配体为ox40l。
在一个实施方案中,cd40l的胞外结构域包含seqidno:1的第51至261或116至261位氨基酸残基或者由其组成,cd27l的胞外结构域包含seqidno:2的第52至193位氨基酸残基或者由其组成,4-1bbl的胞外结构域包含seqidno:3的第71至254位氨基酸残基或者由其组成,和/或ox40l的胞外结构域包含seqidno:4的第51至183位氨基酸残基或者由其组成。
在一个实施方案中,细胞因子融合蛋白还包含允许检测和/或分离所述细胞因子融合蛋白的至少一种标记或标签。
在一个实施方案中,细胞因子融合蛋白还包含提高所述细胞因子融合蛋白稳定性的一种或更多种修饰。
在另一个方面中,本发明涉及核酸分子,其编码如上限定的细胞因子融合蛋白或其亚基。
在一个实施方案中,核酸分子与表达控制序列有效连接。
在一个实施方案中,核酸分子包含在载体中。
在一个实施方案中,核酸分子为rna分子,优选体外转录的(invitrotranscribed,ivt)rna分子。
在另一个方面中,本发明涉及细胞,其转化或转染有如上定义的核酸分子。
在一个实施方案中,细胞为原核细胞。
在一个实施方案中,细胞为真核细胞,优选哺乳动物细胞,更优选人细胞。
在另一个方面中,本发明涉及非人生物体,其转化或转染有如上限定的核酸分子。
在另一个方面中,本发明涉及药物组合物,其包含如上限定的细胞因子融合蛋白、如上限定的核酸分子或者如上限定的细胞作为活性剂。
在一个实施方案中,药物组合物还包含可药用载体和/或赋形剂。
在另一个方面中,本发明涉及药盒(kit),其包含如上限定的细胞因子融合蛋白、如上限定的核酸分子、如上限定的细胞或者如上限定的药物组合物。
在另一个方面中,本发明涉及如上限定的细胞因子融合蛋白、如上限定的核酸分子、如上限定的细胞或者如上限定的药物组合物,其用作药物。
在另一个方面中,本发明涉及如上限定的细胞因子融合蛋白、如上限定的核酸分子、如上限定的细胞或者如上限定的药物组合物,其用于治疗选自以下的疾病:癌症、感染性疾病、炎性疾病、代谢性疾病、自身免疫病、退行性疾病、凋亡相关疾病和移植排斥。
在另一个方面中,本发明涉及如上限定的细胞因子融合蛋白、如上限定的核酸分子、如上限定的细胞或者药物组合物在制备用于治疗选自以下的疾病的药物中的用途:癌症、感染性疾病、炎性疾病、代谢性疾病、自身免疫病、退行性疾病、凋亡相关疾病和移植排斥。
在另一个方面中,本发明涉及治疗选自以下的疾病的方法:癌症、感染性疾病、炎性疾病、代谢性疾病、自身免疫病、退行性疾病、凋亡相关疾病和移植排斥,所述方法包括将有效量的如上限定的细胞因子融合蛋白、如上限定的核酸分子、如上限定的细胞或者如上限定的药物组合物施用于有此需要的对象。
附图说明
图1.duokine、scduokine和ehd2-scduokine的示意性组合。
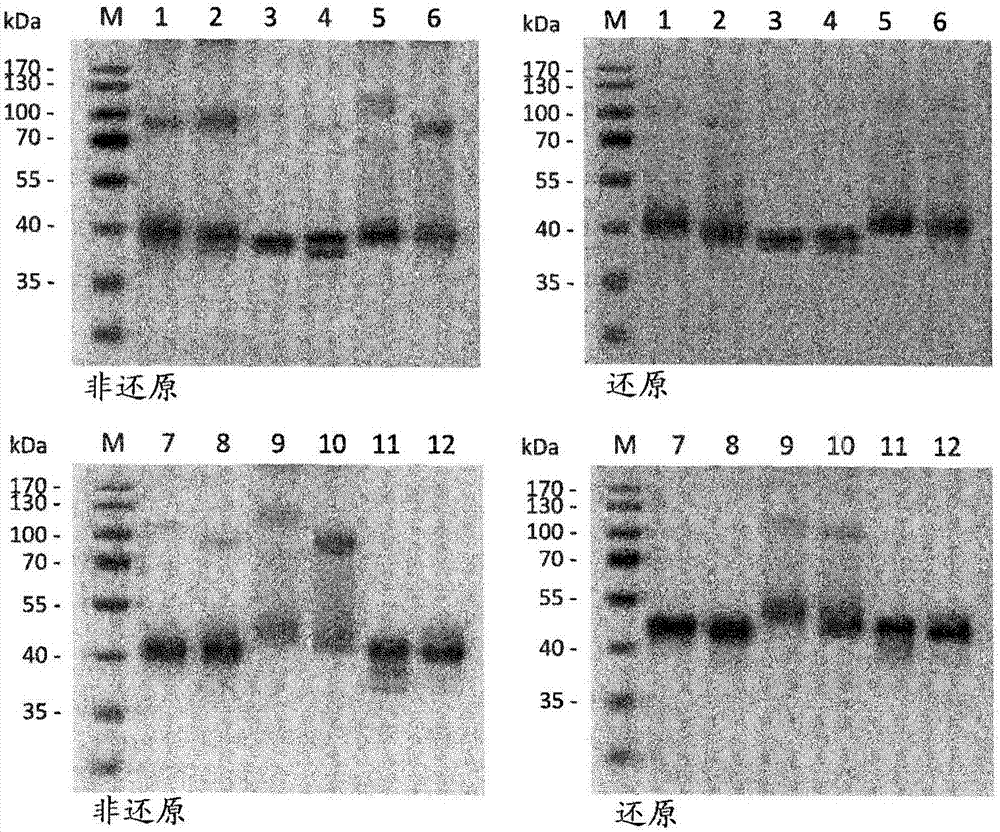
图2.在还原和非还原条件下使用12%聚丙烯酰胺凝胶的纯化的duokine之sds-page分析(1,cd40l-cd27l;2,cd27l-cd40l;3,cd40l-4-1bbl;4,4-1bbl-cd40l;5,cd27l-4-1bbl;6,4-1bbl-cd27l;7,cd40l-ox40l;8,ox40l-cd40l;9,cd27l-ox40l;10,ox40l-cd27l;11,4-1bbl-ox40l;12,ox40l-4-1bbl)。通过用考马斯亮蓝g250染色使蛋白质可视化。
图3a和b.duokine的尺寸排阻色谱(sec)分析表明融合蛋白的完整性。用yarrasec-2000(phenomenex)在0.5ml/分钟的流量下进行高效液相色谱(hplc)。使用甲状腺球蛋白、醇脱氢酶、牛血清白蛋白、碳酸酐酶和flag肽作为标准蛋白质。
图4.elisa中duokine(100nm)与固定化cd40-、cd27-、4-1bb-和ox40-fc融合蛋白的结合。所有duokine均与相应受体fc融合蛋白结合,并且未检测出交叉反应性。
图5a和b.elisa中duokine与固定化cd40-、cd27-、4-1bb-和ox40-fc融合蛋白的结合(n=3±sd)。对duokine以316nm的浓度开始一式两份地进行滴定。所有duokine均以计量依赖方式和低纳摩尔范围内的ec50值与相应受体fc融合蛋白结合。蛋白浓度根据三聚体分子。
图6a和b.通过流式细胞术分析的duokine(100nm)与表达cd40、cd27、4-1bb和ox40的ht1080细胞的结合。用pe标记的抗flag抗体检测结合的duokine(灰色,仅细胞;细线,用pe标记的抗flag抗体孵育的细胞;粗线,用duokine孵育的细胞)。
图7a和b.通过流式细胞术分析duokine的双特异性。在duokine(100nm)与表达cd40、cd27、4-1bb和ox40的ht1080细胞结合之后,使用对应受体fc融合蛋白(10nm)和pe标记的抗人fc抗体检测duokine。包含tnfr1-fc作为阴性对照(灰色,用pe标记的抗人fc抗体孵育的细胞;细线,用duokine和tnfr1-fc孵育的细胞;粗线,用cd40-、cd27-、4-1bb-或ox40-fc孵育的细胞)。
图8.在还原和非还原条件下使用10%聚丙烯酰胺凝胶的纯化的单链duokine之sds-page分析(1,sccd40l-sccd27l;2,sccd27l-sccd40l;3,sccd40l-sc4-1bbl;4,sc4-1bbl-sccd40l;5,sccd27l-sc4-1bbl;6,sc4-1bbl-sccd27l;7,sccd40l-scox40l;8,scox40l-sccd40l;9,sccd27l-scox40l;10,scox40l-sccd27l;11,sc4-1bbl-scox40l;12,scox40l-sc4-1bbl)。通过用考马斯亮蓝g250染色使蛋白质可视化。
图9a和b.单链duokine的尺寸排阻色谱(sec)分析表明融合蛋白的完整性。用yarrasec-2000(phenomenex)在0.5ml/分钟的流量下进行高效液相色谱(hplc)。使用甲状腺球蛋白、醇脱氢酶、牛血清白蛋白、碳酸酐酶和flag肽作为标准蛋白质。
图10.elisa中单链duokine(100nm)与固定化cd40-、cd27-、4-1bb-和ox40-fc融合蛋白的结合(n=3±sd)。所有单链duokine均与相应受体fc融合蛋白结合,并且未检测出交叉反应性。
图11a和b.elisa中单链duokine与固定化cd40-、cd27-、4-1bb-和ox40-fc融合蛋白的结合(n=3±sd)。对duokine以316nm的浓度开始一式两份地进行滴定。所有单链duokine均以计量依赖方式和低纳摩尔范围内的ec50值与相应受体fc融合蛋白结合。
图12a和b.通过流式细胞术分析的单链duokine(100nm)与表达cd40、cd27、4-1bb和ox40的ht1080细胞的结合。用pe标记的抗flag抗体检测结合的单链duokine(灰色,仅细胞;细线,用pe标记的抗flag抗体孵育的细胞;粗线,用单链duokine孵育的细胞)。
图13a和b.通过流式细胞术分析单链duokine的双特异性。在单链duokine(100nm)与表达cd40、cd27、4-1bb和ox40的ht1080细胞结合之后,使用对应受体fc融合蛋白(10nm)和pe标记的抗人fc抗体检测单链duokine。包含tnfr1-fc作为阴性对照(灰色,用pe标记的抗人fc抗体孵育的细胞;细线,用单链duokine和tnfr1-fc孵育的细胞;粗线,用单链duokine和cd40-、cd27-、4-1bb-或ox40-fc孵育的细胞)。
图14.在还原和非还原条件下使用4-15%聚丙烯酰胺凝胶的纯化的单链duokine之sds-page分析(1,sc4-1bbl-ehd2-sccd40l;2,sc4-1bbl-ehd2-sccd27l;3,sccd40l-sccd27l)。通过用考马斯亮蓝g250染色使蛋白质可视化。
图15.ehd2-scduokine的尺寸排阻色谱(sec)分析表明融合蛋白的完整性。用yarrasec-2000(pheuomenex)在0.5ml/分钟的流量下进行高效液相色谱(hplc)。使用甲状腺球蛋白、醇脱氢酶、牛血清白蛋白、碳酸酐酶和flag肽作为标准蛋白质。
图16.elisa中ehd2-scduokine(100nm)与固定化cd40-、cd27-、4-1bb-和ox40-fc融合蛋白的结合。所有ehd2-scduokine均与相应受体fc融合蛋白结合,并且未检测出交叉反应性。
图17.elisa中连接有ehd2的单链duokine与固定化cd40-、cd27-、4-1bb-和ox40-fc融合蛋白的结合(n=3±sd)。对ehd2-scduokine以316nm的浓度开始一式两份地进行滴定。所有ehd2-scduokine均以计量依赖方式和低纳摩尔范围内的ec50值与相应受体fc融合蛋白结合。
图18.通过流式细胞术分析ehd2-scduokine(100nm)与表达cd40、cd27、4-1bb的ht1080细胞的结合。用pe标记的抗flag抗体检测结合的ehd2-scduokine(灰色,单独细胞;细线,用pe标记的抗flag抗体孵育的细胞;粗线,用ehd2-scduokine孵育的细胞)。
图19.通过流式细胞术分析ehd2-scduokine的双特异性。在ehd2-scduokine(100nm)与表达cd40、cd27、4-1bb和ox40的ht1080细胞结合之后,使用对应的受体-fc融合蛋白(10nm)和pe标记的抗人fc抗体检测ehd2-scduokine。包含tnfr1-fc作为阴性对照(灰色,用pe标记的抗人fc抗体孵育的细胞;细线,用ehd2-scduokine和tnfr1-fc孵育的细胞;粗线,用ehd2-scduokine和cd40-、cd27-、4-1bb-或ox40-fc孵育的细胞)。
图20.通过il-8从表达cd40和4-1bb的ht1080细胞(n=3±sd)或者从表达cd27的ht1080细胞(n=1±sd)的释放分析的ehd2-scduokine的受体活化。将2×104个ht1080细胞用连续稀释的ehd2-scduokine进行孵育,并在18小时孵育后通过elisa检测上清液中il-8的量。包含单体配体及其单链衍生物作为对照。
图21.在用duokine或单链duokine刺激之后t细胞的增殖。将1.5×105个cfse染色的人pbmc(群体)在交联抗人cd3抗体作为初始次优刺激物存在下用连续稀释的duokine或单链duokine进行孵育。在6天之后,通过流式细胞术评估t细胞的增殖。
图22.用于编码tnfr配体的胞外结构域及其融合蛋白的mrna之体外转录的载体设计。使用质粒构建体pst1-hag-kozak-sec(opt)-insert-2hbgutr-a120作为用于编码tnf受体(tnfr)配体及其融合蛋白的rna之体外转录的模板。tnfr配体经insert编码的胞外结构域是功能活性同三聚体。产生那些tnf受体配体的两种不同种类的编码序列:(i)包含tnf受体的一个单胞外结构域因而编码非共价结合的三聚体的插入片段;和(ii)其中包含胞外结构域的三个拷贝的插入片段被短接头结构域(编码的氨基酸:g3sg3)分开因而编码共价结合的三聚体的单链构建体。使两种tnfr配体通过接头连接以产生其融合蛋白。命名:将编码人蛋白质序列的构建体简称为“h”,将鼠蛋白质序列简称为“m”。数字“1”和“3”表示编码的tnfr配体胞外结构域的拷贝量。
图23.ivt-rna电穿孔后融合蛋白的细胞内表达。对k562细胞用编码tnfr配体的胞外结构域或其融合蛋白的ivt-rna进行电穿孔。在电穿孔后6小时,用golgiplug和golgistop阻断蛋白质输出,并在孵育12小时后,对细胞分别进行cd27l、cd40l、ox40l或4-1bbl胞内染色。作为阴性对照,对k562细胞不用rna(mock)进行电穿孔并适当染色。(a)与h3_cd27l和h3_cd40l单构建体相比,在h3_cd40l-h3_cd27l构建体电穿孔后tnfr配体的胞内染色。(b)与h3_ox40l和h3_cd40l单构建体相比,在h3_cd40l-h3_ox40l构建体电穿孔后tnfr配体的胞内染色。(c)与h3_cd27l和h3_4-1bbl单构建体相比,在h3_4-1bbl-h3_cd27l构建体电穿孔后tnfr配体的胞内染色。(d)在h1_cd40l-h1_cd27l、h1_4-1bbl-h1_cd40l和h1_4-1bbl-h1_cd27l构建体电穿孔后tnfr配体的胞内染色。
图24.瞬时转染后tnf受体在稳定的ht1080和k562转染子上的细胞表面表达。(a)将稳定的ht1080的tnf受体转染子用抗cd27-pe、抗cd40-fitc、抗4-1bb-pe和抗ox40-pe染色。(b)对k562细胞用编码人cd27、cd40、4-1bb和ox40的全长编码序列的质粒进行电穿孔。在电穿孔后1天时,将细胞分别用抗cd27-pe、抗cd40-fitc、抗4-1bb-pe和抗ox40-pe染色。
图25.在反式呈现设置下tnfl(1)-tnfl(2)融合构建体产生的增强的tnf受体活化。对k562细胞在多孔电穿孔板(96孔)中用不同量的编码tnfr配体的胞外结构域或其融合蛋白的ivt-rna进行电穿孔。将rna量表示为相对于对应编码蛋白的pmolrna。在孵育过夜后,将上清液转移至两种对应的ht1080细胞系的稳定tnf受体转染子的汇合细胞层(见图24a)。将在前一天经mock电穿孔(作为对照)或经对应tnf受体质粒电穿孔的k562细胞添加至ht1080-tnfr转染子的汇合细胞层和上清液以产生用于融合蛋白的反式呈现设置(细胞对细胞反式激活(celltocelltransactivation))。在共同孵育8小时后,收集无细胞上清液,并且测量在tnf受体依赖性nf-κb活化后由ht1080细胞释放的il-8的浓度。(a)示出在用上清液孵育后因ht1080_cd40的活化而从经编码h3_cd27l-h3_cd40l的ivt-rna电穿孔的k562细胞释放il-8。h3_cd40l单构建体和没有反式呈现的融合构建体h3_cd27l-h3_cd40l(+k562_mock)在相对于编码蛋白至少1pmolrna的电穿孔后引起il-8分泌。在通过k562_cd27介导的反式呈现条件下,融合构建体h3_cd27l-h3_cd40l以与相对于编码蛋白约100倍更少量的ivt-rna相同诱导程度的cd40活化。(b)通过测量il-8分泌物未检测到没有反式呈现条件在编码h3_cd27l或h3_cd27l-h3_cd40l的ivt-rna的电穿孔后的cd27活化。在通过k562_cd40反式呈现的情况下,在h3_cd27l-h3_cd40l融合构建体的k562电穿孔后检测到cd27活化。(c)示出在用编码h3_cd27l-h3_ox40l的ivt-rna的上清液孵育后由ht1080_ox40的活化所引起的il-8释放。h3_ox40l单构建体和没有反式呈现的融合构建体h3_cd27l-h3_ox40l(+k562_mock)在相对于编码蛋白约1pmolrna及更多的电穿孔后产生il-8分泌物。在通过k562_cd27介导的反式呈现条件下,融合构建体h3_cd27l-h3_ox40l以与相对于编码蛋白约10倍更少量的ivt-rna相同诱导程度的cd40活化。(d)通过测量il-8分泌物未检测到没有反式呈现条件在编码h3_cd27l或h3_cd27l-h3_ox40l的ivt-rna的电穿孔后的cd27活化。在通过k562_ox40反式呈现的情况下,在h3_cd27l-h3_cd40lrna构建体的k562电穿孔后检测到cd27活化。(e)示出在用编码h3_cd27l-h3_4-1bbl的ivt-rna的上清液孵育后因ht1080_cd27的活化产生的il-8浓度。h3_cd27l单构建体和没有反式呈现的融合构建体h3_cd27l-h3_4-1bbl(+k562_mock)不诱导il-8分泌。在通过k562_4-1bb介导的反式呈现条件下,融合构建体h3_cd27l-h3_4-1bbl诱导cd27的活化。(f)h3_4-1bbl单构建体和没有反式呈现的融合构建体h3_cd27l-h3_4-1bbl(+k562_mock)不诱导il-8分泌。在通过k562_cd27介导的反式呈现条件下,融合构建体h3_cd27l-h3_4-1bbl诱导4-1bb的活化。(g)示出在用上清液孵育后因ht1080_cd40的活化而从经编码h3_41bbl-h3_cd40l和h1_41bbl-h1_cd40l的ivt-rna电穿孔的k562释放il-8。h3_cd40l单构建体和没有反式呈现的两种融合构建体(+k562_mock)在相对于编码蛋白至少1pmolrna的电穿孔后引起il-8分泌。在通过k562_41bb介导的反式呈现条件下,两种融合构建体h3_41bbl-h3_cd40l和h1_41bbl-h1_cd40l以与约10倍更少量的ivt-rna(关于编码蛋白)相同的程度诱导cd40活化。(h)h3_4-1bbl单构建体和没有反式呈现的两种融合构建体h3_41bbl-h3_cd40l和h1_41bbl-h1_cd40l(+k562_mock)不诱导il-8分泌。在通过k562_cd40介导的反式呈现条件下,这两种融合构建体在相同程度上诱导4-1bb的活化。
图26.h3_cd27l-h3_cd40l和h3_cd40l-h3_cd27l融合构建体对cd8+t细胞增殖的作用。对idc分别用编码h3_cd27l-h3_cd40l、h3_cd40l-h3_cd27l和单构建体h3_cd27l+h3_cd40l的密封蛋白(claudin)-6ivt-rna+ivt-rna或对照rna进行电穿孔。对cd8+t细胞(hla-a2+供体)用编码密封蛋白-6特异cd8+t细胞受体或编码tpte特异cd8+t细胞受体的ivt-rna进行电穿孔,然后用cfse染色。在通过facs分析cd8+t细胞的增殖之前将经电穿孔的idc和cd8+t细胞以1∶10的比例共培养5天。将对密封蛋白-6-tcr+cd8+t细胞cfse分析的代表性直方图示出于(a)中,对tpte-tcr+cd8+t细胞的示出于(b)中。通过flowjo软件根据表示细胞分裂的峰进行增殖的详细分析。通过这种方式,计算进入分裂的t细胞的百分比,表示为“%分裂细胞”;和进入分裂的细胞的平均分裂数,表示为“增殖指数”,二者示出于(c)中。施用h3_cd27l-h3_cd40l和h3_cd40l-h3_cd27l融合构建体二者引起抗原特异方式的cd8+t细胞提高的增殖,而施用编码两种对应tnfr配体的两种rna对增殖没有影响。
图27.h3_4-1bbl-h3_cd27l和h1_4-1bbl-h1_cd27l融合构建体对cd8+t细胞增殖的作用。对idc分别用编码h3_4-1bbl-h3_cd27l、h1_4-1bbl-h1_cd27l和单构建体h3_cd27l+h3_4-1bbl的密封蛋白-6ivt-rna+ivt-rna或对照rna进行电穿孔。对cd8+t细胞(hla-a2+供体)用编码密封蛋白-6特异cd8+t细胞受体或编码tpte特异cd8+t细胞受体的ivt-rna进行电穿孔,然后用cfse染色。在通过facs分析cd8+t细胞的增殖之前将经电穿孔的idc和cd8+t细胞以1∶10的比例共培养5天。将对密封蛋白-6-tcr+cd8+t细胞cfse分析的代表性直方图示出于(a)中,对tpte-tcr+cd8+t细胞的示出于(b)中。通过flowjo软件根据表示细胞分裂的峰进行增殖的详细分析。通过这种方式,计算进入分裂的t细胞的百分比,表示为“%分裂细胞”;和进入分裂的细胞的平均分裂数,表示为“增殖指数”,二者示出于(c)中。施用h3_4-1bbl-h3_cd27l和h1_4-1bbl-h1_cd27l融合构建体二者引起抗原特异方式的cd8+t细胞提高的增殖,而施用编码两种对应tnfr配体的两种rna对增殖没有影响。
图28.重组duokine对cd8+t细胞增殖的作用。对idc用密封蛋白-6ivt-rna进行电穿孔。对cd8+t细胞(hla-a2+供体)用编码密封蛋白-6特异cd8+t细胞受体的ivt-rna进行电穿孔,然后用cfse染色。在电穿孔后1天时,将idc和cd8+t细胞以1∶10的比例共培养4天;向共培养物中添加各自10nm的标示重组蛋白。通过facs分析cd8+t细胞增殖。将对密封蛋白-6-tcr+cd8+t细胞cfse分析的代表性直方图示出于(a)中。通过flowjo软件根据表示细胞分裂的峰进行增殖的详细分析。通过这种方式,计算进入分裂的t细胞的百分比,表示为“%分裂细胞”;和进入分裂的细胞的平均分裂数,表示为“增殖指数”,二者分别示出于(b)和(c)中。添加所有三种duokine均引起抗原特异方式的cd8+t细胞提高的增殖,而添加两种对应单独tnfr配体对增殖没有影响。
图29.duokine与固定化受体和pbmc的同时结合引起t细胞的活化和增殖。将200ng/孔受体fc于4℃下在微量滴定板上固定过夜。将残余结合位点用rpmi1640+10%fcs封闭1h。将连续稀释的duokine用固定化受体孵育1h,随后洗去未结合的蛋白。在交联抗人cd3抗体作为初始次优刺激物存在(或不存在)下将1.5×105个经cfse染色的人pbmc(群体)添加至微量滴定板。6天后,以流式细胞术通过cfse稀释评估cd4+和cd8+t细胞的增殖。
图30.单链duokine与固定化受体和pbmc的同时结合引起t细胞的活化和增殖。将200ng/孔受体fc于4℃下在微量滴定板上固定过夜。将残余结合位点用rpmi1640+10%fcs封闭1h。将连续稀释的scduokine用固定化受体孵育1h随后洗去未结合的蛋白。在交联抗人cd3抗体作为初始次优刺激物存在(或不存在)下将1.5×105个经cfse染色的人pbmc(群体)添加至微量滴定板。6天后,以流式细胞术通过cfse稀释评估cd4和cd8t细胞的增殖。
图31.所选duokine和单链duokine在人血浆中的稳定性。用50%人血浆制备200nm(功能性tnf配体单元)纯化的duokine和单链duokine。将样品在制备之后立即(0天)或者在37℃下孵育1天、3天和7天后于-20℃下进行冷冻。用elisa通过c末端同三聚体配体单元与固定化受体(150ng/孔)的结合和n末端flag标签的检测测定完整蛋白质的水平。从纯化的蛋白质的标准曲线内插经稀释的血浆样品中的蛋白浓度。将在第0天检测的融合蛋白的量设为100%。
图32.所选鼠duokine和单链duokine在cd1小鼠中的药代动力学性质。将25μg纯化的蛋白质以150μl的总体积注入雌性cd1小鼠(12至16周,30至35g,每种构建体3只小鼠)的尾静脉。在注射后3分钟、30分钟、1小时、2小时、6小时、1天和3天时采取血液样品,在冰上孵育30分钟,在4℃下以13,000g离心30分钟。在-20℃下储存血清样品。用elisa通过与对应于c末端配体的固定化受体(150ng/孔)的结合以及通过n末端flag标签检测测定融合蛋白的血清水平。通过内插法从纯化的蛋白质的标准曲线获得所有蛋白的血清浓度。为了比较,将第3分钟的浓度设为100%。用excel计算初始和终末半衰期(t1/2α3-60分钟,t1/2β1-24小时)及auc。
图33.人pbmc上的受体表达以及单链duokine与免疫细胞亚群的结合。在交联抗人cd3抗体作为初始次优刺激物存在或不存在下将2.5×105个人pbmc(群体)用10nm单链duokine进行孵育。在37℃下3天后,用流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd14、抗cd20和抗cd56)识别不同亚群,并通过检测其flag标签来评估单链duokine与不同亚群的结合。此外,对经刺激和未经刺激的pbmc不用单链duokine也进行孵育,在培育3天后识别亚群并通过抗体染色测定cd40、cd27、4-1bb和ox40的表面表达。
图34.顺式作用单链duokine与人免疫细胞的结合以及t细胞增殖的诱导。在交联抗人cd3抗体作为初始次优刺激物存在或不存在下将2.5×105个人pbmc(群体)用10nmsc4-1bbl-sccd27l进行孵育。在37℃下3天后,用流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd20和抗cd56)识别不同亚群,通过抗体染色测定cd27和4-1bb的表面表达,并通过检测其flag标签来评估单链duokine的结合。在交联抗人cd3抗体作为初始次优刺激物存在或不存在下将1.5×105个cfse标记的pbmc(群体,不同pbmc批次)用30、3、0.3或0nmsc4-1bbl-sccd27l进行孵育。6天后,用流式细胞术通过cfse稀释测定cd4和cd8t细胞的增殖。
图35.反式作用单链duokine与人免疫细胞的结合以及t增殖的诱导。在交联抗人cd3抗体作为初始次优刺激物存在或不存在下将2.5×105个人pbmc(群体)用10nmsc4-1bbl-sccd40l进行孵育。在37℃下3天后,用流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd20和抗cd56)识别不同亚群,通过抗体染色测定cd40和4-1bb的表面表达,并通过检测其flag标签来评估单链duokine的结合。在交联抗人cd3抗体作为初始次优刺激物存在或不存在下将1.5×105个cfse标记的pbmc(群体,不同pbmc批次)用30、3、0.3或0nmsc4-1bbl-sccd40l进行孵育。6天后,用流式细胞术通过cfse稀释测定cd4和cd8t细胞的增殖。
图36.反式作用单链duokine与人免疫细胞的结合以及t细胞增殖的诱导。在交联抗人cd3抗体作为初始次优刺激物存在或不存在下将2.5×105个人pbmc(群体)用10nmsccd40l-sccd27l进行孵育。在37℃下3天后,用流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd20和抗cd56)识别不同亚群,通过抗体染色测定cd40和cd27的表面表达,并通过检测其flag标签来评估单链duokine的结合。在交联抗人cd3抗体作为初始次优刺激物存在或不存在下将1.5×105个cfse标记的pbmc(群体,不同pbmc批次)用30、3、0.3或0nmsccd40l-sccd27l进行孵育。6天后,用流式细胞术通过cfse稀释测定cd4和cd8t细胞的增殖。
发明详述
尽管下文中详细地描述了本发明,但是应理解,本发明不限于本文中所述的特定方法学、方案和试剂,因为这些可改变。还应理解,本文中所使用的术语只是为了描述特定实施方案的目的,而不旨在限制将仅受所附权利要求书限制的本发明的范围。除非另外限定,否则本文中所使用的所有技术和科学术语均具有与本领域普通技术人员通常所理解的相同的含义。
下文中,将描述本发明的要素。这些要素和具体实施方案一起列出,然而应理解,其可以以任何方式和任何数量组合以产生另外的实施方案。所描述的各个实施例和优选实施方案不应解释为将本发明仅限制于明确描述的实施方案。该说明书应理解为支持并包括将明确描述的实施方案和任何数量的公开和/或优选要素组合的实施方案。此外,除非上下文另外指出,否则本申请中所有描述的要素的任何排列和组合应视为被本申请的说明书公开。
优选地,将本文中的术语定义为如“amultilingualglossaryofbiotechnologicalterms:(iupacrecommendations)”,h.g.w.leuenberger,b.nagel和h.
除非另外指出,否则本发明的实施将采用本领域的文献中阐明的常规化学、生物化学、细胞生物学、免疫学和重组dna技术的方法(参见例如,molecularcloning:alaboratorymanual,第二版,j.sambrook等编,coldspringharborlaboratorypress,coldspringharbor1989)。
除非上下文另外需要,否则下面的整个说明书和权利要求书中,词语“包含/包括”及其变化形式应理解为意指包括所述要素、整体或步骤或者要素、整体或步骤的组,而不排除任何其他要素、整体或步骤或者要素、整体或步骤的组,尽管在一些实施方案中,可能不包括这样的其他要素、整体或步骤或者要素、整体或步骤的组,即,主题在于包括所述要素、整体或步骤或者要素、整体或步骤的组。除非本文中另外指出或者与上下文明确地相矛盾,否则在描述本发明的上下文中(尤其在权利要求书的上下文中),没有数量词修饰的名词表示一个/种或更多个/种。本文中值的范围的记载仅旨在用作单独提及落在所述范围内的各个单独的值的速记法。除非本文中另外指出,否则各个单独的值被并入本说明书,就像其在本文中被单独记载。除非本文中另外指出或者与上下文明确地相矛盾,否则本文中所述所有方法可以以任何合适的顺序进行。本文中提供的任何和所有实例或示例性语言(例如,“例如”)的使用仅旨在更好地举例说明本发明,而不对本发明另外要求的范围提出限制。本说明书中的语言不应被解释为指明对实施本发明必需的任何未要求保护的要素。
整个本说明书的正文中引用了若干文献。本文中引用的各个文献(包括所有专利、专利申请、科学出版物、生产商说明书、用法指导等),无论在上文还是下文中,均通过全文引用并入本文。本文中的内容都不应解释为承认本发明未被授权先于现有发明的公开内容。
术语“细胞因子”一般是指在细胞信号传导中重要且通过受体作用的蛋白质。在本发明的上下文中,该术语特别地指tnf超家族的配体,更特别地这些配体的形成可溶性活性同三聚体的胞外结构域。
本文中的术语“tnf超家族的配体”还包括给定的tnf超家族的配体的变体,前提是这些变体是功能性的,更特别地具有能形成能够与所述配体的受体结合的同三聚体的胞外结构域。
根据本发明的术语“tnf超家族的配体的变体”特别地指突变体、剪接变体、构象变体、同种型、等位基因变体、物种变体和物种同源物,特别是天然存在的那些。等位基因变体涉及基因正常序列的改变,其意义经常不清楚。完整基因测序通常识别给定基因的多种等位基因变体。物种同源体是具有不同于给定核酸或氨基酸序列的物种来源的核酸或氨基酸序列。术语“tnf超家族的配体的变体”应包括任何的转移后修饰的变体和构象变体。
根据本发明,tnf超家族的第一配体和第二配体优选地选自cd40l、cd27l、4-1bbl、ox40l、april、cd30l、eda-a1、eda-a2、fasl、gitrl、light、lt-α、tl1a、tnf-α、trail、rankl和tweak,更优选地选自cd40l、cd27l、4-1bbl和ox40l。
cd40配体(cd40l)也称作cd154、tnfsf5、trap或gp39,是属于tnf超家族的ii型跨膜糖蛋白。在一个实施方案中,本文中的术语cd40l是指人cd40l。人cd40l的uniprot登记号为p29965。在一个实施方案中,cd40l具有seqidno:1的氨基酸序列。
cd27配体(cd27l)也称作cd70或tnfsf7,是属于tnf超家族的ii型跨膜糖蛋白。在一个实施方案中,本文中的术语cd27l是指人cd27l。人cd27l的uniprot登记号为p32970。在一个实施方案中,cd27l具有seqidno:2的氨基酸序列。
4-1bb配体(4-1bbl)是属于tnf超家族的ii型跨膜糖蛋白,也称作tnfsf9。在一个实施方案中,本文中的术语4-1bbl是指人4-1bbl。人4-1bbl的uniprot登记号为p41273。在一个实施方案中,4-1bbl具有seqidno:3的氨基酸序列。
ox40配体(ox40l)也称作gp34或tnfsf4,是属于tnf超家族的ii型跨膜糖蛋白。在一个实施方案中,本文中的术语ox40l是指人ox40l。人ox40l的uniprot登记号为p23510。在一个实施方案中,ox40l具有seqidno:4的氨基酸序列。
增殖诱导配体(april)也称作tall-2、trdl-1或tnfsf13,是为tnf超家族成员的ii型跨膜蛋白。在一个实施方案中,本文中的术语april是指人april。人april的uniprot登记号为o75888。
cd30配体(cd30l)也称作tnfsf8,是属于tnf超家族的ii型膜蛋白。在一个实施方案中,本文中的术语cd30l是指人cd30l。人cd30l的uniprot登记号为p32971。
外异蛋白-a1(ectodysplasin-a1,eda-a1)是属于tnf超家族的ii型跨膜蛋白。其为外异蛋白-a(eda)的剪接变体。在一个实施方案中,本文中的术语eda-a1是指人eda-a1。人eda-a1的uniprot登记号为q92838-1。
外异蛋白-a2(eda-a2)是属于tnf超家族的ii型跨膜蛋白。其为外异蛋白-a(eda)的剪接变体。在一个实施方案中,本文中的术语eda-a2是指人eda-a2。人eda-a2的uniprot登记号为q92838-3。
fas配体(fasl)也称作cd95l或tnfsf6,是属于tnf超家族的ii型跨膜蛋白。在一个实施方案中,本文中的术语fasl是指人fasl。人fasl的uniprot登记号为p48023。
gitr配体(gitrl)是属于tnf超家族的ii型跨膜蛋白,且已被命名为tnfsf18。在一个实施方案中,本文中的术语gitrl是指人gitrl。人gitrl的uniprot登记号为q9ung2。
light也称作hveml或tnfsf14,是属于tnf超家族的ii型跨膜蛋白。在一个实施方案中,本文中的术语light是指人light。人light的uniprot登记号为o43557。
淋巴毒素-α(lt-α)也称作tnf-β或tnfsf1,是tnf超家族的成员。在一个实施方案中,本文中的术语lt-α是指人lt-α。人lt-α的uniprot登记号为p01374。
tl1a是属于tnf超家族的ii型跨膜蛋白,且已被命名为tnf超家族成员15(tnfsf15)。在一个实施方案中,本文中的术语tl1a是指人tl1a。人tl1a的uniprot登记号为o95150-1。
肿瘤坏死因子α(tnf-α)也称作恶液质素或tnfsf2,是属于tnf超家族的ii型跨膜蛋白。在一个实施方案中,本文中的术语tnf-α是指人tnf-α。人tnf-α的uniprot登记号为p01375。
tnf相关的凋亡诱导配体(trail)也称作apo-2配体或tnfsf10,是属于tnf超家族的ii型跨膜蛋白。在一个实施方案中,本文中的术语trail是指人trail。人traiil的uniprot登记号为p50591。
nf-kb的受体活化剂(rank)配体(rankl)也称作trance、odf、opgl或tnfsf11,是属于tnf超家族的ii型跨膜蛋白。在一个实施方案中,本文中的术语rankl是指人rankl。人rankl的uniprot登记号为o14788。
tweak是属于tnf超家族的ii型跨膜蛋白,也称作apo3配体或tnfsf12。在一个实施方案中,本文中的术语tweak是指人tweak。人tweak的uniprot登记号为o43508。
在一个实施方案中,第一配体的受体和第二配体的受体位于同一细胞上(“顺式”),其中优选所述第一配体和所述第二配体选自cd27l、4-1bbl和ox40l。在一个实施方案中,所述细胞为t细胞,优选cd4+和/或cd8+t细胞。在一个实施方案中,所述t细胞为活化t细胞。
在另一个实施方案中,第一配体的受体和第二配体的受体位于不同细胞上(“反式”)。所述不同细胞可以是相同类型或不同类型。在一个实施方案中,所述不同细胞为抗原呈递细胞(apc),例如树突细胞和t细胞。在另一个实施方案中,所述不同细胞为b细胞和t细胞。在一个实施方案中,第一配体或第二配体为cd40l,而相应另一配体选自cd27l、4-1bbl和ox40l。在一个实施方案中,所述t细胞为cd4+和/或cd8+t细胞。在一个实施方案中,所述t细胞为活化t细胞。
在一个实施方案中,细胞因子融合蛋白活化第一配体的受体和/或第二配体的受体。在一个实施方案中,细胞因子融合蛋白为顺式活化细胞因子融合蛋白,同时活化位于同一细胞上的第一配体的受体和第二配体的受体。在另一个实施方案中,细胞因子融合蛋白为反式活化细胞因子融合蛋白,同时活化位于不同细胞上的第一配体的受体和第二配体的受体。在一个实施方案中,细胞因子融合蛋白活化表达第一配体和/或第二配体的受体的细胞中的nf-κb途径和/或诱导从其释放il-8。
在一个实施方案中,细胞因子融合蛋白活化t细胞和/或诱导t细胞的增殖。在一个实施方案中,细胞因子融合蛋白诱导t细胞的抗原特异增殖。在一个实施方案中,所述t细胞为cd4+和/或cd8+t细胞。在一个实施方案中,所述t细胞为活化t细胞。
本文中的术语“胞外结构域”是指包含tnf同源结构域(thd)的tnf超家族的配体的胞外c末端部分。胞外结构域的特征在于其形成能够与配体的受体结合的(同-)三聚体的能力,还可称作“受体结合结构域”。
根据本发明可使用的胞外结构域的“片段或变体”为功能胞外结构域的功能片段或变体,其具有形成能够与配体的受体结合的(同-)三聚体的能力。因此,合适的配体或变体至少包含功能性tnf同源结构域(thd)。
本文中可互换使用的术语“部分”或“片段”是指连续原件。例如,结构的一部分(例如氨基酸序列或蛋白)是指所述结构的连续元件。蛋白质序列的一部分或片段优选地包含所述蛋白质序列的至少6个,特别地至少8个、至少12个、至少15个、至少20个、至少30个、至少50个、至少100个、至少150个或至少200个连续氨基酸的序列。
为了本发明的目的,氨基酸序列的“变体”包括氨基酸插入变体、氨基酸添加变体、氨基酸缺失变体和/或氨基酸替换变体。包括在蛋白质的n末端和/或c末端处缺失的氨基酸缺失变体也称作n末端和/或c末端截短变体。
氨基酸插入变体包含单个或两个或更多个氨基酸在特定氨基酸序列中的插入。在具有插入的氨基酸序列变体的情况下,一个或更多个氨基酸残基被插入氨基酸序列中的特定位点,虽然对所得产物适当筛选下的随机插入也有可能。
氨基酸添加变体包含一个或更多个氨基酸(例如1、2、3、5、10、20、30、50或更多个氨基酸)的氨基和/或羧基末端融合。
氨基酸缺失变体的特征在于一个或更多个氨基酸从序列中的去除,例如在于1、2、3、5、10、20、30、50或更多个氨基酸的去除。缺失可在蛋白质的任何位置。
氨基酸替换变体的特征在于序列中的至少一个残基被除去且另一残基被插入其位置。给出的优选是同源蛋白或肽之间不保守的氨基酸序列中位置上的修饰和/或用具有相似性质的氨基酸取代氨基酸。优选地,蛋白质变体中的氨基酸替换为保守氨基酸替换。保守氨基酸替换包括氨基酸被同一氨基酸家族的另一氨基酸,即,在其侧链上(例如,在电荷和/或尺寸方面)相关的氨基酸的替换。天然存在的氨基酸通常分为4个家族:酸性(天冬氨酸、谷氨酸)、碱性(赖氨酸、精氨酸、组氨酸)、非极性(丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、和不带电极性(甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸)氨基酸。有时将苯丙氨酸、色氨酸和酪氨酸共同划分为芳香族氨基酸。
优选地给定氨基酸序列与为所述给定氨基酸序列变体的氨基酸序列之间的相似度、优选地同一性为至少约60%、65%、70%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。优选地对氨基酸区域给定的相似度或同一性为参照氨基酸序列全长的至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或约100%。例如,如果参照氨基酸序列由200个氨基酸组成,则优选地给定的相似度或同一性为至少约20、至少约40、至少约60、至少约80、至少约100、至少约120、至少约140、至少约160、至少约180或约200个氨基酸,优选连续氨基酸。在一些优选实施方案中,相似度或同一性为参照氨基酸序列的全长给出。
用于确定序列相似性,优选序列同一性的比对可以用本领域已知工具进行,优选使用最佳序列比对,例如使用align、使用标准设置,优选emboss::needle,matrix:blosum62,gapopen10.0,gapextend0.5。
“序列相似性”表示相同或代表保守氨基酸替换的氨基酸之百分比。两个氨基酸序列之间的“序列同一性”表示这些序列之间相同的氨基酸之百分比。
术语“同一性百分比”旨在表示在最佳比对后获得的待比较的两个序列之间相同的氨基酸残基之百分比,该百分比是单纯地统计学的,并且所述两个序列之间的差异在其全长内随机分布。两个氨基酸序列之间的序列比较常规地通过在对其进行最佳比对后比较这些序列来进行,所述比较通过区段或通过“比较窗”来进行以识别和比较序列相似的局部区域。除人工地以外,用于比较的序列的最佳比对可通过smithandwaterman,1981,adsapp.math.2,482的局部同源性算法,通过neddleman和wunsch,1970,j.mol.biol.48,443的局部同源性算法,通过pearson和lipman,1988,proc.natlacad.sci.usa85,2444的相似性检索法,或者通过使用这些算法的计算机程序(wisconsingeneticssoftwarepackage,geneticscomputergroup,575sciencedrive,madison,wis.中的gap、bestfit、fasta、blastp、blastn和tfasta)产生。
同一性百分比如下计算:确定进行比较的两个序列之间相同位置的数目,将该数目除以所比较的位置的数目,并且将所得结果乘以100以获得这两个序列之间的同一性百分比。
术语“融合蛋白”一般是指通过将两个或更多个不同(多)肽或蛋白,优选头对尾(即,n末端对c末端或者反之)连接而产生的蛋白,产生具有源自每个原始蛋白的功能特性的单蛋白。根据本发明,术语“细胞因子融合蛋白”还涵盖不同融合蛋白的多聚体(例如,二聚体或三聚体)复合物,这在本文中也称作“亚基”。优选地,亚基非共价或共价(例如,通过二硫键)结合形成细胞因子融合蛋白。
根据本发明的优选亚基具有如本文中限定的以下通式:
n’-a-l-b-c’(式ii),
其中,优选地,这些亚基中的三个通过第一配体的胞外结构域或者其片段或变体和第二配体的胞外结构域或者其片段或变体非共价缔合以形成细胞因子融合蛋白。
根据本发明的另一种优选亚基具有如本文中限定的以下通式:
n’-a-la-a-la-a-l-b-lb-b-lb-b-c’(式i),
其中l还包含允许形成多聚化、优选二聚化细胞因子融合蛋白的多聚化结构域、优选二聚化结构域。
本文中的术语“区段”是指包含tnf超家族之配体的三个共价连接的胞外结构域或者其片段或变体的分子单元/实体。在一个实施方案中,区段具有通式a-la-a-la-a或b-lb-b-lb-b,其中a、b、la和lb如本文中所限定。在一个实施方案中,区段包含根据seqidnos:9至12之一的氨基酸序列或者由其组成。
本文中的术语“共价连接”是指通过共价键或通过共价接头分子(例如肽接头)的连接。
本文中使用的术语“肽接头”是指适于结合/连接蛋白质部分(例如tnf超家族之配体的胞外结构域、或者其区段、或者由这些胞外结构域形成的同三聚体)的肽。根据本发明的肽接头可具有任何长度,即包含任何数目的氨基酸残基。然而,优选足够长以提供足够程度的柔性,以防止结合/连接的部分干扰彼此的活性——例如,tnf超家族之配体的胞外结构域形成能够与所述配体的受体结合的同三聚体的能力,和/或两个不同同三聚体例如经由空间位阻与同一细胞上(“顺式”)或不同细胞上(“反式”)的两个不同受体结合并允许恰当蛋白折叠的能力;还优选足够短以提供在细胞中的稳定性(例如,蛋白水解稳定性)。
在一些优选实施方案中,肽接头的长度为1至30个氨基酸。因此,根据本发明,肽接头可由单个氨基酸残基构成。优选地,长肽接头将第一配体的胞外结构域或者其片段或变体与第二配体的胞外结构域或者其片段或变体(例如,第一同三聚体与第二同三聚体或者第一区段与第二区段)连接,而通常来说,短肽接头用于分别将第一或第二配体的两个胞外结构域或者其片段或变体(即,同一配体的两个胞外结构域或者其片段或变体)连接。在配体4-1bbl的情况下,优选将长肽接头用于连接两个其胞外结构域或者其片段或变体。短肽接头可由12或更少(例如11、10、9、8、7、6、5、4、3、2或1个)氨基酸、并且优选地1至7个氨基酸组成。长肽接头可由12或更多(例如12至30或12至25或12至20个)氨基酸组成。
肽接头的氨基酸可选自所有天然或非天然存在的氨基酸,其中优选氨基酸甘氨酸(gly,g)、丝氨酸(ser,s)和苏氨酸(thr,t)。在一个实施方案中,肽接头为富含甘氨酸-丝氨酸-苏氨酸的接头或富含甘氨酸-丝氨酸的接头,其中至少50%、优选至少60%、更优选至少70%、更优选至少80%、甚至更优选至少90%的氨基酸为分别为甘氨酸或丝氨酸或苏氨酸残基或者甘氨酸或丝氨酸残基。在另一个实施方案中,氨基酸选自甘氨酸、丝氨酸和苏氨酸,即,肽接头仅由甘氨酸、丝氨酸和苏氨酸残基构成(称作甘氨酸-丝氨酸-苏氨酸接头)。在另一个实施方案中,肽接头仅由甘氨酸和丝氨酸残基构成(称作甘氨酸-丝氨酸接头)。
根据本发明的优选肽接头具有通式(ggggx)n,其中x在每次出现时独立地选自s和t,n为选自1至6、优选地1至5的整数;或者选自gxg、ggxgg和gggxggg的通式,其中x为s或t。
优选的短肽接头具有选自gxg、ggxgg、gggxggg和ggggxgggg的通式,其中x为s或t,优选s。特别优选的短肽接头为gggxggg,其中x为s或t,优选s。
优选的长肽接头具有通式(ggggx)n,其中x在每次出现时独立地选自s和t,且n为选自3至6、优选3至5、更优选3和4的整数。特别优选的长肽接头选自(ggggs)3(seqidno:19)、ggggsgggtggggs(seqidno:20)和(ggggs)4(seqidno:21)。
优选地,在细胞因子融合蛋白包含具有如本文中限定的式i的通式的分子/结构的情况下,
l包含如本文中限定的长肽接头和/或
la和lb在每次出现时独立地选自共价键(例如,肽键)、如本文中限定的短肽接头和如本文中限定的长肽接头。
特别地,在a或b包含4-1bbl的胞外结构域或者其片段或变体的情况下,la或lb在每次出现时独立地选自如本文中限定的长肽接头。优选地,在a和b都不包含4-1bbl的胞外结构域或者其片段或变体的情况下,la和lb在每次出现时独立地选自共价键(例如,肽键)和如本文中限定的短肽接头。
根据本发明,la和lb可相同或不同。
根据本发明,在细胞因子融合蛋白包含具有如本文中限定的式i的通式的分子/结构的情况下,
l还可包含允许细胞因子融合蛋白多聚化的多聚化结构域。
在这样的一些情况下,l可包含如本文中限定的肽接头,其中已插入多聚化结构域。在一个替选实施方案中,l可包含插入多聚化结构域的两个如本文中限定的肽接头,其中所述两个肽接头可相同或不同。在一个实施方案中,两个肽接头选自如本文中限定的短肽接头。在另一个实施方案中,多聚化结构域表示由l包含的肽接头。
多聚化可通过非共价相互作用和/或共价相互作用发生,特别地通过多个(例如,2、3或4,优选2或3,更优选2个)多聚化结构域之间的一个或更多个二硫键发生。
合适的多聚化结构域是本领域技术人员已知的,并且包括例如三聚化结构域,例如生腱蛋白(tenascin)三聚体基序、胶原凝集素(collectin)三聚化结构域和链霉亲和素;以及二聚化结构域,例如ige重链结构域2(ehd2)、igm重链结构域2(mhd2)、igg重链结构域3(ghd3)、iga重链结构域3(ahd2)、igd重链结构域3(dhd3)、ige重链结构域4(ehd4)、igm重链结构域4(mhd4)、fc结构域和子宫珠蛋白二聚化结构域。在一个实施方案中,二聚化结构域为ehd2结构域或mhd2结构域,例如,如wo2013/156148a1中所述。在一个实施方案中,二聚化结构域为人ehd2结构域,优选地包含seqidno:23的氨基酸序列或者由其组成。还包含前述结构域中任一种的功能变体,例如,已经被修饰以延长其半衰期和/或提高其效力的结构域。合适的修饰是本领域技术人员已知的,并且包括但不限于如zalevsky,j.etal.等(2010),naturebiotechnology,28(2):157-9中所述提高其对fcrn的亲合力的fc结构域的修饰(例如,n434s、v259i/v308f、m252y/s254t/t256e、m428l/n434s和v259i/v308f/m428l)。
在细胞因子融合蛋白包含具有如本文中限定的式ii的通式的分子/结构(或至少一个,优选三个亚基)的情况下,
l优选地包含如本文中限定的长肽接头。
如本文中所述的肽接头可用非肽分子替换,例如,用适当长度的非肽低聚物和聚合物替换。本发明中明确地包含这样的一些等价实施方案。
优选地,在根据本发明的细胞因子融合蛋白中,
-第一配体为cd40l,并且第二配体为cd27l;
-第一配体为cd27l,并且第二配体为cd40l;
-第一配体为cd40l,并且第二配体为4-1bbl;
-第一配体为4-1bbl,并且第二配体为cd40l;
-第一配体为cd27l,并且第二配体为4-1bbl;
-第一配体为4-1bbl,并且第二配体为cd27l;
-第一配体为cd40l,并且第二配体为ox40l;
-第一配体为ox40l,并且第二配体为cd40l;
-第一配体为cd27l,并且第二配体为ox40l;
-第一配体为ox40l,并且第二配体为cd27l;
-第一配体为ox40l,并且第二配体为4-1bbl;或者
-第一配体为4-1bbl,并且第二配体为ox40l。
在一个实施方案中,细胞因子融合蛋白包含具有如本文中限定的式ii的通式的分子/结构(或至少一个、优选三个亚基),其中第二配体(即c末端配体)为cd40l。
“允许检测和/或分离细胞因子融合蛋白的标记或标签”意指包括用于这些目的的本领域已知的任何标记/标签。特别优选的是亲合力标签,例如壳多糖结合蛋白(cbp)、麦芽糖结合蛋白(mbp)、谷胱甘肽-s-转移酶(gst)和聚(his)(例如,his6);增溶标签,例如硫氧还蛋白(trx)和聚(nanp);色谱标签,例如flag标签;表位标签,例如v5标签、myc标签和ha标签;以及荧光或发光标记或标签,例如荧光蛋白(例如,gfp、yfp、rfp等)、荧光染料和萤光素酶。在一个实施方案中,标记/标签为flag标签。
(多)肽标记或标签的氨基酸序列可在细胞因子融合蛋白的氨基酸序列内的任何位置引入,并且可以例如采取所编码蛋白结构内(例如,在任何本文中所述肽接头内或者甚至在第一和第二配体的胞外结构域内,只要标记/标签不妨碍其功能即可)环的形状,或者其可以是n末端或c末端融合的。标记或标签还可包含允许标记或标签从细胞因子融合蛋白去除的切割位点。类似地,非肽标记或标签(例如荧光染料)可在任何合适位点与细胞因子融合蛋白缀合。
根据本发明的细胞因子融合蛋白还可包含用于促进分子的分泌的氨基酸序列,例如n末端分泌信号。优选地,分泌信号是允许充分通过分泌途径和/或分泌到胞外环境的信号序列。优选地,分泌信号序列是可切割和从成熟细胞因子融合蛋白去除的。分泌信号序列优选地相对于细胞因子融合蛋白在其中产生的细胞或生物体进行选择。在一个实施方案中,分泌信号序列包含seqidno:15或seqidno:22的氨基酸序列或者由其组成。
本发明的细胞因子融合蛋白还可包含用于例如增强对特定细胞类型的选择性的结合结构域。这可以例如通过提供与在所述细胞类型的表面上表达的特异抗原结合的结合结构域来获得。
根据本发明的细胞因子融合蛋白还可包含提高所述细胞因子融合蛋白的稳定性的一种或更多种修饰。术语细胞因子融合蛋白的“稳定性”涉及细胞因子融合蛋白的“半衰期”(例如体内)。“半衰期”涉及消除分子的一半活性、量或数目所需的时间。
细胞因子融合蛋白可以例如与半衰期延长分子缀合。这样的分子是本领域技术人员已知的,并且包括含例如白蛋白、白蛋白结合结构域、免疫球蛋白结合结构域、fcrn结合基序,并且特别是聚合物。特别优选的聚合物包括聚乙二醇(peg)、羟乙基淀粉(hes)、聚唾液酸和peg模拟肽序列。
根据本发明的术语“结合”优选地涉及特异性结合。如果结合剂(例如根据本发明的细胞因子融合蛋白)能够与预定靶结合而不能与其他靶结合,则其对所述预定靶是特异性的。
根据本发明,“核酸序列”优选为脱氧核糖核酸(dna)或核糖核酸(rna),更优选rna(例如,mrna),最优选体外转录rna(ivtrna)或合成的rna。根据本发明,核酸分子可以是单链或双链并且线性或共价闭合以形成环的分子形式。
在本发明的上下文中,术语“dna”涉及包含脱氧核糖核苷酸残基并且优选完全或基本上由脱氧核糖核苷酸残基构成的分子。“脱氧核糖核苷酸”涉及在β-d-呋喃核糖基的2’位处没有羟基的核苷酸。术语“dna”包括分离的dna,例如部分或完全纯化的dna、基本上纯的dna、合成的dna和重组产生的dna,并且包括通过一个或更多个核苷酸的添加、缺失、替换和/或改变而不同于天然存在的dna的经修饰的dna。这样的改变可包括非核苷酸物质(例如在dna的末端或内部,例如dna的一个或更多个核苷酸)的改变。dna分子中的核苷酸还可包含非标准核苷酸,例如非天然存在的核苷酸或化学合成的核苷酸。这些改变的dna可以指天然存在的dna的类似物或同型物。
在本发明的上下文中,术语“rna”涉及包含核糖核苷酸残基且优选完全或基本上由核糖核苷酸残基构成的分子。“核糖核苷酸”涉及在β-d-呋喃核糖基的2’位处具有羟基的核苷酸。术语“rna”包括分离的rna,例如部分或完全纯化的rna、基本上纯的rna、合成的rna和重组产生的rna,并且包括通过一个或更多个核苷酸的添加、缺失、替换和/或改变而不同于天然存在的rna的经修饰的rna。这样的改变可包括非核苷酸物质(例如在rna的末端或内部,例如rna的一个或更多个核苷酸)的改变。rna分子中的核苷酸还可包含非标准核苷酸,例如非天然存在的核苷酸或化学合成的核苷酸或脱氧核苷酸。这些改变的rna可以指天然存在的rna的类似物或同型物。根据本发明,“rna”是指单链rna或双链rna。
根据本发明,术语“信使rna(mrna)”涉及可通过使用dna模板产生并且可编码肽或蛋白的“转录物”。通常来说,mrna包含5’-非翻译区、蛋白编码区和3’-非翻译区。在本发明的上下文中,mrna可通过从dna模板体外转录而产生。体外转录方法论是技术人员已知的。例如,可商购获得多种体外转录试剂盒。
根据本发明,rna可被修饰。例如,rna可通过对rna具有稳定作用的一种或更多种修饰而稳定化。
如根据本发明使用的rna的上下文中的术语“修饰”包括非天然存在于所述rna中的rna的任何修饰。
在本发明的一个实施方案中,根据本发明使用的rna不具有未加帽5′-三磷酸。这样的未加帽5′-三磷酸的去除可以通过用磷酸酶处理rna来实现。
根据本发明的rna可具有经修饰的天然存在的或非天然存在的(合成的)核糖核苷酸以提高其稳定性和/或降低细胞毒性和/或调节其免疫刺激潜能。例如,在一个实施方案中,在根据本发明使用的rna中,尿苷被假尿苷部分地或完全地取代,优选完全地取代。
在一个实施方案中,术语“修饰”涉及提供具有5’-帽或5’-帽类似物的rna。术语“5’-帽”是指见于mrna分子的5′-末端的帽结构,并且一般由通过独特的5′至5′三磷酸酯键与mrna连接的鸟苷核苷酸组成。在一个实施方案中,该鸟苷在7位被甲基化。术语“常规5’-帽”是指天然存在的rna5’-帽,优选7-甲基鸟苷帽(m7g)。在本发明的上下文中,术语“5’-帽”包括5’-帽类似物,其类似rna帽结构且经修饰而具有稳定rna(如果附着在其上)的能力,优选体内和/或细胞内。提供具有5’-帽或5’-帽类似物的rna可通过在所述5’-帽或5’-帽类似物的存在下dna模板的体外转录来实现,其中所述5’-帽并被共同转录并入产生的rna链中,或者所述rna可以例如通过体外转录产生,并且5’-帽可使用加帽酶(例如痘苗病毒的加帽酶)转录后产生。
rna可包含其他修饰。例如,在本发明中使用的mrna的修饰可以是天然存在的聚(a)尾的延长或截短。
术语rna的“稳定性”涉及rna的“半衰期”。“半衰期”涉及消除分子的一半活性、量或数目所需的时间。在本发明的上下文中,rna的半衰期指示所述rna的稳定性。
根据本发明,如果希望降低rna的稳定性,则还可以修饰rna以干扰如上所述提高rna的稳定性的要素的功能。
根据本发明,rna可通过化学合成或者通过适当dna模板的体外转录获得。在本发明的上下文中,术语“转录”涉及dna序列中的遗传密码被转录成rna的过程。其后,rna可被翻译成蛋白质。根据本发明,术语“转录”包括“体外转录”,其中术语“体外转录”涉及其中rna(特别是mrna)被优选地使用合适的细胞提取物在无细胞系统中体外合成的过程。优选地,克隆载体被应用于转录物的产生。这些克隆载体通常被命名为转录载体,并且根据本发明被术语“载体”涵盖。用于控制转录的启动子可以是用于任何rna聚合酶的任何启动子。rna聚合酶的特殊实例为t7、t3和sp6rna聚合酶。用于体外转录的dna模板可通过核酸(特别是cdna)的克隆,并且将其引入用于体外转录的合适载体而获得。cdna可通过rna的逆转录获得。优选地,将克隆载体用于产生通常命名为转录载体的转录物。
根据本发明的术语“翻译”涉及细胞的核糖体中信使rna的链指导氨基酸序列的装配以产生肽或蛋白质的过程。
根据本发明的术语“肽”包括寡肽或多肽,并且是指包含两个或更多个、优选3或更多个、优选4或更多个、优选6或更多个、优选8或更多个、优选9或更多个、优选10或更多个、优选13或更多个、优选16或更多个、优选21或更多个并且高至优选8、10、20、30、40或50个、特别是100个通过肽键共价连接的氨基酸的物质。术语“蛋白质”是指大肽,优选具有多于100个氨基酸残基的肽,但是通常来说,术语“肽”和“蛋白”为同义词并且在本文中可互换使用。
本文中的使用术语“表达控制序列”意在指允许有效连接的核酸分子在期望的宿主细胞或在体外环境中的表达的核酸序列。合适的表达控制序列是本领域技术人员已知的,并且包括启动子,例如rna启动子,例如t7、t3或sp6启动子。
根据本发明的核酸分子可包含/包括在载体中。本文中的术语“载体”包括技术人员已知的任何载体,包括质粒载体;黏粒载体;噬菌体载体,例如λ噬菌体;病毒载体,例如腺病毒或杆状病毒载体;或人工染色体载体,例如细菌人工染色体(bac)、酵母人工染色体(yac)或p1人工染色体(pac)。所述载体包括表达载体和克隆载体。表达载体包括质粒载体和病毒载体,并且通常包含对特定宿主生物体(例如,细菌、酵母、植物、昆虫或哺乳动物)或体外表达系统中可操作地连接的编码序列的表达必需的期望编码序列和适当dna序列。克隆载体通常被用于设计和扩增某期望dna片段,并且可缺乏期望dna片段的表达所需的功能序列。
术语“细胞”或“宿主细胞”优选地涉及完整细胞,即,尚未释放其正常胞内组分(例如酶、细胞器或遗传物质)的具有完整膜的细胞。完整细胞优选为活细胞,即,能够进行其正常代谢功能的活着的细胞。优选地,根据本发明,所述术语涉及可被外源核酸转染或转化的任何细胞。优选地,当被外源核酸转染或转化并转移至接受体时,细胞可在所述接受体中表达所述核酸。术语“细胞”包括原核细胞,例如细菌细胞;以及真核细胞,例如酵母细胞、真菌细胞或哺乳动物细胞。合适的细菌细胞包括来自革兰氏阴性细菌菌株的细胞,例如来自大肠杆菌(escherichiacoli)、变形杆菌属(proteus)和假单胞菌属(pseudomonas)的菌株的细胞;以及来自革兰氏阳性细菌菌株的细胞,例如来自芽孢杆菌属(bacillus)、链霉菌属(streptomyces)、葡萄球菌属(staphylococcus)和乳球菌属(lactococcus)的细胞。合适的真菌细胞包括来自木霉属(trichoderma)、链孢霉属(neurospora)和曲霉属(aspergillus)物种的细胞。合适的酵母细菌包括来自酵母属(saccharomyces)(例如酿酒酵母(saccharomycescerevisiae))、裂殖酵母属(schizosaccharomyces)(例如粟酒裂殖酵母(schizosaccharomycespombe))、毕赤酵母属(pichia)(例如巴斯德毕赤酵母(pichiapastoris)和甲醇毕赤酵母(pichiamethanolica))和汉逊酵母属(hansenula)物种的细胞。合适的哺乳动物细胞包括例如cho细胞、bhk细胞、hela细胞、cos细胞、293hek等。然而,也可使用本领域中用于异源蛋白质之表达的两栖动物细胞、昆虫细胞、植物细胞和任何其他细胞。哺乳动物细胞对过继转移是特别优选的,例如来自人、小鼠、仓鼠、猪、山羊和灵长类的细胞。这些细胞可来自于大量的组织类型,并且包括原代细胞和细胞系,例如免疫系统的细胞,特别是抗原呈递细胞(apc),例如树突细胞、b细胞和t细胞;干细胞,例如造血干细胞和间充质干细胞;以及其他细胞类型。抗原呈递细胞是在其表面上展示主要组织相容性复合体的环境中的抗原的细胞。t细胞可使用其t细胞受体(tcr)识别该复合体。
本文中使用的术语“非人生物体”意在包括非人灵长类或其他动物,特别是哺乳动物,例如牛、马、猪、绵羊、山羊、狗、猫、兔、豚鼠、仓鼠或啮齿动物(例如小鼠和大鼠)。
本发明的药物组合物优选地是无菌的,并且包含有效量的本文中所述细胞因子融合蛋白、核酸分子或细胞以产生期望反应或期望效果。
药物组合物通常以均一的剂量形式提供,并且可以本身已知的方式制备。药物组合物可以例如为溶液或混悬液的形式。
药物组合物还可包含一种或更多种载体和/或赋形剂,其均优选地是可药用的。本文中使用的术语“可药用”是指物质的无毒性,其优选地不与药物组合物的活性剂的作用相互作用。
术语“载体”是指天然或合成自然物的有机或无机组分,其中组合有活性组分以促进、增强或使得能够应用。根据本发明,术语“载体”还包含适合用于向对象施用的一种或更多种相容性固体或液体填充剂、稀释剂或包封物质。
用于肠胃外施用的可能载体物质为例如无菌水、林格液(ringer)、乳酸林格液、无菌氯化钠溶液、聚亚烷基二醇、氢化萘,并且特别是生物相容的丙交酯聚合物、丙交酯/乙交酯共聚物或聚氧乙烯/聚氧丙烯共聚物。
本文中的术语“赋形剂”旨在包括可存在于药物组合物中且不是活性成分的所有物质,例如盐、黏合剂、润滑剂、增稠剂、表面活性剂、防腐剂、乳化剂、缓冲物质、矫味剂或着色剂。
非可药用的盐可用于制备可药用盐且包含在本发明中。这种可药用盐以非限制性方式包括由以下酸制备的那些:盐酸、氢溴酸、硫酸、硝酸、磷酸、马来酸、乙酸、水杨酸、柠檬酸、甲酸、丙二酸、琥珀酸等。可药用盐还可作为碱金属盐或碱土金属盐(例如钠盐、家宴或钙盐)制备。
用于药物组合物的合适防腐剂包括苯扎氯铵、氯丁醇、尼泊金和硫柳汞。
用于药物组合物的合适缓冲物质包括乙酸盐、柠檬酸盐、硼酸盐和磷酸盐。
本文中所述试剂和组合物可通过任何常规途径施用,例如通过包括通过注射或输液的肠胃外施用。施用优选地是肠胃外的,例如静脉内、动脉内、皮下、皮内或肌内。
适合用于肠胃外施用的药物组合物通常包括优选地与接受者的血液等张的活性化合物的无菌水性或非水性制剂。相容性载体/溶剂/稀释剂的实例为林格液和等张氯化钠溶液。此外,通常使用无菌的不挥发油作为溶液或混悬液介质。
本文中所述试剂和组合物以有效量施用。“有效量”是指单独或与另外的剂量一起实现期望反应或期望效果的量。在治疗特定疾病或特定病症的情况下,期望反应优选地涉及病程的抑制。这包括减缓疾病的进程,并且特别是中断或逆转疾病的进程。疾病或病症的治疗中的期望反应也可以是所述疾病或所述病症的发作延迟或发作阻止。本文中所述试剂或组合物的有效量将取决于有待治疗的病症、疾病的严重程度、对象的个体参数(包括年龄、生理条件、体型大小和体重)、治疗的持续时间、伴随疗法(如果存在的话)的类型、施用的特定途径和类似因素。因此,本文中所述试剂的施用剂量可取决于多种这样的参数。在对象中的反应因初始剂量而不足的情况下,可使用更高的剂量(或者通过不同的更局部的施用途径实现的有效的更高剂量)。
本文中使用的术语“药盒组件(kitofparts)(简称:药盒)”是指包含一个或更多个容器和任选地数据载体的制品。所述一个或更多个容器可填充用上述方式或试剂中的一种或更多种。附加容器可包含在含有例如稀释剂、缓冲剂和其他试剂的药盒中。所述数据载体可以是非电子数据载体,例如图形数据载体如信息小册子、信息表、条形码或访问码;或者电子数据载体,例如软盘、光碟(compactdisk,cd)、数字多功能光碟(digitalversatiledisk,dvd)、微型芯片或其他基于半导体的电子数据载体。访问码可允许访问数据库,例如互联网数据库、集中数据库或分散数据库。所述数据载体可包含用于本发明的细胞因子融合蛋白、核酸分子、细胞和/或药物组合物的使用说明。
本文中所述试剂和组合物可以例如体内施用于对象以治疗或预防多种病症,例如本文中所述的那些。
根据本发明,术语“疾病”是指任何病理状态,特别是癌症、感染性疾病、炎性疾病、代谢性疾病、自身免疫病、退行性疾病、凋亡相关疾病和移植排斥。
本文中的术语“癌症”包括特征为异常调节的细胞生长、增殖、分化、黏附和/或迁移的疾病。“癌细胞”意指以迅速、不可控的细胞增殖生长并在引起新生长的刺激中止后继续生长的异常细胞。根据本发明的术语“癌症”包括白血病、精原细胞瘤、黑素瘤、畸胎瘤、淋巴瘤、神经母细胞瘤、胶质瘤、直肠癌、子宫内膜癌、肾癌、肾上腺癌、甲状腺癌、血癌、皮肤癌、脑癌、宫颈癌、肠癌、肝癌、结肠癌、胃癌、肠癌、头颈癌、胃肠癌、淋巴结癌、食道癌、结直肠癌、胰腺癌、耳鼻喉(ent)癌、乳腺癌、前列腺癌、子宫癌、卵巢癌和肺癌及其转移。其实例为肺癌、乳房癌、前列腺癌、结肠癌、肾细胞癌、宫颈癌、或者上述癌症类型或肿瘤的转移。
根据本发明的术语“癌症”还包括癌症转移。“转移”意指癌细胞从其原来位置扩散至身体另一部分。转移的形成是非常复杂的过程,并且取决于恶性细胞从原发性肿瘤脱离,侵袭细胞外基质,穿过内皮基底膜以进入体腔和血管,然后,在被血液运输后,浸润靶器官。最终,新肿瘤(即继发瘤或转移瘤)在靶点的生长取决于血管生成。肿瘤转移即使在除去原发瘤后也经常发生,因为肿瘤细胞或组分可余留并发展转移潜力。在一个实施方案中,根据本发明的术语“转移”涉及“远处转移”,其涉及远离原发瘤和局部淋巴结系统的转移。
术语“感染性疾病”是指可以从个体传染至个体或者从生物体传染至生物体并且由微生物原(microbialagent)引起的任何疾病(例如,感冒)。感染性疾病的实例包括病毒感染性疾病,例如aids(hiv),甲型、乙型或丙型肝炎,疱疹,带状疱疹(鸡痘),德国麻疹(风疹病毒),黄热病,登革热等黄病毒,流感病毒,出血性感染性疾病(马尔堡(marburg)或埃博拉(ebola)病毒),以及严重急性呼吸综合症(severeacuterespiratorysyndrome,sars);细菌感染性疾病,例如军团病(军团病杆菌属(legionella)),性传播疾病(例如,衣原体或淋病),胃溃疡(螺杆菌属(helicobacter)),霍乱(弧菌属(vibrio)),结核病,白喉,大肠杆菌(e.coli)、葡萄球菌属(staphylococci)、沙门菌属(salmonella)或链球菌属(streptococci)(破伤风)感染;原生动物病原体感染,例如疟疾、昏睡病、利什曼病;弓形体病,即,疟原虫、锥虫、利什曼原虫和弓形虫感染;或者真菌感染,其例如由新型隐球酵母(cryptococcusneoformans)、荚膜组织胞浆菌(histoplasmacapsulatum)、粗球孢菌(coccidioidesimmitis)、皮炎芽生菌(blastomycesdermatitidis)或白色念珠菌(candidaalbicans)引起。
术语“炎性疾病”是指以组织(特别是结缔组织)中的高水平炎症或这些组织的变性为特征或与其相关的任何疾病。慢性炎性疾病是特征为持续炎症的医学病症。(慢性)炎性疾病的实例包括乳糜泻、血管炎、狼疮、慢性阻塞性肺疾病(chronicobstructivepulmonarydisease,copd)、肠易激疾病、动脉粥样硬化、关节炎、强直性脊柱炎、克罗恩病、结肠炎、慢性活动性肝炎、皮炎和银屑病。
术语“代谢性疾病”是指破坏正常代谢的任何疾病或病症。实例包括胱氨酸贮积症、糖尿病、血脂异常、甲状腺功能亢进症、甲状腺功能减退症、高脂血症、低脂血症、半乳糖血症、戈谢病(gaucher’sdisease)、肥胖症和苯丙酮尿症。
术语“自身免疫病”是指身体对其自身组织的某组分产生免疫原性(即,免疫系统)应答的任何疾病/病症。换言之,免疫系统丧失其识别自身体内的某组织或系统的能力并对其靶向并攻击,如同其为外来的。自身免疫病可分为一个器官主要受影响的那些(例如,溶血性贫血和抗免疫甲状腺炎)和自身免疫病过程通过许多组织扩散的那些(例如,系统性红斑狼疮)。例如,多发性硬化被认为由t细胞攻击围绕大脑和脊髓的神经纤维的髓鞘所引起。这导致协调丧失、虚弱和视力模糊。自身免疫病是本领域中已知的并且包括例如桥本氏甲状腺炎(hashimoto’sthyroiditis)、格雷夫斯病(grave’sdisease)、狼疮、多发性硬化、风湿性关节炎、溶血性贫血、抗免疫甲状腺炎、系统性红斑狼疮、乳糜泻、克罗恩病、结肠炎、糖尿病、硬皮病、银屑病等。
术语“退行性疾病”是指受影响的组织或器官的功能或结构将随时间逐渐劣化的任何疾病。实例包括阿尔茨海默病、帕金森病、肌萎缩性侧索硬化(amyotrophiclateralsclerosis,als)、亨廷顿病、黄斑变性、多发性硬化、肌营养不良、尼曼-皮克病(niemannpickdisease)、骨质疏松和类风湿性关节炎。
术语“凋亡相关疾病”是指涉及凋亡改变的任何疾病。实例包括癌症、神经疾病(例如阿尔茨海默病、帕金森氏症、亨廷顿病、肌萎缩性侧索硬化(als)和卒中)、心脏病(例如缺血再灌注和慢性心力衰竭)、感染性疾病和自身免疫病。
术语“移植排斥”是指移植的组织或器官被接受者免疫系统排斥,这可最终破坏所移植的组织或器官。
本文中使用的术语“药物”是指在治疗中(即在疾病的治疗中)使用的物质/组合物。
“治疗”意指向对象施用化合物或组合物或者化合物或组合物的组合以预防或消除疾病,包括减小对象中肿瘤的尺寸或肿瘤的数目;阻滞或减缓对象中的疾病;抑制或减缓对象中新疾病的发生;降低目前患有或先前已经患有疾病的对象中症状和/或复发的频率或严重程度;和/或延长(即提高)对象的寿命。
特别地,术语“治疗疾病”包括治愈、缩短持续时间、改善、预防、减缓或抑制进程或恶化,或者预防或延迟疾病或其症状的发作。
根据本发明,术语“对象”意指治疗对象,特别是患病对象(也称作“患者”),包括人、非人灵长类或其他动物,特别是哺乳动物,例如牛、马、猪、绵羊、山羊、狗、猫、兔、豚鼠、仓鼠或啮齿动物如小鼠和大鼠。在一个特别优选的实施方案中,对象/患者为人。
实施例
实施例1:duokine的克隆、产生和纯化
对编码人cd40l(aa116-261)、人cd27l(aa52-193)、人4-1bbl(aa71-254)和人ox40l(aa51-183)的胞外部分的dna进行密码子优化以用于在人细胞中表达,并且通过geneart(lifetechnologies,carlsbad,usa)添加合适的克隆位点来合成。通过第15位氨基酸(在duokine没有4-1bbl的情况下)或第20位氨基酸(在duokine包含4-1bbl的情况下)富含甘氨酸-丝氨酸的接头将这些不同细胞因子中的两者的单亚基融合并克隆进表达质粒pirespuro3(clontech,mountainview,usa)而产生duokine。在n末端,duokine具有用于分泌的vh前导序列和用于纯化和检测的flag标签。生产了以下duokine:cd40l-cd27l、cd27l-cd40l、cd40l-4-1bbl、4-1bbl-cd40l、cd27l-4-1bbl、4-1bbl-cd27l、cd40l-ox40l、ox40l-cd40l、cd27l-ox40l、ox40l-cd27l、4-1bbl-ox40l和ox40l-4-1bbl(表1)。所有duokine均由稳定转染的hek293细胞产生,并且通过一步flag亲和色谱法(sigma-aldrich,st.louis,usa)由细胞培养物上清液纯化,产生收率为0.3mg/l至1.9mg/l的上清液。
在还原和非还原条件下使用12%聚丙烯酰胺凝胶在sds-page中分析duokine,并且通过用考马斯亮蓝g250染色使其可视化。考虑到cd40l(1个位点;aa240)、cd27l(2个位点;aa63和170)和ox40l(4个位点;aa90、114、152和157)中存在可能的n-糖基化位点,sds-page分析显示单体多肽链的预期分子量(对于没有4-1bbl的duokine为约33kda而对于包含4-1bbl的duokine为37kda)(图2,表1)。此外,在非还原条件下所有蛋白示出与二聚体的分子量对应的第二次要条带(minorband)。以0.5ml/分钟的流量在yarrasec-2000(phenomenex)上使用高效液相色谱的尺寸排阻色谱确定duokine的同三聚体装配。duokinecd40l-4-1bbl、4-1bbl-cd40l、cd27l-4-1bbl和4-1bbl-cd27l作为主峰洗脱,表观分子量为80kda至100kda,因此略微小于计算的分子量112kda,这可能是由于包含4-1bbl的duokine的更紧凑的结构。所有其他duokine作为主峰洗脱,表观分子量为130kda至160kda,比计算的分子量大30%至50%,这可能是由于n-糖基化。此外,duokine4-1bbl-cd27l、4-1bbl-cd40l、cd40l-ox40l、ox40l-cd40l和ox40l-4-1bbl显示出最有可能与更高分子量复合物对应的次峰(图3ab)。
表1:duokine及其生物化学性质
实施例2:duokine的受体结合特性
通过elisa分别使用cd40、cd27、4-1bb和ox40的胞外区域和包含用于共价装配的铰链区的人fcγ1区域的融合蛋白(cd40-fc,cd27-fc、4-1bb-fc、ox40-fc)分析duokine的受体结合。将受体-fc融合蛋白(200ng/孔)在4℃下包被过夜,用pbs、2%脱脂奶粉(2%mpbs)封闭残余结合位点。对duokine以316nm的浓度开始一式两份地进行滴定,并用与hrp缀合的小鼠抗flag抗体检测结合的duokine。所有duokine均显示出与其相应受体的特异结合,并且未观察到与其他受体fc融合蛋白的交叉反应性(图4)。duokine-受体相互作用是计量依赖性的,具有低纳摩尔范围内的ec50值(图5ab,表1)。
此外,通过流式细胞术分析duokine与设计成分别表达cd40、cd27、4-1bb或ox40受体的纤维肉瘤细胞系ht1080(ht1080-cd40、ht1080-cd27、ht1080-4-1bb、ht1080-ox40)的结合。其中,将1.5×105个细胞用100nmduokine进行孵育,并使用pe标记的小鼠抗flag抗体检测结合。使用macsquant10分析仪(miltenyibiotec,bergischgladbach,germany)分析细胞并使用flowjo(treestar,ashland,usa)分析数据。流式细胞术显示所有duokine均与表达其相应受体的细胞系结合(图6ab)。
实施例3:duokine的双特异受体结合特性
通过流式细胞术评估duokine的双特异性。将1.5×105个表达cd40、cd27、4-1bb或ox40受体的ht1080细胞(ht1080-cd40、ht1080-cd27、ht1080-4-1bb、ht1080-ox40)用100nmduokine进行孵育,接着通过用对应受体fc融合蛋白(10nm)孵育检测第二结合位点。使用pe标记的小鼠抗人fc抗体检测细胞结合的duokine-受体复合物,因此只有识别两种受体(一种在细胞上而另一种作为可溶性fc融合蛋白提供)的duokine才能够产生荧光信号。使用macsquant10分析仪(miltenyibiotec)分析细胞并使用flowjo(treestar,ashland,usa)分析数据。此处,据显示,所有duokine能够同时结合两种受体,证明duokine的双重结合能力(图7ab)。
实施例4:单链duokine(scduokine)的克隆、产生和纯化
对编码人cd40l(aa116-261)、人cd27l(aa52-193)、人4-1bbl(aa71-254)和人ox40l(aa51-183)的胞外部分的单链衍生物的dna进行密码子优化以用于在人细胞中表达,并且通过geneart(lifetechnologies)添加合适的克隆位点来合成。在sccd40l、sccd27l和scox40l的情况下,细胞因子的三个单亚基通过gggsggg接头连接,而将(ggggs)3接头用于sc4-1bbl。通过15个氨基酸的富含甘氨酸-丝氨酸的接头将这些不同单链细胞因子中的两者融合而产生单链duokine(scduokine),并克隆进表达质粒pirespuro3(clontech)。在n末端,scduokine具有用于分泌的vh前导序列和用于纯化和检测的flag标签。产生了以下scduokine:sccd40l-sccd27l、sccd27l-sccd40l、sccd40l-sc4-1bbl、sc4-1bbl-sccd40l、sccd27l-sc4-1bbl、sc4-1bbl-sccd27l、sccd40l-scox40l、scox40l-sccd40l、sccd27l-scox40l、scox40l-sccd27l、sc4-1bbl-scox40l和scox40l-sc4-1bbl(表2)。所有scduokine均由稳定转染的hek293细胞生产,并且通过一步flag亲和色谱法(sigma-aldrich)由细胞培养物上清液纯化,产生1.4至4.0mg/l上清液的收获物。
在还原和非还原条件下使用10%聚丙烯酰胺凝胶在sds-page中分析单链duokine,并且通过用考马斯亮蓝g250染色使其可视化。考虑到cd40l(1个位点;aa240)、cd27l(2个位点;aa63和170)和ox40l(4个位点;aa90、114、152和157)中存在可能的n-糖基化位点,在还原和非还原条件下的sds-page分析显示三聚体多肽链的预期分子量(对于没有4-1bbl的duokine为约97kda且对于包含4-1bbl的duokine为111kda)(图8,表2)。此外,在还原条件下所有蛋白示出与较高分子量复合物对应的第二条带。较高分子量复合物的出现对于包含scox40l的scduokine尤其显著。以0.5ml/分钟的流量在yarrasec-2000(phenomenex)上使用高效液相色谱的尺寸排阻色谱确定scduokine的优先同三聚体装配。sccd40l-sccd27l和sccd27l-sccd40l作为主峰洗脱,表观分子量为125kda,因此略微大于计算的分子量98kda。所有包含scox40l的scduokine示出与140kda和160kda对应的主峰和较长的保留时间,这可能是由于scox40l的结构。由sccd40l、sc4-1bbl和sccd27l构成的scduokine作为对应于计算的分子量110kda的主峰洗脱。此外,scduokinesccd40l-sc4-1bbl、sc4-1bbl-sccd40l、sccd40l-scox40l、scox40l-sccd40l、sc4-1bbl-scox40l和scox40l-sc4-1bbl显示出最有可能与较高分子量复合物对应的次峰(图9ab)。
表2:单链duokine及其生物化学性质
实施例5:单链duokine的受体结合特性
通过elisa分别使用cd40、cd27、4-1bb和ox40的胞外区域和包含用于共价装配的铰链区的人fcγ1区域的融合蛋白(cd40-fc、cd27-fc、4-1bb-fc、ox40-fc)分析单链duokine的受体结合。将受体fc融合蛋白(200ng/孔)在4℃下包被过夜,用pbs、2%脱脂奶粉(2%mpbs)封闭剩余结合位点。对单链duokine以316nm的浓度开始一式两份地进行滴定,并用与hrp缀合的小鼠抗flag抗体检测结合的scduokine。所有scduokine均显示出与其相应受体的特异结合,并且未观察到与其他受体fc融合蛋白的交叉反应性(图10)。scduokine与受体之间的相互作用是计量依赖性的,具有低纳摩尔范围内的ec50值(图11ab,表2)
此外,通过流式细胞术分析单链duokine与设计成分别表达cd40、cd27、4-1bb或ox40受体的纤维肉瘤细胞系ht1080(ht1080-cd40、ht1080-cd27、ht1080-4-1bb、ht1080-ox40)的结合。其中,将1.5×105个细胞用100nmscduokine进行孵育,并使用pe标记的小鼠抗flag抗体检测结合。使用macsquant10分析仪(miltenyibiotec,bergischgladbach,germany)分析细胞并使用flowjo(treestar,ashland,usa)分析数据。流式细胞术显示所有scduokine均与表达其相应受体的细胞系结合(图12ab)。
实施例6:单链duokine的双特异受体结合特性
通过流式细胞术评估单链duokine的双特异性。将1.5×105个表达cd40、cd27、4-1bb或ox40受体的ht1080细胞(ht1080-cd40、ht1080-cd27、ht1080-4-1bb、ht1080-ox40)用100nmscduokine进行孵育,接着通过用对应受体fc融合蛋白(10nm)孵育以检测第二结合位点。使用pe标记的小鼠抗人fc抗体检测scduokine-受体复合物,因此只有识别这两种受体(一种在细胞上且另一种作为可溶性fc融合蛋白提供)的scduokine才能够产生荧光信号。使用macsquant10分析仪(miltenyibiotec,bergischgladbach,germany)分析细胞并使用flowjo(treestar,ashland,usa)分析数据。其中,据显示,所有scduokine能够同时结合这两种受体,证明单链duokine的双重结合能力(图13ab)。
实施例7:连接有ehd2的单链duokine(ehd2-scduokine)的克隆、产生和纯化
通过ggsgg接头将一个单链细胞因子n末端和第二单链细胞因子c末端融合至ige重链结构域2(ehd2)而产生ehd2-scduokine,并克隆进表达质粒psectaga(lifetechnologies,carlsbad,usa)。在n末端,ehd2-scduokine具有用于分泌的igκ前导序列和用于纯化和检测的flag标签。生产了以下ehd2-scduokine:sc4-1bbl-ehd2-sccd40l、sc4-1bbl-ehd2-sccd27l和sccd40l-ehd2-sccd27l(表3)。所有ehd2-scduokine均由稳定转染的hek293细胞产生,并且通过一步flag亲和色谱法(sigma-aldrich)由细胞培养物上清液纯化,产生3.7至8.0mg/l上清液的收获物。
在还原和非还原条件下使用4%至15%聚丙烯酰胺凝胶在sds-page中分析ehd2-scduokine,并且通过用考马斯亮蓝g250染色使其可视化。考虑到cd40l(1个位点;aa240)和cd27l(2个位点;aa63和170)中存在可能的n-糖基化位点,在还原条件下的sds-page分析显示六价多肽链的预期分子量(约120kda)(图14,表3)。此外,在非还原条件下所有蛋白示出与通过ehd2结构域之间的二硫键形成的二聚体对应的第二条带。约50%的ehd2-scduokine显示出共价连接。以0.5ml/分钟的流量在yarrasec-2000(phenomenex)上使用高效液相色谱的尺寸排阻色谱确定ehd2-scduokine的同二聚体装配。sc4-1bbl-ehd2-sccd27l洗脱为主峰的表观分子量为与六价单体对应的120kda(计算的分子量为122kda),次峰的表观分子量为最可能与二硫连接的二聚体对应的200kd(计算的分子量为245kda)。同样,sccd40l-ehd2-sccd27l作为主峰洗脱,表观分子量为与单体对应的150kda,且第二次峰的表观分子量为与二聚体对应的270kda,然而,通过sec测定的分子量略微高于计算的分子量(分别为110kda和220kda)。对于sc4-1bbl-ehd2-sccd40l,在单体和较小片段之间的分布等于在表观分子量为123kda和74kda处洗脱的两个主峰。此外,所有ehd2-scduokine显示出最有可能与较高分子量复合物对应的次峰(图15)。
表3:ehd2-scduokine及其生物化学性质
实施例8:连接有ehd2的单链duokine(ehd2-scduokine)的受体结合特性
通过elisa分别使用cd40、cd27和4-1bb的胞外区域和包含用于共价装配的铰链区的人fcγ1区域的融合蛋白(cd40-fc,cd27-fc,4-1bb-fc)分析ehd2-scduokine的受体结合。将受体fc融合蛋白(200ng/孔)在4℃下包被过夜,用pbs、2%脱脂奶粉(2%mpbs)封闭剩余结合位点。对ehd2-scduokine以316nm的浓度开始一式两份地进行滴定,并用与hrp缀合的小鼠抗flag抗体检测结合的ehd2-scduokine。所有ehd2-scduokine均显示出与其相应受体的特异结合,并且未观察到与其他受体fc融合蛋白的交叉反应性(图16)。ehd2-scduokine与受体之间的相互作用是剂量依赖性的,具有低纳摩尔范围内的ec50值(图17,表3)。
此外,通过流式细胞术分析ehd2-scduokine与设计成分别表达cd40、cd27或4-1bb受体的纤维肉瘤细胞系ht1080(ht1080-cd40、ht1080-cd27、ht1080-4-1bb)的结合。其中,将1.5×105个细胞用100nmehd2-scduokine进行孵育,并使用pe标记的小鼠抗flag抗体检测结合。使用macsquant10分析仪(miltenyibiotec,bergischgladbach,germany)分析细胞并使用flowjo(treestar,ashland,usa)分析数据。流式细胞术显示所有ehd2-scduokine均与表达其相应受体的细胞系结合(图18)。
实施例9:连接有ehd2的单链duokine(ehd2-scduokine)的双特异受体结合特性
通过流式细胞术分析ehd2-scduokine的双特异性。将1.5×105个表达cd40、cd27或4-1bb受体的ht1080细胞(ht1080-cd40、ht1080-cd27、ht1080-4-1bb)用100nmehd2-scduokine进行孵育,接着通过用对应受体fc融合蛋白(10nm)孵育检测第二结合位点。使用pe标记的小鼠抗人fc抗体检测ehd2-scduokine-受体复合物,因此只有识别这两种受体(一种在细胞上且另一种作为可溶性fc融合蛋白提供)的ehd2-scduokine才能够产生荧光信号。使用macsquant10分析仪(miltenyibiotec,bergischgladbach,germany)分析细胞并使用flowjo(treestar,ashland,usa)分析数据。此处,据显示,所有ehd2-scduokine能够同时结合这两种受体,证明ehd2-scduokine的双重结合能力(图19)。
实施例10:连接有ehd2的单链duokine(ehd2-scduokine)的受体活化
为了评估ehd2-scduokine的生物活性,通过ehd2-scduokine介导的il-8从ht1080细胞的分泌分析受体活化(图20,表3)。因此,将2×104个分别表达cd40、cd27或4-1bb的ht1080细胞在96孔微量滴定板上接种过夜,并在第二天更换上清液以除去不断产生的il-8。然后,将所述细胞用以316nm的浓度开始连续稀释的ehd2-scduokine一式两份地孵育18小时。根据生产商的使用说明使用il-8elisa试剂盒(immunotools,freiburg,germany)测定上清液中il-8的量。为了进行比较,包含对应的单特异三聚体可溶性配体(cd40l、cd27l)或其可溶性单链衍生物(sccd40l、sccd27l、sc4-1bbl)。在ht1080-cd40细胞上,所测试的ehd2-scduokine以剂量依赖方式诱导强il-8分泌,产生浓度高至225ng/ml的il-8。两种包含ehd2-scduokine的sccd40l(sc4-1bbl-ehd2-sccd40l和sccd40l-ehd2-sccd27l)均引起比单特异可溶性sccd40l更强的cd40受体活化。虽然由4-1bb的活化诱导的il-8分泌对这两种靶向4-1bb的ehd2-scduokine均可观察到,但是sc4-1bbl-ehd2-sccd40l显示出相对于sc4-1bbl-ehd2-sccd27l显著提高的活性,所述sc4-1bbl-ehd2-sccd27l具有与单特异可溶性sc4-1bbl相同的活性。虽然sc4-1bbl-ehd2.sccd27l和sccd40l-ehd2-sccd27l均能在活化cd27后诱导il-8分泌,但是sc4-1bbl与sccd27l在ehd2-scduokine内的组合显示出il-8释放的更强诱导(图20)。这些实验确定ehd2-scduokine能够诱导在该测试系统中产生il-8释放的受体活化。
实施例11:duokine和单链duokine对t细胞增殖的作用
为了评估duokine和scduokine的增殖能力,分析t细胞在大量pbmc群体中的增殖。为此,将人pbmc从健康供体分离,在-80℃下冷冻储存,并在实验前一天解冻。按照生产商的使用说明使用celltracecfse细胞增殖试剂盒(lifetechnologies)将pbmc在1×106个细胞/ml的浓度下用625nm羧基荧光素二乙酸琥珀酰亚胺酯(cfse)进行染色。对于t细胞的主要刺激,使用交联抗人cd3单克隆抗体(ucht-1,r&dsystems,minneapolis,usa)。由融合蛋白在溶液中诱导的增殖如下评估:将1.5×105个pbmc/孔用连续稀释的不同duokine或scduokine孵育6天,接着进行流式细胞术分析。进行额外的抗体介导的染色以识别t细胞(cd3-pe,immunotools,friesoythe,germany)。
所有测试的pbmc批次均需要用交联抗人cd3mab的主要刺激以进行增殖。其中,使用次优抗体浓度(5-30ng/ml)诱导t细胞仅以t细胞的20%增殖。所有受试duokine和scduokine(cd40l与4-1bbl、cd27l与4-1bbl或cd40l与ox40l的组合)在没有主要刺激物而进行施用时是无活性的,但是在与交联抗人cd3mab组合施用时以剂量依赖方式诱导t细胞增殖。其中,增殖在融合蛋白的低纳摩尔浓度下已提高两至三倍。在所有情况下,无法检测出duokine或单链duokine内细胞因子的不同取向之间增殖效果的差异。包含cd40l和4-1bbl或cd27l和4-1bbl的融合蛋白显示出与所使用形式无关的相同增殖能力(图21)。
实施例12:体外转录的rna(ivt-rna)(mrna编码的duokine和scduokine)的载体设计、克隆和生产
用作用于体外转录编码肿瘤坏死因子受体(tnfr)配体及其融合蛋白之rna的模板的质粒构建体(pst1-hag-kozak-sec-2hbgutr-a120)甚于pst1-2hbgutr-a120(holtkamps.等(2006),blood,108(13):4009-17)。质粒主链通过引入t7启动子、5’-人α-球蛋白utr、科扎克序列(kozrksequence)、源于mhci类分子的78-bp信号肽(sec;分泌信号)、人3’β-球蛋白utr的两个拷贝、120bp聚(a)尾和卡那霉素抗性基因从pcmv-script(stratagene,lajolla/ca,usa)获得。通过与pcr产物(coldfusionkit,biocat)的冷融合反应引入tnfr配体或其融合蛋白(与duokine或scduokine一致)。编码部分的相关蛋白的dna序列在表4中列出(表4)。
如下通过两种不同策略引入三聚体人tnfr配体(cd40l、cd27l、ox40l和4-1bbl)的编码序列:(i)指定人tnfr配体的胞外序列的一个拷贝,将其规定为h1_tnfr-配体(h1_cd27l、h1_cd40l、h1_ox40l或h1_41bbl);和(ii)线性连接并被gs-接头分开的指定人tnfr配体的胞外序列的三个拷贝,这样的人插入片段规定为h3_tnfr-配体(h3_cd40l、h3_cd27l、h3_ox40l或h3_41bbl)并且与上述单链蛋白对应。为了获得融合蛋白的编码序列,将两个h1_tnfr-配体或h3_tnfr-配体序列分别由15-氨基酸接头((g4s)3-接头)连接(图22)。rna转录物h1_tnfr-l(1)-h1_tnfr-l(2)对应于duokine,转录物h3_tnfr-l(1)-h3_tnfr-l(2)对应于scduokine。单h1_tnfr-配体和h3_tnfr-配体的蛋白质序列在表5中列出(表5)。
为了产生ivt-rna,使用ii类限制性内切酶将质粒在聚(a)尾的下游线性化。根据生产商的使用说明将线性化的质粒通过磁珠(
表4:根据本发明使用的pst1-hag-kozak-sec-insert-2hbgutr-a120和其他质粒的特定部分的dna/氨基酸序列
表5:编码tnfr配体的胞外结构域的pst1-hag-kozak-sec-insert-2hbgutr-a120和质粒的可变插入片段的氨基酸序列(接头序列加有下划线)
实施例13:在ivt-rna电穿孔后tnf受体配体的细胞内表达
将源自慢性髓样白血病的人细胞系k562(得自于atcc,manassas,va.,usa)在补充有5%fcs(均gibco)、100iu/ml青霉素和100μg/ml链霉素(gibco)的rpmi1640glutamax中进行培养。为了k562在96孔板系统中的电穿孔,将细胞用x-vivo15培养基(lonza)洗涤一次,并再次在x-vivo15中重悬至500,000个细胞/150μl。将150μl细胞悬液吸移到已包含所需用于多孔电穿孔的96孔板(biorad)中。混合后,在作为96孔电穿孔装置的来自biorad的genepulsermxcell电穿孔系统(250v,1×30ms脉冲)中进行电穿孔。在电穿孔后即刻,通过添加100μl新鲜培养基将细胞转移到新培养板中并在培养箱中静置约6小时。为了k562的细胞内染色,然后根据生产商的方案将细胞用golgiplug和golgistop(bdbiosciences,sanjose,ca)孵育16小时(过夜)。次日,在室温下将细胞用pbs洗涤并用bdcytofixbuffer(bdbiosciences)固定20分钟。其后,将细胞在pbs中再次洗涤,并且通过将细胞洗涤并转移到1×perm/washbuffer(bdbiosciences)中而透化。在孵育10分钟之后,将细胞在室温下于黑暗中用在1×perm/washbuffer中稀释的抗tnfr-配体抗体染色30分钟,接着用1×perm/washbuffer进行3次洗涤步骤。然后通过流式细胞术使用facscantoii流式细胞仪(bdbiosciences)直接分析细胞。使用flowjo软件(treestar,ashland,oregon,usa)进行分析。
mrna编码的tnfr配体duokine和scduokine的电穿孔导致细胞内蛋白质表达,这可通过细胞内抗体染色检测。在单独tnfr配体构建体的电穿孔后,通过对应抗体检检测cd27l、cd40l、ox40l和4-1bbl(图23a-c)。因此用各自两种对应抗tnfr-配体抗体检测由h3_cd40l-h3_cd27l、h3_cd40l-h3_ox40l和h3_4-1bbl-h3_cd27l编码的scduokine(图23a-c)。因此用各自两种对应抗tnfr-配体抗体检测由h1_cd40l-h1_cd27l、h1_41bbl-h1_cd40l和h1_4-1bbl-h1_cd27l编码的duokine(图23d)。
实施例14:在编码tnfl(1)-tnfl(2)融合构建体(分别对应duokine和scduokine)的ivt-rna电穿孔后表达的蛋白质的受体活化特性
表达tnf受体(tnfr)的细胞系/细胞的制备:将ht1080细胞系及其稳定tnfr转染子在补充有5%fcs、100iu/ml青霉素和100μg/ml链霉素的rpmi1640glutamax中进行培养。通过facs分析tnf受体在ht1080转染子上的细胞表面表达。为此,使用针对cd40-fitc(biolegend)、cd27-pe(bd)、ox40-pe(bd)和41bb-pe(bd)的抗体对细胞进行染色(图24a)。
为了产生瞬时表达tnf受体的k562,将k562细胞在x-vivo15培养基(lonza)中洗涤一次,并再次在x-vivo15中重悬至最终浓度为8×106个细胞/250μl。将8×106个k562细胞在250μl培养基中用20至40μg编码人cd40、cd27、ox40或4-1bb的全长tnf受体的质粒dna进行电穿孔。电穿孔使用btx
包含tnfr-配体融合蛋白的上清液的产生:如上述进行k562多电穿孔。在电穿孔后即刻,通过添加100μl新鲜培养基将细胞转移到新培养板中,并在培养箱中静置约3小时。然后,对细胞进行离心,并将细胞沉淀用250μl具有0.5%fcs的rpmi1640glutamax重悬以用于过夜孵育(约16小时)。次日,将100μl包含分泌的融合蛋白的上清液转移至ht1080-tnf受体转染子的汇合层。
通过ht1080细胞的il-8释放测量的tnf-受体活化后nf-κb途径活化:将ht1080细胞系的tnf受体转染子用于报道子测定以测量tnf-受体活化。使用以下表达人tnf受体的稳定转染子:ht1080_cd40、ht1080_cd27、ht1080_ox40和ht1080_4-1bb;通过facs分析检验报道子测定之前的细胞表面表达(图24a)。将细胞用具有5%fcs的rpmi1640培养基在96孔组织培养板中接种(2×104个细胞/孔)并使其培养过夜。抽出培养基,并添加100μl来自经电穿孔的k562的细胞培养物上清液。如果希望,则将指定表达tnf受体的k562额外添加到100μl具有0.5%fcs的rpmi1640glutamax培养基中。在孵育6至8小时后,根据生产商的方案收集无细胞上清液并通过il-8elisa试剂盒(biolegend)测量il-8浓度。
在h3_cd40l和h3_cd27l-h3_cd40l的电泳后检测cd40受体对ht1080_cd40的活化。然而,在施用h3_cd27l-h3_cd40l后,在反式呈现设置下检测到与所施用rna量相关的cd40活化的强烈提高,这通过添加k562-cd27实现,因此使得细胞-细胞相互作用能够由翻译的duokine介导(图25a)。未通过测量il-8分泌检测出在编码h3_cd27l或h3_cd27l-h3_cd40l的ivt-rna电穿孔后没有反式呈现设置的cd27活化。在反式呈现设置下,检测出在h3_cd27l-h3_cd40l融合构建体的k562电穿孔后由k562_cd40介导的cd27活化(图25b)。
h3_ox40l和h3_cd27l-h3_ox40l构建体介导ox40受体的活化。在由k562_cd27介导的反式呈现设置下再次检测出在施用h3_cd27l-h3_ox40l后与所施用rna量相关的ox40活化的明显提高(图25c)。经由h3_cd27l-h3_ox40l的cd27活化仅在由k562_ox40介导的反式呈现设置下才可检测(图25d)。
在施用h3_cd27l-h3_4-1bbl后的41bb和cd27活化仅在分别由k562_cd27和k562_4-1bb介导的反式呈现设置下才均可明显地检出(图25ef)。
h3_4-1bbl-h3_cd40l和h1_4-1bbl-h1_cd40l构建体即使没有反式呈现也介导cd40受体的活化。然而,在由k562_4-1bb介导的反式呈现设置下检测出与所施用rna量相关的cd40活化的强烈提高(图25g)。在施用h3_4-1bbl-h3_cd40l和h1_4-1bbl-h1_cd40l后41bb的活化仅在由k562_cd40介导的反式呈现设置下才可清楚地检测(图25h)。
实施例15:duokine和mrna编码的scduokine对抗原特异cd8+t细胞增殖的作用
从来自universityhospitalinmainz,germany的transfusionszentrale的血液捐赠品获得hla-a2+外周血单个核细胞(peripheralbloodmononuclearcell,pbmc)。通过磁活化的细胞分选(magnetic-activatedcellsorting,macs)技术使用抗cd14微珠(miltenyi)从pbmc分离单核细胞;冷冻外周血淋巴细胞(pbl,cd14-级分)以用于将来的t细胞分离。为了分化成不成熟dc(immaturedc,idc),将单核细胞在包含以下的rpmiglutamax中培养4至5天:5%人ab血清(gibco)、丙酮酸钠(gibco)、非必需氨基酸、100iu/ml青霉素和100μg/ml链霉素、1000iu/ml粒细胞巨噬细胞集落刺激因子和1000iu/mlil-4(均来自miltenyi)。在这4至5天期间将一半培养基用新鲜培养基替换一次。在电穿孔之前收获idc并用x-vivo15培养基洗涤一次,并且再次用x-vivo15重悬至300,000至500,000细胞/150μl。将150μl细胞悬液吸移进用于多孔电穿孔的96孔板中,所述板已包含所需ivt-rna,即分别编码抗原密封蛋白-6的rna和如所指定编码tnfr-配体融合蛋白的rna或无关rna(编码萤光素酶)用作对照。在将细胞悬液与rna混合后,在多孔电穿孔装置(300v,1×12ms脉冲)中进行电穿孔。在电穿孔后即刻,通过添加100μl补充有5%人ab血清的imdm培养基将细胞转移到新培养板中,并在培养箱中静置约1至3小时。
通过macs技术使用抗cd8microbeads(miltenyi)从在cd14+-macs分离后冷冻的剩余hla-a2+外周血淋巴细胞分离cd8+t细胞。将cd8+t细胞在x-vivo15培养基中洗涤一次,并再次在x-vivo15中重悬至最终浓度为10×106个细胞/250μl。将10×106个cd8+t细胞在250μl培养基中用10μg编码密封蛋白-6-tcr(限制为hla-a2+)的α链的ivt-rna和10μg编码密封蛋白-6-tcr(限制为hla-a2+)的β链的ivt-rna进行电穿孔。作为对照,使用编码tpte-tcr(限制为hla-a2+)的rna。使用btx
为了分析tnfr-配体构建体(ivt-rna)介导的效果,进行了cfse增殖测定。为此,将总共5,000个经电穿孔的dc添加进已包含已经分别以编码cld6-tcr或tpte-tcr的rna进行电穿孔的50,000个t细胞的96孔板的孔中。用补充有5%人ab血清、100iu/ml青霉素和100mg/ml的rpmi1640glutamax进行孵育。在孵育5天后通过流式细胞术测量pbmc增殖并通过flowjo软件进行分析。
用密封蛋白-6抗原-rna和h3_cd27l-h3_cd40lrna或h3_cd40l-h3_cd27lrna的dc共电穿孔产生cd8+-t细胞的提高的增殖,更特别地,更多t细胞进入分裂(提高的“分裂细胞的%”)然后也分裂得更频繁(提高的“增殖指数”)(图26a-c)。相反,用密封蛋白-6抗原-rna和编码两种单独蛋白h3_cd40l和h3_cd27l的构建体的共电穿孔不产生提高的t细胞增殖(图26a)。此外,h3_cd27l-h3_cd40l不诱导对照t细胞tpte-tcr+cd8+t细胞的显著增殖,显示出构建体不以抗原非特异方式活化t细胞增殖(图26b)。h3_cd27l-h3_cd40l和h3_cd40l-h3_cd27l介导相当的效果(图26a)。h3_cd27l-h3_cd40l是用于融合蛋白的实例,其一方面能够与在dc上表达的cd40结合并使其活化,另一方面能够与在t细胞上组成性表达的cd27结合并使其活化,从而反式交联这些细胞。
同样,用抗原-rna和h3_4-1bbl-h3_cd27lrna的dc共电穿孔产生cd8+-t细胞提高的增殖,而用抗原-rna和编码两种单独蛋白h3_4-1bbl和h3_cd27l的单构建体的共电穿孔不产生提高的t细胞增殖(图27a)。此外,h3_4-1bbl-h3_cd27l不诱导对照t细胞tpte-tcr+cd8+t细胞的增殖,显示出构建体不以抗原非特异方式活化t细胞增殖(图27b)。
h3_4-1bbl-h3_cd27l(对应scduokine)和h1_4-1bbl-h1_cd27l(对应duokine)介导相当的效果(图27a)。h3_4-1bbl-h3_cd27l是用于融合蛋白的实例,其能够与在t细胞上组成性表达的cd27结合并使其活化,并且与活化后在t细胞上表达的4-1bb结合并使其活化,从而可以顺式交联受体。
为了分析重组duokine的效果,在电穿孔后一天以上述细胞计数和比例开始idc和t细胞的共培养。同时,如所指示添加重组蛋白。然后在孵育4天后测量pbmc增殖。
将重组融合蛋白cd40l-cd27l、41bbl-cd40l和4-1bbl-cd27l添加至t细胞:dc共培养产生cd8+-t细胞的提高增殖(图28a)。更多t细胞进入分裂(提高的“分裂细胞的%”)然后也分裂得更频繁(提高的“增殖指数”)(图28b)。相反,单独添加两种tnfr配体蛋白不产生提高的t细胞增殖。
实施例16:duokine与固定化受体和pbmc的同时结合导致t细胞的活化和增殖
已示出在溶液中由4-1bbl/cd40l、4-1bbl/cd27l和cd40l/cd27l构成的duokine能够活化t细胞。在进一步实验中,分析了以下情形:是否那些duokine在通过与固定在塑料表面上的受体结合,将活化限制为第二受体结合特异性而呈递时也活化t细胞。因此,在4℃下将200ng/孔受体fc(cd40-fc、cd27-fc、4-1bb-fc、ox40-fc)在微量滴定板上固定过夜。将残余结合位点用rpmi1640+10%fcs封闭1小时。将连续稀释的duokine(cd40l-cd27l、4-1bbl-cd40l、4-1bbl-cd27l、ox40l-cd40l和ox40l-cd27l)用固定化受体孵育1小时,并随后洗去未结合的蛋白质。同时,按照制造商的使用说明使用celltracecfse细胞增殖试剂盒(lifetechnologies)用625nm羧基荧光素二乙酸琥珀酰亚胺酯(cfse)对浓度为1×106个细胞/ml的人pbmc进行染色。对于t细胞的主要刺激,用抗小鼠igg以1∶3的摩尔比交联抗人cd3单克隆抗体(ucht-1,r&dsystems,minneapolis,usa)。将pbmc(1.5×105个细胞每孔)与主要刺激物一起添加至包含与固定化受体结合的duokine的测定板。6天后,通过流式细胞术测定t细胞的增殖。t细胞通过用cd3-pe、cd4-vioblue和cd8-pe-vio770的抗体染色来识别。由于观察到所有duokine与cd4+和cd8+t细胞的提高的增殖,进一步表明duokine的两个结合位点都是有功能的,并且其能够与通过cd3提供的主要刺激物一起诱导t细胞的共刺激(图29)。在没有通过duokine支持t细胞活化对主要活化的依赖性的cd3刺激的情况下,未观察到增殖。
实施例17:单链duokine与固定化受体和pbmc的同时结合导致t细胞的活化和增殖
已示出在溶液中由4-1bbl/cd40l、4-1bbl/cd27l和cd40l/cd27l构成的单链duokine能够活化t细胞。在进一步实验中,分析了以下情形:是否那些单链duokine在通过与固定在塑料表面上的受体结合,将活化限制为第二受体结合特异性而呈递时也活化t细胞。因此,在4℃下将200ng/孔受体-fc(cd40-fc、cd27-fc、4-1bb-fc、ox40-fc)在微量滴定板上固定过夜。将残余结合位点用rpmi1640+10%fcs封闭1小时。将连续稀释的单链duokine(sccd40l-sccd27l、sc4-1bbl-sccd40l、sc4-1bbl-sccd27l、scox40l-sccd40l和scox40l-sccd27l)用固定化受体孵育1小时,并随后洗去未结合的蛋白质。同时,按照制造商的使用说明使用celltracecfse细胞增殖试剂盒(lifetechnologies)用625nm羧基荧光素二乙酸琥珀酰亚胺酯(cfse)对浓度为1×106个细胞/ml的人pbmc进行染色。对于t细胞的主要刺激,抗人cd3单克隆抗体(ucht-1,r&dsystems,minneapolis,usa)以1∶3的摩尔比与抗小鼠igg交联。将每孔1.5×105个pbmc细胞与主要刺激物一起添加至包含与固定化受体结合的单链duokine的测定板。6天后,通过流式细胞术测定t细胞的增殖。t细胞通过用cd3-pe、cd4-vioblue和cd8-pe-vio770的抗体染色来识别。由于观察到所有duokine与cd4+和cd8+t细胞的提高的增殖,进一步表明单链duokine的两个结合位点都是有功能的,并且其能够与通过cd3提供的主要刺激物一起诱导t细胞的共刺激(图30)。在没有通过单链duokine支持t细胞活化对主要活化的依赖性的cd3刺激物的情况下,未观察到增殖。
实施例18:所选duokine和单链duokine在人血浆中的稳定性
使用人血浆体外测试duokine和单链duokine的稳定性。用来自健康供体的50%人血浆制备200nm纯化的duokine和单链duokine。将样品在制备之后立即(0天)或者在37℃下孵育1天、3天和7天后于-20℃下进行冷冻。使用elisa通过c末端同三聚体配体单元与固定化受体(150ng/孔)的结合和n末端flag标签的检测测定完整蛋白质的水平。从纯化的蛋白质的标准曲线内插经稀释的血浆样品中的蛋白浓度。将在第0天检测的融合蛋白的量设为100%。测试六种duokine和六种单链duokine,涵盖所有可能的配体组合,并且如受体结合测定显示的,所有构建体完整蛋白质水平时间依赖性降低。7天后,对于大多数配体组合可在血浆样品中检测到50%至70%的完整duokine(图31,左侧)。只有在4-1bbl-cd27l的情况下,7天后完整蛋白质的量降低至小于10%并且在第一天降低40%。通常来说,单链duokine显示出降低的稳定性,7天后剩余20%至50%的完整蛋白质(图31,右侧)。
实施例19:所选鼠duokine和鼠单链duokine在cd1小鼠中的药代动力学性质
通过在单次i.v.注射后测定血清浓度研究所选小鼠特异性duokine及其对应单链duokine的体内生物利用率。雌性cd1小鼠(12至16周,30至35g,3只小鼠/duokine)各自分别接受25μgm4-1bbl-mcd40l和msc4-1bbl-msccd40l(总体积各自为150μl)的一次静脉内注射。在注射后3分钟、30分钟、1小时、2小时、6小时、1天和3天时从尾静脉采取血液样品,在冰上孵育30分钟,在4℃下以13,000g离心30分钟。从细胞组分分离血清并将样品在-20℃下储存。在elisa中通过与对应于c末端配体的固定化受体(150ng/孔)的结合以及通过n末端flag标签检测测定融合蛋白的血清水平。通过内插法从纯化的蛋白质的标准曲线获得所有蛋白的血清浓度。为了比较,将第3分钟的浓度设为100%。用excel计算初始和终末半衰期(t1/2α3-60分钟,t1/2β1-24小时)。m4-1bbl-mcd40l和msc4-1bbl-msccd40l均显示以3.8小时(单链duokine)和5.6小时(duokine)的终末半衰期以及在两种情况下均为10至13分钟的短初始半衰期从血流清除(图32)。相对于使用fcrn介导的循环的igg(西妥昔单抗),这两种构建体被快速清除。与终末半衰期为6.6小时的scfv-4-1bbl融合蛋白的比较(数据未示出)示出,m4-1bbl-mcd40l和msc4-1bbl-msccd40l在那些功能相关的免疫刺激性融合蛋白的相同范围内。包含duokine的免疫刺激性融合蛋白的总体迅速清除指向靶细胞(即,免疫细胞)特异性消耗。
实施例20:人pbmc上的受体表达和单链duokine与免疫细胞亚群的结合
为了测定pbmc群内可能的靶细胞群和单链duokine的实际靶细胞,详细表征了人pbmc。将来自健康供体的pbmc解冻并在细胞培养皿上于4℃下孵育过夜。次日,在交联抗人cd3抗体作为主要刺激物以应答限制性次优浓度存在或不存在下将2.5×105个人pbmc用10nm单链duokine进行孵育。在37℃下3天后,以流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd14、抗cd20和抗cd56)识别不同亚群,并通过检测其flag标签来评估单链duokine与不同亚群的结合。此外,对经刺激和未经刺激的pbmc不用单链duokine也进行孵育,在培养3天后识别亚群并通过抗体染色测定cd40、cd27、4-1bb和ox40的表面表达。未经刺激的pbmc由约40%cd8+t细胞、40%cd4+t细胞、15%b细胞和5%nk细胞构成(图33,左上)。由于pbmc的处理,所有单核细胞黏附至塑料表面并且不存在于实验中。在用抗cd3mab刺激3天后,cd8+t细胞的量提高至近80%,伴随有所有其他细胞类型的百分比的略微降低(图33,左下)。受体cd40和cd27在b细胞(cd40)和与刺激无关的这两种类型的t细胞(cd27)上被组成性表达。而4-1bb和ox40不存在于任何未经刺激的pbmc上,约80%经刺激的cd4+t细胞和40%经刺激的cd8+t细胞表达这两种受体(图33,中图)。与受体表达一致,三种测试的反式作用单链duokine(sccd40l-sccd27l、sc4-1bbl-sccd40l和scox40l-sccd40l)几乎只与经刺激和未经刺激的b细胞结合(图33,右上)。顺式作用单链duokine(sc4-1bbl-sccd27l和scox40l-sccd27l)只在未经刺激的环境下与cd4+t细胞的级分以及在刺激后与cd4+和cd8+t细胞的大部分结合(图33,右下)。综上,这些实验示出反式作用分子靶向b细胞与刺激无关,而顺式作用构建体靶向活化cd8+和cd4+t细胞。
实施例21:顺式作用单链duokine与人免疫细胞的结合以及t细胞增殖的诱导
对一种所选择的顺式作用单链duokine验证与人免疫细胞的结合和t细胞增殖的诱导之间的联系。为此,在交联抗人cd3抗体作为主要次优刺激物存在或不存在下将2.5×105个人pbmc(群体)用10nmsc4-1bbl-sccd27l进行孵育。在37℃下3天后,以流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd20和抗cd56)识别不同亚群。通过抗体染色测定cd27和4-1bb的表面表达,并通过检测其flag标签来评估单链duokine的结合。在交联抗人cd3抗体作为主要次优刺激物存在或不存在下将1.5×105个cfse标记的pbmc(群体,不同pbmc批次)用30、3、0.3或0nmsc4-1bbl-sccd27l进行孵育。6天后,以流式细胞术通过cfse稀释测定cd4+和cd8+t细胞的增殖。当与作为主要刺激物的交联抗人cd3抗体组合施用时,sc4-1bbl-sccd27l使cd4+和cd8+t细胞的初始cd3介导的增殖早在0.3nm的低浓度下提高30%(图34,右下)。通常来说,比cd4+t细胞(60%)更多的cd8+t细胞(80%)开始增殖。该增殖谱与sc4-1bbl-sccd27l在经刺激的环境下与表达4-1bb和cd27二者的cd4+和cd8+t细胞结合的发现相一致(图34,左下)。没有抗cd3刺激,根本观察不到增殖性cd8+t细胞,只发现~10%cd4+t细胞的微小增殖(图34,右上)。尽管注意到与表达cd27的cd4+t细胞结合,但是sc4-1bbl-sccd27l未提高该基础增殖率(图34,左上),表明顺式作用duokine不作用于静息t细胞。
实施例22:顺式作用单链duokine与人免疫细胞的结合以及t细胞增殖的诱导
对所选择的反式作用单链duokine验证与人免疫细胞的结合和t细胞增殖的诱导之间的联系。为此,在交联抗人cd3抗体作为主要次优刺激物存在或不存在下将2.5×105个人pbmc(群体)用10nmsc4-1bbl-sccd40l进行孵育。在37℃下3天后,以流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd20和抗cd56)识别不同亚群。通过抗体染色测定cd40和4-1bb的表面表达,并通过检测其flag标签来评估单链duokine的结合。在交联抗人cd3抗体作为主要次优刺激物存在或不存在下将1.5×105个cfse标记的pbmc(群体,不同pbmc批次)用30、3、0.3或0nmsc4-1bbl-sccd40l进行孵育。6天后,以流式细胞术通过cfse稀释测定cd4+和cd8+t细胞的增殖。当与作为主要刺激物的交联抗人cd3抗体组合施用时,sc4-1bbl-sccd40l使cd4+和cd8+t细胞的初始cd3介导的增殖早在0.3nm的低浓度下强烈提高50%至60%。通常来说,几乎所有cd8+t细胞(90%)和70%左右cd4+t细胞开始增殖(图35,右下)。sc4-1bbl-sccd40l起初与组成性表达cd40b的b细胞结合,使得该单链duokine的4-1bbl的模式能够反式呈现于引发的表达4-1bb的t细胞(图35,右下)。没有cd3刺激,只可以观察到微小的(3%)cd8+t细胞增殖,并且在添加sc4-1bbl-sccd40l后观察到略微提高至9%的增殖性细胞,表明一小部分cd8+t细胞可以在没有蓄意cd3触发下响应于反式活化(图35,上图),这表明这些细胞处于预活化状态。
实施例23:反式作用单链duokine与人免疫细胞的结合以及t细胞增殖的诱导
对第二种所选择的反式作用单链duokine验证与人免疫细胞的结合和t细胞增殖的诱导之间的联系。为此,在交联抗人cd3抗体作为主要次优刺激物存在或不存在下将2.5×105个人pbmc(群体)用10nmsccd40l-sccd27l进行孵育。在37℃下3天后,用流式细胞术通过cd标记染色(抗cd3、抗cd4、抗cd8、抗cd20和抗cd56)识别不同亚群。通过抗体染色测定cd40和cd27的表面表达,并通过检测其flag标签来评估单链duokine的结合。在交联抗人cd3抗体作为主要次优刺激物存在或不存在下将1.5×105个cfse标记的pbmc(群体,不同pbmc批次)用30、3、0.3或0nmsccd40l-sccd27l进行孵育。6天后,以流式细胞术通过cfse稀释测定cd4+和cd8+t细胞的增殖。当与作为主要刺激物的交联抗人cd3抗体组合施用时,sc4-1bbl-sccd27l使cd4+和cd8+t细胞的初始cd3介导的增殖早在0.3nm的低浓度下提高20%至35%(图36,右下)。通常来说,比cd4+t细胞(45%)稍多的cd8+t细胞(60%)开始增殖。抗体染色显示cd27在所有cd8+和cd4+t细胞上被组成性表达,在所有cd4+t细胞的50%上检测到sccd40l-sccd27lduokine的结合,但是低于cd8+t细胞上的检测水平。还发现sccd40l-sccd27l结合组成性表达cd40的b细胞的整个群(图36,左下)。因此,经由sccd40l-sccd27l通过cd27+cd4细胞-cd40+b细胞相互作用的直接反式活化容易导致cd4+t细胞增殖,而在cd8+t细胞的另外的情况下,迄今非确定机理/细胞看来对使得能够通过该单链duokine强烈反式活化是必需的。在没有任何cd3刺激的情况下,响应于duokinesccd40l-sccd27l的t细胞增殖对cd8+和cd4+t细胞分别从1%上升至10%和从5%上升至25%(图36,右上),表明一些t细胞没有蓄意cd3活化下能够响应共刺激信号,再次表明存在预活化细胞的亚群。
综上所述,由sccd40l-sccd27l介导的相当多的t细胞活化可以归因于cd27在所有t细胞上和cd40在所有b细胞上的组成性表达(图36,左上),这导致不同免疫细胞的延长的串扰(crosstalk)和活化。
序列表
<110>生物技术rna制药有限公司
斯图加特大学
约翰·古腾堡大学美因兹医学大学转化肿瘤学公司
<120>细胞因子融合蛋白
<130>674-132pct
<150>pct/ep2015/050682
<151>2015年1月15日
<160>23
<170>patentinversion3.5
<210>1
<211>261
<212>prt
<213>人
<400>1
metilegluthrtyrasnglnthrserproargseralaalathrgly
151015
leuproilesermetlysilephemettyrleuleuthrvalpheleu
202530
ilethrglnmetileglyseralaleuphealavaltyrleuhisarg
354045
argleuasplysilegluaspgluargasnleuhisgluasppheval
505560
phemetlysthrileglnargcysasnthrglygluargserleuser
65707580
leuleuasncysglugluilelysserglnphegluglyphevallys
859095
aspilemetleuasnlysglugluthrlyslysgluasnserpheglu
100105110
metglnlysglyaspglnasnproglnilealaalahisvalileser
115120125
glualaserserlysthrthrservalleuglntrpalaglulysgly
130135140
tyrtyrthrmetserasnasnleuvalthrleugluasnglylysgln
145150155160
leuthrvallysargglnglyleutyrtyriletyralaglnvalthr
165170175
phecysserasnargglualaserserglnalapropheilealaser
180185190
leucysleulysserproglyargphegluargileleuleuargala
195200205
alaasnthrhisserseralalysprocysglyglnglnserilehis
210215220
leuglyglyvalphegluleuglnproglyalaservalphevalasn
225230235240
valthraspproserglnvalserhisglythrglyphethrserphe
245250255
glyleuleulysleu
260
<210>2
<211>193
<212>prt
<213>人
<400>2
metproglugluglyserglycysservalargargargprotyrgly
151015
cysvalleuargalaalaleuvalproleuvalalaglyleuvalile
202530
cysleuvalvalcysileglnargphealaglnalaglnglnglnleu
354045
proleugluserleuglytrpaspvalalagluleuglnleuasnhis
505560
thrglyproglnglnaspproargleutyrtrpglnglyglyproala
65707580
leuglyargserpheleuhisglyprogluleuasplysglyglnleu
859095
argilehisargaspglyiletyrmetvalhisileglnvalthrleu
100105110
alailecysserserthrthralaserarghishisprothrthrleu
115120125
alavalglyilecysserproalaserargserileserleuleuarg
130135140
leuserphehisglnglycysthrilealaserglnargleuthrpro
145150155160
leualaargglyaspthrleucysthrasnleuthrglythrleuleu
165170175
proserargasnthraspgluthrphepheglyvalglntrpvalarg
180185190
pro
<210>3
<211>254
<212>prt
<213>人
<400>3
metglutyralaseraspalaserleuaspproglualaprotrppro
151015
proalaproargalaargalacysargvalleuprotrpalaleuval
202530
alaglyleuleuleuleuleuleuleualaalaalacysalavalphe
354045
leualacysprotrpalavalserglyalaargalaserproglyser
505560
alaalaserproargleuarggluglyprogluleuserproaspasp
65707580
proalaglyleuleuaspleuargglnglymetphealaglnleuval
859095
alaglnasnvalleuleuileaspglyproleusertrptyrserasp
100105110
proglyleualaglyvalserleuthrglyglyleusertyrlysglu
115120125
aspthrlysgluleuvalvalalalysalaglyvaltyrtyrvalphe
130135140
pheglnleugluleuargargvalvalalaglygluglyserglyser
145150155160
valserleualaleuhisleuglnproleuargseralaalaglyala
165170175
alaalaleualaleuthrvalaspleuproproalasersergluala
180185190
argasnseralapheglypheglnglyargleuleuhisleuserala
195200205
glyglnargleuglyvalhisleuhisthrglualaargalaarghis
210215220
alatrpglnleuthrglnglyalathrvalleuglyleupheargval
225230235240
thrprogluileproalaglyleuproserproargserglu
245250
<210>4
<211>183
<212>prt
<213>人
<400>4
metgluargvalglnproleuglugluasnvalglyasnalaalaarg
151015
proargphegluargasnlysleuleuleuvalalaservalilegln
202530
glyleuglyleuleuleucysphethrtyrilecysleuhispheser
354045
alaleuglnvalserhisargtyrproargileglnserilelysval
505560
glnphethrglutyrlyslysglulysglypheileleuthrsergln
65707580
lysgluaspgluilemetlysvalglnasnasnservalileileasn
859095
cysaspglyphetyrleuileserleulysglytyrpheserglnglu
100105110
valasnileserleuhistyrglnlysaspglugluproleuphegln
115120125
leulyslysvalargservalasnserleumetvalalaserleuthr
130135140
tyrlysasplysvaltyrleuasnvalthrthraspasnthrserleu
145150155160
aspaspphehisvalasnglyglygluleuileleuilehisglnasn
165170175
proglygluphecysvalleu
180
<210>5
<211>211
<212>prt
<213>人工序列
<220>
<223>h1_cd40l
<400>5
asplysilegluaspgluargasnleuhisgluaspphevalphemet
151015
lysthrileglnargcysasnthrglygluargserleuserleuleu
202530
asncysglugluilelysserglnphegluglyphevallysaspile
354045
metleuasnlysglugluthrlyslysgluasnserpheglumetgln
505560
lysglyaspglnasnproglnilealaalahisvalilesergluala
65707580
serserlysthrthrservalleuglntrpalaglulysglytyrtyr
859095
thrmetserasnasnleuvalthrleugluasnglylysglnleuthr
100105110
vallysargglnglyleutyrtyriletyralaglnvalthrphecys
115120125
serasnargglualaserserglnalapropheilealaserleucys
130135140
leulysserproglyargphegluargileleuleuargalaalaasn
145150155160
thrhisserseralalysprocysglyglnglnserilehisleugly
165170175
glyvalphegluleuglnproglyalaservalphevalasnvalthr
180185190
aspproserglnvalserhisglythrglyphethrserpheglyleu
195200205
leulysleu
210
<210>6
<211>142
<212>prt
<213>人工序列
<220>
<223>h1_cd27l
<400>6
serleuglytrpaspvalalagluleuglnleuasnhisthrglypro
151015
glnglnaspproargleutyrtrpglnglyglyproalaleuglyarg
202530
serpheleuhisglyprogluleuasplysglyglnleuargilehis
354045
argaspglyiletyrmetvalhisileglnvalthrleualailecys
505560
serserthrthralaserarghishisprothrthrleualavalgly
65707580
ilecysserproalaserargserileserleuleuargleuserphe
859095
hisglnglycysthrilealaserglnargleuthrproleualaarg
100105110
glyaspthrleucysthrasnleuthrglythrleuleuproserarg
115120125
asnthraspgluthrphepheglyvalglntrpvalargpro
130135140
<210>7
<211>184
<212>prt
<213>人工序列
<220>
<223>h1_4-1bbl
<400>7
arggluglyprogluleuserproaspaspproalaglyleuleuasp
151015
leuargglnglymetphealaglnleuvalalaglnasnvalleuleu
202530
ileaspglyproleusertrptyrseraspproglyleualaglyval
354045
serleuthrglyglyleusertyrlysgluaspthrlysgluleuval
505560
valalalysalaglyvaltyrtyrvalphepheglnleugluleuarg
65707580
argvalvalalaglygluglyserglyservalserleualaleuhis
859095
leuglnproleuargseralaalaglyalaalaalaleualaleuthr
100105110
valaspleuproproalaserserglualaargasnseralaphegly
115120125
pheglnglyargleuleuhisleuseralaglyglnargleuglyval
130135140
hisleuhisthrglualaargalaarghisalatrpglnleuthrgln
145150155160
glyalathrvalleuglyleupheargvalthrprogluileproala
165170175
glyleuproserproargserglu
180
<210>8
<211>133
<212>prt
<213>人工序列
<220>
<223>h1_ox40l
<400>8
glnvalserhisargtyrproargileglnserilelysvalglnphe
151015
thrglutyrlyslysglulysglypheileleuthrserglnlysglu
202530
aspgluilemetlysvalglnasnasnservalileileasncysasp
354045
glyphetyrleuileserleulysglytyrpheserglngluvalasn
505560
ileserleuhistyrglnlysaspglugluproleupheglnleulys
65707580
lysvalargservalasnserleumetvalalaserleuthrtyrlys
859095
asplysvaltyrleuasnvalthrthraspasnthrserleuaspasp
100105110
phehisvalasnglyglygluleuileleuilehisglnasnprogly
115120125
gluphecysvalleu
130
<210>9
<211>452
<212>prt
<213>人工序列
<220>
<223>h3_cd40l
<400>9
glyaspglnasnproglnilealaalahisvalileserglualaser
151015
serlysthrthrservalleuglntrpalaglulysglytyrtyrthr
202530
metserasnasnleuvalthrleugluasnglylysglnleuthrval
354045
lysargglnglyleutyrtyriletyralaglnvalthrphecysser
505560
asnargglualaserserglnalapropheilealaserleucysleu
65707580
lysserproglyargphegluargileleuleuargalaalaasnthr
859095
hisserseralalysprocysglyglnglnserilehisleuglygly
100105110
valphegluleuglnproglyalaservalphevalasnvalthrasp
115120125
proserglnvalserhisglythrglyphethrserpheglyleuleu
130135140
lysleuglyglyglyserglyglyglyglyaspglnasnproglnile
145150155160
alaalahisvalileserglualaserserlysthrthrservalleu
165170175
glntrpalaglulysglytyrtyrthrmetserasnasnleuvalthr
180185190
leugluasnglylysglnleuthrvallysargglnglyleutyrtyr
195200205
iletyralaglnvalthrphecysserasnargglualasersergln
210215220
alapropheilealaserleucysleulysserproglyargpheglu
225230235240
argileleuleuargalaalaasnthrhisserseralalysprocys
245250255
glyglnglnserilehisleuglyglyvalphegluleuglnprogly
260265270
alaservalphevalasnvalthraspproserglnvalserhisgly
275280285
thrglyphethrserpheglyleuleulysleuglyglyglysergly
290295300
glyglyglyaspglnasnproglnilealaalahisvalileserglu
305310315320
alaserserlysthrthrservalleuglntrpalaglulysglytyr
325330335
tyrthrmetserasnasnleuvalthrleugluasnglylysglnleu
340345350
thrvallysargglnglyleutyrtyriletyralaglnvalthrphe
355360365
cysserasnargglualaserserglnalapropheilealaserleu
370375380
cysleulysserproglyargphegluargileleuleuargalaala
385390395400
asnthrhisserseralalysprocysglyglnglnserilehisleu
405410415
glyglyvalphegluleuglnproglyalaservalphevalasnval
420425430
thraspproserglnvalserhisglythrglyphethrserphegly
435440445
leuleulysleu
450
<210>10
<211>440
<212>prt
<213>人工序列
<220>
<223>h3_cd27l
<400>10
serleuglytrpaspvalalagluleuglnleuasnhisthrglypro
151015
glnglnaspproargleutyrtrpglnglyglyproalaleuglyarg
202530
serpheleuhisglyprogluleuasplysglyglnleuargilehis
354045
argaspglyiletyrmetvalhisileglnvalthrleualailecys
505560
serserthrthralaserarghishisprothrthrleualavalgly
65707580
ilecysserproalaserargserileserleuleuargleuserphe
859095
hisglnglycysthrilealaserglnargleuthrproleualaarg
100105110
glyaspthrleucysthrasnleuthrglythrleuleuproserarg
115120125
asnthraspgluthrphepheglyvalglntrpvalargproglygly
130135140
glyserglyglyglyserleuglytrpaspvalalagluleuglnleu
145150155160
asnhisthrglyproglnglnaspproargleutyrtrpglnglygly
165170175
proalaleuglyargserpheleuhisglyprogluleuasplysgly
180185190
glnleuargilehisargaspglyiletyrmetvalhisileglnval
195200205
thrleualailecysserserthrthralaserarghishisprothr
210215220
thrleualavalglyilecysserproalaserargserileserleu
225230235240
leuargleuserphehisglnglycysthrilealaserglnargleu
245250255
thrproleualaargglyaspthrleucysthrasnleuthrglythr
260265270
leuleuproserargasnthraspgluthrphepheglyvalglntrp
275280285
valargproglyglyglyserglyglyglyserleuglytrpaspval
290295300
alagluleuglnleuasnhisthrglyproglnglnaspproargleu
305310315320
tyrtrpglnglyglyproalaleuglyargserpheleuhisglypro
325330335
gluleuasplysglyglnleuargilehisargaspglyiletyrmet
340345350
valhisileglnvalthrleualailecysserserthrthralaser
355360365
arghishisprothrthrleualavalglyilecysserproalaser
370375380
argserileserleuleuargleuserphehisglnglycysthrile
385390395400
alaserglnargleuthrproleualaargglyaspthrleucysthr
405410415
asnleuthrglythrleuleuproserargasnthraspgluthrphe
420425430
pheglyvalglntrpvalargpro
435440
<210>11
<211>592
<212>prt
<213>人工序列
<220>
<223>h3_4-1bbl
<400>11
arggluglyprogluleuserproaspaspproalaglyleuleuasp
151015
leuargglnglymetphealaglnleuvalalaglnasnvalleuleu
202530
ileaspglyproleusertrptyrseraspproglyleualaglyval
354045
serleuthrglyglyleusertyrlysgluaspthrlysgluleuval
505560
valalalysalaglyvaltyrtyrvalphepheglnleugluleuarg
65707580
argvalvalalaglygluglyserglyservalserleualaleuhis
859095
leuglnproleuargseralaalaglyalaalaalaleualaleuthr
100105110
valaspleuproproalaserserglualaargasnseralaphegly
115120125
pheglnglyargleuleuhisleuseralaglyglnargleuglyval
130135140
hisleuhisthrglualaargalaarghisalatrpglnleuthrgln
145150155160
glyalathrvalleuglyleupheargvalthrprogluileproala
165170175
glyleuproserproargsergluglyglyglyglyserglyglygly
180185190
glyserglyglyglyglyserglyglyglyglyserarggluglypro
195200205
gluleuserproaspaspproalaglyleuleuaspleuargglngly
210215220
metphealaglnleuvalalaglnasnvalleuleuileaspglypro
225230235240
leusertrptyrseraspproglyleualaglyvalserleuthrgly
245250255
glyleusertyrlysgluaspthrlysgluleuvalvalalalysala
260265270
glyvaltyrtyrvalphepheglnleugluleuargargvalvalala
275280285
glygluglyserglyservalserleualaleuhisleuglnproleu
290295300
argseralaalaglyalaalaalaleualaleuthrvalaspleupro
305310315320
proalaserserglualaargasnseralapheglypheglnglyarg
325330335
leuleuhisleuseralaglyglnargleuglyvalhisleuhisthr
340345350
glualaargalaarghisalatrpglnleuthrglnglyalathrval
355360365
leuglyleupheargvalthrprogluileproalaglyleuproser
370375380
proargsergluglyglyglyglyserglyglyglyglyserglygly
385390395400
glyglyserglyglyglyglyserarggluglyprogluleuserpro
405410415
aspaspproalaglyleuleuaspleuargglnglymetphealagln
420425430
leuvalalaglnasnvalleuleuileaspglyproleusertrptyr
435440445
seraspproglyleualaglyvalserleuthrglyglyleusertyr
450455460
lysgluaspthrlysgluleuvalvalalalysalaglyvaltyrtyr
465470475480
valphepheglnleugluleuargargvalvalalaglygluglyser
485490495
glyservalserleualaleuhisleuglnproleuargseralaala
500505510
glyalaalaalaleualaleuthrvalaspleuproproalaserser
515520525
glualaargasnseralapheglypheglnglyargleuleuhisleu
530535540
seralaglyglnargleuglyvalhisleuhisthrglualaargala
545550555560
arghisalatrpglnleuthrglnglyalathrvalleuglyleuphe
565570575
argvalthrprogluileproalaglyleuproserproargserglu
580585590
<210>12
<211>413
<212>prt
<213>人工序列
<220>
<223>h3_ox40l
<400>12
glnvalserhisargtyrproargileglnserilelysvalglnphe
151015
thrglutyrlyslysglulysglypheileleuthrserglnlysglu
202530
aspgluilemetlysvalglnasnasnservalileileasncysasp
354045
glyphetyrleuileserleulysglytyrpheserglngluvalasn
505560
ileserleuhistyrglnlysaspglugluproleupheglnleulys
65707580
lysvalargservalasnserleumetvalalaserleuthrtyrlys
859095
asplysvaltyrleuasnvalthrthraspasnthrserleuaspasp
100105110
phehisvalasnglyglygluleuileleuilehisglnasnprogly
115120125
gluphecysvalleuglyglyglyserglyglyglyglnvalserhis
130135140
argtyrproargileglnserilelysvalglnphethrglutyrlys
145150155160
lysglulysglypheileleuthrserglnlysgluaspgluilemet
165170175
lysvalglnasnasnservalileileasncysaspglyphetyrleu
180185190
ileserleulysglytyrpheserglngluvalasnileserleuhis
195200205
tyrglnlysaspglugluproleupheglnleulyslysvalargser
210215220
valasnserleumetvalalaserleuthrtyrlysasplysvaltyr
225230235240
leuasnvalthrthraspasnthrserleuaspaspphehisvalasn
245250255
glyglygluleuileleuilehisglnasnproglygluphecysval
260265270
leuglyglyglyserglyglyglyglnvalserhisargtyrproarg
275280285
ileglnserilelysvalglnphethrglutyrlyslysglulysgly
290295300
pheileleuthrserglnlysgluaspgluilemetlysvalglnasn
305310315320
asnservalileileasncysaspglyphetyrleuileserleulys
325330335
glytyrpheserglngluvalasnileserleuhistyrglnlysasp
340345350
glugluproleupheglnleulyslysvalargservalasnserleu
355360365
metvalalaserleuthrtyrlysasplysvaltyrleuasnvalthr
370375380
thraspasnthrserleuaspaspphehisvalasnglyglygluleu
385390395400
ileleuilehisglnasnproglygluphecysvalleu
405410
<210>13
<211>40
<212>dna
<213>人工序列
<220>
<223>hag-kozak
<400>13
attcttctggtccccacagactcagagagaacccgccacc40
<210>14
<211>84
<212>dna
<213>人工序列
<220>
<223>sec
<400>14
atgagagtgaccgcccccagaaccctgatcctgctgctgtctggcgccctggccctgaca60
gagacatgggccggaagcggatcc84
<210>15
<211>28
<212>prt
<213>人工序列
<220>
<223>sec
<400>15
metargvalthralaproargthrleuileleuleuleuserglyala
151015
leualaleuthrgluthrtrpalaglyserglyser
2025
<210>16
<211>287
<212>dna
<213>人工序列
<220>
<223>2hbgutr
<400>16
ctcgagagctcgctttcttgctgtccaatttctattaaaggttcctttgttccctaagtc60
caactactaaactgggggatattatgaagggccttgagcatctggattctgcctaataaa120
aaacatttattttcattgctgcgtcgagagctcgctttcttgctgtccaatttctattaa180
aggttcctttgttccctaagtccaactactaaactgggggatattatgaagggccttgag240
catctggattctgcctaataaaaaacatttattttcattgctgcgtc287
<210>17
<211>134
<212>dna
<213>人工序列
<220>
<223>a120
<400>17
gagacctggtccagagtcgctagcaaaaaaaaaaaaaaaaaaaaaaaaaaaaaagcatat60
gactaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa120
aaaaaaaaaaaaaa134
<210>18
<211>45
<212>dna
<213>人工序列
<220>
<223>接头
<400>18
ggaggcggtggtagtggaggtggcgggtccggtggaggtggaagc45
<210>19
<211>15
<212>prt
<213>人工序列
<220>
<223>接头
<400>19
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
<210>20
<211>14
<212>prt
<213>人工序列
<220>
<223>接头
<400>20
glyglyglyglyserglyglyglythrglyglyglyglyser
1510
<210>21
<211>20
<212>prt
<213>人工序列
<220>
<223>接头
<400>21
glyglyglyglyserglyglyglyglyserglyglyglyglysergly
151015
glyglyglyser
20
<210>22
<211>19
<212>prt
<213>人工序列
<220>
<223>sec
<400>22
metasptrpthrtrpargvalphecysleuleualavalalaprogly
151015
alahisser
<210>23
<211>106
<212>prt
<213>人工序列
<220>
<223>hehd2
<400>23
aspphethrproprothrvallysileleuglnsersercysaspgly
151015
glyglyhispheproprothrileglnleuleucysleuvalsergly
202530
tyrthrproglythrileasnilethrtrpleugluaspglyglnval
354045
metaspvalaspleuserthralaserthrthrglngluglygluleu
505560
alaserthrglnsergluleuthrleuserglnlyshistrpleuser
65707580
aspargthrtyrthrcysglnvalthrtyrglnglyhisthrpheglu
859095
aspserthrlyslyscysalaaspserasn
100105
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗CD24人源化抗体融合蛋白的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 一种融合蛋白表达纯化方法与制造工艺
- 抗USP2a蛋白单克隆抗体杂交瘤细胞及其产生的抗USP2a单克隆抗体和应用的制造方法与工艺
- 与癌症相关的基因融合体和基因变异体的制造方法与工艺
- 包含邻近氨基酸端的志贺毒素A亚基效应子区和细胞靶向性免疫球蛋白型结合区的蛋白的制造方法与工艺
- 杀虫融合蛋白改进的制造方法与工艺
- vin‑cdtb在大肠杆菌中的表达和制备的制造方法与工艺
- 一种抗肿瘤侵袭转移的多靶点融合蛋白的制备及用途的制造方法与工艺
- 重组人成纤维细胞生长因子21融合蛋白及其在制备治疗代谢疾病药物中的应用的制造方法与工艺