天冬氨酸激酶/高丝氨酸脱氢酶突变体及其应用的制作方法
本发明涉及生物
技术领域:
。具体地说,本发明涉及突变型天冬氨酸激酶/高丝氨酸脱氢酶、其编码基因以及在l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸生产中的应用;本发明还涉及利用所述突变型天冬氨酸激酶/高丝氨酸脱氢酶或其编码基因生产l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的方法。
背景技术:
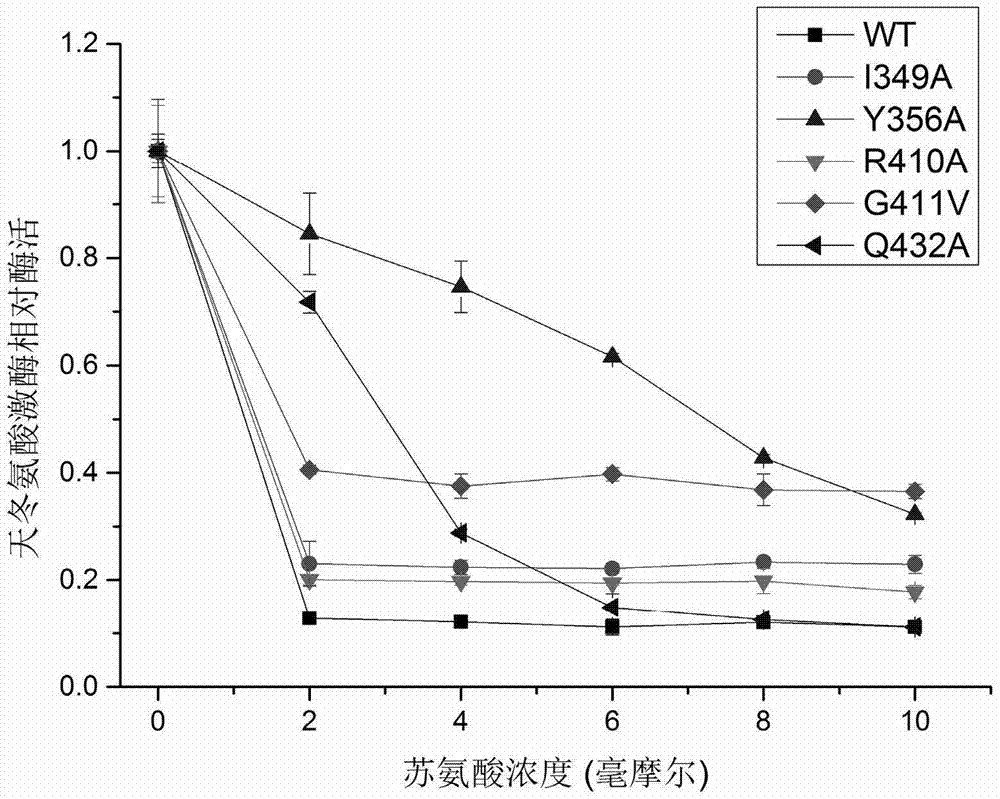
:l-苏氨酸是人类和动物营养中重要的必需氨基酸,在食品工业、养殖业和饲料工业中有着十分重要的地位。近年来,其市场需求稳步增加,世界市场销售量有望突破百万吨规模。目前,苏氨酸主要采用微生物发酵法生产。在大肠杆菌中l-苏氨酸的合成途径是以天冬氨酸为前体,通过五步反应生产苏氨酸(如图1所示)。其中,天冬氨酸激酶/高丝氨酸脱氢酶,英文缩写为aki-hdi,是一个双功能酶,由thra基因编码,催化苏氨酸生物合成的第一步反应和第三步反应,是苏氨酸生产的限速步骤,它的活力决定着代谢流流向l-苏氨酸合成途径的比例,在酶活性水平上受终产物苏氨酸的反馈抑制(costrejeanjm,truffa-bachip(1977)."threonine-sensitivehomoserinedehydrogenaseandaspartokinaseactivitiesofescherichiacolik12.kineticandspectroscopiceffectsuponbindingofserineandthreonine."jbiolchem252(15);5332-6.pmid:328500)。目前大肠杆菌已经被多家企业改造用来进行苏氨酸的工业化生产。由于天冬氨酸激酶/高丝氨酸脱氢酶活性受到苏氨酸严谨的调控,解除苏氨酸对天冬氨酸激酶/高丝氨酸脱氢酶的反馈抑制是发展高产苏氨酸菌株的必经之路。德固赛公司通过随机突变筛选获得了解除反馈抑制的aki突变体,是将345位的丝氨酸用其他氨基酸(比如苯丙氨酸s345f)进行替换替换,用于苏氨酸生产(us8143032b1)。增加具有s345f突变体的天冬氨酸激酶/高丝氨酸脱氢酶表达,苏氨酸产量可达82.4mm,增加了野生型天冬氨酸激酶/高丝氨酸脱氢酶表达的对照菌株,苏氨酸产 量仅为2.8mm(lee,j.-h.,etal.,globalanalysesoftranscriptomesandproteomesofaparentstrainandanl-threonine-overproducingmutantstrain.journalofbacteriology,2003.185(18):p.5442-5451)。此外,由于l-苏氨酸是合成其他代谢物的前体,比如大肠杆菌中以苏氨酸为前体,经过苏氨酸脱氨酶等七步反应催化获得异亮氨酸,如果能够获得有效解除l-苏氨酸反馈抑制的天冬氨酸激酶/高丝氨酸脱氢酶,保障前体l-苏氨酸的供应,这对于l-异亮氨酸的生产具有重要的意义。另外,由于天冬氨酸激酶/高丝氨酸脱氢酶催化天冬氨酸半醛合成高丝氨酸,而高丝氨酸是合成l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的前体,如果能够获得有效解除l-苏氨酸反馈抑制的天冬氨酸激酶/高丝氨酸脱氢酶,对于l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的生产都具有重要的意义。因此,综上所述,本领域急需有效解除l-苏氨酸反馈抑制且具有高酶活的天冬氨酸激酶/高丝氨酸脱氢酶突变体。技术实现要素:本发明的目的之一在于提供解除苏氨酸反馈抑制的天冬氨酸激酶/高丝氨酸脱氢酶、其编码基因,包含该编码基因的表达载体以及宿主细胞。本发明的另一目的在于,基于本发明的天冬氨酸激酶/高丝氨酸脱氢酶、其编码基因,包含该编码基因的表达载体以及宿主细胞,提供一种制备l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的方法。本发明再有一目的在于提供一种改造野生型天冬氨酸激酶/高丝氨酸脱氢酶使之解除苏氨酸反馈抑制的方法。在第一方面,本发明提供一种天冬氨酸激酶/高丝氨酸脱氢酶,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列在对应于seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位氨基酸残基发生突变。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶来源于埃希氏菌属细菌;优选地,来源于大肠杆菌。在具体的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶是:a.其氨基酸序列如seqidno:2所示且在seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位氨基酸残基发生突变,或b.具有a所限定的序列且在第432位、349位、410位411位和/或356位以外的位置经过一个或几个氨基酸残基,优选1-20个、更优选1-15个、更优选1-10个、更优选1-3个、最优选1个氨基酸残基的取代、缺失或添加而形成的序列,且基本具有a所限定的天冬氨酸激酶/高丝氨酸脱氢酶功能的由a衍生的天冬氨酸激酶/高丝氨酸脱氢酶。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列在对应于seqidno:2所示氨基酸序列的第432位氨基酸残基为ala、349位氨基酸残基为ala、410位氨基酸残基为ala、411位氨基酸残基为val和/或356位氨基酸残基为ala。在具体的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶是:a.其氨基酸序列如seqidno:10、4、6、8或37所示;或b.包含a所限定的序列且在第432位、349位、410位、411位和/或356位以外的位置经过一个或几个氨基酸残基,优选1-20个、更优选1-15个、更优选1-10个、更优选1-3个、最优选1个氨基酸残基的取代、缺失或添加而形成的序列,且基本具有a所限定的天冬氨酸激酶/高丝氨酸脱氢酶功能的由a衍生的天冬氨酸激酶/高丝氨酸脱氢酶。在具体的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列如seqidno:10、4、6、8、37所示。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶解除苏氨酸反馈抑制。在优选的实施方式中,在4mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,30%以上的活性;更优选,40%以上的活性;最优选,70%以上的活性。在更优选的实施方式中,在6mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,40%以上的活性;更优选,60%以上的活性。在更优选的实施方式中,在8mm或10mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,40%以上的活性。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列如 seqidno:37所示。在第二方面,本发明提供编码本发明第一方面所述天冬氨酸激酶/高丝氨酸脱氢酶的基因。在优选的实施方式中,所述基因的核苷酸序列如seqidno:9、3、5、7或36所示。在第三方面,本发明提供包含本发明第二方面所述编码基因的表达载体。在第四方面,本发明提供一种宿主细胞,所述宿主细胞含有本发明第一方面所述的编码基因或本发明第二方面所述的表达载体。在优选的实施方式中,所述宿主细胞来自埃希氏菌属(escherichia)、棒状杆菌属(corynebacterium)、短杆菌属(brevibacteriumsp.)、芽孢杆菌属(bacillus)、沙雷氏菌属(serratia)或弧菌属(vibrio)。在优选的实施方式中,所述宿主细胞是大肠杆菌(e.coli)或谷氨酸棒状杆菌(corynebacteriumglutamicum)。在优选的实施方式中,所述宿主细胞染色体上整合有本发明的编码基因或表达载体。在优选的实施方式中,所述宿主细胞表达本发明的天冬氨酸激酶/高丝氨酸脱氢酶。在第五方面,本发明提供本发明第一方面所述天冬氨酸激酶/高丝氨酸脱氢酶,或本发明第二方面所述的编码基因,或本发明第三方面所述的表达载体或本发明第四方面所述的宿主细胞在生产l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸中的应用。在第六方面,本发明提供一种制备l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的方法,所述方法包括以下步骤:a.培养本发明第四方面所述的宿主细胞,使之产生l-苏氨酸、l-异亮氨酸、 l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸;和b.从培养液中分离l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸。在优选的实施方式中,所述方法在30-45℃,更优选在37℃实施。在第七方面,本发明提供一种改造野生型天冬氨酸激酶/高丝氨酸脱氢酶使之解除苏氨酸反馈抑制的方法,所述方法包括以下步骤:a.将野生型天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列与seqidno:2所示氨基酸序列作比对;和b.改造所述野生型天冬氨酸激酶/高丝氨酸脱氢酶的编码序列,使得编码的氨基酸序列中对应于seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位的氨基酸残基发生突变。在具体的实施方式中,改造野生型天冬氨酸激酶/高丝氨酸脱氢酶使之解除苏氨酸反馈抑制的方法还包括以下步骤:c.将b得到的编码序列引入合适的宿主细胞;d.培养c得到的宿主细胞;e.测定从步骤d得到的培养体系中所述天冬氨酸激酶/高丝氨酸脱氢酶解除苏氨酸反馈抑制的能力;或直接测定高丝氨酸下游衍生物l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的合成能力。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列在对应于seqidno:2所示氨基酸序列的第432位氨基酸残基为ala、349位氨基酸残基为ala、410位氨基酸残基为ala、411位氨基酸残基为val和/或356位氨基酸残基为ala。在优选的实施方式中,制备本发明天冬氨酸激酶/高丝氨酸脱氢酶的方法包括以下步骤:a.改造seqidno:2所示氨基酸序列的编码序列,使得编码的氨基酸序列中对应于seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位的氨基酸残基发生突变;b.将a得到的编码序列引入合适的宿主细胞;c.培养b得到的宿主细胞;d.测定从步骤c得到的培养体系中所述天冬氨酸激酶/高丝氨酸脱氢酶解除苏氨酸反馈抑制的能力;或直接测定高丝氨酸下游衍生物l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸等的合成能力。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列在对应于seqidno:2所示氨基酸序列的第432位氨基酸残基为ala、349位氨基酸残基为ala、410位氨基酸残基为ala、411位氨基酸残基为val和/或356位氨基酸残基为ala。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1是以天冬氨酸为前体,产生l-苏氨酸、l-异亮氨酸和l-蛋氨酸的示意图,并显示了天冬氨酸激酶/高丝氨酸脱氢酶在l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸合成途径中的位置;图2显示了苏氨酸浓度对野生型天冬氨酸激酶/高丝氨酸脱氢酶以及天冬氨酸激酶/高丝氨酸脱氢酶突变体的活性的影响;图3显示过表达野生型天冬氨酸激酶/高丝氨酸脱氢酶以及天冬氨酸激酶/高丝氨酸脱氢酶突变体的宿主细胞的苏氨酸产量。具体实施方式发明人经过广泛而深入的研究,出乎意料地发现对大肠杆菌来源的天冬氨酸激酶/高丝氨酸脱氢酶的第432位、349位、410位、411位和/或356位进行遗传改造,获得的天冬氨酸激酶/高丝氨酸脱氢酶突变体不仅具有优秀的酶活性,还有效解除了l-苏氨酸的反馈抑制,从而能用于高效生产l-苏氨酸、l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸。在此基础上完成了本发明。本发明的天冬氨酸激酶/高丝氨酸脱氢酶本文所用的术语“天冬氨酸激酶/高丝氨酸脱氢酶”具有本领域普通技术人员通常理解的含义,其由thra基因编码,具有天冬氨酸激酶和高丝氨酸脱氢酶活性,可催化天冬氨酸到天冬氨酸磷酸,以及天冬氨酸半醛到高丝氨酸的反应,是苏氨酸合成途径中的关键酶(如图1所示)。本发明的天冬氨酸激酶/高丝氨酸脱氢酶是一种多酶融合体,所述多酶融合体是指一条肽链上含有两种或两种以上催化活性的酶。本发明的天冬氨酸激酶/高丝氨酸脱氢酶具有两个活性区域,这两个催化活性中心结构相互独立,中间以一段多肽相互连接。在具体的实施方式中,本发明的天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列在对应于seqidno:2所示氨基酸序列(其编码核苷酸序列如seqidno:1所示)的第432位、349位、410位、411位和/或356位氨基酸残基发生突变。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列在对应于seqidno:2所示氨基酸序列的第432位氨基酸残基为ala、349位氨基酸残基为ala、410位氨基酸残基为ala、411位氨基酸残基为val和/或356氨基酸残基为ala。在优选的实施方式中,所述天冬氨酸激酶/高丝氨酸脱氢酶的氨基酸序列如seqidno:10、4、6、8或37所示,优选如seqidno:37所示。本发明的天冬氨酸激酶/高丝氨酸脱氢酶解除苏氨酸反馈抑制。在具体的实施方式中,在4mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,30%以上的活性;更优选,40%以上的活性;最优选,70%以上的活性。在具体的实施方式中,在6mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,40%以上的活性;更优选,60%以上的活性。在具体的实施方式中,在8mm或10mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,40%以上的活性。本领域普通技术人员不难知晓,在多肽的某些区域,例如非重要区域改变少数氨基酸残基基本上不会改变生物活性,例如,适当替换某些氨基酸得到的序列并不会影响其活性(可参见watson等,molecularbiologyofthegene,第四版,1987,thebenjamin/cummingspub.co.p224)。因此,本领域普通技术人员能够实施这种 替换并且确保所得分子仍具有所需生物活性。例如,本领域技术人员熟知,用性能相近或相似的氨基酸进行取代,例如,异亮氨酸与亮氨酸相互取代时,不会改变所得蛋白质的功能。再例如,在c末端和/或n末端添加一个或数个氨基酸,例如为便于分离而添加的标签通常不会改变所得蛋白质的功能。例如,本申请实施例中的蛋白即是为了便于纯化在c端带有6his标签的蛋白。因此,本发明的天冬氨酸激酶/高丝氨酸脱氢酶可以在对应于seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位氨基酸残基发生突变的基础上作进一步突变而仍具备本发明天冬氨酸激酶的功能和活性。例如,本发明的天冬氨酸激酶/高丝氨酸脱氢酶可以是:a.其氨基酸序列如seqidno:2所示且在seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位氨基酸残基发生突变;或,b.具有a所限定的序列且在第432位、349位、410位、411位和/或356位以外的位置经过一个或几个氨基酸残基,优选1-20个、更优选1-15个、更优选1-10个、更优选1-3个、最优选1个氨基酸残基的取代、缺失或添加而形成的序列,且基本具有a所限定的天冬氨酸激酶/高丝氨酸脱氢酶功能的由a衍生的天冬氨酸激酶/高丝氨酸脱氢酶。在本发明中,本发明的天冬氨酸激酶/高丝氨酸脱氢酶包括与氨基酸序列如seqidno:10、4、6、8或37所示的天冬氨酸激酶相比,有至多20个、较佳地至多10个,再佳地至多3个,更佳地至多2个,最佳地至多1个氨基酸被性质相似或相近的氨基酸所替换而形成的突变体。这些保守性变异的突变体可根据,例如下表所示进行氨基酸替换而产生。本发明还提供了编码本发明多肽的多核苷酸。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。因此,本文所用的“含有”,“具有”或“包括”包括了“包含”、“主要由……构成”、“基本上由……构成”、和“由……构成”;“主要由……构成”、“基本上由……构成”和“由……构成”属于“含有”、“具有”或“包括”的下位概念。thra、thrb和thrc基因本文所述的thra基因编码天冬氨酸激酶/高丝氨酸脱氢酶,thrb基因编码高丝氨酸激酶,thrc基因编码苏氨酸合成酶。在l-苏氨酸生产领域,采用thra基因、thrb基因和thrc基因过表达的菌株是常规手段。三种基因处于同一基因表达框中(thrabc),因此,可以克隆得到包含它们的基因表达框,连接入表达载体,从而得到三种基因的过表达载体。对应于seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位的氨基酸残基本领域普通技术人员均知道,可在某个蛋白的氨基酸序列中对一些氨基酸残基作出各种突变,例如取代、添加或缺失,但得到的突变体仍能具备原蛋白的功能或活性。因此,本领域普通技术人员可对本发明具体公开的氨基酸序列作出一定改变而得到仍具有所需活性的突变体,那么这种突变体中与seqidno:2所示氨基酸序列的第432位、349位、410位、411位和/或356位的氨基酸残基相对应的氨基酸残基可能就不是第432位、349位、410位、411位和/或356位,但如此得到的突变体仍应落在本发明的保护范围内。本文所用的术语“对应于”具有本领域普通技术人员通常理解的意义。具体地说,“对应于”表示两条序列经同源性或序列相同性比对后,一条序列与另一条 序列中的指定位置相对应的位置。因此,就“对应于seqidno:2所示氨基酸序列的第432位的氨基酸残基”而言,如果在seqidno:2所示氨基酸序列的一端加上6-his标签,那么所得突变体中对应于seqidno:2所示氨基酸序列的第432位就可能是第438位;而如果删除seqidno:2所示氨基酸序列中的少数氨基酸残基,那么所得突变体中对应于seqidno:2所示氨基酸序列的第432位就可能是第428位,等等。再例如,如果一条具有400个氨基酸残基的序列与seqidno:2所示氨基酸序列的第50-450位具有较高的同源性或序列相同性,那么所得突变体中对应于seqidno:2所示氨基酸序列的第432位就可能是第382位。同样,以上描述也等同适用于“对应于seqidno:2所示氨基酸序列的349位、410位、411位和/或356位的氨基酸残基”。在具体的实施方式中,所述同源性或序列相同性可以是80%以上,优选90%以上,更优选95%-98%,最优选99%以上。本领域普通技术人员公知的测定序列同源性或相同性的方法包括但不限于:计算机分子生物学(computationalmolecularbiology),lesk,a.m.编,牛津大学出版社,纽约,1988;生物计算:信息学和基因组项目(biocomputing:informaticsandgenomeprojects),smith,d.w.编,学术出版社,纽约,1993;序列数据的计算机分析(computeranalysisofsequencedata),第一部分,griffin,a.m.和griffin,h.g.编,humanapress,新泽西,1994;分子生物学中的序列分析(sequenceanalysisinmolecularbiology),vonheinje,g.,学术出版社,1987和序列分析引物(sequenceanalysisprimer),gribskov,m.与devereux,j.编mstocktonpress,纽约,1991和carillo,h.与lipman,d.,siamj.appliedmath.,48:1073(1988)。测定相同性的优选方法要在测试的序列之间得到最大的匹配。测定相同性的方法编译在公众可获得的计算机程序中。优选的测定两条序列之间相同性的计算机程序方法包括但不限于:gcg程序包(devereux,j.等,1984)、blastp、blastn和fasta(altschul,s,f.等,1990)。公众可从ncbi和其它来源得到blastx程序(blast手册,altschul,s.等,ncbinlmnihbethesda,md.20894;altschul,s.等,1990)。熟知的smithwaterman算法也可用于测定相同性。宿主细胞本文所用的术语“宿主细胞”具有本领域普通技术人员通常理解的含义,即,能够产生本发明的天冬氨酸激酶/高丝氨酸脱氢酶的宿主细胞。换言之,本发明可以利用任何宿主细胞,只要本发明的天冬氨酸激酶/高丝氨酸脱氢酶能在该宿主细胞中表达。例如,在具体的实施例中,本发明利用的是包含外源性的本发明天冬氨酸激酶/高丝氨酸脱氢酶编码基因,例如seqidno:3或5所示核苷酸序列的宿主细胞,优选大肠杆菌菌株。但本领域普通技术人员应该知道,本发明不限于包含外源性编码基因的宿主细胞。例如,本发明的宿主细胞中包含的天冬氨酸激酶/高丝氨酸脱氢酶的编码基因不仅可以是重组载体或质粒,还有可能是基因组上整合有所述酶的编码基因,即,在基因组整合上的酶的编码基因可能是通过转入质粒进行同源重组得到,也有可能在基因组上定点突变相应的位点而得到。在具体的实施方式中,本发明的宿主细胞能够高效产生l-苏氨酸,且具有对l-苏氨酸的抗反馈抑制能力。在具体的实施方式中,本发明的宿主细胞能够产生l-苏氨酸以及以l-苏氨酸为前体的其它氨基酸,例如l-异亮氨酸。另外,由于天冬氨酸激酶/高丝氨酸脱氢酶催化天冬氨酸半醛合成高丝氨酸,而高丝氨酸是合成l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的前体,有效解除l-苏氨酸反馈抑制的天冬氨酸激酶/高丝氨酸脱氢酶,对于l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的生产都具有重要的意义。在优选的实施方式中,所述的宿主细胞来自埃希氏菌属(escherichia)、棒状杆菌属(corynebacterium)、短杆菌属(brevibacteriumsp.)、芽孢杆菌属(bacillus)、沙雷氏菌属(serratia)或弧菌属(vibrio)。在优选的实施方式中,所述的宿主细胞是大肠杆菌(e.coli)或谷氨酸棒状杆菌(corynebacteriumglutamicum)。本发明多肽或本发明宿主细胞的应用鉴于本发明的教导,本领域技术人员可以知晓本发明的天冬氨酸激酶/高丝氨酸脱氢酶,或其编码基因,或包含所述编码基因的表达载体或所述宿主细胞可以用于生产l-苏氨酸。而鉴于天冬氨酸激酶是l-苏氨酸为前体合成的其他代谢物,比如 l-异亮氨酸的合成途径所共用的酶,本发明多肽或本发明宿主细胞也能够用于产生l-异亮氨酸。由于天冬氨酸激酶/高丝氨酸脱氢酶催化天冬氨酸半醛合成高丝氨酸,而高丝氨酸是合成l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的前体,另外,由于天冬氨酸激酶/高丝氨酸脱氢酶催化天冬氨酸半醛合成高丝氨酸,而高丝氨酸是合成l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的前体,有效解除l-苏氨酸反馈抑制的天冬氨酸激酶/高丝氨酸脱氢酶对于l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸的生产都具有重要的意义。在具体的实施方式中,本发明的宿主细胞可以在30-45℃,优选37℃产生l-苏氨酸。解除苏氨酸反馈抑制本领域技术人员应理解,本文所用的术语“解除苏氨酸反馈抑制”是指一种原本受到苏氨酸反馈抑制的酶,在经过改造后令其受苏氨酸抑制程度降低。这种降低是通过两种酶在相同苏氨酸浓度下的抑制程度比较获得的。“解除苏氨酸反馈抑制”包含对反馈抑制的部分解除以及全部解除。而抑制程度是指在一定浓度的苏氨酸存在下,与不存在苏氨酸时相比,天冬氨酸激酶/高丝氨酸脱氢酶酶活性损失(即受到抑制)的比例。在这种条件下,天冬氨酸激酶酶活性保留下来的比例,称为酶活残存比例或酶活保留比例或相对酶活,由于:酶活损失比例+酶活残存比例=100%,所以经常用酶活残存比例表示抑制程度。酶活残存比例越高,抑制程度越低。相应的,“解除苏氨酸反馈抑制”也通常用改造前后两个酶残存酶活比例的比较来刻画。在具体的实施方式中,在4mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,30%以上的活性;更优选,40%以上的活性;最优选,70%以上的活性。在具体的实施方式中,在6mm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,40%以上的活性;更优选,60%以上的活性。在具体的实施方式中,在8mm或10nm浓度的苏氨酸存在下,所述的天冬氨酸激酶/高丝氨酸脱氢酶至少保留20%以上的活性;优选地,40%以上的活性。本发明的应用与优点1.本发明提供的各种天冬氨酸激酶/高丝氨酸脱氢酶、其编码基因以及包含所述编码基因的宿主细胞可以在工业上应用以产生l-苏氨酸和其它氨基酸,例如l-异亮氨酸、l-蛋氨酸、o-乙酰高丝氨酸或o-琥珀酰高丝氨酸;2.本发明提供的各种天冬氨酸激酶/高丝氨酸脱氢酶是一种高比活和有效解除l-苏氨酸反馈抑制的天冬氨酸激酶/高丝氨酸脱氢酶。因此,本发明的各种天冬氨酸激酶/高丝氨酸脱氢酶、其编码基因以及包含所述编码基因的宿主细胞不仅能高效地产生l-苏氨酸,还能有效解除苏氨酸反馈抑制,在工业上的应用前景广阔;3.本发明提供的各种天冬氨酸激酶/高丝氨酸脱氢酶以及它们的编码基因有助于阐明与理解l-苏氨酸生物合成途径以及反馈抑制的相关机理,从而为进一步利用基因工程手段改造相关蛋白质或宿主细胞提供了理论基础与材料。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。实施例1.天冬氨酸激酶/高丝氨酸脱氢酶突变体的体外效果检测1.天冬氨酸激酶/高丝氨酸脱氢酶野生型基因的克隆表达将e.colimg1655(获自atcc700926,可参考blattnerfr等,thecompletegenomesequenceofescherichiacolik-12.science277:1453-62(1997))在lb培养基(胰蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,ph7.0)中,37℃,200rpm,培养12-16h后,收集细胞,采用biomiga基因组小提试剂盒提取基因组dna。以大肠杆菌基因组为模板,通过pcr获得野生型thra基因。具体操作为:pcr扩增:以catatgcgagtgttgaagttcggcggtaca和(seqidno:15)和cgcgaattctcagactcctaacttccatgagagggtac(seqidno:16)为引物,从e.colimg1655基因组dna上扩增thra基因(野生型thra的编码基因,其氨基酸序列为seqidno:2,其核苷酸序列为seqidno:1;最后所获得的dna片段带上了ndei和ecori的酶切位点。通过ndei和ecori将最后获得的dna片段克隆至pet28a质粒,所得质粒命名为pet-thra。2.天冬氨酸激酶/高丝氨酸脱氢酶的定点突变利用stratagene系列xl-ⅱ定点突变试剂盒,通过引物thra_i349a_f/r(见表1)对质粒pet-thra进行pcr引入突变位点,获得的质粒经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,采用dpni酶切1h除去甲基化的模板质粒dna,处理后的质粒转入感受态细胞e.colibl21(de3)(购自北京全式金生物技术有限公司),所获得的正确突变质粒命名为pet-thra349,携带的thra突变体核苷酸序列如seqidno:3所示,翻译的氨基酸序列如seqidno:4所示。通过引物thra_r410a_f/r(见表1)对质粒pet-thra进行pcr引入突变位点,获得的质粒经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,采用dpni酶切1h除去甲基化的模板质粒dna,处理后的质粒转入感受态细胞e.colibl21(de3)(购自北京全式金生物技术有限公司),所获得的正确突变质粒命名为pet-thra410,携带的thra突变体核苷酸序列如seqidno:5所示,翻译的氨基酸序列如seqidno:6所示。通过引物thra_g411v_f/r(见表1)对质粒pet-thra进行pcr引入突变位点,获得的质粒经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,采用dpni酶切1h除去甲基化的模板质粒dna,处理后的质粒转入感受态细胞e.colibl21(de3)(购自北京全式金生物技术有限公司),所获得的正确突变质粒命名为pet-thra411,携带的thra突变体核苷酸序列如seqidno:7所示,翻译的氨基酸序列如seqidno:8所示。通过引物thra_q432a_f/r(见表1)对质粒pet-thra进行pcr引入突变位点,获得的质粒经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,采用dpni酶切1h除去甲基化的模板质粒dna,处理后的质粒转入感受态细胞e.coli bl21(de3)(购自北京全式金生物技术有限公司),所获得的正确突变质粒命名为pet-thra432,携带的thra突变体核苷酸序列如seqidno:9所示,翻译的氨基酸序列如seqidno:10所示。通过引物thra_y356a_f/r(见表1)对质粒pet-thra进行pcr引入突变位点,获得的质粒经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,采用dpni酶切1h除去甲基化的模板质粒dna,处理后的质粒转入感受态细胞e.colibl21(de3)(购自北京全式金生物技术有限公司),所获得的正确突变质粒命名为pet-thra356,携带的thra突变体核苷酸序列如seqidno:36所示,翻译的氨基酸序列如seqidno:37所示。表1thra_i349a_fatttccgtggtgctggcaacgcaatcatcttc(seqidno:21)thra_i349a_rgccagcaccacggaaatacgggcgcgtg(seqidno:22)thra_r410a_fgcagggatctcggcgaaattctttgccgcactgg(seqidno:23)thra_r410a_rgccgagatccctgccaaggtgcgcataccatc(seqidno:24)thra_g411v_fcgtgtgatctcggcgaaattctttgcc(seqidno:25)thra_g411v_rcgccgagatcacacgcaaggtgcgcatac(seqidno:26)thra_q432a_fgccattgctgcgggatcttctgaacgctcaatctc(seqidno:27)thra_q432a_rgttcagaagatcccgcagcaatggcgacaatgttg(seqidno:28)thra_y356a_fcaatcatcttccgaagccagcatcagtttc(seqidno:29)thra_y356a_rcttcggaagatgattgcgtaatcagcac(seqidno:30)3.天冬氨酸激酶/高丝氨酸脱氢酶的表达将前面构建好的野生型型质粒pet-thra以及突变体质粒pet-thra349、pet-thra410、pet-thra411、pet-thra432、pet-thra356分别化学转化至e.colibl21(de3)(购自北京全式金生物技术有限公司),依次获得的菌株分别命名为e.colide3(pet-thra)、e.colide3(pet-thra349)、e.colide3(pet-thra410)、e.colide3(pet-thra411)、e.colide3(pet-thra432)和e.colide3(pet-thra356)以实现其诱导表达。4.天冬氨酸激酶/高丝氨酸脱氢酶的蛋白纯化及酶活测定蛋白表达:将e.colide3(pet-thra)、e.colide3(pet-thra349)、e.colide3(pet-thra410)、e.colide3(pet-thra411)、e.colide3(pet-thra432)和e.colide3(pet-thra356)菌株分别在lb培养基上37℃过夜培养,然后按照2%转接装有100mllb培养基的500ml三角瓶,补加25mg/l的卡纳霉素,37℃,200rpm培养至od600约为0.6,加入100ul0.5miptg进行诱导,诱导温度16℃(温度高 时诱导包涵体较多),诱导时间16-20h.蛋白纯化:收集培养好的菌体,6000rpm,10min收集菌体,去上清,菌体用30mlbuffera悬浮;再次离心(6000rpm,10min),去上清,再次用30mlbuffera悬浮;最后,离心(6000rpm,10min),去上清,重悬浮于6mlbuffera中。超声破碎(25%功率,10min,超声1s,停止3s,冰浴操作)。破碎后4℃,13000rpm离心30min,保留上清。表达蛋白上加有his标签,利于利用镍柱(ge)进行纯化:首先所有上清分次过镍柱;然后600ulbuffera清洗3次,弃流穿液体;随后200ulbufferb过柱,重复1次;将过柱后的液体加入超滤管,加入4mlbufferc,7500g,25min,重复1次。蛋白纯化中用到的溶液:buffera:25mmtris,150mmnacl,20mm咪唑,ph7.5;bufferb:25mmtris,150mmnacl,500mm咪唑,ph7.5;bufferc:tes50mm,kcl250mm,mgcl26mm,ph7.5。蛋白浓度定量:1.按操作手册(bca蛋白定量分析试剂盒,thermofisher)对标准蛋白质和样品进行稀释;2.以50:1混合a液和b液,组成workingreagent(wr);3.在96孔板中点25ul蛋白质+200ulwr;4.震动混匀20-30s,37℃反应30min,冷却至室温;5.562nm下检测吸光值。酶活测定:天冬氨酸激酶测定是根据偶联反应进行测定。200ul体系中含有:50mmtes,250mmkcl,6mmmgcl2,ph7.5,丙酮酸激酶(pk)2u,乳酸脱氢酶(ldh)2.5u,nadh0.3mm,pep1.5mm和纯化的酶(大约0.8ug)。最终加入天冬氨酸开始反应,并且在340nm处进行检测。酶活单位是每分钟每mg蛋白催化nadh降低的毫摩尔数(chassagnole,c.,etal.,anintegratedstudyofthreonine-pathwayenzymekineticsinescherichiacoli.biochem.j,2001.356:p.415-423)。结果如图2所示,野生型的天冬氨酸激酶/高丝氨酸脱氢酶在4mm的苏氨酸时只残存约12%的酶活,说明酶活受到苏氨酸的反馈抑制;349,410,411,432突变体能够在一定程度的解除苏氨酸的反馈抑制;而356突变体的酶活在高达4mm的苏氨酸条件下酶活超过70%,说明356位氨基酸突变能够有效的解除苏氨酸的反馈抑制。实施例2.检验野生型和突变型(i349a、r410a、g411v、q432a)天冬氨酸 激酶/高丝氨酸脱氢酶产生l-苏氨酸的能力1.天冬氨酸激酶/高丝氨酸脱氢酶野生型基因的克隆表达将e.colimg1655(获自atcc700926,可参考blattnerfr等,thecompletegenomesequenceofescherichiacolik-12.science277:1453-62(1997))在lb培养基(胰蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,ph7.0)中,37℃,200rpm,培养12-16h后,收集细胞,采用biomiga基因组小提试剂盒提取基因组dna。以大肠杆菌基因组为模板,通过pcr获得在含有野生型thrb和thrc的片段,最后所获得的dna片段带上了ncoi和hindiii的酶切位点。thrb氨基酸序列为(seqidno:12),其核苷酸序列为(seqidno:11);thrc氨基酸序列为(seqidno:14),其核苷酸序列为(seqidno:13).具体操作为:pcr扩增:以cgggatccatggttaaagtttatgcccc(seqidno:17)和cccaagcttttactgatgattcatcatcaattt(seqidno:18)为引物,从e.colimg1655基因组dna上扩增thrb和thrc基因;最后所获得的dna片段带上了ncoi和hindiii的酶切位点。将最后获得的含有thrb和thrc的dna片段克隆至ptrc99a质粒,所得质粒命名为ptrc99a-thrbc。2.天冬氨酸激酶/高丝氨酸脱氢酶表达载体构建以catgccatggtttacggctagctcagtcctaggtactatgctagcactagtgaaagaggagaaatactagatgcgagtgttgaagttcggc(seqidno:19)和catgccatggatcctcagactcctaacttccatg(seqidno:20)为引物,以质粒pet-thra为模板,进行pcr,最后所获得的dna片段n端含有启动子并且两端均带上了ncoi酶切位点,获得的产物经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,ncoi酶切后连接到ptrc99a-thrbc。处理后的质粒转入大肠杆菌dh5α(购自北京全式金生物技术有限公司),获得的正确突变质粒。以具有正确突变质粒为模板,gagcggataacaatttcacacagg(seqidno:38)和ttggtgtcatagaggaatttac(seqidno:39)为引物,能够扩增获得约1900bp片段的质粒命名为ptrc99a-thrabc。携带野生thra核苷酸序列如seqidno:1所 示,翻译的氨基酸序列如seqidno:2所示;以catgccatggtttacggctagctcagtcctaggtactatgctagcactagtgaaagaggagaaatactagatgcgagtgttgaagttcggc(seqidno:19)和catgccatggatcctcagactcctaacttccatg(seqidno:20)为引物,以质粒pet-thra349为模板,进行pcr,最后所获得的dna片段n端含有启动子并且两端均带上了ncoi酶切位点,获得的产物经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,ncoi酶切后连接到ptrc99a-thrbc。处理后的质粒转入大肠杆菌dh5α,获得的正确突变质粒。以具有正确突变质粒为模板,gagcggataacaatttcacacagg(seqidno:38)和ttggtgtcatagaggaatttac(seqidno:39)为引物,能够扩增获得约1900bp片段的质粒命名为ptrc99a-thra349bc。携带thra的突变体核苷酸序列如seqidno:3所示,翻译的氨基酸序列20如seqidno:4所示;以catgccatggtttacggctagctcagtcctaggtactatgctagcactagtgaaagaggagaaatactagatgcgagtgttgaagttcggc(seqidno:19)和catgccatggatcctcagactcctaacttccatg(seqidno:20)为引物,以质粒pet-thra410为模板,进行pcr,最后所获得的dna片段n端含有启动子并且两端均带上了ncoi酶切位点,获得的产物经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,ncoi酶切后连接到ptrc99a-thrbc。处理后的质粒转入大肠杆菌dh5α,获得的正确突变质粒。以具有正确突变质粒为模板,gagcggataacaatttcacacagg(seqidno:38)和ttggtgtcatagaggaatttac(seqidno:39)为引物,能够扩增获得约1900bp片段的质粒命名为ptrc99a-thra410bc。携带thra的突变体核苷酸序列如seqidno:5所示,翻译的氨基酸序列如seqidno:6所示;以catgccatggtttacggctagctcagtcctaggtactatgctagcactagtgaaagaggagaaatactagatgcgagtgttgaagttcggc(seqidno:19)和catgccatggatcctcagactcctaacttccatg(seqidno:20)为引物,以 质粒pet-thra411为模板,进行pcr,最后所获得的dna片段n端含有启动子并且两端带上了ncoi酶切位点,获得的产物经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,ncoi酶切后连接到ptrc99a-thrbc。处理后的质粒转入大肠杆菌dh5α,获得的正确突变质粒。以具有正确突变质粒为模板,gagcggataacaatttcacacagg(seqidno:38)和ttggtgtcatagaggaatttac(seqidno:39)为引物,能够扩增获得约1900bp片段的质粒命名为ptrc99a-thra411bc。携带thra的突变体核苷酸序列如seqidno:7所示,翻译的氨基酸序列如seqidno:8所示;以catgccatggtttacggctagctcagtcctaggtactatgctagcactagtgaaagaggagaaatactagatgcgagtgttgaagttcggc(seqidno:19)和catgccatggatcctcagactcctaacttccatg(seqidno:20)为引物,以质粒pet-thra432为模板,进行pcr,最后所获得的dna片段n端含有启动子并且两端均带上了ncoi酶切位点,获得的产物经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,ncoi酶切后连接到ptrc99a-thrbc。处理后的质粒转入大肠杆菌dh5α,获得的正确突变质粒。以具有正确突变质粒为模板,gagcggataacaatttcacacagg(seqidno:38)和ttggtgtcatagaggaatttac(seqidno:39)为引物,能够扩增获得约1900bp片段的质粒命名为ptrc99a-thra432bc。携带thra的突变体核苷酸序列如seqidno:9所示,翻译的氨基酸序列如seqidno:10所示;将质粒ptrc99a-thrabc,ptrc99a-thra349bc,ptrc99a-thra410bc,ptrc99a-thra411bc,ptrc99a-thra432bc分别电转至大肠杆菌mg1655中,并分别命名为mg-thrabc,mg-thra349bc,mg-thra410bc,mg-thra411bc,mg-thra432bc。发酵培养基如下:葡萄糖50g/l、硫酸铵10g/l、磷酸二氢钾2g/l、酵母粉3g/l,七水合硫酸镁0.5g/l;五水合硫酸亚铁0.01g/l,五水合硫酸锰0.01g/l,mops0.4m。4ml发酵培养基,接种5%,加入4ul,100mg/ml氨苄。96深孔板每个孔加入400ul接种后并加抗生素的发酵培养基,37℃、750rpm,摇床发酵36h。在e.colimg1655菌株中过表达天冬氨酸激酶/高丝氨酸脱氢酶野生型和突变 体的苏氨酸产量如图3所示。过表达野生型thra、thrb和thrc所编码的三个蛋白的菌株中苏氨酸产量为:0.178±0.002g/l;过表达含有i349a突变的thra和野生型thrb、thrc所编码的三个蛋白的菌株中苏氨酸产量为:0.860±0.027g/l,其苏氨酸产量为过表达野生型thra、thrb和thrc所编码的三个蛋白的菌株的苏氨酸产量的4.8倍;过表达含有r410a突变的thra和野生型thrb、thrc所所编码的三个蛋白的菌株中苏氨酸产量为:1.408±0.029g/l,其苏氨酸产量为过表达野生型thra、thrb和thrc所编码的三个蛋白的菌株的苏氨酸产量的7.9倍;过表达含有g411v突变的thra和野生型thrb、thrc所编码的三个蛋白的菌株中苏氨酸产量为:1.130±0.024g/l,其苏氨酸产量为过表达野生型thra、thrb和thrc所编码的三个蛋白的菌株的苏氨酸产量的6.3倍;过表达含有q432a突变的thra和野生型thrb、thrc所编码的三个蛋白的菌株中苏氨酸产量为:2.353±0.036g/l,其苏氨酸产量为过表达野生型thra、thrb和thrc编码的三个蛋白的菌株的苏氨酸产量的13.2倍。发酵实验表明,过表达thra基因的349,410,411,432突变体能够明显提高苏氨酸的产量。这些突变体可以应用到苏氨酸生产菌株的改造,提升菌株的苏氨酸产量。实施例3.检验野生型和突变型(y356a)天冬氨酸激酶/高丝氨酸脱氢酶产生l-苏氨酸的能力1.天冬氨酸激酶/高丝氨酸脱氢酶野生型基因的克隆表达将e.colimg1655(获自atcc700926,可参考blattnerfr等,thecompletegenomesequenceofescherichiacolik-12.science277:1453-62(1997))在lb培养基(胰蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l,ph7.0)中,37℃,200rpm,培养12-16h后,收集细胞,采用biomiga基因组小提试剂盒提取基因组dna。以大肠杆菌基因组为模板,通过pcr获得在含有野生型thrb和thrc的片段,最后所获得的dna片段带上了ncoi和hindiii的酶切位点。thrb氨基酸序列为(seqidno:12),其核苷酸序列为(seqidno:11);thrc氨基酸序列为(seqidno:14),其核苷酸序列为(seqidno:13).具体操作为:pcr扩增:以cgggatccatggttaaagtttatgcccc(seqidno:17)和 cccaagcttttactgatgattcatcatcaattt(seqidno:18)为引物,从e.colimg1655基因组dna上扩增thrb和thrc基因;最后所获得的dna片段具有了ncoi和hindiii的酶切位点。将最后获得的含有thrb和thrc的dna片段克隆至ptrc99a质粒,所得质粒命名为ptrc99a-thrbc。2.天冬氨酸激酶/高丝氨酸脱氢酶表达载体构建利用iionestepcloningkit(vazymebiotech,中国),将以(seqidno:31)、(seqidno:32)为引物,ptrc99a-thrbc质粒为模板pcr获得的dna片段和人工合成的含有四环素抗性基因的dna片段(seqidno:33)为模板pcr获得的dna片段重组成为环形dna,该dna转化dh5α,提取的质粒命名为ptrc99at-thrbc。以catgccatggcatgatctagagaaagacaggacccactagatgcgagtgttgaagttcgg(seqidno:34)和catgccatgggtatatctccttcttaaagtttctagatcagactcctaacttccatgag(seqidno:35)为引物,以质粒pet-thra为模板,进行pcr,最后所获得的dna片段含有核糖体结合序列并且两端均带上了ncoi酶切位点,获得的产物经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,ncoi酶切后连接到ptrc99at-thrbc。处理后的质粒转入大肠杆菌dh5α(购自北京全式金生物技术有限公司),获得的正确突变质粒。以具有正确突变质粒为模板,gagcggataacaatttcacacagg(seqidno:38)和ttggtgtcatagaggaatttac(seqidno:39)为引物,能够扩增获得约1900bp片段的质粒命名为ptrc99at-thrabc。携带野生thra核苷酸序列如seqidno:1所示,翻译的氨基酸序列如seqidno:2所示;以catgccatggcatgatctagagaaagacaggacccactagatgcgagtgttgaagttcgg(seqidno:34)和catgccatgggtatatctccttcttaaagtttctagatcagactcctaacttccatgag(seqidno:35)为引物,以质粒pet-thra356为模板,进行pcr,最后所获得的dna片段含有核糖体结合序列并且两端均带上了ncoi酶切位点,获得的产 物经过pcr产物回收,除去pcr体系中的酶及缓冲体系中的盐离子后,ncoi酶切后连接到ptrc99at-thrbc。处理后的质粒转入大肠杆菌dh5α(购自北京全式金生物技术有限公司),获得的正确突变质粒。以具有正确突变质粒为模板,gagcggataacaatttcacacagg(seqidno:38)和ttggtgtcatagaggaatttac(seqidno:39)为引物,能够扩增获得约1900bp片段的质粒命名为ptrc99at-thra356bc。携带thra的突变体核苷酸序列如seqidno:36所示,翻译的氨基酸序列如seqidno:37所示;将质粒ptrc99at-thrabc,ptrc99at-thra356bc分别电转至大肠杆菌mg1655中,并分别命名为mg-tthrabc,mg-tthra356bc。3表达天冬氨酸激酶/高丝氨酸脱氢酶野生型或突变体菌株苏氨酸生产能力比较发酵培养基如下:葡萄糖50g/l、硫酸铵10g/l、磷酸二氢钾2g/l、酵母粉3g/l,七水合硫酸镁0.5g/l;五水合硫酸亚铁0.01g/l,五水合硫酸锰0.01g/l,mops0.4m。500ml三角瓶加入20ml培养基,接种5%,加入20ul,100mg/ml四环素,37℃、250rpm,摇床发酵4h后添加10ul0.1miptg,发酵至第36h结束。在e.colimg1655菌株中过表达天冬氨酸激酶/高丝氨酸脱氢酶野生型和突变体的苏氨酸产量如表2所示。过表达野生型thra、thrb和thrc所编码的三个蛋白的菌株中苏氨酸产量低于0.2g/l;过表达含有356突变的thra和野生型thrb、thrc所编码的三个蛋白的菌株中苏氨酸产量为:0.688g/l。发酵实验表明,过表达thra基因的356突变体能够明显提高苏氨酸的产量。该突变体可以应用到苏氨酸生产菌株的改造,提升菌株的苏氨酸产量。表2在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后, 本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1