CD40片段及其用途的制作方法
关于联邦资助研究的声明
本发明在美国国立过敏和传染病研究所、美国国立卫生研究院提供的合同HHSN272200900037C的美国政府支持下完成。政府对本专利具有某些权利。
技术领域
本发明涉及CD40片段、抗CD40抗体和所述抗体的用途,例如,降低移植排斥的可能性、或增加移植排斥之前的持续时间,诱导免疫抑制或治疗自身免疫性病症。
背景技术:
免疫系统、特别是体液免疫系统的抑制在器官移植和自身免疫性病症的治疗中是有益的。例如,器官移植已成为涉及器官损害的多种形式的危及生命的疾病的优选治疗方法。当接受移植的细胞或组织的生物体产生对该组织的不期望的免疫应答时,发生移植排斥。组织型匹配可以最大限度地减少移植排斥,但是甚至匹配的组织通常受供体排斥。因此,对于几乎所有组织移植的情况,都需要免疫抑制治疗。
已经实现了临床移植的改善结果,这主要通过开发日益强大的非特异性免疫抑制药物来抑制排斥反应。尽管短期结果已经改善,但是长期结果仍然不足。需要长期免疫抑制剂来抗击移植器官的慢性排斥,并且这些药剂的使用极大地增加了心血管疾病、感染和恶性肿瘤的风险。
用于减少移植排斥的一个潜在目标是CD40/CD154相互作用。CD40在B淋巴细胞表面上表达,而CD154在T细胞表面上表达。这两种蛋白之间的相互作用与B细胞活化相关,所述B细胞活化触发细胞因子表达,以及细胞表面标志物包括CD23、CD80和CD86的表达。已经显示使用抗CD154抗体阻断该相互作用以减少或消除非人灵长类动物中移植组织的排斥。
对于任何类型的免疫抑制(例如,在移植程序中),效力和毒性之间的平衡对于其临床接受性而言是一个关键因素。因此,存在对于特异性靶向参与(例如)移植排斥和自身免疫性病症的免疫途径的疗法的需求。
技术实现要素:
在第一方面,本发明的特征在于分离的抗体或其抗原结合片段(例如,缺乏Fc部分或者是F(ab')2、Fab、Fv或scFv结构的抗体),其特异性结合CD40(例如,猕猴、鼠或人CD40)上存在的表位,其中该表位被2C10抗体所识别(例如,其中所述表位不被3A8或Chi220抗体或两者所识别)。该抗体在体外能够阻断表达CD154的Jurkat细胞对B淋巴细胞(例如,猕猴或人B淋巴细胞)的活化,或者在体外能够抑制猕猴B细胞,例如,降低CD23、CD80或CD86表达。该抗体可以是2C10抗体。该抗体可以具有人恒定区。在某些实施方案中,该抗体是人源化抗体或人抗体。在某些实施方案中,该抗体可以是单克隆抗体或多克隆抗体。
在具体实施方案中,该抗体包括由SEQ ID NO:2的氨基酸20-132定义的重链可变区,其抗体结合部分或片段,或其人源化形式。在其他实施方案中,抗体的抗体轻链可变区包括SEQ ID NO:4的23-128的序列,其抗体结合部分或片段,或其人源化形式。在其他实施方案中,抗体的重链可变区包括SEQ ID NO:2的氨基酸20-132,并且抗体的轻链可变序列包括SEQ ID NO:4的氨基酸23-128。
本发明的特征还在于编码第一方面的抗体或抗体片段的多核苷酸,包括该多核苷酸的载体,和包括该载体的细胞。该细胞可以是真核细胞(例如,哺乳动物诸如人、小鼠、猴或兔细胞),或者可以是原核细胞(例如,细菌细胞诸如大肠杆菌细胞)。
在另一个方面,本发明的特征在于抑制受试者(例如,哺乳动物诸如人)的免疫系统的方法。该方法包括给受试者施用有效量的第一方面的抗体或其抗原结合片段。
在又另一个方面,本发明的特征在于在需要其的受试者(例如,哺乳动物诸如人)中治疗或预防性治疗移植排斥或增加发生移植排斥之前的持续时间的方法。该方法包括给受试者施用有效量的第一方面的抗体或其抗原结合片段。
在前述两个方面的任一个中,受试者可能已经接受,或者可能需要,器官移植(例如,心脏、肾、肺、肝脏、胰腺、肠、和胸腺、或其部分)或组织移植(例如,骨、肌腱、角膜、皮肤、心脏瓣膜、静脉、或骨髓)。
在前述两个方面的任一个中,可以在移植(transplantation)或嫁接(graft)之前开始施用。施用可以在移植(transplantation)或嫁接(graft)之后继续至少1、2、3、4、5、7 或10天;2、3、4、6、8、10、或12周;3、4、5、6、8、10、12、24、或36个月。
在又另一个方面,本发明的特征在于在需要其的受试者(例如,哺乳动物诸如人)中治疗或预防性治疗移植物抗宿主疾病(graft-versus-host disease)的方法。该方法包括给受试者施用有效量的第一方面的抗体或其抗原结合片段。
在另一个方面,本发明的特征在于在需要其的受试者(例如,哺乳动物诸如人)中治疗或预防性治疗自身免疫性病症的方法。该方法包括给受试者施用有效量的第一方面的抗体或其抗原结合片段。在某些实施方案中,自身免疫性病症与自身抗体的存在相关或由自身抗体的存在所引起(例如,全身性红斑狼疮(SLE)、CREST综合症(钙质沉着、雷诺氏综合症、食道运动功能障碍、指端硬化(sclerodactyl)、和毛细血管扩张)、斜视眼阵挛、炎性肌病(例如,多肌炎、皮肌炎和包涵体肌炎)、全身性硬皮病、原发性胆汁性肝硬化、乳糜泻(例如,谷蛋白敏感肠病)、疱疹样皮炎、Miller-Fisher综合症、急性运动性轴索神经病(AMAN)、具有传导阻滞的多灶性运动神经病、自身免疫性肝炎、抗磷脂综合症、Wegener氏肉芽肿、显微多血管炎、Churg-Strauss综合症、类风湿关节炎、慢性自身免疫性肝炎、硬化性肌炎、重症肌无力、Lambert–Eaton肌无力综合症、桥本氏甲状腺炎、Graves氏病、副肿瘤性小脑变性、僵人综合症、边缘性脑炎、Isaacs综合症、Sydenham氏舞蹈病、与链球菌相关的小儿自身免疫性神经精神疾病(PANDAS)、 脑炎、1型糖尿病和视神经脊髓炎)。在其他实施方案中,病症选自恶性贫血、Addison氏病、牛皮癣、炎性肠病、牛皮癣性关节炎、Sjögren氏综合症、红斑狼疮(例如,盘状红斑狼疮、药物诱导的红斑狼疮和新生儿红斑狼疮)、多发性硬化症和反应性关节炎。在还有其他实施方案中,病症选自多肌炎、皮肌炎、多发性内分泌衰竭、Schmidt氏综合症、自身免疫性眼色素层炎、肾上腺炎、甲状腺炎、自身免疫性甲状腺疾病、胃萎缩、慢性肝炎、狼疮状肝炎、动脉粥样硬化、早老性痴呆症、脱髓鞘疾病、亚急性皮肤型红斑狼疮、甲状旁腺功能减退、Dressler氏综合症、自身免疫性血小板减少症、特发性血小板减少性紫癜、溶血性贫血、寻常型天疱疮、天疱疮、斑秃(alopecia arcata)、类天疱疮、硬皮病、进行性全身性硬化症、成人发病型糖尿病(例如,II型糖尿病)、男性和女性自身免疫性不育、强直性脊椎炎、溃疡性结肠炎、Crohn氏病、混合性结缔组织病、结节性多动脉炎、全身性坏死性血管炎、少年发病性类风湿关节炎、肾小球肾炎、特应性皮炎、特应性鼻炎、Goodpasture氏综合症、Chagas氏综合症、肉状瘤病、风湿热、哮喘、复发性流产、抗磷脂综合症、farmer氏肺、多形性红斑、心切开后综合症、Cushing氏综合症、自身免疫性慢性活跃肝炎、bird-fancier氏肺、过敏性疾病、过敏性脑脊髓炎、中毒性表皮坏死松解症、秃头症、Alport氏综合症、肺泡炎、过敏性肺泡炎、纤维化性肺泡炎、间质性肺疾病、结节性红斑、坏疽性脓皮病、输血反应、麻风病、疟疾、利什曼病、锥虫病、高安氏动脉炎、风湿性多肌痛、颞动脉炎、血吸虫病、巨细胞动脉炎、蛔虫病、曲霉病、 Sampter氏综合症、湿疹、淋巴瘤样肉芽肿、Behcet氏病、Caplan氏综合症、川崎氏病、登革热、心内膜炎、心内膜纤维化、眼内炎、持久性隆起性红斑(erythema elevatum et diutinum)、胎儿红细胞增多症、嗜酸性筋膜炎、Shulman氏综合症、Felty氏综合症、丝虫病、睫状体炎、慢性睫状体炎、异时睫状体炎、 Fuch氏睫状体炎、IgA肾病、Henoch-Schonlein紫癜、移植物抗宿主病、移植排斥、人免疫缺陷病毒感染、埃可病毒感染、心肌病、阿尔茨海默氏病、细小病毒感染、风疹病毒感染、接种疫苗后综合症、先天性风疹感染、霍奇金淋巴瘤和非霍奇金淋巴瘤、肾细胞癌、多发性骨髓瘤、Eaton-Lambert综合症、复发性多软骨炎、恶性黑色素瘤、冷球蛋白血症、Waldenstrom氏巨球蛋白血症、Epstein-Barr病毒感染、腮腺炎、Evan氏综合症和自身免疫性性腺衰竭。
在前述三个方面的任一个中,施用可以是肠胃外、静脉内、皮下、口服、外用、鞘内、局部、或通过本文所述的任何途径。
在前述四个方面的任一个中,该方法可以进一步包括在6个月内施用第二药剂(例如,抗体施用的3、2、或1个月内;4、3、2、或1周内;6、5、4、3、2或1天内;或18、12、6、3、2或1小时内),其中所述第二药剂是免疫抑制剂。第二药剂可以选自钙调神经磷酸酶抑制剂(例如,环孢素A、环孢素G)、他克莫司、mTor抑制剂(例如,西罗莫司、替西罗莫司、佐他莫司或依维莫司)、芬戈莫德、多球壳菌素、阿仑单抗、利妥昔单抗、抗CD4单克隆抗体、抗LFA1单克隆抗体、抗LFA3单克抗体、抗CD45抗体(例如,抗CD45RB抗体)、抗CD19抗体、monabatacept、贝拉西普、吲哚基-ASC;硫唑嘌呤、淋巴细胞免疫球蛋白和抗胸腺细胞球蛋白[马]、吗替麦考酚酯、麦考酚钠、达利珠单抗、巴利昔单抗、环磷酰胺、泼尼松、泼尼松龙、来氟米特、FK778、FK779、15-脱氧精胍菌素、白消安、氟达拉滨、甲氨蝶呤、6-巯基嘌呤、15-脱氧精胍菌素、LF15-0195、布雷青霉素、布喹那和莫罗单抗-CD3。在某些实施方案中,第二药剂是贝拉西普。
在又另一个方面,本发明的特征在于制备抗体的方法。该方法包括:(a) 给哺乳动物(例如,小鼠或兔)施用包含CD40多肽的片段(例如,小于50、40、30、20、10个氨基酸长度,但多于6、8、或10个氨基酸长度)、但非全长CD40分子的多肽,其方式足以生成针对所述片段的免疫应答,所述CD40多肽的片段包括被2C10抗体识别的表位的,;(b)从哺乳动物分离脾细胞;(c)形成脾细胞和骨髓瘤细胞之间的杂交瘤;和(d)纯化杂交瘤产生的抗体。多肽可以是(例如,CD40片段和钥孔血蓝蛋白或谷胱甘肽S-转移酶之间的)融合蛋白。本发明的特征还在于通过这种方法产生的抗体。
在另一个方面,本发明的特征在于被2C11抗体特异性结合的小于150 (例如,小于120、100、80、70、60、50、40、30、20、15、12、11、10、9、8、或7)个氨基酸长度的CD40的片段。在某些实施方案中,该片段是8-10、8-12、8-15、8-20、8-30、8-40、8-50、8-60、8-70、8-80、或8-100个氨基酸长度。在其他实施方案中,该片段是7-10、7-12、7-15、7-20、7-30、7-40、7-50、7-60、7-70、7-80、或7-100个氨基酸长度。CD40片段可以来自CD40的胞外结构域(例如,SEQ ID NO:5和6)。本发明的特征还在于包括本文所述片段和异源序列的融合蛋白。
“特异性结合”是指识别并结合特定表位、但基本上不识别并结合样品(例如,天然包括其他多肽、核酸和/或其他生物分子的生物样品)中存在的其他分子的化合物或抗体。在一个实例中,特异性结合被2C10抗体识别的CD40表位的抗体不结合CD40上存在的其他表位。
抗体的“抗原结合片段”是指具有特异性结合全长抗体的目标抗原的能力的抗体的任何片段或部分。
非人(例如鼠类)抗体的“人源化”形式是嵌合抗体,其含有源自非人免疫球蛋白的最小序列。在一个实施方案中,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体高变区(HVR)的残基被来自非人物种((供体抗体),诸如小鼠、大鼠、兔非人灵长类)HVR的残基替换,所述人源化抗体具有所需特异性、亲和力和/或能力。在一些情况下,人免疫球蛋白的框架(FR)残基(即,在除了高变区以外的可变区的残基)被相应的非人残基替换。此外,人源化抗体可包含在受体抗体或供体抗体中没有发现的残基。可进行这些修饰,以进一步完善抗体性能。通常,人源化抗体可以包含基本上所有的至少一个,通常两个可变结构域,其中所有的或基本上所有的高变环对应非人免疫球蛋白的那些高变环,并且所有的或基本上所有的FRs是人免疫球蛋白序列的那些FRs。人源化抗体任选还包含至少部分的免疫球蛋白恒定区(Fc),通常是人免疫球蛋白的恒定区(Fc)。对于其他细节,参见例如Jones等人,Nature 321:522-25, 1986; Riechmann等人,Nature 332:323-29, 1988; 和Presta, Curr. Op. Struct. Biol. 2:593-6, 1992。还参见例如,Vaswani 等人,Ann. Allergy Asthma & Immunol. 1:105-15, 1998; Harris, Biochem. Soc. Transactions 23:1035-8, 1995; Hurle等人,Curr. Op. Biotech. 5:428-33, 1994; 以及美国专利号6,982,321和7,087,409。
“人抗体”是具有对应于人产生的抗体的氨基酸序列的氨基酸序列和/或已经使用用于制备本文公开的人抗体的任何技术制备的人抗体。这种人抗体的定义特别排除了包含非人抗原结合残基的人源化抗体。可使用本领域已知的多种技术,包括噬菌体展示文库(Hoogenboom等人,J. Mol. Biol. 227:381-8, 1992; Marks 等人,J. Mol. Biol, 222:581-97, 1991)产生人抗体。也可以用于制备人单克隆抗体的是在Cole等人,Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer等人,J. Immunol. 147:86-95, 1991中描述的方法。也参见van Dijk等人,Curr. Opin. Pharmacol. 5:368-74, 2001。可通过向转基因动物施用抗原制备人抗体,已经修饰了所述转基因动物,以产生响应抗原攻击的此类抗体,但所述转基因动物(例如经免疫的异种小鼠(xenomice))的内源基因座的功能已经丧失(参见例如,关于XenoMouse®技术的美国专利号6,075,181和 6,150,584)。关于经由人B细胞杂交瘤技术生成的人抗体,也参见例如,Li等人,Proc. Natl. Acad. Sci. USA 103:3557-62, 2006。
“治疗”受试者中的疾病、病症或状况是指通过给受试者施用治疗剂而减少所述疾病、病症或状况的至少一种症状。
“预防性治疗”受试者中的疾病、病症或状况是指通过在出现一种或多种疾病症状之前给受试者施用治疗剂而减少(例如,预防)疾病、病症或状况的发生频率或严重度。
术语“有效量”是指有效治疗医疗状况(例如,移植排斥或移植物抗宿主疾病)的生理效应所需的剂量。
“免疫抑制剂”是指诱导免疫抑制的化合物或组合物,即其减少(例如,预防)或干扰(例如,细胞或体液)免疫应答的发展。
“受试者”是指人或非人动物(例如,哺乳动物)。
“融合蛋白”是指含有(a)目标蛋白或其片段;和(b)异源融合伴侣的多肽。
根据以下的详细说明、附图和权利要求,本发明的其他特征和益处将是明显的。
附图说明
图1显示2C10抗体的重链和轻链的可变区。对于重链显示的核苷酸序列(SEQ ID NO:1)包括信号肽(核苷酸1-57;下划线)和重链可变序列(核苷酸58-396)。对应氨基酸序列显示在下面(SEQ ID NO:2),其中氨基酸1-19对应于信号序列(下划线)并且氨基酸20-132对应于重链可变区。
对于轻链显示的核苷酸序列(SEQ ID NO:3)包括信号肽(核苷酸1-66;下划线)和轻链可变序列(核苷酸67-384)。对应氨基酸序列显示在下面(SEQ ID NO:4),其中氨基酸1-22对应于信号肽(下划线)并且氨基酸23-128对应于轻链可变区。
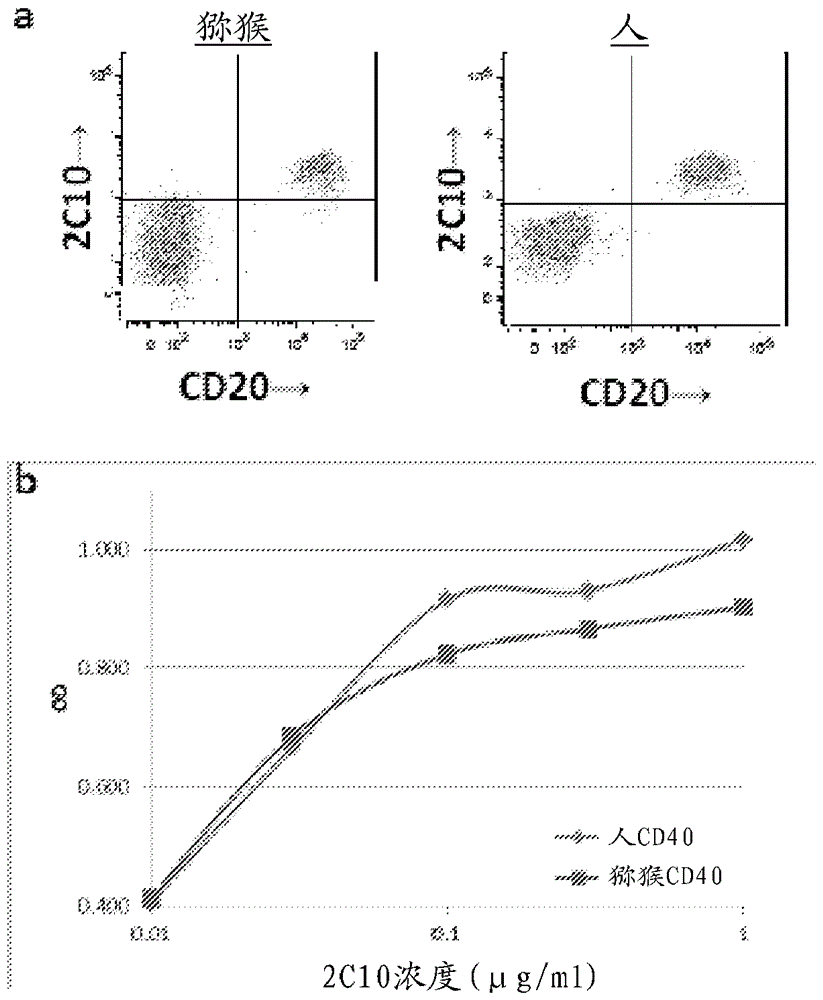
图2A是显示确认2C10结合人和猕猴CD20+ B细胞的流式细胞术数据的图。
图2B是显示如使用山羊抗小鼠IgG-HRP所检测用不同浓度的2C10的ELISA测定的CD40吸附数据以确认2C10结合人和猕猴CD40的图。
图3是显示2C10对CD154与B细胞结合的剂量依赖性抑制的图。通过与组氨酸标签的可溶性CD154孵育并且分析组氨酸表达来分析B细胞的CD154结合。结果代表实验的多次重复。
图4是显示涉及猕猴或人外周血单核细胞(PBMCs)和Jurkat细胞的测定原理的示意图和图表。
图5是显示取自在各种浓度的3A8、5C8或2C10抗体存在的情况下猕猴PBMCs和Jurkat细胞的共培养的CD20+细胞中CD23表达的一组图。
图6是显示取自在各种浓度的3A8、5C8或2C10抗体存在的情况下人PBMCs和Jurkat细胞的共培养的CD20+细胞中CD86表达的一组图。
图7是显示来自在3A8或2C10抗体存在的情况下无Jurkat细胞培养的人或猕猴PBMCs的CD20+细胞中CD23表达的一组图。
图8是显示用进行工程改造以含有猕猴IgG1 (2C10R1)或IgG4 (2C10R4)重链恒定区的2C10的小鼠-猕猴嵌合形式和抗CD40 3A8的嵌合IgG1形式(3A8R1)或抗CD40 Chi220 (Chi220)处理的猕猴的外周B细胞计数的图。所有动物在第一次抗体处理后都用4-羟基-3-硝基苯基乙酰基缀合的钥孔血蓝蛋白(KLH)免疫。
图9是显示用2C10R1、2C10R4或3A8R1抗体处理的猕猴中的T细胞依赖性抗体应答的图。所有动物在第一次抗体处理后都用KLH免疫。
图10是显示异源胰岛移植的标准猕猴模型的图。使用链脲佐霉素在猕猴中诱导糖尿病。糖尿病猴用异源胰岛进行移植,并且使用巴利昔单抗和西罗莫司开始免疫抑制。实验动物在移植后第0天和第7天接受2C10R4治疗。
图11A是显示胰岛移植、背景免疫抑制和用2C10R4处理后4只猕猴中游离血糖水平(FBG)的图。图上的实线代表血浆中的2C10水平。
图11B是显示仅接受背景免疫抑制的猕猴中FBG的图。
图12是显示与渐增浓度的2C10、3A8或Chi220抗体孵育并且用APC-缀合的2C10染色的人PBMC以评价各抗体交叉阻断2C10的能力的竞争阻断测定的结果的图。
具体实施方式
本发明涉及具有结合CD40分子上特定表位的能力的抗CD40抗体和抗体片段,以及涉及使用这种抗体的方法。这种表位特异性赋予特定活性概况,从而使得抗体通常阻断CD40与其结合伴侣(例如,CD154)相互作用的能力,并且这样做不活化表达CD40的细胞。理解了这种活性概况来使这些抗体特别可用于减少与器官或组织移植相关的并发症。
CD40抗体的制备和鉴定
小鼠(AJ品系)用融合蛋白进行免疫,所述融合蛋白由猕猴(M. mulatta) CD40的胞外结构域(氨基酸序列:
和与之融合的麦芽糖结合蛋白组成(CD40-MBP)。猕猴CD40蛋白的该区域的氨基酸序列在5个氨基酸位置不同于人CD40蛋白(人氨基酸序列:
。将CD40-MBP与完全弗氏佐剂和不完全弗氏佐剂多次施用于小鼠。将来自免疫小鼠的脾细胞与小鼠骨髓瘤细胞系SP2/0进行融合,并且使用标准杂交瘤技术选择杂合体。
选择抗体对第二种融合蛋白的反应性,所述第二种融合蛋白由相同的猕猴CD40结构域和与之融合的谷氨酰胺合成酶组成(CD40-GST)。通过流式细胞术进一步测试通过ELISA对CD40-GST有反应的抗体对在猕猴血液B细胞、人血液B细胞和猕猴B-类淋巴母细胞细胞系上表达的天然CD40的反应性。作为选择的最终水平,在体外测定中测试抗体在与表达CD154的Jurkat D1.1细胞共培养之后抑制人或猕猴B细胞活化的能力。通过有限稀释获得抗CD40抗体2C10的稳定亚克隆。抗体是小鼠IgG1-κ。
抗体克隆
可以使用本领域中已知的任何方法克隆单克隆抗体的可变区。用于获得杂交瘤细胞的抗体可变区序列的基于PCR的方法描述于,例如,Larrick等人, Nat. Biotechnol. 7:934-8, 1989和Orlandi等人, Proc. Natl. Acad. Sci. USA 86:3833-7, 1989。使用这些技术或类似技术,单克隆抗体的可变区可以进行克隆并且进一步操作。
在目前情况下,将2C10抗体的重链和轻链的可变序列进行克隆和测序。采用以下DNA引物使用5’ RACE PCR克隆代表来自2C10杂交瘤的免疫球蛋白重链和轻链可变区的DNA:
小鼠κ反向:
小鼠κ正向:
小鼠IgG1反向:
小鼠IgG1正向:
将PCR产物克隆进商售克隆载体,并使用标准测序技术进行测序。获得的序列提供在图1中。
使用cDNA末端-聚合酶链式反应的5'快速扩增从分泌抗CD40抗体的杂交瘤克隆2C10和抗人CD40分子克隆3A8(Kwekkeboom等人, Immunology 79:439-44, 1993) (从美国典型培养物保藏中心(American Type Culture Collection), ATCC, Vienna, VA获得)克隆免疫球蛋白可变区基因。将免疫球蛋白重链和轻链可变区亚克隆到含有猕猴IgGl或猕猴IgG4重链和猕猴κ轻链恒定区序列的表达载体中。
将重组重链和轻链亚克隆到表达载体中,并且包装在逆转录病毒载体中,所述逆转录病毒载体使用GPEx™表达技术(Catalent Pharma Solutions, Middleton, WI)转导中国仓鼠卵巢细胞。经转导细胞的合并物在无血清培养基中生长,并且通过蛋白A亲和层析纯化分泌的抗体。纯化的嵌合猕猴IgG1 (2C10R1, 3A8R1)和IgG4 (2C10R4)抗体在磷酸盐缓冲液中渗滤;内毒素水平被验证为小于1内毒素单位/mg。
抗体表征
2C10结合CD40并且防止CD154的结合
为了评价2C10结合猕猴和人CD40两者的能力,将重组表达的人或猕猴CD40吸附至ELISA板,并且与不同浓度的2C10反应。在ELISA中使用山羊抗小鼠IgG-HRP检测2C10与CD40的结合。图2B中的结果显示2C10对于猕猴和人CD40具有类似的结合亲和力,这对于2C10的临床转化是重要的。为了确认2C10阻断结合其同源配体CD154的能力,将猕猴和人B细胞与渐增浓度的2C10或同种型对照进行培养,然后与组氨酸-标记的可溶性CD154(R&D Systems, Minneapolis, MN)进行孵育,并且分析组氨酸表达。2C10以剂量依赖的方式阻断CD154的结合(图3),表明2C10可以有效阻断T细胞结合的CD154与B细胞和抗原递呈细胞上的CD40的相互作用。
2C10阻断猕猴和人外周血单核细胞中的B细胞活化
使用猕猴和人外周血单核细胞(PBMC)两者表征CD40抗体2C10影响B细胞活化的能力。选择CD20表达作为B细胞的指标,并且CD23、CD80和CD86的表达与B细胞活化相关。首先评价2C10结合CD20的能力。猕猴或人PBMCs与荧光染料缀合的2C10和抗CD20抗体进行孵育。使用流式细胞术分析确认2C10与人和猕猴CD20+ B细胞的结合(图2A)。在另一组实验中,将来自猕猴或人的PBMCs在CD154+ Jurkat D1.1细胞(永生化的T淋巴细胞细胞系)存在或不存在的情况下进行培养。B细胞的活化通过测量PBMCs中存在的CD20+细胞中三种标志物(CD23、CD80和CD86)的表达而进行测定。该测定的一般方案显示在图4中。如图4中显示,在Jurkat细胞存在的情况下培养PBMCs导致所有三种标志物的表达增加,表明B细胞被CD154+Jurkat细胞活化。
为了测试抗体阻断B细胞活化的能力,PBMCs和Jurkat细胞在三种抗体(3A8、5C8和2C10)之一存在或不存在的情况下进行共培养。3A8抗体是小鼠抗人CD40抗体(ATCC保藏号HB-12024),并且5C8是抗CD154抗体(ATCC保藏号CRL-10915)。每种被用作阳性对照。在5个数量级的抗体浓度(0.001 µg至10 µg)的范围内进行共培养。如图5中显示,3A8没有阻断猕猴PBMCs中的B细胞活化,如CD23表达所测量的,而2C10和5C8两者都能够以类似效力阻断活化。CD80和CD86的表达也观察到相应变化。这些结果表明,与3A8相比,2C10结合CD40上不同的表位。这些结果还表明,与以前已经显示充当具有弱刺激潜能的部分激动剂的3A8相反,2C10主要充当CD40拮抗剂(Adams等人, J. Immunol. 174:542-50, 2005, Badell等人, Am. J. Transplant. 接受用于出版, 2011)。当使用人而非猕猴PBMCs 进行类似实验时,再次观察到2C10和5C8两者都以类似效力阻断B细胞活化,如通过CD86表达所测量的。此处,3A8抗体,不像用猕猴PBMCs,阻断B细胞活化(图6)。
还使用猕猴或人PBMCs 测试2C10和3A8抗体在Jurkat细胞不存在的情况下活化B细胞的能力。此处,在2C10或3A8存在或不存在的情况下培养PBMCs。然后在CD20+细胞中测量CD23、CD80和CD86的表达。如图7中显示,在3A8抗体存在的情况下,猕猴细胞中CD23表达增加,但在2C10抗体存在的情况下则没有增加。相比之下,3A8和2C10都无法活化人B细胞。3A8和2C10抗体之间观察到的活性差异表明,2C10抗体结合与3A8抗体的表位不同的表位。
2C10防止T细胞依赖的抗体应答
已经确定2C10结合CD40上的独特表位,与抗CD154抗体类似地抑制B细胞活化,并且缺乏激动剂特性,所以我们表征2C10在体内的作用。使用猕猴IgG1 (2C10R1)或IgG4 (2C10R4)重链和猕猴κ轻链恒定区序列生成2C10的重组小鼠-猕猴嵌合形式。还生成3A8的嵌合猕猴IgG1形式(3A8R1)用作对照。
猕猴在第0天用4-羟基-3-硝基苯基乙酰基缀合的钥孔血蓝蛋白(KLH, 10 mg IM)抗原(Biosearch Technologies, Novato, CA)免疫一次。接种前和在1周时,三只动物的群组接受2C10R1、2C10R4、3A8R1或盐水的静脉内剂量(50 mg/kg)。所有动物观察70天,并且每周进行流式细胞术。与以前报道的在接受3A8R1 (Badell等人, Am. J. Transplant. 10:214, 2010)或Chi220 (Adams等人, J. Immunol. 174:542-50, 2005)的动物中存在的外周B细胞的显著且长期的耗竭相比,用任一重组2C10同种型处理导致外周B细胞计数的轻微改变(图8)。
通过ELISA测试对KLH-NP 的T细胞依赖的抗体应答。板用KLH (0.01 mg/ml, Sigma, St. Louis, MO)包被,并且用Super Block (Thermo Scientific, Woodstock, GA)封闭。处理之前和之后的血浆样品连续稀释,铺板1小时,并且用磷酸盐缓冲盐水/0.05% Tween洗涤。抗KLH抗体通过与单克隆抗猕猴IgG-辣根过氧化物酶(克隆1B3, NHP Reagent Resource, Boston, MA)孵育1小时而进行检测。板然后与过氧化物酶底物溶液(KPL)孵育。然后添加终止溶液(KPL),并且在ELISA读板器上在450nm处读取光密度。如果处理之后血浆的光密度读数超过相同稀释度的处理之前血浆的光密度2倍,则样品在给定稀释度被认为是阳性的。KLH免疫之后,对照动物产生高滴度KLH-特异性IgG(图9)。接受3A8R1的动物还产生抗-KLH应答,但是滴度比对照约低10倍,尽管B细胞明显耗竭。相比之下,在接受2C10R1或2C10R4的所有动物中,至第56天几乎完全阻断IgG抗-KLH抗体的生成。
在异源胰岛移植的猕猴模型中2C10显著延长胰岛异源移植物存活
我们在非人灵长类动物异源胰岛移植模型中进一步测试2C10R4(CD4纯化的嵌合猕猴IgG4抗体)(图10)。体重为10-20 kg的猕猴进行供体胰腺切除术,一天后经由中线剖腹术进行移植。在动物末端放血后分离胰腺并置于冰上。使用胶原酶/中性蛋白酶(分别为950个Wunsch单位和63个单位;Serva, Heidelberg, Germany)进行胰岛分离。消化的胰腺在四层不连续Euroficoll梯度(Mediatech, Manassas, VA)和Cobe 2991血细胞处理器(CaridianBCT, Lakewood, CO)上进行纯化。对最终胰岛制剂的样品进行计数,并表示为胰岛当量(IEQ)。分离的胰岛培养过夜,计数,并悬浮在移植培养基(Mediatech)中。
使用链脲佐霉素(1250 mg/m2 IV; Zanosar, Teva Parenteral Medicines, Irvine, CA)使体重为3-5 kg的猕猴患有糖尿病,四周后进行移植。通过用静脉推注500 mg/kg葡萄糖的静脉内葡萄糖耐量试验(IVGTT)和测量灵长类C-肽验证糖尿病。在基线和葡萄糖注射后10、30、60 和90监测葡萄糖水平并测量C-肽。通过在可检测的血清C-肽不存在的情况下测量血糖水平的升高而确认糖尿病。糖尿病受体经受MHC错配的胰岛异源移植。经由小中线剖腹术和肠系膜静脉插管输注平均15,745 (± 4,063) IEQ。
通过耳棒(earstick)每天两次测量血糖水平;施用NPH (Novolin; Novo Nordisk, Princeton, NJ)和甘精胰岛素(Lantus; Sanofi-Aventis, Bridgewater, NJ),以便在移植前和移植物排斥之后维持低于300 mg/dL 的空腹血糖(FBG)。IVGTT在移植后定期进行,以监测移植物功能。移植受体每周进行流式细胞术分析,以监测T细胞(CD3 V450, CD4 PerCP-Cy5.5, CD8 PerCp; BD Bioscience)和B细胞(CD20 PE, BD Bioscience)群体。胰岛移植后,排斥被定义为在连续两天FBG大于130 mg/dL。主要终点为无排斥的胰岛移植物存活。根据Emory University IACUC和Guide for the Care and Use of Laboratory Animals处理这些实验中使用的所有动物。
移植受体接受2C10R4、巴利昔单抗(basiliximab)(Simulect, Novartis, Basel, Switzerland)和西罗莫司(sirolimus),或单独的巴利昔单抗和西罗莫司。在手术后第0天和第7天(POD)静脉内施用2C10R4 (50 mg/kg)。在POD 0和3静脉内施用巴利昔单抗(0.3 mg/kg)。每天肌内施用西罗莫司,以实现至POD 120 5-15 ng/ml的谷底水平。接受单独的巴利昔单抗和西罗莫司的所有三只动物是历史对照(Badell等人, J. Clin. Invest. 120:4520-312, 2010)。这些历史对照中的两只(RQz6和RIb7)经历通过胰腺切除术而诱导糖尿病,并且口服接受西罗莫司。
与仅接受巴利昔单抗诱导和西罗莫司维持治疗的对照(图11B)相比,用上述方案处理导致显著延长胰岛移植物存活(图11A)。对于接受2C10R4的动物,无排斥的移植物存活时间中值为280天,与之相比,对照动物为8天(p=0.010, 表1)。药代动力学数据预测到POD 100血浆2C10R4水平将小于1 μg/ml。因为在POD120停止西罗莫司,具有最长存活(304天)的受体在排斥之前约24周没有接受免疫抑制。用2C10R4处理的动物都没有发生临床相关的感染并发症或体重减轻。这些结果反映了接受2C10的IgG4同种型的动物。接受2C10的IgG1同种型(2C10R1)连同巴利昔单抗和西罗莫司的两只额外动物类似地实现了220天和162天的延长移植物存活(数据未显示)。鉴于使用用作诱导治疗的2C10的阳性结果,下一步是评价施用2C10作为维持治疗对移植物存活的影响。
表 1
CD40/CD154途径连同CD28/B7途径的阻断
CD40/CD154途径的阻断连同其他共刺激阻断剂证明是有用的。已经显示贝拉西普(设计用于阻断CD28/B7共刺激途径的CTLA4-Ig的高亲和力形式)在肾和胰岛移植的非人灵长类动物模型中和在肾移植的II期和III期临床试验中的效力(Larsen等人, Transplantation 90:1528-35, 2010, Vincenti等人, Am. J. Transplant. 10:535-46, 2010, Adams等人, J. Immunol. 174:542-50, 2005, Adams等人, Diabetes 51:265-70, 2002, Larsen等人, Am. J. Transplant. 5:443-53, 2005, Vincenti等人, N. Engl. J. Med. 358:770-81, 2005)。BENEFIT试验揭示用贝拉西普治疗的患者的优异肾功能;然而,这些患者具有活检证明的急性排斥的较高发生率和更严重级别(Larsen等人, Transplantation 90:1528-35, 2010, Vincenti等人. Am. J. Transplant. 10:535-46, 2010)。鉴于CD40和B7阻断之间的急性排斥和协同的这种增加比率(Larsen等人, Nature381:434-8, 1996),我们接下来想试验组合的2C10和贝拉西普治疗在非人灵长类动物肾移植中的效力。
表位作图
用于鉴定抗体结合的具体表位的方法是本领域技术人员已知的。标准技术包括肽扫描,其中单独测试源自抗体结合的全长蛋白的重叠短肽(例如,10-30个氨基酸,例如,20个氨基酸长度)结合抗体的能力。然后从这种实验可以被确定该抗体结合的蛋白的区域。
位点定向诱变也可以用来鉴定特定蛋白的一个或多个抗原性区域。在该方法中,将点突变系统引入目标多肽,并且抗体结合在不同位置具有突变的肽的能力用来确定该蛋白的特定区域是否含有该抗体结合的表位。
还可以使用高通量诱变技术诸如鸟枪诱变(Integral Molecular, Inc., Philadelphia, Pa.)(其可以用来在目标蛋白内生成大量突变)鉴定抗体表位。这种方法允许有效鉴定蛋白内的表位。
为了确定针对CD40的各种抗体是否结合类似表位,进行体外竞争阻断测定。在该测定中使用抗体2C10、3A8和Chi220(嵌合的IgG1 CD40特异性抗体)。使用Lightning Link抗体标记试剂盒(Novus Biologics, Littleton, CO)将2C10缀合至别藻蓝蛋白(APC)。人PBMC与渐增浓度的2C10、3A8或Chi220孵育,然后用APT-缀合的2C10染色,以评价各抗体交叉阻断2C10的能力。如图12中显示,APC-缀合的2C10的结合随着2C10但非Chi220或3A8的浓度渐增而降低。结果表明,2C10结合不同于Chi220或3A8的独特表位。
额外抗体的生成
可以,例如,使用本领域已知的制备抗体的任何多种方法制备针对2C10识别的CD40表位的额外抗体(例如,单克隆抗体、多克隆抗体、多特异性抗体或单特异性抗体)。在一个实例中,将2C10抗体识别的表位的编码序列表达为与谷胱甘肽S-转移酶(GST) (Smith等人, Gene 67:31-40, 1988)的C-末端融合体。融合蛋白在谷胱苷肽-琼脂糖珠粒上纯化,用谷胱甘肽洗脱,用凝血酶(在工程改造的切割位点)切割,并且纯化用于免疫兔。初始免疫使用弗氏完全佐剂来实施,随后免疫用弗氏不完全佐剂实施。使用凝血酶切割的GST融合蛋白的蛋白片段通过Western印迹和免疫沉淀分析监测抗体滴度。免疫血清使用CNBr-琼脂糖偶联的蛋白进行亲和纯化。抗血清特异性可以使用一组无关GST蛋白进行确定。
作为GST融合蛋白的替代或辅助免疫原,可以生成对应于本发明多肽的相对独特免疫原性区域的肽,并且通过引入C-末端赖氨酸偶联至钥孔血蓝蛋白(KLH)。每个这些肽的抗血清在缀合至BSA的肽上类似地亲和纯化,并且通过使用肽缀合物的ELISA或Western印迹分析,或者通过使用表达为GST融合蛋白的多肽的Western印迹或免疫沉淀测试特异性。
或者,可以使用标准杂交瘤技术制备特异性结合被2C10抗体识别的CD40表位的单克隆抗体(参见,例如,Kohler等人, Nature 256:495-7, 1975; Kohler等人, Eur. J. Immunol. 6:511-9, 1976; Kohler等人, Eur. J. Immunol. 6:292-5, 1976; Hammerling 等人, Monoclonal Antibodies and T Cell Hybridomas, Elsevier, NY, 1981)。一旦产生,也可以通过Western印迹或免疫沉淀分析测试单克隆抗体的特异性识别。或者,可以使用上述本发明的多肽和噬菌体展示文库(Vaughan等人, Nat. Biotechnol.14:309-14, 1996)制备单克隆抗体。
可以通过标准技术,例如,使用PCR和将片段克隆进入pGEX表达载体而生成表位片段。融合蛋白在大肠杆菌中表达并且使用谷胱甘肽琼脂糖亲和基质进行纯化。为了尽量减少抗血清的低亲和力或特异性的潜在问题,对于每种蛋白生成两种或三种这样的融合体,并且将每种融合体注入至少两只兔。通过一系列注射产生抗血清,并且可以包括,例如,至少三次加强注射。
为了大规模低成本生成多克隆抗体,可以选择适当的动物物种。可以从,例如,经免疫奶牛的牛奶或初乳中分离多克隆抗体。牛初乳含有28 g IgG/每升,而牛奶含有1.5 g IgG /每升(Ontsouka等人 J. Dairy Sci.86:2005-11, 2003)。多克隆抗体也可以从经免疫鸡的鸡蛋的蛋黄中分离(Sarker等人, J. Pediatr. Gastroenterol. Nutr. 32:19-25, 2001)。
多种佐剂批准用于奶牛。本发明中可用的佐剂包括,但不限于,Emulsigen®(水包油型乳化佐剂),Emulsigen®-D(具有DDA免疫刺激剂的水包油型乳化佐剂),Emulsigen®-P(具有共聚物免疫刺激剂的水包油型乳化佐剂),Emulsigen®-BCL(具有嵌段共聚物免疫刺激剂的水包油型乳化佐剂),CarbigenTM(卡波姆基质)和PolygenTM(共聚物基质)。所有列出的佐剂由Omaha, Nebr的MVP Laboratories商售。
可用的抗体可以在几种不同的筛选测定中鉴定。首先,通过ELISA测定抗体,以确定它们对于免疫抗原(即,本文所述的CD40表位)是否是特异性的。使用标准技术,ELISA板用免疫原包被,将抗体添加至板,洗涤,和通过使用对生成该抗体的物种的Ig特异性的二抗检测结合抗体的存在。
功能性体外测定可用于筛选抗体,例如,基于单核细胞衍生的树突状细胞的中和测定。
人受试者的illeal体液中牛免疫球蛋白的直接测量已经显示,显著量的免疫球蛋白在转移通过胃和小肠后仍然有活性(Warny等人, Gut 44:212-7, 1999)。也已经描述了配制用于GI递送的禽免疫球蛋白(IgY)的方法(Kovacs-Nolan等人, Immunol.Methods296:199-209, 2005)。
人源化抗体
本发明包括人源化抗体。用于使非人抗体人源化的各种方法是本领域已知的。例如,人源化抗体可具有从非人来源引入其中的一个或更多氨基酸残基。这些非人氨基酸残基经常称为“输入”残基,其通常取自“输入”可变结构域。可基本根据Winter及其同事(Jones等人,Nature 321:522-5, 1986; Riechmann等人,Nature 332:323-7, 1988; Verhoeyen 等人,Science 239:1534-6, 1988)的方法,通过将高变区序列替换为人抗体的相应序列来进行人源化。因此,此类“人源化”抗体是嵌合抗体(美国专利号4,816,567),其中基本上少于完整人可变结构域已经被替换成非人物种的相应序列。实际上,人源化抗体通常是人抗体,其中至少一些高变区残基以及其他可变区残基替换为啮齿类抗体中类似位点的残基。
选择待用于制备人源化抗体中的人轻链和重链可变结构域对降低抗原性是重要的。根据所谓的“最佳拟合”方法,针对已知人可变结构域序列的整个文库筛选啮齿类抗体可变结构域的序列。然后接受与啮齿类序列最接近的人序列作为用于人源化抗体的人构架。参见例如,Sims等人, J. Immunol. 151:2296-308, 1993; Chothia等人, J. Mol. Biol. 196:901-17, 1987。另一种方法使用特定的构架,其来自轻链或重链特定亚群的所有人抗体的共有序列。相同的构架可用于几种不同的人源化抗体。参见例如,Carter等人, Proc. Natl. Acad. Sci. USA 89:4285-9, 1992; Presta等人, J. Immunol. 151:2623-32, 1993。
通常进一步希望,抗体进行人源化,以保留对抗原的高亲和力和其他有利的生物学特性。为了实现该目标,根据一种方法,通过分析亲本序列和多种概念上的人源化产物的过程,使用亲本和人源化序列的三维模型制备人源化抗体。通常可获得三维免疫球蛋白模型,并且其为本领域技术人员所熟悉。可获得计算机程序,其阐明并展示所选的候选免疫球蛋白序列的三维构象结构。检查这些显示允许分析残基在候选免疫球蛋白序列功能中的可能作用,即,分析影响候选免疫球蛋白结合其抗原能力的残基。这样,可从受体和输入序列中选择并组合FR残基,从而实现所需抗体特征,诸如对目标抗原提高的亲和力。通常,高变区残基直接并最实质地参与影响抗原结合。
人抗体
本发明的人抗体可以通过将从源自人的噬菌体展示文库选择的Fv克隆可变结构域序列与已知人恒定结构域序列组合而构建(Hoogenboom等人, J. Mol. Biol. 227:381-8, 1992; Marks等人, J. Mol. Biol. 222:581-97, 1991)。或者,本发明的人单克隆抗体可以通过杂交瘤方法制备。用于产生人单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系已经描述于,例如,Kozbor, J. Immunol. 133:3001-5, 1984; Brodeur等人, Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987); 和Boerner等人, J. Immunol. 147:86-95, 1991。
目前可以产生转基因动物(例如,小鼠),其在免疫后能够在没有内源免疫球蛋白产生的情况下产生人抗体的全部所有组成成分。例如,已经描述了嵌合和种系突变体小鼠中抗体重链连接区(JH)基因的纯合缺失导致内源抗体产生的完全抑制。该种系突变体小鼠中人种系免疫球蛋白基因排列的转移将导致在抗原攻击后产生人抗体。参见例如,Jakobovits等人, Proc. Natl. Acad. Sci. USA 90:2551-5, 1993; Jakobovits等人, Nature 362:255-8, 1993; Brüggemann 等人, Year Immunol. 7:33-40, 1993。
基因改组也可用于从非人抗体(例如,啮齿动物抗体)衍生人抗体,其中所述人抗体具有与初始非人抗体相似的亲和力和特异性。根据该方法(也称为“表位印迹(epitope imprinting)”),如本文所述通过噬菌体展示技术获得的非人抗体片段的重链或轻链可变区被人V结构域基因的所有组成成分所替代,生成非人链/人链scFv或Fab嵌合体的群体。用抗原选择导致分离非人链/人链嵌合scFv或Fab,其中人链保留了在初始噬菌体展示克隆中对应的非人链去除后破坏的抗原结合位点,即,表位控制(印迹)了人链伴侣的选择。当重复该过程以替代剩余的非人链时,获得人抗体(参见PCT公开WO 93/06213)。不同于通过CDR嫁接常规人源化非人抗体,该技术提供了完全人抗体,其不具有非人来源的FR或CDR残基。
抗体片段
本发明的特征还在于包含完整抗体的部分,优选包含其抗原结合区的抗体片段。抗体片段的实例包括Fab、Fab’、F(ab’)2和Fv片段;双抗体;线性抗体;单链抗体分子;和由抗体片段形成的多特异性抗性。
抗体的木瓜蛋白酶消化产生两个相同的抗原结合片段,称为“Fab”片段(每一个片段具有单个抗原结合位点)和残留“Fc”片段,其名称反映了其容易结晶的能力。胃蛋白酶处理产生具有两个抗原组合位点并仍然能够交联抗原的F(ab’)2片段。
Fv是最小抗体片段,其含有完整的抗原结合位点。在一个实施方案中,双链Fv种类由紧密非共价结合的一个重链可变结构域和一个轻链可变结构域的二聚体组成。在单链Fv(scFv)种类中,一个重链可变结构域和一个轻链可变结构域可由柔性的肽接头共价连接,从而轻链和重链可以与双链Fv种类类似的“二聚体”结构连接。其为这样的构型,其中每一可变结构域的三个高变区(HVRs)相互作用,以定义VH-VL二聚体表面上的抗原结合位点。总共,六个HVRs赋予抗体的抗原结合特异性。然而,尽管比完整结合位点的亲和力低,但甚至单个可变结构域(或Fv的一半,其仅包含对抗原特异的三个HVRs)也具有识别并结合抗原的能力。
Fab片段含有重链可变结构域和轻链可变结构域,并且还含有轻链的恒定结构域和重链的第一恒定结构域(CH1)。Fab’片段因在重链CH1结构域的羧基末端加入了一些残基(包括来自抗体铰链区的一个或多个半胱氨酸)而不同于Fab片段。Fab’-SH本文中是指其中恒定结构域的半胱氨酸残基携带游离的巯基的Fab’。F(ab’)2抗体片段最初产生为Fab’片段对,其在它们之间具有铰链半胱氨酸。抗体片段的其他化学偶联也是已知的。
单链Fv或scFv抗体片段包含抗体的VH和VL结构域,其中这些结构域存在于单条多肽链中。通常,scFv多肽在VH和VL结构域之间还包含多肽接头,其使得scFv能够形成所需结构用于抗原结合。对于scFv的综述,参见例如,Pluckthün, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg和Moore编辑,(Springer-Verlag, New York, 1994), pp. 269-315。
双抗体是具有两个抗原结合位点的抗体片段,所述片段包含连接同一多肽链(VH-VL)中轻链可变结构域(VL)的重链可变结构域(VH)。通过使用太短以至于不能允许同一条链上的两个结构域配对的接头,结构域被迫与另一条链的互补结构域配对,并产生两个抗原结合位点。双抗体可以是二价或多特异性的。例如在欧洲专利号404,097;PCT专利号WO 1993/01161;Hudson等人,Nat. Med. 9:129-34, 2003;和Hollinger等人,Proc. Natl. Acad. Sci. USA 90:6444-8, 1993中更详细描述了双抗体。也在Hudson等人,Nat. Med. 9:129-34, 2003中描述了三抗体和四抗体。
抗体片段可以通过传统方式,诸如酶消化,或通过重组技术来生成。在某些情况下,使用抗体片段而非整个抗体具有优点。大小较小的片段可以快速清除,并且可以导致改进对实体瘤的接近。对于某些抗体片段的综述,参见Hudson等人 Nat. Med. 9:129-134, 2003。
已经开发了多种技术用于产生抗体片段。通常,这些片段通过完整抗体的蛋白水解消化得到(参见例如,Morimoto等人, J. Biochem. Biophys. Methods 24:107-17, 1992; 和Brennan 等人, Science 229:81-3, 1985)。然而,现在可通过重组宿主细胞直接产生这些片段。Fab、Fv和ScFv抗体片段都可以在大肠杆菌中表达并分泌,从而允许易于产生大量这些片段。抗体片段可以从抗体噬菌体文库中分离。或者,可以从大肠杆菌中直接回收Fab’-SH片段,并经化学偶联形成F(ab’)2片段(Carter 等人, Bio/Technology 10:163-7, 1992)。在另一种方法中,直接从重组宿主细胞培养物中分离F(ab′)2片段。包含拯救受体结合表位残基的具有增强的体内半衰期的Fab和F(ab’)2片段描述于美国专利号5,869,046。用于产生抗体片段的其他技术对于技术人员将是显而易见的。
药物组合物
本发明提供含有与药学可接受的载体配制在一起的本发明抗体或其抗原结合部分的组合物,例如药物组合物。本发明的药物组合物还可以在组合疗法中施用,即与其他药剂(例如,免疫抑制剂)组合。本文使用的“药学可接受的载体”包括生理相容的任何及所有溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等。优选地,所述载体适用于静脉内、鞘内、肌内、皮下、胃肠外、脊柱或表皮施用(如通过注射或输注)。取决于施用途径,可将本发明的抗体包衣在一定材料中,以保护化合物免受可能使该化合物失活的酸和其他天然条件的作用。
本发明的组合物可以通过本领域已知的各种方法进行施用。如技术人员将理解的,使用途径和/或模式将根据所需结果而不同。施用可以是肠胃外、静脉内、鞘内、皮下、口服、外用、或局部的,例如,通过直接注射到脑脊液中。通过连续输注的静脉内递送是用于施用本发明的治疗性抗体的一种示例性方法。治疗性化合物可以是溶液、悬浮液、乳状液、输注装置、或用于植入的递送装置的形式,或者它可以作为在使用前用水或另一种合适媒介物重构的干粉提供。组合物可以是丸剂、片剂、胶囊、液体、或用于口服施用的缓释片剂;或用于静脉内、鞘内、皮下或肠胃外施用的液体;或用于局部施用的聚合物或其他缓释媒介物的形式。
本领域中众所周知的制备制剂方法可见,例如“Remington: The Science and Practice of Pharmacy” (20th ed., ed. A.R. Gennaro AR., 2000, Lippincott Williams & Wilkins, Philadelphia, PA)。用于肠胃外施用的制剂可以,例如,含有赋形剂、无菌水、盐水、聚亚烷基二醇诸如聚乙二醇、植物来源的油或氢化萘。可以使用生物相容的、可生物降解的丙交酯聚合物,丙交酯/乙交酯共聚物,或聚氧乙烯 - 聚氧丙烯共聚物来控制化合物的释放。纳米颗粒制剂(例如,可生物降解的纳米颗粒、固体脂质纳米颗粒、脂质体)可用于控制化合物的生物分布。其他可能有用的递送系统包括乙烯-乙酸乙烯酯共聚物颗粒、渗透泵、鞘内泵、可植入的输注系统和脂质体。制剂中化合物的浓度根据一些因素包括待施用的药物剂量和施用途径而变化。
为了通过某些施用途径施用本发明的化合物,可能必须用一定材料包衣化合物或与化合物共施用,以防止其失活。例如,化合物可在适当的载体如脂质体或稀释剂中施用于受试者。药学可接受的稀释剂包括盐水和水性缓冲溶液。脂质体包括水包油包水CGF乳剂以及常规脂质体(Strejan等人, J. Neuroimmunol. 7:27-41, 1984)。药学可接受的载体包括无菌水溶液或分散剂以及用于在临用时制备无菌注射溶液或分散剂的无菌粉剂。这些介质和试剂用于药物活性物质的用途为本领域已知的并且包括在本发明中,除非其中任何常规介质或药剂与活性化合物不相容。补充性活性化合物也可掺入该组合物中。
治疗性组合物通常在生产和贮藏条件下必须是无菌和稳定的。该组合物可配制成溶液、微乳剂、脂质体或其他适用于高药物浓度的有序结构。载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其适当的混合物的溶剂或分散介质。可以例如通过使用包衣(诸如卵磷脂)、通过维持所需微粒大小(对于分散剂的情况)以及通过使用表面活性剂来维持适当的流动性。在许多情况下,组合物中优选包含等渗剂,例如糖、多元醇诸如甘露醇、山梨醇或者氯化钠。可以通过在组合物中包含延缓吸收的试剂(例如单硬脂酸盐和明胶)来引起注射用组合物的延长吸收。
无菌注射溶液可通过以所需量将活性化合物与所需上述成分中的一种或组合一起掺入适当的溶剂随后进行无菌微过滤来制备。通常,通过将活性化合物掺入无菌媒介物来制备分散剂,所述无菌媒介物含有碱性分散介质和来自上述那些的其他所需成分。对于用于制备无菌注射溶液的无菌粉剂的情况,优选的制备方法为真空干燥和冷冻干燥(冻干),所述方法从之前已无菌过滤的溶液中获得活性成分加任何额外所期望成分的粉末。对剂量方案进行调整以提供最佳的期望应答(例如,治疗应答)。例如,可以进行单次推注,随时间施用几个分开的剂量,或者可以根据治疗情况的紧急程度,按比例降低或提高剂量。例如,可以通过皮下注射每周一次或两次,或者通过皮下注射每个月一次或两次施用本发明的抗体。
特别有利的是将肠胃外组合物配制成剂量单位形式,以便于施用和实现剂量的均一性。本文使用的剂量单位形式指适于作为待治疗受试者的单位剂量的物理分开的单位;每个单位含有与所需药用载体相关联的预定量的活性化合物,所述预定量为经计算产生所需疗效的量。本发明剂量单位形式的规格由以下因素决定,并直接取决于以下因素:(a)活性化合物的独特特征和待实现的具体疗效,和(b)调配用于治疗个体中敏感性状况的这些活性化合物的领域中的内在限制。
本文使用的术语“肠胃外施用”和“肠胃外施用”指除了肠内和局部施用以外的施用模式,通常是通过注射,包括但不仅限于静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、椎管内、硬膜外、胸骨内注射和输注。可用于本发明药物组合物的适当水性和非水性载体的实例包括水、乙醇、多元醇(诸如甘油、丙二醇、聚乙二醇等)及其适当的混合物、植物油(诸如橄榄油)以及注射用有机酯(诸如油酸乙酯)。可通过例如使用包衣材料(诸如卵磷脂)、通过维持所需微粒大小(对于分散剂的情况)以及通过使用表面活性剂来维持适当的流动性。
本发明的组合物还可含有辅剂,诸如防腐剂、湿润剂、乳化剂和分散剂。通过灭菌程序和通过包含多种抗菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等)均可保证防止存在微生物。还可以期望在组合物中包含等渗剂,诸如糖、氯化钠等。此外,可以通过包含延缓吸收的药剂(诸如单硬脂酸铝和明胶)来实现注射用药物形式的延长吸收。
当本发明的化合物作为药物施用于人和动物时,它们可单独给予或作为药物组合物给予,所述药物组合物包含例如0.001%至90%(更优选0.005至70%,诸如0.01至30%)的活性成分与药学可接受的载体的组合。
对于静脉或鞘内递送或直接注射,所述组合物必须无菌,并且其流动性达到组合物可通过注射器递送的程度。除了水以外,载体还可以是等渗缓冲的盐水溶液、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其适当的混合物。可以例如通过使用包衣(诸如卵磷脂)、通过维持所需微粒大小(对于分散剂的情况)和通过使用表面活性剂来维持适当的流动性。在许多情况下,优选在组合物中包含等渗剂,例如糖、多元醇诸如甘露醇或山梨醇以及氯化钠。可通过在组合物中包含延缓吸收的药剂(诸如单硬脂酸铝或明胶)来实现注射用组合物的长期吸收。
无论选择什么施用途径,可以适当水化形式使用的本发明化合物,和/或本发明的药物组合物均通过本领域技术人员已知的常规方法配制成药学可接受的剂型。可以改变本发明药物组合物中活性成分的确切剂量水平,从而获得对具体的患者、组合物和施用模式有效实现理想的治疗应答而又对患者无毒的活性成分量。所选择的剂量水平将取决于多种药代动力学因素,包括具体使用的本发明组合物、或其酯、盐或酰胺的活性、施用途径、施用时间、具体使用的化合物的排泄速率、治疗持续时间、与具体使用的组合物组合使用的其他药物、化合物和/或材料、受治患者的年龄、性别、体重、状况、总体健康和之前的病史以及医学领域众所周知的类似因素。本领域普通医师或兽医能够容易地确定所需药物组合物的有效量并开出处方。例如,医师或兽医可从低于获得理想疗效所需剂量的水平开始给予药物组合物中所用本发明化合物的剂量,并逐渐提高剂量直至实现理想的疗效。通常,适当的本发明组合物的每日剂量将是有效产生疗效的最低剂量的化合物量。这样的有效剂量一般将取决于上述因素。必要时,治疗组合物的有效日剂量可以以2、3、4、5、6或更多的小剂量以适当的间隔在一天中分开施用,任选地以单位剂量形式施用。尽管有可能单独施用本发明化合物,但优选将化合物作为药物制剂(组合物)施用。
可以用本领域中已知的医疗设备施用治疗性组合物。可用于本发明中的众所周知的植入物、递送系统和模块的实例是本领域技术人员已知的。
状况和病症
本文所述的抗体和抗体片段可用于其中期望免疫抑制的任何情况(例如,移植排斥或自身免疫性病症)。这些抗体尤其可用于治疗移植排斥,例如,降低特定移植被宿主排斥的可能性,或增加排斥发生之前的时间。本文所述的抗体可以与适合用于移植的任何器官或任何组织的移植组合使用。示例性的器官包括心脏、肾脏、肺、肝、胰腺、小肠和胸腺;示例性的组织包括骨、肌腱、角膜、皮肤、心脏瓣膜、静脉和骨髓。
抗体和抗体片段也可用于治疗自身免疫性病症,特别是其中自身抗体牵涉于疾病的发病机制中的病症。与或可以与自身抗体产生相关的自身免疫性病症包括全身性红斑狼疮(SLE)、CREST综合症(钙质沉着、雷诺氏综合症、食道运动功能障碍、指端硬化(sclerodactyl)、和毛细血管扩张)、斜视眼阵挛、炎性肌病(例如,多肌炎、皮肌炎和包涵体肌炎)、全身性硬皮病、原发性胆汁性肝硬化、乳糜泻(例如,谷蛋白敏感肠病)、疱疹样皮炎、Miller-Fisher综合症、急性运动性轴索神经病(AMAN)、具有传导阻滞的多灶性运动神经病、自身免疫性肝炎、抗磷脂综合症、Wegener氏肉芽肿、显微多血管炎、Churg-Strauss综合症、类风湿关节炎、慢性自身免疫性肝炎、硬化性肌炎、重症肌无力、Lambert–Eaton肌无力综合症、桥本氏甲状腺炎、Graves氏病、副肿瘤性小脑变性、僵人综合症、边缘性脑炎、Isaacs综合症、Sydenham氏舞蹈病、与链球菌相关的小儿自身免疫性神经精神疾病(PANDAS)、 脑炎、1型糖尿病和视神经脊髓炎。
其他自身免疫性病症包括恶性贫血、Addison氏病、牛皮癣、炎性肠病、牛皮癣性关节炎、Sjögren氏综合症、红斑狼疮(例如,盘状红斑狼疮、药物诱导的红斑狼疮和新生儿红斑狼疮)、多发性硬化症和反应性关节炎。
可以使用本发明的方法治疗的额外病症包括,例如,多肌炎、皮肌炎、多发性内分泌衰竭、Schmidt氏综合症、自身免疫性眼色素层炎、肾上腺炎、甲状腺炎、自身免疫性甲状腺疾病、胃萎缩、慢性肝炎、狼疮状肝炎、动脉粥样硬化、早老性痴呆症、脱髓鞘疾病、亚急性皮肤型红斑狼疮、甲状旁腺功能减退、Dressler氏综合症、自身免疫性血小板减少症、特发性血小板减少性紫癜、溶血性贫血、寻常型天疱疮、天疱疮、斑秃(alopecia arcata)、类天疱疮、硬皮病、进行性全身性硬化症、成人发病型糖尿病(例如,II型糖尿病)、男性和女性自身免疫性不育、强直性脊椎炎、溃疡性结肠炎、Crohn氏病、混合性结缔组织病、结节性多动脉炎、全身性坏死性血管炎、少年发病性类风湿关节炎、肾小球肾炎、特应性皮炎、特应性鼻炎、Goodpasture氏综合症、Chagas氏综合症、肉状瘤病、风湿热、哮喘、复发性流产、抗磷脂综合症、farmer氏肺、多形性红斑、心切开后综合症、Cushing氏综合症、自身免疫性慢性活跃肝炎、bird-fancier氏肺、过敏性疾病、过敏性脑脊髓炎、中毒性表皮坏死松解症、秃头症、Alport氏综合症、肺泡炎、过敏性肺泡炎、纤维化性肺泡炎、间质性肺疾病、结节性红斑、坏疽性脓皮病、输血反应、麻风病、疟疾、利什曼病、锥虫病、高安氏动脉炎、风湿性多肌痛、颞动脉炎、血吸虫病、巨细胞动脉炎、蛔虫病、曲霉病、 Sampter氏综合症、湿疹、淋巴瘤样肉芽肿、Behcet氏病、Caplan氏综合症、川崎氏病、登革热、心内膜炎、心内膜纤维化、眼内炎、持久性隆起性红斑(erythema elevatum et diutinum)、胎儿红细胞增多症、嗜酸性筋膜炎、Shulman氏综合症、Felty氏综合症、丝虫病、睫状体炎、慢性睫状体炎、异时睫状体炎、 Fuch氏睫状体炎、IgA肾病、Henoch-Schonlein紫癜、移植物抗宿主病、移植排斥、人免疫缺陷病毒感染、埃可病毒感染、心肌病、阿尔茨海默氏病、细小病毒感染、风疹病毒感染、接种疫苗后综合症、先天性风疹感染、霍奇金淋巴瘤和非霍奇金淋巴瘤、肾细胞癌、多发性骨髓瘤、Eaton-Lambert综合症、复发性多软骨炎、恶性黑色素瘤、冷球蛋白血症、Waldenstrom氏巨球蛋白血症、Epstein-Barr病毒感染、腮腺炎、Evan氏综合症和自身免疫性性腺衰竭。
免疫抑制剂
本文所述的抗体和抗体片段可以与免疫抑制剂组合配制或施用。免疫抑制剂的实例包括,但不限于,钙调神经磷酸酶抑制剂(例如,环孢素A(Sandimmune®)、环孢素G他克莫司(Prograf®、Protopic®))、mTor抑制剂(例如,西罗莫司(Rapamune®、Neoral®)、替西罗莫司(Torisel®)、佐他莫司和依维莫司(Certican®))、芬戈莫德(Gilenya™)、多球壳菌素、阿仑单抗(Campath®、MabCampath®、Campath-1H®)、利妥昔单抗(Rituxan®、MabThera®)、抗CD4单克隆抗体(例如,HuMax-CD4)、抗LFA1单克隆抗体(例如,CD11a)、抗LFA3单克抗体、抗CD45抗体(例如,抗CD45RB抗体)、抗CD19抗体(参见,例如,美国专利公开2006/0280738)、monabatacept(Orencia®)、 贝拉西普(belatacept)、吲哚基-ASC (他克莫司和子囊霉素的32-吲哚醚衍生物)、硫唑嘌呤(Azasan®、Imuran®)、淋巴细胞免疫球蛋白和抗胸腺细胞球蛋白[马] (Atgam®)、吗替麦考酚酯(Cellcept®)、麦考酚钠(myfortic®)、达利珠单抗(Zenapax®)、巴利昔单抗(Simulect®)、环磷酰胺(Endoxan®、Cytoxan®、Neosar™、Procytox™、Revimmune™)、泼尼松、泼尼松龙、来氟米特(Arava®)、FK778、FK779、 15-脱氧精胍菌素(DSG)、白消安(Myleran®、Busulfex®)、氟达拉滨(Fludara®)、甲氨蝶呤(Rheumatrex®、Trexall®)、6-巯基嘌呤(Purinethol®)、15-脱氧精胍菌素(Gusperimus)、LF15-0195、布雷青霉素、布喹那和莫罗单抗-CD3 (Orthoclone®)。
用于评估药剂的免疫抑制活性的方法是本领域已知的。例如,在有和没有药理学干预下移植器官在体内的存活时间长度可充当对免疫应答的抑制的定量量度。也可使用体外测定,例如混合淋巴细胞反应(MLR)测定法(参见例如,Fathman等人, J. Immunol. 118:1232-8, 1977);CD3测定(经由抗CD3抗体特异性活化免疫细胞(例如,OKT3))(参见例如,Khanna等人,Transplantation 67:882-9, 1999; Khanna等人(1999) Transplantation67:S58); 及IL-2R测定(用外源加入的细胞因子IL-2特异性活化免疫细胞) (参见例如,Farrar等人, J. Immunol. 126:1120-5, 1981)。
环孢菌素A (CsA; CAS号59865-13-3; 美国专利号3,737,433)及其类似物可以用作免疫抑制剂。许多显示免疫抑制活性的其他环孢菌素及其衍生物和类似物是已知的。环孢菌素及其制剂描述于例如,2004 Physicians’ Desk Reference® (2003) Thomson Healthcare, 58th ed., 和美国专利号5,766,629; 5,827,822; 4,220,641; 4,639,434; 4,289,851; 4,384,996; 5,047,396; 4,388,307; 4,970,076; 4,990,337; 4,822,618; 4,576,284; 5,120,710; 和4,894,235。
他克莫司(FK506)是大环内酯,其在其作用的分子模式和其临床功效两方面发挥很大程度上类似于CsA的作用(Liu, Immunol. Today 14:290-5, 1993; Schreiber等人,Immunol. Today, 13:136-42, 1992); 但是,这些作用是在比CsA低20-100倍的剂量下显示的(Peters等人,Drugs 46:746-94, 1993)。他克莫司及其制剂描述于例如,2004 Physicians’ Desk Reference® (2003) Thomson Healthcare, 58th ed., 和美国专利号4,894,366; 4,929,611; 和5,164,495。
西罗莫司(雷帕霉素)是免疫抑制性内酰胺大环内酯,可例如由吸水链霉菌(Streptomyces hygroscopicus)产生。多种西罗莫司衍生物和其类似物及它们的制剂是已知的且描述于例如,2004 Physicians’ Desk Reference® (2003) Thomson Healthcare, 58th ed., 欧洲专利EP 0467606; PCT专利号WO 94/02136, WO 94/09010, WO 92/05179, WO 93/11130, WO 94/02385, WO 95/14023, 和WO 94/02136, 以及美国专利号5,023,262; 5,120,725; 5,120,727; 5,177,203; 5,258,389; 5,118,677; 5,118,678; 5,100,883; 5,151,413; 5,120,842; 和 5,256,790。
CD40片段
本发明的特征还在于包括被2C10抗体特异性结合的表位的CD40片段。2C10抗体针对CD40多肽的胞外部分而产生;因此,据信该抗体与该序列(SEQ ID NO:5和6)的部分反应。
因此,本发明的特征在于被2C11抗体特异性结合的小于150 (例如,小于120、100、80、70、60、50、40、30、20、18、15、12、11、10、9、8、或7)个氨基酸长度的CD40片段。在某些实施方案中,该片段是8-10、8-12、8-15、8-20、8-30、8-40、8-50、8-60、8-70、8-80、或8-100个氨基酸长度。在其他实施方案中,该片段是7-10、7-12、7-15、7-20、7-30、7-40、7-50、7-60、7-70、7-80、或7-100个氨基酸长度。
融合蛋白
本发明的特征还在于包括本文所述片段和异源序列的融合蛋白。在某些实施方案中,融合伴侣之一是Fc蛋白(例如,小鼠Fc或人Fc)。融合体也可以是可用于产生抗体的序列,例如,麦芽糖结合蛋白或GST。在其他实施方案中,所述融合蛋白是纯化或检测标签,例如,可以直接或间接地检测的蛋白质(诸如绿色荧光蛋白、血球凝集素或碱性磷酸酶)、DNA结合结构域(例如,GAL4或LexA)、基因活化结构域(例如,GAL4或VP16)、纯化标签或分泌信号肽(例如,前胰蛋白酶原(preprotyrypsin)信号序列)。在其他实施方案中,融合伴侣可以是标签,诸如c-myc、聚组氨酸或FLAG 。每个融合伴侣可以含有一个或多个结构域,例如,前胰蛋白酶原信号序列和FLAG标签。
CD40片段和融合蛋白的产生
通过在适宜的表达载体中用编码多肽片段或融合蛋白的多核苷酸分子转化适宜的宿主细胞,可以生产本文所述的CD40片段和融合蛋白。
分子生物学领域的技术人员将理解可以使用的各种各样的表达系统的任何一种并且所使用的确切系统或宿主细胞对于本发明不是关键的。示例性表达系统包括原核宿主(例如大肠杆菌)和真核宿主(例如,酿酒酵母、昆虫细胞例如Sf21细胞,或哺乳动物细胞例如NIH 3T3、HeLa或优选地COS细胞)。这样的细胞可以从广泛的来源获得(例如,美国典型培养物保藏中心,Manassas, VA)。转化或转染的方法和表达载体的选择将取决于选择的宿主系统。例如,在Kucherlapati等人(CRC Crit. Rev. Biochem. 16:349-379, 1982)中和在 DNA Transfer to Cultured Cells (eds., Ravid and Freshney, Wiley-Liss, 1998)中描述了转化和转染方法;且可以从例如Vectors: Expression Systems: Essential Techniques (ed., Jones, Wiley & Sons Ltd., 1998)中提供的那些中选择表达载体。
一旦表达重组CD40多肽片段或融合蛋白,可以使用例如亲和层析来分离它。在一个实例中,针对片段或融合蛋白产生的抗体(例如,2C10抗体)可以连接到管柱上并用于分离多肽片段或融合蛋白。亲和层析之前含有片段或融合蛋白的细胞的裂解和分离可以用标准方法进行(参见例如,Methods in Enzymology, volume 182, eds., Abelson, Simon, and Deutscher, Elsevier, 1990)。
一旦分离,如果需要,CD40多肽片段或融合蛋白可以进一步纯化,例如通过高效液相色谱(参见例如,Fisher, Laboratory Techniques in Biochemistry and Molecular Biology, eds., Work and Burdon, Elsevier, 1980; 和Scopes, Protein Purification: Principles and Practice, Third Edition, ed., Cantor, Springer, 1994)。
也可以通过化学合成产生CD40多肽片段或融合蛋白 (例如,通过Solid Phase Peptide Synthesis, 2nd ed., 1984, The Pierce Chemical Co., Rockford, IL; 和Solid-Phase Synthesis: A Practical Guide, ed., Kates and Albericio, Marcel Dekker Inc., 2000中所述方法)。
其他实施方案
在本说明书中提及的所有专利、专利申请和出版物通过引用并入本文,其程度与特定的或单独的指示通过引用并入的每个单独的专利、专利申请或出版物相同。
- 还没有人留言评论。精彩留言会获得点赞!