一种比率荧光氟离子探针及其制备和应用的制作方法
本发明属于化学/生物传感器技术领域,具体涉及一种比率荧光氟离子探针及其制备和在水相氟离子检测和细胞成像领域中的应用。
背景技术:
生物识别和生物传感已经成为一个重要的研究领域,尤其是阴离子的检测变的尤为重要。氟广泛存在于自然界中,氟化物是人体必须的微量元素之一。但同时含氟化合物是有毒性的,氟化物对人体毒性取决于氟离子的浓度和摄入量。饮用水中含氟的适宜浓度为0.5-1.0mg/L,长期饮用高氟水则会给人体带来不利影响,严重的会引起氟斑牙和氟骨病。氟及氟化物作为重要的化学物质在各个行业有着广泛的应用。化肥、农药、化工、石化行业等在生产中使用含氟化学品或生产含氟化工产品,产生了相应的含氟废水,必须对含氟工业废水加以处理和监测。因此实现对氟离子简便、快速的检测在临床医学中表现出越来越重要的作用。
检测氟离子的机理主要有两类:一是利用路易斯酸碱相互作用,即硼原子作为路易斯酸与作为路易斯碱的氟离子之间产生强的亲和力而实现选择性识别;二是利用氢键作用,即许多氢键给体如脲基、吡咯/杯吡咯、酰胺或咪唑能够与氟离子形成氢键从而达到检测的目的。但是,基于氢键相互作用的氟离子探针选择性较差;基于三芳基硼的氟离子探针选择性较好,但很难实现水相氟离子检测。对氟离子的检测往往很难在水溶液中实现,并且由于检测过程受到其它多种阴离子的干扰,专一性受到限制。近几年,利用硅与氟的特殊的相互作用,可以成功实现了纯水溶剂体系中氟离子的快速检测(Angew.Chem.Int.Ed.2010,49,4915–4918)。
现在基于硅与氟相互作用实现氟离子检测的荧光探针都是基于荧光信号的检测,荧光信号检测在实际应用中容易受到背景荧光的干扰,从而降低了检测的灵敏度和信噪比。荧光比率法是通过两个波长荧光强度的比值变化检测目标物,可以通过自我校正消除不定因素的影响,所以比率法是目前检测离子的最佳选择。相比有机荧光,具有d6、d8和d10电子结构的磷光重金属配合物具有优异的光物理性质,如大的斯托克斯位移可以很容易区分激发和发射峰,能使用可见光进行激发,长的发射寿命有利于使用时间分辨技术有效地与背景荧光信号区分开以提高检测的信噪比和灵敏度等。为了进一步提高检测的信噪比和灵敏度,并实现水相溶液中的氟离子检测,有必要设计合成同时基于磷光信号和荧光信号的新型比率荧光氟离子探针。
本发明提供了一种高灵敏度和高选择性的比率荧光氟离子探针,该探针提高了检测的准确性,,并可用于细胞标记和成像等领域中。
技术实现要素:
技术问题:本发明的目的在于提供一种比率荧光氟离子探针,所述探针为一类磷光铱配合物,给出该探针的制备方法,并提出这类配合物在检测氟离子及其在细胞标记、成像中的应用。同时,还利用紫外-可见吸收光谱、荧光发射光谱检测了该磷光铱配合物对氟离子的响应性能。本发明采用的技术方案如下所述。
技术方案:本发明提供一种比率荧光氟离子探针,所述探针为一类磷光铱配合物,其具有如下结构通式::
其中
n为1-10的正整数。
由上述通式可知,该探针由两部分组成,一部分为荧光的能量给体,一部分为含有异丁基二苯基硅氧基团的离子型铱配合物并作为能量受体,这两部分通过共价键连接在一起。该探针在与氟离子相遇时,铱配合物配体中的硅氧键与氟离子发生作用,硅氧键会发生断裂,导致铱配合物激发态和光物理性质的改变从而影响能量给体和受体间的能量转移效率,外在表现为荧光效应的明显变化,从而通过对比这种变化,能够实现对氟离子的比率荧光检测。
本发明还提供了上述探针分子的制备方法,具体过程为:
(1)在氮气保护下,向2,7-二溴-芴中加入强碱和1-辛醇,搅拌并加热至150-220℃,减压蒸馏出过量的1-辛醇,分离提纯得到2,7-二溴-9-辛基芴;
(2)向强碱和2-吡啶基苯并咪唑中加入离子液体,混合搅拌,加入1,6-二溴己烷,在室温下搅拌,分离提纯得到化合物4;
(3)在氮气保护下,化合物4、2,7-二溴-9-辛基芴、强碱和有机溶剂的混合物加热到30-110℃,搅拌反应,分离提纯得到化合物5;
(4)称取化合物5、Ar-B(OH)2和钯催化剂加入到两颈瓶中,反应体系避光、氮气保护,将2M的强碱水溶液、有机溶剂经过除氧操作,用注射器注入到反应体系中,升温至30-110℃,搅拌反应,分离提纯得到化合物6;
(5)在氮气保护下,C^N配体与三水合三氯化铱在乙二醇乙醚/水(3:1,v:v)混合液中50-180℃密闭反应得到相应的铱二氯桥化合物;
(6)再将得到的铱二氯桥化合物与化合物6在有机溶剂混合液中氮气保护下30-110℃密闭反应,冷却后得到化合物7;
(7)将上述反应物冷却至室温后加入六氟磷酸钾继续反应,旋出溶剂,将得的固体用柱层析方法分离,即得到所述磷光氟离子探针;
其中,所述强碱为氢氧化钾、氢氧化钠、碳酸钠等;步骤(2)中的离子液体为1-丁基-3-甲基咪唑鎓六氟磷酸盐;步骤(3)中的有机溶剂为DMSO;步骤(4)所述的钯催化剂为四(三苯基磷)钯等,所述有机溶剂为甲苯及乙醇的混合溶剂,且经过除氧操作;步骤(6)中的有机溶剂为二氯甲烷和甲醇的混合溶剂,且两者的体积比为2:1。
其中,
n为1-10的正整数。
所述制备方法的制备过程可参照下述方程式:
本发明还提供所述探针的应用,该比率荧光氟离子探针可以用于水相中氟离子的检测。
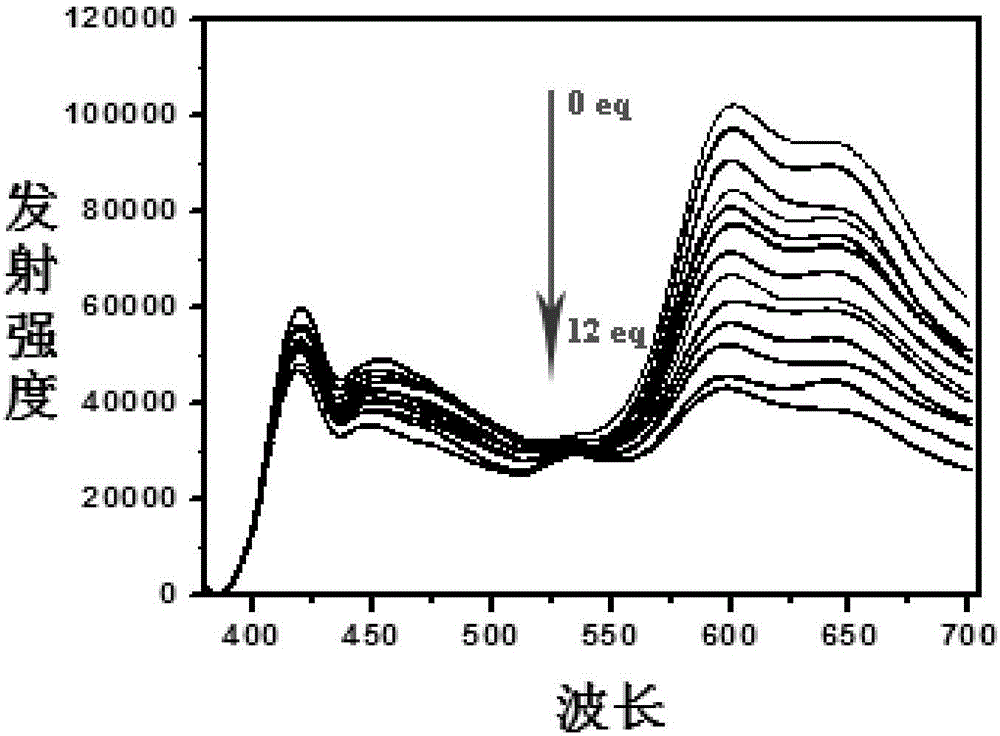
将探针分子溶解在CH3OH/H2O(v/v,2:1,pH 7.2)混合溶液中,逐次加入氟离子的CH3OH/H2O混合溶液中,每次滴加氟离子后,在37℃恒温水浴中加热搅拌5min,使氟离子与铱配合物Ir1充分反应,随后测试其荧光发射光谱,从光谱图中可以看到,随着体系中氟离子浓度的增加,化合物在600nm左右处的荧光强度逐渐变弱,而420nm左右处的荧光强度基本不变。
以上结果表明,本发明的化合物对氟离子具有较高的灵敏度,而且可以实现比率法的检测。
配制10μM的探针分子溶液(CH3OH/H2O(v/v,2:1,pH 7.2)),移取2.5mL所配化合物溶液于比色皿中,加入过量的(超过200倍当量)的含CO32-,HSO4-,NO2-,NO3-,CH3COO-,HSO3-,HCO3-,Cl-,Br-的水溶液,分别测其发射光谱。从光谱图中观察加入各种阴离子前后化合物在600nm处的荧光强度变化,可以看出,化合物对除氟离子之外的其它常见阴离子的荧光基本没有响应。
同时,本发明所述的比率荧光氟离子探针可用于细胞内比率成像。
将消化后的细胞接种在96孔板中,每孔的接种密度为104个/孔,在37℃,5%CO2的条件下继续培养24h。吸除不新鲜的培养液后用不同浓度探针分子溶液(1、5、10、25、50μM)的细胞培养液继续培养细胞24h。每孔加入10μL MTT(5mg/mL)继续培养4h后终止培养。吸除培养液,每孔加入150μL DMSO,摇床震荡10min后使用酶标仪测试OD570。
MTT细胞毒性实验结果显示,在配合物的浓度为1~50μM时,培养24h后的细胞存活率均大于80%,证明该配合物具有较低的细胞毒性,可用于细胞成像。
本发明采用的细胞均为人宫颈癌HeLa细胞。将消化后的细胞接种在培养皿中,在37℃,5%CO2的条件下继续培养24h使之贴壁。将培养好的HeLa细胞用PBS缓冲溶液洗三次,然后用上述配好的探针分子溶液培养15min后,加入NaF水溶液继续培养15min。参照组则只用探针溶液培养15min。明场成像和荧光成像用共聚焦显微镜观测。共聚焦显微镜激发波长为405nm,收集波段通道为410-500nm和550-650nm区域。从图片可以看出,只用化合物溶液培养的HeLa细胞,在两个波段区域都有很强的荧光信号。而加入氟离子之后,在410-500nm通道有很强的光信号,在550-650nm通道区域的荧光信号很弱。明场观察可以看到很好的细胞形态,证明在整个实验过程中细胞活性良好。
有益效果:
1.本发明的化合物作为氟离子磷光传感器,可用于对水相中氟离子的高灵敏度、高选择性检测。
2.本发明的化合物作为氟离子磷光传感器,可实现比率法和比色法的检测,消除了背景荧光的干扰,提高了检测的准确性。
3.本发明的化合物作为氟离子磷光传感器能够实现对水相中氟离子的高灵敏度、高选择性检测,尤其是能够实现对氟离子的比率荧光检测和生物比率成像。
附图说明
图1为实施例1中配合物Ir1的荧光滴定图。
图2为实施例1中配合物Ir1对常见阴离子的识别响应图。
图3为实施例1中配合物Ir1的MTT细胞毒性实验。。
图4为实施例1中配合物Ir1在细胞培养后加入氟离子前后的共聚焦成像图。
具体实施方式
本发明涉及化合物的结构通式如下:
其中
n为1-10的正整数。
为了更好地理解本发明专利的内容,下面通过具体的实例来进一步说明本发明的技术方案。具体包括合成、性质测定、滴定实验以及细胞成像等。但这些实施例并不限制本发明。
实施例1:探针Ir1,即配体为的探针材料的制备及应用测验:
探针Ir1的制备方法如下述方程式和步骤所示:
(1)化合物3的制备:在反应瓶中加入2,7-二溴-芴(10.0g,60.2mmol)、细粉状的氢氧化钾(1.69g,30.1mmol)和1-辛醇(40g,0.31mol),搅拌并加热至190℃反应19h。将反应混合物冷却至室温,减压蒸馏出过量的1-辛醇。粗产物采用干的硅胶柱,以正己烷作为淋洗剂,过柱得到2,7-二溴-9-辛基-芴(86%)。1H NMR(400MHz,CDCl3):δ=7.62(d,J=1.7Hz,2H),7.56(d,J=8.1Hz,2H),7.49(dd,J=1.7Hz and 8.1Hz,2H),3.95(t,J=5.8Hz,1H),1.90-2.04(m,2H,CH2),1.06-1.35(m,12H,6×CH2),0.87(t,J=6.7Hz,3H,CH3);13C NMR(100MHz CDCl3,):δ=149.2,139.0,130.1,127.6,121.1,121.0,47.4,32.6,31.7,29.7,29.2,25.4,22.6,14.0;C21H24Br2元素分析理论(实验)值(%):C 57.8(57.9),H 5.6(5.5)。
(2)化合物4的制备:在反应瓶中加入氢氧化钾51mmol和2-吡啶基苯并咪唑10.2mmol,并加入1-丁基-3-甲基咪唑鎓六氟磷酸盐(离子液体)20ml。混合物预先搅拌5min后,加入1,6-二溴己烷8ml,搅拌反应5h。反应完成后,用乙醚萃取三次,合并油相,采用旋转蒸发仪除去溶剂。得到的粗产物用柱层析进行分离,淋洗液为体积比为石油醚:乙酸乙酯=3∶1的混合溶液,最后得到无色油状液体2.2g,产率60%。1H NMR(400MHz,CDCl3):δ=8.70(d,J=4.80Hz,1H),8.41(d,J=7.97Hz,1H),7.88-7.33(m,2H),7.46-7.44(m,1H),7.37-7.30(m,3H),4.84(t,J=7.6Hz,2H),3.38(t,J=6.8Hz,2H),1.95-1.88(m,2H),1.86-1.79(m,2H),1.53-1.44(m,2H),1.42-1.35(m,2H);13C NMR(100MHz,CDCl3,298K):δ=150.79,149.94,148.76,142.71,136.94,136.69,124.82,123.88,123.40,122.68,120.23,110.28,45.36,33.88,32.64,29.94,27.81,26.07。
(3)化合物5的制备:在氮气保护下,化合物4(4.0mmol)、2,7-二溴-9-辛基芴(4.0mmol)、KOH(20mmol)和DMSO(10mL)的混合物加热到60℃,搅拌反应6h。原料反应完全后,将混合物倒入大量饱和食盐水中,用乙酸乙酯萃取三次。所得到的有机相用无水硫酸钠干燥。干燥完全后,将固体过滤,所得滤液用旋转蒸发仪在减压下除去部分溶剂,然后以体积比为石油醚:乙酸乙酯=3:1的混合溶液作为洗脱液过硅胶柱进行提纯,最后得到无色胶状体,产率74%。1H NMR(400MHz,CDCl3):δ=8.61(d,J=4.59Hz,1H),8.36(d,J=7.92Hz,1H),7.85-7.80(m,2H),7.52-7.29(m,10H),4.73(t,J=7.38Hz,2H),1.90-1.84(m,4H),1.74-1.67(m,2H),1.25-1.04(m,14H),0.83(t,J=6.97Hz,3H),0.6-0.49(m,4H);13C NMR(100MHz,CDCl3):δ=152.48,150.81,149.96,148.70,142.72,139.16,136.86,136.67,130.33,126.20,124.76,123.77,123.32,122.58,121.61,121.31,120.17,110.30,55.70,45.34,40.30,40.17,31.88,30.03,29.95,29.27,26.52,23.69,22.72,14.21。
(4)化合物6a的制备:称取化合物5(0.71g,1mmol)、9-己基咔唑-3-硼酸(1.0g,2.3mmol)和四(三苯基磷)钯(0.05g,0.04mmol)加入到两颈瓶中,并对反应装置采取避光措施,然后在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将2M的碳酸钠水溶液(2.5mL)、甲苯(5.0mL)及乙醇(2.5mL)分别用氮气鼓泡除氧后,用注射器注入到反应体系中。升温至70℃,搅拌反应36h。然后,将反应体系冷却至室温并倒入大量水中,用乙酸乙酯萃取。萃取液用饱和食盐水洗后再用无水Na2SO4干燥。干燥后过滤除去无机盐固体,将所得滤液用旋转蒸发仪减压下除去部分溶剂,浓缩到一定程度后用正己烷作溶剂进行重结晶纯化,得白色固体(0.74g,70%)。1H NMR(400MHz,CDCl3):δ=8.54(d,J=4.37Hz,1H),8.39(d,J=1.26Hz,2H),8.19(d,J=7.70Hz,2H),7.83-7.78(m,5H),7.73-7.67(m,5H),7.55-7.39(m,7H),7.74-7.17(m,6H),4.67(t,J=7.70Hz,2H),4.35(t,J=7.13Hz,4H),1.95-1.88(m,4H),1.75-1.66(m,2H),1.53-1.44(m,2H),1.52-1.35(m,2H),1.46-1.28(m,16H),1.21-1.11(m,14H),0.88(t,J=6.91Hz,9H);13C NMR(100MHz,CDCl3,298K):δ=151.62,148.75,141.06,141.00,139.58,136.84,132.87,128.65,127.93,126.95,126.30,126.33,125.94,125.39,124.79,123.84,123.52,123.40,123.11,121.70,120.61,120.04,119.94,119.01,118.92,110.38,109.05,108.99,55.35,45.46,43.39,40.77,40.66,32.07,31.97,31.76,30.22,30.07,29.85,29.81,29.51,29.42,29.38,29.15,27.15,26.63,22.84,22.75,22.71,14.28,14.22,14.19。
(5)化合物1a的制备:称取4-(2-苯并噻唑基)苯酚(1g),二苯基叔丁基氯硅烷2ml,咪唑200mg,加入到两口瓶中,在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将纯的N,N二甲基甲酰胺(5ml)加到反应瓶中,搅拌,并将反应体系的温度升到40℃,反应约24h。处理:用水和乙酸乙酯萃取,真空旋干,乙醇重结晶,得到C^N配体。1H NMR(400MHz,DMSO)δ=6.91-6.86(dd,2H),7.51-7.39(m,8H),1.05(s,9H),7.71-7.66(m,4H),7.96-7.79(d,J=7.8Hz,1H),8.09-8.04(d,1H),7.91-7.86(m,2H).
化合物2a的制备:称取IrCl3·3H2O(1mmol)和C^N配体(2.5mmol)加入到三口烧瓶中,在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将乙二醇乙醚和水的混合物(3:1v/v)用注射器注入到反应体系中,搅拌,并将反应体系升温至110℃,反应约24h,反应过程中有沉淀生成。将反应体系冷却至室温,然后将沉淀过滤,并用水、乙醇洗,得到固体产物,即铱二氯桥化合物。产率:80%
(6)配合物Ir1的制备:称取铱二氯桥化合物200mg和化合物6a(420mg)加入到三口瓶中,随后加入15mL二氯甲烷和甲醇的混合溶剂(2:1,v/v),在磁力搅拌下回流。加入5倍当量的六氟磷酸钾后继续搅拌1h,然后除去溶剂,将所得固体混合物再溶于约10mL的二氯甲烷中,将不溶固体过滤除去,滤液除去溶剂后所得的固体物用柱层析(二氯甲烷/丙酮)分离得到纯品。产率:61%。核磁数据:1H NMR(400MHz,CDCl3):δ=8.43(d,J=9.8Hz,2H),8.17-8.04(m,9H),7.98(d,J=7.8Hz,1H),7.91-7.75(m,11H),7.71-7.47(m,13H),7.45-7.29(m,15H),7.15-6.88(m,6H),6.81-6.66(dd,4H),4.19-4.62(m,6H),2.13-1.87(m,9H),1.44-1.12(m,32H),1.06(s,18H),0.85(t,J=7.1Hz,6H),0.78(t,J=6.9Hz,3H)。
探针Ir1的发射光谱对氟离子的响应性::
将铱配合物Ir1溶解在CH3OH/H2O(v/v,2:1,pH 7.2)混合溶液中,逐次加入氟离子的CH3OH/H2O混合溶液中,每次滴加氟离子后,在37℃恒温水浴中加热搅拌5min,使氟离子与铱配合物Ir1充分反应,随后测试其荧光发射光谱,600nm处,发射强度由高到低依次对应的氟离子浓度为0eq、1eq、2eq、3eq、4eq、5eq、6eq、7eq、8eq、9eq、10eq、11eq、12eq。从图1中可以看到,随着体系中氟离子浓度的增加,化合物在600nm左右处的荧光强度逐渐变弱,而420nm左右处的荧光强度基本不变。
以上结果表明,本发明的化合物对氟离子具有较高的灵敏度,而且可以实现比率法的检测。
探针Ir1在溶液中对氟离子的选择性实验:
配制10μM的配合物Ir1溶液(CH3OH/H2O(v/v,2:1,pH 7.2)),移取2.5mL所配化合物溶液于比色皿中,加入过量的(超过200倍当量)的含CO32-,HSO4-,NO2-,NO3-,CH3COO-,HSO3-,HCO3-,Cl-,Br-的水溶液,分别测其发射光谱。图2为加入各种阴离子前后化合物在600nm处的荧光强度变化。从图中可以看出,化合物对除氟离子之外的其它常见阴离子的荧光基本没有响应。
配合物Ir1的MTT细胞毒性实验:
将消化后的细胞接种在96孔板中,每孔的接种密度为104个/孔,在37℃,5%CO2的条件下继续培养24h。吸除不新鲜的培养液后用不同浓度Ir1(1、5、10、25、50μM)的细胞培养液继续培养细胞24h。每孔加入10μL MTT(5mg/mL)继续培养4h后终止培养。吸除培养液,每孔加入150μL DMSO,摇床震荡10min后使用酶标仪测试OD570。
MTT细胞毒性实验结果如图3所示,在配合物的浓度为1~50μM时,培养24h后的细胞存活率均大于80%,证明该配合物具有较低的细胞毒性,可用于细胞成像。
配合物Ir1活细胞成像实验:
本发明采用的细胞均为人宫颈癌HeLa细胞。将消化后的细胞接种在培养皿中,在37℃,5%CO2的条件下继续培养24h使之贴壁。将培养好的HeLa细胞用PBS缓冲溶液洗三次,然后用上述配好的化合物溶液培养15min后,加入NaF水溶液继续培养15min。参照组则只用化合物溶液培养15min。明场成像和荧光成像用共聚焦显微镜观测。共聚焦显微镜激发波长为405nm,收集波段通道为410-500nm和550-650nm区域。从图4可以看出,其中图4A、D是明场照片,图4B、E是暗场照片,图4C、F是叠加场照片,只用化合物溶液培养的HeLa细胞,在两个波段区域都有很强的荧光信号。而加入氟离子之后,在410-500nm通道有很强的光信号,在550-650nm通道区域的荧光信号很弱。明场观察可以看到很好的细胞形态,证明在整个实验过程中细胞活性良好。
实施例2:探针Ir2,即当配体为的探针材料的制备及应用测验:
探针Ir2的制备方法如下述方程式和步骤所示:
(1)化合物3的制备:在反应瓶中加入2,7-二溴-芴(10.0g,60.2mmol)、细粉状的氢氧化钾(1.69g,30.1mmol)和1-辛醇(40g,0.31mol),搅拌并加热至150-220℃反应过夜。将反应混合物冷却至室温,减压蒸馏出过量的1-辛醇。粗产物采用干的硅胶柱,以正己烷作为淋洗剂,过柱得到2,7-二溴-9-辛基-芴(86%)。
(2)化合物4的制备:在反应瓶中加入氢氧化钾51mmol和2-吡啶基苯并咪唑10.2mmol,并加入1-丁基-3-甲基咪唑鎓六氟磷酸盐(离子液体)20ml。混合物预先搅拌5min后,加入1,6-二溴己烷8ml,搅拌反应。反应完成后,用乙醚萃取三次,合并油相,采用旋转蒸发仪除去溶剂。得到的粗产物用柱层析进行分离,淋洗液为体积比为石油醚:乙酸乙酯=3:1的混合溶液,最后得到无色油状液体2.2g,产率60%。
(3)化合物5的制备:在氮气保护下,化合物4(4.0mmol)、2,7-二溴-9-辛基芴(4.0mmol)、KOH(20mmol)和DMSO(10mL)的混合物加热到30-110℃,搅拌反应。原料反应完全后,将混合物倒入大量饱和食盐水中,用乙酸乙酯萃取三次。所得到的有机相用无水硫酸钠干燥。干燥完全后,将固体过滤,所得滤液用旋转蒸发仪在减压下除去部分溶剂,然后以体积比为石油醚:乙酸乙酯=3:1的混合溶液作为洗脱液过硅胶柱进行提纯,最后得到无色胶状体,产率74%。
(4)化合物6b的制备:称取化合物5(0.71g,1mmol)、4-硼酸三苯胺(0.67g,2.3mmol)和四(三苯基磷)钯(0.05g,0.04mmol)加入到两颈瓶中,并对反应装置采取避光措施,然后在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将2M的碳酸钠水溶液(2.5mL)、甲苯(5.0mL)及乙醇(2.5mL)分别用氮气鼓泡除氧后,用注射器注入到反应体系中。升温至30-110℃。然后,将反应体系冷却至室温并倒入大量水中,用乙酸乙酯萃取。萃取液用饱和食盐水洗后再用无水Na2SO4干燥。干燥后过滤除去无机盐固体,将所得滤液用旋转蒸发仪减压下除去部分溶剂,浓缩到一定程度后用正己烷作溶剂进行重结晶纯化,得白色固体(0.74g,70%)。
(5)化合物1b的制备:称取4-(2-吡啶基)苯酚(1g),二苯基叔丁基氯硅烷2ml,咪唑200mg,加入到两口瓶中,在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将纯的N,N二甲基甲酰胺(5ml)加到反应瓶中,搅拌,并将反应体系的温度升到30-110℃。处理:用水和乙酸乙酯萃取,真空旋干,乙醇重结晶。
化合物2b的制备:称取IrCl3·3H2O(1mmol)和C^N配体(2.5mmol)加入到三口烧瓶中,在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将乙二醇乙醚和水的混合物(3:1v/v)用注射器注入到反应体系中,搅拌,并将反应体系升温至50-180℃,反应过程中有沉淀生成。将反应体系冷却至室温,然后将沉淀过滤,并用水、乙醇洗,得到固体产物,即。产率:80%
(6)配合物Ir2的制备:称取铱二氯桥化合物200mg和化合物6b(433mg)加入到三口瓶中,随后加入15mL二氯甲烷和甲醇的混合溶剂(2:1,v/v),在30-110℃下磁力搅拌下回流。加入5倍当量的六氟磷酸钾后继续搅拌,然后除去溶剂,将所得固体混合物再溶于约10mL的二氯甲烷中,将不溶固体过滤除去,滤液除去溶剂后所得的固体物用柱层析(二氯甲烷/丙酮)分离得到纯品。产率:60%。核磁数据
探针Ir2的发射光谱对氟离子的响应性::
将铱配合物Ir2溶解在CH3OH/H2O(v/v,2:1,pH 7.2)混合溶液中,逐次加入氟离子的CH3OH/H2O混合溶液中,每次滴加氟离子后,在37℃恒温水浴中加热搅拌5min,使氟离子与铱配合物Ir2充分反应,随后测试其荧光发射光谱,从图1中可以看到,随着体系中氟离子浓度的增加,化合物在592nm左右处的荧光强度逐渐变弱,而415nm左右处的荧光强度基本不变。
以上结果表明,本发明的化合物对氟离子具有较高的灵敏度,而且可以实现比率法的检测。
探针Ir2在溶液中对氟离子的选择性实验:
配制10μM的配合物Ir2溶液(CH3OH/H2O(v/v,2:1,pH 7.2)),移取2.5mL所配化合物溶液于比色皿中,加入过量的(超过200倍当量)的含CO32-,HSO4-,NO2-,NO3-,CH3COO-,HSO3-,HCO3-,Cl-,Br-的水溶液,分别测其发射光谱。图2为加入各种阴离子前后化合物在592nm处的荧光强度变化。从图中可以看出,化合物对除氟离子之外的其它常见阴离子的荧光基本没有响应。
配合物Ir2的MTT细胞毒性实验:
将消化后的细胞接种在96孔板中,每孔的接种密度为104个/孔,在37℃,5%CO2的条件下继续培养24h。吸除不新鲜的培养液后用不同浓度Ir2(1、5、10、25、50μM)的细胞培养液继续培养细胞24h。每孔加入10μL MTT(5mg/mL)继续培养4h后终止培养。吸除培养液,每孔加入150μL DMSO,摇床震荡10min后使用酶标仪测试OD570。
MTT细胞毒性实验结果如图3所示,在配合物的浓度为1~50μM时,培养24h后的细胞存活率均大于80%,证明该配合物具有较低的细胞毒性,可用于细胞成像。
配合物Ir2活细胞成像实验:
本发明采用的细胞均为人宫颈癌HeLa细胞。将消化后的细胞接种在培养皿中,在37℃,5%CO2的条件下继续培养24h使之贴壁。将培养好的HeLa细胞用PBS缓冲溶液洗三次,然后用上述配好的化合物溶液培养15min后,加入NaF水溶液继续培养15min。参照组则只用化合物溶液培养15min。明场成像和荧光成像用共聚焦显微镜观测。共聚焦显微镜激发波长为405nm,收集波段通道为410-500nm和550-650nm区域。从图4可以看出,只用化合物溶液培养的HeLa细胞,在两个波段区域都有很强的荧光信号。而加入氟离子之后,在410-500nm通道有很强的光信号,在550-650nm通道区域的荧光信号很弱。明场观察可以看到很好的细胞形态,证明在整个实验过程中细胞活性良好。
实施例3:探针Ir2,即当配体为的探针材料的制备及应用测验:
探针Ir3的制备方法如下述方程式和步骤所示:
化合物3、4和5的制备过程和实施例2中的一致。
化合物6c的制备:称取化合物5(0.71g,1mmol)、苯硼酸(0.28g,2.3mmol)和四(三苯基磷)钯(0.05g,0.04mmol)加入到两颈瓶中,并对反应装置采取避光措施,然后在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将2M的碳酸钠水溶液(2.5mL)、甲苯(5.0mL)及乙醇(2.5mL)分别用氮气鼓泡除氧后,用注射器注入到反应体系中。升温至30-110℃。然后,将反应体系冷却至室温并倒入大量水中,用乙酸乙酯萃取。萃取液用饱和食盐水洗后再用无水Na2SO4干燥。干燥后过滤除去无机盐固体,将所得滤液用旋转蒸发仪减压下除去部分溶剂,浓缩到一定程度后用正己烷作溶剂进行重结晶纯化,得白色固体(0.74g,70%)。
化合物1c的制备:称取4-(2-喹啉基)苯酚(1g),二苯基叔丁基氯硅烷2ml,咪唑200mg,加入到两口瓶中,在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将纯的N,N二甲基甲酰胺(5ml)加到反应瓶中,搅拌,并将反应体系的温度升到30-110℃。处理:用水和乙酸乙酯萃取,真空旋干,乙醇重结晶。
化合物2c的制备:称取IrCl3·3H2O(1mmol)和C^N配体(2.5mmol)加入到三口烧瓶中,在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将乙二醇乙醚和水的混合物(3:1v/v)用注射器注入到反应体系中,搅拌,并将反应体系升温至50-180℃,反应过程中有沉淀生成。将反应体系冷却至室温,然后将沉淀过滤,并用水、乙醇洗,得到固体产物,即。产率:80%
配合物Ir3的制备:称取铱二氯桥化合物200mg和化合物6c(400mg)加入到三口瓶中,随后加入15mL二氯甲烷和甲醇的混合溶剂(2:1,v/v),在磁力搅拌下回流。加入5倍当量的六氟磷酸钾后继续搅拌,然后除去溶剂,将所得固体混合物再溶于约10mL的二氯甲烷中,将不溶固体过滤除去,滤液除去溶剂后所得的固体物用柱层析(二氯甲烷/丙酮)分离得到纯品。产率:61%。核磁数据
探针Ir3的发射光谱对氟离子的响应性::
将铱配合物Ir3溶解在CH3OH/H2O(v/v,2:1,pH 7.2)混合溶液中,逐次加入氟离子的CH3OH/H2O混合溶液中,每次滴加氟离子后,在37℃恒温水浴中加热搅拌5min,使氟离子与铱配合物Ir3充分反应,随后测试其荧光发射光谱,从图1中可以看到,随着体系中氟离子浓度的增加,化合物在588nm左右处的荧光强度逐渐变弱,而416nm左右处的荧光强度基本不变。
以上结果表明,本发明的化合物对氟离子具有较高的灵敏度,而且可以实现比率法的检测。
探针Ir3在溶液中对氟离子的选择性实验:
配制10μM的配合物Ir3溶液(CH3OH/H2O(v/v,2:1,pH 7.2)),移取2.5mL所配化合物溶液于比色皿中,加入过量的(超过200倍当量)的含CO32-,HSO4-,NO2-,NO3-,CH3COO-,HSO3-,HCO3-,Cl-,Br-的水溶液,分别测其发射光谱。图2为加入各种阴离子前后化合物在588nm处的荧光强度变化。从图中可以看出,化合物对除氟离子之外的其它常见阴离子的荧光基本没有响应。
配合物Ir3的MTT细胞毒性实验:
将消化后的细胞接种在96孔板中,每孔的接种密度为104个/孔,在37℃,5%CO2的条件下继续培养24h。吸除不新鲜的培养液后用不同浓度Ir3(1、5、10、25、50μM)的细胞培养液继续培养细胞24h。每孔加入10μL MTT(5mg/mL)继续培养4h后终止培养。吸除培养液,每孔加入150μL DMSO,摇床震荡10min后使用酶标仪测试OD570。
MTT细胞毒性实验结果如图3所示,在配合物的浓度为1~50μM时,培养24h后的细胞存活率均大于80%,证明该配合物具有较低的细胞毒性,可用于细胞成像。
配合物Ir3活细胞成像实验:
本发明采用的细胞均为人宫颈癌HeLa细胞。将消化后的细胞接种在培养皿中,在37℃,5%CO2的条件下继续培养24h使之贴壁。将培养好的HeLa细胞用PBS缓冲溶液洗三次,然后用上述配好的化合物溶液培养15min后,加入NaF水溶液继续培养15min。参照组则只用化合物溶液培养15min。明场成像和荧光成像用共聚焦显微镜观测。共聚焦显微镜激发波长为405nm,收集波段通道为410-500nm和550-650nm区域。从图4可以看出,只用化合物溶液培养的HeLa细胞,在两个波段区域都有很强的荧光信号。而加入氟离子之后,在410-500nm通道有很强的光信号,在550-650nm通道区域的荧光信号很弱。明场观察可以看到很好的细胞形态,证明在整个实验过程中细胞活性良好。
实施例4:探针Ir4,即当配体为的探针材料的制备及应用测验:
探针Ir4的制备方法如下述方程式和步骤所示:
化合物1a和2a的制备过程和实施例1中的一致,化合物3、4和5的制备过程和实施例2中的一致。
化合物6d的制备:称取化合物5(0.71g,1mmol)、(9,9-二辛基)-芴-2-硼酸(1.0g,2.3mmol)和四(三苯基磷)钯(0.05g,0.04mmol)加入到两颈瓶中,并对反应装置采取避光措施,然后在双排管上抽真空-充氮气-抽真空,循环三次,最后用氮气保护反应体系。将2M的碳酸钠水溶液(2.5mL)、甲苯(5.0mL)及乙醇(2.5mL)分别用氮气鼓泡除氧后,用注射器注入到反应体系中。升温至30-110℃。然后,将反应体系冷却至室温并倒入大量水中,用乙酸乙酯萃取。萃取液用饱和食盐水洗后再用无水Na2SO4干燥。干燥后过滤除去无机盐固体,将所得滤液用旋转蒸发仪减压下除去部分溶剂,浓缩到一定程度后用正己烷作溶剂进行重结晶纯化,得白色固体(0.79g,74.7%)。
配合物Ir4的制备:称取铱二氯桥化合物200mg和化合物6d(450mg)加入到三口瓶中,随后加入15mL二氯甲烷和甲醇的混合溶剂(2:1,v/v),在磁力搅拌下回流。加入5倍当量的六氟磷酸钾后继续搅拌,然后除去溶剂,将所得固体混合物再溶于约10mL的二氯甲烷中,将不溶固体过滤除去,滤液除去溶剂后所得的固体物用柱层析(二氯甲烷/丙酮)分离得到纯品。产率:65%。
探针Ir4的发射光谱对氟离子的响应性:
将铱配合物Ir4溶解在CH3OH/H2O(v/v,2:1,pH 7.2)混合溶液中,逐次加入氟离子的CH3OH/H2O混合溶液中,每次滴加氟离子后,在37℃恒温水浴中加热搅拌5min,使氟离子与铱配合物Ir4充分反应,随后测试其荧光发射光谱,从图1中可以看到,随着体系中氟离子浓度的增加,化合物在587nm左右处的荧光强度逐渐变弱,而411nm左右处的荧光强度基本不变。
以上结果表明,本发明的化合物对氟离子具有较高的灵敏度,而且可以实现比率法的检测。
探针Ir4在溶液中对氟离子的选择性实验:
配制10μM的配合物Ir4溶液(CH3OH/H2O(v/v,2:1,pH 7.2)),移取2.5mL所配化合物溶液于比色皿中,加入过量的(超过200倍当量)的含CO32-,HSO4-,NO2-,NO3-,CH3COO-,HSO3-,HCO3-,Cl-,Br-的水溶液,分别测其发射光谱。图2为加入各种阴离子前后化合物在600nm处的荧光强度变化。从图中可以看出,化合物对除氟离子之外的其它常见阴离子的荧光基本没有响应。
配合物Ir4的MTT细胞毒性实验:
将消化后的细胞接种在96孔板中,每孔的接种密度为104个/孔,在37℃,5%CO2的条件下继续培养24h。吸除不新鲜的培养液后用不同浓度Ir4(1、5、10、25、50μM)的细胞培养液继续培养细胞24h。每孔加入10μL MTT(5mg/mL)继续培养4h后终止培养。吸除培养液,每孔加入150μL DMSO,摇床震荡10min后使用酶标仪测试OD570。
MTT细胞毒性实验结果如图3所示,在配合物的浓度为1~50μM时,培养24h后的细胞存活率均大于80%,证明该配合物具有较低的细胞毒性,可用于细胞成像。
配合物Ir4活细胞成像实验:
本发明采用的细胞均为人宫颈癌HeLa细胞。将消化后的细胞接种在培养皿中,在37℃,5%CO2的条件下继续培养24h使之贴壁。将培养好的HeLa细胞用PBS缓冲溶液洗三次,然后用上述配好的化合物溶液培养15min后,加入NaF水溶液继续培养15min。参照组则只用化合物溶液培养15min。明场成像和荧光成像用共聚焦显微镜观测。共聚焦显微镜激发波长为405nm,收集波段通道为410-500nm和550-650nm区域。从图4可以看出,只用化合物溶液培养的HeLa细胞,在两个波段区域都有很强的荧光信号。而加入氟离子之后,在410-500nm通道有很强的光信号,在550-650nm通道区域的荧光信号很弱。明场观察可以看到很好的细胞形态,证明在整个实验过程中细胞活性良好。
- 还没有人留言评论。精彩留言会获得点赞!