CectGPDH2基因及其应用的制作方法
本发明涉及一种甘油-3-磷酸脱氢酶基因CectGPDH2及其应用。具体地,涉及该基因序列的获得和植物表达载体的构建,以及其能显著提高模式植物拟南芥及油料作物种子脂肪酸含量的应用。
背景技术:
目前,随着传统能源的过度消耗和日益增长的能源需求,能源问题日益严峻,可替代能源的研究和开发成为全球学者关注的热点。生物柴油主要以大豆、麻疯树等油料作物、废弃的厨余油脂、动物性脂肪以及基因工程改造过的微藻作为原材料加工成液体燃料,是可以替代传统石油燃料的优质新型可再生能源。而微藻由于含油量高,易于培养,单位土地油脂产量远高于其他油料作物,被认为是最有潜力的能源资源之一。
微藻繁殖能力强,对生长环境要求低,易于培养,光合作用效率高,含油量高,但目前微藻油脂代谢途径中关键酶基因的研究还相对较少。小球藻(Chlorella)是微藻中的一类,属于绿藻门小球藻属,是光合自养型球形单细胞绿藻,直径大约3-8微米。小球藻繁殖能力很强,含有丰富的营养元素,例如蛋白质、油脂、多不饱和脂肪酸、维生素、矿物质、食物纤维、核酸及叶绿素等,还含有多种生物活性物质,例如糖蛋白、多糖。小球藻是少数几个可用于大规模培养的微藻。
真核生物(例如小球藻)中,油脂的主要储存形式是三酰甘油(TAG),由甘油-3-磷酸(G3P)和脂酰辅酶A为前体合成。甘油-3-磷酸脱氢酶(Glycerol-3-phosphate dehydrogenase,GPDH)催化糖酵解过程中产生的磷酸二羟丙酮(Dihydroxyacetone phosphate,DHAP)与G3P之间的相互转变,产物G3P是合成TAG的重要原料,因此,GPDH是连接糖代谢和脂代谢的关键酶。
G3P是由甘油磷酸化而来,在植物中,淀粉通常作为光合作用的终产物被储存起来,甘油的主要来源是通过将淀粉分解的葡萄糖送入糖酵解过程,将糖酵解中间产物转化为甘油。而在微藻中,有些种类的微藻在积累淀粉的同时会产生大量的甘油,作为光合作用的终产物储存起来。因此,在微藻中,主要有两条不同的甘油合成途径,其一是利用光合作用直接合成甘油,另一条是通过分解储藏物质,将淀粉及蔗糖分解成为6-磷酸果糖,后转变为DHAP,再由甘油-3-磷酸脱氢酶催化,生成G3P,最后通过去磷酸化作用生成甘油。从微藻GPDH在油脂合成代谢中的位置上来看,GPDH所催化的由DHAP转变为G3P的反应是甘油合成途径的关键步骤,GPDH参与了线粒体G3P穿梭,为呼吸链提供电子,是G3P合成的关键酶之一,而G3P是TAG和磷脂合成的重要原料,并且GPDH连接了糖代谢和脂代谢,对植物体内油脂合成和能量代谢有重要作用。
根据GPDH在细胞内位置不同,将其分为三种类型同工酶——细胞质型GPDH(ctGPDH),叶绿体型GPDH(cpGPDH)和线粒体型GPDH(mGPDH)。每种同工酶在细胞内偏好催化DHAP与G3P之间相互转变的正反应或逆反应,辅酶类型不同(以FAD或NADH/NADPH作为辅酶),受不同条件诱导表达(渗透胁迫、热激、油酸胁迫等),并且在不同物种中目前已发现的GPDH同工酶数量不同。
细胞质型甘油-3-磷酸脱氢酶(Cytosolic glycerol-3-phosphate dehydrogenase,ctGPDH)(EC1.1.1.8)是一个以NADH为辅酶的甘油-3-磷酸脱氢酶,位于细胞质中,主要催化DHAP向G3P转变的反应。ctGPDH与线粒体甘油-3-磷酸脱氢酶(Mitochondrial glycerol-3-phosphate dehydrogenase,mGPDH)一起参与了线粒体G3P穿梭。ctGPDH在胞质中催化DHAP转变为G3P,NADH转变为NAD+,随后G3P被转运到线粒体内外膜之间,在mGPDH的催化下转变为DHAP,同时向电子穿地链贡献两个电子,随后DHAP穿过线粒体外膜回到胞质中。
有报道表明绿茶儿茶酚对GPDH的活性有抑制作用。ctGPDH被认为在细胞甘油合成和三酰甘油积累途径中起主要作用。研究表明,将油菜种子特异性启动子控制下的酵母ctGPDH转入油菜,转基因株系甘油含量最高是野生型的四倍,种子总脂肪酸含量最高提高40%,达到81.4±10mg/g鲜重(授粉后30天的种子),脂肪酸组成没有明显变化,并且成熟种子种蔗糖含量下降,但蛋白质含量并没有明显变化。但成熟种子的总油脂含量和总脂肪酸含量没有给出数据。在一定范围浓度的渗透胁迫下,会导致细胞ctGPDH的表达量增加,进而导致甘油积累。
目前尚未有来源于植物的ctGPDH基因能够大幅提高植物含油量及提高提高植物亚油酸(C18:2)及二十烯酸(C20:1)含量的报道。
技术实现要素:
本发明的目的是提供一种甘油-3-磷酸脱氢酶基因CectGPDH2及其应用。
本发明首先提供来自椭圆小球藻(Chlorella ellipsoidea)的CectGPDH2蛋白,其为
(a)由SEQ ID NO.2所示的氨基酸序列组成的蛋白;或
(b)将SEQ ID NO.2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加由SEQ ID NO.2衍生的且保持SEQ ID NO.2所示的蛋白功能的蛋白;
本发明提供了编码CectGPDH2蛋白的基因,其核苷酸序列为:
i)SEQ ID NO.2所示的核苷酸序列;或
ii)SEQ ID NO.2所示的核苷酸序列经取代、缺失和/或增加一个或多个核苷酸且表达相同功能蛋白的核苷酸序列;或
iii)在严格条件下与SEQ ID NO.2所示序列杂交且表达相同功能蛋白质的核苷酸序列,所述严格条件为在含0.1%SDS的0.1×SSPE或含0.1%SDS的0.1×SSC溶液中,在65℃下杂交,并用该溶液洗膜;或
iv)与i)、ii)或iii)的核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列。
本发明提供了含有上述基因的生物材料,所述生物材料为重组表达载体、表达盒、重组菌或宿主细胞。
可用现有的植物表达载体构建含有CectGPDH2基因的重组表达载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。使用CectGPDH2基因构建重组表达载体时,可在其转录起始核苷酸前加上任何一种增强型、组成型、组织特异型或诱导型启动子,它们可单独使用或与其它的植物启动子结合使用;此外,使用CectGPDH2基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入在植物中表达可产生颜色变化的酶或发光化合物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以开花时间为表型筛选转化植株。
本发明提供了CectGPDH2蛋白或其编码基因或含有该编码基因的生物材料在提高细胞中亚油酸含量中的应用。
本发明提供了CectGPDH2蛋白或其编码基因或含有该编码基因的生物材料在提高细胞中二十烯酸含量中的应用。
本发明提供了CectGPDH2蛋白或其编码基因或含有该编码基因的生物材料在提高细胞中总脂肪酸含量中的应用。
上述应用中,所述细胞为酵母细胞、植物细胞或藻类细胞。
进一步地,所述酵母是酿酒酵母;所述藻类是小球藻;所述植物为油菜、拟南芥、向日葵、大豆、番茄、蓖麻、芝麻或花生。
更进一步地,所述酿酒酵母为尿嘧啶缺陷型酿酒酵母INVSC1;所述小球藻是椭圆小球藻(Chlorella ellipsoidea);所述植物优选是油菜和拟南芥。
本发明提供了CectGPDH2蛋白或其编码基因或含有该编码基因的生物材料在制备转基因植物中的应用。
本发明提供的椭圆小球藻GPDH基因,可应用于利用基因工程方法提高酵母、植物或藻类油脂含量。
本发明提供了CectGPDH2蛋白或其编码基因或含有该编码基因的生物材料在生产食用油或生物柴油中的应用。
本发明提供了CectGPDH2蛋白或其编码基因或含有该编码基因的生物材料在植物种质资源改良中的应用。
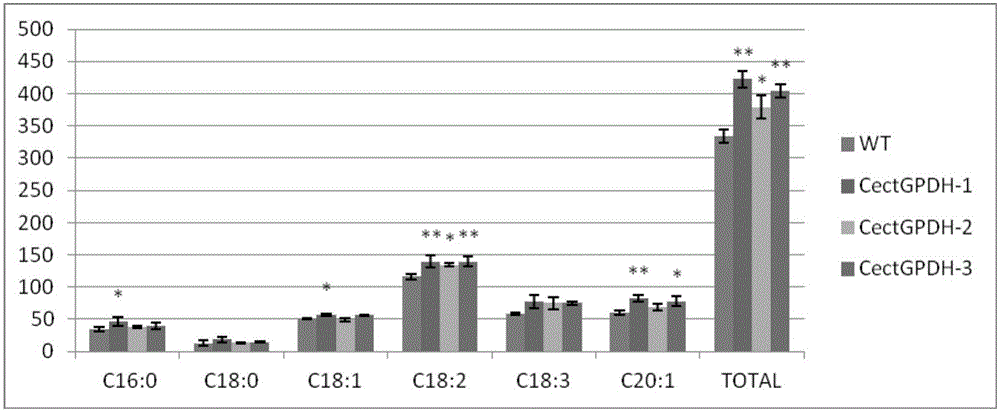
本发明发现将来源于椭圆小球藻的CectGPDH2基因转入模式植物拟南芥后,可显著提高种子中主要脂肪酸组分的含量。转基因拟南芥的3个株系种子的六种主要脂肪酸组分中,棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)和亚麻酸(C18:3)含量变化不显著,亚油酸(C18:2)含量分别提高了约20.26%、15.52%和20.26%,二十烯酸(C20:1)含量分别提高了约35.35%、13.48%和27.62%。转基因拟南芥种子的总脂肪酸含量也分别提高了约26.31%、13.47%和20.69%。在拟南芥种子中研究表明,转CectGPDH2基因株系种子与对照组(野生型拟南芥种子)相比,总脂肪酸含量分别显著提高了约26.31%、13.47%和20.69%,且其部分主要脂肪酸组分的含量也有明显提高,其中棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)和亚麻酸(C18:3)含量变化不显著,亚油酸(C18:2)分别显著提高了约20.26%、15.52%和20.26%,二十烯酸(C20:1)提高了约35.35%、13.48%和27.62%。单个基因使得总脂肪酸及各不同脂肪酸的含量达到这种程度的实属少见。
本发明还发现将来源于椭圆小球藻的CectGPDH2基因转入油料作物油菜后,可显著提高种子中主要脂肪酸组分的含量。总脂肪酸含量最高提高了22.3%。其中亚油酸(C18:2)含量平均分别提高了约23.51%、二十烯酸(C20:1)含量平均分别提高了约37.15%。因此该基因对改良油料作物有较好的应用前景。
附图说明
图1为含椭圆小球藻CectGPDH2基因的植物表达载体的构建图。
图2为GC-MS法测定的转基因拟南芥种子中各脂肪酸组分含量以及总脂肪酸含量比较图,WT为对照,CectGPDH-1、CectGPDH-2和CectGPDH-3为转CectGPDH基因的拟南芥种子脂肪酸测定。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验手册(Sambrook J&Russell DW,Molecular Cloning:a Laboratory Manual,2001),或按照制造厂商说明书建议的条件。以下实施例中的定量实验,均设置三次重复实验,结果取平均值。
实施例1椭圆小球藻CectGPDH基因cDNA全长的获得
取培养3-4天的对数生长期椭圆小球藻(来自于中国科学院水生生物研究所)藻液,离心收集藻体后置于液氮中充分研磨。参照艾德莱EASYspin RNA提取试剂盒说明书及Takara DNase I说明书进行总RNA提取和纯化。以带polyT的引物进行逆转录获得cDNA,并进行RT-PCR(具体操作见TOYOBO ReverTra Ace-α试剂盒)。
cDNA的合成反应条件如下:
用RNase Free H2O补至总体积为20μL。轻弹混匀并瞬时离心后按如下程序进行逆转录反应:30℃10min,42℃30min,99℃5min,4℃5min。
取适量上述逆转录产物以ATGCGCTGGTCCAAGGTG和TCACCTCTCTTCTATTTGAGG为一对引物进行PCR扩增。
PCR反应条件如下:95℃5min;94℃30s,53℃30s,72℃3min,30-35个循环;72℃10min,4℃保存。
PCR产物电泳(1%琼脂糖凝胶浓度)后切胶回收目的片段(CectGPDH2,约1kb),连入pCAMBIA2301载体(购自CAMBIA公司),测序验证获得了CectGPDH2的全长cDNA(SEQ ID NO.1)。其编码蛋白的氨基酸序列如SEQ ID NO.2所示。
实施例2含有CectGPDH2基因的植物表达载体的构建
选用CAMBIA公司植物表达载体pCAMBIA2301作为CeGPDH基因的植物表达载体。由于pCAMBIA2301载体多克隆位点区附近没有启动方向合适的启动子和终止子,因此选用带有启动子和终止子的载体pT305R作为中间载体(采用pUC18载体作为骨架,实验室自建,氨苄霉素抗性),将CeGPDH2基因连接到pT305R上的启动子-终止子间的多克隆位点区,再选择启动子上游及终止子下游酶切位点切下完整的带有启动子-CectGPDH-终止子的序列,将该序列插入到pCAMBIA2301载体多克隆位点区,构建完成CeGPDH-2301植物表达载体,其载体图见图1。
实施例3植物表达载体CeGPDH-2301转化农杆菌
将50μL新鲜农杆菌感受态细胞置于冰上,加1μg实施例2制得的质粒DNA即CeGPDH-2301植物表达载体,混匀后冰上放置30min。液氮中速冻1min后迅速转入37℃水浴中放置5min。加入1mL无抗生素的YEP液体培养基,28℃,230rpm培养2-4h。3,000rpm离心2min收集菌体,留100μL液体重悬菌体,涂布于YEP固体培养基(含有kan 50μL/100mL,rif 30μL/100mL)上,28℃培养24-48h。
24-48h后,从培养基平板上挑取菌落,进行菌落PCR验证。最后对验证为阳性的菌落进行保存。
实施例4CectGPDH2在拟南芥中的表达
通过农杆菌介导利用抽真空法把CectGPDH2基因转入拟南芥。侵染前一天浇透水,除去盛开的花和已长成的角果。将实施例3的转CectGPDH2农杆菌菌株甘油管按1%接种于5mL YEP培养基中(含有kan 50μL/100mL,rif 30μL/100mL),置于28℃,200rpm振荡过夜。取过夜培养菌液按照1:50的比例接种到100mL YEP抗性液体培养基中,置于28℃,200rpm震荡培养至OD600=1-2。5,000rpm离心5min收集菌体,将菌体重悬于250mL侵染缓冲液中(0.015%Silwet L-77,5%蔗糖,10mMMgCl2)。将拟南芥倒置于装有菌液的玻璃瓶后置于真空罐中,调节真空泵压力为200Mbar抽真空10min。
T0代侵染后拟南芥种子置于4℃浸泡2日打破休眠,在20%消毒水中浸泡30min后用无菌水漂洗3遍,播种于含抗生素(Kan50μg/L,Carb 300μg/L)的S0(1/2MS)培养基上。22℃长日照培养两周左右可见幼苗,此时抗性植株呈深绿色,子叶完整;而未转化的植株呈黄色或灰白色,子叶皱缩。选择抗性植株移栽至添加蛭石的营养土中,直至收获单株T1代种子。PCR鉴定及GUS染色筛选出阳性植株,重复筛选过程直至获得T5代阳性纯和种子,用于后续的脂肪酸提取与检测。
实施例5拟南芥种子脂肪酸的提取与检测
1.实施例4制得的拟南芥种子脂肪酸的提取
称取30mg干燥的拟南芥种子充分研磨,加入3mL 7.5%KOH-CH3OH,加15-20μL的d17:0(购自sigma公司,浓度27mg/mL),70℃水浴3-5h;加入2mL HCl酸化至其pH值达2.0;加入2mL 14%BF3-CH3OH(购自Aldtich公司)溶液,70℃水浴1.5h;加入1mL0.9%NaCl溶液,4mL正己烷抽提一次,N2吹干;300μL乙酸乙酯溶解。该实验每次每个样品平行做两份,共重复三次。
2.终产物GC-MS检测分析实验
所用GC/MS仪为TurboMass(PerkinElmer公司);GC条件:色谱柱:BPX-70,30m×0.25mm×0.25um。柱温:120℃,气化室温度230℃。取1μL终产物上样,分流比10:1。
3.GC-MS结果分析
研究表明,转CectGPDH2基因拟南芥株系与对照组(野生型拟南芥)相比,其种子的总脂肪酸含量显著提高了约26.31%、13.47%和20.69%,且部分主要脂肪酸组分的含量也有明显提高,其中棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)和亚麻酸(C18:3)含量变化不显著,亚油酸(C18:2)提高了约20.26%、15.52%和20.26%,二十烯酸(C20:1)提高了约35.35%、13.48%和27.62%。GC-MS测定的拟南芥种子中各脂肪酸组分及含量测定结果见图2。
实施例6Floral-dip法转化油菜(westar)
选择初花期的甘蓝型油菜植株处理,前l d田间浇透水。去除主花序和每个分枝花序的顶端花蕾,同时除去已开放的花朵,只保留快要开放的花蕾用于转化。
用10ml新鲜的YEP+kan的培养基28℃过夜培养含有目标基因CeGPDH2的实施例3制得的CeGPDH-2301植物表达载体的农杆菌至次日10:00,再取5ml转入100ml新鲜的YEP+kan的培养基,过夜培养22h。2 500rpm离心农杆菌菌液,弃上清后,用100ml转化Bufer(MS基本培养基+蔗糖5%+Silwet-77,pH5.8)重悬至OD600=1.0后浸渍油菜花序。10d内间隔l d连续处理5次。浸渍完后套上纸袋。浸渍处理24h后除去纸袋直至收获种子。
实施例7转基因油菜的筛选
对浸渍处理后获得的实施例6的油菜T1代种子经75%酒精表面消毒30s,0.1%HgCl2消毒10min,铺在预先倒好的筛选培养基上,经7~15d筛选培养,将正常生长的绿色苗进行第2次抗性筛选(7~15d),将第2次筛选后的抗性植株进行第3次抗性筛选(7~15d),第2次,第3次筛选培养基为:Ms+Kan(150mg/L)。将第三次筛选后的绿苗转入花盆,温室培养至种子收获。将收获的种子进行下一代筛选,共选到第3代的转基因油菜种子进行脂肪酸成分和含量的测定。
实施例8油菜种子脂肪酸的提取与检测
1.转基因油菜种子脂肪酸的提取:提取方法同实施例5。
2.终产物GC-MS检测分析实验:检测方法同实施例5。
3.GC-MS结果分析
研究表明,转CectGPDH2基因油菜株系T01,T02和T03与对照组(野生型westar)相比,其种子的总脂肪酸含量显著提高了约20.4%-28.32%,且部分主要脂肪酸组分的含量也有明显提高,其中亚油酸(C18:2)提高了约19.01%-29.74%,二十烯酸(C20:1)提高了约32.35%-37.18%。其它脂肪酸组分未观察到显著变化。因此CectGPDH2基因对改良油料作物,提高作物产油量效果显著,具有较好的应用前景。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!