N‑卤代芳基取代的胺类化合物及其制备方法和应用与流程
本发明属于药物合成技术领域,具体地说,涉及一种N-卤代芳基取代的胺类化合物及其制备方法和应用。
背景技术:
细菌等病原微生物广泛存在于人类生活的自然界。在空气、土壤与水体中,在人类和动植物的体表及其与外界相通的腔道中,在各种物体表面,均无例外地有细菌等病原微生物存在。就人类自身而言,一位健康成人体表与外界相通的腔道定植的细菌总数,是人体组织细胞总数的10倍,其数量之多与种类之杂,对人类健康之重要,尽管至今并未为人类真正充分了解,不过有一点已经清楚,即它们所形成的正常微生物群,总体上讲对人体健康是有益而无害的,随着抗生素在临床的广泛应用,当不合理应用抗菌药物之后,对人体正常菌群来说,其中敏感菌群受到抑制或杀灭,而未能被抑杀的不敏感菌群,或具有耐药性的菌群却能乘机大量繁殖细菌很快对抗生素产生了耐药性,而且,随着抗生素的不断更新换代,细菌的耐药性不断增强,有结果分析表明(参考文献廖晓辉.抗菌药物临床应用中的问题与对策[J].中华医院管理杂志.2005,21;122-125.),在青霉素应用于临床后的2年~3年内,75%的金葡菌随之产生了耐药性,目前对青霉素敏感的金葡菌不到10%;而红霉素仅仅在临床使用5个月后,即有70%的金葡菌对其产生耐药,耐药性产生速度之快令人难以想象。近年来临床研究表明,细菌耐药现象对人类的身心健康构成了极大的威胁。
抗菌药物是指具有杀菌或抑菌活性的,一类主要用于治疗细菌性与真菌性感染的药物。抗菌药物既有天然的,也有人工半合成与合成的。各种抗菌药物的抗菌谱不一,有的窄,例如异烟肼只对各型结核分枝杆菌有高度选择性抗菌作用;再如万古霉素只对革兰阳性球菌与杆菌具有抗菌作用;有的稍宽,例如青霉素对革兰阳性菌、革兰阴性球菌、嗜血杆菌属细菌、致病螺旋体和放线菌等有抗菌作用;有的抗菌谱更广。例如碳青霉烯类抗生素对98%的病原菌具有杀菌作用。医学知识告诉我们,引起人类任何一种细菌性感染大多为一种细菌,少数可为两种细菌,三种或多种细菌同时引起某种感染的机会极少。从理论上讲,我们只需针对一两种致病菌治疗细菌性感染即够,没有必要去抑杀并未证实与当前感染无关的定植菌(它们大多是人体的正常微生物群)。可惜,目前可供临床应用的“理想化”的窄谱抗菌药物偏少,而广谱抗菌药物却较多。假如经常使用广谱抗菌药物,不可避免地将抑杀许多与当前感染无关的正常微生物群。所以,希望在抗感染治疗过程中,尽量选用针对性较强而抗菌谱相对较窄的抗菌药物,既能治愈感染性疾病,又能尽量维护人体正常微生物群。鉴于细菌的耐药性不断增强,且耐药机制日趋复杂,在用药剂量和疗程上遵循“最小有效剂量、最短必须疗程”的原则;按照价廉、有效原则选择使用抗生素;首选有效、窄谱的抗生素,减少广谱抗生素的使用,合理采用联合用药。针对日益严峻的细菌耐药性和耐药菌感染,医学界已经采取多种措施进行积极应对,研发可供临床应用的“理想化”的窄谱抗菌药物受到广泛关注,也是重中之重。
技术实现要素:
有鉴于此,本发明针对上述的问题,提供了一种N-卤代芳基取代的胺类化合物及其合成方法和抗菌应用。
为了解决上述技术问题,本发明公开了一种N-卤代芳基取代的胺类化合物,该化合物的结构如式(I)所示:
其中,X为氟原子或者氯原子;Y为氟原子或者氯原子;R'为氢原子、甲基、乙基;R为对氟苯基、邻氟苯基、2,4-二氟苯基、2,6-二氟苯基、3,4-二氟苯基、3,4,5-三氟苯基、苯基、呋喃基、2-甲基呋喃基、四氢呋喃基、噻吩基、四氢吡喃基、3,4-亚甲二氧基苯基、萘基;n为0、1或2;当R'为H、且n为0时,R不为苯基。本发明还公开了一种N-卤代芳基取代的胺类化合物的制备方法,按照如下反应式,将如式(II)所示的多卤代间苯二甲腈化合物与如式(III)所示的胺类化合物进行亲核取代反应,制得如式(I)所示的N-卤代芳基取代的胺类化合物;
反应式为:
其中,式(II)中,X为氟原子或者氯原子;Y为氟原子或者氯原子;
式(III)中,R'为氢原子、甲基、乙基;R为对氟苯基、邻氟苯基、2,4-二氟苯基、2,6-二氟苯基、3,4-二氟苯基、3,4,5-三氟苯基、苯基、呋喃基、2-甲基呋喃基、四氢呋喃基、噻吩基、四氢吡喃基、3,4-亚甲二氧基苯基、萘基;n为0、1或2;当R'为H、且n为0时,R不为苯基。
进一步,优选的是,包括如下步骤:
步骤(1),将如式(II)所示的多卤代间苯二甲腈化合物于非质子溶剂中溶解后,将如式(III)所示的胺类化合物加入其中,于0℃~40℃下进行反应并采用TLC跟踪反应,反应完全之后,立即加入冰水淬灭,得到反应液;多卤代间苯二甲腈化合物与胺类化合物的摩尔比为1:1~1:1.2;非质子溶剂的体积与多卤代间苯二甲腈化合物的摩尔比为10~15mL/1mmol。
步骤(2),用乙酸乙酯对反应液进行萃取,取有机层,然后用无水Na2SO4进行干燥,将经过干燥的液体浓缩蒸干,之后对浓缩蒸干物进行柱层析分离,即得到如式(I)所示的N-卤代芳基取代的胺类化合物。
进一步,优选的是,所述非质子溶剂为N,N-二甲基甲酰胺、1,4-二氧六环、乙腈、四氢呋喃或丙酮。
进一步,优选的是,反应时间为10~60分钟。
进一步,优选的是,所述的柱层析的采用的流动相为石油醚和乙酸乙酯,体积比为20:1~10:1,产物Rf值为0.2~0.5。
进一步,优选的是,所述的冰水用量体积与非质子溶剂用量体积相同;所述的乙酸乙酯萃取时,萃取次数为3次,但不限于3次,每次萃取乙酸乙酯用量体积与非质子溶剂用量体积相同。
本发明还公开了上述N-卤代芳基取代的胺类化合物及其药学上可接受的盐与溶剂化物作为制备抗细菌药物或抗真菌药物的应用。
进一步,优选的是,所述的细菌为蜡样芽孢杆菌或金黄葡萄球菌;真菌为白色念珠菌。
本发明还公开了上述N-卤代芳基取代的胺类化合物及其药学上可接受的盐与溶剂化物作为制备抗菌剂的应用。
与现有技术相比,本发明可以获得包括以下技术效果:
本发明利用简单易得的原料式(II)所示的多卤代间苯二甲腈化合物与式(III)所示的胺类化合物出发,通过一步反应得到具有抗菌活性的目标化合物(I)。该发明的合成工艺简单,产率高,产物稳定。该发明实现了简洁、高效平行合成N-卤代芳基取代的胺类化合物库,而且真正实现了分子多样性。为杀灭、治疗和预防细菌、真菌感染提供一类共72种新的抗细菌、真菌的潜在化合物;其中部分化合物对革兰氏阳性菌蜡样芽孢杆菌与金黄葡萄球菌的最低抑菌浓度与最小杀菌浓度均优于参考对照诺氟沙星,部分化合物对真菌白色念珠菌的最低抑菌浓度与最小杀菌浓度优于参考对照氟康唑。
附图说明
图1为化合物1的高分辨质谱;
图2为化合物2的高分辨质谱。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过购买获得的常规产品。
合成本发明的N-卤代芳基取代的胺类化合物方法如下:
用式(II)结构的多卤代间苯二甲腈化合物与式(III)结构的胺类化合物在适当溶剂中。TLC检测反应完全后,反应完全之后,立即加入冰水淬灭;用乙酸乙酯进行萃取,取有机层,萃取液用无水Na2SO4进行干燥,半小时之后进行抽滤,将滤液浓缩蒸干,进行柱层析分离得到纯净的式(I)目标产物,具体反应式如下:
在式(I)中,X为氟原子或者氯原子;Y为氟原子或者氯原子;R'为氢原子、甲基、乙基;R为对氟苯基、邻氟苯基、2,4-二氟苯基、2,6-二氟苯基、3,4-二氟苯基、3,4,5-三氟苯基、苯基、呋喃基、2-甲基呋喃基、四氢呋喃基、噻吩基、四氢吡喃基、3,4-亚甲二氧基苯基、萘基;n为0、1或2;当R'为H、且n为0时,R不为苯基。。
在式(II)中,X为氟原子或者氯原子;Y为氟原子或者氯原子;
在式(III)中,R'为氢原子、甲基、乙基;R为对氟苯基、邻氟苯基、2,4-二氟苯基、2,6-二氟苯基、3,4-二氟苯基、3,4,5-三氟苯基、苯基、呋喃基、2-甲基呋喃基、四氢呋喃基、噻吩基、四氢吡喃基、3,4-亚甲二氧基苯基、萘基;n为0、1或2;当R'为H、且n为0时,R不为苯基。
反应中,溶剂可选用N,N-二甲基甲酰胺、1,4-二氧六环、乙腈、四氢呋喃、丙酮中的一种,溶剂的体积与多卤代间苯二甲腈化合物的摩尔比为10~15mL/1mmol,通常优选1,4-二氧六环;反应温度为0℃~40℃,通常优选室温;反应时间不作具体规定,常为10~60分钟。反应过程采用TLC检测跟踪,反应完全后用等溶剂体积冰水淬灭反应得到反应液,用乙酸乙酯对反应液进行萃取,通常用等溶剂体积,萃取三次。柱色谱分离用溶剂不作具体规定,常采用的流动相为石油醚和乙酸乙酯,体积比为20:1~10:1,产物Rf值为0.2~0.5。
反应中,式(II)化合物与式(III)化合物的摩尔比为1:1~1:1.2。反应的收率一般在70~94%。
式(II)的化合物是公知的,可按照公知的方法制备,也可商购。
式(III)的化合物是公知的,或者可按照公知的方法制备,也可商购。
本发明从易得原料多卤代间苯二甲腈(II)和胺类化合物(III)出发,通过一锅法合成一系列结构新颖的N-卤代芳基取代的胺类化合物(I)。
MIC值的测定采用微量稀释法(参考文献:Bioorganic&Medicinal Chemistry Letters,2013,23,5958–5963;Bioorganic&Medicinal Chemistry Letters,2013,23,2399–2403):
第一步:将已灭菌的液体培养基加入到无菌96孔聚苯乙烯板中,在板上的第1列的每个小孔中加入180μL培养基,剩余所有小孔每孔加入100μL。将准备好的药液取20μL分别加入第一列小孔中,每一个小孔中只能加入一种抗菌药,一个板上可以加7个样品,剩余一个加对照药诺氟沙星或者氟康唑。与常量稀释法操作基本相似,用移液枪将第1个小孔中的液体混合均匀,吸出100μL加入到第二个小孔中,同样操作,混合均匀之后吸取100μL至第3个小孔中,依次进行到底11个小孔中,将液体混合均匀,吸取100μL弃去,第12个小孔作为生长对照。此时第1-11孔中的药物浓度分别是1000.000、500.000、250.000、125.000、62.500、31.250、15.625、7.813、3.906、1.953、0.976μg/mL;为满足更低药物浓度下的MIC值测定时,同样的将已灭菌的液体培养基加入到无菌96孔聚苯乙烯板中,在板上的第1列的每个小孔中加入198μL培养基,剩余所有小孔每孔加入100μL。将准备好的药液取2μL分别加入第一列小孔中,每一个小孔中只能加入一种抗菌药,一个板上可以加7个样品,剩余一个加对照药诺氟沙星或者氟康唑。与常量稀释法操作基本相似,用移液枪将第1个小孔中的液体混合均匀,吸出100μL加入到第二个小孔中,同样操作,混合均匀之后吸取100μL至第3个小孔中,依次进行到底11个小孔中,将液体混合均匀,吸取100μL弃去,第12个小孔作为生长对照。此时第1-11孔中的药物浓度分别是100.000、50.000、25.000、12.500、6.250、3.125、1.563、0.781、0.391、0.195、0.098μg/mL
第二步:取本发明化合物的菌悬液15uL用培养基稀释1000倍,混合均匀,向96孔板中每孔加入100uL液体培养基。此时第1-11孔中样品浓度分别为500.000、250.000、125.000、62.5.000、31.250、15.625、7.813、3.906、1.953、0.977、0.488μg/mL。更低药物浓度下的MIC值测定时,第1-11孔中样品浓度分别为50.000、25.000、12.500、6.250、3.125、1.563、0.781、0.391、0.196、0.098、0.049μg/mL。盖上盖子放置恒温箱内培养,细菌需培养24-48h,真菌培养48-72h,之后观察结果并记录。
第三步:在小孔内样品能够完全抑制细菌生长的最低浓度为该样品的MIC值。若出现跳孔现象,此时以抑制细菌生长的最高样品浓度为准,并记录结果。每块96孔板只能接种一种菌,不能接种多种菌。一般需重复试验三次,在无较大误差情况下,取三组实验的平均值即为MIC值。
MBC值的测定(参考文献:郭菲,侯淼.药敏纸片扩散法与仪器法在阴道加德纳菌鉴定中的比较[J].
检验医学与临床,2015,12,2600-2602.):在最小抑菌浓度测量的基础上,选取活性较好的化合物进行下一步的MBC值测定。选取化合物进行第二步MIC值的操作步骤,经过培养之后,将无菌生长的小孔内的混合液用移液枪头吸出涂布于培养基上,置于恒温箱中培养一段时间观察结果,培养基上无任何细菌生长的对应最低抗菌药物浓度即为该药物的MBC值。
所得数据证实,本发明的化合物对金黄色葡萄球菌、蜡样芽孢杆菌、白色念珠菌有明显的活性。
本发明化合物的日给药剂量为0.001mg-1mg/kg。优选的日给药剂量为约0.02mg至0.2mg/kg体重,对于体重约70kg的患者来说,采用在24小时内单次剂量给药约1.4mg至约14mg的活性物质。该剂量范围可进行调整以获得更好的治疗效果。本发明的活性化合物可通过外涂、口服、静脉内给药、肌内给药、皮下给药等方式给药。
本发明的化合物可与其它用于治疗细菌感染的试剂组合给药,以协同增加所述化合物的抗菌效果。可用于本发明的化合物组合使用的化合物的实例为:阿莫西林、氨苄西林、诺氟沙星、氧氟沙星、左氧氟沙星、红霉素、头孢、磺胺嘧啶、头孢克肟、氟康唑、酮康唑等。
本发明的药物组合物包含治疗有效量的至少一种发明的化合物与可药用的混合物。
外用包括滴剂、膏剂等含有本发明的化合物。
口服组合物包含适用于口服给药的胶囊、片剂、丸剂、悬浮液或糖浆。
为制备用于肠胃外给药的药物组合物,可将活性成分掺入溶液或悬浮液中,其还包括以下的组合:无菌稀释剂如注射用水、盐水溶液、油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂如苄基醇;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂如乙二胺四乙酸;缓和剂如乙酸盐、柠檬酸盐或磷酸盐,用于调节溶液张力的试剂如氯化钠或葡萄糖。肠胃外制剂可包含于安瓿、一次性注射器或玻璃或塑料小药瓶中。
下面结合部分具体实施方案对本发明进行详述。
实施例1
2,4,5-三氟-6-((1-苯基)氨基)间苯二腈(化合物1)的合成:在室温下将原料2,4,5,6-四氟间苯二甲腈加入25mL的圆底烧瓶中,加入1,4-二氧六环溶解搅拌,1,4-二氧六环体积与2,4,5,6-四氟间苯二甲腈摩尔比为15mL/1mmol,将原料α-甲基苯乙胺缓慢滴加,α-甲基苯乙胺与2,4,5,6-四氟间苯二甲腈的摩尔比为1:1~1.2:1。随时进行TLC检测反应,反应完全之后,立即加入与1,4-二氧六环相同体积的冰水进行淬灭,用与1,4-二氧六环相同体积的乙酸乙酯萃取三次,取有机层,萃取液用无水Na2SO4进行干燥之后进行抽滤,将滤液浓缩蒸干,采用的流动相为石油醚和乙酸乙酯为20:1比例,进行柱层析分离,干燥得白色固体产品,2,4,5-三氟-6-((1-苯基)氨基)间苯二腈(化合物1),产率92%。
高分辨质谱C16H10F3N3[M-H]-,理论值300.0754实测值,300.0758。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=1.66(d,J=6.6Hz,3H,CH3),5.38-7.37(m,5H,ArH),7.39(br,1H,NH)。
实施例2
5-氯-2,4-二氟-6-((1-苯基)氨基)间苯二腈(化合物2)的合成:在20℃下将原料5-氯-2,4,6-三氟间苯二甲腈加入25mL的圆底烧瓶中,加入1,4-二氧六环溶解搅拌(即以1,4-二氧六环为溶剂),1,4-二氧六环体积与5-氯-2,4,6-三氟间苯二甲腈摩尔比为10mL/1mmol,将原料α-甲基苯乙胺缓慢滴加,α-甲基苯乙胺与5-氯-2,4,6-三氟间苯二甲腈的摩尔比为1:1。随时进行TLC检测反应,20min反应完全,立即加入等溶剂体积冰水淬灭,用等溶剂体积的乙酸乙酯萃取三次,取有机层,萃取液用无水Na2SO4进行干燥之后进行抽滤,将滤液浓缩蒸干,采用的流动相为石油醚和乙酸乙酯为20:1比例,进行柱层析分离,产物Rf值为0.2,干燥得白色固体产品5-氯-2,4-二氟-6-((1-苯基)氨基)间苯二腈(化合物2),产率90%。
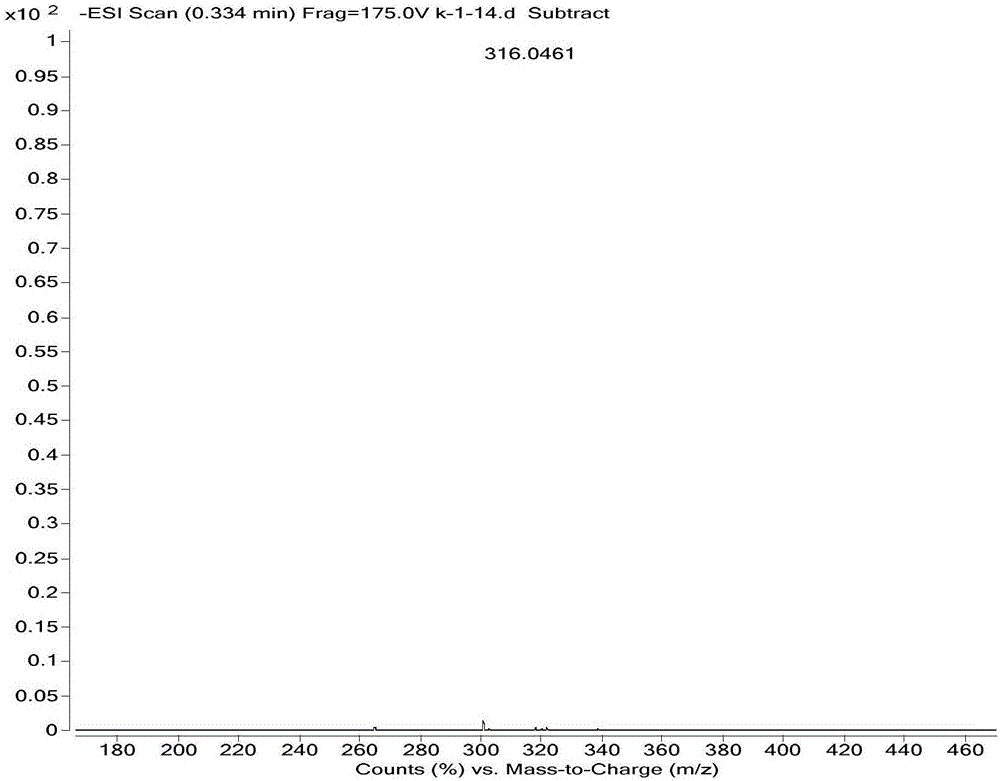
高分辨质谱C16H10ClF2N3[M-H]-,理论值316.0459;实测值,316.0461。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=1.69(d,J=6.6Hz,3H,CH3),5.70-7.38(m,5H,ArH),7.39(br,1H,NH)。
实施例3
5-氯-2,4-二氟-6-((1-(4-氟苯基)乙基)氨基)间苯二腈(化合物3)的合成:在0℃下将原料5-氯-2,4,6-三氟间苯二甲腈加入25mL的圆底烧瓶中,加入N,N-二甲基甲酰胺溶解搅拌(即以N,N-二甲基甲酰胺为溶剂),N,N-二甲基甲酰胺体积与5-氯-2,4,6-三氟间苯二甲腈摩尔比为12mL/1mmol,将原料1-(4-氟苯基)乙胺缓慢滴加,1-(4-氟苯基)乙胺与5-氯-2,4,6-三氟间苯二甲腈的摩尔比为1.2:1。随时进行TLC检测反应,60min反应完全,立即加入等溶剂体积冰水淬灭,用等溶剂体积乙酸乙酯萃取三次,取有机层,萃取液用无水Na2SO4进行干燥之后进行抽滤,将滤液浓缩蒸干,采用的流动相为石油醚和乙酸乙酯为10:1比例,进行柱层析分离,产物Rf值为0.5,干燥得白色固体产品,5-氯-2,4-二氟-6-((1-(4-氟苯基)乙基)氨基)间苯二腈(化合物3),产率88%。
高分辨质谱C16H9ClF3N3[M-H]-,理论值334.0364;实测值,334.0363。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=1.59(d,J=6.7Hz,3H,CH3),5.60(m,1H,CH),6.91-7.21(m,4H,ArH),5.91(br,1H,NH)。
实施例4
4-((2,4-二氟苄基)氨基)-2,5,6-三氟间苯二腈(化合物4)的合成:在40℃下将原料2,4,5,6-四氟间苯二甲腈加入25mL的圆底烧瓶中,加入乙腈溶解搅拌(即以乙腈为溶剂),乙腈体积与2,4,5,6-四氟间苯二甲腈摩尔比为15mL/1mmol,将原料(2,4-二氟苯基)甲胺缓慢滴加,(2,4-二氟苯基)甲胺与2,4,5,6-四氟间苯二甲腈的摩尔比为1.1:1。随时进行TLC检测反应,10min反应完全,立即加入等溶剂体积冰水淬灭,用等溶剂体积乙酸乙酯萃取三次,取有机层,萃取液用无水Na2SO4进行干燥之后进行抽滤,将滤液浓缩蒸干,采用的流动相为石油醚和乙酸乙酯为15:1比例,进行柱层析分离,产物Rf值为0.3,干燥得白色固体产品,4-((2,4-二氟苄基)氨基)-2,5,6-三氟间苯二腈(化合物4),产率87%。
高分辨质谱C15H6F5N3[M-H],理论值;322.0409,实测值,322.0407。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=4.89(d,J=6.06Hz,2H,CH2),5.57(br,1H,NH),6.87-7.31(m,3H,ArH)。
实施例5
5-氯-2,4-氟-6-((噻吩-3-甲基)氨基)间苯二腈(化合物5)的合成:在30℃下将原料5-氯-2,4,6-三氟间苯二甲腈加入25mL的圆底烧瓶中,加入四氢呋喃溶解搅拌(即以四氢呋喃为溶剂),四氢呋喃体积与5-氯-2,4,6-三氟间苯二甲腈摩尔比为15mL/1mmol,将原料噻吩-3-甲胺缓慢滴加。(2,4-二氟苯基)甲胺与2,4,5,6-四氟间苯二甲腈的摩尔比为1.2:1。随时进行TLC检测反应,30min反应完全,立即加入等溶剂体积冰水淬灭,用等溶剂体积乙酸乙酯萃取三次,取有机层,萃取液用无水Na2SO4进行干燥之后进行抽滤,将滤液浓缩蒸干,采用的流动相为石油醚和乙酸乙酯为15:1比例,进行柱层析分离,产物Rf值为0.3,干燥得黄色固体产品5-氯-2,4-氟-6-((噻吩-3-甲基)氨基)间苯二腈(化合物5),产率85%。
高分辨质谱C13H16ClF2N3S[M-H]-,理论值307.9866;实测值,307.9866。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=5.03-5.08(m,2H,CH2),7.11-7.33(m,3H,CH),5.57(br,1H,NH)。
实施例6
2,4,5-三氟-6-((呋喃-3-甲基)氨基)间苯二腈(化合物6)的合成:在10℃下将原料5-氯-2,4,6-三氟间苯二甲腈加入25mL的圆底烧瓶中,加入丙酮溶解搅拌(即以丙酮为溶剂),丙酮体积与5-氯-2,4,6-三氟间苯二甲腈摩尔比为15mL/1mmol,将原料呋喃-3-甲胺缓慢滴加。呋喃-3-甲胺与5-氯-2,4,6-三氟间苯二甲腈的摩尔比为1.2:1。随时进行TLC检测反应,40min反应完全,立即加入等溶剂体积冰水淬灭,用等溶剂体积乙酸乙酯萃取三次,取有机层,萃取液用无水Na2SO4进行干燥之后进行抽滤,将滤液浓缩蒸干,采用的流动相为石油醚和乙酸乙酯为15:1比例,进行柱层析分离,产物Rf值为0.3,得到白色固体2,4,5-三氟-6-((呋喃-3-甲基)氨基)间苯二腈(化合物6),产率89%。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=4.93-4.96(m,CH2),6.29-7.39(m,2H,CH2),7.32-7.35(m,1H,CH),5.95(br,1H,NH)。
实施例7
2,4,5–三氟-6-((1-(4-氟苯基)乙基)氨基)间苯二腈(化合物7)的合成:用1-(4-氟苯基)乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5–三氟-6-((1-(4-氟苯基)乙基)氨基)间苯二腈(化合物7),产率79%。
高分辨质谱C16H9F4N3[M-H]-,理论值318.0660;实测值,318.0662。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=1.57(d,J=6.72Hz,3H,CH3),5.30-5.34(m,1H,CH),6.95-6.97(m,2H,ArH),7.18-7.22(m,2H,ArH),5.43(br,1H,NH)。
实施例8
(S)-(-2,4,5-三氟-6(2-苯丙基)氨基)间苯二腈(化合物8)的合成:用(S)-2-苯丙基-1-胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体(S)-(-2,4,5-三氟-6(2-苯丙基)氨基)间苯二腈(化合物8),产率87%。
高分辨质谱C17H12F3N3[M-H]-,理论值314.0911;实测值,374.0515。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=1.26(d,J=6.96Hz,3H,CH3),3.15(m,1H,CH),3.71-3.76(m,2H,CH2),7.20-7.32(m,5H,ArH),8.15(br,1H,NH)。
实施例9
2,4,5-三氯-6-((3–(三氟甲基)苄基)氨基)间苯二腈(化合物9)的合成:(3–(三氟甲基)苯基)甲胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5-三氯-6-((3–(三氟甲基)苄基)氨基)间苯二腈(化合物9),产率74%。
实施例10
5-氯-4-((3,5-二氟苄基)氨基)-2,6-二氟间苯二腈(化合物10)的合成:用(2,4-二氟苯基)甲胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-4-((3,5-二氟苄基)氨基)-2,6-二氟间苯二腈(化合物10),产率88%。
高分辨质谱C15H6F3ClF4N3[M-H]-,理论值338.0114;实测值,338.0112。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=5.05(d,J=5.94,3H,CH2),5.47–5.53(m,1H,CH),5.92(br,1H,NH),6.89-6.96(m,2H,ArH),7.27-7.42(m,1H,ArH)。
实施例11
5-氯-2,4-二氟-6-((4-氟苄基)氨基)间苯二腈(化合物11)的合成:用4-氟苄胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体进行反应可得到白色固体5-氯-2,4-二氟-6-((4-氟苄基)氨基)间苯二腈(化合物11),产率87%。熔点:85.7-86.0℃。
高分辨质谱C15H7ClF3N3[M-H]-,理论值320.0207;实测值,320.0208。
实施例12
2,4,5-三氟-6-((2-氟苄基)氨基)间苯二腈(化合物12)的合成:用2-氟苄胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((2-氟苄基)氨基)间苯二腈(化合物12),产率92%。熔点:97.6-98.0℃。
高分辨质谱C15H7F4N3[M-H]-,理论值304.0503;实测值,304.0505。
实施例13
5-氯-2,4-二氟-6-((2-氟苄基)氨基)间苯二腈(化合物13)的合成:用2-氟苄胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-2,4-二氟-6-((2-氟苄基)氨基)间苯二腈(化合物13),产率89%。熔点:90.1-90.8℃。
高分辨质谱C15H7ClF3N3[M-H]-,理论值320.0207;实测值,320.0207。
实施例14
(S)-2,4,5-三氟-6-((1-苯基乙基)氨基)间苯二腈(化合物14)的合成:用(S)-1-苯基乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体(S)-2,4,5-三氟-6-((1-苯基乙基)氨基)间苯二腈(化合物14),产率90%。熔点:107.1-107.9℃。
高分辨质谱C16H10F3N3[M-H]-,理论值300.0754;实测值,300.0752。
实施例15
(S)-5-氯-2,4-二氟-6-((1-苯基乙基)氨基)间苯二腈(化合物15)的合成:用(S)-1-苯基乙胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体(S)-5-氯-2,4-二氟-6-((1-苯基乙基)氨基)间苯二腈(化合物15),产率84%。熔点:94.8-95.4℃。
高分辨质谱C16H10ClF2N3[M-H]-,理论值316.0458;实测值,316.0459。
实施例16
2,4,5-三氟-6-((3–(三氟甲基)苄基)氨基)间苯二腈(化合物16)的合成:(3–(三氟甲基)苯基)甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((1-(3,4,5-三氟苯基)乙基)氨基)间苯二腈(化合物16),产率84%。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=4.93(d,J=5.94Hz,2H,CH2),7.53-7.64(m,4H,ArH),5.72(br,1H,NH)。
实施例17
2,4,5-三氟-6-((噻吩-3-甲基)氨基)间苯二腈(化合物17)的合成:用噻吩-3-甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到黄色固体2,4,5-三氟-6-((噻吩-3-甲基)氨基)间苯二腈(化合物17),产率80%。
高分辨质谱C13H6F3N3S[M-H]-,理论值292.0162;实测值,292.0165。
实施例18
4-((3,4-二氟苄基)氨基)-2,5,6-三氟间苯二腈(化合物18)的合成:用(3,4-二氟苯基)甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体4-((3,4-二氟苄基)氨基)-2,5,6-三氟间苯二腈(化合物18),产率92%。
高分辨质谱C15H6F5N3[M-H]-,理论值322.0409;实测值,322.0407。
实施例19
5-氯-4-((3,4-二氟苄基)氨基)-2,6-二氟间苯二腈(化合物19)的合成:用(3,4-二氟苯基)甲胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体进行反应可得到白色固体5-氯-4-((3,4-二氟苄基)氨基)-2,6-二氟间苯二腈(化合物19),产率89%。
高分辨质谱C15H6Cl3F4N[M-H]-,理论338.0114;实测值,338.0114。
实施例20
2,4,5-三氯-6-(3,4-二氟苄基)氨基)间苯二腈(化合物20)的合成:用(3,4-二氟苯基)甲胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体进行反应可得到白色固体2,4,5-三氯-6-(3,4-二氟苄基)氨基)间苯二腈(化合物20),产率80%。
高分辨质谱C15H6Cl3F2N3[M-H]-,理论值369.9523;实测值,369.9525。
实施例21
2,4,5-三氯-6-(2,4-二氟苄基)氨基)间苯二腈(化合物21)的合成:用(2,4-二氟苯基)甲胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体进行反应可得到白色固体2,4,5-三氯-6-(2,4-二氟苄基)氨基)间苯二腈(化合物21),产率83%。
高分辨质谱C15H6Cl3F2N3[M-H]-,理论值369.9523;实测值,369.9525。
实施例22
5-氯-2,4-二氟-6-((3-(三氟甲基)苄基)氨基)间苯二腈(化合物22)的合成:用(3–(三氟甲基)苯基)甲胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的四氟间苯二腈进行反应可得到白色固体进行反应可得到白色固体5-氯-2,4-二氟-6-((3-(三氟甲基)苄基)氨基)间苯二腈(化合物22),产率87%。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=5.03(d,J=6Hz,2H,CH2),7.26-7.63(m,4H,ArH),5.74(br,1H,NH)。
实施例23
2,4,5-三氯-6-((噻吩-3-甲基)氨基)间苯二腈(化合物23)的合成:用噻吩-3-甲胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到黄色固体5-氯-2,4-氟-6-((噻吩-3-甲基)氨基)间苯二腈(化合物5),产率70%。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=5.20(d,J=5.3Hz,2H,CH2),7.03(d,J=7.9Hz,1H,CH),7.13(d,J=1.4Hz,1H,CH),7.35(d,J=5.0Hz,1H,CH),5.92(br,1H,NH)。
实施例24
5-氯-2,4-二氟-(R)-(+)-1-苯丙胺间苯二甲腈(化合物24)的合成:用(R)-(+)-1-苯丙胺间苯二甲腈代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到黄色固体5-氯-2,4-二氟-(R)-(+)-1-苯丙胺间苯二甲腈(化合物24),产率91%。
高分辨质谱C17H12ClF2N3,[M-H]-,理论值330.0615;实测值,330.0617。
实施例25
5-氯-2,4-二氟-6-(呋喃-3-基甲基)氨基间苯二腈(化合物25)的合成:用呋喃-3-甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((呋喃-3-甲基)氨基)间苯二腈(化合物25),产率89%。
核磁共振氢谱(氘代DMSO,Bruker AM 600仪):δ=4.86(d,J=5.8Hz,2H,CH2),6.37(m,2H,2CH2),5.64(br,1H,NH),7.41(d,J=0.84Hz,H,CH2)。
实施例26
2,4,5-三氯-6-((呋喃-3-甲基)氨基)间苯二腈(化合物26)的合成:用呋喃-3-甲胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5-三氯-6-((呋喃-3-甲基)氨基)间苯二腈(化合物26),产率89%。
核磁共振氢谱(氘代DMSO,Bruker AM 600仪):δ=4.99(d,J=6.2Hz,2H,CH2),6.38(m,2H,2CH2),7.63(br,1H,NH),8.15(d,J=5.8Hz,H,CH2)。
实施例27
(S)-(-5-氯-2,4-二氟-6-(2-丙基)氨基)间苯二腈(化合物27)的合成:用(S)-2-苯丙基-1-胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体(S)-(-2,4,5-三氟-6-(2-苯丙基)氨基)间苯二腈(化合物27),产率83%。
核磁共振氢谱(氘代DMSO,Bruker AM 600仪):δ=1.25(d,J=7.0Hz,3H,CH3),3.89(m,2H,CH2),3.18(br,1H,NH),7.19-7.44(m,5H,ArH)。
实施例28
(S)-(-2,4,5-三氯-6(2-苯丙基)氨基)间苯二腈(化合物28)的合成:用(S)-2-苯丙基-1-胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体(S)-(-2,4,5-三氟-6(2-苯丙基)氨基)间苯二腈(化合物28),产率80%。
高分辨质谱C17H12Cl3N3[M-H]-,理论值362.0024;实测值,362.0029。
实施例29
(R)-(-2,4,5-三氟-6-(2-苯丙基)氨基)间苯二腈(化合物29)的合成:用(R)-2-苯丙基-1-胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体(R)-(-2,4,5-三氟-6(2-苯丙基)氨基)间苯二腈(化合物29),产率86%。
高分辨质谱C17H12F3N3[M-H]-,理论值314.0911;实测值,314.0909。
实施例30
(R)-(-5-氯-2,4-二氟-6-(2-丙基)氨基)间苯二腈(化合物30)的合成:用(R)-2-苯丙基-1-胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体(R)-(-2,4,5-三氟-6-(2-苯丙基)氨基)间苯二腈(化合物30),产率83%。
核磁共振氢谱(氘代DMSO,Bruker AM 600仪):δ=1.45(d,J=7.0Hz,3H,CH3),4.19(m,2H,CH2),5.56(br,1H,NH),7.26-7.40(m,5H,ArH)。
实施例31
(R)-(-2,4,5-三氯-6-(2-苯丙基)氨基)间苯二腈(化合物31)的合成:用(R)-2-苯丙基-1-胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体(R)-(-2,4,5-三氯-6-(2-苯丙基)氨基)间苯二腈(化合物31),产率80%。
高分辨质谱C17H12Cl3N3[M-H]-,理论值362.0024;实测值,362.0028。
实施例32
2,4,5–三氯-6-((1-(4-氟苯基)乙基)氨基)间苯二腈(化合物32)的合成:用1-(4-氟苯基)乙胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5–三氯-6-((1-(4-氟苯基)乙基)氨基)间苯二腈(化合物32),产率72%。
高分辨质谱C16H9Cl3FN3[M-H]-,理论值365.9773;实测值,365.9774。
实施例33
2,4,5–三氟(((四氢呋喃-3-基)甲基)氨基)间苯二腈(化合物33)的合成:用(四氢呋喃-3-基)甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5–三氟(((四氢呋喃-3-基)甲基)氨基)间苯二腈(化合物33),产率93%。
高分辨质谱C13H10F3N3O[M-H]-,理论值280.0703实测值,280.0705。
实施例34
5-氯-2,6-二氟(((四氢呋喃-3-基)甲基)氨基)间苯二腈(化合物34)的合成:用(四氢呋喃-3-基)甲胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-2,6-二氟(((四氢呋喃-3-基)甲基)氨基)间苯二腈(化合物34),产率92%。
高分辨质谱C13H10ClF2N3O[M-H]-,理论值296.0408;实测值,296.0408。
实施例35
2,4,5–三氯(((四氢呋喃-3-基)甲基)氨基)间苯二腈(化合物35)的合成:用(四氢呋喃-3-基)甲胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到黄色固体2,4,5–三氯(((四氢呋喃-3-基)甲基)氨基)间苯二腈(化合物35),产率83%。
核磁共振氢谱(氘代DMSO,Bruker AM 600仪):δ=1.57-1.60(m,1H,CH),1.84-1.90(m,2H,CH2),2.48-2.52(m,1H,CH),3.64-4.11(m,4H,2CH2),7.78(br,1H,NH)。
实施例36
2,4,5-三氟-6-(((四氢-2H-吡喃-4-甲基)氨基))间苯二腈(化合物36)的合成:用(四氢-2H-吡喃-4-基)甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-(((四氢-2H-吡喃-4-甲基)氨基))间苯二腈(化合物36),产率94%。
高分辨质谱C14H12F3N3O[M-H]-,理论值294.0860;实测值,296.0860。
实施例37
5-氯-2,4-二氟-6-(((四氢-2H-吡喃-4-基)甲基)氨基)间苯二腈(化合物37)的合成:用(四氢-2H-吡喃-4-基)甲胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-2,4-二氟-6-(((四氢-2H-吡喃-4-基)甲基)氨基)间苯二腈(化合物37),产率94%。
高分辨质谱C14H12ClF2N3O[M-H]-,理论值310.0564;实测值,310.0563。
实施例38
2,4,5-三氯-6-(((四氢-2H-吡喃-4-甲基)氨基))间苯二腈(化合物38)的合成:用(四氢-2H-吡喃-4-基)甲胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5-三氯-6-(((四氢-2H-吡喃-4-甲基)氨基))间苯二腈(化合物38),产率84%。
实施例39
2,4,5-三氟-6-((4-氟苄基)氨基)间苯二腈(化合物39)的合成:用4-氟苄胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((4-氟苄基)氨基)间苯二腈(化合物39),产率90%。熔点:117-118.0℃。
核磁共振氢谱(氘代二甲亚砜,Bruker AM 400仪):δ=4.81(d,J=6.4Hz,2H,CH2),7.17-7.39(m,4H,ArH),8.70(br,1H,NH)。
核磁共振碳谱(氘代二甲亚砜,Bruker AM 400仪):δ=46.4,78.8,82.3,109.3,111.8,115.7,115.9,129.1,129.2,134.7,137.3,144.9,152.5,161.6,164.2。高分辨质谱C15H7F4N3[M-H]-,理论值304.0503;实测值,304.0502。
实施例40
2,4,5-三氟-6-((4-甲氧基苄基)氨基)间苯二腈(化合物40)的合成:用4-甲氧基苄胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((4-甲氧基苄基)氨基)间苯二腈(化合物40),产率94%。熔点:92.3-93.1℃。
高分辨质谱C16H10F3N3O[M-H]-,理论值316.0703;实测值,316.0703。
实施例41
5-氯-2,4-二氟-6-((4-甲氧基苄基)氨基)间苯二腈(化合物41)的合成:用4-甲氧基苄胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-2,4-二氟-6-((4-甲氧基苄基)氨基)间苯二腈(化合物41),产率86%。熔点:117.6-118.2℃。
高分辨质谱C16H10ClF2N3O[M-H]-,理论值332.0407;实测值,332.0406。
实施例42
4-((2,6-二氟苄基)氨基)-2,5,6-三氟间苯二腈(化合物42)的合成:用2,6-二氟苄胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体4-((2,6-二氟苄基)氨基)-2,5,6-三氟间苯二腈(化合物42),产率93%。熔点:137.8-138.4℃。
高分辨质谱C15H6F5N3[M-H]-,理论值322.0410;实测值,322.0411。
实施例43
5-氯-4-((2,6-二氟苄基)氨基)-2,6-二氟间苯二腈(化合物43)的合成:用2,6-二氟苄胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-4-((2,6-二氟苄基)氨基)-2,6-二氟间苯二腈(化合物43),产率87%。熔点:142.3-142.9℃。
高分辨质谱C15H6ClF4N3[M-H]-,理论值300.0754;实测值,300.0752。
实施例44
2,4,5-三氟-6-((4-甲基苄基)氨基)间苯二腈(化合物44)的合成:用4-甲基苄胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((4-甲基苄基)氨基)间苯二腈(化合物44),产率92%。熔点:140.2-140.9℃。
高分辨质谱C16H10F3N3[M+K]+,理论值340.0085;实测值,340.0084。
实施例45
5-氯-2,4-二氟-6-((4-甲基苄基)胺)间苯二腈(化合物45)的合成:用4-甲基苄胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应,可得到白色固体5-氯-2,4-二氟-6-((4-甲基苄基)胺)间苯二腈(化合物45),产率87%。熔点:87.6-88.4℃。
高分辨质谱C16H10ClF2N3[M-H]-,理论值316.0458;实测值,316.0458。
实施例46
2,4,5-三氯-6-((4-氟苄基)氨基)间苯二腈(化合物46)的合成:用4-氟苄胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5-三氯-6-((4-氟苄基)氨基)间苯二腈(化合物46),产率80%。熔点:167.2-168.1℃。
高分辨质谱C15H7Cl3FN3[M-H]-,理论值351.9616;实测值,351.9611。
实施例47
2,4,5-三氯-6-((2,6-二氟苄基)氨基)间苯二腈(化合物47)的合成:用2,6-二氟苄胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5-三氯-6-((2,6-二氟苄基)氨基)间苯二腈(化合物47),产率82%。熔点:200.8-201.6℃。
高分辨质谱C15H6Cl3F2N3[M-H]-,理论值369.9522;实测值,369.9520。
实施例48
2,4,5-三氯-6-((2-氟苄基)氨基)间苯二腈(化合物48)的合成:用4-氟苄胺代替实施例1中的α-甲基苯乙胺,用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5-三氯-6-((2-氟苄基)氨基)间苯二腈(化合物48),产率78%。熔点:149.4-150.2℃。
高分辨质谱C15H7Cl3FN3[M-H]-,理论值351.9616;实测值,351.9616。实施例49
(R)-2,4,5-三氟-6-((1-苯基乙基)氨基)间苯二腈(化合物49)的合成:用(R)-1-苯基乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体(R)-2,4,5-三氟-6-((1-苯基乙基)氨基)间苯二腈(化合物49),产率94%。熔点:106.4-107.2℃。
高分辨质谱C16H10F3N3[M-H]-,理论值300.0754;实测值,300.0755。
实施例50
(R)-5-氯-2,4-二氟-6-((1-苯基乙基)氨基)间苯二腈(化合物50)的合成:用(R)-1-苯基乙胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体(R)-5-氯-2,4-二氟-6-((1-苯基乙基)氨基)间苯二腈(化合物50),产率86%。熔点:98.2-99.0℃。
高分辨质谱C16H10ClF2N3[M-H]-,理论值316.0455;实测值,316.0457。
实施例51
2,4,5-三氟-6-((4-(三氟甲基)苄基)氨基)间苯二腈(化合物51)的合成:用4-三氟甲基苄胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((4-(三氟甲基)苄基)氨基)间苯二腈(化合物51),产率90%。熔点:103.3-104.1℃。
高分辨质谱C16H7F6N3[M-H]-,理论值354.0458;实测值,354.0459。
实施例52
5-氯-2,4-二氟-6-((4-(三氟甲基)苄基)氨基)间苯二腈(化合物52)的合成:用4-三氟甲基苄胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-2,4-二氟-6-((4-(三氟甲基)苄基)氨基)间苯二腈(化合物52),产率85%。熔点:111.7-112.6℃。
高分辨质谱C16H7ClF5N3,理论值370.0175;实测值,370.0175。
实施例53
2,4,5-三氯-6-((4-(三氟甲基)苄基)氨基)间苯二腈(化合物53)的合成:用2,4,5,6-四氯间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体2,4,5-三氯-6-((4-(三氟甲基)苄基)氨基)间苯二腈(化合物53),产率81%。
高分辨质谱C16H7ClF5N3,理论值370.0175;实测值,370.0175
实施例54
2,4,5-三氟-6-((4-氟苯乙基)胺)间苯二甲腈(化合物54)的合成:用4-氟苯乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((4-氟苯乙基)胺)间苯二甲腈(化合物54),产率89%。
核磁共振氢谱(氘代二甲亚砜,Bruker AM 600仪):δ:2.93(t,2H,CH2),3.80(s,2H,CH2),5.36(s,2H,CH2),7.12–7.30(m,4H,ArH),8.23(br,1H,NH);核磁共振碳谱(氘代二甲亚砜,Bruker AM 600仪):δ:35.4,45.6,78.1,81.8,109.3,112.2,115.5,115.7,131.1,131.1,134.6,136.0,144.9,152.5,161.0,163.1;高分辨质谱C16H9F4N3[M-H]-,理论值318.0660;实测值,318.0660。
实施例55
5-氯-2,4,二氟-6-((4-氟苯乙基)胺)间苯二甲腈(化合物55)的合成:用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈,用4-氟苯乙胺代替实施例1中Α-甲基苯乙胺进行反应可得到白色固体状5-氯-2,4,二氟-6-((4-氟苯乙基)胺)间苯二甲腈(化合物2),产率90%。
高分辨质谱C16H6ClF3N3[M-F],理论值334.064;实测值,334.0367。
核磁共振氢谱(氘代二甲亚砜,Bruker AM 600仪):δ:2.98(t,2H,CH2),3.83(s,2H,CH2),5.36(s,2H,CH2),7.13–7.34(m,4H,ArH),8.24(br,1H,NH);
实施例56
2,4,5-三氟-6-((4-氟苯乙基)胺间苯二甲腈(化合物56)的合成:用2-氟苯乙胺代替实施例1中的Α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氟-6-((2-氟苯乙基)胺)间苯二甲腈(化合物56),产率89%。
高分辨质谱C16H9lF4N3[M-H]-,理论值318.0660;实测值,318.0666。
核磁共振氢谱(氘代二甲亚砜,Bruker AM 600仪):δ=2.95–2.97(m,2H,CH2),3.90–3.93(m,2H,CH2),7.12–7.15(t,J=18.0Hz,2H,ArH),7.28–7.29(m,2H,ArH)7.94(m,1H,NH)
实施例57
5-氯-2,4,二氟-6-((2-氟苯乙基)胺)间苯二甲腈(化合物57)的合成:用用2-氟苯乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体5-氯-2,4,二氟-6-((2-氟苯乙基)胺)间苯二甲腈(化合物57),产率87%。
核磁共振氢谱(氘代二甲亚砜,Bruker AM 600仪):δ=3.00–3.24(m,2H,CH2),3.96–3.99(m,2H,CH2),7.12–7.36(m,4H,ArH),7.94(m,1H,NH)
高分辨质谱C16H9ClF3N3[M-H]-,理论值,334.0364;实测值,334.0369。
实施例58
2,4,5-三氟-6-(苯乙胺)间苯二甲腈(化合物58)的合成:用苯乙胺代替实施例2中的α-甲基苯乙胺进行反应可得到白色半固体2,4,5-三氟-6-(苯乙胺)间苯二甲腈(化合物58),产率85%。
核磁共振氢谱(氘代二甲亚砜,Bruker AM 600仪):δ=2.93–2.95(m,2H,CH2),3.80–3.83(m,2H,CH2),7.21–7.32(m,2H,ArH),7.28–7.32(m,5H,ArH)8.24(br,1H,NH)
高分辨质谱C16H10F3N3[M-H]-,理论值300.0754;实测值,300.0759。
实施例59
5-氯-2,4-二氟-6-(苯乙胺)间苯二甲腈(化合物59)的合成:用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈,用苯乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体5-氯-2,4-二氟-6-(苯乙胺)间苯二甲腈(化合物59),产率80%。熔点:85.7-85.9℃。
高分辨质谱C16H10ClF2N3[M-H]-,理论值316.0459;实测值,316.0462。
实施例60
2,4,5-三氟-6-5-甲基-2-呋喃甲胺间苯二甲腈(化合物60)的合成:用5-甲基-2-呋喃甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到黄色半固体2,4,5,-三氟-6-(5-甲基-2-呋喃)甲胺间苯二甲腈(化合物60),产率93%。
高分辨质谱C14H8F3N3O[M-H]-,理论值290.0547;实测值,290.0552。
实施例61
5-氯-2,4-二氟-6-(5-甲基-2-呋喃)甲胺间苯二甲腈(化合物61)的合成:用5-甲基-2-呋喃甲胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到黄色固体5-氯-2,4-二氟-6-(5-甲基-2-呋喃)间苯二甲腈(化合物61),产率92%。
核磁共振氢谱(氘代氯仿,Bruker AM 600仪):δ=4.95(d,J=5.82Hz,2H,CH3),4.72-4.90(m,2H,CH2),6.01-6.24(m,2H,CH),8.57(br,1H,NH)。
实施例62
2,4,5,-三氟-3,4-亚甲二氧基苯甲胺间苯二甲腈(化合物62)的合成:用3,4-亚甲二氧基苯甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体3,4-亚甲二氧基苯甲胺间苯二甲腈(化合物62),产率88%。
高分辨质谱C16H8F3N3O2[M-H]-,理论值330.0496;实测值,330.0500。
实施例63
5-氯-2,4-二氟-3,4-亚甲二氧基苯甲胺间苯二甲腈(化合物63)的合成:用3,4-亚甲二氧基苯甲胺代替实施例1中的α-甲基苯乙胺,用5-氯-2,4,6-三氟间苯二甲腈代替实施例1中的2,4,5,6-四氟间苯二甲腈进行反应可得到白色固体5-氯-2,4-二氟-3,4-亚甲二氧基苯甲胺间苯二甲腈(化合物63),产率90%。
高分辨质谱C16H8ClF2N3O2[M-H]-,理论值346.0200;实测值,346.0207。
实施例64
2,4,5-三氯-6-((4-氟苯乙基)胺)间苯二甲腈(化合物64)的合成:用四氯间苯二腈代替实施例1中的四氟间苯二腈,用4-氟苯乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氯-6-((4-氟苯乙基)胺)间苯二甲腈(化合物64),产率90%。
核磁共振氢谱(氘代二甲亚砜,Bruker AM 600仪):δ=2.95–2.97(m,2H,CH2),3.90–3.95(m,2H,CH2),7.09–7.30(m,2H,ArH),7.69–7.29(m,4H,ArH)7.70(br,1H,NH)
高分辨质谱C16H9Cl3FN3[M-H]-,理论值365.9773;实测值,365.9770。
实施例65
2,4,5-三氯-6-((2-氟苯乙基)胺)间苯二甲腈(化合物65)的合成:用四氯间苯二腈代替实施例1中的四氟间苯二腈;用2-氟苯乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色固体2,4,5-三氯-6-((2-氟苯乙基)胺)间苯二甲腈(化合物65),产率92%。
高分辨质谱C16H9Cl3FN3[M-H]-,理论值365.9773;实测值,365.9777。
实施例66
2,4,5-三氯-6-苯乙胺间苯二甲腈(化合物66)的合成:用三氟间苯二腈代替代替实施例1中的四氟间苯二腈用苯乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到黄色固体2,4,5-三氯-6-苯乙胺间苯二甲腈(化合物66),产率86%。
高分辨质谱C16H10Cl3N3[M-H]-,理论值347.9868;实测值,347.9868。
实施例67
2,4,5–三氯-6-(5-甲基-2-呋喃)甲胺间苯二甲腈(化合物67)的合成:5-甲基-2-呋喃甲胺用代替实施例1中的α-甲基苯乙胺进行反应可得到红色半固体2,4,5–三氯-6-(5-甲基-2-呋喃)甲胺间苯二甲腈(化合物67),产率86%,熔点:150.1-150.9℃。
实施例68
2,4,5,-三氯-3,4-亚甲二氧基苯甲胺间苯二甲腈(化合物68)的合成:用3,4-亚甲二氧基苯甲胺代替实施例1中的α-甲基苯乙胺进行反应可得到白色半固体2,4,5,-三氯-3,4-亚甲二氧基苯甲胺间苯二甲腈(化合物68),产率85%,熔点:201.3-201.8℃。
实施例69
2,4,5-三氟-6-((1-(萘乙基-1)乙基)甲胺间苯二甲腈(化合物69)的合成:用1-萘乙胺代替实施例1中的α-甲基苯乙胺进行反应可得到黄色固体2,4,5-三氟-6-((1-(萘乙基-1)乙基)甲胺间苯二甲腈(化合物69),产率90%。
高分辨质谱C20H12F3N3[M-H]-,理论值350.0911;实测值,350.0911。
实施例70
5-氯-2,4-二氟-6-((1-(萘乙基-1)乙基)甲胺间苯二甲腈(化合物70)的合成:用1-萘乙胺代替实施例1中的α-甲基苯乙胺,用三氟间苯二腈代替实施例1中的四氟间苯二腈进行反应可得到白色固体5-氯-2,4-二氟-6-((1-(萘乙基-1)乙基)甲胺间苯二甲腈(化合物70),产率90%。
高分辨质谱C20H12ClF2N3[M-H]-,理论值366.0615;实测值,366.0617。
实施例71
2,4,5-三氯-6-((1-(萘乙基-1)乙基)甲胺间苯二甲腈(化合物71)的合成:用1-萘乙胺代替实施例1中的α-甲基苯乙胺,用四氯间苯二腈代替实施例1中的四氟间苯二腈进行反应可得到白色固体2,4,5-三氯-6-((1-(萘乙基-1)乙基)甲胺间苯二甲腈(化合物71),产率78%。
高分辨质谱C20H12Cl3N3[M-H]-,理论值398.0024;实测值,398.0027。
实施例72
2,4,5-三氟-(R)-(+)-1-苯丙胺间苯二甲腈(化合物72)的合成:用(R)-(+)-1-苯丙胺间苯二甲腈代替实施例1中的α-甲基苯乙胺进行反应可得到黄色固体2,4,5-三氟-(R)-(+)-1-苯丙胺间苯二甲腈(化合物72),产率93%。
高分辨质谱C17H12F3N3[M-H]-,理论值314.0911;实测值,314.0915。
实施例73
MIC值得测定采用微量稀释法(参考文献:Bioorganic&Medicinal Chemistry Letters,2013,23,5958–5963;Bioorganic&Medicinal Chemistry Letters,2013,23,2399–2403):
第一步:将已灭菌的液体培养基加入到无菌96孔聚苯乙烯板中,在板上的第1列的每个小孔中加入180μL培养基,剩余所有小孔每孔加入100μL。将准备好的药液取20μL分别加入第一列小孔中,每一个小孔中只能加入一种抗菌药,一个板上可以加7个样品,剩余一个加对照药诺氟沙星或者氟康唑。与常量稀释法操作基本相似,用移液枪将第1个小孔中的液体混合均匀,吸出100μL加入到第二个小孔中,同样操作,混合均匀之后吸取100μL至第3个小孔中,依次进行到底11个小孔中,将液体混合均匀,吸取100μL弃去,第12个小孔作为生长对照。此时第1-11孔中的药物浓度分别是1000.000、500.000、250.000、125.000、62.500、31.250、15.625、7.813、3.906、1.953、0.976μg/mL。为满足更低药物浓度下的MIC值测定时,同样的将已灭菌的液体培养基加入到无菌96孔聚苯乙烯板中,在板上的第1列的每个小孔中加入198μL培养基,剩余所有小孔每孔加入100μL。将准备好的药液取2μL分别加入第一列小孔中,每一个小孔中只能加入一种抗菌药,一个板上可以加7个样品,剩余一个加对照药诺氟沙星或者氟康唑。与常量稀释法操作基本相似,用移液枪将第1个小孔中的液体混合均匀,吸出100μL加入到第二个小孔中,同样操作,混合均匀之后吸取100μL至第3个小孔中,依次进行到底11个小孔中,将液体混合均匀,吸取100μL弃去,第12个小孔作为生长对照。此时第1-11孔中的药物浓度分别是100.000、50.000、25.000、12.500、6.250、3.125、1.563、0.781、0.391、0.195、0.098μg/mL。
第二步:取本发明化合物的菌悬液15uL用培养基稀释1000倍,混合均匀,向96孔板中每孔加入100uL液体培养基。此时第1-11孔中样品浓度分别为500.000、250.000、125.000、62.5.000、31.250、15.625、7.813、3.906、1.953、0.977、0.488μg/mL。更低药物浓度下的MIC值测定时,第1-11孔中样品浓度分别为50.000、25.000、12.500、6.250、3.125、1.563、0.781、0.391、0.196、0.098、0.049μg/mL。盖上盖子放置恒温箱内培养,细菌需培养24-48h,真菌培养48-72h,之后观察结果并记录。
第三步:在小孔内样品能够完全抑制细菌生长的最低浓度为该样品的MIC值。若出现跳孔现象,此时以抑制细菌生长的最高样品浓度为准,并记录结果。
每块96孔板只能接种一种菌,不能接种多种菌。一般需重复试验三次,在无较大误差情况下,取三组实验的平均值即为MIC值。
测定结果见表一。
MBC值的测定:(参考文献:郭菲,侯淼.药敏纸片扩散法与仪器法在阴道加德纳菌鉴定中的比较[J].检验医学与临床,2015,12,2600-2602):在最小抑菌浓度测量的基础上,选取活性较好的化合物进行下一步的MBC值测定。选取化合物进行第二步MIC值的操作步骤,经过培养之后,将无菌生长的小孔内的混合液用移液枪头吸出涂布于培养基上,置于恒温箱中培养一段时间观察结果,培养基上无任何细菌生长的对应最低抗菌药物浓度即为该药物的MBC值。测定结果见表二。
所得数据证实,本发明的化合物对金黄色葡萄球菌、蜡样芽孢杆菌、白色念珠菌有明显的活性。
表一本发明的化合物对细菌和真菌的抗菌活性测试MIC值
注:“N”代表无抗菌活性,“-”代表无数据
表二本发明的代表性化合物对细菌和真菌的抗菌活性测试MBC值
注:“-”代表无数据。
对本发明的化合物对五种菌株进行抗菌活性实验:蜡样芽孢杆菌(BC),金黄葡萄球菌(SA),大肠杆菌(EC),铜绿假单胞菌(PA),白色念珠菌(MA)。对所合成的72个N-卤代芳基取代的胺类化合物进行纸片扩散法初筛,MIC(最小抑菌浓度)与MBC(最小杀菌浓度)的测定。经过筛选本发明部分化合物对大肠杆菌(EC),铜绿假单胞菌(PA)具有一定活性,部分化合物对蜡样芽孢杆菌(BC),金黄葡萄球菌(SA),白色念珠菌(MA)有较好活性与上市药物诺氟沙星,氟康唑活性相当。
所得数据证实,本发明的化合物对蜡样芽孢杆菌、金黄葡萄球菌和白色念珠菌有明显的活性。
本发明对所合成的72个N-卤代芳基取代的胺类化合物针对五种菌种进行纸片扩散法初筛,在初筛的结果上进一步进行MIC(最小抑菌浓度)值测定从而获得MIC值,进而测定MBC值。
如实施例1化合物1(0.082μg/mL),实施例2化合物2(0.065μg/mL)对金黄色葡萄球菌抑菌活性参照诺氟沙星(0.651μg/mL)较优异;实施例2化合物2(0.065μg/mL)、实施例4化合物4(0.065μg/mL)、实施例8化合物8(0.082μg/mL)对蜡样芽孢杆菌(BC)的抑菌活性优于参照诺氟沙星(0.651μg/mL);实施例1化合物1(0.049μg/mL)、实施例2化合物2(0.049μg/mL)、实施例3化合物3(0.049μg/mL)、实施例4化合物4(0.065μg/mL)、实施例5化合物5(0.065μg/mL)对白色念珠菌的抑菌活性明显优与参照氟康唑(3.255μg/mL)。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!