一种多交叉恒温扩增结合金纳米生物传感的核酸检测技术的制作方法
本发明公开了一种核酸扩增技术及应用,属于微生物学和分子生物学领域。
背景技术:
在现代医学和生物学领域,核酸扩增是一种不可缺少的技术,广泛应用于基础研究、生物研究、临床诊断、流行病研究、考古研究、转基因研究等领域。在已经建立的核酸扩增技术中,聚合酶链式反应(PCR)是第一个被建立的体外核酸扩增技术,具有划时代意义,现已被广泛应用于生物、医学等相关领域。然而,PCR进行核酸扩增时,受实验室的条件限制,依赖于复杂昂贵的热循环仪器。此外,PCR产物的检测比较复杂,需要一套专门的流程及设备。这些劣势限制了该技术的广泛应用,尤其在经济落后的地区及快速诊断领域。因此,对于生物相关研究领域而言,非常有必要发展一个简单、快速、敏感的核酸扩增方法。
为了克服PCR扩增技术的劣势,近年来发展了许多恒温扩增技术。恒温扩增技术较PCR技术而言,不依赖于热循环扩增设备、反应速度快、敏感性好。因此,恒温扩增技术有利于实现快速扩增、便捷检测及现场诊断。到目前为止,已发展的恒温扩增技术有10余种,应用较为广泛的有滚环扩增(RCA)、链置换扩增(SDA)、解旋酶依赖的恒温扩增(HDA)、环介导恒温扩增(LAMP)、交叉扩增(CPA)等。然而,这些恒温技术实现核酸扩增需要多种酶同时工作,依赖于昂贵的试剂,复杂的操作步骤。因此这些方法的实用性、便捷性、可操作性有待于提高,尤其是在快速诊断领域及欠发达地区。为了克服PCR技术及现有恒温扩增技术的劣势,实现便捷、快速、敏感及特异的扩增核酸序列,在生物、农业、医学等领域,有必要发展一种操作简单、经济实用、反应速度快、特异性强的核酸扩增技术。
为了实现这一目标,发明人近期已经建立了一种新的核酸扩增技术,命名为多交叉置换扩增(Multiple Cross Displacement Amplification,MCDA),相关内容公开于CN104946744A,本申请引用该专利文件作为现有技术构成本申请说明书的一个部分。MCDA在恒温条件下实现核酸扩增,仅使用一种恒温置换酶、扩增速度快、反应灵敏、特异性高。MCDA扩增之后,其产物的检测可以通过琼脂糖电泳后染色观察。较为简便的方法是直接在产物中加入SYBR GreenⅠ染色,呈现绿色为阳性反应,橙红色为阴性反应。也可以通过扩增副产物焦磷酸镁沉淀的浊度进行判断,液体浑浊,离心或有白色沉淀的为阳性反应,无此现象的则为阴性反应。现在更为简单的方法是在反应混合物中加入可视染料,阳性反应管的颜色从浅灰色变为绿色,阴性反应管则保持原来的浅灰色。然而,这些方法都只能检测MCDA反应是否进行,不能识别针对特定靶序列的特异性扩增,导致MCDA在检测目的序列时,其结果的判定缺乏特异性。因此,传统MCDA检测很难实现对多重目的片段的同时检测,这极大限制了MCDA的广泛应用。
志贺菌(Shigella spp.)和沙门菌(Salmonella spp.)是两种重要的食源性疾病病原体,广泛存在于环境中的革兰氏阴性菌。志贺菌和沙门菌常分离自食品样本及临床标本,引起食源性的肠热症,临床症状表现为发热、腹泻。据WHO数据统计,全球每年有180万病人死于腹泻,其中绝大多数病例是由志贺菌和沙门菌导致,从而受到全球卫生部门的高度关注,成为各国的重大公共卫生问题。在发展中国家,志贺菌是引起菌痢的最主要的病原体,然而,无论是在发展中国家还是发达国家,沙门菌是导致食源性疾病最重要的病原体。因此,为了给予临床病人准确快速的治疗,食源性病原体监测以及志贺菌和沙门菌的流行病学调查,研发一个省时、省力和特异性较高的诊断方法,能够同时检测和鉴定志贺菌和沙门菌成为必要。
目前对于志贺菌和沙门菌的检测主要依赖于传统的增菌培养和生化鉴定,该方法耗时大约5到7天,包括增菌、选择培养及后续的生化鉴定,其劣势在于耗时耗力,生化结果的判读依赖于人的主观判断,导致结果重复性差,易错判。随着核酸诊断技术的快速发展,一些以PCR为基础的诊断技术(如普通PCR技术,荧光PCR技术)被用于志贺菌和沙门菌的快速检测,然而这些方法依赖于昂贵的仪器设备,需要后续的电泳操作,昂贵的探针合成,以及熟练的操作人员。对于一些条件落后的实验室无法进行,从而限制了这些技术的运用。目前运用这些检测技术诊断沙门菌和志贺菌的PCR方法和Real-time PCR方法,诊断灵敏度差,检测过程耗时较长,不利于快速检测和应急检测。
本发明意欲针对志贺菌的特异基因ipaH和沙门菌的特异基因invA分别设计两套MCDA扩增引物,开发出能够快速、敏感、方便和特异地鉴定出志贺菌和沙门菌病原体的一种新型的MCDA检测技术。
技术实现要素:
基于上述目的,本发明首先提供了一种扩增目的基因片段并对扩增结果进行检测的方法,该方法以CN104946744A所公开的MCDA为基础,将MCDA技术与纳米生物检测技术相结合,开发了依赖MCDA技术、实现多重检测的纳米生物传感技术,该技术被命名为多交叉恒温扩增结合金纳米生物传感的核酸检测技术(Visual and multiplex detection of nucleic acid sequence by multiple cross displacement amplification coupled with gold nanoparticle-based lateral flow biosensor,MCDA-LFB)。所述方法包括以下步骤:
(1)自所述目的基因片段的3’端起,设定第一任意序列F1s,第二任意序列P1s,自所述目的基因片段的5’端起,设定第三任意序列F2,第四任意序列P2,在所述第二任意序列P1s的5’端设定第五任意序列C1,和/或在所述第四任意序列P2的3’端设定第六任意序列C2s,在序列C1的3’端和5’端分别设定第七任意序列D1和第八任意序列R1,在序列C2s的5’端和3’端分别设定第九任意序列D2s和第十任意序列R2s;
(2)提供置换引物F1,所述引物F1含有与序列F1s互补的序列,提供交叉引物CP1,所述引物CP1自5’端依次含有序列C1和与序列P1s互补的序列P1,提供置换引物F2,所述引物含有序列F2,提供交叉引物CP2,所述引物CP2自5’端依次含有序列C2s互补的序列C2和序列P2;
(3)提供扩增引物,所述扩增引物包括含有序列C1的扩增引物C1,和/或含有与序列C2s互补的扩增引物C2,含有序列D1的扩增引物D1、含有序列R1的扩增引物R1、含有与序列D2s互补的扩增引物D2和含有与序列R2s互补的扩增引物R2,其中,在所述扩增引物C1或C2的5’端标记生物素,在所述扩增引物D1或D2在5’端标记半抗原;
(4)在链移位型聚合酶、解链温度调节剂、引物存在下,使用目的基因片段作为模板恒温扩增DNA;
(5)使用金纳米生物传感器检测步骤(4)的扩增产物。
在一个优选的技术方案中,在所述扩增引物D1或D2的5’端所标记的半抗原为荧光素或地高辛。
在一个更为优选的技术方案中,所述金纳米生物传感器包括一背板,在所述背板上依次设置装有样品垫、金标垫、硝酸纤维素膜及吸水垫,在所述纤维素膜上依次设置检测线1、检测线2及控制线,在金标垫、检测线1、检测线2及控制线区域依次包被有金纳米粒子偶联的链霉素亲和素(SA-G)、抗荧光素抗体、抗地高辛抗体及生物素偶联的牛血清蛋白(B-BSA)。
其次,本发明还提供了上述方法在检测沙门菌中的应用,所述置换引物F1的序列如SEQ ID NO:1所示,所述置换引物F2的序列如SEQ ID NO:2所示;所述交叉引物CP1的序列如SEQ ID NO:3所示,所述交叉引物CP2的序列如SEQ ID NO:5所示,引物C1的序列如SEQ ID NO:6所示,引物C2的序列如SEQ ID NO:8所示,引物D1的序列如SEQ ID NO:9所示,引物D2的序列如SEQ ID NO:11所示,引物R1的序列如SEQ ID NO:12所示,引物R2的序列如SEQ ID NO:13所示。
同时,本发明还提供了上述方法在检测志贺菌中的应用,所述置换引物F1的序列如SEQ ID NO:14所示,所述置换引物F2的序列如SEQ ID NO:15所示;所述交叉引物CP1的序列如SEQ ID NO:16所示,所述交叉引物CP2的序列如SEQ ID NO:18所示,引物C1的序列如SEQ ID NO:19所示,引物C2的序列如SEQ ID NO:20所示,引物D1的序列如SEQ ID NO:22所示,引物D2的序列如SEQ ID NO:23所示,引物R1的序列如SEQ ID NO:25所示,引物R2的序列如SEQ ID NO:26所示。
再次,本发明提供了上述方法在检测多种目的基因片段中的应用,所述应用提供针对多个不同的目的基因片段的步骤(2)和(3)所述的交叉引物CP1、CP2,置换引物F1、F2,扩增引物C1、C2、D1、D2、R1和R2。
在一个优选的技术方案中,所述多种目的基因片段分别为沙门菌的invA基因和志贺菌的ipaH基因。
又次,本发明还提供了一组用于恒温扩增沙门菌invA基因的引物序列,所述序列包括:如SEQ ID NO:1所示的置换引物F1,SEQ ID NO:2所示的置换引物F2,如SEQ ID NO:3所示的交叉引物CP1,如SEQ ID NO:5所示的交叉引物CP2,如SEQ ID NO:6所示的扩增引物C1,如SEQ ID NO:8所示的扩增引物C2,如SEQ ID NO:9所示的扩增引物D1,如SEQ ID NO:11所示的扩增引物D2,如SEQ ID NO:12所示的扩增引物R1,如SEQ ID NO:13所示的扩增引物R2。
同时,本发明还提供了一组用于恒温扩增志贺菌ipaH基因的引物序列,所述序列包括:如SEQ ID NO:14所示的置换引物F1,SEQ ID NO:15所示的置换引物F2,如SEQ ID NO:16所示的交叉引物CP1,如SEQ ID NO:18所示的交叉引物CP2,如SEQ ID NO:19所示的扩增引物C1,如SEQ ID NO:20所示的扩增引物C2,如SEQ ID NO:22所示的扩增引物D1,如SEQ ID NO:23所示的扩增引物D2,如SEQ ID NO:25所示的扩增引物R1,如SEQ ID NO:26所示的扩增引物R2。
最后,本发明提供了一种用于对恒温扩增基因产物进行检测的金纳米生物传感器,所述传感器包括一背板,在所述背板上依次设置装有样品垫、金标垫、硝酸纤维素膜及吸水垫,在所述纤维素膜上依次设置检测线1、检测线2及控制线,在金标垫、检测线1、检测线2及控制线区域依次包被有SA-G、抗荧光素抗体、抗地高辛抗体及B-BSA。
在本发明的MCDA扩增体系中,能够形成大量双标的可检测产物。引物C1或C2的5’端标记生物素,引物D1或D2的5’端标记半抗原。该双标的产物能被金纳米生物传感器(LFB)检测,从而进行可视检测。当针对不同靶标设计的引物D2进行不同半抗原标记时,可实现多重检测。因此,在利用MCDA-LFB技术进行靶序列检测时,可利用引物C1和D1构建可检测产物,也可利用引物C2和D2构建可检测产物。
在标准的MCDA-LFB检测体系中,其独立检测沙门菌的invA基因和志贺菌的ipaH基因的检测下限为10fg/反应管,其灵敏度与ET-MCDA技术相同。
MCDA-LFB多重检测体系在检测沙门菌时的检测下限为10fg DNA/反应管。MCDA-LFB多重检测体系在检测志贺菌时的检测下限为10fgDNA/反应管。
以常见的致病菌及条件致病菌(沙门菌、志贺菌、单增李斯特菌、霍乱弧菌、副溶血性弧菌、创伤弧菌、粪肠球菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌、肠致病性大肠杆菌、肠产毒性大肠杆菌、肠侵袭性大肠杆菌等共63株菌)DNA为模板评价MCDA-LFB技术的特异性。MCDA-LFB技术能准确鉴别沙门菌和志贺菌,说明MCDA-LFB方法的特异性良好。
附图说明
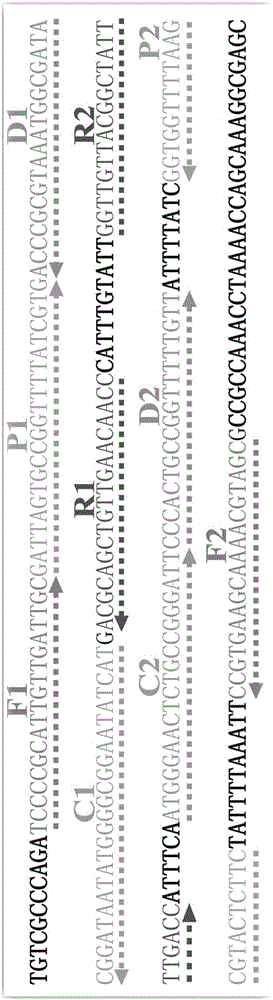
图1.MCDA-LFB引物设计的位置和方向示意图;
图2.MCDA扩增原理及金纳米生物传感器结构示意图;
图3.标准MCDA-LFB检测结果图谱;
图4.标准MCDA-LFB最佳反应温度测试结果图谱;
图5.MCDA-LFB检测单一靶标的灵敏度结果图谱;
图6.多重MCDA-LFB检测扩增曲线图;
图7.运用LFB可视化读取多重MCDA扩增结果图;
图8.多重MCDA-LFB技术的最佳反应时间测试结果图谱;
图9.MCDA-LFB技术的特异性检测评价图谱
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的保护范围构成任何限制。
一、MCDA-LFB检测原理
1.MCDA反应体系包括10条引物,识别靶序列的10个区域,包括2条交叉内引物,即CP1和CP2(Cross Primer,CP),2条置换引物,即F1和F2,6条扩增引物,即D1、C1、R1、D2、C2和R2。为了构建可检测产物,扩增引物C1或C2在5’端标记生物素,扩增引物D1或D2在5’端标记半抗原(荧光素或者地高辛),新标记的引物被命名为C1*,C2*,D1*和D2*。CP1包含序列C1和与序列P1s互补的序列P1,即5′-Cl-P1;CP2包含序列C2s互补的序列C2和序列P2,即5′-C2-P2。两条交叉引物CP1和CP2是介导MCDA扩增的主要引物;置换引物F1和F2在MCDA反应中发挥置换作用,置换交叉引物CP1和CP2;六条扩增引物D1*、C1*、R1、D2*、C2*和R2能够加速MCDA反应及增加MCDA产物量(见图2A)。
在既定的恒温条件下,双链DNA在处于半解离和半结合的动态平衡状态中,任何一个引物向双链DNA的互补部位进行碱基配对延伸时,另一条链就会解离,变成单链。首先在Bst DNA聚合酶的作用下,以CP1引物P1区段的3′末端为起点,与对应的DNA互补序列配对,启动链置换DNA合成。F1引物与C1s前端F1s序列互补,以3′末端为起点,通过链置换活性DNA聚合酶的作用,首先置换出CP1引物合成的DNA链,同时合成自身DNA。最终F1引物合成而得的DNA链与模板DNA形成双链。然后由交叉引物CP1先合成的DNA链被F1引物进行链置换产生一单链,该单链的D1s、C1s、R1s、P2s、F2s区域能够依次与扩增引物D1*、C1*、R1,交叉引物CP2及置换引物F2结合,并发挥链置换扩增作用(步骤1、2)。C1*引物扩增并置换D1*的扩增链,生成短片段C1s-D1*产物,该产物能够与C1*和CP1引物结合,启动链置换扩增,进入循环扩增1(步骤3和循环1)。在循环扩增1中,随着MCDA扩增的进行,大量的双标产物被形成,C1*端标记生物素,D1*端标记半抗原。该双标的产物能被金纳米生物传感器检测,从而进行可视检测。当针对不同靶标设计的D1*引物进行不同半抗原标记时,可实现多重检测。后续的MCDA扩增,包括步骤4、5和6,详见中国专利CN104946744A,该专利内容通过引用形式并入本发明的公开内容之中。此外,由于C2*和D2*的扩增过程与C1*和D1*的扩增过程相似,在MCDA扩增体系中,同样能够形成大量的双标的可检测产物。C2*端标记生物素,D2*端标记半抗原。该双标的产物能被金纳米生物传感器(LFB)检测,从而进行可视检测。当针对不同靶标设计的D2*引物进行不同半抗原标记时,可实现多重检测。因此,在利用MCDA-LFB技术进行靶序列检测时,可利用C1*和D1*引物构建可检测产物,也可利用C2*和D2*引物构建可检测产物。
2.生物传检测器(LFB)的设计
生物检测器(LFB)的设计见图2B。LFB包含五个部分:1.背板;2.样品垫;3.金标垫;4.硝酸纤维素膜(反应区域);5.吸水垫。首先将样品垫、金标垫、纤维膜及吸水垫依次组装在背板上。然后将金纳米粒子偶联的链霉素亲和素(SA-GNP)、抗荧光素抗体(anti-FITC)、抗地高辛抗体(anti-Dig)及生物素偶联的牛血清蛋白(Biotin-BSA)分别包被在金标垫、检测线1(TL1)、检测线2(TL2)及控制线(CL)区域,待干燥后备用。图2B中,扩增子(I)为生物素和荧光素同时标记的MCDA扩增,扩增子(II)为生物素和地高辛同时标记的MCDA扩增。
LFB的检测原理:将MCDA产物滴加到LFB的样品垫区域,然后将LFB的底部1~1.5cm置于缓冲液中,MCDA产物在虹吸作用下,从下往上运动(从样品垫向吸水垫方向运动)。当MCDA产物达到金标垫后,双标产物的一端(即生物素标记端)与SA-G反应。当产物继续运动,双标产物的另一端(即半抗原标记端)与TL1或TL2区域的抗体结合,将双标产物固定在TL1或TL2区域。随着产物在TL1或TL2区域的积累,通过另一端的SA-G进行显色反应,从而对MCDA产物进行可视化检测。此外,过剩的SA-G可与CL区域的B-BSA反应,进行直接显色反应,判断LFB的功能是否正常。
LFB结果的判读:仅仅CL区域出现红色条带,表示阴性对照,没有阳性产物;CL及TL1区域出现红色条带,表示针对靶标一的检测为阳性结果;CL及TL2区域出现红色条带,表示针对靶标二的检测为阳性结果;CL、TL1和TL2区域均出现红色条带,表示针对靶标一和二的检测都为阳性结果;当LFB不出现红色条带时,表示LFB失效;当TL1和/或TL2出现红色条带时,CL无红色条带,代表结果不可信,需要重新检测。
3.MCDA扩增后的检测
MCDA扩增之后,三种检测方法被用于MCDA扩增判别。首先,在反应混合物中加入可视染料(如FD试剂,朗普荧光可视试剂),阳性反应管的颜色从浅灰色变为绿色,阴性反应管则保持原来的浅灰色。其次,MCDA产物可以通过琼脂糖电泳后检测扩增子,由于产物中包含了不同大小的扩增片段,因此阳性扩增产物的电泳图呈特异性阶梯状,阴性反应不出现任何条带。更为直接简单的方法为通过LFB对产物进行检测。
二、本发明实施例涉及的材料方法
1.本发明中所涉及的试剂:
抗荧光素抗体(anti-FITC)、抗地高辛抗体(anti-Dig)、金纳米粒子偶联的链霉素亲和素(SA-G)及生物素偶联的牛血清蛋白(B-BSA)购于Resenbio公司。背板、样品垫、金标垫、纤维膜及吸水垫购于Jie-Yi公司。Loopamp Kit(Eiken Chemical Co.Ltd.,Tokyo,Japan)购于日本荣研公司。DNA提取试剂盒(QIAamp DNA minikits;Qiagen,Hilden,Germany)购于德国Qiagen公司。PCR反应体系混合物MIX(Taq DNA聚合酶,dNTP和缓冲液)购于北京康为世纪生物科技有限公司。DL50 DNA Marker购于宝生物工程(大连)有限公司。其余试剂均为市售分析纯产品。
2.本发明实验中使用的主要仪器
恒温实时浊度仪LA-320C(Eiken Chemical Co.,Ltd,Japan)购于日本荣研公司。PCR仪为Sensoquest Labcycler,德国Sensoquest公司产品;电泳设备为北京君意东方电泳设备有限公司产品;凝胶成像系统为Bio-Rad Gel Dox XR,美国Bio-Rad公司产品。
3.基因组提取:志贺菌、沙门菌及其他细菌的基因组DNA的提取使用Qiagen公司的DNA提取试剂盒(QIAamp DNA minikits;Qiagen,Hilden,Germany),按照说明书进行操作。利用紫外分光光度计测定基因组DNA的浓度和纯度,志贺菌及沙门菌的DNA用GE缓冲液连续稀释(从10ng、10pg、10fg、1fg到0.1fg/微升)。各种基因组DNA均少量分装,-20℃保存备用。
连续稀释的志贺菌及沙门菌DNA用于MCDA及多重MCDA扩增步骤的最佳温度的探索及多重扩增体系的建立。以常见的致病菌及条件致病菌DNA为模板评价MCDA-LFB技术的特异性。菌株信息见表3。
4.引物设计
为了验证、评价MCDA-LFB技术,以及建立针对志贺菌和沙门菌病原体的快速、敏感和特异的MCDA-LFB检测体系,本发明针对志贺菌的特异基因ipaH和沙门菌的特异基因invA分别设计两套MCDA扩增引物,旨在验证MCDA-LFB技术的可行性、敏感性、特异性及可靠性。
invA存在于沙门菌所有血清型中,其特异性好,可以将沙门菌与其他密切相近的菌种区分开。ipaH存在于所有的志贺菌中,其特异性好,可以将志贺菌与其他密切相近的菌种区分开。利用引物设计软件PrimerExplorer V4(Eiken Chemical)(http://primerexplorer.jp/e/)和引物设计软件Primer Premier 5.0设计MCDA引物,并将获得的特异性引物在NCBI数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行序列比对分析,以排除引物与其他物种序列可能存在的非特异性匹配,最终获得优化后的两套完整MCDA扩增引物,一套引物针对沙门菌检测,另一套引物针对志贺菌检测。引物设计的位置和方向见图1(图1A为沙门菌,图1B为志贺菌),序列及修饰见表1。
表1引物序列及修饰
a Sal,沙门菌;Shi,志贺菌;Sal-C1*,该引物用于MCDA-LFB检测体系,在5’端标记生物素;Sal-D1*,该引物用于MCDA-LFB检测体系,在5’端标记荧光素;Shi-C2*,该引物用于MCDA-LFB检测体系,在5’端标记生物素;Shi-D2*,该引物用于MCDA-LFB检测体系,在5’端标记地高辛;
b FITC,荧光素;Dig,地高辛;
c mer,monomeric unit(单体单元);nt,nucleotide(核苷酸)。
实施例1标准MCDA-LFB检测
1.标准的MCDA反应体系
交叉引物CP1和CP2的浓度为60pmol,置换引物F1和F2的浓度为10pmol,扩增引物R1、R2、D1(D1*)和D2(D2*)的浓度为30pmol,扩增引物C1(C1*)和C2(C2*)的浓度为20pmol,10mM的Betain,6mM的MgSO4,1mM的dNTP,12.5μL的10×Bst DNA聚合酶缓冲液,10U的链置换DNA聚合酶,1μL的模板,补加去离子水至25μL。整个反应恒温在65℃1小时,80℃5min终止反应。
2.结果检测
(1)可视颜色变化法:MCDA在合成DNA的同时产生大量的焦磷酸根离子,该离子能够夺取与钙黄绿素结合的锰离子,使钙黄绿素恢复游离状态而发荧光。该发光混合物能够与反应中产生的镁离子结合,使荧光得到增强。可以通过荧光目视检测颜色变化判读结果,阳性反应管从浅灰色变为绿色,阴性反应保持浅灰色不变,参见图3A和图3B。图3A表示针对沙门菌的MCDA引物的验证,图3A1表示阳性扩增(反应管中加入10pg的沙门菌模板,作为阳性对照),A2表示阴性扩增(反应管中加入10pg的志贺菌模板,测定是否存在交叉反应),A3表示阴性扩增(反应管中加入10pg的Gram-大肠杆菌模板,作为阴性对照),A4表示阴性扩增(反应管中加入10pg的Gram+李斯特菌模板,作为阴性对照),A5表示阴性扩增(1微升双蒸水代替10pg的模板,作为空白对照)。只有阳性对照出现阳性扩增,说明针对invA设计的检测沙门菌的MCDA引物可用。图3B表示针对志贺菌的MCDA引物的验证,图3B1表示阳性扩增(反应管中加入10pg的志贺菌模板,作为阳性对照),B2表示阴性扩增(反应管中加入10pg的沙门菌模板,测定是否存在交叉反应),B3表示阴性扩增(反应管中加入10pg的Gram-大肠杆菌模板,作为阴性对照),B4表示阴性扩增(反应管中加入10pg的Gram+李斯特菌模板,作为阴性对照),B5表示阴性扩增(1微升双蒸水代替10pg的模板,作为空白对照)。只有阳性对照出现阳性扩增,说明针对ipaH设计的检测志贺菌的MCDA引物可用。
(2)电泳检测法:将图3A和图3B的产物进行电泳检测,由于MCDA的扩增产物包含了许多大小不一的短片段及一系列反向重复的靶序列构成的茎环结构和多环花椰菜样结构的DNA片段混合物,电泳后在凝胶上显现不同大小区带组成的阶梯式图谱,见图3C和图3D。通过电泳检测法判读MCDA扩增结果,阳性反应出现了预期的结果,而阴性反应和空白对照未出现任何扩增条带,进一步验证了本研究所设计的MCDA引物可行,可用于靶序列扩增检测。
(3)LFB检测:将图3A和图3B的产物进行LFB检测,由于针对沙门菌检测的MCDA引物标记的半抗原为FITC,因此,当TL1和CL出现红色条带时表示为沙门菌检测阳性。由于针对志贺菌检测的MCDA引物标记的半抗原为Dig,因此,当TL2和CL出现红色条带时表示为志贺菌检测阳性。通过LFB检测法判读MCDA扩增结果,阳性反应出现了预期的结果,而阴性反应和空白对照仅出现CL红色条带,验证了本研究所设计的MCDA-LFB技术及MCDA引物可行,能够用于目的靶序列的检测(图3E和图3F)。
3.测定MCDA技术的最佳反应温度
在标准反应体系条件下,加入针对沙门菌及志贺菌DNA模板及所设计的对应MCDA引物,其模板浓度为10pg/μl。反应在恒温条件下进行(60-67℃),结果运用实时浊度仪进行检测,在不同的温度下得到不同的动态曲线图,见图4和图5。64-66℃被推荐作为两套MCDA引物的最佳反应温度。本发明中的后续验证选择65℃作为恒温条件进行MCDA扩增。图4A表示针对invA设计的检测沙门菌的MCDA引物温度动态曲线图;图4B表示针对ipaH设计的检测志贺菌的MCDA引物温度动态曲线图。
4.MCDA-LFB检测单一靶标的灵敏度
运用连续稀释好的沙门菌基因组DNA进行标准的MCDA扩增反应后,运用LFB检测显示:MCDA-LFB的检测范围为10ng~10fg,LFB在TL1和CL区域出现红色线(图5A1-A3)。当反应体系中基因组模板量降低至10fg以下时,LFB仅在CL区域出现红色线,表示阴性结果(图5A4-A5)。图5A运用LFB可视化读取MCDA扩增结果;图5A1到A5表示沙门菌的模板量为10ng、10pg、10fg、1fg和0.1fg,图5A6、A7、A8、A9分别表示志贺菌模板(10pg)、大肠杆菌模板(10pg)、李斯特菌模板(10pg)、空白对照(1微升双蒸水)。
运用连续稀释好的志贺菌基因组DNA进行标准的MCDA扩增反应后,运用LFB检测显示:MCDA-LFB的检测范围为10ng~10fg,LFB在TL2和CL区域出现红色线(图5B1-B3)。当反应体系中基因组模板量降低至10fg以下时,LFB仅在CL区域出现红色线,表示阴性结果(图5B4-B5)。图5B运用LFB可视化读取MCDA扩增结果;图5B1到B5表示志贺菌的模板量为10ng、10pg、10fg、1fg和0.1fg,图5B6、B7、B8、B9分别表示沙门菌模板(10pg)、大肠杆菌模板(10pg)、李斯特菌模板(10pg)、空白对照(1微升双蒸水)。
电泳检测法确认结果:将图5A和图5B的产物进行电泳检测,由于MCDA的扩增产物包含了许多大小不一的短片段及一系列反向重复的靶序列构成的茎环结构和多环花椰菜样结构的DNA片段混合物,电泳后在凝胶上显现不同大小区带组成的阶梯式图谱,见图5C和图5D。通过电泳检测法判读MCDA扩增结果,阳性反应出现了预期的结果,而阴性反应和空白对照未出现任何扩增条带,进一步验证了MCDA-LFB的检测灵敏度。
实施例2多重ET-MCDA反应体系:
ET-MCDA,即内切酶介导的实时多交叉置换核酸扩增技术,详见CN105755134A,本发明通过引用该专利文件,将其作为本发明公开内容的一部分。
交叉引物Sal-CP1和Sal-E-CP1的浓度为30pmol,Sal-CP2的浓度为60pmol,置换引物Sal-F1和Sal-F2的浓度为10pmol,扩增引物Sal-R1,Sal-R2,Sal-D1和Sal-D2的浓度为30pmol,扩增引物Sal-C1和Sal-C2的浓度为20pmol,交叉引物Shi-CP1和Shi-E-CP1的浓度为8pmol,Shi-CP2的浓度为16pmol,置换引物Shi-F1和Shi-F2的浓度为10pmol,扩增引物Shi-R1、Shi-R2、Shi-D1和Shi-D2的浓度为8pmol,扩增引物Shi-C1和Shi-C2的浓度为10pmol,10mM的Betain,6mM的MgSO4,1mM的dNTP,12.5μL的10×Bst DNA聚合酶缓冲液,10U的链置换DNA聚合酶,15U Nb.BsrDI的内切酶,沙门菌及志贺菌各1μL的模板,补加去离子水至25μL。整个反应恒温在65℃1小时,80℃5min终止反应。
为了实现MCDA-LFB技术同时检测多个靶标,内切酶介导的实时多重MCDA技术(ET-MCDA)被用于调节多重MCDA的反应体系。在上述描述的多重ET-MCDA扩增条件下,沙门菌和志贺菌在同一反应中能够被同时检测(图6)。图6A和图6B实时扩增曲线被同时产生,来自不同的荧光通道。此外多重ET-MCDA针对沙门菌和志贺菌的检测下限也为10fg。
实施例3多重MCDA反应体系:
1.多重MCDA反应体系
交叉引物Sal-CP1和Sal-CP2的浓度为60pmol,置换引物Sal-F1和Sal-F2的浓度为10pmol,扩增引物Sal-R1、Sal-R2、Sal-D1*和Sal-D2的浓度为30pmol,扩增引物Sal-C1*和Sal-C2的浓度为20pmol,交叉引物Shi-CP1和Shi-CP2的浓度为16pmol,置换引物Shi-F1和Shi-F2的浓度为10pmol,扩增引物Shi-R1,Shi-R2,Shi-D1和Shi-D2*的浓度为8pmol,扩增引物Shi-C1和Shi-C2*的浓度为10pmol,10mM的Betain,6mM的MgSO4,1mM的dNTP,12.5μL的10×Bst DNA聚合酶缓冲液,10U的链置换DNA聚合酶,沙门菌及志贺菌各1μL的模板,补加去离子水至25μL。整个反应恒温在65℃1小时,80℃5min终止反应。
2.MCDA-LFB同时检测多个靶标的灵敏度
为了实现MCDA-LFB能够同时检测多个靶标,首先要保证MCDA-LFB技术在扩增步骤能实现在一个反应体系中同时扩增多个目的序列。多重MCDA扩增体系与多重ET-MCDA体系相似,仅仅用相同量的Sal-CP1和Shi-CP1代替Sal-E-CP1和Shi-E-CP1,这样保证在同一反应体系中,多重MCDA体系能够同时扩增多个目的序列。
运用连续稀释好的沙门菌和志贺菌基因组DNA进行多重MCDA扩增反应后,运用LFB检测显示:MCDA-LFB技术在检测多个靶标时,检测范围仍然为10ng~10fg,LFB在TL1、TL2和CL区域出现红色线(LFB1-LFB3)。当反应体系中基因组模板量降低至10fg以下时,LFB仅在CL区域出现红色线,表示阴性结果(LFB4-LFB5)。图7运用LFB可视化读取多重MCDA扩增结果;LFB1到LFB5表示沙门菌和志贺菌的模板量为10ng、10pg、10fg、1fg和0.1fg,LFB6、LFB7、LFB8分别表示大肠杆菌模板(10pg)、李斯特菌模板(10pg)、空白对照(1微升双蒸水)。表2是本发明与其它几种检测方法的敏感性比较。
表2sMCDA-LFB、mMCDA-LFB和ET-MCDA针对invA和ipaH基因检测的敏感性比较
1sMCDA-LFB,singlex MCDA-LFB assay(单重MCDA-LFB检测);mMCDA-LFB,multiplex MCDA-LFB assay(多重MCDA-LFB检测);ET-MCDA,endonuclease restriction-mediated real-time multiple cross displacement amplification(限制性内切酶介导的实时多交叉置换扩增);LFB,lateral flow biosensors(纳米生物传感检测技术);MCDA,multiple cross displacement amplification(多交叉置换扩增)。
3.测定MCDA-LFB技术的最佳反应时间
在多重反应体系条件下,同时加入针对沙门菌及志贺菌所设计的对应的两套MCDA引物,运用连续稀释好的沙门菌和志贺菌基因组DNA作为模板。反应在恒温条件下进行(65℃),恒温时间分别10分钟、20分钟、30分钟、40分钟、50分钟和60分钟。运用LFB检测显示:MCDA-LFB技术在检测多个靶标时,最佳反应时间为40分钟(图8)。当多重MCDA体系在扩增步骤恒温40分钟时,检测限水平的模板能够被检出(图8D)。图8D中,LFB检测范围为10ng~10fg,LFB在TL1、TL2和CL区域出现红色线(LFB1-LFB3)。当反应体系中基因组模板量降低至10fg以下时,LFB仅在CL区域出现红色线,表示阴性结果(LFB4-LFB5)。图8运用LFB可视化读取多重MCDA体系从10分钟到60分钟的扩增结果;LFB1到LFB5表示沙门菌和志贺菌的模板量为10ng、10pg、10fg、1fg和0.1fg,LFB6、LFB7、LFB8分别表示大肠杆菌模板(10pg)、李斯特菌模板(10pg)、空白对照(1微升双蒸水)。
实施例3.MCDA-LFB技术的特异性
以常见的致病菌及条件致病菌DNA(沙门菌、志贺菌、单增李斯特菌、霍乱弧菌、副溶血性弧菌、创伤弧菌、粪肠球菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌、肠致病性大肠杆菌、肠产毒性大肠杆菌、肠侵袭性大肠杆菌等)为模板评价MCDA-LFB技术的特异性(菌株信息详见表3)。MCDA-LFB技术能准确的鉴别沙门菌和志贺菌,说明MCDA-LFB方法的特异性良好,见图9。LFB1:阳性对照(10pg沙门菌和志贺菌模板各10pg);LFB2-16,沙门菌模板;LFB17-37,志贺菌模板;LFB38-56,非沙门菌、非志贺菌模板;LFB57,空白对照。结果表明,MCDA-LFB能够正确的检测靶序列,通过TL1和TL2可视线将不同靶序列鉴别开。
表3.菌株信息
a U,unidentified serotype(未鉴别的血清型);ATCC,American Type Culture Collection(美国模式培养物保藏中心);ICDC,National Institute for Communicable Disease Control and Prevention,Chinese Center for Disease Control and Prevention(中国疾病预防控制中心传染病预防控制所)。
- 还没有人留言评论。精彩留言会获得点赞!