一种VDR‑His融合蛋白及其DNA序列、表达和应用的制作方法
本发明属于生物技术和蛋白质工程领域,具体涉及一种VDR-His融合蛋白及其DNA序列、表达和应用。
背景技术:
维生素D(vitamin D)是人体重要的健康元素,可促进钙磷的吸收,影响骨骼的生长和代谢,特别适于中老年人缓解和预防骨质疏松症。同时,维生素D还能调节机体的免疫功能,预防和缓解免疫疾病的症状,对细胞生长也有抑制作用,因而能防癌抗癌。维生素D还可以防治心脑血管疾病的发生。因此,维生素D是机体不可缺少的活性调节因子,一般情况下,机体中维生素D的生理浓度范围应该在 30-60 ng/mL,即75-150 nmol/L。
机体内的维生素D在细胞微粒体中受25-羟化酶系统催化生成骨化二醇,经肾近曲小管细胞1-羟化酶系统催化,生成具有生物活性的骨化三醇(1, 25(OH)VD3)。活性的骨化三醇可以通过与机体细胞内的一个特殊蛋白质结合才能控制基因的表达,这个蛋白质叫做维生素D受体(vitamin D receptor,简称VDR)。因此,针对靶蛋白VDR开发了一系列维生素D类药物。这些药物用于治疗多种骨疾病如佝偻病、软骨症和骨质疏松症。近年来,这些药物也用于治疗各类甲状旁腺功能亢奋症,疗效显著。
另外,维生素D药物筛选模型是以VDR为靶点,通过药物与VDR蛋白的结合力判断药物的活力大小。目前,VDR蛋白在哺乳动物细胞内生产,通过免疫沉淀技术分离获得,这一方法产量有限,且依赖于抗体的质量,操作复杂,分离效率较低。
多聚组氨酸亲和标签肽(6×His tag)的分子量相对较小且带有电荷,几乎不影响目的蛋白的活性,其纯化产物可直接用于蛋白功能的研究。目前,我国对维生素D类药物产品的需求与维生素D类药物的研发之间存在迟缓的矛盾,加上VDR蛋白与维生素D药物的结合力可以判断药物的活性大小。因此,提供一种维生素D受体(VDR)与组氨酸标签肽(6×His tag)融合蛋白及其表达在维生素D类药物研发过程中具有重要应用价值。
技术实现要素:
本发明的目的是提供一种维生素D受体(VDR)与组氨酸标签肽(6×His tag)融合蛋白,简称VDR-His融合蛋白,可以用于维生素D药物的筛选和维生素D活性的评估,同时,本发明还提供所述融合蛋白的DNA序列及其表达系统和表达方法,可以实现体外快速分离和纯化该融合蛋白。
本发明是通过以下技术方案实现的:
一种VDR-His融合蛋白,其氨基酸序列如SEQ ID No.2所示。其中,本发明中所述的VDR-His融合蛋白的氨基酸序列为SEQ ID No.2所示的氨基酸序列或者在SEQ ID No.2所述氨基酸序列中经突变或同义氨基酸取代后的序列,且这些序列与SEQ ID No.2所示的序列有相同功能,即实现VDR-His融合蛋白的表达。
上述VDR-His融合蛋白的DNA序列,其DNA序列如SEQ ID No.1所示。其中,本发明中所述的VDR-His融合蛋白DNA序列指上述SEQ ID No.1所述整个DNA 序列,或者是不包含扩增引物的序列,或者所述VDR-His融合蛋白在SEQ ID No.1所示DNA序列中添加、取代、插入或缺失一个或一个以上核苷酸生成的突变体或等位基因或衍生物,且这些序列是与SEQ ID No.1所示的序列具有编码相同功能蛋白的DNA序列。
一种含有上述VDR-His融合蛋白的DNA序列的表达载体。
优选地,上述表达载体为真核表达载体。
更优选地,上述真核表达载体为pcDNA3.1/His质粒。
一种含有上述VDR-His融合蛋白的DNA序列或含有上述表达载体的宿主菌。
优选地,上述宿主菌为大肠杆菌。
一种上述的VDR-His融合蛋白的表达方法,包括以下步骤:
(1)设计扩增人VDR的 cDNA序列的上、下游引物,通过PCR扩增程序获得人VDR的cDNA片段;
(2)利用重组技术将人VDR的cDNA片段与6×His tag的cDNA实现连接,其间插入12个甘氨酸cDNA序列,构建真核表达载体;
(3)将步骤(2)得到的表达载体转染到真核细胞中进行表达、纯化。
上述VDR-His融合蛋白的表达方法中步骤(2)所述的表达载体为pcDNA3.1/His质粒。
一种上述VDR-His融合蛋白在维生素D药物的筛选、活性评估的应用。因为本发明所制备的VDR-His融合蛋白具有维生素D药物诱导的基因转录活性,可以用于研究维生素D类药物与受体蛋白的相互作用,进而应用于维生素D药物筛选和活性评估方面的应用。
本发明的优点:
本发明提供的表达系统及VDR-His融合蛋白的表达方法能够成功实现VDR-His融合蛋白的表达,并利用His标签肽与镍离子的结合特性,在体外可以快速分离和制备VDR-His融合蛋白。同时,本发明所制备的VDR-His融合蛋白具有维生素D药物诱导的基因转录活性,可以用于研究维生素D类药物与受体蛋白的相互作用,进而应用于维生素D药物筛选和研发领域,以及保健品或食物、药物中维生素D活性的评估方面,在实际中有较好的应用价值。
附图说明
图1 VDR-His融合蛋白序列连接于pcDNA3.1/His质粒中的示意图。A为pcDNA3.1/VDR-His的示意图,B为VDR-His融合蛋白表达盒(expression cassette)的示意图,其中明示出了VDR与His标签肽的相关位置(从左至右依次为CMV 启动子(PCMV)、维生素D受体(VDR)、12个甘氨酸序列(Gly12)、组氨酸标签肽(6×His tag)、PolyA结构(PolyA))。
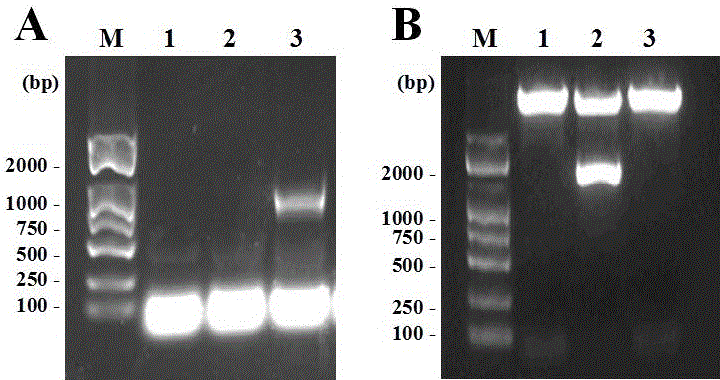
图2 对本发明的pcDNA3.1/VDR-His真核表达载体进行PCR和双酶切验证的结果示意图。A,菌液PCR鉴定结果(M:DL2000;1和2是阴性克隆;3为阳性克隆);B,载体双酶切鉴定结果(M:DL2000;1为Hind III单酶切;2为Hind III和EcoR I双酶切;3为EcoR I单酶切)。
图3 VDR融合蛋白表达效率检测。
图4 表达VDR-His融合蛋白的HEK293细胞经活性1, 25(OH)VD3处理后的qPCR分析图。
图5 利用稳定表达VDR-His融合蛋白的HEK293细胞测定两种维生素D药物中的维生素D生物活性的分析结果图(横坐标1~5分别为0、0.01、0.1、1、10 nM的药物处理浓度;纵坐标是CYP24A1的相对表达量)。
具体实施方式
下面结合实施例对本发明进行详细地说明。下述实施例中的实验方法,如无特殊说明,均为现有技术中的常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。
实施例1
1. 获得人VDR的cDNA片段
(1)设计扩增人VDR的cDNA序列的的上、下游引物
上游引物:(带有Hind III酶切位点以及Kozak序列)5’-CGATGCAAGCTTCGCCACCATGGAGTGGAGGAATAAGAAAAGGAG-3’,其中,斜体加粗部分为Hind III酶切位点,有下划线的部分为Kozak序列;
下游引物:(带有EcoR I酶切位点,为了与His序列融合表达,VDR去掉终止密码子,加入12个甘氨酸残基序列(Gly12),以保护VDR的功能不受影响)5’-ATATTAGAATTCTCCTCCTCCTCCTCCTCCTCCTCCTCCTCCTCCTCCGGAGATCTCATTGCCAAACACTTC-3’,其中,斜体加粗部分为EcoRI酶切位点,有下划线的部分为12个甘氨酸残基序列;
(2)通过PCR扩增程序获得人VDR的cDNA片段
PCR扩增程序为:95℃预变性10 min,95℃变性30 s,60℃退火60 s,55℃延伸2 min,循环30次,72℃延伸10 min,16℃保存。
得到人VDR的cDNA片段,产物长度约为1480 bp。
2. pcDNA3.1/VDR-His真核表达载体的构建
利用重组技术将人VDR的cDNA片段与6×His tag的cDNA实现连接,其间插入12个甘氨酸cDNA序列,构建pcDNA3.1/VDR-His真核表达载体,具体操作如下:
(1)线性化pcDNA 3.1/His载体:对pcDNA 3.1/His载体进行EcoR I和Hind III双酶切,并将酶切产物进行胶回收,备用;
(2)双酶切人VDR的cDNA序列:对PCR扩增获得的人VDRcDNA片段进行EcoR I和Hind III双酶切,并将酶切产物进行胶回收,备用;
(3)连接:将(1)和(2)得到的产物按照1:5的比例混合后,在16 ℃的条件下,过夜连接;
(4)转化:将(3)获得的连接产物转化DH5α感受态,转化的菌液均匀涂布于含100 mg/L氨苄霉素的LB平板上进行筛选,挑取单克隆,经菌液PCR及质粒双酶切鉴定后,委托Invitrogen公司测序。
验证正确的克隆即为所要获得的pcDNA3.1/VDR-His真核表达载体。只有经过真核细胞表达,能得到VDR-His融合蛋白的载体,才能说明其是能够产生VDR-His融合蛋白的真核表达载体。
其中,图1为VDR-His融合蛋白DNA序列连接于pcDNA3.1/His质粒中的示意图。A为pcDNA3.1/VDR-His的示意图,B为VDR-His融合蛋白表达盒的示意图,其中明示出了VDR与His标签肽的相关位置:从左至右依次为CMV 启动子(PCMV)、维生素D受体(VDR)、12个甘氨酸序列(Gly12)、组氨酸标签肽(6×His tag)、PolyA结构(PolyA)。
图2为对本实施例的pcDNA3.1/VDR-His真核表达载体进行双酶切验证的结果示意图。A,菌液PCR鉴定结果(M:DL2000;1和2是阴性克隆;3为阳性克隆);B,载体双酶切鉴定结果(M:DL2000;1为Hind III单酶切;2为Hind III和EcoRI双酶切;3为EcoRI单酶切)。
由图1、图2可以看出,本发明提供的pcDNA3.1/VDR-His真核表达载体构建成功。
本发明还提供一种宿主菌,即含有上述真核表达载体pcDNA3.1/VDR-His的大肠杆菌。用于外源DNA序列,比如本实施例中VDR-His融合蛋白的DNA序列的保存、分子克隆、质粒提取和蛋白质表达等方面。
实施例2
VDR-His融合蛋白具有镍离子结合活性的验证实验
(1)传代培养真核细胞12 h,本实施例选用HEK293细胞,用质粒转染技术将实施例1构建好的真核表达载体pcDNA3.1/VDR-His转入HEK293细胞内;
(2)用含G418的培养液培养步骤(1)所得的细胞48 h,至细胞密度达到培养瓶的90%;
(3)配制细胞裂解液,各成分及含量为:2 M HEPES(pH 7.0)200 μl,4 M NaCl 500 μl,DTT 3 μl,Brij 100 μl,PMSF 200 μl,H2O 19 ml,混合即可。取配制好的该细胞裂解液2mL,加入步骤(2)的培养瓶中,用超声波破碎细胞,超声时每次10 s,共20次;离心,收集上清液,因为碱性有利于His标签肽与镍离子的结合,所以再加入100 μL细胞蛋白提取液,即100 μL pH=8.0的1M Tris-HCl Buffer到上清液中;
(4)分离纯化:在空镍柱中缓慢滴加300 μL Ni-NTA Agarose的镍填料,待其完全沉淀后,再用2 ml的AT Buffer 平衡柱子1 h,加2 ml细胞蛋白提取液,即2 mL pH=8.0的1M Tris-HCl Buffer 到镍柱中,待样液流过柱子后,用2 ml 的AT buffer清洗柱子。随后用1 ml的Salt Washing Buffer清洗柱子,去除非特异性结合蛋白。最后,用300 μl的Elution Buffer洗脱特异性结合的VDR-His融合蛋白;
(5)纯化目标蛋白的鉴定:用SDS-PAGE分离细胞蛋白提取液和纯化的融合蛋白样品,按蛋白质免疫印迹技术鉴定融合蛋白上的VDR蛋白和His标签肽。VDR蛋白的鉴定使用VDR抗体,His标签肽的鉴定使用His标签肽抗体。
结果如图3所示,说明该表达系统成功生产了VDR-His融合蛋白。经表达后产生的VDR-His融合蛋白的DNA序列如SEQ ID No.1所示,氨基酸序列如SEQ ID No.2所示。也说明了实施例1构建的pcDNA3.1/VDR-His真核表达载体含有VDR-His融合蛋白的DNA序列,转染到真核细胞中进行表达后可以产生VDR-His融合蛋白。同时,利用融合蛋白的镍离子结合活性,可以实现VDR-His融合蛋白的快速分离与纯化。
图3为VDR-His融合蛋白的表达效率检测结果图。在转染质粒48 h后收集HEK293的总蛋白,验证了VDR融合蛋白的表达效率。结果显示,在经His和VDR抗体孵育后,可分别检测出VDR和His蛋白的表达。同时,在pcDNA3.1/VDR-His转染组中VDR蛋白表达显著增加(P<0.05)。说明该真核表达载体pcDNA3.1/VDR-His可增强VDR融合蛋白的表达量。同时,利用His标签肽的镍离子结合作用,可对VDR-His融合蛋白进行快速有效的分离和纯化。
实施例3
VDR-His融合蛋白具有维生素D药物诱导的基因转录活性的验证实验
(1)传代培养真核细胞12 h,本实施例选用HEK293细胞,用质粒转染技术将实施例1构建好的真核表达载体pcDNA3.1/VDR-His转入HEK293细胞内;
(2)用含G418的培养液培养步骤(1)所得的细胞48 h,至细胞密度达到培养瓶90%;
(3)用含有0、0.01、0.1、1、10 nM的活性1, 25(OH)VD3培养基处理稳定表达VDR-His融合蛋白的HEK293细胞,连续孵育12 h后收集总mRNA,进行qPCR分析。
结果如图4所示,1 nM的活性1, 25(OH)VD3能显著增加VDR下游基因CYP24A1基因的表达量(P<0.05),说明VDR-His融合蛋白能够有效应答活性1, 25(OH)VD3的处理,激活下游靶基因CYP24A1基因的表达,证明VDR-His融合蛋白具有维生素D药物的基因转录活性。
实施例4
VDR-His融合蛋白可用于维生素D类药物的筛选的验证实验
(1)传代培养真核细胞12 h,本实施例选用HEK293细胞,用质粒转染技术将实施例1构建好的真核表达载体pcDNA3.1/VDR-His转入HEK293细胞内;
(2)用含G418的培养液培养步骤(1)所得的细胞48 h,至细胞密度达到培养瓶90%;
(3)用活性1, 25(OH)VD3和两种维生素D药物(药物A为O2C3,药物B为MART-10)处理稳定表达VDR-His融合蛋白的细胞,连续孵育12 h后收集总mRNA,进行qPCR分析,以活性1, 25(OH)VD3的处理为阳性对照。
结果如图5所示,可以看出,含有真核表达载体pcDNA3.1/VDR-His的细胞模型能够响应活性1, 25(OH)VD3的药物处理,并在一定的药物浓度范围内,CYP24A1的表达呈上升趋势。由实施例3已经证明该VDR-His融合蛋白具有维生素D药物的基因转录活性,因此根据VDR靶基因CYP24A1的相对表达量可以反映出维生素D药物的生物活性,可用于维生素D药物的筛选和鉴别工作。从结果可知,两种维生素D药物的处理结果略有差异,说明不同药物中维生素D的活性与药物种类有关。
SEQUENCE LISTING
<110> 陕西理工学院
<120> 一种VDR-His融合蛋白及其DNA序列、表达方法和应用
<130> 2016
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 1641
<212> DNA
<213> 人工序列
<400> 1
aagcttcgcc accatggagt ggaggaataa gaaaaggagc gattggctgt cgatggtgct 60
cagaactgct ggagtggagg aagcctttgg gtctgaagtg tctgtgagac ctcacagaag 120
agcacccctg ggctccactt acctgccccc tgctccttca gggatggagg caatggcggc 180
cagcacttcc ctgcctgacc ctggagactt tgaccggaac gtgccccgga tctgtggggt 240
gtgtggagac cgagccactg gctttcactt caatgctatg acctgtgaag gctgcaaagg 300
cttcttcagg cgaagcatga agcggaaggc actattcacc tgccccttca acggggactg 360
ccgcatcacc aaggacaacc gacgccactg ccaggcctgc cggctcaaac gctgtgtgga 420
catcggcatg atgaaggagt tcattctgac agatgaggaa gtgcagagga agcgggagat 480
gatcctgaag cggaaggagg aggaggcctt gaaggacagt ctgcggccca agctgtctga 540
ggagcagcag cgcatcattg ccatactgct ggacgcccac cataagacct acgaccccac 600
ctactccgac ttctgccagt tccggcctcc agttcgtgtg aatgatggtg gagggagcca 660
tccttccagg cccaactcca gacacactcc cagcttctct ggggactcct cctcctcctg 720
ctcagatcac tgtatcacct cttcagacat gatggactcg tccagcttct ccaatctgga 780
tctgagtgaa gaagattcag atgacccttc tgtgacccta gagctgtccc agctctccat 840
gctgccccac ctggctgacc tggtcagtta cagcatccaa aaggtcattg gctttgctaa 900
gatgatacca ggattcagag acctcacctc tgaggaccag atcgtactgc tgaagtcaag 960
tgccattgag gtcatcatgt tgcgctccaa tgagtccttc accatggacg acatgtcctg 1020
gacctgtggc aaccaagact acaagtaccg cgtcagtgac gtgaccaaag ccggacacag 1080
cctggagctg attgagcccc tcatcaagtt ccaggtggga ctgaagaagc tgaacttgca 1140
tgaggaggag catgtcctgc tcatggccat ctgcatcgtc tccccagatc gtcctggggt 1200
gcaggacgcc gcgctgattg aggccatcca ggaccgcctg tccaacacac tgcagacgta 1260
catccgctgc cgccacccgc ccccgggcag ccacctgctc tatgccaaga tgatccagaa 1320
gctagccgac ctgcgcagcc tcaatgagga gcactccaag cagtaccgct gcctctcctt 1380
ccagcctgag tgcagcatga agctaacgcc ccttgtgctc gaagtgtttg gcaatgagat 1440
ctccggagga ggaggaggag gaggaggagg aggaggagga gaattctgca gatatccagc 1500
acagtggcgg ccgctcgagt ctagagggcc cttcgaacaa aaactcatct cagaagagga 1560
tcatctgaat atgcataccg gtcatcatca ccatcaccat tgagtttaaa cccgctgatc 1620
agcctcgact gtgccttcta g 1641
<210> 2
<211> 528
<212> PRT
<213> 人工序列
<400> 2
Met Glu Trp Met Lys Lys Arg Ser Asp Trp Leu Ser Met Val Leu Arg
1 5 10 15
Thr Ala Gly Val Glu Glu Ala Phe Gly Ser Glu Val Ser Val Arg Pro
20 25 30
His Arg Arg Ala Pro Leu Gly Ser Thr Tyr Leu Pro Pro Ala Pro Ser
35 40 45
Gly Met Glu Ala Met Ala Ala Ser Thr Ser Leu Pro Asp Pro Gly Asp
50 55 60
Phe Asp Arg Asn Val Pro Arg Ile Cys Gly Val Cys Gly Asp Arg Ala
65 70 75 80
Thr Gly Phe His Phe Asn Ala Met Thr Cys Glu Gly Cys Lys Gly Phe
85 90 95
Phe Arg Arg Ser Met Lys Arg Lys Ala Leu Phe Thr Cys Pro Phe Asn
100 105 110
Gly Asp Cys Arg Ile Thr Lys Asp Asn Arg Arg His Cys Gln Ala Cys
115 120 125
Arg Leu Lys Arg Cys Val Asp Ile Gly Met Met Lys Glu Phe Ile Leu
130 135 140
Thr Asp Glu Glu Val Gln Arg Lys Arg Glu Met Ile Leu Lys Arg Lys
145 150 155 160
Glu Glu Glu Ala Leu Lys Asp Ser Leu Arg Pro Lys Leu Ser Glu Glu
165 170 175
Gln Gln Arg Ile Ile Ala Ile Leu Leu Asp Ala His His Lys Thr Tyr
180 185 190
Asp Pro Thr Tyr Ser Asp Phe Cys Gln Phe Arg Pro Pro Val Arg Val
195 200 205
Asn Asp Gly Gly Gly Ser His Pro Ser Arg Pro Asn Ser Arg His Thr
210 215 220
Pro Ser Phe Ser Gly Asp Ser Ser Ser Ser Cys Ser Asp His Cys Ile
225 230 235 240
Thr Ser Ser Asp Met Met Asp Ser Ser Ser Phe Ser Asn Leu Asp Leu
245 250 255
Ser Glu Glu Asp Ser Asp Asp Pro Ser Val Thr Leu Glu Leu Ser Gln
260 265 270
Leu Ser Met Leu Pro His Leu Ala Asp Leu Val Ser Tyr Ser Ile Gln
275 280 285
Lys Val Ile Gly Phe Ala Lys Met Ile Pro Gly Phe Arg Asp Leu Thr
290 295 300
Ser Glu Asp Gln Ile Val Leu Leu Lys Ser Ser Ala Ile Glu Val Ile
305 310 315 320
Met Leu Arg Ser Asn Glu Ser Phe Thr Met Asp Asp Met Ser Trp Thr
325 330 335
Cys Gly Asn Gln Asp Tyr Lys Tyr Arg Val Ser Asp Val Thr Lys Ala
340 345 350
Gly His Ser Leu Glu Leu Ile Glu Pro Leu Ile Lys Phe Gln Val Gly
355 360 365
Leu Lys Lys Leu Asn Leu His Glu Glu Glu His Val Leu Leu Met Ala
370 375 380
Ile Cys Ile Val Ser Pro Asp Arg Pro Gly Val Gln Asp Ala Ala Leu
385 390 395 400
Ile Glu Ala Ile Gln Asp Arg Leu Ser Asn Thr Leu Gln Thr Tyr Ile
405 410 415
Arg Cys Arg His Pro Pro Pro Gly Ser His Leu Leu Tyr Ala Lys Met
420 425 430
Ile Gln Lys Leu Ala Asp Leu Arg Ser Leu Asn Glu Glu His Ser Lys
435 440 445
Gln Tyr Arg Cys Leu Ser Phe Gln Pro Glu Cys Ser Met Lys Leu Thr
450 455 460
Pro Leu Val Leu Glu Val Phe Gly Asn Glu Ile Ser Gly Gly Gly Gly
465 470 475 480
Gly Gly Gly Gly Gly Gly Gly Gly Glu Phe Cys Arg Tyr Pro Ala Gln
485 490 495
Trp Arg Pro Leu Glu Ser Arg Gly Pro Phe Glu Gln Lys Leu Ile Ser
500 505 510
Glu Glu Asp His Leu Asn Met His Thr Gly His His His His His His
515 520 525
- 还没有人留言评论。精彩留言会获得点赞!