小鼠或人类的全能性干细胞quteASCs诱导及培养建系方法与流程
本发明属于动物和人类生殖与发育生物工程技术,主要涉及一种小鼠或人类的全能性干细胞quteASCs诱导及培养建系方法。
背景技术:
动物胚胎干细胞(Embryonic Stem Cells,ES)研究开始于上世纪90年代,首次在小鼠和人类获得成功,两组科学家并因此获得2009年度诺贝尔奖。动物成体细胞干细胞诱导技术(induced pluripotent stem cells,iPS)是由Takahashi和Yamanaka在2006年创立,利用Oct4,Sox2,Klf4和c-Myc四个转录因子重编程小鼠成纤维细胞,使之逆转发育为全能干细胞。总体来说,近几年各国开展的干细胞相关研究主要集中在小鼠和人类领域,小鼠模型主要是进行干细胞相关的生命科学基础研究,人类干细胞的医学应用目的非常显著。
随着动物遗传调控机制、基因编辑技术、生物个体发育等生命科学基础理论研究进展与生物工程技术的发展,动物干细胞诱导方法变的多元化和干细胞种类更加细分,但是还没有获得一种“全能性干细胞”单独或者通过嵌合体模式能够在子宫内像正常受精产生的胚胎与胎盘相结合发育到动物个体的情况。
技术实现要素:
本发明所要解决的技术问题是,提供一种小鼠和人类全能性干细胞quteASCs诱导及培养建系方法。
为了解决上述技术问题,本发明采用的技术方案是:一种小鼠或人类的全能性干细胞quteASCs诱导及培养建系方法,包括以下步骤:
1)小鼠或人类早期胚胎的准备
材料来源是3-8天的小鼠早期胚胎或3-14天的人类早期胚胎;
2)ASCs过渡型干细胞诱导建系
将步骤1)中获得小鼠胚胎或者人类早期胚胎在KSOM培养液体外培养2天后,通过用台氏酸去掉胚胎的透明带,然后把裸露的胚胎在不使用血清替代物和饲养层细胞的条件下,在N2B27基础培养液中添加碱性纤维母细胞生长因子bFGF、激活素A的AF培养液中进行干细胞诱导建系处理;
500ml ASCs干细胞诱导建系的AF培养液组成:
获得的干细胞称为ASCs过渡型干细胞;
3)quteASCs多能性干细胞诱导传代
把获得的ASCs过渡型干细胞通过Wnt基因、BMP4基因干细胞信号通路调控,进一步诱导培养获得多能性干细胞quteASCs;具体方法为:首先,在不使用血清替代物和饲养层细胞的条件下,在N2B27基础培养液中添加激活素A、BMP4、CHIR99021和LIF的ABCL培养液进行干细胞诱导,培养10-14天后ASCs细胞中开始出现绿色标记细胞GOF-GFP,把绿色细胞克隆挑出传代或者继续培养形成细胞杂合体通过流式细胞仪把绿色细胞分离纯化,在同样条件下进行干细胞培养增殖传代2-3天,用细胞消化液消化后采用同样培养液和方法继续传代20代以上;
500ml quteASCs多能性干细胞诱导的ABCL培养液组成:
所述步骤1)中,3-8天的小鼠早期胚胎来源于体外受精或者从母体子宫回收;3-14天的人类早期胚胎来源于体外受精或者从母体子宫回收。
本发明的有益效果是:实验动物、人类的干细胞研究结果显示,到目前为止还没有获得哺乳动物包括人类在内的全能性干细胞,而本发明通过特定诱导方法成功获得了小鼠和人类新型干细胞quteASCs,并通过实验手段验证了其向动物个体组织及其胎盘发育的全能性。
附图说明
图1是本发明的第一步诱导建立过度型干细胞ASCs技术流程。
图2是本发明的第二步进一步诱导完成新型多能型干细胞quteASCs建系技术流程。
图3显示了ESCs与quteASCs基因表达差别图。
图4通过4N补偿技术(4倍体染色体加倍胚胎)能贡献小鼠胎儿所有组织和胎儿胎盘组织的发育图。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步详细说明:
如图1-2所示,本发明材料来源是3-8天的小鼠早期胚胎(体外受精或者从母体子宫回收),3-14天的人类早期胚胎(体外受精或者从母体子宫回收)。诱导方法包括两个关键技术流程:第一步诱导建立过度型干细胞ASCs流程(关键诱导因子:AF),第二步进一步诱导完成新型多能型干细胞quteASCs建系技术流程(关键诱导因子:ABCL)。
1、小鼠和人类早期胚胎的准备
以小鼠为模型的新型多能性干细胞诱导方法是通过公鼠和母鼠自然交配后,从母体小鼠子宫回收受精后3-8天的小鼠胚胎,用于以下的新型多能性干细胞诱导与培养建系。人类早期胚胎的一般通过体外受精3-5天或者人工流产14天以内胎儿获得。
2、ASCs过渡型干细胞诱导建系及培养液组成
通过上述方法回收的受精后3-8天的小鼠早期胚胎或者3-14天的人类早期胚胎在KSOM培养液体外培养2天后,通过用台氏酸去掉小鼠胚胎的透明带(zona pelucida),然后把裸露的胚胎在不使用血清替代物和饲养层细胞的条件下,在N2B27基础培养液中添加bFGF、Activin A的特定培养液(AF培养液)进行干细胞诱导建系处理。
ASCs干细胞诱导建系培养液(AF培养液)组成(总体积为500ml):
这个阶段获得的干细胞称为ASCs(advanced stem cells,具有干细胞自我复制功能的过渡型干细胞)。形态特点:与EpiSCs相似,基因表达特点:Oct4(基因水平有表达,虽然有GOF-GFP标记,但是,在ASC阶段Oct4驱动的GOF-GFP显阴性)、Nanog和Sox2等多能性基因表达水平很低;此外,内胚层特异性基因blimp1、Gata4和Gata6的表达水平很高。
3、quteASCs新型多能性干细胞诱导传代及培养液组成
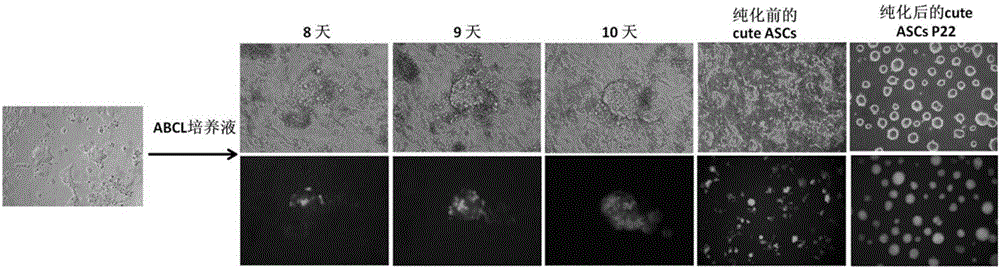
把获得的ASCs过渡型干细胞通过Wnt基因、BMP4基因干细胞信号通路调控,进一步诱导培养获得新型多能性干细胞quteASCs。具体方法为:首先,在不使用血清替代物和饲养层细胞的条件下,在N2B27基础培养液中添加Activin A、BMP4、CHIR99021和LIF的特定培养液(ABCL培养液)进行干细胞诱导。在此条件下培养10-14天后ASCs细胞中开始出现绿色标记细胞(GOF-GFP),把绿色细胞克隆挑出传代或者继续培养形成细胞杂合体通过流式细胞仪把绿色细胞分离纯化,在同样条件下进行干细胞培养增殖传代(2-3天),用Accutase(细胞消化液)消化后采用同样的培养液和方法继续传代20代以上。
quteASCs新型多能性干细胞诱培养液(ABCL培养液)组成(总体积为500ml):
ASCs细胞培养到ABCL培养液的主要目的是激活Wnt基因(胚胎3个胚层进一步分化的信号调控通路)和BMP4(胚胎中胚层进一步分化的信号通路)信号通路。新型多能性干细胞quteASCs的形态特点:类似ESCs;基因表达特点:常规干细胞特异性基因(Oct4、Nanog和Sox2)与ESCs表达水平基本相同,但是中胚层相关特异性基因(T和Sox17)表达水平显著高于ESCs。
4、新型多能性干细胞quteASCs特性及发育潜能分析
嵌合体形成能力:通过显微操作方法把10-15个quteASCs干细胞注射到2N(二倍体)小鼠囊胚腔中,与常规干细胞相同具有与正常胚胎形成嵌合、并且能够进行生殖嵌合与传代,但是与常规干细胞相比能够明显贡献胎盘组织的形成。形成个体的发育潜能:通过4N补偿技术(4倍体染色体加倍胚胎),能贡献小鼠胎儿所有组织并支撑胎儿胎盘组织的发育,同样与常规干细胞相比能够明显贡献胎盘组织的形成。
5、干细胞冷冻保存及冷冻液组成
不论是建系传代的过渡型ASCs和quteASCs新型全能性干细胞的基础冷冻液均为百分之九十的血清替代物加百分之十的二甲基亚砜,细胞密度为每毫升5-10万个细胞,按照这个密度先把干细胞样品放到-80℃低温冰箱静置12小时,然后移入液氮中长期保存。
实施例1:小鼠新型全能性干细胞(quteASCs)诱导及建系结果
1、小鼠早期胚胎的准备
通过自然交配和手术方法获取小鼠胚胎,分别从处理的母体小鼠子宫回收受精后3.5和6.5天的50个早期胚胎(为了合理安排每次实验时间,一般上午回收早期胚胎,根据受精时间推算正好是3.5天和6.5天),用于新型干细胞诱导与培养建系。
2、ASCs过渡型干细胞诱导建系
将把上述方法获得3.5天的小鼠囊胚在KSOM培养液体外培养2天后,用用台氏酸去除透明带后接种到Fibronectin(纤维连接蛋白)(纤维连接蛋白用磷酸盐缓冲液稀释成1:60的工作液)处理的24孔板中,用AF培养液进行培养建系。按照上述培养方法,从50个3.5天的小鼠囊胚中可建系获得ASCs干细胞系25个。这些新型干细胞的形态与EpiSCs相似,表达干细胞特异性基因Oct4、Nanog和Sox2等基因表达水平很低;而内胚层特异性基因blimp1、Gata4和Gata6的表达水平显著高于ESCs。回收6.5天的小鼠胚胎后将把胚胎的外胚层(Epiblast)和胚外外胚层(extra-embryonic ectoderm)用细的玻璃针切开分离后把外胚层(Epiblast)的部分培养到Fibronectin处理的24孔板中,用AF培养液进行培养建系。
3、quteASCs新型多能性干细胞诱导方法
把获得的25个ASCs培养到ABCL培养液(激活Wnt和BMP4信号通路),在此条件下培养10-14天后ASCs细胞中开始出现绿色标记细胞(GOF-GFP),然后用机械方法把绿色细胞克隆挑出传代、或者继续培养形成细胞杂合体通过流式细胞仪把绿色细胞分离纯化,在同样条件下进行干细胞培养增殖传代(2-3天),用Accutase(细胞消化液)消化后能稳定传代20代以上(12孔板)。用上述方法获得quteASCs干细胞系6个(雌3个、雄3个)。形态特点类似ESCs,常规干细胞特异性基因(Oct4、Nanog和Sox2)与ESCs表达水平基本相同,但是中胚层相关特异性基因(T和Sox17)表达水平显著高于ESCs(见图3,显示了ESCs与quteASCs基因表达差别)。
4、新型干细胞特性及发育潜能分析
通过显微操作方法把quteASCs干细胞注射到2N小鼠囊胚(2倍体正常胚胎)后能形成胚胎嵌合体,并且能够进行生殖嵌合与传代(表1、表2),同时具有通过4N补偿技术(4倍体染色体加倍胚胎)能贡献小鼠胎儿所有组织和胎儿胎盘组织的发育(图4)。
表1、通过显微操作方法把15个quteASCs干细胞注射到每个2N小鼠囊胚(2倍体正常胚胎)后能形成胚胎嵌合体,并且能够进行生殖嵌合与传代。
表2、通过显微操作方法把1个quteASCs干细胞注射到每个2N小鼠囊胚(2倍体正常胚胎)后能形成胚胎嵌合体,并且能够进行生殖嵌合与传代
实施例2:人类新型全能性干细胞(quteASCs)诱导及建系结果
1、人类早期胚胎的准备
从体外受精获得3.5天的10个早期胚胎用于新型干细胞诱导与培养建系实验。
2、ASCs过渡型干细胞诱导建系
将把上述方法获得3.5天的人类早期胚胎在KSOM培养液体外培养2天后,用用台氏酸去除透明带后接种到Fibronectin(纤维连接蛋白)(纤维连接蛋白用磷酸盐缓冲液稀释成1:60的工作液)处理的24孔板中,用AF培养液进行培养建系。按照上述培养方法,从10个3.5天的人类早期胚胎建系获得ASCs干细胞系6个。这些新型干细胞的形态与EpiSCs相似,表达干细胞特异性基因Oct4、Nanog和Sox2等基因表达水平很低;而内胚层特异性基因blimp1、Gata4和Gata6的表达水平显著高于ESCs。
3、quteASCs新型多能性干细胞诱导方法
把获得的6个ASCs培养到ABCL培养液(激活Wnt和BMP4信号通路),在此条件下培养10-14天后把细胞克隆挑出传代,在同样条件下进行干细胞培养增殖传代(2-3天),用Accutase(细胞消化液)消化后能稳定传代20代以上(12孔板)。用上述方法获得quteASCs干细胞系2个。形态特点和基因表达类似。
以上所述的实施例仅用于说明本发明的技术思想及特点,其目的在于使本领域内的技术人员能够理解本发明的内容并据以实施,不能仅以本实施例来限定本发明的专利范围,即凡本发明所揭示的精神所作的同等变化或修饰,仍落在本发明的专利范围内。
- 还没有人留言评论。精彩留言会获得点赞!