一种利用芽孢杆菌HS17发酵生产胶原蛋白酶的方法及其应用与流程
本发明涉及一种利用芽孢杆菌HS17发酵生产胶原蛋白酶的方法,及其在胶原蛋白多肽制备中的应用,属于生物技术领域。
背景技术:
胶原蛋白具有独特的超螺旋结构(3 条 α肽链的右手螺旋),性质稳定,一般加工温度及短时间加热都不能使其分解,不易被人体吸收利用。而将胶原蛋白水解为胶原多肽,具有易吸收、抗溃疡、抗过敏、降血压、抗菌、抗氧化、降胆固醇、抗衰老、促进伤口愈合、预防骨质疏松及关节炎、促进角膜上皮损伤修复等多种生理活性,使得胶原多肽成为水产加工副产物高值化利用的研究热点。
胶原蛋白酶是一种水解天然胶原的蛋白水解酶,能在生理 pH 和温度条件下特异性地水解天然胶原蛋白的三维螺旋结构,而不损伤其它蛋白质和组织。胶原蛋白酶的降解活力、稳定性等因素成为高效利用胶原蛋白关键。微生物源胶原蛋白酶是某些微生物在特定环境下分泌的具有降解胶原能力的蛋白酶类,微生物来源的胶原蛋白酶主要是细菌胶原酶,目前研究最多的微生物胶原蛋白酶来源为溶组织梭状芽孢杆菌(Clostridium histolyticum),但其为病原菌,伴有毒素产生,并非理想的胶原酶来源。
基于目前水产加工企业产生大量鱼皮下脚料的现状,本发明是在获得一株促进海马健康养殖的芽孢杆菌(发明专利CN 104232541 A)的基础上,该菌株为益生菌,经培养特性研究发现该菌株也高产胶原蛋白酶,确定其产胶原蛋白酶的培养方法,并以此转化底物胶原蛋白生产胶原蛋白多肽,实现鱼皮等下脚料的高值化利用。
技术实现要素:
本发明针对上述技术存在的不足,提供一种利用芽孢杆菌HS17发酵生产高活性胶原蛋白酶的培养方法及其应用,以解淀粉芽孢杆菌HS17为出发菌株,经液体发酵的方法生产胶原蛋白酶,该酶可通过高效水解胶原蛋白来生产胶原蛋白多肽。
本发明所用的菌株为解淀粉芽孢杆菌HS17,其在添加明胶的培养平板上能产生较大的降解圈(附图1),具有高产胶原蛋白酶的,其保藏名称为:HS17,保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,保藏日期:2014年8月20日,保藏号为CGMCC No.9532,分类命名:解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
本发明是通过如下技术方案来实现的:
1.菌种活化
取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl,1 g/L K2HPO4,0.4 g/L MgSO4,0.2 g/L MnSO4,pH7.2。
2.摇瓶培养发酵生产胶原蛋白酶
采用优选发酵培养基:2~4 g/L明胶, 40~50 g/L果糖, 3~6 g/L酵母浸粉,3~5 g/L ZnSO4, 3~4 g/L MnSO4, 2~4 g/L FePO4.2H2O, 5~6 g/L (NH4)2SO4, 3~5 g/L Na2HPO4, 4~6 g/L K2HPO4,初始pH 6~7,每500 mL三角烧瓶中分装50~100 mL发酵培养基,115℃灭菌20 min。
按照3~6%(v/v)的接种量接入活化的种子活化液,后入200 rpm的旋转摇床中培养,控制温度为温度30~33℃,发酵36~48 h后培养完毕,测定胶原蛋白酶活力。发酵液经8000r/min离心6 min,去除菌体后收集保留上清液,然后再经0.22 um的微孔过滤膜过滤除菌,即作为液体酶使用。
3. 发酵罐培养发酵生产胶原蛋白酶
以70%比例装入发酵培养组分,经118℃蒸汽灭菌20min后,火焰圈保护条件下按照3~6%(v/v)的比例接入活化的菌种,通过调节酸碱蠕动泵控制发酵过程中的pH始终维持在pH 6~7,利用发酵罐的加热装置调节培养温度在30~33℃,溶解氧参数通过调节进罐的无菌空气量和搅拌转速的大小使其始终维持在6%以上。经发酵30~42 h后发酵完毕,测定胶原蛋白酶活力。发酵液经8000 r/min离心6 min,去除菌体后收集保留上清液,然后再经0.22um的微孔过滤膜过滤除菌,即作为液体酶使用。所用的优化培养基:2~4 g/L明胶, 40~50 g/L果糖, 3~6 g/L酵母浸粉,3~5 g/L ZnSO4, 3~4 g/L MnSO4, 2~4 g/L FePO4.2H2O, 5~6 g/L (NH4)2SO4, 3~5 g/L Na2HPO4, 4~6 g/L K2HPO4。
4. 胶原蛋白多肽的制备
一定量的鳕鱼皮胶原蛋白粉,按照1:5的比例加入磷酸缓冲液(pH 7.2)中,然后加入胶原蛋白酶液(底物与酶量比为2:1),在35℃条件下缓慢振摇反应10~20 h后终止反应。胶原蛋白水解液经90℃加热灭酶10 min,经10000 r/min离心8 min去除蛋白沉淀,在-75℃下冷冻干燥获得胶原蛋白多肽粉。
所用的胶原蛋白酶活力测定方法:1mg的鱼鳞胶原蛋白用0.5 mL磷酸缓冲液溶解(pH7.4),加入0.1ml稀释酶液,37℃反应40min。加0.5 mL三氯乙酸(10%,m/v)终止反应,再加入0.9mL乙酸缓冲液(pH5.4)和1mL茚三酮显色液混匀。100℃下水浴加热10min,冷却后用3 mL的60%%乙醇稀释,在570 nm下比色测定。
所用的酶活力测定的对照组处理:为消除干扰,首先取0.1 mL的稀释酶液在100℃下水浴煮沸10min将酶进行灭活,其余步骤同酶活力测定。
所用的酶活力计算方法:在37℃条件下以每mL酶液水解胶原蛋白每min生成1ug的甘氨酸的量为一个酶活力单位(U)。
所用的相对酶活力计算方法:每组中的样品酶活力/每组中的最大样品酶活力×100%。
本发明的有益效果在于:
(1)本发明所用的芽孢杆菌HS17是来自海马肠道的内生解淀粉芽孢杆菌,非致病菌,生产的胶原蛋白酶安全性高。
(2)培养方法切合实际,发酵条件易操作,产酶量高
采用本发明的培养方法,发酵生产的胶原蛋白酶活力值,与初期的培养方法比较,其酶产量提高了20多倍,培养方法的产量突出。
(3)利用该菌株所产胶原蛋白酶对胶原蛋白的水解效率高,用于胶原蛋白多肽的生产将具有广阔的应用前景。
附图说明
图1为芽孢杆菌HS17平板培养的明胶降解圈;
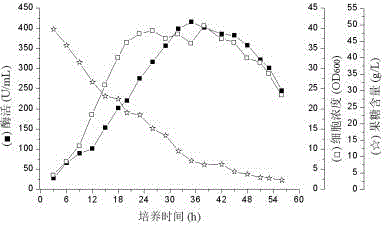
图2为芽孢杆菌HS17在发酵罐中培养曲线;
图3为酶解液的薄层层析定性分析,其中标号1为胶原蛋白,标号2为酶解液产物。
具体实施方式
以下结合具体实施例对本发明做进一步详细描述,这些实施例用于理解而不是限制本发明的保护范围。
实施例1:发酵生产胶原蛋白酶的培养基的单因素优化
(1)菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
(2)发酵优化:活化种子液按照5%(v/v)接种量接入不同的发酵培养基后,在30℃、200 rpm的摇床中发酵48 h后测定胶原蛋白酶活力。
碳源对菌株HS17产胶原蛋白酶的影响见表1,可以看出果糖作为碳源发酵生产胶原蛋白酶的效果最好,其次是葡萄糖和糊精。所用的发酵培养基(g/L):碳源20(其种类见表1),蛋白胨8,明胶5,Na2HPO4 2,K2HPO4 3,pH 7.5。
表1 碳源对菌株产胶原蛋白酶的影响
氮源对菌株产胶原蛋白酶的影响见表2,所用的发酵培养基(g/L)::果糖20,氮源8(其种类见表2),明胶5,Na2HPO4 2,K2HPO4 3,pH 7.5。在选用的有机氮源中,以酵母浸粉发酵生产胶原蛋白酶为最佳,其次为胰蛋白胨;无机氮源中,以硫酸铵为氮源时发酵生产胶原蛋白酶的效果最好,其次为氯化铵。在菌种培养前期快速利用无机氮源使得菌体大量增殖,而菌体浓度达到一定程度后,微生物体内的代谢酶系开始形成,能够缓慢利用有机氮源,并且在此阶段能够大量生产目标产物。依据氮源对芽孢杆菌HS17产胶原蛋白酶影响的结果,选取酵母粉和硫酸铵作为优选氮源。
表2 氮源对菌株产胶原蛋白酶的影响
金属盐对菌株产胶原蛋白酶的影响见表3,所用的发酵培养基(g/L):果糖20,酵母粉8,明胶5,Na2HPO4 2,K2HPO4 3,金属盐3(其种类见表3),pH 7.5。与空白相比,对胶原蛋白酶的发酵生产有正影响的为硫酸锰、硫酸锌和正磷酸铁。
表3 金属盐对菌株产胶原蛋白酶的影响
实施例2:发酵生产胶原蛋白酶的培养基的多因素优化
(1)菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
(2)发酵优化:活化种子液按照5%(v/v)接种量接入不同的发酵培养基后,在30℃、200 rpm的摇床中发酵48 h后测定胶原蛋白酶活力。根据对碳源、氮源和金属离子对芽孢杆菌HS17产胶原蛋白酶的优化结果,选取明胶、果糖、酵母浸粉、ZnSO4、MnSO4、FePO4.2H2O、(NH4)2SO4、Na2HPO4和K2HPO4进行9因素2水平的的Plackett–Burman设计优化,其因素和水平见表4,结果见表5,在第3组时获得最大胶原蛋白酶活性,为105.81 U/mL。
表4 Plackett–Burman 设计优化的因素水平
表5 Plackett–Burman 设计优化的结果
采用Design Expert软件对Plackett–Burman 设计进行优化分析,基于修正后一阶方程和回归分析结果,确定果糖、MnSO4和(NH4)2SO4是最显著因素,这意味着提高果糖、MnSO4和(NH4)2SO4浓度有利于提高胶原蛋白酶产量。采用Plackett–Burman设计优化后各因素条件,进行爬坡实验,其结果见表6。由表6可以看出,在第3组时得到最大胶原蛋白酶活力,为125.42 U/mL,因此以45 g/L果糖、3.5 g/L MnSO4和3.5 g/L (NH4)2SO4为中心点,进行中心组合设计和响应面分析优化。
表6爬坡实验设计与结果
利用 Design-Expert软件分别对果糖、MnSO4和(NH4)2SO4这3个因素进行中心组合设计,因素水平编码见表7,其中心组合设计和发酵产酶结果见表8。
表7中心组合设计的水平和编码
采用Design Expert软件对所得数据进行回归分析,编码因子A(果糖)、B(MnSO4)和C((NH4)2SO4)的二次多项回归方程:胶原酶活性(Y,U/mL)= 126.36 + 10.12A -12.88B + 8.09C - 19.36AB + 17.81AC – 1.87BC – 12.18A2 – 5.32B2 – 8.43C2;该回归模型的F=137.13,p<0.0001,表明模型显著,仅有0.01%的优化误差;失拟项F=2.10,p=0.2177>0.05,即方程模型失拟不显著,说明该方程能较好的描述各发酵条件与胶原蛋白酶活性的关系。
根据所建立的数学模型进行参数的响应面最优化分析,50 g/L果糖、3 g/L MnSO4和6 g/L (NH4)2SO4时,理论胶原蛋白酶最高活性值为170.58 U/mL。为检验方法的可靠性,采用优化发酵培养组分(g/L):明胶 3, 果糖 50, 酵母浸粉4,ZnSO4 4, MnSO4 3, FePO4.2H2O 3, (NH4)2SO4 6, Na2HPO4 4, K2HPO4 5,发酵生产胶原蛋白酶,在此条件下进行3次平行试验,实际得到胶原蛋白酶活性平均值为171.85U/mL,实际值与预测值之间的误差约为0.74%。 因此采用响应面优化菌株HS17发酵生产胶原蛋白酶的条件可靠,具有实用价值。
表8中心组合设计与结果
实施例3:发酵生产胶原蛋白酶的培养条件的单因素优化
(1)菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
(2)发酵优化:在不同接种量、初始pH、培养温度和装液量条件下,发酵48 h后测定胶原蛋白酶活力。所用发酵培养基(g/L): 明胶 3, 果糖 50, 酵母浸粉4,ZnSO4 4, MnSO43, FePO4.2H2O 3, (NH4)2SO4 6, Na2HPO4 4, K2HPO4 5。
接种量对芽孢杆菌HS17产胶原蛋白酶的影响见表9,由表9可以看出最适初始pH为4%(v/v)。发酵初始pH对芽孢杆菌HS17产胶原蛋白酶的影响见表10,在pH 6.5时获得最大产胶原蛋白酶能力。培养温度对芽孢杆菌HS17产胶原蛋白酶的影响见表11,最佳产胶原蛋白酶的培养温度为32℃。装液量对芽孢杆菌HS17产胶原蛋白酶的影响见表12,最佳装液量为100 mL/500 mL三角烧瓶。
表9 接种量对菌株HS17产胶原蛋白酶的影响
表10 初始pH对菌株HS17产胶原蛋白酶的影响
表11 培养温度对菌株HS17产胶原蛋白酶的影响
表12 装液量对菌株HS17产胶原蛋白酶的影响
实施例4:发酵生产胶原蛋白酶的培养条件的多因素优化
(1)菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
(2)发酵优化:根据单因素优化的试验结果,接种量、初始pH和培养温度对芽孢杆菌HS17产胶原蛋白酶有较大的影响。利用 Design-Expert软件对接种量、初始pH和培养温度这3个因素进行中心组合设计,因素水平编码见表13,其结果见表14。
表13中心组合设计的水平和编码
采用Design Expert软件对所得数据进行回归分析,编码因子A(接种量)、B(培养温度)和C((初始pH)的二次多项回归方程:胶原蛋白酶活性(Y,U/mL)= 263.39 + 6.98A - 11.99B - 8.95C – 25.16AB + 10.01AC – 25.03BC – 45.55A2 – 7.52B2 + 3.29C2;回归模型的F=185.90,p<0.0001,表明模型显著,仅有0.01%的优化误差;失拟项F=2.91,p=0.1331>0.05,即方程模型失拟不显著,说明该方程能较好的描述各发酵条件与胶原蛋白酶活性的关系。
根据所建立的数学模型进行参数最优化分析,接种量4.46%(v/v)、培养温度30℃和初始pH为7时,模型模拟的理论胶原蛋白酶最高活性值为268.68 U/mL。为检验方法的可靠性,采用得到的最优发酵培养组分和条件,进行发酵生产胶原蛋白酶,在此条件下进行3次平行试验,实际得到胶原蛋白酶活性平均值为267.15 U/mL,实际值与预测值之间的误差约为0.68%。 因此采用响应面优化芽孢杆菌HS17发酵生产胶原蛋白酶的条件可靠,具有实用价值。
表14中心组合设计与结果
实施例5:摇瓶发酵生产胶原蛋白酶
菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
发酵生产:采用得到的最优发酵培养组分和条件: 3 g/L明胶, 50 g/L果糖, 4 g/L酵母浸粉,4 g/L ZnSO4, 3 g/L MnSO4, 3 g/L FePO4.2H2O, 6 g/L (NH4)2SO4, 4 g/L Na2HPO4, 5 g/L K2HPO4,装液量100 mL/500 mL,接种量4.46%(v/v)、培养温度30℃和初始pH 7,进行发酵生产胶原蛋白酶,,摇床转速200 rpm,定期取样测定酶活性,在发酵42 h时获得最大酶活力,为284.71 U/mL。
实施例6:发酵罐发酵生产胶原蛋白酶
(1)对比例1
菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
发酵生产:采用得到的最优发酵培养组分和条件: 2 g/L明胶, 40 g/L果糖, 3 g/L酵母浸粉,3 g/L ZnSO4, 3 g/L MnSO4, 2 g/L FePO4.2H2O, 5 g/L (NH4)2SO4, 3 g/L Na2HPO4, 4 g/L K2HPO4。以70%比例装入发酵培养组分,经118℃蒸汽灭菌20min后,火焰圈保护条件下按照3%(v/v)的比例接入活化的菌种,通过调节酸碱蠕动泵控制发酵过程中的pH始终维持在pH 6,利用发酵罐的加热装置调节培养温度在30℃,溶解氧参数通过调节进罐的无菌空气量和搅拌转速的大小使其始终维持在6%以上,定期测定胶原蛋白酶活力,在发酵36 h时获得最大胶原蛋白酶活力为365.32 U/mL。。发酵液经8000 r/min离心6 min,去除菌体后收集保留上清液,然后再经0.22um的微孔过滤膜过滤除菌,即作为液体酶使用。
(2)对比例2
菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
发酵生产:采用得到的最优发酵培养组分和条件: 4 g/L明胶, 50 g/L果糖, 6 g/L酵母浸粉,5 g/L ZnSO4, 4 g/L MnSO4, 4 g/L FePO4.2H2O, 6 g/L (NH4)2SO4, 5 g/L Na2HPO4, 6 g/L K2HPO4。以70%比例装入发酵培养组分,经118℃蒸汽灭菌20min后,火焰圈保护条件下按照6%(v/v)的比例接入活化的菌种,通过调节酸碱蠕动泵控制发酵过程中的pH始终维持在pH 7,利用发酵罐的加热装置调节培养温度在33℃,溶解氧参数通过调节进罐的无菌空气量和搅拌转速的大小使其始终维持在6%以上,定期测定胶原蛋白酶活力,在发酵40 h时获得最大胶原蛋白酶活力为389.27 U/mL。发酵液经8000 r/min离心6 min,去除菌体后收集保留上清液,然后再经0.22um的微孔过滤膜过滤除菌,即作为液体酶使用。
(3)对比例3
菌种活化:取试管斜面保存的菌种转接活化培养基中,于37℃、200 rpm下活化18~24h至菌体混浊,制得活化种子液;所用的活化培养基:种子培养基:5 g/L葡萄糖,4 g/L牛肉膏,1 g/L明胶,3 g/L NaCl, 1 g/L K2HPO4, 0.4 g/L MgSO4, 0.2 g/L MnSO4,pH7.2。
发酵生产:采用的发酵培养组分和条件: 3 g/L明胶, 50 g/L果糖, 4 g/L酵母浸粉,4 g/L ZnSO4, 3 g/L MnSO4, 3 g/L FePO4.2H2O, 6 g/L (NH4)2SO4, 4 g/L Na2HPO4, 5 g/L K2HPO4。以70%比例装入发酵培养组分,经118℃蒸汽灭菌20min后,火焰圈保护条件下按照4.46%(v/v)的比例接入活化的菌种,通过调节酸碱蠕动泵控制发酵过程中的pH始终维持在pH 7,利用发酵罐的加热装置调节培养温度在30℃,溶解氧参数通过调节进罐的无菌空气量和搅拌转速的大小使其始终维持在6%以上。发酵液经8000 r/min离心6 min,去除菌体后收集保留上清液,然后再经0.22um的微孔过滤膜过滤除菌,即作为液体酶使用。发酵38 h时获得最大菌体浓度40.56(OD600),发酵35 h时获得最大胶原蛋白酶产量为415.39 U/mL(见附图2)。
实施例7:水解胶原蛋白制备胶原蛋白多肽
称取10 g鳕鱼皮胶原蛋白粉,按照1:5的比例加入磷酸缓冲液(pH 7.2)中,然后加入胶原蛋白酶液(底物与酶量比为2:1),在35℃条件下缓慢振摇反应20 h后终止反应。胶原蛋白水解液经90℃加热灭酶10min,经10000 r/min离心8 min去除蛋白沉淀,在-75℃下冷冻干燥获得胶原蛋白多肽粉6.12 g。由附图3可以看出,酶解胶原蛋白后产生6种以上的胶原蛋白多肽,且随着反应时间的延长,胶原多肽的产生量越多,故生产的胶原酶具有较好的胶原蛋白降解效果。
将蛋白水解液经10000r/min冷冻离心(5℃)8min,采用茚三酮显色法测定水解蛋白液中的-NH2含量,计算水解度后确定胶原蛋白的水解率为68%。所用的水解度计算方法如下:水解度(DH)=h/hb×100%,式中h为水解后每克胶原蛋白被裂解的肽键毫摩尔数,hb为每克胶原蛋白原料的肽键毫摩尔数(为8.41)。
- 还没有人留言评论。精彩留言会获得点赞!