一种含α‑芳基‑α,β‑二氨基酸酯衍生物及其合成方法和应用与流程
本发明涉及合成医药化工领域,主要涉及一种含α-芳基-α,β-二氨基酸酯衍生物及其快速、高选择性的化学合成方法和应用。
背景技术:
α-季碳手性中心氨基酸(Cα-Tetrasubstitutedα-amino acids)是构建天然产物和合成一些重要药物的中心骨架,其具有抗菌、抗肿瘤、抗癌等生物学活性,因此,对其合成方法的研究一直是天热产物研究领域和药物化学领域的热点课题。近年来,Takeo Kawabata利用Clayden酯的烯醇重排得到不对称的α-芳基氨基酸衍生物(J.Am.Chem.Soc.2013,135,13294-13297);Boris J.Nachtsheim发现炔基碘盐介导Azlactones发生炔基化反应可快速得到α-季碳手性中心氨基酸类衍生物(Org.Lett.2014,16,1326-1329)。之后陆续也有人发现了新合成方法,但这些新合成方法和路线均有步骤长、成本高、耗时长、产率低、操作及后处理烦琐等缺点,在工业化方面很难大规模的应用,经济价值有限。因此,上述方法都不利于含α-芳基-α,β-二氨基酸酯衍生物在有机合成中的应用及其工业化合成。
技术实现要素:
本发明克服了现有技术的上述缺陷,提出一种含α-芳基-α,β-二氨基酸酯衍生物及其合成方法,所述方法制备路线短、操作简单、效率高。本发明的方法以芳基重氮化合物、酰胺、亚胺为原料,在催化剂的作用下,制备得到所述含α-芳基-α,β-二氨基酸酯衍生物。相比于已报道的合成方法,本发明以廉价易得的化合物为原料,具有反应条件温和、反应路线短、反应快、成本低、废物少、操作简单、原子经济性高等特点,本发明的合成方法在药物合成领域具有广阔应用前景。
本发明提出的含α-芳基-α,β-二氨基酸酯衍生物,如式(I)所示,
其中,
Ar为芳基,选自于苯基、卤素取代的苯基、硝基取代的苯基、甲氧基取代的苯基、三氟甲基取代的苯基、C1-C10烷基取代的苯基;
R1为氢、C1-C10烷基、苯基、C1-C10烷基取代的苯基、苄基;
R2为C1-C10烷基取代的炔基、C1-C10烷基取代的烯基、C1-C10烷基;
R3为带有卤素、C1-C10烷基、硝基、甲氧基、三氟甲基、酯基的苯环,呋喃环,噻吩环,吡咯环,2-苯甲酸甲酯基。
优选地,
Ar为芳基,选自于苯基、4-氯苯基、3-氯苯基、2-氯苯基、4-硝基苯基、3-氟苯基、2-甲氧基苯基;
R1为氢、甲基、乙基、甲苯、苄基;
R2为乙炔,乙烯、甲基、乙基;
R3为4-硝基苯基、4-氟苯基、3-氟苯基、2-氟苯基、4-溴苯基、3-溴苯基、2-溴苯基、4-氯苯基、3-氯苯基、3-溴-4-氟苯基、1,2-二氯苯基、三氟甲基苯基、呋喃环、2-苯甲酸甲酯基。
进一步优选地,
Ar为芳基,选自于苯基、4-氯苯基、3-氯苯基;
R1为甲基;
R2为乙炔、乙烯、甲基、乙基;
R3为4-硝基苯基、4-氟苯基、3-溴苯基、2-溴苯基、3-溴-4氟苯基、三氟甲基苯基、呋喃环、2-苯甲酸甲酯基。
本发明提出一种含α-芳基-α,β-二氨基酸酯衍生物的合成方法,以式(1)所示芳基重氮化合物、式(2)所示酰胺、式(3)所示亚胺为原料,在有机溶剂中,在分子筛(MS)存在下和氮气保护下,在金属催化剂的作用下,经一步反应制备得到式(I)所示含α-芳基-α,β-二氨基酸酯衍生物。其中,所述方法需在无水环境下进行,分子筛的作用是除水,氮气保护下通过油泵换气,防止空气进入反应体系。
具体地,所述方法为:将式(3)所示亚胺、醋酸铑、分子筛溶于有机溶剂,配制成混合溶液A;将式(1)所示芳基重氮化合物、式(2)所示酰胺溶于有机溶剂配制成混合溶液B;将混合溶液B缓慢加入混合溶液A中;经反应、纯化得到高非对映选择性的式(I)所示含α-芳基-α,β-二氨基酸酯衍生物,所述合成反应如式(II)所示:
其中,
Ar为芳基,选自于苯基、卤素取代的苯基、硝基取代的苯基、甲氧基取代的苯基、三氟甲基取代的苯基、C1-C10烷基取代的苯基;
R1为氢、C1-C10烷基、苯基、C1-C10烷基取代的苯基、苄基;
R2为C1-C10烷基取代的炔基、C1-C10烷基取代的烯基、C1-C10烷基;
R3为带有卤素、C1-C10烷基、硝基、甲氧基、三氟甲基、酯基的苯环,呋喃环,噻吩环,吡咯环,2-苯甲酸甲酯基;
优选地,
Ar为芳基,选自于苯基、4-氯苯基、3-氯苯基、2-氯苯基、4-硝基苯基、3-氟苯基、2-甲氧基苯基;
R1为氢、甲基、乙基、甲苯、苄基;
R2为乙炔,乙烯、甲基、乙基;
R3为4-硝基苯基、4-氟苯基、3-氟苯基、2-氟苯基、4-溴苯基、3-溴苯基、2-溴苯基、4-氯苯基、3-氯苯基、3-溴-4-氟苯基、1,2-二氯苯基、三氟甲基苯基、呋喃环、2-苯甲酸甲酯基。
进一步优选地,
Ar为芳基,选自于苯基、4-氯苯基、3-氯苯基;
R1为甲基;
R2为乙炔、乙烯、甲基、乙基;
R3为4-硝基苯基、4-氟苯基、3-溴苯基、2-溴苯基、3-溴-4氟苯基、三氟甲基苯基、呋喃环、2-苯甲酸甲酯基。
本发明方法中,所述芳基重氮化合物、酰胺、亚胺和醋酸铑的投料量摩尔比为芳基重氮化合物:酰胺:亚胺:醋酸铑=1.0:0.8~1.5:1.0~1.5:0.05~0.20,优选地,芳基重氮化合物:酰胺:亚胺:醋酸铑的摩尔比为1.0:1.0:1.2:0.1。
本发明方法中,有机溶剂与芳基重氮化合物的用量比例为5mL~10mL:1mmol。优选地,有机溶剂与芳基重氮化合物的用量比例为10mL:1mmol。
本发明方法中,所述反应温度为-20~120℃。优选地,所述反应温度为25℃。
本发明方法中,所述反应时间为2~24h。优选地,所述反应时间为3~12h。
本发明方法中,所述芳基重氮化合物为芳基重氮酸酯化合物。
本发明方法中,所述有机溶剂包括二氯甲烷、三氯甲烷、甲苯、四氢呋喃、乙酸乙酯、1,2-二氯乙烷。优选地,所述有机溶剂为无水二氯甲烷。
本发明方法中,所示催化剂为金属催化剂,选自醋酸铑、或醋酸铑和手性磷酸的混合物;优选地,所述金属催化剂为醋酸铑、或以摩尔比1:10醋酸铑和手性磷酸的混合物共催化。
在一个具体实施方案中,本发明含α-芳基-α,β-二氨基酸酯衍生物的合成方法,包括以下步骤:芳基重氮化合物:酰胺:亚胺:醋酸铑=1.0:1.0:1.2:0.1摩尔比(以芳基重氮化合物用量为基准),称取原料。将亚胺、醋酸铑和分子筛溶于有机溶剂(加有机溶剂前N2保护下油泵换气),配制成混合溶液A;将芳基重氮化合物和酰胺溶于有机溶剂,配制成混合溶液B;在室温下,将混合溶液B用注射泵加入混合溶液A,同时剧烈搅拌;重氮化合物溶液滴加完毕后,室温下继续搅拌3~12小时,直至重氮酰胺化合物消耗完全;将粗产物进行柱层析(以石油醚:乙酸乙酯=10:1~5:1~3:1为洗脱剂)得到纯产品式(I)含α-芳基-α,β-二氨基酸酯衍生物。
本发明还提出了依本发明合成方法制备得到的式(I)含α-芳基-α,β-二氨基酸酯衍生物。
本发明还提出了式(I)含α-芳基-α,β-二氨基酸酯衍生物在制备抗肿瘤药物中的应用。
本发明还提出了式(I)所示含α-芳基-α,β-二氨基酸酯衍生物在制备抗结肠癌、抗肝癌药物中的应用。
本发明还提出了式(I)所示含α-芳基-α,β-二氨基酸酯衍生物在制备抗结肠癌HCT116细胞、抗肝癌BEL7402细胞、抗肝癌SMMC7721细胞药物中的应用。
本发明含α-芳基-α,β-二氨基酸酯衍生物是重要的化工和医药中间体,在医药化工领域广泛应用,具有很大应用前景。本发明的合成方法以廉价易得的化合物为原料,具有反应条件温和、反应步骤少、反应快、成本低、产生的废物少、操作简单安全、原子经济性高、选择性高等有益效果。
附图说明
图1为实施例1所得产物的1H NMR示意图。
图2为实施例1所得产物的13C NMR示意图。
图3为实施例1所得产物的HPLC图。
图4为实施例2所得产物的1H NMR示意图。
图5为实施例2所得产物的13C NMR示意图。
图6为实施例2所得产物的HPLC图。
图7为实施例3所得产物的1H NMR示意图。
图8为实施例3所得产物的13C NMR示意图。
图9为实施例3所得产物HPLC图。
图10为实施例4所得产物的1H NMR示意图。
图11为实施例4所得产物的13C NMR示意图。
图12为实施例4所得产物的19F NMR示意图。
图13为实施例4所得产物HPLC图。
图14为实施例5所得产物的1H NMR示意图。
图15为实施例5所得产物的13C NMR示意图。
图16为实施例5所得产物HPLC图。
图17为实施例6所得产物的1H NMR示意图。
图18为实施例6所得产物的13C NMR示意图。
图19为实施例6所得产物的19F NMR示意图。
图20为实施例6所得产物的HPLC图。
图21为实施例7所得产物的1H NMR示意图。
图22为实施例7所得产物的13C NMR示意图。
图23为实施例7所得产物的19F NMR示意图。
图24为实施例7所得产物的HPLC图。
图25为实施例8所得产物的1H NMR示意图。
图26为实施例8所得产物的13C NMR示意图。
图27为实施例8所得产物HPLC图。
图28为实施例9所得产物的1H NMR示意图。
图29为实施例9所得产物的13C NMR示意图。
图30为实施例9所得产物HPLC图。
图31为实施例10所得产物的1H NMR示意图。
图32为实施例10所得产物的13C NMR示意图。
图33为实施例10所得产物HPLC图。
图34为实施例11所得产物的1H NMR示意图。
图35为实施例11所得产物的13C NMR示意图。
图36为实施例11所得产物的HPLC图。
图37为实施例12所得产物的1H NMR示意图。
图38为实施例12所得产物的13C NMR示意图。
图39为实施例12所得产物的HPLC图。
图40为实施例13所得产物的1H NMR示意图。
图41为实施例13所得产物的13C NMR示意图。
图42为实施例13所得产物HPLC图。
图43为实施例14所得产物的1H NMR示意图。
图44为实施例14所得产物的13C NMR示意图。
图45为实施例14所得产物HPLC图。
图46为实施例15所得产物的1H NMR示意图。
图47为实施例15所得产物的13C NMR示意图。
图48为实施例15所得产物HPLC图。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
本发明合成含α-芳基-α,β-二氨基酸酯衍生物的制备方法,反应过程如式(II)所示:
Ar为芳基,选自于苯基、卤素取代的苯基、硝基取代的苯基、甲氧基取代的苯基、三氟甲基取代的苯基、C1-C10烷基取代的苯基;
R1为氢、C1-C10烷基、苯基、C1-C10烷基取代的苯基、苄基;
R2为C1-C10烷基取代的炔基、C1-C10烷基取代的烯基、C1-C10烷基;
R3为带有卤素、C1-C10烷基、硝基、甲氧基、三氟甲基、酯基的苯环,呋喃环,噻吩环,吡咯环,2-苯甲酸甲酯基。
实施例1
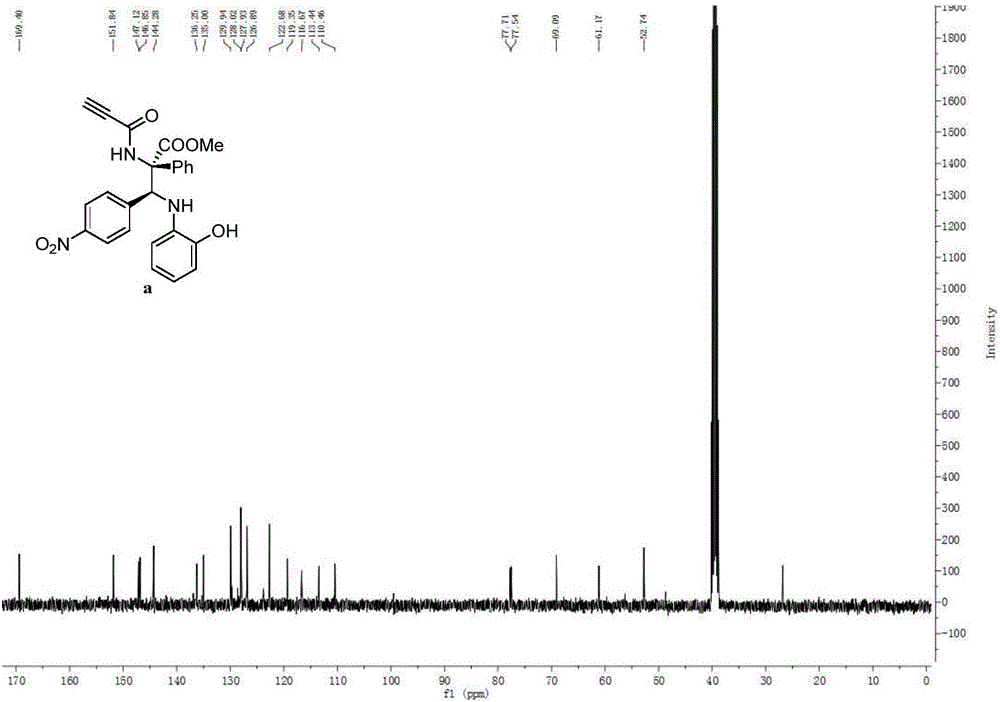
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(a)所示,为甲基(2S,3S)-3-(4-硝基苯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为87%,dr值等于89:11,HPLC纯度为96%。式(a)所示化合物的1H NMR示意图如图1所示,其13C NMR示意图如图2所示,其HPLC示意图如图3所示。
1H NMR(400MHz,DMSO)δ9.60(s,1H),9.31(s,1H),8.10(d,J=8.2Hz,2H),7.51–7.29(m,7H),6.59(d,J=7.3Hz,1H),6.45(t,J=7.2Hz,1H),6.36(t,J=7.3Hz,1H),6.25(d,J=7.2Hz,1H),5.78(d,J=7.7Hz,1H),5.60(d,J=7.7Hz, 1H),4.36(s,1H),3.57(s,3H).13C NMR(100MHz,DMSO)δ169.40,151.84,147.12,146.85,144.28,136.25,135.00,129.94,128.02,127.93,126.89,122.68,119.35,116.67,113.44,110.46,77.71,77.54,69.09,61.17,52.74.HRMS(ESI):Calcd.for C25H21N3O6Na[M+Na]+:482.1328,Found:482.1322.
实施例2
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(b)所示,为甲基(2S,3S)-3-(2-溴苯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为54%,dr值等于94:6,HPLC纯度为95%。式(b)所示化合物的1H NMR示意图如图4所示,其13C NMR示意图如图5所示,其HPLC示意图如图6所示。
1H NMR(400MHz,DMSO)δ10.03(s,1H),9.40(s,1H),7.43–7.11(m,9H),6.61(d,J=7.5Hz,1H),6.44(t,J=7.4Hz,1H),6.34(t,J=7.3Hz,1H),6.20(dd,J=12.6,8.3Hz,2H),5.29(d,J=8.5Hz,1H),4.40(s,1H),3.67(s,3H).13C NMR(100MHz,DMSO)δ168.85,151.52,144.25,136.93,136.09,135.02,131.86,129.76,129.29,128.12,127.61,127.40,127.13,126.85,119.26,116.54,113.37,110.59,77.75,77.56,67.83,61.04,52.60.HRMS(ESI):Calcd.for C25H21BrN2O4Na[M+Na]+:515.0582,Found:515.0608.
实施例3
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(c)所示,为甲基(2S,3S)-3-(3-溴苯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为70%,dr值等于95:5,HPLC纯度为97%。式(c)所示化合物的1H NMR示意图如图7所示,其13C NMR示意图如图8所示,其HPLC示意图如图9所示。
1H NMR(400MHz,DMSO)δ9.43(s,1H),9.28(s,1H),7.45–7.11(m,9H),6.59(d,J=6.9Hz,1H),6.46(t,1H),6.37(t,1H),6.27(d,J=6.9Hz,1H),5.74(d,J=6.5Hz,1H),5.39(d,J=6.5Hz,1H),4.37(s,1H),3.57(s,3H).13C NMR(100MHz,DMSO)δ169.54,151.82,151.74,144.24,144.10,141.49,136.29,135.24,131.13,130.37,129.74,127.84,127.61,127.03,121.14,119.40,116.51,113.41,110.49,77.58,69.25,61.25,52.67.HRMS(ESI):Calcd.for C25H21BrN2O4Na[M+Na]+:515.0582,Found:515.0582.
实施例4
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(d)所示,为甲基(2S,3S)-3-(4-氟苯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为93%,dr值等于90:10,HPLC纯度为99%。式(d)所示化合物的1H NMR示意图如图10所示,其13C NMR示意图如图11所示,其19F NMR示意图如图12所示,其HPLC示意图如图13所示。
1H NMR(400MHz,DMSO)δ9.32(s,1H),9.23(s,1H),7.40–7.25(m,5H),7.12(m,2H),7.04(m,2H),6.58(dd,J=7.5,1.28Hz,1H),6.45(t,J=7.1Hz,1H),6.38–6.30(t,J=7.5,1H),6.23(d,J=7.1Hz,1H),5.80(d,J=8.0Hz,1H),5.36(d,J=8.0Hz,1H),4.34(s,1H),3.59(s,3H).13C NMR(100MHz,DMSO)δ169.59,161.48(d,J=243.6Hz),151.74,144.26,136.48,135.38,134.49,130.28(d,J=8.3Hz),127.74(d,J=7.5Hz),127.14,119.33,116.33,114.45(d,J=21.2Hz),113.33,110.51,77.69,77.50,69.25,61.18,52.71.19F NMR(376MHz,DMSO)δ-115.08.HRMS(ESI):Calcd.for C25H22FN2O4Na[M+Na]+:455.1383,Found:455.1369.
实施例5
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(e)所示,为甲基(2S,3S)-3-(4-甲基苯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为78%,dr值等于89:11,HPLC纯度为99%。式(e)所示化合物的1H NMR示意图如图14所示,其13C NMR示意图如图15所示,其HPLC示意图如图16所示。
1H NMR(400MHz,DMSO)δ9.21(s,1H),9.09(s,1H),7.44–7.21(m,5H),7.01(d,J=7.7Hz,2H),6.94(d,J=7.7Hz,2H),6.58(d,J=7.4Hz,1H),6.44(t,J=7.6Hz,1H),6.33(t,J=7.4Hz,1H),6.22(d,J=7.6Hz,1H),5.90(d,J=7.8Hz,1H),5.29(d,J=7.8Hz,1H),4.34(s,1H),3.61(s,3H),2.22(s,3H).13C NMR(100MHz,DMSO)δ169.71,151.70,144.23,136.64,136.45,135.60,135.18,128.36,128.21,127.70,127.65,127.31,119.31,116.09,113.26,110.41,77.73,77.49,69.36,61.60,52.79,20.61.HRMS(ESI):Calcd.for C26H24N2O4Na[M+Na]+:451.1634,Found:451.1640.
实施例6
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(f)所示,为甲基(2S,3S)-3-(4-三氟甲基苯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为70%,dr值等于95:5,HPLC纯度为97%。式(f)所示化合物的1H NMR示意图如图17所示,其13C NMR示意图如图18所示其19F NMR示意图如图19所示,其HPLC示意图如图20所示。
1H NMR(400MHz,DMSO)δ9.46(s,1H),9.27(s,1H),7.60(d,J=7.9Hz,2H),7.34(m,7H),6.58(d,J=7.6Hz,1H),6.44(d,J=7.5Hz,1H),6.35(t,J=7.5Hz,1H),6.23(d,J=7.7Hz,1H),5.83(d,J=7.9Hz,1H),5.51(d,J=7.9Hz,1H),4.36(s,1H),3.59(s,3H).13C NMR(100MHz,DMSO)δ169.49,151.85,144.26,143.62,136.29,135.20,129.33,127.88(d,J=6.7Hz),127.01,124.54,119.35,116.49,113.39,110.35,77.65,77.61,69.19,61.26,52.75.19F NMR(376MHz, DMSO)δ-60.81.HRMS(ESI):Calcd.for C26H21F3N2O4Na[M+Na]+:505.1351,Found:505.1331.
实施例7
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(g)所示,为甲基(2S,3S)-3-(3-溴-4-氟-苯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为77%,dr值等于>95:5,HPLC纯度为99%。式(g)所示化合物的1H NMR示意图如图21所示,其13C NMR示意图如图22所示,其19F NMR示意图如图23所示其HPLC示意图如图24所示。
1H NMR(400MHz,DMSO)δ10.05(s,1H),9.41(s,1H),7.41–7.13(m,8H),6.62(d,J=7.5Hz,1H),6.44(t,J=7.3Hz,1H),6.37(t,J=7.5Hz,1H),6.15(dd,J=7.3,3.4Hz,2H),5.27(d,J=8.2Hz,1H),4.40(s,1H),3.67(s,3H).13C NMR(100MHz,DMSO)δ168.83,160.94(d,J=249.3Hz),151.59,144.30,136.07,134.89,133.44(d,J=3.3Hz),130.68(d,J=8.9Hz),128.05,127.47,127.26,126.76(d,J=9.6Hz),119.28,118.69(d,J=24.3Hz),116.71,114.96(d,J=21.1Hz),113.44,110.55,77.72,77.61,67.86,60.52,52.65.19F NMR(376MHz,DMSO)δ-112.05,-112.06.HRMS(ESI):Calcd.for C25H20FBrN2O4Na[M+Na]+:533.0488,Found:533.0514.
实施例8
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合与10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(h)所示,为甲基(2S,3S)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺-3-(噻吩-2-基)丙酸甲酯,产率为58%,dr值等于>95:5,HPLC纯度为98%。式(h)所示化合物的1H NMR示意图如图25所示,其13C NMR示意图如图26所示,其HPLC示意图如图27所示。
1H NMR(400MHz,DMSO)δ9.23(s,1H),9.21(s,1H),7.33(m,6H),6.93–6.88(m,1H),6.85(d,J=2.8Hz,1H),6.60(d,J=7.6Hz,1H),6.52(t,J=7.2Hz,1H),6.39(dd,J=11.8,7.6Hz,2H),5.73(s,2H),4.36(s,1H),3.62(s,3H).13C NMR(100MHz,DMSO)δ169.70,151.84,144.30,143.29,135.68,135.53,127.94,127.01,126.38,126.31,125.82,119.36,116.72,113.39,110.43,77.74,77.58,69.76,58.08,52.94.HRMS(ESI):Calcd.for C23H20SN2O4Na[M+Na]+:433.1041,Found:433.1042.
实施例9
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(i)所示,为甲基(2S,3S)-3-(3-呋喃-2-基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为60%,dr值等于>95:5,HPLC纯度为98%。式(i)所示化合物的1H NMR示意图如图28所示,其13C NMR示意图如图29所示,其HPLC示意图如图30所示。
1H NMR(400MHz,DMSO)δ9.45(s,1H),9.33(s,1H),7.52(s,1H),7.47–7.19(m,5H),6.67(d,J=7.5Hz,1H),6.60(t,J=7.5Hz,1H),6.53–6.42(m,2H),6.36(m,1H),6.25(d,J=3.0Hz,1H),5.48(d,J=9.7Hz,1H),5.40(d,J=9.7Hz,1H),4.39(s,1H),3.67(s,3H).13C NMR(100MHz,DMSO)δ169.61,151.69,151.47,144.39,142.39,135.84,135.40,127.63,127.57,127.09,119.38,116.92,113.59,110.81,110.22,109.07,77.81,77.28,68.41,56.74,52.64.HRMS(ESI):Calcd.for C23H20N2O5Na[M+Na]+:427.1270,Found:427.1258.
实施例10
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(j)所示,为甲基(2S,3S)-3-(2-甲酸甲酯基)-3-((2-羟基苯基)氨基)-2-苯基-2-丙炔酰胺丙酸甲酯,产率为40%,dr值等于>95:5,HPLC纯度为97%。式(j)所示化合物的1H NMR示意图如图31所示,其13C NMR示意图如图32所示,其HPLC示意图如图33所示。
1H NMR(400MHz,DMSO)δ9.95(s,1H),9.31(s,1H),7.59(d,J=7.5Hz,1H),7.51–7.41(m,1H),7.33(m,2H),7.24(m,5H),6.60(dd,J=14.5,7.6Hz,2H), 6.40(t,J=7.1Hz,1H),6.32(m,2H),5.94(d,J=8.7Hz,1H),4.35(s,1H),3.63(s,3H),3.54(s,3H).13C NMR(100MHz,DMSO)δ169.10,167.50,151.48,144.14,138.92,136.72,135.22,131.67,131.40,129.14,128.23,127.58,127.30,119.35,116.31,113.25,111.11,77.74,77.34,68.48,56.62,52.36,51.92.HRMS(ESI):Calcd.for C27H24N2O6Na[M+Na]+:495.1532,Found:495.1535.
实施例11
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(k)所示,为甲基(2S,3S)-3-(4-溴苯基)-3-((2-羟基苯基)氨基)-2-(4-氯苯基)-2-丙炔酰胺丙酸甲酯,产率为70%,dr值等于>95:5,HPLC纯度为95%。式(k)所示化合物的1H NMR示意图如图34所示,其13C NMR示意图如图35所示,其HPLC示意图如图36所示。
1H NMR(400MHz,DMSO)δ9.55(s,1H),9.30(s,1H),7.56–7.32(m,6H),7.06(d,J=8.3Hz,2H),6.60(d,J=7.4Hz,1H),6.45(t,J=7.4Hz,1H),6.36(t,J=7.3Hz,1H),6.22(d,J=7.6Hz,1H),5.80(d,J=8.2Hz,1H),5.29(d,J=8.2Hz,1H),4.37(s,1H),3.60(s,3H).13C NMR(100MHz,DMSO)δ169.09,151.77,144.33,137.59,135.80,135.09,132.46,130.65,130.60,129.13,127.74,120.86,119.34,116.62,113.42,110.70,77.75,77.57,68.69,61.56,52.82.HRMS(ESI):Calcd.for C25H20ClBrN2O4Na[M+Na]+:549.0194,Found:549.0211.
实施例12
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(l)所示,为甲基(2S,3S)-3-(4-氯苯基)-3-((2-羟基苯基)氨基)-2-(3-氯苯基)-2-丙炔酰胺丙酸甲酯,产率为88%,dr值等于90:10,HPLC纯度为96%。式(l)所示化合物的1H NMR示意图如图37所示,其13C NMR示意图如图38所示,其HPLC示意图如图39所示。
1H NMR(400MHz,MeOD)δ7.31–7.15(m,6H),7.09(d,J=8.5Hz,2H),6.56–6.49(d,J=7.1Hz,1H),6.43(t,J=7.6Hz,1H),6.34(t,J=7.1Hz,1H),6.20(d,J=7.6Hz,1H),5.38(s,1H),3.64(s,3H).13C NMR(100MHz,MeOD)δ170.96,154.44,145.97,139.73,138.50,136.88,135.21,134.94,131.24,130.72,129.33,129.22,128.78,126.86,120.97,118.43,114.70,112.29,71.64,63.65,54.04.HRMS(ESI):Calcd.for C25H21Cl2N2O4[M+H]+:483.0878,Found:583.0879.
实施例13
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(m)所示,为甲基(2S,3S)-3-(4-氯苯基)-3-((2-羟基苯基)氨基)-2-(4-氯苯基)-2-丙炔酰胺丙酸甲酯,产率为71%,dr值等于>95:5,HPLC纯度为98%。式(m)所示化合物的1H NMR示意图如图40所示,其13C NMR示意图如图41所示,其HPLC示意图如图42所示。
1H NMR(400MHz,MeOD)δ7.28(d,J=8.8Hz,2H),7.24–7.16(m,4H),7.12(d,J=8.5Hz,2H),6.55–6.49(m,1H),6.43(dd,J=7.6,6.6Hz,1H),6.33(t,J=7.5,6.5Hz,1H),6.19(d,J=7.1Hz,1H),5.40(3,1H),3.63(s,3H).13C NMR(100MHz,MeOD)δ171.16,154.43,145.91,138.71,136.96,136.22,135.13,134.91,131.21,130.15,129.39,129.36,120.99,118.30,114.70,112.08,71.76,63.44,54.03.HRMS(ESI):Calcd.for C25H20Cl2N2O4Na[M+Na]+:549.0194,Found:549.0211.
实施例14
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(n)所示,为甲基(2S,3S)-2-丙烯酰胺-3-(4-溴苯基)-3-((2-羟基苯基)氨基)-2苯基丙酸甲酯,产率为65%,dr值等于85:15,HPLC纯度为97%。式(n)所示化合物的1H NMR示意图如图43所示,其13C NMR示意图如图44所示,其HPLC示意图如图45所示。
1H NMR(400MHz,DMSO)δ9.12(s,1H),8.43(s,1H),7.41(d,J=15.1Hz,2H),7.30(m,5H),7.08(d,J=8.1Hz,2H),6.67(dd,J=16.9,10.2Hz,1H),6.57(d,J=7.4Hz,1H),6.46(t,J=7.4Hz,1H),6.34(t,J=7.1Hz,2H),6.23(d,J=7.7Hz,1H),6.11(d,J=16.9Hz,1H),5.68(d,J=10.5Hz,1H),5.57(d,J=7.0Hz,1H), 3.61(s,3H).13C NMR(100MHz,DMSO)δ170.43,165.20,144.20,138.70,136.64,135.68,131.15,130.70,130.51,127.98,127.67,126.95,129.90,120.69,119.33,116.00,113.27,109.83,69.39,60.63,52.96.HRMS(ESI):Calcd.for C25H23BrN2O4[M+Na]+:517.0739,Found:517.0717.
实施例15
将亚胺(0.24mmol),醋酸铑(0.0024mmol)和分子筛(300mg)混合于10mL单口瓶中,油泵进行氮气换气,用1mL注射器加入1mL重蒸CH2Cl2溶液,配制成混合溶液A,在室温下搅拌10分钟。再将芳基重氮化合物(0.2mmol)和酰胺化合物(0.2mmol)溶于1mL重蒸CH2Cl2溶液,配制成溶液B。将溶液B于25℃下,在1小时内用注射泵加入混合溶液A。搅拌3~12小时,反应混合物通过柱层析进行纯化,得到纯产品,其结构如式(o)所示,为甲基(2S,3S)-2-乙酰氨基-3-(4-溴苯基)-3-((2-羟基苯基)氨基)-2-苯基丙酸甲酯,产率为77%,dr值等于80:20,HPLC纯度为98%。式(o)所示化合物的1H NMR示意图如图46所示,其13C NMR示意图如图47所示,其HPLC示意图如图48所示。
1H NMR(400MHz,DMSO)δ9.08(s,1H),8.18(s,1H),7.45(d,J=8.4Hz,2H),7.35–7.25(m,5H),7.11(d,J=8.4Hz,2H),6.56(dd,J=7.6,1.2Hz,1H),6.45(m,1H),6.37–6.28(m,1H),6.22(m,2H),5.52(d,J=7.4Hz,1H),3.59(s,3H),1.99(s,3H).13C NMR(100MHz,DMSO)δ170.63,170.36,144.20,138.88,136.80,135.73,130.67,130.56,127.91,127.60,126.99,120.60,119.33,115.92,113.27,109.82,69.16,60.48,52.83,22.93.HRMS(ESI):Calcd.for C24H23BrN2O4Na[M+Na]+:505.0739,Found:505.0716.
实施例16抗肿瘤活性测试
IC50值测试
人结肠癌HCT116细胞、人肝癌BEL7402细胞、人肝癌SMMC7721细胞分别接种于McCoy,s5A培养液(10%血清,1%青-链霉素)和1640培养液中。置于37℃,5%CO2培养箱中,每2-3天传代一次,试验取对数生长期细胞。CCK-8法测定IC50值。
取对数生长期细胞,以配置好的新鲜培养液调整细胞悬液至2500~4000/ml,取100ul(2千细胞/孔)细胞悬液接种到96孔培养板。置于5%CO2,37℃培养箱中过夜孵育培养后,更换新鲜细胞培养液,每孔加入200ul DMSO等体积稀释的浓度梯度药物与细胞共孵育72h,更换新鲜细胞培养液,每孔加100ul+10ulCCK-8溶液继续孵育1-4小时,终止培养,用多功能酶标仪(Molecular Devices M5)检测450nm的吸光度,620nm的吸光度校正细胞数差异。
将待测化合物(实施例1~实施例15)溶解在DMSO中,并用培养液中进一步稀释。DMSO最终浓度不超过0.1%(v/v)。对照组为加入等体积DMSO的肿瘤细胞;空白组无细胞,在加入培养液中加入等体积DMSO。在一次实验内,每个实验条件的均设3个复孔。计算各浓度的化合物对细胞生长的抑制率,计算公式为:抑制率(%)={1-[(加药组)-(空白组)]/[(对照组)-(空白组)]}x 100%,用GraphPad Prim6计算出IC50(为将细胞生长降至对照组的50%所需的药物浓度)。其检测结果如下表1。
表一:本发明一种含α-芳基-α,β-二氨基酸酯衍生物的生物活性数据
“---”表示无活性;a表示阳性药在肿瘤细胞中的抑制率(%)。
综上,实验结果表明,含α-芳基-α,β-二氨基酸酯衍生物对人结肠癌细胞、人肝癌细胞均具有显著的抑制作用。与实施例4相比,实施例14和实施例15无活性,说明炔基为必须官能团;实施例6活性降低,说明杂环是不利基团。总体而言,含α-芳基-α,β-二氨基酸酯衍生物表现出优良的抗癌活性,抗癌活性在1.354~6.80μM;与市场上报道的紫杉醇药(PTX)相比,细胞活性相当甚至更好,其极有可能发展成药或者潜在药,同时这也说明该类化合物具有非常良好的抗结肠癌、抗肝癌活性。本发明为开发治疗结肠癌、肝癌药物提供了非常广阔的发展空间。
- 还没有人留言评论。精彩留言会获得点赞!