一种靶向PD‑1的融合蛋白及其相关应用的制作方法
本发明涉及生物医药技术领域,尤其涉及一种靶向PD-1的融合蛋白及其相关应用。
背景技术:
肿瘤可以通过多种抑制免疫系统及其效应因子的机制来达到免疫逃逸的目的。基于对肿瘤生物学和免疫学原则的不断深入研究,提高抗肿瘤细胞免疫功能和消除肿瘤细胞对免疫细胞抑制性因素,已发展成为免疫治疗的重要策略。在抗肿瘤免疫反应体系中,T细胞作为重要的参与者其反应效应和反应强度受多种共刺激信号和共抑制信号所调控,而其中介导抑制信号的即被称为免疫检查点。
近年来对于免疫检查点与肿瘤免疫逃逸关系的研究越来越深入,包括免疫检查点分子的结构与功能、信号通路、肿瘤表达谱与肿瘤预后等研究也越来越广泛,而其中尤其以PD-1/PD-L为代表的临床肿瘤免疫治疗靶点研究更具应用前景。
作为负性免疫调节因子的PD-1及其配体PD-L分子,其对于肿瘤的治疗效果以及肿瘤预后的重要作用与其受配体相互作用所传递的信号通路密切相关。PD-1是一种细胞膜蛋白受体,调节免疫细胞功能的一个关键点,主要表达于激活的T细胞和B细胞以及其他免疫细胞,PD-1在结构上与免疫球蛋白可变区结构域类似,包括胞外免疫球蛋白可变区(IgV)样结构域、疏水跨膜区和胞内结构域三个部分,功能是抑制T细胞的过度激活,这是免疫系统的一种正常的自稳机制,因为过度激活的T/B细胞会导致自身免疫病。肿瘤微环境会诱导肿瘤浸润T细胞高表达PD-1分子,同时肿瘤细胞会通过高表达PD-1的配体PD-L1和PD-L2,导致肿瘤微环境中PD-1信号通路持续激活,从而抑制T细胞介导的抗肿瘤免疫反应。
免疫检查点存在的作用是一方面参与维持对自身抗原的免疫耐受,避免自身免疫性疾病,另一方面避免免疫反应的过度激活对机体组织造成的损伤。更重要的是,以PD-1为代表的免疫检查点分子作为负性免疫调节分子,在介导肿瘤细胞免疫逃逸中同样发挥着重要的作用。由于在正常组织中这些检查点能够抑制T细胞的过度反应,而在肿瘤组织中则能够被肿瘤利用形成免疫逃逸,即肿瘤可以通过免疫检查点来抑制T细胞激活,从而逃避免疫杀伤反应;反之阻断这种检查点所传到的信号则能解除免疫细胞的抑制状态,使其发挥有效的抗肿瘤作用。
基于此,通过激活机体免疫反应以及解除肿瘤微环境中的免疫抑制状态是肿瘤免疫治疗中的核心策略,其中针对以PD-1为代表的免疫检查点分子的阻断是激发免疫细胞活化的有效策略之一,也是近些年抗肿瘤药物开发最热门靶点。因此,通过构建靶向PD-1的蛋白制剂来有针对性地阻断PD-1所介导的信号通路进而增强免疫细胞功能不仅是免疫治疗的重要策略,也是当前肿瘤治疗的急待解决的问题。
技术实现要素:
为了解决上述技术问题,本发明的一个目的在于提供一种靶向PD-1的融合蛋白制剂,具体而言,一种能靶向并阻断PD-1分子从而增强免疫细胞功能的融合蛋白制剂。
本发明第一方面提供一种靶向PD-1的融合蛋白制剂,所述融合蛋白分别包含氨基端的人程序性细胞死亡配体2胞外段区域和羧基端的人免疫球蛋白G亚型1恒定区片段;所述融合蛋白的氨基酸序列如SEQ ID NO:1所示。
本发明第二方面提供一种靶向PD-1的融合蛋白的编码核酸,所述核酸序列如SEQ ID NO:2所示。由于一种氨基酸可以有多种密码子编码,因此在某些实施方案中,可以根据实际需要对上述编码所述融合蛋白分子的DNA核酸序列的密码子进行突变,特别是使用真核细胞偏好密码子,但所编码融合蛋白的氨基酸序列不变。
本发明第三方面提供一种靶向PD-1的融合蛋白的重组载体,所述重组载体包括SEQ ID NO:2所示的编码核酸;重组载体可选用真核表达载体或者原核表达载体;优选为pcDNA3真核表达载体。
本发明第四方面提供一种细胞株,所述细胞株经过基因工程改造,所述细胞株包括上述重组载体并能够稳定高效地分泌表达靶向PD-1的融合蛋白;细胞株可选用多种工程细胞株,优选人胚肾细胞(293细胞)或中国仓鼠卵巢细胞(CHO细胞)。
本发明第五方面提供一种靶向PD-1的融合蛋白的制备方法,具体包括如下步骤:
步骤一,将如SEQ ID NO:2所示的编码核酸导入表达载体,构建重组表达载体;
步骤二,将所述步骤一获得的重组表达载体转入宿主细胞,进一步筛选获得稳定高效分泌表达融合蛋白的细胞株;
步骤三,将所述步骤二获得的细胞株在合适条件下进行扩增培养,收集培养上清并纯化获得融合蛋白。
优选地,所述步骤一中合适的载体可选用各种已知的载体,包括真核表达载体或者原核表达载体,进一步优选为pcDNA3真核表达载体。
优选地,所述步骤二中宿主细胞可选用多种工程细胞株,包括293细胞和CHO细胞,进一步优选为CHO细胞。
本发明第六方面提供一种药物组合物,所述药物组合物包含本发明所述的融合蛋白、核酸分子、载体或细胞株中的任一项或几项;可选地,该组合物还包含药学上可接受的载体、辅料或赋形剂。
本发明第七方面提供本发明所述融合蛋白或核酸分子或载体或细胞株或药物组合物在制备PD-1靶向药物以及制备增强免疫细胞功能药物中的用途;上述免疫细胞主要包括淋巴细胞如T细胞、B细胞、自然杀伤细胞以及树突状细胞、单核巨噬细胞,优选免疫细胞为T淋巴细胞。
本发明成功设计并制备了能够有效靶向并阻断PD-1分子的融合蛋白制剂,该融合蛋白制剂不仅显示出特异性结合PD-1的活性,而且还能够显著增强免疫细胞本身的增殖活性以及活化水平。值得注意的是,本发明所述的融合蛋白组成来源于人源性成分,并且在制备过程中不引入其他外源成分,因此,该融合蛋白作为药物使用没有其他引起免疫反应的异源成分,对人体几乎无副作用,具有高度种属特异性。更为重要的是,该融合蛋白制剂能够通过与PD-1配体竞争性结合,从而阻断PD-1传递信号来解除免疫细胞的免疫抑制状态,维持免疫细胞长效活性。同时,本发明所述的融合蛋白制剂以及相关的核酸分子、载体、细胞株以及药物组合物均可用于制备PD-1靶向药物以及制备增强免疫细胞功能的药物,不仅为抗肿瘤药物开发提供了新的药物选择,而且为临床上以PD-1为靶点的肿瘤免疫治疗途径提供了新的方法与策略。
附图说明
图1为融合蛋白PDL2-Ig结构示意图;
图2为实施例中融合蛋白稳定转染细胞株的分泌表达鉴定结果;
图3为实施例中融合蛋白的结合活性检测结果;
图4为实施例中融合蛋白的阻断活性检测结果;
图5为实施例中融合蛋白对T细胞增殖活性影响的检测结果;
图6为实施例中融合蛋白对T细胞活化水平影响的检测结果。
具体实施方式
下面通过具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
实施例1.融合蛋白的设计及构建
本发明所涉及到的靶向PD-1的融合蛋白的设计结构示意图如图1所示,主要包含氨基端的PDL2胞外段序列和羧基端的IgG1Fc序列,融合蛋白氨基酸序列如SEQ ID NO:1所示,其所对应的编码核酸序列如SEQ ID NO:2所示。
将上述设计的融合蛋白全长序列进行合成并且构建入pcDNA3真核表达载体中,进一步通过测序验证融合基因插入正确,由此得到构建好的重组表达载体。
实施例2.融合蛋白的稳定转染细胞株的构建
将上述构建好的重组表达载体以及对照载体转染入CHO-K1细胞中,转染后2天观察GFP阳性细胞达到20-40%,并使用含G418抗生素的培养基进行加压筛选培养,每两天更换含抗生素的新鲜培养基。两周后观察GFP阳性细胞率显著增加,将转染细胞通过有限稀释方法进行限定稀释后按每孔一个细胞接种至多个96孔板中并继续加压筛选培养,培养一周后共得到60~80个单克隆稳转细胞群落。将这些单克隆细胞群落按荧光表达强弱的不同从中挑取20个荧光表达最高的单克隆群落至24孔板以及6孔板中继续扩大培养。
将扩大培养的20个单克隆进行流式分析后显示所有20个单克隆细胞GFP阳性表达率都在99.9%以上,说明这些单克隆细胞具有很好的均一性;同时流式分析结果显示所有20个单克隆细胞中目的融合蛋白表达阳性率也均在99%以上,说明这20个单克隆稳转细胞株均能够有效表达目的融合蛋白。
由此已构建好20株表达目的融合蛋白的单克隆稳定转染细胞株。优选地,从中挑取A9、C6、D12和G10共四株单克隆细胞株进行后续蛋白表达工作。
实施例3.融合蛋白的分泌表达及鉴定
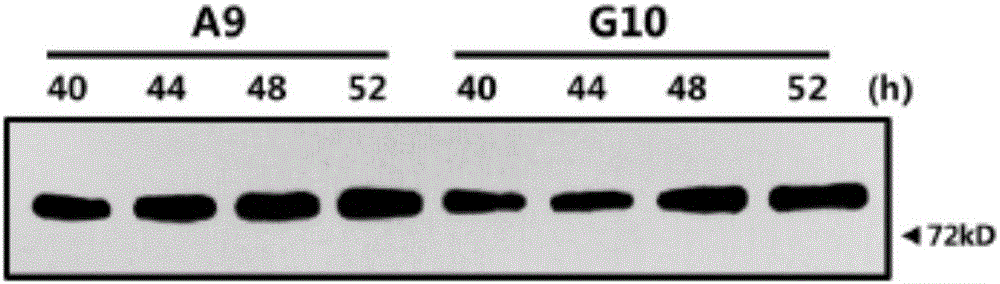
收集上述实施例2中所挑选的四株单克隆稳转细胞株,每种细胞计数后取等量细胞接种至24孔板中,待贴壁后换成不含血清的培养基培养,并分别在培养后40h、44h、48h以及52h等四个不同的时间点收集无血清培养上清样品并进行目的融合蛋白的Western Blot检测,检测结果显示四株单克隆稳转细胞株在培养40小时后均能有效分泌目的蛋白,并且目的蛋白表达量由强到弱依次为A9>G10>C6>D12。
选取表达量最高的A9和G10两株单克隆细胞株进行无血清培养以及上清分泌的表达检测,结果如图2所示。两株细胞在四个时间点均能检测到较高的目的蛋白表达,进一步细化后分析A9单克隆细胞株表达量高于G10单克隆细胞株,而且两株细胞均在48小时时间点表达量最高。由此,优先选择A9单克隆细胞株作为后续蛋白表达体系。
进一步地,将A9单克隆细胞株大量扩增后进行无血清培养,48小时候后收集培养上清,使用ProteinA层析柱进行亲和层析后得到纯化的融合蛋白。
实施例4.融合蛋白的结合活性检测
为了检测所制备的融合蛋白与靶分子PD-1是否存在相互作用,首先使用夹心法ELSIA实验来检测融合蛋白的结合活性。将PD-1蛋白铺板后加入适量融合蛋白或对照蛋白溶液,进一步使用融合蛋白的特异性抗体以及辣根过氧化物酶标记的二抗来进行特异性标记,最后加入TMB显色底物进行显色后使用酶标仪检测对照组以及实验组OD450值。综合多次重复实验的统计结果如图3所示,相比空白组(Blank)和对照蛋白组(Control)的OD450值(0.15±0.01),融合蛋白组(PDL2-Ig)显示出很强的结合活性(1.75±0.05),说明融合蛋白与PD-1靶蛋白存在很强的特异性结合。
实施例5.融合蛋白的阻断活性检测
为进一步验证融合蛋白与细胞膜表面PD-1受体的特异性结合活性,首先将来源于人外周血单个核细胞(PBMC)中的T细胞使用铺板的CD3抗体进行激活,收集细胞并分别使用对照蛋白和融合蛋白预先处理,最后使用PD-1特异性荧光抗体标记并进行流式检测。代表性检测结果如图4所示,对比对照组和实验组,活化的T细胞高表达PD-1分子(80%±7%),经过融合蛋白预先处理后PD-1标记率则降低为(60%±5%),说明融合蛋白的预先处理能够部分阻断PD-1特异性抗体的标记。综上,融合蛋白不仅显示出与PD-1靶蛋白较强的结合活性,还能特异性阻断PD-1抗体与细胞表面PD-1分子的结合,说明这种较强的结合活性能够发挥与PD-1配体竞争性结合PD-1分子的作用,从而阻断T细胞表面PD-1分子所传递的免疫抑制信号。
实施例6.融合蛋白对T细胞增殖活性影响的检测
为检测融合蛋白对T细胞增殖活性的影响,将人PBMC来源的T细胞使用一定浓度的CFSE进行标记,对照组与实验组设计平行孔,分别加入等量的CFSE标记细胞与对照蛋白或融合蛋白进行共孵育,培养1天、2天以及3天后将对照组及实验组同时进行流式检测,统计结果如图5所示。由于CFSE检测细胞增殖原理为具有荧光活性的CFSE能够在母代细胞增殖过程中均分到子代细胞中,相应地增殖的子代细胞的荧光强度也会因为CFSE的均分而减弱,采用流式细胞仪分析的时候,通过检测到细胞荧光强度不断的降低,进一步分析得出细胞分裂增殖的情况。从图5结果中可以看到,对照组(Control)和融合蛋白处理组(PDL2-Ig)中T细胞在第1天到第3天过程中CFSE的平均荧光强度(MFI)值持续降低,说明两组中的T细胞都处于持续增殖状态;同时相较于对照组,融合蛋白处理组CFSE的MFI值在三个时间点均存在明显的降低,说明融合蛋白的处理能够较为明显地增强T细胞的增殖活性和抑制T细胞凋亡。
实施例7.融合蛋白对T细胞活化水平影响的检测
为进一步检测融合蛋白对T细胞活化水平的影响,取等量人PBMC来源的T细胞分别加入对照蛋白和融合蛋白进行共孵育,同时加入CD3抗体处理组作为阳性对照组,共孵育24小时后收集细胞并使用T细胞活化表面分子CD279、CD69以及CD107a的荧光抗体(BioLegend)进行标记,采用流式细胞仪检测三组中相关分子的表达水平,代表性结果如图6所示。
从图6结果中可以看到,相较于对照组(Control),CD3抗体处理组(Anti-CD3)中CD279+、CD69+以及CD107a+细胞比例达到55%±5%、90%±3%和77%±9%,相比对照组分别提升30%、29%和40%,说明CD3抗体的处理能明显增强T细胞活化水平。相较而言,融合蛋白处理组中三群阳性细胞比例相比对照组则分别提升25%、10%以及27%,虽然提升幅度不及阳性对照组,但相比对照组的本底水平这种提升同样显著。
综上,本发明成功设计并制备了能够有效靶向并阻断PD-1分子的融合蛋白制剂,该融合蛋白制剂不仅显示出特异性结合PD-1的活性,同时还能够显著增强T细胞本身的增殖活性以及活化水平。该融合蛋白能与PD-1配体竞争性结合PD-1受体,通过阻断免疫抑制信号来增强免疫细胞功能,在天然免疫及适应性免疫所介导的肿瘤免疫治疗中具有良好的应用前景。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
SEQUENCE LISTING
<110> 上海科医联创生物科技有限公司
<120> 一种靶向PD-1的融合蛋白及其相关应用
<130> IPI170277
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 431
<212> PRT
<213> Artificial Sequence
<220>
<223> 靶向PD-1的融合蛋白氨基酸序列
<400> 1
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Pro Lys Ser Cys Asp Lys Thr His
195 200 205
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
210 215 220
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
225 230 235 240
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
245 250 255
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
260 265 270
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
275 280 285
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
290 295 300
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
305 310 315 320
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
325 330 335
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
340 345 350
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
355 360 365
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
370 375 380
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
385 390 395 400
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
405 410 415
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
420 425 430
<210> 2
<211> 1293
<212> DNA
<213> Artificial Sequence
<220>
<223> 靶向PD-1的融合蛋白核酸编码序列
<400> 2
ttattcacag tgacagtccc taaggaactg tacataatag agcatggcag caatgtgacc 60
ctggaatgca actttgacac tggaagtcat gtgaaccttg gagcaataac agccagtttg 120
caaaaggtgg aaaatgatac atccccacac cgtgaaagag ccactttgct ggaggagcag 180
ctgcccctag ggaaggcctc gttccacata cctcaagtcc aagtgaggga cgaaggacag 240
taccaatgca taatcatcta tggggtcgcc tgggactaca agtacctgac tctgaaagtc 300
aaagcttcct acaggaaaat aaacactcac atcctaaagg ttccagaaac agatgaggta 360
gagctcacct gccaggctac aggttatcct ctggcagaag tatcctggcc aaacgtcagc 420
gttcctgcca acaccagcca ctccaggacc cctgaaggcc tctaccaggt caccagtgtt 480
ctgcgcctaa agccaccccc tggcagaaac ttcagctgtg tgttctggaa tactcacgtg 540
agggaactta ctttggccag cattgacctt caaagtcaga tggaacccag gacccatcca 600
cccaaatctt gtgacaaaac tcacacatgc ccaccgtgcc cagcacctga actcctgggg 660
ggaccgtcag tcttcctctt ccccccaaaa cccaaggaca ccctcatgat ctcccggacc 720
cctgaggtca catgcgtggt ggtggacgtg agccacgaag accctgaggt caagttcaac 780
tggtacgtgg acggcgtgga ggtgcataat gccaagacaa agccgcggga ggagcagtac 840
aacagcacgt accgtgtggt cagcgtcctc accgtcctgc accaggactg gctgaatggc 900
aaggagtaca agtgcaaggt ctccaacaaa gccctcccag cccccatcga gaaaaccatc 960
tccaaagcca aagggcagcc ccgagaacca caggtgtaca ccctgccccc atcccgggat 1020
gagctgacca agaaccaggt cagcctgacc tgcctggtca aaggcttcta tcccagcgac 1080
atcgccgtgg agtgggagag caatgggcag ccggagaaca actacaagac cacgcctccc 1140
gtgctggact ccgacggctc cttcttcctc tacagcaagc tcaccgtgga caagagcagg 1200
tggcagcagg ggaacgtctt ctcatgctcc gtgatgcatg aggctctgca caaccactac 1260
acgcagaaga gcctctccct gtctccgggt aaa 1293
- 还没有人留言评论。精彩留言会获得点赞!
- 一种肿瘤靶向丝胶蛋白胶束及其制备方法和应用与流程
- 一种靶向缺血心肌的VEGF重组蛋白的制作方法与工艺
- 一种胰岛靶向蛋白及其真核表达方法与流程
- 一种基于Ion Torrent测序平台的靶向叶绿体测序方法与流程
- 用于癌症靶向治疗的包含基于重组血红蛋白蛋白质或亚基的治疗剂的药物组合物的制作方法与工艺
- 基于STAT3蛋白靶点的靶向抗癌药物的发明的制作方法与工艺
- 靶向泛素化降解PLK1和BRD4蛋白的化合物及其应用的制造方法与工艺
- 抗HBV复制的靶向融合蛋白及其构建方法与流程
- 靶向于钙粘着蛋白‑11的EC1结构域的人源化抗体及相关组合物和方法与流程
- 用于刺激靶向热休克蛋白以及促进蛋白质修复的脉冲电磁和超声疗法的制造方法与工艺