同步检测肺炎克雷伯氏菌和豚鼠气单胞菌的双重PCR引物及其检测方法与流程
本发明涉及一种同步检测肺炎克雷伯氏菌和豚鼠气单胞菌的双重PCR引物及其检测方法,属于生物检测技术领域。
背景技术:
肺炎克雷伯氏菌(Klebsiella Pneumoniae)属于肠杆菌科(Enterobacteriaceae)克雷伯菌属(Klebsiella),为有荚膜的革兰氏阴性菌,包含肺炎亚种(subsp.pneumoniae)、鼻炎亚种(subsp.azaenae)和鼻硬结亚种(subsp.rhinoscleromatis)3个亚种。肺炎克雷伯氏菌于1882年首次分离出来,是革兰氏阴性菌感染中仅次于大肠杆菌的条件致病菌。它是一种人畜共患致病菌,主要引起人的肺炎、呼吸道疾病、肠炎、败血症等,研究人员陆续从鲤、小鼠、梅花鹿、牛、大熊猫等多种动物上分离发现该菌。由于机体免疫力的降低,抗菌药物的滥用,物种间的交叉感染,肺炎克雷伯氏菌对畜禽、水产动物等的危害越来越严重,引起鲤、白鲢、中华鳖等大规模的感染及发病。
豚鼠气单胞菌(Aeromonas caviae)属于气单胞菌属(Aeromonas),为嗜温有动力气单胞菌(mesophilic motile aeromonas),普遍存在于淡水、海水、淤泥和污水等环境中,是一种条件致病菌,其宿主范围很广,能引起人类和动物的腹泻。豚鼠气单胞菌单独或与其他病原菌混合感染也能引起多种水产养殖动物如鳗鲡、鲢鳙、金鱼、鲤、对虾等的败血症及甲鱼、中华绒螯蟹等的病害,造成水产动物的大量死亡。
近年来,我国水产养殖动物大规模暴发细菌性败血症引起了研究者的重点关注。经过病原分离鉴定,发现了致病菌肺炎克雷伯氏菌和豚鼠气单胞菌。通过对现有资料文献检索发现,目前肺炎克雷伯氏菌和豚鼠气单胞菌的检测方法主要有:细菌培养法、核酸PCR检测法(TaqMan real-time PCR法和SYBR Green real-time PCR法)和DNA碱基序列测定技术、基因芯片技术、LAMP结合示差脉冲伏安法、PCR-DHPLC检测技术等。这几种方法具有不受病程影响、快速、敏感性和特异性高、新颖的优点,但成本高,实验条件要求高,需要精密昂贵的仪器、操作复杂,不适合在基层进行检测和推广。寻求一种在实际生产中快速、准确、灵敏、特异的检测方法,对于病原的确定及诊治尤为重要。由于聚合酶链式反应(Polymerase Chain Reaction)适合早期和大量样品的检测,且操作简单,耗时短,试验要求不高,能大批量检测样本,具有普遍适用性,能很好的满足水产动物病原菌的检测需求。本试验选择肺炎克雷伯氏菌的毒力外膜蛋白C基因和豚鼠气单胞菌的外膜蛋白Aha1基因,来建立一种双重PCR检测方法,为引起鱼体暴发性出血病病原肺炎克雷伯氏菌和豚鼠气单胞菌的检测提供可靠、可行的技术支持。
技术实现要素:
本发明的目的在于克服上述不足之处,建立一种同步检测肺炎克雷伯氏菌和豚鼠气单胞菌的双重PCR方法,该方法可用于肺炎克雷伯氏菌和豚鼠气单胞菌的双重PCR检测,具有检测结果特异性强、灵敏度高、实用性强等特点。
按照本发明提供的技术方案,一种同步检测肺炎克雷伯氏菌和豚鼠气单胞菌的双重PCR引物,引物对如下:
引物ompC:
正向引物F:5’-AACACTGAAA GCTCCAGCGA-3’;
反向引物R:5’-CGTCGGTACG TTTGGAGTGA-3’;
引物ahal:
正向引物F:5’-AGACGGTACC ACTTTCGACG-3’
反向引物R:5’-ATGTGACGCG GGTCTATGTC-3’。
以引物ompC和引物ahal为靶基因,通过双重PCR方法,以待检样品DNA为模板,以引物ompC和引物ahal扩增靶基因,检测是否存在扩增产物,有对应条带则表明检测结果为阳性。
具体步骤如下:
(1)肺炎克雷伯氏菌和豚鼠气单胞菌的DNA提取:扩大培养肺炎克雷伯氏菌和豚鼠气单胞菌,采用常规细菌基因组DNA抽提试剂盒提取肺炎克雷伯氏菌和豚鼠气单胞菌菌液的DNA,溶解在pH7.5的TE缓冲液中,置于-20℃保存备用;
(2)双重PCR反应:引物ompC和引物ahal在同一反应体系中同时进行双重PCR反应,其中取浓度均为100mmol/L的上下游引物各0.5-1μL,
(3)电泳检测:取5-10μL PCR检测产物,在1%含goldview染色剂的琼脂糖凝胶上电泳检测,结束后将胶放在凝胶成像系统下观察结果并拍照记录;
(4)结果分析:在418bp位置处有扩增条带代表样品中含有肺炎克雷伯氏菌,213bp位置处有扩增条带代表样品中含有豚鼠气单胞菌;若对应位置无扩增条带,表示样品为阴性,待检测样品中不含有肺炎克雷伯氏菌和豚鼠气单胞菌。
步骤(2)中PCR反应条件及检测体系具体如下:
PCR检测体系:两组浓度均为100mmol/L的上下游引物各0.5-1μL,含Mg2+的10×Buffer 3-4μL,浓度为25g/L dNTP 2-3μL,Taq酶0.2μL,DNA模板各1-3μL,灭菌蒸馏水补齐至25μL;
PCR反应条件:94℃预变性3-5min,94℃变性30-45s、56℃复性30-45s、72℃延伸30-60s、30-35个循环,然后72℃温育7min,最后降温至4-12℃。
步骤(3)所述电泳检测条件为电压为100-140V,时间为40-60min。
本发明建立的用于检测肺炎克雷伯氏菌和豚鼠气单胞菌的双重PCR方法,可用于检测水产动物是否携带肺炎克雷伯氏菌和豚鼠气单胞菌,与国内外现有的方法相比,本发明具有如下技术优势:
(1)准确性高,特异性强:从肺炎克雷伯氏菌和豚鼠气单胞菌的ompC和ahal两个基因序列来检测,可同时特异性检测肺炎克雷伯氏菌和豚鼠气单胞菌,无扩增产物。
(2)操作简单,耗时短,易推广;本发明建立的双重PCR技术,在同一体系中同时扩增两对引物,模板为新鲜培养的菌液提取的DNA;整个过程简单,上手快,可大批量检测,一般整个检测过程可在短时间内完成。基层技术人员易于掌握,推广性很强。
附图说明
图1为实施例2肺炎克雷伯氏菌和豚鼠气单胞菌双重PCR引物的特异性检测。
图2为实施例3肺炎克雷伯氏菌和豚鼠气单胞菌双重PCR方法的灵敏度检测。
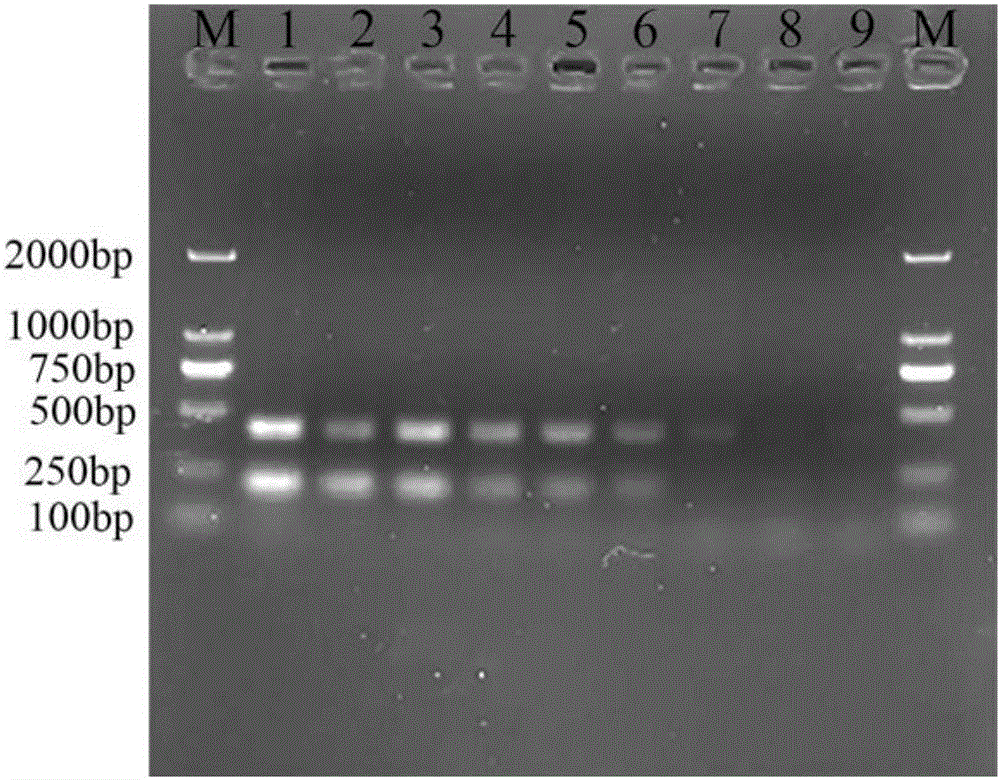
图3为实施例4肺炎克雷伯氏菌和豚鼠气单胞菌双重PCR的临床样本检测。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。其中,goldview染色剂购自SBS赛百盛生物工程有限公司。
本发明检测系统中的特异性引物均通过核酸合成设备制备。核酸合成设备可委托相关基因公司合成。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1肺炎克雷伯氏菌和豚鼠气单胞菌双重PCR引物获得
根据NCBI网站上已收录的肺炎克雷伯氏菌ompC序列(Genbank登录号KJ579291)和豚鼠气单胞菌ahal序列(Genbank登录号JQ946880)运用在线网站Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计出两组特异性引物,所述引物的核苷酸序列如下所示:
引物ompC:
正向引物F:5’-AACACTGAAAGCTCCAGCGA-3’
反向引物R:5’-CGTCGGTACGTTTGGAGTGA-3’;
引物ahal:
正向引物F:5’-AGACGGTACCACTTTCGACG-3’
反向引物R:5’-ATGTGACGCGGGTCTATGTC-3’;
实施例2肺炎克雷伯氏菌和豚鼠气单胞菌双重PCR引物的特异性检测
1、肺炎克雷伯氏菌、大肠杆菌、迟钝爱德华氏菌、豚鼠气单胞菌、嗜水气单胞菌、维氏气单胞菌的基因组DNA提取。
细菌菌株DNA提取:采用Ezup柱式细菌基因组DNA抽提试剂盒(上海生工)的手册指南进行(公众可从上海生工获取详细资料),具体如表1所示,DNA溶解在50μL、pH7.5的TE缓冲液中,置于-20℃保存备用。
表1
2、双重PCR反应体系及程序:
双重PCR检测体系为25μL的总量,具体包括:
ompC和ahal上下游引物各0.5μL(100mmol/L)
10×Buffer(含Mg2+)3μL
dNTP 2μL(25g/L)
Taq酶0.2μL
DNA模板各3μL
最后用灭菌双蒸水补至25μL
其中,DNA模板3μL:每个管中分别加入肺炎克雷伯氏菌、大肠杆菌、迟钝爱德华氏菌、豚鼠气单胞菌、嗜水气单胞菌、维氏气单胞菌的基因组DNA模板3μL,或者两株菌各1.5μL混合DNA。
双重PCR检测程序为:94℃预变性5min,接94℃变性30s、56℃复性45s、72℃延伸30s、30个循环,然后72℃温育7min。
电泳检测:取5μL的PCR产物在1%含goldview染色剂的琼脂糖凝胶上电泳检测,结束后将胶放在在凝胶成像系统下观察结果并拍照记录。
3、双重PCR扩增产物电泳图如图1所示,其中,M:DL2000 DNA Marker;1:肺炎克雷伯氏菌DNA;2:大肠杆菌DNA;3:迟钝爱德华氏菌DNA;4:嗜水气单胞菌DNA;5:维氏气单胞菌DNA;6:豚鼠气单胞菌DNA;7:大肠杆菌DNA;8:迟钝爱德华氏菌DNA;9:嗜水气单胞菌DNA;10:维氏气单胞菌DNA;11:肺炎克雷伯氏菌和豚鼠气单胞菌混合DNA;12:大肠杆菌和迟钝爱德华氏菌混合DNA;13:大肠杆菌和嗜水气单胞菌混合DNA;14:大肠杆菌和维氏气单胞菌混合DNA;15:迟钝爱德华氏菌和嗜水气单胞菌混合DNA;16:迟钝爱德华氏菌和维氏气单胞菌混合DNA;17:嗜水气单胞菌和维氏气单胞菌混合DNA。
泳道1在418bp位置有一条扩增条带,表示样品为阳性,待检测样品中含有肺炎克雷伯氏菌;泳道6在213bp位置有一条扩增条带,表示样品为阳性,待检测样品中含有豚鼠气单胞菌;泳道11在418bp和213bp位置有两条扩增条带,表示样品为阳性,待检测样品中同时含有肺炎克雷伯氏菌和豚鼠气单胞菌;泳道2、3、4、5、7、8、9、10、12、13、14、15、16、17没有扩增条带,表示样品为阴性,待检测样品中不含有肺炎克雷伯氏菌和豚鼠气单胞菌。
实施例3肺炎克雷伯氏菌和豚鼠气单胞菌双重PCR方法的灵敏度检测
通过肺炎克雷伯氏菌ompC序列和豚鼠气单胞菌ahal序列基因克隆和浓度调整,使得肺炎克雷伯氏菌和豚鼠气单胞菌DNA最高浓度均为2.5×105pg/μL,后进行3倍梯度稀释制备,直至3.3×10pg/μL。按实施例1中加入除DNA模板外的其他PCR反应试剂进行,扩增产物进行电泳检测。
双重PCR灵敏性检测结果如图2所示,其中,M:DL2000 DNA Marker;1~9分别为:肺炎克雷伯氏菌DNA浓度分别为2.5×105pg/μL,8.3×104pg/μL,2.8×104pg/μL,9.3×103pg/μL,3.1×103pg/μL,1.0×103pg/μL,3.3×102pg/μL,1.1×102pg/μL,3.3×10pg/μL;豚鼠气单胞菌DNA浓度分别为2.5×105pg/μL,8.3×104pg/μL,2.8×104pg/μL,9.3×103pg/μL,3.1×103pg/μL,1.0×103pg/μL,3.3×102pg/μL,1.1×102pg/μL,3.3×10pg/μL。
本图说明建立的双重PCR体系对肺炎克雷伯氏菌DNA的检测限为3.3×102pg/μL,对豚鼠气单胞菌的检测限为1.0×103pg/μL。
实施例4肺炎克雷伯氏菌和豚鼠气单胞菌双重PCR的临床样本检测
根据实施例1所述方法,随机抽取不同养殖塘口发病团头鲂、鲫、鲢等养殖动物,无菌剪取出血病灶组织少许,经无菌生理盐水清洗后进行研磨,制备组织匀浆液置于1.5mL无菌离心管中,离心取上清置于1.5mL无菌离心管中。按照动物组织DNA提取试剂盒进行DNA提取,并作为检测模板进行PCR反应,经证实在抽取的患病鱼体出血病灶组织处可检测出肺炎克雷伯氏菌和豚鼠气单胞菌。
临床样本检测结果如图3所示,其中,M:DL2000 DNA Marker;1:样品1;2:样品2;3:样品3;4:样品4;5:样品5;6:样品6;7:样品7;8:样品8;9:样品9;10:样品10。
泳道2代表检测出肺炎克雷伯氏菌和豚鼠气单胞菌,泳道4代表检测出豚鼠气单胞菌,泳道7代表检测出肺炎克雷伯氏菌和豚鼠气单胞菌,泳道9代表检测出肺炎克雷伯氏菌,其余抽检组织未检测出肺炎克雷伯氏菌和豚鼠气单胞菌,整个过程简单,可大批量检测,一般整个检测过程可在短时间内完成。
- 还没有人留言评论。精彩留言会获得点赞!