新型的甾体皂苷类化合物及其应用的制作方法
本发明属于医药技术领域,具体涉及一类新型的甾体皂苷类化合物及其应用。
背景技术:
炎症是具有血管系统的活体组织对损伤因子所产生的防御反应。大多数疾病都伴有炎症的发生,炎症会加重疾病的发生和发展,有些慢性炎症会导致肿瘤的发生,因此,对炎症的控制和治疗具有非常重要的意义。
天然药物尤其是来源于植物的药物具有化学结构多样性和生物活性多样性,一直是人类预防和治疗疾病的主要来源。临床上应用的许多药物都直接或间接来源于天然产物,天然产物不仅可以作为药物半合成的前体物,而且可以作为药物化学合成的的模板,为新药设计提供新思路。天然产物已成为发现新药物或先导化合物的主要源泉之一。
龙葵(Solanum nigrum L)为茄科(Solanaceace)茄属(Solanum)具紫茎植物特征的一年至多年生草本植物,又名黑星星、黑天天、天泡果、老鸭眼睛、苦菜、苦葵等,遍布全国,常生于农田、荒地、田边及村庄附近。龙葵全草可入药,以干燥、色绿、肥嫩者入药为佳。龙葵性寒,味苦、微甘,有小毒,归肺、肾二经,有清热解毒、活血化瘀、利水消肿、止咳祛痰的功效,主治疮痈肿毒、细菌性痢疾、慢性支气管炎、乳腺炎和癌症等。
龙葵青果中的主要活性成分为甾体皂苷类成分。现代药理实验研究表明龙葵青果具有较强的抗肿瘤、抗炎、抑菌等活性。现有研究对龙葵青果化学成分研究仍不够彻底,因而龙葵青果中甾体类化学成分值得进一步研究和开发利用。我们对龙葵青果的甾体皂苷类成分进行了系统分离,获得了一类新型的甾体皂苷类化合物,其化学结构和抗炎、抗肿瘤活性未见有过报道。
技术实现要素:
为了解决上述问题,本发明的目的在于提供一类新型的甾体皂苷类化合物及其在制备抗炎、抗肿瘤药物方面的应用。
本发明所采取的技术方案是:
本发明提供一类新型的甾体皂苷类化合物,其结构通式为:
式中,R1为β-D-吡喃葡萄糖基-(1→2)-[β-D-吡喃葡萄糖基-(1→3)]-β-D-吡喃葡萄糖基-(1→4)-β-D-半乳糖或β-D-吡喃葡萄糖基-(1→2)-[β-D-吡喃葡萄糖基-(1→3)]-β-D-吡喃葡萄糖基-(1→4)-β-D-半乳糖或β-D-吡喃葡萄糖基-(1→2)-α-L-鼠李糖-(1→4)-[α-L-鼠李糖-(1→2)]-β-D-吡喃葡萄糖或α-L-鼠李糖-(1→2)-[α-L-鼠李糖-(1→4)]-[β-D-吡喃葡萄糖基-(1→6)]-β-D-吡喃葡萄糖或β-D-吡喃葡萄糖基-(1→2)-[β-D-吡喃葡萄糖基-(1→3)]-[β-D-吡喃葡萄糖基-(1→6)]-β-D-吡喃葡萄糖基-(1→4)-β-D-半乳糖或β-D-吡喃葡萄糖基-(1→2)-[β-D-吡喃木糖-(1→3)]-β-D-吡喃葡萄糖基-(1→4)-β-D-半乳糖或β-D-吡喃葡萄糖基-(1→2)-[β-D-吡喃木糖-(1→3)]-[β-D-吡喃葡萄糖基-(1→6)]-β-D-吡喃葡萄糖基-(1→4)-β-D-半乳糖;
R2为α-OH或β-OH或=O;
R3为β-D-吡喃葡萄糖或β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖;
R4和R5为H或R4与R5形成碳碳双键;
R6为-OH或H。
本发明所述的新型的甾体皂苷类化合物包括9种化合物,其来源是从龙葵青果中提取获得,所述的提取方法为:
取干燥龙葵青果药材6kg,用环己烷回流提取两次,弃去环己烷提取液。脱脂处理后的药材以10倍量的70%甲醇加热回流提取3次,每次2小时,合并提取液减压浓缩得到浸膏。将浸膏用水混悬,经D101大孔树脂柱(1300×100mm),分别以水、10%甲醇、30%甲醇、50%甲醇、70%甲醇及100%甲醇洗脱,其中50%甲醇洗脱部分通过反复硅胶柱色谱、反相MPLC柱色谱、Sephadex LH-20柱色谱及半制备反相HPLC柱色谱等手段,分离得到化合物1-9。并通过理化常数和现代波谱学手段(HRESIMS,1D-NMR,2D-NMR)鉴定以上9个化合物。
进一步地,所述的9种化合物的化学名称如下表所示:
进一步地,所述的9种化合物的化学结构式如下表所示:
本发明还提供了所述的甾体皂苷类化合物在制备抗肿瘤药物中的应用,所述的甾体皂苷类化合物可以单独使用或与其他药物组合使用,添加药学上可接受的载体,制成各种成品制剂。
本发明的有益效果是:
本发明从龙葵青果中提取出9种新型的甾体皂苷类化合物,并通过理化常数和现代波谱学手段进行鉴定,所得的9种新型的甾体皂苷类化合物化学结构明确,为进一步研究和开发利用龙葵青果中甾体类化学成分的价值提供有力的参考资料。动物药效学试验表明,本发明提供的9种新型的甾体皂苷类化合物具有较好体外抗炎活性,对人急性髓性白血病细胞HL-60、人组织细胞淋巴瘤细胞U937和人肝癌细胞HepG2 3个肿瘤株均具有不同程度的肿瘤抑制作用,表明其可以进一步作为新的抗炎、抗肿瘤药物进行研究开发。
附图说明
图1为本发明甾体皂苷类化合物对IL-6和IL-1β的的抑制作用,其中,Ctrl-:阴性对照;Ctrl+:阳性对照;1-9:化合物1-9,LPS:脂多糖;*表示与LPS组相比,P<0.05;**表示与LPS组相比,p<0.01。
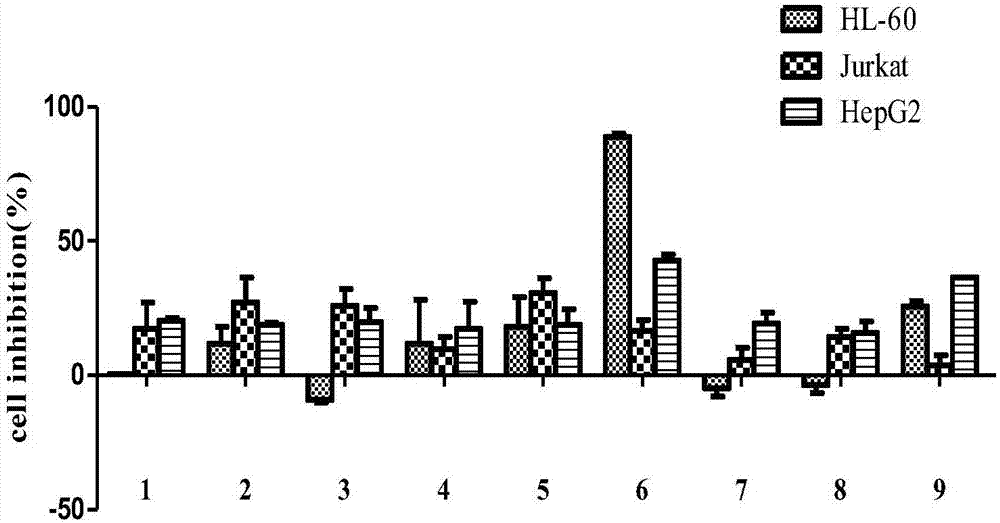
图2为本发明甾体皂苷类化合物对不同肿瘤细胞的抑制作用,其中,1-9:化合物1-9。
具体实施方式
以下通过具体实施方式进一步描述本发明,但本发明不仅仅限于以下实施例。
实施例1甾体皂苷类化合物的提取
取干燥龙葵青果药材6kg,用环己烷回流提取两次,弃去环己烷提取液。脱脂处理后的药材以10倍量的70%甲醇加热回流提取3次,每次2小时,合并提取液减压浓缩得到浸膏。将浸膏用水混悬,经D101大孔树脂柱(1300×100mm),分别以水、10%甲醇、30%甲醇、50%甲醇、70%甲醇及100%甲醇洗脱,其中50%甲醇洗脱部分通过反复硅胶柱色谱、反相MPLC柱色谱、Sephadex LH-20柱色谱及半制备反相HPLC柱色谱等手段,分离得到化合物1-9。
实施例2化合物1的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物1进行鉴定,结果为如下:
化合物1为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)不显色,酸水解检出D-葡萄糖和D-半乳糖,提示该化合物为螺甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1128.5492(calcd.for C51H86NO26 1128.5438),提示其分子量为1110,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C51H82O26。
在1H-NMR谱中,高场区给出甾体皂苷元上四个特征的甲基信号,其中两个角甲基为单峰,另外两个为双峰,分别位于δ1.17(3H,s,Me-18)、0.64(3H,s,Me-19)、1.57(3H,d,J=6.9Hz,Me-21)及1.19(3H,d,J=7.2Hz,Me-27),与18-Me的氢信号相比,19-Me的氢信号处于高场,说明苷元5位氢为α构型。在糖端基氢区给出四个糖端基氢信号δ4.86(1H,d,J=7.6Hz)、5.15(1H,d,J=7.9Hz)、5.30(1H,d,J=7.9Hz)和5.57(1H,d,J=7.7Hz),结合这些糖端基氢信号的J值与酸水解分析结果,说明分子中的D-葡萄糖和D-半乳糖均为β构型。
13C-NMR(DEPT)中,δ181.1为一个酯羰基碳信号,δ110.7为螺甾类皂苷骨架上22位碳的特征信号。在糖端基信号区给出四个糖端基碳信号δ102.7、104.8、105.2和105.4,提示化合物1为四糖螺甾皂苷。比较该化合物苷元部分的碳谱数据与文献报道的solanigroside D苷元部分的碳谱数据发现,除C环上C-11、C-12和C-13有差异外,其余基本一致。与solanigroside D比较,化合物1苷元的C-12向低场位移至79.6ppm,C-11和C-13也分别向低场位移了10.6和6.0ppm,推测在该化合物苷元的C-12位存在一个羟基,其二维图谱也证实了上述推测。在ROESY谱中,12位的氢信号δ3.48(1H,dd,J=11.0,4.5Hz)与δ1.02(1H,m,H-14)和2.28(1H,dd,J=8.5,6.6Hz,H-17)相关,说明12位氢为α构型,因而12位羟基为β构型。从而确定该化合物的苷元为(25R)-5α-spirostan-3β,12β,23α-triol-26-one。
在HMBC谱中,葡萄糖的端基质子信号δ5.57(1H,d,J=7.7Hz)与内侧葡萄糖的C-2(δ81.8)相关,另一个葡萄糖端基质子信号δ5.30(1H,d,J=7.9Hz)与内侧葡萄糖的C-3(δ88.8)相关,另外内侧葡萄糖的端基质子信号δ5.15(1H,d,J=7.9Hz)与半乳糖的C-4(δ80.5)相关,半乳糖的端基质子信号δ4.86(1H,d,J=7.6Hz)与苷元C-3(δ77.8)相关,确定该化合物3位的糖链为D-Glc-(1→2)-[D-Glc-(1→3)]-D-Glc-(1→4)-D-Gal。通过1H-NMR、13C-NMR(DEPT)、HSQC、HMBC及1H-1H COSY谱可以对该化合物的碳及氢信号进行全面归属。
综合以上信息,化合物1鉴定为
(25R)-5α-spirostan-3β,12β,23α-triol-26-one-3-O-β-D-glucopyranosyl-(1→2)-[β-D-glucopyranosyl-(1→3)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside。化合物1的1H和13C-NMR数据见表1,结构式为:
实施例3化合物2的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物2进行鉴定,结果为如下:
化合物2为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)不显色,酸水解检出D-葡萄糖和D-半乳糖,提示该化合物为螺甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1128.5497(calcd.for C51H86NO26 1128.5438),提示其分子量为1110,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C51H82O26。
在1H-NMR谱中,高场区给出甾体皂苷元上四个特征的甲基信号,其中两个角甲基为单峰,另外两个为双峰,分别位于δ1.01(3H,s,Me-18)、0.66(3H,s,Me-19)、1.33(3H,d,J=6.9Hz,Me-21)和1.20(3H,d,J=7.2Hz,Me-27),与18-Me的氢信号相比,19-Me的氢信号处于高场,说明苷元5位氢为α构型。在糖端基氢区给出四个糖端基氢信号δ4.84(1H,d,J=7.6Hz)、5.14(1H,d,J=7.9Hz)、5.30(1H,d,J=7.8Hz)和5.57(1H,d,J=7.7Hz),结合这些糖端基氢信号的J值与酸水解分析结果,说明分子中的D-葡萄糖和D-半乳糖均为β构型。
13C-NMR(DEPT)中,δ181.1为一个酯羰基碳信号,δ110.5为螺甾类皂苷骨架上22位碳的特征信号。在糖端基信号区给出四个糖端基碳信号δ102.6、104.8、105.2和105.4,提示化合物2为四糖螺甾皂苷。该化合物苷元和糖链部分碳谱数据与化合物1的十分相似,除C环上C-12有差异外,其余基本一致,又因二者具有相同的分子式,推测二者具有相同的平面结构,仅立体构型有差异。化合物2苷元的C-12位于71.7ppm,与化合物1比较向高场位移了7.9ppm,推测在该化合物12羟基为α构型。在ROESY谱中,12位氢信号δ3.93(1H,m)与δ1.01(3H,s,Me-18)和2.79(1H,p,J=8.5,6.8Hz,H-20)相关,说明12位氢为β构型,因而12位羟基为α构型。综合以上信息,化合物2鉴定为
(25R)-5α-spirostan-3β,12α,23α-triol-26-one-3-O-β-D-glucopyranosyl-(1→2)-[β-D-glucopyranosyl-(1→3)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside。化合物2的1H和13C-NMR数据见表1,结构式为:
实施例4化合物3的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物3进行鉴定,结果为如下:
化合物3为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)不显色,酸水解检出D-葡萄糖和D-半乳糖,提示该化合物为螺甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1126.5308(calcd.for C51H84NO26 1126.5282),提示其分子量为1108,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C51H80O26。
在1H-NMR谱中,高场区给出甾体皂苷元上四个特征的甲基信号,其中两个角甲基为单峰,另外两个为双峰,分别位于δ1.15(3H,s,Me-18)、0.64(3H,s,Me-19)、1.50(3H,d,J=7.0Hz,Me-21)和1.20(3H,d,J=7.2Hz,Me-27),与18-Me的氢信号相比,19-Me的氢信号处于高场,说明苷元5位氢为α构型。在糖端基氢区给出四个糖端基氢信号δ4.86(1H,d,J=7.6Hz)、5.15(1H,d,J=7.9Hz)、5.31(1H,d,J=7.8Hz)和5.58(1H,d,J=7.7Hz),结合这些糖端基氢信号的J值与酸水解分析结果,说明分子中的D-葡萄糖和D-半乳糖均为β构型。
13C-NMR(DEPT)中,δ213.0与181.1为羰基碳信号,δ110.6为螺甾类皂苷骨架上22位碳的特征信号。在糖端基信号区给出四个糖端基碳信号δ102.7、104.8、105.2和105.4,提示化合物3为四糖螺甾皂苷。该化合物苷元和糖链部分碳谱数据与化合物2的十分相似,除C环上C-11、C-12和C-13有差异外,其余基本一致。在HMBC谱中,δ2.33(H-11)、2.18(H-11)、1.29(H-14)、2.87(H-17)及1.15(Me-18)与δ213.0相关,说明化合物3苷元12位为羰基。通过1H-NMR、13C-NMR(DEPT)、HSQC、HMBC及1H-1H COSY谱可以对该化合物的碳及氢信号进行全面归属。综合以上信息,化合物3鉴定为
(25R)-5α-spirostan-3β,23α-diol-12,26-dione-3-O-β-D-glucopyranosyl-(1→2)-[β-D-glucopyranosyl-(1→3)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside。化合物3的1H和13C-NMR数据见表1,结构式为:
实施例5化合物4的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物4进行鉴定,结果为如下:
化合物4为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)不显色,酸水解检出D-葡萄糖和D-半乳糖,提示该化合物为螺甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 964.4782(calcd.for C45H74NO21 964.4753),提示其分子量为946,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C45H70O21。
在1H-NMR谱中,高场区给出甾体皂苷元上四个特征的甲基信号,其中两个角甲基为单峰,另外两个为双峰,分别位于δ1.16(3H,s,Me-18)、0.67(3H,s,Me-19)、1.51(3H,d,J=6.9Hz,Me-21)和1.21(3H,d,J=7.1Hz,Me-27),与18-Me的氢信号相比,19-Me的氢信号处于高场,说明苷元5位氢为α构型。在糖端基氢区给出三个糖端基氢信号δ4.88(1H,d,J=7.7Hz)、5.15(1H,d,J=7.8Hz)和5.23(1H,d,J=7.5Hz),结合这些糖端基氢信号的J值与酸水解分析结果,说明分子中的D-葡萄糖和D-半乳糖均为β构型。
13C-NMR(DEPT)中,δ213.1与181.1为羰基碳信号,δ110.6为螺甾类皂苷骨架上22位碳的特征信号。在糖端基信号区给出三个糖端基碳信号δ102.7、105.5和107.3,提示化合物4为三糖螺甾皂苷。该化合物苷元部分碳谱数据与化合物3的基本一致,提示二者含有相同的苷元(25R)-5α-spirostan-3β,23α-diol-12,26-dione。化合物4的糖链部分的核磁数据与文献报道的(25R)-5α-spirostan-3β-ol-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside的糖链部分数据一致,提示二者具有相同的糖组成和连接顺序。在HMBC谱中,外侧葡萄糖的端基氢信号δ5.23(1H,d,J=7.5Hz)与内侧葡萄糖的C-2(δ86.5)相关,内侧葡萄糖的端基质子信号δ5.15(1H,d,J=7.8Hz)与半乳糖的C-4(δ81.4)相关,半乳糖的端基质子信号δ4.88(1H,d,J=7.7Hz)与苷元的C-3(δ77.4)相关,进一步确定了糖链的连接顺序和链接位点。通过1H-NMR、13C-NMR(DEPT)、HSQC、HMBC及1H-1H COSY谱可以对该化合物的碳及氢信号进行全面归属。综合以上信息,化合物4鉴定为
(25R)-5α-spirostan-3β,23α-diol-12,26-dione-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside。化合物4的1H和13C-NMR数据见表1,结构式为:
实施例6化合物5的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物5进行鉴定,结果为如下:
化合物5为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)显粉红色,酸水解检出D-葡萄糖和L-鼠李糖,提示该化合物为呋甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1244.6339(calcd.for C57H98NO28 1244.6275),提示其分子量为1226,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C57H94O28。
在1H-NMR谱中,高场区给出六个特征的甲基信号,包括甾体皂苷元上四个特征的甲基信号,分别位于δ0.99(3H,d,J=6.6Hz)、1.38(3H,d,J=7.1Hz)、1.00(3H,s)和1.09(3H,s),以及两个鼠李糖上甲基的特征信号,分别位于δ1.59(3H,d,J=6.1Hz)和1.76(3H,d,J=6.2Hz),提示分子中含有两分子鼠李糖残基。由于27位甲基的化学位移(δ0.99)小于1.00ppm且26位两个质子的化学位移之差(0.33ppm)小于0.48ppm,说明该化合物为25R呋甾皂苷。
在13C-NMR谱中,δ111.7为呋甾皂苷C-22特征信号,δ100.6、102.0、102.3、105.2和107.6为糖端基碳信号,提示该化合物为五糖呋甾皂苷。该化合物的碳谱数据与文献报道的(25R)-spirostan-5(6)-en-3β,17α-diol-3-O-β-D-glucopyranosyl-(1→2)-α-L-rhamnopyranosyl-(1→4)-[α-L-rhamnopyranosyl-(1→2)]-β-D-glucopyranoside(solanigroside H)的碳谱数据基本一致,除了多出六个属于葡萄糖的碳信号及F环有差别外,其余基本一致,提示该化合物为solanigroside H的F环开环后形成的产物。
在HMBC谱中,多出的葡萄糖端基质子信号δ4.82(1H,d,J=7.7Hz)与苷元C-26(δ75.6)相关,证明葡萄糖连接在化合物的C-26位。通过1H-NMR、13C-NMR(DEPT)、HSQC、HMBC及1H-1H COSY谱并结合文献可以对该化合物的碳及氢信号进行全面归属。综合以上信息,化合物5鉴定为
(25R)-26-O-β-D-glucopyranosyl-furost-5(6)-en-3β,17α,22α,26-tetraol-3-O-β-D-glucopyranosyl-(1→2)-α-L-rhamnopyranosyl-(1→4)-[α-L-rhamnopyranosyl-(1→2)]-β-D-glucopyranoside。化合物5的1H和13C-NMR数据见表2,结构式为:
实施例7化合物6的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物6进行鉴定,结果为如下:
化合物6为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)显粉红色,酸水解检出D-葡萄糖和L-鼠李糖,提示该化合物为呋甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1228.6338(calcd.for C57H98NO27 1228.6326),提示其分子量为1210,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C57H94O27。
在1H-NMR谱中,高场区给出六个特征的甲基信号,包括甾体皂苷元上四个特征的甲基信号,分别位于δ0.98(3H,d,J=6.6Hz)、1.31(3H,d,J=6.7Hz)、0.89(3H,s)和1.04(3H,s),以及两个鼠李糖上甲基的特征信号,分别位于δ1.62(3H,d,J=6.2Hz)和1.76(3H,d,J=6.2Hz),提示分子中含有两分子鼠李糖残基。由于27位甲基的化学位移(δ0.98)小于1.00ppm且26位两个质子的化学位移之差(0.46ppm)小于0.48ppm,说明该化合物为25R呋甾皂苷。
在13C-NMR谱中,δ111.0为呋甾皂苷C-22特征信号,δ141.1和122.2为一对双键碳信号,δ100.6、102.3、103.2、105.1和105.8为糖端基碳信号,提示该化合物为五糖呋甾皂苷。该化合物苷元部分碳谱数据与已知化合物
(25R)-26-O-β-D-glucopyranosyl-furost-5(6)-en-3β,22α,26-triol-3-O-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→4)]-β-D-glucopyranoside苷元部分的碳谱数据基本一致,可以确定该化合物的苷元为(25R)-furost-5(6)-en-3β,22α,26-triol。通过1H-NMR、13C-NMR(DEPT)、HSQC、HMBC及1H-1H COSY谱并结合文献可以对该化合物的碳及氢信号进行全面归属。综合以上信息,化合物6鉴定为
(25R)-26-O-β-D-glucopyranosyl-furost-5(6)-en-3β,22α,26-triol-3-O-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→4)]-[β-D-glucopyranosyl-(1→6)]-β-D-glucopyranoside。化合物6的1H和13C-NMR数据见表2,结构式为:
实施例8化合物7的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物7进行鉴定,结果为如下:
化合物7为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)显粉红色,酸水解检出D-葡萄糖和D-半乳糖,提示该化合物为呋甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1424.6948(calcd.for C63H110NO34 1424.6909),提示其分子量为1406,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C63H106O34。
在1H-NMR谱中,高场区给出甾体皂苷元上四个特征的甲基信号,其中两个角甲基为单峰,位于δ0.86(3H,s,Me-18)和0.61(3H,s,Me-19),另外两个为双峰,位于δ1.33(3H,d,J=6.8Hz,Me-21)和0.97(3H,d,J=6.6Hz,Me-27)。在糖端基氢信号区给出六个糖端基氢信号δ4.74(1H,d,J=7.8Hz)、4.89(1H,d,J=7.6Hz)、5.11(1H,d,J=7.8Hz)、5.16(1H,d,J=7.8Hz)、5.31(1H,d,J=8.0Hz)和5.58(1H,d,J=7.8Hz),结合这些糖端基氢信号的J值与酸水解分析结果,说明分子中的D-葡萄糖和D-半乳糖均为β构型。另外,由于27位甲基的化学位移小于1.00ppm且26位两个质子的化学位移之差(0.46ppm)小于0.48ppm,说明该化合物为25R呋甾皂苷。
13C-NMR中,δ111.0为呋甾皂苷C-22特征信号,δ102.7、104.8、105.1、105.2、105.4和105.8为糖端基碳信号,提示该化合物为六糖呋甾皂苷。该化合物苷元部分碳谱数据与已知化合物(25R)-26-O-β-D-glucopyranosyl-5α-furost-3β,22α,26-triol-3-O-β-D-glucopyranosyl-(1→2)-[β-D-glucopyranosyl-(1→3)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside基本一致,可以确定该化合物的苷元为(25R)-5α-furost-3β,22α,26-triol。对比它们糖链部分的碳谱数据可以发现,该化合物3-O-Gal-(4-1)-Glc的C-6向低场位移至70.4ppm,同时多出六个属于葡萄糖的碳信号(δ105.8、75.5、78.8、71.9、77.5、62.6),推测多出的葡萄糖连接在该葡萄糖的6位。在HMBC谱中,多出的糖端基质子信号δ5.11(1H,d,J=7.8Hz)与内侧葡萄糖的C-6(δ70.4)相关,进一步证明了上述推测的正确性。葡萄糖端基质子信号δ5.58(1H,d,J=7.8Hz)与内侧葡萄糖的C-2(δ81.8)相关,另一葡萄糖端基质子δ5.31(1H,d,J=8.0Hz)与内侧葡萄糖的C-3(δ88.8)相关,从而确定内侧葡萄的C-2、C-3、C-6均连接有葡萄糖。此外,内侧葡萄糖的端基质子信号δ5.16(1H,d,J=7.8Hz)与半乳糖的C-4(δ80.5)相关,半乳糖的端基质子信号δ4.89(1H,d,J=7.6Hz)与苷元C-3(δ77.7)相关,从而确定该化合物3位的糖链为D-Glc-(1→6)-[D-Glc-(1→3)]-[D-Glc-(1→2)]-D-Glc-(1→4)-D-Gal。经查证,该糖链为一未见报道的新糖链。结合TOCSY谱,可以进一步验证糖残基的信号归属。综合以上信息,化合物7鉴定为
(25R)-26-O-β-D-glucopyranosyl-5α-furost-3β,22α,26-triol-3-O-β-D-glucopyranosyl-(1→2)-[β-D-glucopyranosyl-(1→3)]-[β-D-glucopyranosyl-(1→6)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside。化合物7的1H和13C-NMR数据见表3,结构式为:
实施例9化合物8的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物8进行鉴定,结果为如下:
化合物8为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)显粉红色,酸水解检出D-葡萄糖、D-木糖和D-半乳糖,提示该化合物为呋甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1394.6846(calcd.for C62H108NO33 1394.6804),提示其分子量为1376,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C62H104O33。
在1H-NMR谱中,高场区给出甾体皂苷元上四个特征的甲基信号,其中两个角甲基为单峰,位于δ0.88(3H,s,Me-18)和0.61(3H,s,Me-19),另外两个为双峰,位于δ1.31(3H,d,J=6.8Hz,Me-21)和1.05(3H,d,J=6.4Hz,Me-27)。在糖端基氢信号区给出六个糖端基氢信号δ4.84(1H,d,J=7.7Hz)、4.88(1H,d,J=7.5Hz)、5.19(1H,d,J=7.8Hz)、5.23(1H,d,J=7.7Hz)、5.28(1H,d,J=7.7Hz)和5.56(1H,d,J=7.3Hz),结合这些糖端基氢信号的J值与酸水解分析结果,说明分子中的D-葡萄糖、D-木糖和D-半乳糖均为β构型。
13C-NMR中,δ110.9为呋甾皂苷C-22特征信号,δ102.7、103.4、105.1、105.2、105.4和106.8为糖端基碳信号,提示该化合物为六糖呋甾皂苷。该化合物苷元部分的碳谱数据与化合物7基本一致,提示该化合物的苷元为(25R)-5α-furost-3β,22α,26-triol。该化合物苷元C-3、C-26位的糖链部分的碳谱数据分别与已知化合物
(25R)-26-O-β-D-glucopyranosyl-5α-furost-3β,22α,26-triol-3-O-β-D-glucopyranosyl-(1→2)-[β-D-xylopyranosyl-(1→3)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside苷元C-3位和已知化合物26-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl nuatigenin-3-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside苷元C-26位的糖链部分的数据相一致,提示化合物8的C-3、C-26位的糖链分别为D-Glc-(1→2)-[D-Xyl-(1→3)]-D-Glc-(1→4)-D-Gal和D-Glc-(1→2)-D-Glc,其HMBC谱也证实了上述推测。综合以上信息,化合物8鉴定为
(25R)-26-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranosyl-5α-furost-3β,22α,26-triol-3-O-β-D-glucopyranosyl-(1→2)-[β-D-xylopyranosyl-(1→3)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside。化合物8的1H和13C-NMR数据见表3,结构式为:
实施例10化合物9的鉴定
通过理化常数和波谱学手段(HRESIMS、1H-NMR、13C-NMR、HSQC、HMBC及1H-1H COSY谱)对化合物9进行鉴定,结果为如下:
化合物9为白色无定形粉末,对Anisaldehyde(A试剂)反应显黄色,对Ehrlish(E试剂)显粉红色,酸水解检出D-葡萄糖、D-木糖和D-半乳糖,提示该化合物为呋甾皂苷类化合物。HRESIMS(positive)给出准分子离子峰[M+NH4]+m/z 1394.6815(calcd.for C62H108NO33 1394.6804),提示其分子量为1376,结合1H-NMR和13C-NMR(DEPT)可确定其分子式为C62H104O33。
在1H-NMR谱中,高场区给出甾体皂苷元上四个特征的甲基信号,其中两个角甲基为单峰,位于δ0.86(3H,s,Me-18)和0.61(3H,s,Me-19),另外两个为双峰,位于δ1.32(3H,d,J=6.7Hz,Me-21)和0.96(3H,d,J=6.7Hz,Me-27)。在糖端基氢信号区给出六个糖端基氢信号δ4.72(1H,d,J=7.7Hz)、4.87(1H,d,J=7.3Hz)、5.09(1H,overlapping)、5.18(1H,d,J=7.8Hz)、5.22(1H,d,J=7.8Hz)和5.55(1H,d,J=7.2Hz),结合这些糖端基氢信号的J值与酸水解分析结果,说明分子中的D-葡萄糖、D-木糖和D-半乳糖均为β构型。另外,由于27位甲基的化学位移小于1.00ppm且26位两个质子的化学位移之差(0.46ppm)小于0.48ppm,说明该化合物为25R呋甾皂苷。
13C-NMR中,δ110.9为呋甾皂苷C-22特征信号,δ102.7、105.1、105.1、105.2、105.4和105.7为糖端基碳信号,提示该化合物为六糖呋甾皂苷。该化合物苷元部分碳谱数据与已知化合物(25R)-26-O-β-D-glucopyranosyl-5α-furost-3β,22α,26-triol-3-O-β-D-glucopyranosyl-(1→2)-[β-D-xylopyranosyl-(1→3)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside苷元部分的碳谱数据基本一致,可以确定该化合物的苷元为(25R)-5α-furost-3β,22α,26-triol。对比它们糖链部分的数据可以发现,化合物9的3-O-Gal-(4-1)-Glc的C-6向低场位移至70.4ppm,同时多出六个属于葡萄糖的碳信号(δ105.7、75.4、78.7、71.2、77.4、62.7),推测多出的葡萄糖连接在该葡萄糖的6位。在HMBC谱中,多出的糖端基质子信号δ5.09与内侧葡萄糖的C-6(δ70.4)相关,进一步证明了上述推测的正确性。葡萄糖端基质子信号δ5.55(1H,d,J=7.2Hz)与内侧葡萄糖的C-2(δ81.6)相关,木糖端基质子δ5.22(1H,d,J=7.8Hz)与内侧葡萄糖的C-3(δ87.0)相关,从而确定内侧葡萄的C-2、C-3、C-6分别连接有葡萄糖、木糖和葡萄糖。此外,内侧葡萄糖的端基质子信号δ5.18(1H,d,J=7.8Hz)与半乳糖的C-4(δ80.2)相关,半乳糖的端基质子信号δ4.87(1H,d,J=7.3Hz)与苷元C-3(δ77.7)相关,从而确定该化合物3位的糖链为D-Glc-(1→6)-[D-Xyl-(1→3)]-[D-Glc-(1→2)]-D-Glc-(1→4)-D-Gal。经查证,该糖链为一未见报道的新糖链。结合TOCSY谱,可以进一步验证糖残基的信号归属。综合以上信息,化合物9鉴定为
(25R)-26-O-β-D-glucopyranosyl-5α-furost-3β,22α,26-triol-3-O-β-D-glucopyranosyl-(1→2)-[β-D-xylopyranosyl-(1→3)]-[β-D-glucopyranosyl-(1→6)]-β-D-glucopyranosyl-(1→4)-β-D-galactopyranoside。化合物9的1H和13C-NMR数据见表3,结构式为:
表1本发明化合物1-4的1H-NMR和13C-NMR谱数据(pyridine-d5)
表2:本发明化合物5和化合物6的1H-NMR和13C-NMR谱数据(pyridine-d5)
表3:本发明化合物7-9的1H-NMR和13C-NMR谱数据(pyridine-d5)
实施例11抗炎活性试验
对本发明化合物进行体外抗炎活性试验,采用LPS(脂多糖)诱导的RAW 264.7(小鼠巨噬细胞)细胞,建立体外炎症模型。采用MTT和Griess实验,考察本发明化合物对经脂多糖诱导后的RAW 264.7细胞释放炎症介质NO的影响。抗炎药Indomethacin(吲哚美辛)作为阳性对照。
(1)MTT实验
RAW 264.7细胞接种于96孔板中,培养24小时后,加入待测供试品,再培养24h后用MTT法测定样品对肿瘤细胞增殖的抑制率。细胞增殖抑制率按下述公式计算,并用CalcuSyn软件计算被测试样品的半数抑制浓度(IC50)。
细胞增殖抑制率=(阴性对照组OD值平均值-样品组OD值平均值)÷(阴性对照组OD值平均值-空白对照组OD值平均值)×100%。
(2)Griess实验
RAW 264.7细胞接种于96孔板中,培养24小时后,加入待测供试品,再培养24h后,吸取各孔培养液50μL,加入50μL Griess A试剂和50μL Griess B试剂混匀,用酶标仪于546nm处测定OD值,按如下公式计算对NO产生的抑制率,并用CalcuSyn软件计算被测试样品的半数抑制浓度(IC50)。
NO抑制率=(模型对照组OD值平均值-样品组OD值平均值)÷(模型对照组OD值平均值-阴性对照组OD值平均值)×100%。
实验结果见表4。
同时采用IL-6和IL-1β试剂盒测定培养液中IL-6和IL-1β的含量,实验结果见图1.
表4本发明化合物对RAW 264.7细胞释放炎症介质NO的抑制作用
从表4的实验数据可知,化合物1-3、5、6、8、9具有较好体外抗炎活性,其中化合物1-3对炎症介质NO的抑制作用最为显著,明显优于抗炎药吲哚美辛的抑制效果。从图1的实验数据可知,化合物1,3,5在25μM时可以明显抑制炎症因子IL-6的产生,化合物1-5,9在25μM时可以显著降低炎症因子IL-1β的含量,上述结果表明这些化合物可以进一步作为新的抗炎药物进行研究开发。
实施例12抗肿瘤活性试验
本发明化合物对人体3个瘤株的体外抑瘤活性实验,这3个瘤株包括HL-60(人急性髓性白血病细胞),U937(人组织细胞淋巴瘤细胞),HepG2(人肝癌细胞)三种人体肿瘤细胞的细胞毒活性。抗癌药cis-dichlorodiamineplatinum(II)(顺铂)作为阳性对照。
抑制肿瘤细胞增殖(MTT法):将肿瘤细胞接种于96孔板中,培养24h后加入待测试样品,再培养48h后用MTT法测定样品对肿瘤细胞增殖的抑制率。细胞增殖抑制率按下述公式计算,并用CalcuSyn软件计算被测试样品的半数抑制浓度(IC50)。
细胞增殖抑制率=(阴性对照组OD值平均值-样品组OD值平均值)÷(阴性对照组OD值平均值-空白对照组OD值平均值)×100%,实验结果见图2。
从图2的实验数据可知,化合物1-9在浓度为50μM时对HL-60、U937和HepG2三种不同的肿瘤细胞均有不同程度的抑制作用,表明化合物1-9可以进一步作为新的抗肿瘤药物进行研究开发。
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!