一种基于肿瘤抗原ECM1的长肽ERE1及其在肿瘤免疫治疗中的应用的制作方法
本发明涉及肿瘤的免疫治疗领域,尤其涉及一种基于肿瘤抗原ECM1的长肽ERE1及其在肿瘤免疫治疗中的应用,特别涉及通过肿瘤肽疫苗特异性诱导、刺激活化生物体肿瘤特异性T淋巴细胞,激发、增强生物体抗肿瘤免疫功能及其在特异性抗肿瘤免疫治疗中的应用。
背景技术:
肿瘤发病率、死亡率呈逐年上升趋势,目前癌症已经成为严重威胁人类健康的头号杀手。尽管肿瘤的手术治疗、化疗、放射治疗及分子靶向治疗不断取得进展,但肿瘤的有效治疗仍是亟待解决的关键问题。近年来,随着人们对肿瘤的分子机理和免疫机制的不断揭示,肿瘤特异的免疫治疗日益受到重视,而获得理想肿瘤抗原是肿瘤免疫治疗的关键。随着免疫学理论方法和分子生物学方法的飞速发展,大量可以诱导机体免疫应答的肿瘤抗原的发现,为肿瘤免疫治疗开辟了新纪元。
细胞外基质蛋白-1(ECM1)是1994年Mathieu等从鼠的成骨基质细胞株MN7中分离出来的一种分泌型糖蛋白,相对分子质量为85KD。ECM1蛋白质参与多种生物学过程,包括细胞增殖,血管生成,胚胎软骨的形成,皮肤分化等。近年来研究表明,ECM1在乳腺癌、甲状腺癌、喉癌、肝癌、胆管癌、胃癌、结直肠癌、肺癌等多种上皮样恶性肿瘤中高表达,因此,ECM1可作为肿瘤相关抗原成为肿瘤免疫治疗靶点。
近年来,随着对免疫应答分子机制研究的深入,现已逐渐认识到机体的免疫细胞并不是对应于各种各样的病原体或天然抗原的整体分子,而是针对各种各样抗原分子的抗原表位,即蛋白质抗原是通过其表位来体现其免疫特异性。研究表明,CD8+ T细胞所识别的肿瘤抗原需先经抗原提呈细胞处理,之后以“抗原肽-MHC-I类分子”复合物的形式呈现在抗原提呈细胞或靶细胞表面,相应的与MHC-I类分子结合的抗原肽即为CTL表位。肿瘤抗原来源的CTL表位肽能够激活诱导产生特异性细胞毒性T淋巴细胞(CTL细胞),可对人类白细胞抗原(HLA)配型匹配的肿瘤产生杀伤作用。中国人群中MHC-I类最常见的亚型型为HLA-A2。因此,筛选HLA-A2限定性CTL表位,实现靶向肿瘤抗原的免疫治疗也成为目前肿瘤免疫治疗的热点。
由于单独肿瘤抗原CTL表位肽分子量小,不稳定,在体内迅速被水解,其免疫效能有限,因此提升CTL表位肽的免疫活性是目前亟待解决的问题。研究表明,通过氨基酸替换修饰可增强 CTL 表位诱导的靶向抗肿瘤效应。例如,利用氨基酸替换修饰 HLA-A2限制性肿瘤抗原 Ran 表位的氨基酸序列可提升其免疫活性,同样利用氨基酸替换修饰肿瘤抗原POTE来源 HLA-A2限制性CTL表位也获得了免疫活性提升的修饰性表位。另有研究表明,延长表位的氨基酸序列长度也是提升表位活性的有效途径,例如肿瘤抗原CDCA1、KIF20A来源的多表位长肽均显著提升单独CTL表位活性。长肽一般是由大于20个氨基酸的肽段组成,较CTL表位肽(9-10个氨基酸)长,所以长肽进入体内后必须经活化的专职APC加工提呈使T细胞有效活化,而不能像表位肽那样可直接结合在表达MHC分子的细胞上,这样可以减少免疫耐受的发生。长肽片段中存在多个表位,可更有效的产生特异、持久的细胞免疫应答。由于长肽具有CTL表位肽无法比拟的优势,将有可能取代CTL表位用于肿瘤患者的免疫治疗。因此,研发高效、低度的肿瘤抗原来源的长肽,用于肿瘤免疫靶向治疗成为目前研究热点之一。
技术实现要素:
针对上述问题,本发明目的在于提供一种基于肿瘤抗原ECM1的长肽ERE1,具体为HLA-A2限制性免疫靶向ECM1的长肽ERE1,其特征是可诱导ECM1特异性CTL细胞,发挥HLA-A2限制性肿瘤杀伤作用。本发明提供的HLA-A2限制性免疫靶向ECM1的长肽ERE1可用于研制靶向抗原ECM1的治疗性肽疫苗,为上皮样恶性肿瘤精准免疫治疗提供理论基础。
本发明提供的HLA-A2限制性免疫靶向ECM1的长肽ERE1,可诱导产生ECM1特异性的细胞毒性T淋巴细胞,发挥HLA-A2限制性肿瘤杀伤作用,其氨基酸序列为。
Tyr-Leu-Thr-Ile-Asp-Ile-Ser-Arg-Val-Arg-Arg-Tyr-Leu-Thr-Ile-Asp -Ile-Ser-Arg-Val。
所述的HLA-A2限制性免疫靶向ECM1的长肽,为通过添加,缺失或替换一个或多个氨基酸而衍生自ERE1的氨基酸序列组成的突变肽。
所述的HLA-A2限制性免疫靶向ECM1的长肽,为具有ERE1或其突变肽氨基酸序列的游离型多肽、融合型多肽或嵌合型多肽;以及以上所述多肽之一为单体的各种形式的聚合体。
所述的HLA-A2限制性ECM1特异的长肽可通过人工合成,或通过原核细胞或真核细胞表达纯化获得。
本发明的有益技术效果。
本发明提供一种可诱导ECM1特异性CTL细胞的HLA-A2限制性免疫靶向ECM1的长肽,其体外容易合成,能够诱导产生显著靶向抗肿瘤免疫反应,具有非常大的商业产业化价值等优点,可广泛应用于肿瘤免疫治疗技术领域中。所述的HLA-A2限制性免疫靶向ECM1的长肽是将前期筛选的HLA-A2限制性ECM1来源CTL表位(详见专利“与人MHC-I类分子结合的 ECM1多肽表位”,授权号: ZL201310654784.5)首位突变后,利用蛋白酶敏感连接臂(-RR-)串联获得,其可有效被DC内吞进而激活特异性T淋巴细胞,该长肽体外容易合成,方便临床应用。
附图说明
图1为本发明长肽的质谱分析图。
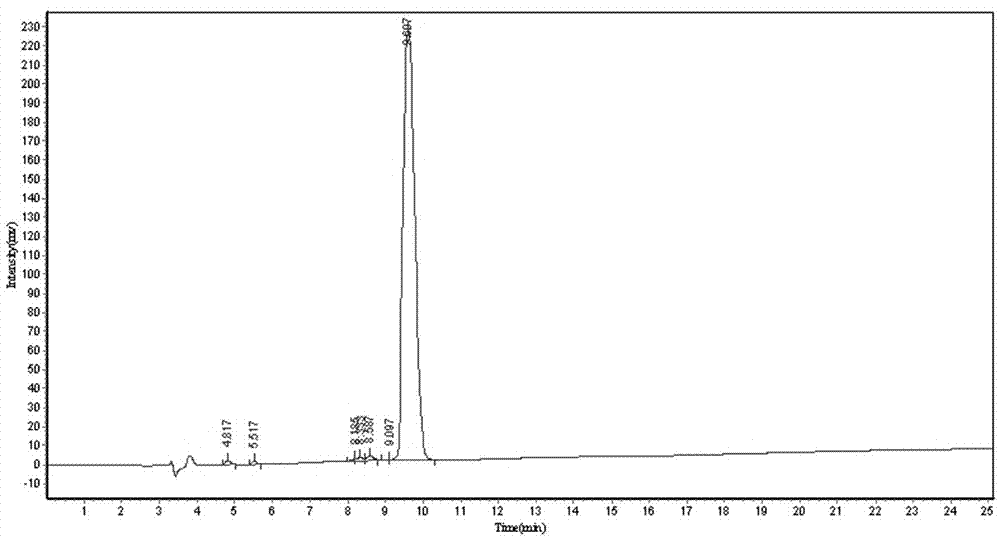
图2为本发明长肽的高效液相色谱法分析图。
图3 ELISPOT法检测本发明长肽诱导HLA-A2阳性PBMC释放IFN-γ水平。
图4 钙黄素实验检测本发明长肽ERE1诱导的效应细胞对乳腺癌MDA-MB-231细胞(HLA-A2阳性)的杀伤作用。
图5钙黄素实验检测本发明长肽ERE1诱导的效应细胞对乳腺癌MCF-7细胞(HLA-A2阴性)的杀伤作用。
图6裸鼠移植瘤模型检测本发明长肽ERE1诱导的效应细胞对乳腺癌生长的抑制作用。
具体实施方式
下面结合具体实施例对本发明做进一步的说明。以下实施例将有助于对本发明的了解,但这些实施例仅为了对本发明加以说明,本发明并不限于这些内容。在实施例中未作特殊说明的操作方法均为本技术领域常规操作方法。
实施例一。
长肽的合成、纯化及分子量测定。
采用标准Fmoc方案,应用美国PE公司生产的ABI43IA型多肽合成仪进行长肽的合成,简述如下:按照多肽序列使肽链从羧基端向氨基端延伸,合成后,选用TFA/DCM进行切割,表位肽收集液在常温下减压干燥至1-2 mL,然后用至少50 mL预冷乙醚沉淀,然后抽滤,得到的多肽粗产品;将获得的长肽粗品用少量DMSO溶解后,用水稀释至所需体积,浓度为10 mg/mL,经0.22μm纤维膜过滤后,在美国Waters公司产品Delta600型HPLC上纯化并进行纯度分析;流动相选用含0.1%TFA水溶液和含0.1%TFA乙氰溶液;各肽的纯化选用C18制备柱(美国Waters公司,7.0μm,100A,7.8mm×150mm),各肽的纯度分析选用C18分析柱(美国Waters公司,5.0μm,100A,3.9mm×150mm);各纯化后长肽的相对分子质量测定在API 2000型(美国Waters公司)质谱仪上安常规方法进行;其质谱分析图参见图1,HPLC分析图参见图2,可以看出长肽的分子量实测值为2451,与理论值2452相近,在允许误差范围之内,且纯度均在95%以上,说明合成效果好,可用于下一步实验;上述多肽经冻干处理后放于-70℃保存、备用。
实施例二。
ELISPOT实验检测IFN-γ分泌水平考察长肽免疫原性。
1、PBMC的制备。
抽取HLA-A2阳性健康志愿者外周静脉血10ml肝素抗凝,用PBS按1:1 稀释,将稀释的血样缓缓的加入盛有淋巴细胞分离液的离心管中,形成明显的分层(稀释血样与淋巴细胞分离液比例为 2:1 ),经1800 rpm,室温水平离心15min;在超净台内吸取试管中间层的单个核细胞(PBMC)于另一无菌的离心管中,用PBS清洗 2次,计数PBMC,于AIM-Ⅴ培养基中培养。
2、ECM1对PBMC致敏。
6孔板中,按照1×106个/ml的密度,应用AIM-Ⅴ培养基培养PBMC,加入5μg人 ECM1重组蛋白致敏PBMC,每周一次,共2次,培养至第14天收集细胞。
3、ELISPOT检测。
(1)常温下往预包被的96孔ELISPOT检测板各个孔中加入200 µl RPMI-1640培养基,静置10 min以活化预包被板。
(2)将致敏的PBMC加入ELISPOT检测板各孔,每孔200µl,含1×105个细胞。
(3)分别加入相应的长肽ERE1及阴性肽,终浓度为50μg/ml,并设立阳性对照(PHA刺激)和阴性对照(仅加培养基);将ELISPOT检测板置于37℃,5% CO2,饱和湿度细胞培养箱内孵育16h。
(4)孵育后倾倒培养基,于检测板各孔中加入200 µl 冰冷的去离子水,于4℃放置10 min,然后倾弃培养板中的去离子水。
(5)每个孔用200 µl 1×Washing buffer洗涤6次,洗涤完成后将检测板在灭菌吸水纸上扣干。
(6)将生物素标记的抗体工作液加入到检测板,每孔加入100µl,加入抗体工作液之后将板置于37℃孵育1小时。
(7)将酶标亲和素工作液加入检测板各孔,每孔加入100 µl,将检测板置于37℃孵育1小时;孵育后,1×Washing buffer清洗检测板7次。
(8)将AEC显色工作液加入检测板各孔,每孔加入100µl,室温孵育,每隔5分钟观察一次,见到检测板有清晰的红色斑点形成的时候倾倒孔内显色工作液,揭开板底座,用大量自来水洗涤终止显色,自然晾干检测板后合上底座。
(9)将检测板交达科为公司进行斑点计数,并作统计分析。
4、结果分析。
计数ELISPOT检测板空地的斑点数目,比较长肽ERE1与阴性肽诱发PBMC分泌IFN-γ的水平,绘制各组IFN-γ分泌水平的柱状图,见图3。
图3所示为长肽ERE1诱导ECM1致敏的HLA-A2阳性健康志愿者PBMC释放IFN-γ水平ELISPOT检测结果统计图;结果表明,HLA-A2限制性ECM1特异长肽ERE1可明显诱导HLA-A2阳性健康志愿者PBMC释放IFN-γ。
实施例三。
钙黄素(Calcein-AM)释放实验检测长肽体外对肿瘤细胞的靶向免疫杀伤效果。
1、效应细胞的制备。
诱导成熟的人DC细胞,以PBS清洗后,无血清RPMI-1640培养基重悬,加50μg/ml 长肽ERE1,37℃孵育过夜;DC细胞经PBS清洗、计数,按30μg/ml的浓度加入丝裂霉素C,37℃孵育30min;DC细胞经冰PBS清洗、计数后,与繁殖期CD8+T细胞按1:20比例共培养,并加入50U/ml的IL-2,以刺激T细胞;1周刺激1次,共3次,将T细胞诱导成细胞毒性T细胞(CTL),即效应细胞。
2、靶细胞的制备。
复苏乳腺癌细胞MCF7、MB-MDA-231,按照常规培养方式进行细胞的正常培养、传代;其中MCF7细胞株为HLA-A2阴性,MB-MDA-231细胞株为HLA-A2阳性。
3、钙黄素释放实验。
以10mM浓度的Calcein-AM标记靶细胞,清洗、重悬。效应细胞与标记后的肿瘤细胞按照1:1、10:1、20:1、40:1、80:1的效靶比例,37℃共培养4h;然后收集培养液,1000rpm离心5min,取100μl上清液测定平均荧光强度,以单纯靶细胞作为自发释放量,以单纯靶细胞加去垢剂作为最大释放量。
效应细胞对靶细胞的杀伤率以细胞溶解率表示:细胞溶解率=(实验释放量-自发释放量)/(最大释放量-自发释放量)。
图4所示为长肽ERE1诱导的效应细胞对乳腺癌MCF-7细胞(HLA-A2阴性)的作用;图5所示为长肽ERE1诱导的效应细胞对乳腺癌MB-MDA-231细胞(HLA-A2阳性)的作用;结果表明:长肽ERE1诱导的CTL对HLA-A2阳性的人乳腺癌细胞MB-MDA-231具有显著杀伤作用,而对HLA-A2阴性的人乳腺癌细胞MCF-7细胞杀伤作用不明显,其杀伤具有HLA-A2分子的限制性。
实施例四。
检测长肽ERE1诱导的CTL对裸鼠移植瘤生长的抑制作用。
1、效应细胞的制备。
诱导成熟的人DC细胞,以PBS清洗后,无血清RPMI-1640培养基重悬,加50μg/ml 长肽ERE1,37℃孵育过夜。DC细胞经PBS清洗、计数,按30μg/ml的浓度加入丝裂霉素C,37℃孵育30min。DC细胞经冰PBS清洗、计数后,与繁殖期呈CD8+T细胞按1:20比例共培养,并加入50U/ml的IL-2,以刺激T细胞。1周刺激1次,共3次,将T细胞诱导成细胞毒性T细胞(CTL),即效应细胞。
2、裸鼠MB-MDA-231皮下移植瘤模型的制备。
酒精消毒裸鼠右腋下皮肤,用1ml注射器抽MB-MDA-231 细胞悬液0.2ml(含MB-MDA-231细胞 2×106个),以于每只裸鼠右侧腋下皮肤扇形注入,见有皮丘鼓起,棉签轻按止血。一般7天左右即可见裸鼠皮下有小的肿瘤长出。
3、观察长肽ERE1诱导的CTL对裸鼠移植瘤生长的抑制作用。
4、待小鼠成瘤后,尾静脉注射上述长肽诱导的CTL细胞悬液0.5ml(含CTL细胞1×107个),每周1次,共2次,同步以阴性肽诱导CD8+T作为对照,末次注射后7d,取小鼠肿瘤组织,计算肿瘤重量以评价长肽ERE1诱导的CTL对裸鼠移植瘤生长的抑制作用。
图6所示为长肽ERE1诱导的效应细胞对乳腺癌MB-MDA-231细胞(HLA-A2阳性)裸鼠皮下移植瘤的抑制作用,其中图6-1为移植瘤实测图;图6-2为移植瘤重量的统计学结果;结果表明:长肽ERE1诱导的CTL显著抑制HLA-A2阳性的人乳腺癌细胞MB-MDA-231裸鼠移植瘤的生长。
序列表
<110> 中国医科大学
<120> 一种基于肿瘤抗原ECM1的长肽ERE1及其在肿瘤免疫治疗中的应用
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 20
<212> PRT
<213> 人工合成
<400> 1
Tyr Leu Thr Ile Asp Ile Ser Arg Val Arg Arg Tyr Leu Thr Ile Asp Ile Ser Arg Val
1 5 10 15 20
- 还没有人留言评论。精彩留言会获得点赞!