一种食源性致病菌沙门氏菌的检测方法与流程
本发明属于微生物筛选技术领域,具体涉及一种食源性致病菌沙门氏菌的检测方法。
背景技术:
沙门氏菌属(Salmonella)分类属细菌界(Bacteria)、变形菌门(Proteobacteria)、γ-变形菌纲(Gammaproteobacteria)、肠杆菌目(Bacillales)、肠杆菌科(Enterobacteriaceae),是一种重要的肠道致病菌,已发现有近一千种(或菌株)。感染沙门氏菌,可引起人类的伤寒、肠热症、感染性腹泻、败血症和胃肠炎等疾病,并引起动物发生沙门氏菌病,是常见的人畜共患型致病菌。蛋、家禽、肉类、水产品是沙门氏菌病的主要传播媒介。据相关数据表明,我国每年因沙门氏菌而导致的食物中毒事件占所有食物中毒事件的70%~80%,居细菌性食物中毒的首位,世界卫生组织(WHO)已将沙门氏菌列入具有严重危害和中等危害的食物传播性病原菌。
传统的沙门氏菌检测是以培养法为基础的微生物学方法,普遍用于食品和药品中沙门氏菌的检验,也是沙门氏菌检验的法定仲裁方法。由于沙门氏菌的血清型过于繁多,食品安全国家标准方法需要经过前增菌、选择性增菌、分离培养、生化鉴定及血清学分型鉴定等5个步骤,工作量大,检测周期长,且受到检测人员的专业、经验等多种因素限制,容易出现误判。因此,如何提供一种便捷快速的检测沙门氏菌的方法一直是研究的热点之一。
技术实现要素:
本发明的目的是提供一种食源性致病菌沙门氏菌的检测方法,以实现对沙门氏菌进行安全、特异、快速、灵敏、简单的现场快速检测,从而弥补现有技术的不足。
本发明首先提供一种用于检测食源性致病菌沙门氏菌的重组酶聚合酶扩增引物对和探针,其中引物对的序列信息如下:
正向引物F-RPA:5′-
GGCGATAGCCTGGCGGTGGGTTTTGTTGTCTT-3′(SEQ ID NO:1)
反向引物R-RPA:ACTTCATCGCACCGTCAAAGGAACCGTAAA-3′(SEQ ID NO:2);
其中反向引物的5′端进行生物素Biotin标记;
探针的序列信息如下:
RPA-P2:5′-
TTGTTGTCTTCTCTATTGTCACCGTGGTCCGTTTATCGTT-3′(SEQ ID NO:2);
其中探针的5′端进行羧基荧光素FAM标记,3′端进行C3-Spacer标记;且第30位的C用四氢呋喃替代;
上述的引物组和探针用于非疾病诊断或治疗领域的食源性致病菌沙门氏菌的检测;
上述的非疾病诊断或治疗领域的食源性致病菌沙门氏菌的检测,是指对水产品中食源性致病菌沙门氏菌的检测;
本发明再一个方面提供检测水产品中食源性致病菌沙门氏菌的方法,包括如下的步骤:
1)配制RPA反应体系:
各引物的终浓度为:引物F-RPA和引物R-RPA各420nmol/μL;探针P 120nmol/μL;缓冲液组成及浓度为:Tris-HCl 50mmol/μL、KAc 100mmol/μL,DTT 2mmol/μL,5%PEG 20mol/μL,dNTPs200μmol/μL,ATP 3mmol/μL,磷酸肌酸激酶)50mmol/μL,肌酸激酶)100ng/μL,DNA聚合酶Bsu 30ng/μL、单链绑定蛋白Gp32300ng/μL、重组酶UvsX 240ng/μL、辅助酶UvsY 60ng/μL、核酸内切酶Nfo 200ng/μL;待检测的样品DNA模板10ng,加双蒸水使未反应的混合体系体积为18μL;280mmol/μL MgAc 1.0μL,使反应体系总体积为20μL;
2)RPA反应体系扩增:
无菌离心管中依次加入除醋酸镁和模板DNA以外的所有反应组分,振荡后离心;加入10ng模板DNA,振荡后离心;向混合体系中加入280mmol/μL MgAc 1.0μL于无菌离心管的盖子上,盖上盖子,离心;摇晃10次,离心;37℃,孵育4min;取出反应管,摇晃10次,离心;40℃,继续孵育16min;
3)LFD检测:取2.0μL核酸扩增产物将产物加入到98μL Buffer中混匀,然后将LFD试纸条垂直浸入混合溶液中显色检测,通过试纸条显色情况判断扩增结果。试纸条的检测线和控制线都呈红色,说明结果阳性;只有控制线呈现红色,检测线位置无颜色,说明结果阴性;控制线未显色,结果无效。
本发明提供一种基于分子生物学的快速检测食源性致病菌沙门氏菌的方法,以实现对沙门氏菌进行安全、特异、快速、灵敏、简单的现场快速检测,从而弥补现有传统检测技术的不足。并且此方法非常适用于现场检测,能够及时、有效的抑制沙门氏菌病疫情的发生,完善食品安全保障体系。
附图说明
图1:沙门氏菌的RPA-LFD优化的引物和探针设计示意图,其中引物由方框圈出,探针由斜体并加下划线表示;
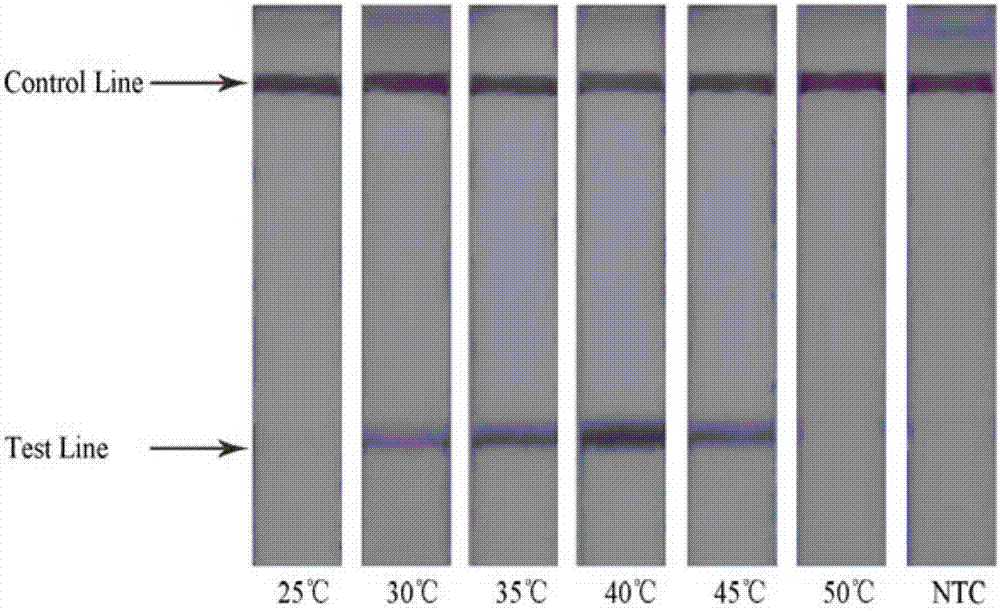
图2:本发明方法的反应温度的优化结果图;
图3:本发明方法的反应时间的优化结果图;
图4:本发明引物和探针的灵敏度的检测结果图;
图5:本发明引物和探针的特异性检测结果图。
具体实施方式
重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)是一项由多种酶和蛋白参与、在恒定温度条件下实现核酸指数扩增的新技术。通过模拟DNA体内扩增,在37~42℃的等温条件下10min内产生目的片段,在40~60min完成数十亿的DNA拷贝。横向流动试纸条(LFD),融合了免疫层析技术和分子生物学手段,能在纸条上形成有颜色的检测线从而可以特异性地检测出该目标产物。重组酶聚合酶扩增技术(RPA)与横向流动试纸条(LFD)相互结合的技术,使RPA扩增产物现场检测可视化,检测结果明显直观,通过肉眼即可辨认,RPA-LFD方法安全、快捷、高效、高灵敏度且无设备及技术限制,非常适合野外现场检测,能对突发状况作出迅速、及时而准确的判断。但是在实际应用中发现如果没有有效的引物和探针组合,常会导致检测过程中出现假阳性或检测灵敏度低下的问题。
下面结合实施例对本发明进行详细的描述。
实施例1:引物及探针设计与筛选:
根据沙门氏菌侵袭蛋白(invasion protein A,invA)编码基因invA基因进行引物设计,通过NCBI查找到公开的invA基因序列
(U43272.1),根据保守区域,经同源性分析后,以位于101-672的基因为目的片段进行RPA引物设计。
设计3组引物对进行最佳引物筛选,引物组及序列如下:
第1组:
正向引物F1-RPA:5′-
TTGTTGTCTTCTCTATTGTCACCGTGGTCC-3′(30bp)
反向引物R1-RPA:5′-
ACTTCATCGCACCGTCAAAGGAACCGTAAA-3′(30bp)
产物长度:231bp
第2组:
正向引物F2-RPA:5′-
TGTCTTCTCTATTGTCACCGTGGTCCAGTT-3′(30bp)
反向引物R1-RPA:5′-
ACTTCATCGCACCGTCAAAGGAACCGTAAA-3′(30bp)
产物长度:227bp
第3组:
正向引物F3-PRA:5′-
GGCGATAGCCTGGCGGTGGGTTTTGTTGTCTT-3′(32bp)
反向引物R1-RPA:5′-
ACTTCATCGCACCGTCAAAGGAACCGTAAA-3′(30bp)
产物长度:253bp
引物筛选:包括如下的步骤
1)配制RPA反应体系:
各引物的终浓度为:引物F-RPA和引物R-RPA各420nmol/μL;探针P 120nmol/μL;缓冲液组成及浓度为:Tris-HCl(pH7.9)50mmol/μL、KAc(醋酸钾)100mmol/μL,DTT(二硫苏糖醇)2mmol/μL,5%PEG 20mol/μL,dNTPs 200μmol/μL,ATP 3mmol/μL,pcr(磷酸肌酸激酶)50mmol/μL,CK(肌酸激酶)100ng/μL,DNA聚合酶Bsu 30ng/μL、单链绑定蛋白Gp32 300ng/μL、重组酶UvsX 240ng/μL、辅助酶UvsY 60ng/μL、核酸内切酶Nfo200ng/μL;样品DNA模板10ng,加双蒸水使未反应的混合体系(reaction mix)体积为18μL;280mmol/μL MgAc(醋酸镁)1.0μL,使反应体系总体积为20μL。醋酸镁能使反应迅速开始,因此需要最后加入。
2)RPA反应体系扩增:
无菌离心管中依次加入除醋酸镁和模板DNA以外的所有反应组分,振荡后离心;加入10ng模板DNA,振荡后离心;向reaction mix中加入280mmol/μL MgAc(醋酸镁)1.0μL于无菌离心管的盖子上,盖上盖子,离心;摇晃10次,离心;37℃,孵育4min;取出反应管,摇晃10次,离心;40℃,继续孵育16min。
3)LFD检测:取2.0μL核酸扩增产物将产物加入到98μL Buffer中混匀,然后将LFD试纸条垂直浸入混合溶液中显色检测,通过试纸条显色情况判断扩增结果。试纸条的检测线和控制线都呈红色,说明结果阳性;只有控制线呈现红色,检测线位置无颜色,说明结果阴性;控制线未显色,结果无效。
预实验结果表明,相同反应条件,第3组引物的扩增效率、产物纯度优于其他2组引物,因此将第3组引物作为优选,并对反向引物R1-RPA的5′端进行生物素Biotin标记。RPA引物的序列如下:
正向引物F-RPA:5′-
GGCGATAGCCTGGCGGTGGGTTTTGTTGTCTT-3′(30bp)
反向引物R-RPA:5′-biotin-
ACTTCATCGCACCGTCAAAGGAACCGTAAA-3′(30bp)
探针设计及筛选:
探针设计:以优选引物组对应目的条带区间为模板设计2条探针,在探针的合适位置插入四氢呋喃(tetrahydrofuran,THF)作为脱碱基位点类似物替代原序列中的碱基,并对探针的5′端进行羧基荧光素FAM标记,3′端进行C3-Spacer标记。修饰后探针序列如下:
RPA-P1:5′-FAM-
CCAAAGGTTCAGAACGTGTCGCGGAAGTCG[THF]GGCCCGATTTTCTCT-C3-Spacer-3′
RPA-P2:5′-FAM-
TTGTTGTCTTCTCTATTGTCACCGTGGTCC[THF]GTTTATCGTT-C3-Spacer-3′
预实验结果表明,相同反应条件,探针RPA-P2效果优于探针RPA-P1,因此将探针RPA-P2作为优选。
反应温度优化
设置25℃,30℃,35℃,40℃,45℃,50℃,进行RPA-LFD实验,反应时间为20min,20μL反应体系,根据前述反应体系添加各组分。模板量为试剂盒提取的1.0μL沙门氏菌基因组DNA。
结果显示,在25℃时,体系中未检出产物扩增,而在30-45℃都检出了产物扩增。40℃时扩增效率最高。RPA反应体系涉及比较多的酶,因此温度过高和过低都会抑制酶活性。选择40℃为最优反应温度,进行后续实验(图2)。
反应时间优化
在最适合的反应温度下,探究最佳反应时间。设置4min,8min,12min,16min,20min。反应温度为40℃,20μL反应体系,根据前述反应体系添加各组分。模板量为试剂盒提取的1.0μL沙门氏菌基因组DNA。
结果显示,在加入镁离子(反应促进剂)反应开始后4min时,体系中未检出产物扩增,此时的扩增子含量可能比较少,还未达到可检测浓度,也可能体系中的各组分之间还在相互作用,没有产物产生,这可能与酶反应动力学有关。反应开始后8min,LFD检测线呈现微红色,说明检出了产物扩增,只是含量较少。当反应时间达到12min以上,扩增子的含量增加。LFD检测线颜色表明,模板量足够的情况下,反应时间12min已经能够检测到明显的阳性扩增。说明RPA反应体系反应迅速,这点优势非常适用于快速检测。考虑到模板量低的情况,后续反应时间选择为16min(图3)。
实施例2引物探针的检测灵敏度和特异性
设置5组不同浓度的沙门氏菌DNA模板(DNA浓度梯度为100、10-1、10-2、10-3、10-4、0),进行RPA最适条件下的核酸扩增。
参照DNA提取试剂盒说明书提取的沙门氏菌DNA,将所提取的DNA模板原始浓度(511.7ng/μL)按10倍梯度稀释成100ng/μL,10ng/μL,1ng/μL,100pg/μL,10pg/μL,1pg/μL,100fg/μL,10fg/μL,1fg/μL,分别取1μL作为反应模板。按照前述加样方法进行核酸扩增,扩增产物LFD进行检测:
结果显示,本发明设计的引物和探针组合能够保证检测时的灵敏性,检测灵敏度为DNA终浓度5fg/μL,相当于5CFU/mL。当模板浓度低于提取DNA浓度的10-8时,不能检出产物的扩增(图4)。
检测特异性
反应时间温度为40℃,反应时间为16min,20μL反应体系,根据前述反应体系添加各组分。Sal模板量为100ng,非特异性菌株(副溶血性弧菌VP,单增李斯特菌LM,溶藻弧菌VA,霍乱弧菌Vc,哈维氏弧菌VH,鳗弧菌Van,金黄色葡萄球菌SA)的DNA分别为各100ng。核酸扩增产物用LFD进行检测。结果显示,除了Sal对应实验组的检测线和控制线都出现了红色,其他非特异性菌株的实验组都只有控制线出现了显色。结果表明,此方法可以实现对沙门氏菌的特异性检测,不与其他相关致病菌发生交叉反应(图5)。
实施例3对实际样品的检测应用
1.样品采购:
水产品来自于水产品流通市场,包括海瓜子(Moerella iridescens)、蛏子(Sinonovacula constricta)、淡菜(Mytilidae)、蛤蜊(Clam)、血蚶(Sanguinolaria)(10g净含量/份)。
2.样品制备
2.1非冷冻样品采集后应立即置7℃~10℃冰箱保存,尽可能及早检验。
2.2贝类取全部内容物,包括贝肉和体液。带壳贝类则应先在自来水中洗刷外壳并甩干表面水分,然后以无菌操作打开外壳,按上述要求取相应部分。
2.3以无菌操作取样品10g,加入Buffered Peptone Water培养基(BPW)90mL,用旋转刀片式均质器以8 000r/min均质1min,或拍击式均质器拍击2min,为增菌前样品液。
3.前增菌
用1mol/mL无菌NaOH或HCl调pH至6.8±0.2。将增菌前样品液于36℃±1℃培养8h~18h。
4.选择性增菌
取前增菌液划线培养于亚硫酸铋琼脂(Bismuth Sulfite Agar,BS)平板上,培养37℃24h±2h。挑取可疑菌落,于1mL BPW,混匀,于36℃±1℃培养18h。
5.鉴定
5.1煮沸法提取DNA作为粗模板:菌液1mL,8000rpm,5min,弃上清,加50μL无菌水重悬,煮沸5min,12000rpm,5min,提取上清液。保存于-20℃备用。
5.2对比方法:参考行业标准《SNT 1870-2007食品中致病菌检测方法实时PCR法》中的方法,作为对比方法。
引物序列:
F-PCR:5’-GCGGCGTTGGAGAGTGATA-3’
R-PCR:5’-AGCAATGGAAAAAGCAGGATG-3’
P-PCR:5’-CATTTCTTAAACGGCGGTGTCTTTCCCT-3’,5’标记FAM,3’标记TAMRA
此方法对沙门氏菌的检测限为5000CFU/mL。Real-time PCR采用两步法扩增核酸,反应程序如下:94℃,预变性10min;94℃变性3s,60℃退火/延伸40s,经40个循环。Real-time PCR通过特定的荧光信号采集进行结果鉴定。
5.3样品检测
a.增菌前样品中Sal鉴定:取1mL增菌前样品液,用煮沸法提取DNA,2μL DNA粗模板分别进行RPA-LFD鉴定和对比方法的鉴定。
b.增菌后样品中Sal鉴定:取1mL选择性增菌液,用煮沸法提取DNA,2μL DNA粗模板进行对比方法的进一步确认。
5.4检测结果
5.4.1以2μL增菌前样品的DNA粗模板分别进行RPA-LFD鉴定和real-time PCR方法的鉴定,结果显示,采用RPA-LFD鉴定结果为四个样品呈Sal阳性,分别是B-1,C-2,G-2,X-2,其他样品鉴定结果为阴性。而real-time PCR鉴定结果为所有样品都为阴性,阳性对照组(反应体系中Sal DNA含量为500ng)出现荧光信号。
5.4.2以2μL选择性增菌后样品的DNA粗模板进行real-time PCR方法的进一步鉴定,结果显示real-time PCR鉴定Sal阳性样品为B-1,C-2,D-1,D-2,G-2,G-3,X-1,X-2,阴性样品为B-2,C-1,G-1。且阳性结果中,样品B-1,C-2,G-2,X-2的Cq值都小于35,说明起始模板中的目的基因含量较高,能在短时间内完成一定量的带标记信号的扩增子,使荧光信号强度较快达到检测阈值。而样品D-1,D-2,G-2,G-3,X-1的Cq值都大于35,说明起始模板中目的基因含量很低,扩增子荧光信号积累达到阈值需要的时间更长。与扩增前样品检测结果比较发现,RPA-LFD在未经微生物培养扩增之前就灵敏检测出部分污染微量沙门氏菌的样品,扩增后real-time PCR鉴定得出的阳性样品结果证明了RPA-LFD检测结果的可靠性。
SEQUENCE LISTING
<110> 宁波大学 宁波海洋研究院
<120> 一种食源性致病菌沙门氏菌的检测方法
<130>
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 32
<212> DNA
<213> 1
<400> 1
ggcgatagcc tggcggtggg ttttgttgtc tt 32
<210> 2
<211> 30
<212> DNA
<213> 2
<400> 2
acttcatcgc accgtcaaag gaaccgtaaa 30
<210> 3
<211> 40
<212> DNA
<213> 3
<400> 3
ttgttgtctt ctctattgtc accgtggtcc gtttatcgtt 40
- 还没有人留言评论。精彩留言会获得点赞!