一种κ‑卡拉胶寡糖单体快速分离纯化的方法与流程
本发明属于海藻低聚糖提取分离技术领域,涉及一种κ-卡拉胶寡糖单体快速分离纯化的方法。
背景技术:
卡拉胶寡糖与其他硫酸低聚糖及其衍生物类似,具有多种生物学活性,如抗肿瘤、抗病毒、抗氧化及调节免疫等。其功能活性与卡拉胶寡糖的聚合度、硫酸基团的取代数量及取代位置有关,已引起了科研工作者的关注,成为食品、医药等领域开发和研究的热点。牟海津等采用酶解法获得不同聚合的新型κ-卡拉胶低聚糖,并采用磺化修饰获得其衍生物,样品能明显抑制小鼠s180肉瘤活性,结果表明其抗肿瘤效果随着硫酸基团的增多而降低,因此卡拉胶低聚糖的抗肿瘤效果与硫酸基团的含量有着密切联系。weiwang等研究发现,低分子量的卡拉胶低聚糖及其硫酸化衍生物可有效地抑制mdck细胞中甲型流感病毒(iva)的生长,同时抗病毒活性最佳的为分子量在1~3kda、硫酸含量在0.8~1.0mole/mole之间的低聚糖片段,进一步阐明了卡拉胶低聚糖的抗病毒活性与其分子量与硫酸基团含量有密切的关系。除此之外,weiwang等进一步验证了κ-卡拉胶寡糖抗h1ni病毒的活性与其分子量有密切关系,即2kda>3kda>5kda。lingxu等、zi-angyao等研究了κ-卡拉胶寡糖对lps诱导的小胶质细胞的免疫调节活性,结果表明κ-卡拉胶寡糖及脱硫κ-卡拉胶寡糖能抑制lps诱导的小胶质炎症细胞的活性,并且呈剂量依赖关系,同时,脱硫κ-卡拉胶寡糖的抗炎效果弱于κ-卡拉胶寡糖。
目前,寡糖分离方法很多,传统的有分步沉淀法、盐析法、超滤、凝胶柱层析、离子交换等,近来发展起来的有高效液相色谱、聚丙烯酰胺凝胶电泳、毛细管电泳、电印迹、离子色谱等新方法。近年来,科研工作者已采用了乙醇分步沉淀法、凝胶过滤层析法(abio-gelp-2column、abio-gelp6column、q-sepharosefastflow)、高效凝胶渗透色谱法(plaquagel-ohcolumn)、体积排阻色谱法(sec)、高效液相系统(superdexpeptide10/300glcolumn)、离子对液相色谱法(spherisorbods1column)、akta快速蛋白液相色谱(superdex30colunm)等对卡拉胶寡糖进行分离纯化。但都因其效率低,制备量小,限制了其工业化应用。其中凝胶柱superdex30colunm及bio-gel为两种最常用的填料,因其较好的灵敏度和分辨率,对于低分子量寡糖,具有较好的分离效果。但由于这些制备柱多被高效液相系统等色谱系统联用,虽然可在线监测,但其制备量及工作效率,大大影响了其规模化应用。
闪式制备色谱技术,根据所施加的压力,可以分为快速色谱(0.1-5/10bars)或中压液相色谱mplc(5/10-50bars)。闪式色谱系统最初用于快速纯化合成化合物的应用,很少见到将这种系统应用在复杂天然产物提取所得混合物的分离中。相比于高效液相色谱和高速逆流色谱法,其制备量大,样品上样量可从毫克级到百克不等,试验时间较短,同时分离柱填料能够自主填充,增加了分离选择性,有效地节约了试验生产成本,在天然产物的分离纯化研究工作中发挥着重要作用。同时,一般配置的制备色谱只有紫外检测器,这并不适用于没有紫外吸收峰的化合物检测,如碳水化合物等;而采用苯酚-硫酸法等离线检测,常需使用有害的化学试剂,且特异性差,分析时间较长,样品浪费也较为严重。卢旭等人,已采用中低压制备色谱系统对莲子低聚糖进行理想的分离纯化,并且上样量较大,得率较高,效果显著。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供一种κ-卡拉胶寡糖单体快速分离纯化的制备方法。以rs分辨率为评价指标,通过优化上样浓度、上样体积、洗脱流速等,确定最佳分离纯化工艺,以期为κ-卡拉胶寡糖单体规模化制备奠定基础;该方法操作方便,同时制备量大,上样浓度可达克级别,纯度高,分离耗时短,工艺过程稳定重现性高,所用预备柱及仪器可重复使用,可实现规模化生产。
为实现上述发明目的,本发明的技术方案在于:
一种κ-卡拉胶寡糖单体快速分离纯化的方法,具体步骤如下:
1)κ-卡拉胶寡糖的酶解制备:用去离子水配制质量浓度为0.2%~0.5%的κ-卡拉胶底物溶液,往溶液中加入用量为反应总体积的5%~10%的κ-卡拉胶酶液,于45℃恒温水浴反应48h,加热煮沸5min终止反应,冷却至室温,水解液于10000r/min离心10min以去除未酶解的不溶性片段;
2)收集离心上清液,依次过10kda、3kda切向超滤膜,收集分子量小于3kda的酶解液,采用sevag法去除上清液中的蛋白、脂类,再次离心取上清液旋蒸浓缩、冷冻干燥,获得κ-卡拉胶寡糖固体混合物;
3)将κ-卡拉胶寡糖固体混合物配制成κ-卡拉胶寡糖溶液,采用中低压制备色谱系统(mediumpressurepreparativeliquidchromatographysystem,简称mplc,包括mplc色谱泵)分离纯化寡糖单体,分离纯化条件为:等度洗脱,柱温:25℃,上样浓度为0.3~1.2g/ml,上样体积为0.5~3ml,洗脱液0.1mnh4hco3,洗脱流速为1~4ml/min;
4)合并组分一致的溶液,旋蒸浓缩,冷冻干燥,采用tlc及esi-ms检测,得到聚合度不同的κ-卡拉胶寡糖单体。
所述κ-卡拉胶酶液为实验室自主筛选菌株发酵制得。发酵方法如下:所述κ-卡拉胶酶液的制备方法如下:将海旋菌(thalassospirasp)fjfst-332菌株于斜面培养基活化24h后,接种至液体种子培养基,接种量为3ml/25ml,在25℃、125r/min震荡培养12h后,得到种子培养液;将培养液接种至发酵培养基中,接种量为3ml/25ml,在25℃、125r/min震荡培养36h,将发酵液以8000r/min转速离心20min,除去培养基中的颗粒性杂质和菌体细胞,收集上清液,分别过50kd和10kd的超滤膜,收集浓缩酶液即为κ-卡拉胶酶液。
优选的,步骤3)中,中低压制备色谱系统分离纯化寡糖单体的条件为:上样浓度为1.2g/ml,上样体积为1ml,洗脱流速为4ml/min。
步骤3)中,每次进样使用3个柱体积的初始梯度流动相平衡色谱柱,每次分离纯化完成后,流动相拉回原梯度冲洗一个柱体积,然后再次准备下次进样。
步骤3)所述的中低压制备色谱系统采用dad紫外全波长扫描器与flashelsd蒸发光散射检测器联合使用,系统的控制和数据采集采用interchimsoftware5.0软件操作;紫外全波长扫描器波长范围:190-840nm,蒸发光散射检测器参数设置:吹扫氮气压力为3.4bar,漂移管温度100℃。
本发明的有益效益在于:
1、发明采用自主筛选的活性菌株酶解制备获得卡拉胶寡糖,该野生菌株(海旋菌(thalassospirasp)fjfst-332)发酵酶解效率高,且产物种类专一,杂质少,产物聚合度并不随酶解时间的延长而进一步断裂降解;
2、本发明首次采用中低压制备色谱联合蒸发光散射系统并结合superdex30colunm预备柱,分离纯化κ-卡拉胶寡糖,操作方便,上样量大、耗时短,所得寡糖单体纯度高,为海藻寡糖的规模化制备奠定了基础。
附图说明
图1不同酶解时间下的酶解产物tlc分析图;
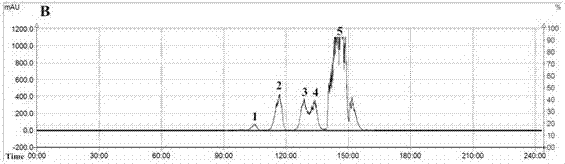
图2a、图2b、图2c、图2d是不同洗脱流速下κ-卡拉胶寡糖色谱图(上样浓度0.6g/ml,上样体积1ml;流动相0.1mnh4hco3;a:1ml/min;b:2ml/min;c:3ml/min;d:4ml/min);
图3a、图3b、图3c、图3d是不同上样浓度下κ-卡拉胶寡糖色谱图(上样体积1ml;洗脱流速4ml/min;流动相0.1mnh4hco3;a:0.3g/ml;b:0.6g/ml;c:1g/ml;d:1.2g/ml);
图4a、图4b、图4c、图4d是不同上样体积下κ-卡拉胶寡糖色谱图(上样浓度1.2g/ml;洗脱流速4ml/min;流动相0.1mnh4hco3;a:0.5ml;b:1ml;c:2ml;d:3ml);
图5κ-卡拉胶寡糖单体tlc分析图;
图6a、图6b、图6c、图6d是κ-卡拉胶寡糖单体的esi-ms图谱(a:κ-卡拉胶二糖;b:κ-卡拉胶四糖;c:κ-卡拉胶六糖;d:κ/ι-卡拉胶六糖)。
具体实施方式
以下是说明本发明的具体实施例,但本发明并不限于此。
一、不同酶解时间对酶解产物的影响
κ-卡拉胶寡糖的酶解制备:用去离子水配制质量浓度0.4%的κ-卡拉胶底物溶液,按反应总体积加入7.5%的κ-卡拉胶酶液,于45℃分别恒温水浴反应1h、4h、8h、12h、24h、30h、36h、48h、72h,加热煮沸5min终止反应,冷却至室温,水解液于10000r/min离心10min以去除未酶解的不溶性片段。
分别取不同酶解时间点下的降解样品,点板观察产物情况,由图1可知,随着酶解时间的延长,酶解产物的种类并没有变化,而产量随着时间的延长而积累,因此综合考虑酶解时间选择为48h。
二、不同洗脱流速下κ-卡拉胶寡糖分离情况
1)κ-卡拉胶寡糖的酶解制备:用去离子水配制质量浓度0.4%的κ-卡拉胶底物溶液,往溶液中加入用量为反应总体积的7.5%的κ-卡拉胶酶液,于45℃分别恒温水浴反应48h,加热煮沸5min终止反应,冷却至室温,水解液于10000r/min离心10min以去除未酶解的不溶性片段;
2)收集离心上清液,依次过10kda、3kda切向超滤膜,收集分子量小于3kda的酶解液,采用sevag法去除上清液中的蛋白、脂类,再次离心取上清液旋蒸浓缩、冷冻干燥,获得κ-卡拉胶寡糖固体混合物;
3)将κ-卡拉胶寡糖固体混合物配制成κ-卡拉胶寡糖溶液,采用中低压制备色谱系统(mediumpressurepreparativeliquidchromatographysystem,简称mplc,包括mplc色谱泵)分离纯化寡糖单体,参数条件为:等度洗脱,柱温为:25℃,上样浓度0.6g/ml,上样体积1ml,洗脱液0.1mnh4hco3,洗脱流速分别为:1、2、3、4ml/min;
4)合并组分一致的溶液,旋蒸浓缩,冷冻干燥。
从图2和表1的结果,综合选择洗脱流速为4ml/min。
三、不同上样浓度下κ-卡拉胶寡糖分离情况
1)κ-卡拉胶寡糖的酶解制备:用去离子水配制质量浓度0.4%的κ-卡拉胶底物溶液,往溶液中加入用量为反应总体积的7.5%的κ-卡拉胶酶液,于45℃恒温水浴反应48h,加热煮沸5min终止反应,冷却至室温,水解液于10000r/min离心10min以去除未酶解的不溶性片段;
2)收集离心上清液,依次过10kda、3kda切向超滤膜,收集分子量小于3kda的酶解液,采用sevag法去除上清液中的蛋白、脂类,再次离心取上清液旋蒸浓缩、冷冻干燥,获得κ-卡拉胶寡糖固体混合物。
3)配置κ-卡拉胶寡糖溶液,采用中低压制备色谱系统(mediumpressurepreparativeliquidchromatographysystem,简称mplc,包括mplc色谱泵)分离纯化寡糖单体,参数条件为:上样浓度0.3、0.6、1.0、1.2g/ml,上样体积1ml,洗脱液0.1mnh4hco3,洗脱速度:4ml/min;
4)合并组分一致的溶液,旋蒸浓缩,冷冻干燥。
从图3和表2的结果,综合选择上样浓度为1.2g/ml。
三、不同上样体积下κ-卡拉胶寡糖分离情况
1)κ-卡拉胶寡糖的酶解制备:用去离子水配制质量浓度0.4%的κ-卡拉胶底物溶液,往溶液中加入用量为反应总体积的7.5%的κ-卡拉胶酶液,于45℃恒温水浴反应48h,加热煮沸5min终止反应,冷却至室温,水解液于10000r/min离心10min以去除未酶解的不溶性片段;
2)收集离心上清液,依次过10kda、3kda切向超滤膜,收集分子量小于3kda的酶解液,采用sevag法去除上清液中的蛋白、脂类,再次离心取上清液旋蒸浓缩、冷冻干燥,获得κ-卡拉胶寡糖固体混合物。
3)配置κ-卡拉胶寡糖溶液,采用中低压制备色谱系统(mediumpressurepreparativeliquidchromatographysystem,简称mplc,包括mplc色谱泵)分离纯化寡糖单体,参数条件为:上样浓度1.2g/ml,上样体积0.5、1.0、2.0、3.0ml,洗脱液0.1mnh4hco3,洗脱速度:4ml/min;
4)合并组分一致的溶液,旋蒸浓缩,冷冻干燥。
从图4和表3的结果,综合选择上样体积为1.0ml。
凝胶层析色谱是混合样品随着流动相流经装有凝胶做固定相的的层析柱时,样品按照分子量大小的不同,按照先后顺序依次被分离。各分子量物质通过填料时同时进行着垂直及扩散流动。分子量大的物质由于颗粒直径较大,不易进入凝胶微孔,只能分布于凝胶颗粒间隙中,随着流动相快速向下移动。分子量小的物质不仅扩散于凝胶颗粒间隙中,还可进入颗粒微孔中,在凝胶颗粒内与间隙间不断分配,从而大分子量的物质快于小分子量物质流出柱外,样品混合物因此而得到分离纯化。resolutionfactor(rs)分辨率用以评价凝胶层析色谱的分离效果,取决于选择性(selectivity)和柱效(efficiency)。峰分离量度高,其选择性好,高选择性可以达到基线分离;柱效与峰宽量度有关,柱效越高峰越窄,高柱效可以弥补选择性的不足。柱效取决于流动相流速、填料粒径大小、粒径分布、层析柱的装填及样品体积和浓度。研究分别优化了洗脱流速、上样浓度及上样体积对分离纯化效果的影响。获得最优纯化参数为:上样浓度1.2g/ml,上样体积1ml,洗脱流速4ml/min。
表1不同洗脱流速下的rs和寡糖得率
表2不同上样浓度下的rs和寡糖得率
表3不同上样体积下的rs和寡糖得率
实施例1
一种κ-卡拉胶寡糖单体快速分离纯化的方法,具体步骤如下:
1)κ-卡拉胶寡糖的酶解制备:用去离子水配制质量浓度0.4%的κ-卡拉胶底物溶液,往溶液中加入用量为反应总体积的7.5%的κ-卡拉胶酶液,于45℃恒温水浴反应48h,加热煮沸5min终止反应,冷却至室温,水解液于10000r/min离心10min以去除未酶解的不溶性片段;
2)收集离心上清液,依次过10kda、3kda切向超滤膜,收集分子量小于3kda的酶解液,采用sevag法去除上清液中的蛋白、脂类,再次离心取上清液旋蒸浓缩、冷冻干燥,获得κ-卡拉胶寡糖固体混合物。
3)配置κ-卡拉胶寡糖溶液,采用中低压制备色谱系统(mediumpressurepreparativeliquidchromatographysystem,简称mplc,包括mplc色谱泵)分离纯化寡糖单体,参数条件为:上样浓度1.2g/ml,上样体积1.0ml,洗脱液0.1mnh4hco3,洗脱速度:4ml/min;
4)合并组分一致的溶液,旋蒸浓缩,冷冻干燥。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!