一种萘基双光子荧光探针及其制备方法和应用与流程
本发明涉及荧光探针,具体是一种萘基双光子荧光探针及其制备方法,以及该探针在细胞线粒体中半胱氨酸检测中的应用。
背景技术:
半胱氨酸(cys)作为人体必需的氨基酸和重要的生物硫醇,在许多细胞的生理活动中发挥着关键作用,如蛋白质转录后的修饰、解毒及其新陈代谢等过程。体内半胱氨酸不足会导致幼儿发育不良、头发脱色、水肿、肌无力、肥胖、肝脏损伤以及皮肤松弛等症状;而半胱氨酸浓度过高也与一些疾病的发生密切相关,包括心血管疾病、神经系统退行性疾病等。因此,针对生物样品中半胱氨酸的高灵敏、实时检测的研究已成为相关领域的研究热点。线粒体是真核细胞中一类非常重要的细胞器,是由两层膜包被的囊状结构,与人的疾病,衰老及细胞凋亡有着密切的联系。为了更好地了解半胱氨酸在生物系统,尤其是线粒体中的作用,发展高敏感、高选择性且线粒体靶向的半胱氨酸检测方法仍旧是一个具有挑战性的课题。
目前文献报道了许多基于半胱氨酸检测的荧光探针,然而由于生物硫醇在结构和生物活性上的相似性,能将半胱氨酸与高半胱氨酸(hcy)和谷胱甘肽(gsh)进行区分检测的荧光探针十分有限,而且这类探针大多数不具有线粒体靶向性且为单光子荧光探针,通常局限于短波激发(400-560nm),光损伤和光漂白较大,限制了在深组织成像中的应用。相反,具有双光子吸收性能的荧光探针结合双光子荧光显微成像技术(tpm),则显示出无可比拟的优势,如:双光子激发波长位于近红外区(700-900nm),在实现深层透射的同时,避免了紫外光对生物组织的损伤及背景荧光的干扰,提高了空间分辨率,有利于三维成像;同时光漂白和光毒化较小,能够对生物样品进行长时间观察等。此外,具有比率发射特性的荧光探针能够避免探针在细胞内分布不均,环境因素以及仪器波动等可能带来的测定误差,为准确定量测定提供有效的工具。因此,迫切需要开发有效的比率发射型双光子半胱氨酸荧光探针,并且能够靶向定位于线粒体,实现对半胱氨酸的的高灵敏实时检测。
技术实现要素:
本发明的目的之一是提供一种萘基双光子荧光探针及其制备方法,目的之二是提供该探针的用途,即利用双光子成像技术在细胞线粒体内半胱氨酸检测中的应用。
本发明提供的一种萘基双光子荧光探针,其结构式为:
该荧光探针选择萘环为双光子母体结构,具有线粒体靶向定位功能的吡啶碘盐为作为荧光团,同时引入2,4-二硝基苯磺酰基作为半胱氨酸的识别基团。利用巯基将2,4-二硝基苯磺酰基断裂产生羟基,发生荧光光谱红移,实现对半胱氨酸的比率检测。该探针能够对半胱氨酸进行灵敏、快速、高选择性的响应,并特异性靶向定位于线粒体,利用双光子成像技术,成功实现对活细胞中半胱氨酸的比率成像。
本发明提供的一种萘基双光子荧光探针的制备方法,包括如下步骤:
(1)将1-甲基-4-[2-(6-羟基-2-萘)-乙烯基]-吡啶碘盐和甲醇钠按摩尔比1:1溶于甲醇中,60℃加热反应4小时,冷却过滤得到蓝色固体。
(2)将上述反应得到的蓝色固体,2,4-二硝基苯磺酸氯和三乙胺按摩尔比1:1.2:1加入到无水乙腈中,60℃加热反应2小时,减压蒸馏得到粗品。
(3)粗品经硅胶柱分离,得到纯品。
其合成路线如下:
本发明的探针具有良好的细胞膜通透性,能够特异性的靶向标记线粒体,并能够对细胞线粒体内半胱氨酸的变化进行高灵敏检测。
与现有的荧光探针相比,本发明萘基双光子荧光探针具有以下优点:(1)本探针合成步骤简便,成本低廉,有利于商品化生产;(2)本探针选择萘环为双光子母体结构,吡啶碘盐为荧光团且具有线粒体靶向定位功能,同时引入2,4-二硝基苯磺酰基作为cys的识别基团。利用巯基将2,4-二硝基苯磺酰基断裂产生羟基,发生荧光光谱红移,实现对cys的比率检测(f583nm/f485nm);(3)对cys的检测在2min内达到最大值,该响应时间比大部分文献报道的生物硫醇探针都要短;(4)荧光强度的比值(f583nm/f485nm)与cys浓度在2.0-10μm范围内呈良好的线性关系,且检测线低达29nm。(5)良好的选择性,本探针与cys的反应比与其他生物硫醇更有活性,应用于细胞内cys的选择性检测而不受其他物质的干扰;(6)在自然光和紫外灯下溶液颜色变化明显,可以通过肉眼观察;(8)本探针能够双光子靶向标记线粒体,同时能够利用双光子荧光成像技术高灵敏检测线粒体内cys的变化。
附图说明
图1.本发明探针的核磁表征,1h-nmr和13cnmr谱。
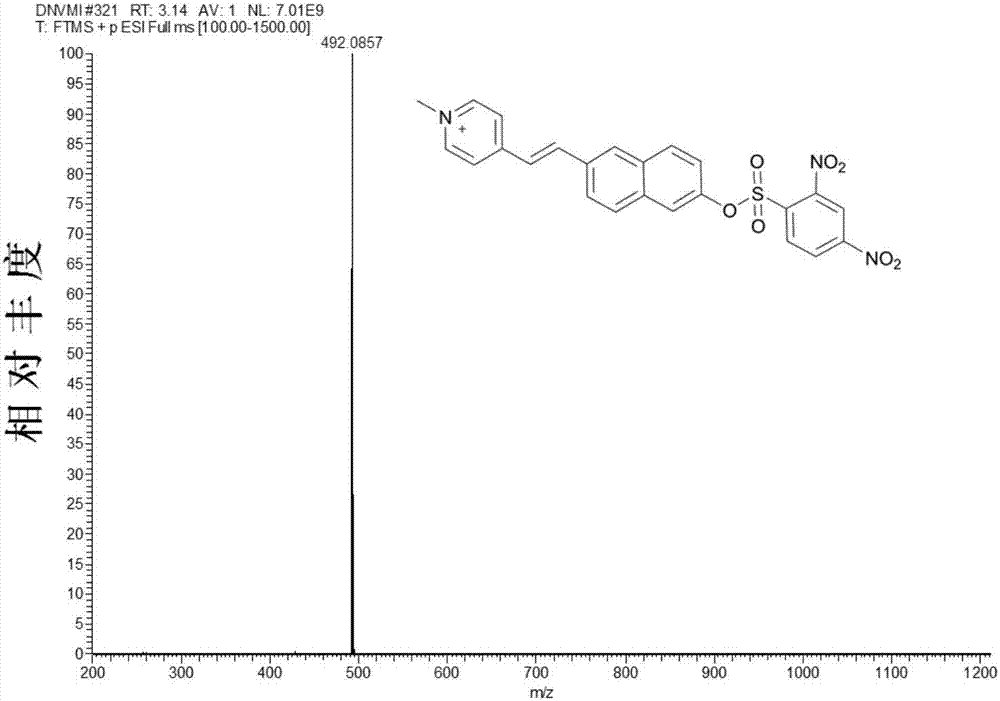
图2.本发明探针的质谱表征,ms(lc-ms)谱。
图3.本发明探针与cys(100μm)反应随时间变化的紫外-可见吸收光谱图。
图4.本发明探针在自然光下识别cys前后颜色变化,颜色由无色变为黄色。
图5.本发明探针与cys(100μm)反应随时间变化的荧光光谱图。
图6.本发明探针在紫外灯下识别cys前后颜色变化,颜色由淡蓝色变为黄色。
图7.本发明探针探针对cys(0-300μm,即0-30eq)响应的荧光光谱滴定图。
图8.本发明探针的荧光强度比值(f583nm/f485nm)与cys浓度在2.0-10μm范围内的线性关系图。
图9.本发明探针(10μm)与各种生物硫醇和na2s(100μm),常见氨基酸和其它各种常见离子(500μm)反应5min后,对cys的选择性。
图10.不同ph值对本发明探针与cys反应的影响。
图11.本发明探针与cys反应后的质谱图。
图12.本发明探针对cys的识别机理。
图13.本发明探针与市售红色线粒体探针(mitotrackerred)在ph值7.4的条件下共同孵育30min的双光子共定位荧光成像图。
图14.本发明探针在细胞中cys经硫醇封阻剂n-乙基马来酰亚胺(nem)处理前后的双光子成像图。
具体实施方式
实施例1
萘基双光子荧光探针的合成路线:
合成步骤及表征:
在n2保护下,将1g(2.56mmol)1-甲基-4-[2-(6-羟基-2-萘)-乙烯基]-吡啶碘盐和0.14g(2.56mmol)甲醇钠加入到50ml无水甲醇中,60℃加热反应4小时,溶液颜色由黄色逐渐变为蓝色,冷却过滤得到蓝色固体,未将处理直接进行下一步反应。将1g(2.43mmol)蓝色固体,0.78g(2.92mmol)2,4-二硝基苯磺酸氯和0.26g(2.43mmol)三乙胺加入到100ml无水乙腈中,60℃加热反应2小时,减压蒸馏得到粗品。粗产品经柱色谱分离(二氯甲烷为流动相)得到土黄色固体1.05g,产率84%。1h-nmr(dmso-d6,600mhz,图1)δ9.16(d,j=2.0hz,1h),8.89(d,j=6.5hz,1h),8.58(dd,2h),8.40(dd,j=8.6,2.1hz,2h),8.34–8.23(m,2h),8.16(d,j=16.2hz,1h),8.12–8.00(m,3h),7.86(s,1h),7.69(d,j=16.4hz,1h),7.40(d,j=8.8hz,1h),4.27(s,3h)ppm.13cnmr(151mhz,dmso,图1)δ152.05(s),151.47(s),148.06(s),147.30(s),146.86(s),145.15(s),144.63(s),139.80(s),133.74(s),133.50(s),131.80(s),131.33(s),130.64(s),129.19(s),128.90(s),127.42(s),125.54(s),124.95(s),124.49(s),123.60(s),121.05(s),119.77(s),118.22(s),46.90(s)ppm.ms(lc-ms,图2)m/zcalcdforc24h18n3o7s+,492.0860,measured,492.0857.
实施例2
将实施例1中的探针用dmso配制浓度为1mm的储备液。将cys溶于二次水配成0.1m的溶液备用。实验中用dmso/pbs缓冲液(ph7.4)体系(v/v=1/1)将探针稀释至终浓度10μm,记录探针与cys(100μm)反应随时间变化的紫外-可见吸收光谱(图3)。随着探针与半胱氨酸反应时间的增长,352nm处的最大吸收峰逐渐减小并红移到392nm处,在370nm处出现一个等吸收点,并且392nm处的吸收峰达到最大的时间为2min。同时溶液颜色由无色变为黄色(图4)。
实施例3
用dmso/pbs缓冲液(ph7.4)体系(v/v=1/1)将探针稀释到10μm,记录探针与cys(100μm)反应随时间变化的荧光光谱光谱,固定激发波长为370nm,激发和发射狭缝宽带均为2.0nm。如图5所示,未加cys之前,探针的最大荧光发射位于485nm处,随着探针与半胱氨酸反应时间的增长,485nm处的荧光发射逐渐降低,在583nm处出现一个新的荧光发射并显著增强,同时在502nm处出现一个清晰的等电点。并且该反应在2min达到最大值,这个反应速度比大部分文献报道的生物硫醇探针都要快。在紫外灯照射下,溶液的颜色由浅蓝色变为绿色(图6)。
实施例4
用dmso/pbs缓冲液(ph7.4)体系(v/v=1/1)将探针稀释到10μm,记录探针对cys(0-300μm,即0-30eq)响应的荧光光谱滴定实验,固定激发波长为370nm,激发和发射狭缝宽带均为2.0nm。如图7所示,随着cys浓度的增大,探针呈现显著的比率荧光发射特性(f583nm/f485nm),并且当cys浓度增大到10μm(即1eq)时,探针在583nm出的荧光强度达到最大值。此外,荧光强度的比值(f583nm/f485nm)与cys浓度在2.0-10μm范围内呈良好的线性关系(图8)。线性回归方程为f583nm/f485nm=1.591ccys-2.766,线性相关系数为0.992,并且检测线低达29nm。
实施例5
考察实施例1中的探针(10μm)与各种生物硫醇和na2s(100μm),常见氨基酸和其它各种常见离子(500μm)反应5min后,对cys的选择性。由图9可知,探针与cys反应后f583nm/f485nm增加超过14倍,而hcy,gsh和na2s的比率荧光(f583nm/f485nm)小于3.7倍,未对cys的检测形成明显干扰,此外,其他物质的比率荧光(f583nm/f485nm)均未发生明显的改变。该结果证明探针与cys的反应比与其他生物硫醇更有活性,并且可以应用于细胞内cys的选择性检测而不受其他物质的干扰。图9中各物质的顺序和浓度依次为:(1)blank;(2)cys;(3)hcy;(4)gsh;(5)na2s;(6)asp;(7)val;(8)phe;(9)tyr;(10)ala;(11)ser;(12)leu;(13)arg;(14)pro;(15)thr;(16)glu;(17);try;(18)iso;(19)lys;(20)gly;(21)k+;(22)na+;(23)ca2+;(24)mg2+;(25)al3+;(26)zn2+;(27)cl-;(28)cu2+;(29)fe3+;(30)br-;(31)so32-;(32)so42-;(33)co32-;(34)aco;(35)no3-;(36)no2-.
实施例6
考察不同ph值对实施例1中的探针(10μm)及其与cys(10μm)反应的影响。如图10所示,在ph值3-9范围内,其改变对探针本身的f583nm/f485nm值没有任何影响,说明探针对ph值的稳定性;当探针中加入cys后,在ph值小于5时f583nm/f485nm值没有明显的改变,大于5后f583nm/f485nm值迅速增加并在生理ph值7.4附近达到最大值。结果表明,探针可以在较大的ph值范围内稳定存在,并且在ph7.4附近对cys的响应能力最佳,适宜于生物体系的应用。
实施例7
利用质谱考察探针和cys的反应产物。如图2所示,探针本身主要观察到m/z为492.0857的峰。当探针与cys反应后,主要观察到质谱峰m/z值为288.0287(图11)和262.1222(图11),分别与化合物1和2的质谱峰一致。该结果证实,探针对cys的识别机理如图12所示。半胱氨酸的巯基可将磺酰酯基断裂产生羟基得到化合物1,同时产生化合物2并脱去so2分子。
实施例8
将实施例1中的探针、市售红色线粒体探针(mitotrackerred)与hela细胞在ph值7.4条件于37℃、5%co2的孵育箱中共同孵育30min,分别在双光子和单光子显微镜下观察荧光成像。固定激发波长分别为760nm和580nm,发射波段分别收集黄色通道(510-610nm)和黄色通道(620-660nm)。如图13所示,探针的双光子绿色荧光(图13a,假色成像)和mitotrackerred的单光子红色荧光(图13b)能够很好的重叠(图13c)。此外,二者在细胞内的荧光光谱变化趋向一致(图13e),且共定位率高达0.94(图13f),说明探针能有效地靶向线粒体。
实施例9
将实施例1合成的探针与hela细胞在ph值7.4条件于37℃、5%co2的孵育箱中孵育30min,固定激发波长分别为760nm,发射波段分别收集蓝色通道(400-500nm)和黄色通道(510-610nm)。在双光子显微镜下探针观察到非常弱的蓝色荧光(图14a,蓝色通道)和明亮的黄色荧光(图14b,黄色通道),这是由于细胞中存在内生的cys。其次,将细胞用n-乙基马来酰亚胺(nem,1.0mm)预处理(硫醇封阻剂,能够屏蔽细胞内硫醇类物质)30min,然后与探针(10μm)共孵育30min,这时,蓝色通道的蓝色双光子荧光增强(图14d),而黄色通道中的黄色荧光发射减弱(图14e),表明硫醇类物质被nem完全屏蔽。最后,将nem预处理过的hela细胞与cys(100μm)共孵育20min,然后加入探针(5μm),可观察加了cys的细胞的蓝色荧光明显减弱(图14g,蓝色通道),同时黄色荧光急剧增强(图14h,黄色通道)。该结果证实探针有能力作为比率型双光子荧光探针实现对活细胞线粒体内cys的高灵敏检测。
- 还没有人留言评论。精彩留言会获得点赞!