一种基因敲除动物模型在男性生殖研究中的应用的制作方法
本发明属于生物技术领域,更具体地,本发明涉及一种基因敲除动物模型在男性生殖研究中的应用。
背景技术:
随着生活节奏加快、社会压力及遗传等原因的影响,现代社会中很多男性都患上了不育症,许多家庭存在不孕不育的问题中有大约一半都是由于男性不育造成的。精子活力较差的男性其预期寿命也相对较短,其中的原因一直没有得到了解,至今也没有开发出很好的生化标记物和预防策略。
精子发生及成熟是一个复杂的细胞分化过程,进入分化途径的精原细胞产生初级精母细胞;初级精母细胞进入减数分裂,依次产生次级精母细胞和单倍体的圆形精子细胞,圆形精子细胞经历复杂的形态变化形成精子细胞,精子细胞最终成熟于附睾中。精子发生及成熟是一个高度调控的发育过程。减数分裂是指有性生殖的个体在形成生殖细胞过程中发生的一种特殊分裂方式。减数分裂仅发生在生命周期某一阶段,它是进行有性生殖的生物性母细胞成熟、形成配子的过程中出现的一种特殊分裂方式。
由于动物遗传体系的复杂性以及不可确定性,本领域中,获得典型症状、能够稳定存活、传代的动物模型是存在较大难度的。这使得生殖领域的研究工作存在很大的瓶颈。因此,本领域还需要找到与男性生殖功能密切相关的基因,以及构建生殖功能障碍的动物模型。
技术实现要素:
本发明的目的在于提供uhrf1基因敲除动物及其在男性生殖研究领域的用途。
发明内容
本发明的目的在于提供精原细胞特异性敲除uhrf1基因的动物模型的一种新的研究用途。
在本发明的第一方面,提供一种制备生殖障碍的动物的方法,所述方法包括:使动物基因组中uhrf1基因降低表达或失活。
在一个优选例中,通过基因敲除的方法使动物基因组中uhrf1基因降低表达或失活。
在另一优选例中,所述的基因敲除是敲除动物基因组中uhrf1基因的第五个外显子序列。
在另一优选例中,将seqidno:2分别插入uhrf1第五外显子的上游470位之前的位置和下游228位之后的位置,从而敲除动物基因组中uhrf1基因的第五个外显子序列。
在另一优选例中,应用loxp-cre方法使动物基因组中uhrf1基因降低表达或失活。
在另一优选例中,所述的动物是啮齿类动物;较佳地,所述的动物是鼠;如大鼠,小鼠。
在本发明的另一方面,提供前面任一所述的方法获得的生殖障碍的动物的应用,用于:
作为筛选治疗雄性/男性生殖障碍的候选药物或治疗剂的动物模型;
作为研究雄性/男性睾丸发育或研究生殖障碍的动物模型;
作为研究雄性/男性生殖细胞发育的动物模型;
作为研究雄性/男性生殖细胞的减数分裂的动物模型;
作为研究雄性/男性精子发生及成熟过程的动物模型;
作为研究雄性/男性生殖的动物模型;或
作为研究提高雄性/男性精子数量及改善男性精子质量的动物模型。
在一个优选例中,该应用为非诊断性、非治疗性的应用。
在另一优选例中,所述的动物是啮齿类动物;较佳地,所述的动物是鼠;如大鼠,小鼠
在本发明的另一方面,提供使动物基因组中uhrf1基因降低表达或失活的试剂的用途,用于制备使动物生殖障碍的组合物(药物)。
在另一优选例中,所述的使动物基因组中uhrf1基因降低表达或失活的试剂是基因敲除试剂,其敲除动物基因组中uhrf1基因的第五个外显子序列。
在本发明的另一方面,提供用于制备生殖障碍动物的试剂盒,所述试剂盒中包括:使动物基因组中uhrf1基因降低表达或失活的试剂;较佳地,所述的使动物基因组中uhrf1基因降低表达或失活的试剂是基因敲除试剂,其敲除动物基因组中uhrf1基因的第五个外显子序列。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
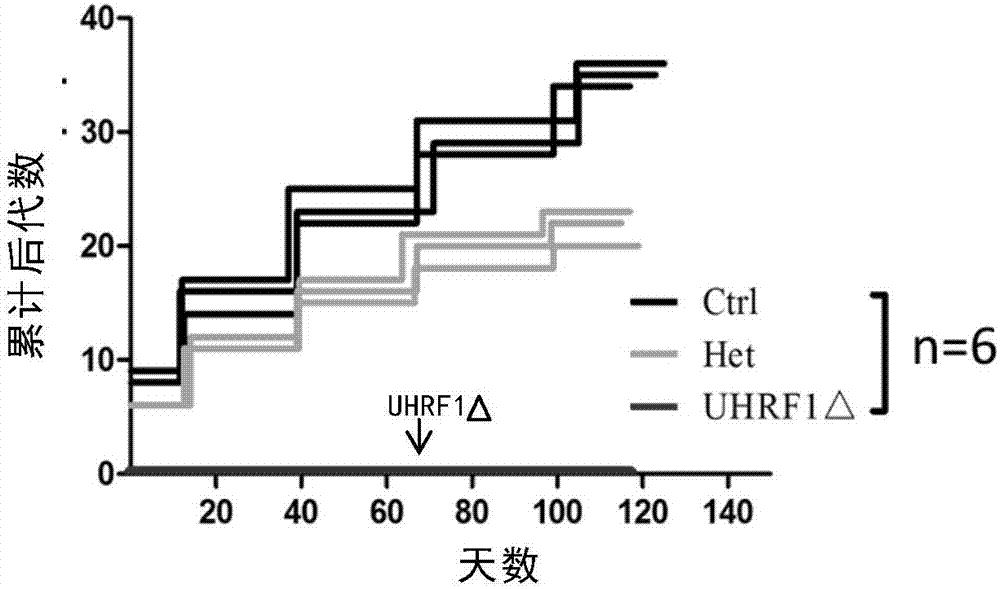
图1、uhrf1对雄性小鼠生育力的影响。
图2、uhrf1基因对睾丸发育的影响。*表示p≤0.05,***表示p≤0.01。
a、uhrf1基因缺失导致睾丸发育过程中重量减轻,且成显著性差异;
b、uhrf1基因敲除后,睾丸体积明显小于同窝对照组。
图3、uhrf1基因对小鼠睾丸形态结构的影响。与对照组相比,uhrf1基因缺失组小鼠睾丸切片多个曲细精管出现生殖细胞丢失的现象。
图4、uhrf1对小鼠精子形成的影响。
a、与对照组相比,uhrf1敲除组检测不到精子。
b、在对照组的附睾尾部出现大量的精子;当uhrf1基因被敲除后,附睾中不能见到精子。
图5、uhrf1对生精细胞凋亡的影响。
图6、uhrf1对减数分裂进程的影响。
具体实施方式
本发明人经过深入的研究,筛选到一个适用于被改造而制备具有典型症状的动物模型的基因——uhrf1基因。在特异性敲除该基因后,敲除鼠表型出现睾丸体积和重量减小,雄性生殖细胞发育异常,减数分裂进程打乱,精子不能正常形成。本发明的方法获得的动物模型是一种有效的、典型的生殖功能障碍动物模型,可用于研究生殖功能障碍疾病,并可以用于特定药物的筛选和测试试验,以及应用于男性/雄性生殖研究领域。
uhrf1基因
如前所述,由于动物遗传体系的复杂性以及不可确定性,本领域中,获得典型症状、能够稳定存活、传代的动物模型是存在较大难度的。而本发明人经过大量筛选后,获得了一种仅通过单个基因的敲除即可制备的新型的生殖功能障碍动物模型。
uhrf1(ubiquitin-like,phdandringfingercontaining1)为一种表观遗传学因子,其功能之一就是调节dna甲基化水平。首先,在细胞周期s期甲基化dna复制时,新链与旧链就会出现半甲基化的中间状态。uhrf1通过其sra区与半甲基化的dna特异性结合,招募dnmt1到uhrf1-dna的复合体上,并通过其甲基转移酶的活性,将半甲基化dna双链转化成全甲基化dna双链。其次,uhrf1的ttd功能区(tandemtudordomain)能与染色质中组蛋白3第9位发生了甲基化的赖氨酸(h3k9me2或h3k9me3)特异性结合。最后,uhrf1还有一个功能区具有e3泛素连接酶活性。当uhrf1与dnmt1结合后,能够将后者降解。由此可见uhrf1对dna甲基化存在正反两个方向的调控作用。尽管本领域对于uhrf1的功能已经有所研究,但目前本领域中,尚没有将uhrf1应用于人或动物的生殖科学研究。
应理解,术语“uhrf1”还包括各种天然存在的uhrf1基因的变异形式。代表性的例子包括:因密码子的简并性而编码与野生型相同的uhrf1蛋白的核苷酸序列,编码野生型uhrf1蛋白的保守性变异多肽的核苷酸序列。
动物模型的制备
在本发明中,提供了一种非常有效的生殖功能障碍动物模型的制备方法。所述方法包括:使动物基因组中uhrf1基因降低表达或失活。
如本文所用,术语“动物”较佳地为啮齿类动物;例如,包括(但并不限于):大鼠、小鼠。
如本文所用,所述的“生殖功能障碍的动物”或“生殖功能障碍的动物模型”是指产生选自以下一种或多种(较佳地至少2种;更佳地至少3种或3种以上)异常症状的雄性动物:不育,生育力下降,睾丸显著减小,睾丸形态结构缺陷,附睾中无精子或精子量显著减少,睾丸中生殖细胞发生显著凋亡,睾丸组织中处于减数分裂前期的细线期和偶线期细胞比例明显增加、偶线期细胞的比例又明显减少。
如本文所用,术语“uhrf1基因降低表达或失活”包括uhrf1基因杂合地和纯合地降低表达或失活。也即,uhrf1基因降低表达或失活的动物可以是杂合或纯合的动物,最佳地是纯合的动物。
如本文所用,所述的“uhrf1基因降低表达”是指与野生型的动物相比,改造的动物(全身或部分组织)的uhrf1基因的表达量显著性降低,如降低至野生型的50%以下;较佳地降低至野生型的30%以下;更佳地降低至野生型的10%或5%以下。并且,所述的“uhrf1基因降低表达”也包括“uhrf1基因不表达”的情形。
如本文所用,术语“uhrf1基因降低表达或失活”包括全身的,或特定细胞类型,或特定组织范围的uhrf1基因降低表达或失活。
可使用多种方法来使得“uhrf1基因降低表达或失活”,包括:基因剔除或转入外源基因(或片段)而使uhrf1基因降低表达或失活;以rnai试剂进行基因干扰或基因沉默;以抗uhrf1抗体进行处理使得uhrf1蛋白失去活性。例如,通过条件性基因剔除;或通过uhrf1基因中插入外源基因(或片段)而实现敲除。
作为本发明的优选方式,应用cre和loxp方法使动物基因组中uhrf1基因降低表达或失活。更佳地,所述的基因敲除是敲除动物基因组中uhrf1基因的一段特定序列包括第五个外显子序列,也包括部分内含子序列。
本发的制备动物模型的方法操作简单,获得的动物模型稳定性好。
作为另一种可选择的方式,通过敲除uhrf1基因,从而下调uhrf1基因的表达。较佳地,采用crispr/cas9系统进行基因编辑。将sgrna或能形成所述sgrna的核酸、cas9mrna或能形成所述cas9mrna的核酸共转入动物精原细胞中,获得经基因编辑的动物。所述的能形成所述sgrna的核酸可以为核酸构建体或表达载体,或所述的能形成所述cas9mrna的核酸可以为核酸构建体或表达载体,将这些表达载体导入到细胞内,从而在细胞内形成有活性的sgrna及cas9mrna。此外,可以体外转录获得cas9mrna以及sgrna。
本发明构建的动物模型可以用于特定药物的筛选和测试试验,可以作为科学研究和新药评价的有力工具。具体体现在:用于作为筛选治疗雄性/男性生殖障碍的候选药物或治疗剂的动物模型;作为研究雄性/男性睾丸发育或研究生殖障碍的动物模型;作为研究雄性/男性生殖细胞发育的动物模型;作为研究雄性/男性生殖细胞的减数分裂的动物模型;作为研究雄性/男性精子发生及成熟过程的动物模型;作为研究雄性/男性生殖的动物模型;或作为研究提高雄性/男性精子数量及改善男性精子质量的动物模型。
作为一种筛选药物方面的应用,可以将候选药物给予本发明的动物模型,观察动物的症状变化,来确定药物的有效性。
在本发明中,候选药物或治疗剂是指已知具有某种药理学活性或正在被检测的可能具有某种药理学活性的物质,包括但不限于核酸、蛋白、糖类、化学合成的小分子或大分子化合物、细胞等。候选药物或治疗剂的给药方式可以是口服、静脉注射、腹腔注射、皮下注射、椎管给药或直接脑内注射。
试剂盒
基于本发明的方法,本发明还提供了用于制备生殖功能障碍动物模型的试剂盒,所述试剂盒中包括:使动物基因组中uhrf1基因降低表达或失活的试剂。较佳地,所述的使动物基因组中uhrf1基因降低表达或失活的试剂是基因敲除试剂。
所述的试剂盒中,还可包括说明实施本发明的制备生殖功能障碍动物模型的方法的使用说明书,以便于本领域技术人员应用。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
为探究uhrf1基因敲除鼠动物模型是否可以应用于男性生殖研究领域,本发明经过深入的研究,首次揭示了uhrf1基因敲除鼠可以作为研究生精细胞发育的新的动物模型。
uhrf1基因,在第19个染色体4,903,080-4,962,154上,由20个外显子构成。uhrf1蛋白的分子量约90kd,在小鼠和人的多个组织中表达。本动物模型运用loxp-cre系统,将小鼠精原细胞的uhrf1敲除。
用途
uhrf1敲除动物模型是通过loxp-cre系统实现的。具体说就是将uhrf1的loxp小鼠于精原细胞特异性表达cre的stra8-cre工具鼠杂交,获得的stra8-cre:uhrf1f/+杂合子再进行交配,得到uhrf1敲除小鼠。
小鼠出生后剪下小鼠脚趾,进行基因型鉴定。根据电泳条带的大小,可以判断是否得到正确基因型小鼠,即基因型为stra8-cre:uhrf1f/f的小鼠。通过对睾丸的westernblot检测,可以判断uhrf1是否已被敲除,即是否得到了uhrf1的敲除小鼠。
为研究uhrf1基因敲除小鼠模型是否可以应用于精子发生及成熟领域,本发明人对敲除鼠的睾丸和附睾进行检测,结果发现敲除鼠组的睾丸体积和重量明显小于对照组,而且根据组织形态切片,发现uhrf1缺失小鼠睾丸生精细胞大量丢失,附睾中检测不到精子。这表示uhrf1基因敲除小鼠模型可以作为研究精子发生及成熟的动物模型。
为了研究uhrf1基因敲除鼠模型是否可以应用于雄性减数分裂研究领域,本发明人对敲除鼠的减数分裂前期各阶段的细胞包括细线期,偶线期,粗线期和双线期的细胞组分,发现uhrf1基因敲除小鼠生精细胞减数分裂个组分比例失调,这表示uhrf1基因敲除鼠模型可以作为研究雄性生殖细胞减数分裂的动物模型。
除非另行定义,文中所使用的所有专业于科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
材料
bouin’s固定液:购自上海生工生物技术有限公司。
乙醇:二甲苯购自上海市天莲化工有限公司。
sycp3抗体:购自abcam抗体公司。
dtt,pmsf,胶原酶iv,胰酶等试剂:均购自sigma试剂公司。
tunel试剂盒:购自promega生物技术公司。
实施例1、uhrf1敲除小鼠的建立
uhrf1敲除小鼠通过loxp-cre系统实现的。
首先,构建uhrf1的loxp小鼠:以野生型c57bl/6小鼠作为出发鼠,通过基因打靶技术将loxp序列(ataacttcgtatagcatacattatacgaagttat(seqidno:2))分别插入uhrf1第五外显子的上游470位之前的位置和下游228位之后的位置;构建uhrf1的loxp小鼠。
敲除动物基因组中uhrf1基因的一段特定序列,包括第五个外显子序列及部分内含子序列(seqidno:1中第471位到631位(即下划线部分)是uhrf1的第五个外显子序列):
gtcgagatatctagacccagctttcttgtacaaagtggttgatatctctatagtcgcagtaggcggaaggatctagggttacgtgggaggttccactctggagtgtatggaggcctgggatgtggctcagcaactggacctagtgtcacatgtggtcactacttatttgctgtcagtaaacctctatggagatagtcacagccatcagagcagaggtctcttgcagatggtgtttgttgagctgtttgtacagaatagtccagtctcatccagtgtccatagtgctgagctttgctgccaggtaggacatggtggctcacacctaacatccccttacctctggaggctgaggcagcatgcttgagtgtgtaaggccaacctgggctacagagtaaaacttggaggcatagctgggcacaggccctgggtctgctctgctgctgggtctcctgagccgcctcttcccgtaggtcaatgagtatgtggacgtgcgtgacaatatcttcggtgcatggtttgaggcccaggtggtccaggtacagaagagagccctatctgaggacgagccctgtagctccagtgccgttaagacctcggaggatgacatcatgtaccatgtcaagtatgatgagtgagtgccatcagtcctgccctgtcctccccaagtgactgctgctggggatatgggaggctgcccttgtcccatcctcattgccctgtttagacaaagggcccttccttcttccctgggcttcctagtgctaggagcccagccatgtgctgccctgccttgatctgatcctgttcagtctgtgtgtgtgaagctcgctctctctgagatggcgcaacgcaattaatgataacttcgtatagcatacattatacgaagttat(seqidno:1)
其次,构建精原细胞特异性表达cre的stra8-cre工具鼠,该工具鼠的遗传背景为c57bl/6。该小鼠的获得方法:stocktg(stra8-icre)1reb/j小鼠(购自美国jacksonlaboratory)与野生型c57bl/6小鼠进行杂交,获得带cre的阳性子代小鼠与野生型c57bl/6小鼠回交6代,所获得的带cre的阳性子代即遗传背景为c57bl/6的stra8-cre工具鼠。
之后,将uhrf1的loxp小鼠与遗传背景为c57bl/6精原细胞特异性表达cre的stra8-cre工具鼠杂交,获得的stra8-cre:uhrf1f/+杂合子再进行交配,得到精原细胞特异性敲除uhrf1的小鼠。
实施例2、小鼠生殖能力及一般行为观察
收集同窝野生对照鼠和uhrf1敲除公鼠,每天观察小鼠的一般行为,包括进食、活动、毛色、体重改变等情况,对到达6周龄的公鼠分别和5周龄发情期的雌鼠合笼,次日收集检测到阴栓的雌鼠统计所生小鼠窝仔个数。
uhrf1对雄性小鼠生育力的影响如图1所示。由图1可见,与对照组相比,uhrf1基因缺失小鼠出现雄性不育(红色)。杂合子小鼠出现生育力下降(灰色)。黑色折线为同窝野生型对照鼠的生育力情况。
实施例3、对睾丸发育的影响
收集同窝野生型对照鼠和uhrf1敲除公鼠。分别取出生后6天,11天,18天,36天和成年雄鼠的睾丸,对睾丸进行大小和重量的统计及比对。
uhrf1基因对睾丸发育的影响如图2。由图2a可见,uhrf1基因缺失导致睾丸发育过程中重量减轻,且成显著性差异(白色为同窝对照组,黑色为基因敲除组)。由图2b可见,uhrf1基因敲除后,睾丸体积明显小于同窝对照组。
实施例4、检测睾丸形态发育
收集同窝野生型对照鼠和uhrf1敲除公鼠。分别取出生后6天,11天,18天,36天和成年雄鼠的睾丸,对睾丸进行固定,石蜡包埋及切片。切片经二甲苯-酒精复水后行he染色,染色片子再度经酒精-二甲苯脱水封片,并显微镜下镜检。
uhrf1基因对小鼠睾丸形态结构的影响如图3所示。由图可见,由图3可见,同窝对照组的睾丸曲细精管中的生殖细胞有序排列。但是uhrf1敲除后,多个曲细精管出现生精细胞丢失,部分生精细胞成团凋亡。(上图左:同窝对照组睾丸切片,上图右:基因缺失组睾丸切片)。
因此,uhrf1缺失导致小鼠睾丸形态结构出现缺陷。
实施例5、检测精子数量
收集同窝野生对照鼠和uhrf1敲除公鼠,8周龄成年鼠。取附睾组织,一侧附睾组织经bouin’s固定,石蜡包埋及切片,切片经he染色并镜检观察。另一侧附睾尾,放在盛有3ml精子培养液的培养板中,静置1-2min。随后,将附睾尾转移到另一个盛有3ml新鲜精子培养液的培养皿中,用手术刀沿附睾尾纵向做2个深切口,以利于精子出游,扩散5min后,在全自动精子分析仪进行检测。
uhrf1对小鼠精子形成的影响。如图4a所示,与对照组相比,uhrf1敲除组检测不到精子。如图4b所示,在对照组的附睾尾部出现大量的精子(蓝色为精子头,左图);但是当uhrf1基因被敲除后,附睾中不能见到精子(右图)。
实施例6、检测睾丸组织中生精细胞的凋亡情况。
收集同窝野生对照鼠和uhrf1敲除公鼠,分离睾丸组织,对睾丸组织的切片经tuenl染色,并经显微镜镜检及统计。
uhrf1对生精细胞凋亡的影响如图5所示。由图可见,在同窝野生型对照组中,只有零星几个tunel信号,这说明在wt中凋亡信号很弱,但在uhrf1缺失组中,出现大量tunel信号,这表明uhrf1基因敲除后,睾丸中的生殖细胞出现大量凋亡。
实施例7、生精细胞减数分裂进程的统计
剪碎睾丸组织,经消化过滤,得到比较纯的生精细胞。生精细胞经低渗处理后,蔗糖终止。1%pfa处理,并固定于载玻片上,经封闭及抗体sycp3孵育,37℃,7-8小时后,荧光二抗染色,并封片镜检,统计细线期,偶线期,粗线期,和双线期比例。
uhrf1对减数分裂进程的影响如图6所示。由图可见,uhrf1缺失后,处于减数分裂前期的细线期和偶线期细胞比例明显多于对照组,而偶线期细胞的比例又明显小于对照组,这说明uhrf1基因在细线期向粗线期进行的过程中发挥了作用。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>上海市计划生育科学研究所
<120>一种基因敲除动物模型在男性生殖研究中的应用
<130>175181
<160>2
<170>patentinversion3.3
<210>1
<211>893
<212>dna
<213>小鼠
<400>1
gtcgagatatctagacccagctttcttgtacaaagtggttgatatctctatagtcgcagt60
aggcggaaggatctagggttacgtgggaggttccactctggagtgtatggaggcctggga120
tgtggctcagcaactggacctagtgtcacatgtggtcactacttatttgctgtcagtaaa180
cctctatggagatagtcacagccatcagagcagaggtctcttgcagatggtgtttgttga240
gctgtttgtacagaatagtccagtctcatccagtgtccatagtgctgagctttgctgcca300
ggtaggacatggtggctcacacctaacatccccttacctctggaggctgaggcagcatgc360
ttgagtgtgtaaggccaacctgggctacagagtaaaacttggaggcatagctgggcacag420
gccctgggtctgctctgctgctgggtctcctgagccgcctcttcccgtaggtcaatgagt480
atgtggacgtgcgtgacaatatcttcggtgcatggtttgaggcccaggtggtccaggtac540
agaagagagccctatctgaggacgagccctgtagctccagtgccgttaagacctcggagg600
atgacatcatgtaccatgtcaagtatgatgagtgagtgccatcagtcctgccctgtcctc660
cccaagtgactgctgctggggatatgggaggctgcccttgtcccatcctcattgccctgt720
ttagacaaagggcccttccttcttccctgggcttcctagtgctaggagcccagccatgtg780
ctgccctgccttgatctgatcctgttcagtctgtgtgtgtgaagctcgctctctctgaga840
tggcgcaacgcaattaatgataacttcgtatagcatacattatacgaagttat893
<210>2
<211>34
<212>dna
<213>人工序列
<220>
<221>misc_feature
<223>插入序列
<400>2
ataacttcgtatagcatacattatacgaagttat34
- 还没有人留言评论。精彩留言会获得点赞!
- 用CRISPR/Cas9技术易于筛选获得目的基因敲除细胞系的方法及产品与制造工艺
- 一种Candida amazonensis的FLP/FRT基因敲除方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 利用CRISPR/Cas9敲除人PD‑1基因构建靶向CD19CAR‑T细胞的方法与制造工艺
- 一种构建基因替代小鼠研究野生型和突变体非肌性肌球蛋白重链II功能的方法与制造工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 猪ApoE基因敲除打靶载体及其构建方法和应用与制造工艺
- 一种血小板减少症的斑马鱼模型的制造方法与工艺
- 基于CRISPR技术敲除FUT8基因的方法与制造工艺