TrPPA基因及其克隆、表达载体构建方法和应用与流程
本发明属于生物技术领域,具体涉及一种trppa基因及其克隆、表达载体构建方法和应用。
背景技术:
白花三叶草(trifoliumrepens)作为一种广泛栽培的豆科牧草,品质优良,为多种畜禽所喜食。其匍匐茎发达、生长低矮、生长适应性和扩展能力强、再生速度快,竞争能力强,也作为温带地区观赏性草坪和绿地建植的主要草种,在国内外城镇绿化、水土保持等方面起着发挥重要作用。然而,白花三叶草虽然品质好,但产量有待提高;且白花三叶草喜冷凉湿润的气候,根系生长短,调控蒸腾能力差,因此抗旱性较弱,在栽培种植过程中经常会因干旱胁迫抑制白花三叶草的生长。近年来,受全球气候变暖的影响,部分地区降雨偏少或降雨分布不均影响了白花三叶草的生长和利。因此,发掘提高白三叶生长及抗旱相关基因并进行功能验证将为提高白三叶产量及其抗逆性奠定重要基础。
焦磷酸酶(pyrophosphatase,ppase,ec3.6.1.1)是以焦磷酸为底物的水解酶,广泛参与了植物体内的多种代谢途径,如糖代谢和脂代谢;也调控植物的生长发育,提高植物的抗逆反应、改善植物营养物质的吸收。植物细胞内的ppase通常分为两种:一类是可溶性的无机焦磷酸酶(inorganicpyrophosphatase;ippa),通常存在于细胞质和细胞器基质中;另一种是与膜结合的不可溶性酶类,即膜结合质子转运焦磷酸酶(h+-ppase),也称为质子焦磷酸酶。在拟南芥(arabidopsisthaliana)中转入液泡膜质子转运磷酸酶基因(avp1)后于250mmol/lnacl进行盐胁迫发现,过表达avp1拟南芥植株正常生长,且耐盐性增强,同时,其蛋白水平显著升高。此后,磷酸酶基因家族被广泛用于在植物中调节其代谢活动和生长发育,改善耐盐抗旱性等方面的研究。因此,对白花三叶草焦磷酸酶基因克隆及功能验证具有重要的理论意义与实际价值。
技术实现要素:
本发明所要解决的技术问题是提供一种能够提高白花三叶草生长过程中对低温、高温、盐胁迫和干旱的抗逆能力,同时可以提高其生物量的trppa基因。
本发明解决其技术问题所采用的技术方案为:该trppa基因的cdna全长序列如序列表sequenceidno.1所示。
进一步的是,所述trppa基因编码的蛋白,其氨基酸序列如序列表sequenceidno.2所示。
本发明还提供了一种trppa基因的克隆方法,其克隆方法包括以下步骤:
1)、材料选择:选取白花三叶草种子,将选取的种子经75%酒精和1%次氯酸钠消毒后用hoagland全营养液水培于光照培养箱中12h光照(23℃),12h无光(19℃),相对湿度75%,光照强度250umol·m-2·s-1,培养30d;
2)、白花三叶草总rna的提取:首先,取步骤1)得到的白花三叶草叶片,然后采用rnapreppure植物总rna提取试剂盒提取白花三叶草叶的rna;
3)、cdna的合成;首先,在微型管中配制反应混合液,随后42℃反应2min,冰上迅速冷却,所述反应混合液体系如表1所示:
表1反应混合液体系表
接着,在另一微型管中配制反转录反应液总量为20μl,缓慢混匀后采用primescripttmiii1ststrandcdnasynthesiskit试剂盒进行反转录反应,反应过程如下:先在37℃下反应15min后,再85℃5sec,冰上冷却,所述反转录反应液体系如表2所示:
表2反转录反应液表
4)、扩增:使用
表3pcr反应体系表
pcr反应过程如下:(1)94.0℃,5.0min;(2)98.0℃,10.0sec;55.0℃,5.0sec;72.0℃,5.0sec;共35cycles;(3)72.0℃,10.0min;
pcr反应引物为:
forwardprimer(5'--3'):atggctccaccaattgagaccc;
reversedprimer(5'--3'):ctaccgcctcaagctctccacaaca;
pcr产物经1%琼脂糖凝胶电泳分离后,采用tiangenmidpurificationkit普通琼脂糖凝胶dna回收试剂盒进行凝胶回收纯化后,得到trppa基因的3’和5’端序列,利用ncbiblastn和dnaman6.0拼接得到trppa基因的cdna全长序列如序列表sequenceidno.1所示。
本发明还提供了一种trppa基因的表达载体构建方法,首先,提取表达载体pbi121-35s的质粒,通过bamhi和saci双酶切进行双酶切,将trppa基因的开放阅读框链接到酶切之后的pbi121-35s载体上,转化感受态细胞后,进行kan抗性筛选,最后对菌液进行pcr验证,并对阳性菌落进行测序,若测序序列与原序列不相同,则表明转化不成功,重复上述步骤再次进行trppa基因的过表达载体构建,若测序序列与原序列相同,则表明转化成功,保存结果正确的菌液至超低温冰箱(-80℃)。
本发明还发现trppa基因在低温、高温、盐胁迫和干旱胁迫中的应用。
本发明还发现trppa基因在促进植物生长中的应用
本发明的有益效果在于:本发明所述的trppa基因通过荧光定量pcr验证了trppa在低温,高温,盐胁迫、干旱胁迫下的表达模式,结果表明该基因在低温,高温,盐胁迫、干旱胁迫下,trppa基因在根与叶中的表达量均发生了显著的变化,各胁迫条件及时间点下有所差异,能够有效提高白花三叶草生长过程中对低温、高温、盐胁迫和干旱的抗逆能力,将trppa基因通过基因工程的手段转入到拟南芥中,转基因植株较野生型生长速度更快,叶片更大型,同时株高和植株鲜重、干重生长量显著提高,说明trppa具有促进植物生长的作用。
附图说明
图1为trppa基因编码蛋白的疏水结构分析图;
图2为trppa基因编码蛋白的跨膜结构分析图;
图3为trppa基因编码蛋白的二级结构图;
图4为trppa基因编码蛋白的三维结构图;
图5为trppa基因编码蛋白的磷酸化位点分析图;
图6为trppa基因编码蛋白的信号肽分析图;
图7为trppa基因在不同逆境下的叶片和根部中的表达模式图;
图8为白花三叶草trppa编码蛋白亚细胞定位图;
图9为拟南芥中trppa表达量图;
图10为trppa转基因拟南芥与野生型拟南芥表型比对图。
具体实施方式
下面结合实施例对本发明作进一步的说明。
该trppa基因的cdna全长序列如下所示:
1tcggcccggtagggcatgacgcacaatcccactatccttcgcaagaccct
51tcctctatataaggaagttcatttcatttggagagaacacgggggactct
101agaggatcctatggctccaccaattgagaccccaaacaaggttcctacct
151caaattatacctcacctccacctctaaatgagaggatcctttcttctttg
201actaggagatctgttgctgcacacccttggcatgatcttgagataggtcc
251tgaagctccaaagatcttcaactgtgtggtcgaaattgggaaaggaaaca
301aggtgaaatatgaacttgacaaaaaaactggacttatcaaggttgaccgt
351gttctttactcatcagttgtgtaccctcacaactatgggtttatcccccg
401cactatttgtgaggatggtgaccccattgatgtcttggttattatgcagg
451agccagttcttcctggttgctttcttcgggctaaagctattgggctcatg
501cctatgattgatcagggtgagaaagatgacaagataattgctgtctgtgc
551tgatgatcctgagtataggcattacaatgatatcaaggagctccctccac
601atcgtttggctgaaatccgtcgtttttttgaagattacaagaagaatgag
651aacaaggaagttgcagtaaacgatttccttccttcctcatctgcctatga
701agcgattgagcattccatgaccttgtatgcggactatgttgtggagagct
751tgaggcggtagtattgatccatatgggattctgctctgcttggtgttgaa
801ctcgaatttccccgatcgttcaaacatttggcaataaagtttcttaagat
851tgaatcctgttgccggtcttgcgatgattatcatataatttctgttgaat
901tacgttaagcatgtaataattaacatgtaatgcatgacgttatttatgag
951atgggttttatgattagagtccg
trppa基因的cdna全长为973bp,包含一个651bp的开放阅读框,编码216个氨基酸。将该基因的核苷酸序列在ncbi网站上通过blastn分析后发现该基因核苷酸序列与蒺藜苜蓿solubleinorganicpyrophosphatase4(loc11429557)同源性近94%,在ncbi网站上通过blastp分析后发现该基因编码的氨基酸序列与蒺藜苜蓿solubleinorganicpyrophosphatase(keh42359.1)同源性近99%。
进一步的是,所述trppa基因编码的蛋白序列共有216个氨基酸,其氨基酸序列如下所示:
1metalaproproilegluthrproasnlys
11valprothrserasntyrthrserpropro
21proleuasngluargileleuserserleu
31thrargargservalalaalahisprotrp
41hisaspleugluileglyproglualapro
51lysilepheasncysvalvalgluilegly
61lysglyasnlysvallystyrgluleuasp
71lyslysthrglyleuilelysvalasparg
81valleutyrserservalvaltyrprohis
91asntyrglypheileproargthrilecys
101gluaspglyaspproileaspvalleuval
111ilemetglngluprovalleuproglycys
121pheleuargalalysalaileglyleumet
131prometileaspglnglyglulysaspasp
141lysileilealavalcysalaaspasppro
151glutyrarghistyrasnaspilelysglu
161leuproprohisargleualagluilearg
171argphephegluasptyrlyslysasnglu
181asnlysgluvalalavalasnasppheleu
191proserserseralatyrglualaileglu
201hissermetthrleutyralaasptyrval
211valgluserleuargarg
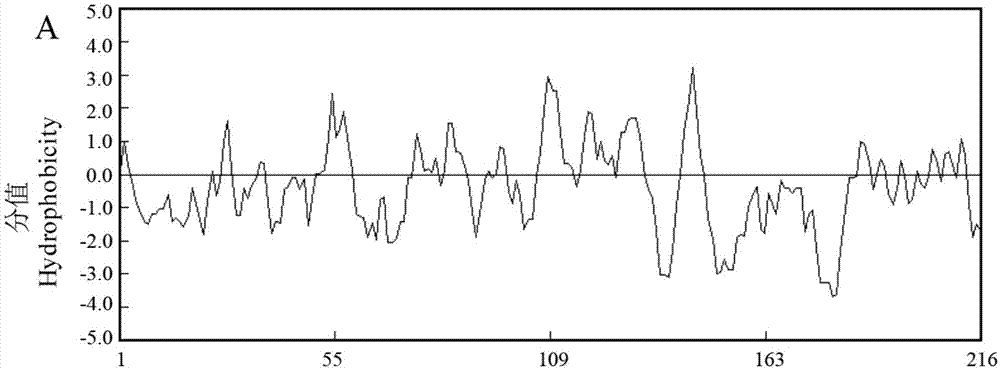
trppa基因编码的蛋白分子式为c1103h1730n292o325s9,分子量为2.46kda,理论等电点为5.57;不稳定指数为51.22,说明其编码蛋白质为不稳定蛋白;利用dnaman6.0对trppa基因编码蛋白疏水性分析结果,如图1所示,由图1可以看出:所编码的肽链中疏水性最大值大约为3.14,最小值大约为-3.70,因此,trppa基因编码的蛋白为亲水性蛋白。使用tmhmm2.0软件对trvp1蛋白进行跨膜结构分析,如图2所示,trppa基因编码的蛋白没有跨膜结构,为非跨膜蛋白。通过sopma及predictprotein分析trppa基因编码蛋白的二级结构,如图3所示,trppa基因编码蛋白由27.78%的α螺旋,8.80%β转角,41.20%的无规则卷曲和22.22%的延伸链构成。使用swiss-model软件分析trppa基因编码蛋白的三维结构图,如图4所示,trppa基因编码蛋白的三维结构图是由3个单体组成的蛋白三聚体。使用netphos3.1serve软件对该蛋白序列进行磷酸化位点分析发现,如图5所示,白三叶可溶性无机磷酸酶共有磷酸化位点ser12个,thr7个,tyr11个,使用signalp4.1server分析trppa基因编码蛋白的信号肽,如图6所示,结果表明该蛋白没有信号肽,是一种胞内蛋白。
实施例1
1)、材料选择:选取白花三叶草种子,将选取的种子经75%酒精和1%次氯酸钠消毒后用hoagland全营养液水培于光照培养箱中12h光照(23℃),12h无光(19℃),相对湿度75%,光照强度250umol·m-2·s-1,培养30d;然后取0.1g离体根和叶片分别进行如下处理:1)200mmol/lnacl;2)15%peg;3)4℃低温;4)35℃高温;5)600μmol/lcdso4;6)5mmol/lcacl2;7)10mmol/lh2o2;8)25μmmol/lsnp;9)100mmaba;10)20μmspm;11)1mmiaa;在处理时间0h、1.5h、3h、6h、12h和24h后取样,
2)、白花三叶草总rna的提取:首先,取步骤1)得到的白花三叶草叶片,然后采用rnapreppure植物总rna提取试剂盒提取白花三叶草叶的rna;
3)、cdna的合成;首先,在微型管中配制反应混合液,随后42℃反应2min,冰上迅速冷却,所述反应混合液体系如表1所示:
表1反应混合液体系表
接着,在另一微型管中配制反转录反应液总量为20μl,缓慢混匀后采用primescripttmiii1ststrandcdnasynthesiskit试剂盒进行反转录反应,反应过程如下:先在37℃下反应15min后,再85℃5sec,冰上冷却,所述反转录反应液体系如表2所示:
表2反转录反应液表
3)荧光定量qrt-pcr:荧光定量qrt-pcr反应体系及程序参考sybrpremixextaqtm试剂盒说明书进行,反应程序为:(1)95.0℃,30sec;(2)94.0℃,30.0sec;58.0℃,30.0sec;72.0℃,60.0sec;共30cycles;(3)72.0℃,5.0min。
检测trppa与内参基因β-actin的ct值,样品设3个独立的生物学重复。采用2–δδct方法计算,相对表达量(relativequantification)=2–δδct目的基因。
trppa引物序列为:
forwardprimer(5'--3'):cagggtgagaaagatgacaagata;
reversedprimer(5'--3'):caaacgatgtggagggagc。
β-actin引物序列为:
forwardprimer(5'--3'):ttacaatgaattgcgtgttg;
reversedprimer(5'--3'):agaggacagcctgaatgg。
图7为trppa基因在不同逆境下的叶片和根部中的表达模式图,由图7可以得知,在非生物胁迫下,trppa在根与叶中的表达量均发生了显著的变化,各胁迫条件及时间点下有所差异。在低温胁迫下根中的trppa表达量显著升高,叶中的表达量呈缓慢升高的趋势,同时,在前12个小时,根中的表达量高于叶中。在低温处理3h时根中trppa表达量达到顶峰,上调了约13.5倍;而叶中trppa的表达量上升缓慢,于处理24h时达到最高值,比对照高4倍(图7.a)。高温处理下,根中trppa的表达受到抑制,而叶中的表达量显著上调,3h时达到峰值,上升约250倍(图7.b)。盐处理显著上调了根和叶中trppa表达量,分别在3h和1.5h达到峰值,上调5.5倍和4.1倍(图7.c)。干旱胁迫处理下,根中的trppa表达量明显上调,而叶中的表达量仅有小幅上调,分别在6h和3h时达到最高值,上升约10倍和2倍(图7.d)。以上结果表明trippa白花三叶草对逆境胁迫的抵抗中发挥了重要作用。
本发明所述的trppa基因通过荧光定量pcr验证了trppa在低温,高温,盐胁迫、干旱胁迫下的表达模式,结果表明该基因在低温,高温,盐胁迫、干旱胁迫下,trppa基因在根与叶中的表达量均发生了显著的变化,各胁迫条件及时间点下有所差异
为了了解trppa在细胞中发挥作用的部位,将trppa基因与绿色荧光蛋白(gfp)通过融合表达载体转化拟南芥原生质体,高效瞬时表达后在蓝光激发下产生绿色荧光。结果显示,大多目标蛋白荧光呈现圆形分散分布在叶绿体周围,部分目标蛋白荧光通道与叶绿体荧光通道重合,如图8所示,图8为白花三叶草trppa编码蛋白亚细胞定位图,注:从左至右依次为目标蛋白通道,叶绿体通道,明场及叠加图,因此,白花三叶草trppa编码蛋白大多数存在于核糖体等小型细胞器内,部分存在于叶绿体中,没有在其他大型细胞器及细胞核中检测到。
本发明还提供了一种trppa基因的克隆方法,其克隆方法包括以下步骤:
1)、材料选择:选取白花三叶草种子,将选取的种子经75%酒精和1%次氯酸钠消毒后用hoagland全营养液水培于光照培养箱中12h光照(23℃),12h无光(19℃),相对湿度75%,光照强度250umol·m-2·s-1,培养30d;
2)、白花三叶草总rna的提取:首先,取步骤1)得到的白花三叶草叶片,然后采用rnapreppure植物总rna提取试剂盒提取白花三叶草叶的rna;
3)、cdna的合成;首先,在微型管中配制反应混合液,随后42℃反应2min,冰上迅速冷却,所述反应混合液体系如表1所示:
表1反应混合液体系表
接着,在另一微型管中配制反转录反应液总量为20μl,缓慢混匀后采用primescripttmiii1ststrandcdnasynthesiskit试剂盒进行反转录反应,反应过程如下:先在37℃下反应15min后,再85℃5sec,冰上冷却,所述反转录反应液体系如表2所示:
表2反转录反应液表
4)、扩增:使用
表3pcr反应体系表
pcr反应过程如下:(1)94.0℃,5.0min;(2)98.0℃,10.0sec;55.0℃,5.0sec;72.0℃,5.0sec;共35cycles;(3)72.0℃,10.0min;
pcr反应引物为:
forwardprimer(5'--3'):atggctccaccaattgagaccc;
reversedprimer(5'--3'):ctaccgcctcaagctctccacaaca;
pcr产物经1%琼脂糖凝胶电泳分离后,采用tiangenmidpurificationkit普通琼脂糖凝胶dna回收试剂盒进行凝胶回收纯化后,得到trppa基因的3’和5’端序列,利用ncbiblastn和dnaman6.0拼接得到trppa基因的cdna全长序列如序列表1所示。
本发明还提供了一种trppa基因的表达载体构建方法,首先,提取表达载体pbi121-35s的质粒,通过bamhi和saci双酶切进行双酶切,将trppa基因的开放阅读框链接到酶切之后的pbi121-35s载体上,转化感受态细胞后,进行kan抗性筛选,最后对菌液进行pcr验证,并对阳性菌落进行测序,若测序序列与原序列不相同,则表明转化不成功,重复上述步骤再次进行trppa基因的过表达载体构建,若测序序列与原序列相同,则表明转化成功,保存结果正确的菌液至超低温冰箱(-80℃)。
实施例2
1)、trppa基因的表达载体构建:通过bamhi和saci双酶切,将trsams完整orf连接到超表达载体pbi121上,取连接产物经热击法转化大肠杆菌dh5α,提取阳性重组子质粒,热击转化农杆菌eha105;
2)、拟南芥的种植与培养:称取一定量的灭菌营养土装入塑料盆钵中置于托盘内;将拟南芥种子小心倒于湿润的滤纸上,置于4℃冰箱春化2-3天;使用镊子均匀地将春化后的种子于与装满营养土的盆钵内,在21℃、光照/黑暗8h/16h条件下(1月后调整为光照/黑暗16h/8h)培养;每隔3-4天浇水一次,待其发芽一月以后,每半个月浇一次1/2hoagland营养液。
3)、花序浸染法转化拟南芥;将含有目的基因的农杆菌于2mlkan抗性的液体lb培养基中(28℃200r/min)过夜培养;将培养后的菌液(0.5%)于200mlkan抗性的液体lb培养基中(28℃200r/min)过夜培养;将上述菌液取50ml于4℃8000r/min离心10min,后取上清液悬浮于5%蔗糖溶液(称取35g蔗糖于ddh2o定容至700ml,加入140μlsilwet混匀);测定菌液od600值为0.8(5%蔗糖溶液调零);剪去拟南芥已开花的花序及荚果,将未开花但是露白的花序浸入农杆菌菌液中15sec左右;浇水后在黑暗条件下培养48h后正常培养,收取t0代种子。选取饱满的t0代种子消毒后均匀置于kan抗性的1/2ms培养基中,4℃春化2d后正常条件培养;培养两周后,选取生长良好、长势正常的拟南芥移栽至装满营养土的盆钵中;提取拟南芥叶片dna,以此为模板,进行pcr验证,将与目标条带一只的产物送华大基因测序比对。经过鉴定,共鉴定出10株转基因植株,随机选取第3和8株进行后续试验。将验证正确的拟南芥收取种子后继续培养。干旱胁迫处理方法为移栽时浇足水后自然干旱,观察其表型变化。
4)、拟南芥指标测定:分别选择长势正常且相近的转基因植株和野生型植株进行相关指标的测定。叶长和叶宽分别选择转基因植株和野生型植株倒数第三轮叶片测定,重复测定5次;株高在种子成熟时测定重复测定5次;干重及鲜重于收取种子后测定。在拟南芥移栽1周后分别采用自然干旱及300mmnacl进行干旱胁迫和盐胁迫。
分别剪取正常条件培养野生型col-0和转基因拟南芥的叶片提取总rna后反转录dna,选拟南芥β-actin作为内参基因,检测转基因拟南芥中trppa的表达量,图9为拟南芥中trppa表达量,结果显示,转基因植株中trppa的表达量显著提高,说明trppa在拟南芥中超量表达发挥功能,能够有效提高白花三叶草生长过程中对低温、高温、盐胁迫和干旱的抗逆能力。
分别选取正常条件培养下野生型col-0和trppa转基因拟南芥倒数第三轮叶片测量其叶长及叶宽,观察其植株大小,并在收种时测定其株高,收种后测定其干鲜重。结果显示:trppa转基因拟南芥叶长和叶宽明显增加,转基因植株显著高于野生型,并且鲜重和干重显著提高,图10为trppa转基因拟南芥与野生型拟南芥表型比对,较野生型植株地上生物量显著提高,说明转基因拟南芥能通过表达trppa促进其生长。
序列表
<110>四川农业大学
<120>trppa基因及其克隆、表达载体构建方法和应用
<130>2018
<160>2
<170>siposequencelisting1.0
<210>1
<211>973
<212>dna
<213>人工序列(artificialsequence)
<400>1
tcggcccggtagggcatgacgcacaatcccactatccttcgcaagacccttcctctatat60
aaggaagttcatttcatttggagagaacacgggggactctagaggatcctatggctccac120
caattgagaccccaaacaaggttcctacctcaaattatacctcacctccacctctaaatg180
agaggatcctttcttctttgactaggagatctgttgctgcacacccttggcatgatcttg240
agataggtcctgaagctccaaagatcttcaactgtgtggtcgaaattgggaaaggaaaca300
aggtgaaatatgaacttgacaaaaaaactggacttatcaaggttgaccgtgttctttact360
catcagttgtgtaccctcacaactatgggtttatcccccgcactatttgtgaggatggtg420
accccattgatgtcttggttattatgcaggagccagttcttcctggttgctttcttcggg480
ctaaagctattgggctcatgcctatgattgatcagggtgagaaagatgacaagataattg540
ctgtctgtgctgatgatcctgagtataggcattacaatgatatcaaggagctccctccac600
atcgtttggctgaaatccgtcgtttttttgaagattacaagaagaatgagaacaaggaag660
ttgcagtaaacgatttccttccttcctcatctgcctatgaagcgattgagcattccatga720
ccttgtatgcggactatgttgtggagagcttgaggcggtagtattgatccatatgggatt780
ctgctctgcttggtgttgaactcgaatttccccgatcgttcaaacatttggcaataaagt840
ttcttaagattgaatcctgttgccggtcttgcgatgattatcatataatttctgttgaat900
tacgttaagcatgtaataattaacatgtaatgcatgacgttatttatgagatgggtttta960
tgattagagtccg973
<210>2
<211>216
<212>prt
<213>人工序列(artificialsequence)
<400>2
metalaproproilegluthrproasnlysvalprothrserasntyr
151015
thrserproproproleuasngluargileleuserserleuthrarg
202530
argservalalaalahisprotrphisaspleugluileglyproglu
354045
alaprolysilepheasncysvalvalgluileglylysglyasnlys
505560
vallystyrgluleuasplyslysthrglyleuilelysvalasparg
65707580
valleutyrserservalvaltyrprohisasntyrglypheilepro
859095
argthrilecysgluaspglyaspproileaspvalleuvalilemet
100105110
glngluprovalleuproglycyspheleuargalalysalailegly
115120125
leumetprometileaspglnglyglulysaspasplysileileala
130135140
valcysalaaspaspproglutyrarghistyrasnaspilelysglu
145150155160
leuproprohisargleualagluileargargphephegluasptyr
165170175
lyslysasngluasnlysgluvalalavalasnasppheleuproser
180185190
serseralatyrglualailegluhissermetthrleutyralaasp
195200205
tyrvalvalgluserleuargarg
210215
- 还没有人留言评论。精彩留言会获得点赞!