纳米颗粒及其制备方法与流程
本发明涉及生命科学
技术领域:
,特别是涉及一种纳米颗粒及其制备方法。
背景技术:
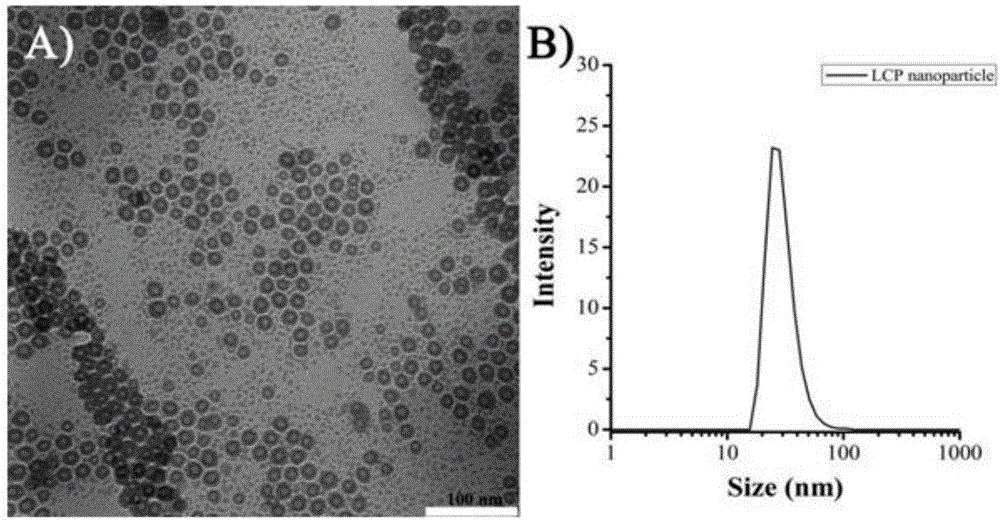
:纳米颗粒是一种中间带有空腔的纳米材料,可以将小分子药物、sirna、抗体等包裹再空腔里面,导入到目标细胞中。til细胞(t细胞)是一种淋巴细胞,将病人的癌症组织和病人的t细胞一起培养,然后让这种淋巴细胞扩增之后回输病人体内,是现有杀死癌细胞的技术。但是,癌细胞的表面会存在一种叫做pd-l1的蛋白,这种pd-l1的蛋白会和t细胞的pd-1蛋白一起结合,就会抑制t细胞对癌细胞的杀伤。因此,想要t细胞能高效杀伤癌细胞,就要想办法把t细胞的pd-1和癌细胞的pd-l1降低就可以了。目前主要是分别将对pd-l1、pd-1有抑制作用的功能物质通过载体转染至t细胞、癌细胞,从而实现t细胞的pd-1和癌细胞的pd-l1降低。但目前的载体普遍存在转染效率低的缺点。技术实现要素:基于此,有必要针对现有纳米颗粒对悬浮细胞转染低效的问题,提供一种高效的纳米颗粒及其制备方法。本发明的目的之一是提供一种纳米颗粒的制备方法,包括如下步骤:将有机溶剂与表面活性剂混合,得a液;第一反应物溶液与功能物质溶液混合,得b液;第二反应物溶液与功能物质溶液混合,得c液;所述第二反应物与所述第一反应物接触后能够形成沉淀;混匀所述a液、所述b液得d液;混匀所述a液、所述c液,并向所得混合溶液中加入dopa(多巴胺)的氯仿溶液混匀,得e液;将所述e液加入所述d液,对所得混合物离心,收集沉淀,得单层膜纳米颗粒;制备单层膜纳米颗粒的分散液,并向所述分散液中加入dopc(1,2-二油酰基磷脂酰胆碱)、胆固醇的混合物,或者加入dotap(2-二油酰基羟丙基-3-n,n,n-三甲铵)、胆固醇的混合物,所得悬浮颗粒溶液中的颗粒即为双层膜纳米颗粒。在其中一些实施例中,所述第一反应物溶液为钙盐溶液,所述第二反应物溶液为磷酸盐溶液或者焦磷酸盐溶液,所述第一反应物、第二反应物的钙、磷的物质量比为(25~400):1。本发明实施例通过控制钙磷的数量比,能够获得很好的获得纳米颗粒核,不均颗粒大小均一、而且稳定性良好,不易发生凝聚。如果超出了本申请实施例的限定,要么无法形成纳米颗粒核,要么是所形成的那么颗粒核凝聚一团,不易进行后续的裹膜操作。在其中一些实施例中,所述钙盐溶液的浓度为4.5~5.5m;所述磷酸盐溶液或者焦磷酸盐溶液的浓度为45~55mm。本发明实施例通过采用4.5~5.5m氯化钙溶液,可以进一步提高第一反应物与第二反应物结合产生的沉淀的均一性,进而提高纳米颗粒的均一性。在其中一些实施例中,所述钙盐溶液包括氯化钙溶液、硝酸钙溶液、葡萄糖酸钙溶液;所述磷酸盐溶液包括磷酸氢二钾溶液、磷酸氢二铵溶液、磷酸二氢铵溶液、磷酸氢钙溶液、磷酸钙溶液、磷酸二氢钠溶液、磷酸氢二钠溶液、磷酸钠溶液;所述焦磷酸盐溶液包括焦磷酸钙溶液、酸式焦磷酸钠溶液、焦磷酸钠溶液。在其中一些实施例中,所述dopa溶液中dopa的浓度为15~25mg/ml,所述dopa溶液的加入体积与所述a液、c液的混合溶液的体积比为(70~80):1。在其中一些实施例中,所述的dopa溶液的溶剂包括氯仿、二氯甲烷、乙酸乙酯、四氢呋喃。在其中一些实施例中,所述dopc、胆固醇的混合物中,dopc、胆固醇的质量比为1:(2.5~3.5);所述dotap、胆固醇的混合物中,dotap、胆固醇的质量比为2:(2.5~3.5)。在其中一些实施例中,所述a液的制备中,有机溶剂为环己烷、苯、甲苯、正庚烷、四氯化碳中的任一种或几种;表面活性剂包括聚氧代乙烯(5)壬基苯基醚;有机溶剂与表面活性剂混合的体积比为80:20~50:50。本申请通过有机溶剂筛选、表面活性剂筛选,目的是引入油水体系,油水体系的优点是得到悬浮性高又受到保护的第一反应物与第二反应物结合产生的沉淀,提高稳定性,使得颗粒之间不容易发生凝聚。在其中一些实施例中,所述a液、b液的用量比为(50~200):1;所述a液、c液的用量比为(50~200):1;e液与d液的用量比为(1~3):(1~3)。在其中一些实施例中,所述制备单层膜纳米颗粒的分散液具体是将所述的单层膜纳米颗粒分散在氯仿、二氯甲烷、乙酸乙酯或四氢呋喃中。在其中一些实施例中,所述功能物质溶液中的功能物质包括功能核酸序列(dsdna、sirna等)、蛋白质抗体、药物分子。在其中一些实施例中,所述功能物质溶液中的功能物质包括功能核酸序列。本发明的另一目的是提供一种纳米颗粒,该纳米颗粒由上述的制备方法获得。与现有技术相比,本发明实施例具有以下有益效果:本发明实施例通过分步混合有机溶剂、表面活性剂、第一反应物溶液、功能物质溶液、第二反应物溶液,然后再包裹上双层外膜,提高了携带功能物质的纳米颗粒对靶细胞的转染效率。具体地,本发明实施例通过分步混合有机溶剂、表面活性剂、第一反应物溶液、功能物质溶液、第二反应物溶液,使得第一反应物、第二反应物携带功能物质后形成的纳米颗粒核小而均匀,不易发生凝聚,以此为核心裹上多巴胺、dopc或者dotap后,所得纳米颗粒产品粒径能够控制在较小的尺度(20nm左右),裹膜的同时还改善了膜外侧的亲水性、增加颗粒的分散性、稳定性,不易发生凝聚,而且还增强了与细胞表面的亲和力,容易被细胞吸收,增加转染效率。附图说明图1a为本发明实施例制备的纳米颗粒的透射电子显微镜(tem)照片;图1b为本发明实施例制备的纳米颗粒的动态光散射(dynamiclightscattering)图谱;图2a为本发明实施例制备的纳米颗粒于不同的浓度下的细胞摄取率;图2b为本发明实施例制备的纳米颗粒在随着时间的推进过程中的细胞摄取率;图3a为本发明实施例制备的纳米颗粒转染til细胞后细胞的pd1mrna水平;图3b为本发明实施例制备的纳米颗粒的转染til细胞后细胞的pd1蛋白水平;图3c为本发明实施例制备的纳米颗粒的转染细胞后,采用流式细胞仪检测pd1阳性的细胞;图4a为本发明实施例制备的纳米颗粒转染乳腺癌细胞后细胞的pdl1mrna转录水平;图4b为本发明实施例制备的纳米颗粒转染乳腺癌细胞后细胞的pdl1蛋白表达水平;图4c为本发明实施例制备的纳米颗粒的转染细胞后,采用流式细胞仪检测pdl1阳性的细胞;图5是不同比例、不同沉默程度的til细胞对乳腺癌细胞的杀伤力测试;图6a、图6b分别是转染对til细胞亚群影响测试结果图;图6c、图6d分别是转染前后til细胞产生细胞因子变化测试结果图;图7为本发明实施例制备所得纳米颗粒的结构示意图。具体实施方式以下结合具体实施例对本发明的纳米颗粒及其制备方法作进一步详细的说明。为了能够更清楚地理解本发明的技术内容,特举以下实施例详细说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。为了使得本发明技术方案更加清楚、易于理解,现对其举例说明,需要说明的是,本发明的保护范围不仅限于下述各例所述的内容。实施例1、包载有沉默sirna(沉默til细胞的pd1)的纳米颗粒及其制备方法1.1纳米颗粒的制备本部分提供一种纳米颗粒的制备方法,包括如下步骤:准备a液:将环己烷与聚氧代乙烯(5)壬基苯基醚混合,二者的用量比为70:30体积比;该处的环己烷可以替换为苯、甲苯、正庚烷、四氯化碳;准备b液:5m氯化钙溶液(所用体积是75μl)与100μmsirna溶液(所用体积是100μl)混合,并加入超纯水50μl;在其他的实施例中,这里的氯化钙也可以换作酸钙溶液或葡萄糖酸钙溶液;准备c液:50mm磷酸氢二钠(所用体积是75μl)与100μmsirna(所用体积是100μl)混合,并加入超纯水50μl;在其他实施例中,该处的磷酸氢二钠溶液可以换作磷酸氢二钾溶液、磷酸氢二铵溶液、磷酸二氢铵溶液、磷酸氢钙溶液、磷酸钙溶液、磷酸二氢钠溶液、磷酸氢二钠溶液、磷酸钠溶液、焦磷酸钙溶液、酸式焦磷酸钠溶液或焦磷酸钠溶液;准备d液:取a液一份(所用体积是15ml),加入150μlb液,搅拌20min;准备e液:取a液一份(所用体积是15ml),加入150μlc液,搅拌5min,然后加入dopa的氯仿溶液(dopa的浓度是20mg/ml,该溶液的体积是200μl),并继续搅拌15min;该步骤的氯仿也可以替换为二氯甲烷、乙酸乙酯或四氢呋喃;制备单层膜颗粒:将e液一滴一滴入到d液中,搅拌20分钟,所得沉淀为单层膜纳米颗粒,也就是第一反应物、第二反应物、功能sirna形成的核外仅包裹有一层dopa;在该步骤中,为了使得最终纳米颗粒大小更加的均匀,此处e液的滴加速度控制在1~3ml/min;该步骤还包括对单层膜纳米颗粒进行清洗、收集的步骤;具体包括:所述清洗的步骤包括:向e液、d液的混合物中以体积比为1:1的量加入10ml乙醇,继续搅拌5分min,于10,000g条件下离心20min,弃上清、留沉淀;向沉淀中再加入10ml乙醇,于10,000g下离心20min,再弃上清、留沉淀;所述收集的步骤包括:加入1ml氯仿收集单层膜纳米颗粒;制备双层膜颗粒:将上述制备得到的单层膜纳米颗粒分散到1ml的氯仿中,将所得分散液与100μldopc、胆固醇的混合物(体积比为1:3)或者dotap、胆固醇的混合物(体积比为2:3)中,在旋转蒸发仪中将氯仿和未结合的dopc或dotap、胆固醇蒸干,剩余部分即为双层膜颗粒,是本发明实施的目的产物,用磷酸缓冲液(pbsph=7.4)将双层膜颗粒,即可。本实施例制备的双层膜颗粒的结构示意图见图7,第一反应物、第二反应物、功能sirna形成的核纳米颗粒的核,dopa形成包括在核外的内膜,dopc、dotap形成外膜。上述制备方法中,pd1sirna:正义链:5’-agaccuugauacuuucaaadtsdt-3',反义链:5’-uuugaaaguaucaaggucudtsdt-3’;本实施例制备方法得到的纳米颗粒:形貌很好,大小在可控范围,颗粒之间没有粘附在一起,分散均匀,见图1a;纳米材料颗粒的大小在20nm左右,并且可以分散均匀,再次验证了颗粒的合适的大小和良好的分散性,见图1b。1.2转染til细胞本部分涉及采用1.1制备得到的纳米颗粒转染til细胞,包括如下步骤:步骤一,以1.5×105个til细胞/孔的密度接种6孔板,置于培养箱(条件:37℃、5%co2)过夜,移去细胞培养基;步骤二、向步骤一处理过的6孔板中分别加入含1.1纳米颗粒的新鲜的细胞培养基,37℃条件下静置;其中,纳米颗粒包裹了50nm的sirna(该量为:加入的sirna总量减去未包裹进纳米颗粒的sirna的量);步骤三、将步骤二处理过的6孔板中的培养基弃掉,用新鲜磷酸缓冲液(pbs)清洗三次,洗去没有被til细胞吸收的纳米颗粒。本实施例为了实现最佳的细胞摄入效果,步骤二中新鲜的细胞培养基含实施例1纳米颗粒的浓度设为三个浓度级别,即20nm、40nm、80nm,检测三个纳米颗粒浓度下til细胞对纳米颗粒的摂取率。结果见图2a,由该图可知,在培养基中纳米颗粒的含量为40nm的时候,til细胞对纳米颗粒的摄入率能达到65%左右。在获得优选的纳米颗粒浓度下,本实施例还对该优选浓度(纳米颗粒的含量为40nm)下较佳的摄取时长进行测试。结果见图2b,由该图可知,2h即可实现65%左右的til细胞被转染。1.3被转染til细胞中pd1基因的mrna转录水平、蛋白表达水平检测参照上述1.2,设置如下til细胞处理:a、正常状态的没有被转染的til细胞,标记为“tils”;b、用包载有40nm对照sirna的纳米颗粒转染的til细胞,标记为“tils+lcp+c-sirna-40nm”;其中,对照sirna的序列为:5'-uucuccgaacgugucacgutt-3';c、用本实施例纳米颗粒于20nm浓度下转染的til细胞,标记为“tils+lcp+sirna-20nm”;d、用本实施例纳米颗粒于40nm浓度下转染的til细胞,标记为“tils+lcp+sirna-40nm”;e、用本实施例纳米颗粒于80nm浓度下转染的til细胞,标记为“tils+lcp+sirna-80nm”;f、用本申请纳米颗粒于160nm浓度下转染的til细胞,标记为“tils+lcp+sirna-160nm”。mrna的转录水平的检测结果见图3a,随着纳米颗粒的浓度从20nm到160nm逐渐增大,pd1的转录从86%下降到15%左右。可见,纳米颗粒可以高效率的将pd1sirna转入til细胞中,从而沉默pd1在til细胞的表达。til细胞中pd1蛋白的表达水平的检测结果见图3b。当纳米颗粒的浓度为40nm时,pd1蛋白的表达量就明显减少。可见,当纳米颗粒浓度为40nm时,就可以有效的降低pd1蛋白在til细胞的表达。转染后pd1阳性细胞的检测结果见图3c,根据流式细胞仪检测图可以看到箭头所指的位置,峰值发生了移动,这就说明til细胞中pd1阳性细胞减少了,因此说明纳米颗粒可以高效率的转染til细胞。实施例2、包载有沉默sirna(沉默乳腺癌细胞mcf7的pdl1)的纳米颗粒及其制备方法2.1纳米颗粒的制备(参照实施例1)本部分提供一种纳米颗粒的制备方法,包括如下步骤:准备a液:将环己烷与聚氧代乙烯(5)壬基苯基醚混合,二者的用量比为70:30体积比;准备b液:5m氯化钙溶液(所用体积是75μl)与100μmsirna溶液(所用体积是100μl)混合,并加入超纯水50μl;准备c液:50mm磷酸氢二钠(所用体积是75μl)与100μmsirna(所用体积是100μl)混合,并加入超纯水50μl;准备d液:取a液一份(所用体积是15ml),加入150μlb液,搅拌20min;准备e液:取a液一份(所用体积是15ml),加入150μlc液,搅拌5min,然后加入dopa的氯仿溶液(dopa的浓度是20mg/ml,该溶液的体积是200μl),并继续搅拌15min;制备单层膜颗粒:将e液一滴一滴入到d液中,搅拌20分钟,所得沉淀为单层膜纳米颗粒,也就是第一反应物、第二反应物、功能sirna形成的核外仅包裹有一层dopa;在该步骤中,为了使得最终纳米颗粒大小更加的均匀,此处e液的滴加速度控制在1~3ml/min;该步骤还包括对单层膜纳米颗粒进行清洗、收集的步骤;具体包括:所述清洗的步骤包括:向e液、d液的混合物中以体积比为1:1的量加入10ml乙醇,继续搅拌5分min,于10,000g条件下离心20min,弃上清、留沉淀;向沉淀中再加入10ml乙醇,于10,000g下离心20min,再弃上清、留沉淀;所述收集的步骤包括:加入1ml氯仿收集单层膜纳米颗粒;制备双层膜颗粒:将上述制备得到的单层膜纳米颗粒分散到1ml的氯仿中,将所得分散液与100μldopc、胆固醇的混合物(体积比为1:3)或者dotap、胆固醇的混合物(体积比为2:3)中,在旋转蒸发仪中将氯仿和未结合的dopc或dotap、胆固醇蒸干,剩余部分即为双层膜颗粒,是本发明实施的目的产物,用磷酸缓冲液(pbsph=7.4)将双层膜颗粒,即可。本实施例制备的双层膜颗粒的结构示意图见图7,第一反应物、第二反应物、功能sirna形成的核纳米颗粒的核,dopa形成包括在核外的内膜,dopc、dotap形成外膜。上述制备方法中,sirna的序列为pd-l1sirna:正义链:5'-agacguaagcaguguugaadtsdt-3',反义链:5’-uucaacacugcuuacgucudtsdt-3’;本部分制备方法得到的纳米颗粒与实施例1相同:形貌很好,大小在可控范围,颗粒之间没有粘附在一起,分散均匀,见图1a;纳米材料颗粒的大小在20nm左右,并且可以分散均匀,再次验证了颗粒的合适的大小和良好的分散性,见图1b。2.2转染乳腺癌细胞采用2.1制备得到的纳米颗粒转染乳腺癌细胞,包括如下步骤:步骤一,以1.5×105个乳腺癌细胞/孔的密度接种6孔板,置于培养箱(条件:37℃、5%co2)过夜,移去细胞培养基;步骤二、向步骤一处理过的6孔板中分别加入含上述2.1制备的纳米颗粒的新鲜的细胞培养基,37℃条件下静置4h;其中,纳米颗粒包裹了40nm的sirna(该量为:加入的sirna总量减去未包裹进纳米颗粒的sirna的量);步骤三、将步骤二处理过的6孔板中的培养基弃掉,用新鲜磷酸缓冲液(pbs)清洗三次,洗去没有被乳腺癌细胞吸收的纳米颗粒。2.3被转染乳腺癌细胞中pdl1基因的mrna转录水平、蛋白表达水平检测参照上述2.2,设置如下乳腺癌细胞处理:a、正常状态的没有被转染的乳腺癌细胞,标记为“blankcontrol”;b、用包载有40nm对照sirna的纳米颗粒于40nm纳米颗粒浓度下转染的乳腺癌细胞,标记为“lcp+c-sirna-40nm”;其中,对照sirna的序列为:5'-uucuccgaacgugucacgutt-3';c、用本实施例的纳米颗粒于10nm浓度下转染的乳腺癌细胞,标记为“10nm”;d、用本实施例的纳米颗粒于20nm浓度下转染的乳腺癌细胞,标记为“20nm”;e、用本实施例的纳米颗粒于40nm浓度下转染的乳腺癌细胞,标记为“40nm”。mrna的转录水平的检测结果见图4a,随着纳米颗粒的浓度从10nm到40nm逐渐增大,pd1的转录从80%下降到20%左右。可见,纳米颗粒可以高效率的将pdl1sirna转入乳腺癌细胞中,从而沉默pdl1在乳腺癌细胞的表达。蛋白表达水平的检测结果见图4b,发明人发现,当纳米颗粒的浓度为40nm时,pdl1蛋白的表达量就发生了明显的减少。可见当纳米颗粒的浓度为40nm时,就可以有效降低pdl1蛋白在乳腺癌细胞的表达。转染后pdl1阳性细胞的检测结果见图4c,根据流式细胞仪检测图可以看到箭头所指的位置,峰值发生了移动,这就说明乳腺癌细胞中pdl1阳性的细胞减少了,因此说明纳米颗粒可以高效率的转染乳腺癌细胞。实施例3、细胞杀伤效率测试本实施例用实施例1中涉及的til细胞与实施例2涉及的乳腺癌细胞mcf7混合,测试til细胞对乳腺癌细胞mcf7的杀伤力。选用的til细胞包括:高表达pd1的未被转染的til细胞,标记为“pd1+”;被40nm纳米颗粒转染过的低表达pd1的til细胞,标记为“pd1-”。选用的乳腺癌细胞mcf7包括:高表达pdl1的未被转染的乳腺癌细胞,标记为“pdl1+”;被40nm纳米颗粒转染过的低表达pdl1的乳腺癌细胞,标记为“pdl1-”;将选用的til细胞、选用的乳腺癌细胞mcf7以不同细胞重量比进行混合,共计12个不同的混合处理,包括如下:数量比为10:1的pd1+/pdl1+、pd1-/pdl1+、pd1+/pdl1-、pd1-/pdl1-;数量比为30:1的pd1+/pdl1+、pd1-/pdl1+、pd1+/pdl1-、pd1-/pdl1-;数量比为100:1的pd1+/pdl1+、pd1-/pdl1+、pd1+/pdl1-、pd1-/pdl1-;细胞杀伤效率的测试是通过乳酸脱氢酶检测试剂盒检测。即使用cytotoxnon-radioactivecytotoxicityassay(promega,wi)进行标准4小时乳酸脱氢酶释放检测。方法如下:①将待检乳腺癌细胞(沉默乳腺癌细胞mcf7k以及未沉默乳腺癌细胞mcf7)以1×104每孔的密度接种到96孔板上,培养18小时后,将培养基换成无酚红,含5%胎牛血清的rpmi1640培养基(gibco-brl),继续培养6小时。②对til细胞:将til细胞(沉默til细胞tilk以及未沉默til细胞til)在cne-2培养基中培养24小时,然后收集细胞,在无酚红,含5%胎牛血清的rpmi1640培养基(gibco-brl)中重悬细胞。③取50μl细胞悬液,按照上述不同比例将til细胞加入含有乳腺癌细胞的孔内,孵育4小时后,将96孔板离心(250×g,10分钟),取50μl上清加入另一96孔板中,根据生产商提供的使用指南进行后续操作。杀伤效率计算公式:%杀伤效率=(实验结果-乳腺癌细胞基础释放值-til细胞基础释放值)/(混合后杀伤细胞释放峰值-乳腺癌细胞基础释放值)×100。测试结果请参见图5,通过该图可知,在不同的比例下,pd1-/pdl1-的处理杀伤的效果是最好的,都有特别高的杀伤效率。实施例4、细胞因子测试首先,本实施例参照实施例1制备方法制备包载sirna纳米颗粒,然后用40nm浓度的纳米颗粒转染til细胞。分别对转染前的til细胞(沉默前的til细胞,标记为tils)、转染后的til细胞(即沉默的til细胞,标记为tilsk)亚群进行检测,检测方法为本领域常规方法。检测结果请参见图6a和图6b;图6a是沉默后的til细胞,图6b是沉默前的til细胞,根据图6a和图6b可知,沉默pd1之后和之前,til细胞亚群没有改变。说明整个沉默过程对til细胞的细胞亚群没有影响。其次,本实施例参照实施例1中的步骤1.1和步骤1.2获得40nm浓度纳米颗粒转染的til细胞,然后用被转染后的til细胞(tilsk)与mcf7、mcf7k、ctl6三种细胞共培养,并在共培养前后测试转染前后的细胞因子表达量,测试细胞因子表达量的方法为本领域常规操作。检测结果请参见图6c、图6d,被转染til细胞的il17、il10、infγ、infα表达量有所增加,特别是infγ显著增加,说明被转染后的til细胞的杀伤能力明显增强。需要说明的是,经过多次实验证明,上述实施例在下述参数限定的范围内均能够实现:所述第一反应物溶液为钙盐溶液,所述第二反应物溶液为磷酸盐溶液或者焦磷酸盐溶液,所述第一反应物、第二反应物的钙、磷的物质量比为(25~400):1;所述钙盐溶液的浓度为4.5~5.5m;所述磷酸盐溶液或者焦磷酸盐溶液的浓度为45~55mm;所述dopa溶液中dopa的浓度为15~25mg/ml,所述dopa溶液的加入体积与所述a液、c液的混合溶液的体积比为(70~80):1;所述dopc、胆固醇的混合物中,dopc、胆固醇的质量比为1:(2.5~3.5);所述dotap、胆固醇的混合物中,dotap、胆固醇的质量比为2:(2.5~3.5);所述a液的制备中,有机溶剂为环己烷、苯、甲苯、正庚烷、四氯化碳中的任一种或几种;表面活性剂包括聚氧代乙烯(5)壬基苯基醚;有机溶剂与表面活性剂混合的体积比为80:20~50:50;所述a液、b液的用量比为(50~200):1;所述a液、c液的用量比为(50~200):1;e液与d液的用量比为(1~3):(1~3)。对比例1(1)本对比例采用的包载有沉默sirna(沉默til细胞的pd1)的纳米颗粒是通过如下制备方法获得:步骤一,将环己烷10.5ml、聚氧代乙烯(5)壬基苯基醚4.5ml、5m氯化钙溶液(所用体积是50μl)、100μmsirna溶液(所用体积是66.7μl)、超纯水33.3μl混合,得混合物ⅰ;步骤二,将环己烷10.5ml、聚氧代乙烯(5)壬基苯基醚4.5ml、50mm磷酸氢二钠(所用体积是50μl)、100μmsirna溶液(所用体积是66.7μl)、超纯水33.3μl混合,得混合物ⅱ;步骤三,将混合物ⅰ以1~3ml/min的速度滴入混合物ⅱ,搅拌20分钟,所得沉淀为纳米颗粒。步骤一,步骤二中,环己烷与聚氧代乙烯(5)壬基苯基醚的体积比为70:30,包裹的sirna的序列、浓度(50nm)均同实施例1。本对比例制备的纳米颗粒为单层膜结构,颗粒大小不均,粒径大于20nm,分散性较差。将所得纳米颗粒的浓度调制40nm,参照实施例1中1.2部分转染til细胞,在不同时间段取样,检测转染效率。结果见表1。根据表1可知,对比例1纳米颗粒随着时间的推进,摂取率变化不明显,转染8小时对应的摂取率不高。表10.25h2h4h6h8h摂取率%2.17±0.2125.43±6.3131.21±4.4743.53±3.2843.57±4.32(2)本对比例采用的包载有沉默sirna(沉默乳腺癌细胞mcf7的pdl1)的纳米颗粒的制备方法参照本对比例中的上述(1)。将所得纳米颗粒的浓度调制40nm,参照实施例1中2.2部分转染乳腺癌细胞mcf7,在不同时间段取样,检测转染效率。结果见表2。根据表2可知,对比例1纳米颗粒随着时间的推进,摂取率变化不明显,转染8小时对应的摂取率不高。表2(3)杀伤效率测试:取上述(1)转染2h获得til细胞、上述(2)转染2h获得乳腺癌细胞mcf7,参照上述实施例3的测试方法进行杀伤力测试,设10:1、30:1、100:1三个比例,结果见表3。根据表3可知,由于转染率不高,对比例1纳米颗粒转染til细胞、乳腺癌细胞mcf7后,二者杀伤效率显著低于实施例。表3杀伤效率%pd1-/pdl1-10:122.11±1.5030:130.06±4.40100:148.09±6.84(4)细胞因子测试:参照实施例4的方法,用上述(1)获得的被转染的til细胞与mcf7、mcf7k、ctl6三种细胞共培养,并在共培养前后测试转染前后的细胞因子表达量。检测结果见表4。表4单位pg/mlil17il10infγtnfαtil/ctl423±3.5515.00±4.0017.33±3.615.33±1.15til/mcf7k309.67±90.7356.33±7.51772.67±10.5081.22±6.11til/mcf7269.00±33.0527.67±10.21414.33±22.3058.33±4.73tilk/ctl423.00±7.5513.00±4.0023.67±28.8813.11±3.46tilk/mcf7k509.67±90.7366.33±7.51923.67±48.3991.67±9.45tilk/mcf7369.00±30.0532.67±10.21595.67±24.6886.13±4.58根据表4可知,由于转染率不高,转染前后所得细胞间的细胞因子表达量不明显。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种纳米粉体工业生产系统的制作方法
- 一种高红外辐射粉体及其制备方法
- 一种铈锌共掺NiFe<sub>2</sub>O<sub>4</sub>纳米粉体及其制备方法
- 一种纳米Al<sub>2</sub>O<sub>3</sub>/Er<sub>3</sub>Al<sub>5</sub>O<sub>12</sub>/ZrO<sub>2</sub>复合粉体材料的制备方法
- 一种β?氢氧化镍纳米片的制备方法
- 一种硫化亚铜纳米玫瑰花的制备方法
- 一种球形氧化钇粉体的制备方法
- 一种亚微米级碳化硼粉体及其制备方法和用图
- 一种B<sub>4</sub>C纳米片的制备方法及B<sub>4</sub>C纳米片的制作方法
- 氮化铝粉体的制备方法