一种基于双Aptamer夹心结构开启环介导等温扩增的凝血酶检测方法及试剂盒与流程
本发明涉及生物学检测技术领域,涉及一种基于环介导等温扩增信号放大技术和核酸适配体识别技术的凝血酶检测方法及试剂盒。
背景技术:
凝血酶是一种丝氨酸蛋白酶,也是血液凝血级联反应中的主要效应蛋白酶,显现出促凝和抗凝的特性。当循环凝血因子在暴露的血管外组织与组织因子相接触时,凝血酶会在组织上聚集。凝血酶不但参与凝血过程,还作为一种重要的细胞外信号分子,通过激活凝血酶受体,参与一系列病理过程,如:裂解纤维蛋白原形成纤维蛋白血栓,激活血小板。因此发展具有实用价值的凝血酶高灵敏检测方法对于医学临床诊断具有重要意义。
具有较强应用价值的检测技术需要三个方面的特征:特异性、高灵敏及低成本。凝血酶的特异性识别技术包括抗体识别和分子适配体识别(aptamer),高灵敏检测使用的信号放大方法有滚环扩增、链置换等温扩增、杂交链式反应及树状结构、纳米技术、g-四链体扩增等,信号来源主要包括荧光信号、电化学信号及化学发光等。近年来在此基础上已经发展了大量的凝血酶检测技术(biosensbioelectron.2014,56,71–76;biosensbioelectron.2018,99,338-345;biosensbioelectron.2016,80,463-470;analyst.2015,140(22),7710-7717;chemcommun.2015,51(37),7927-30;biosensbioelectron.2015,66,423-430),这些方法有较好的特异性、灵敏性等优点,但同时也存在较大的缺陷,如依赖大型仪器、信号获取需要特殊标记导致成本高等缺点。
环介导等温扩增(loop-mediatedisothermalamplification,lamp)是一种全新的核酸扩增方法,该技术在灵敏度、特异性和检测范围等指标上能媲美甚至优于pcr技术,不依赖任何专门的仪器设备可实现现场高通量快速检测,检测成本远低于荧光定量pcr。环介导等温扩增主要用于生物方面微生物的检测,机理是检测其核酸,此方法只能检测核酸,适用性范围较窄。
技术实现要素:
本发明提供了一种基于双aptamer夹心结构开启环介导等温扩增的凝血酶检测方法及试剂盒,将核酸适配体识别、环介导等温扩增技术有机结合起来,形成了一种用于凝血酶检测的高性能生物传感技术。
本发明的技术方案如下:
本发明提供了一种基于双aptamer夹心结构开启环介导等温扩增的凝血酶检测方法,所述双aptamer夹心结构包括亲和素修饰的微球载体和负载在所述微球载体上生物素化的凝血酶双aptamer夹心结构,所述双aptamer夹心结构的3’端带有一条游离单链序列,引发环介导等温扩增;
将所述双aptamer夹心结构与lamp初级基础结构混合;所述lamp初级基础结构具有游离的3’突出末端,所述3’突出末端序列与所述双aptamer夹心结构的3’端游离单链序列互补;所述lamp初级基础结构的3’突出末端序列还带有nb.bsrdi切刻内切酶的切割位点;
在nb.bsrdi切刻内切酶作用下,所述双aptamer夹心结构与lamp初级基础结构结合并切割形成lamp基础结构;
所述lamp基础结构在引物的作用下进行环介导等温扩增,所述引物中至少包括一条含有g-四链体序列互补序列的引物,得到含有g-四链体序列的扩增产物;
将所述扩增产物与血红素混合,所述扩增产物中的dna序列经解旋折叠后,形成g-四链体-血红素dna酶,利用abts-h2o2反应进行凝血酶的检测。
优选的,所述凝血酶双aptamer夹心结构中包括核酸适配体p1和核酸适配体p2,所述核酸适配体p1为生物素修饰的核酸适配体,固定在所述微球载体上,所述核酸适配体p2的3’端带有一条游离单链序列,所述核酸适配体p1与所述核酸适配体p2分别与凝血酶特异性结合形成双aptamer夹心结构。
更优选的,所述核酸适配体p1的核苷酸序列如seqidno.1所示。
更优选的,所述核酸适配体p2的核苷酸序列如seqidno.2所示。
优选的,所述lamp初级基础结构由探针p3-1和探针p3-2同时与探针p3-com互补结合,在ampligase连接酶的作用下构建得到;
其中,所述探针p3-1的核苷酸序列如seqidno.3所示,所述探针p3-2的核苷酸序列如seqidno.4所示,所述探针p3-com的核苷酸序列如seqidno.5所示。
更优选的,所述lamp初级基础结构的构建条件为在90~98℃的温度下反应10~50s,再于30~40℃温度下反应5~10min,在上述条件下进行20~40个循环反应。
优选的,所述lamp初级基础结构的核苷酸序列如seqidno.6所示。
优选的,所述环介导等温扩增使用4条引物,其核苷酸序列分别如seqidno.7~10所示。
优选的,所述lamp基础结构的核苷酸序列如seqidno.11所示。
本发明的另外一个目的是提供一种用于检测凝血酶的环介导等温扩增试剂盒,包括亲和素修饰微球、生物素化的核酸适配体p1、核酸适配体p2、凝血酶;探针p3-1、探针p3-2、探针p3-com、ampligase连接酶、nb.bsrdi切刻内切酶、引物fip、引物bip、引物flp-g4、引物blp-g4、bstdna聚合酶和缓冲液;
所述生物素化的核酸适配体p1、核酸适配体p2、探针p3-1、探针p3-2和探针p3-com的核苷酸序列分别如seqidno.1~5所示;
所述引物fip、引物bip、引物flp-g4、引物blp-g4的核苷酸序列分别如seqidno.7~10所示。
优选的,所述缓冲液包括binding/wash缓冲液、bsatbbuffer、reactionbuffer、nebuffer2.1缓冲液和lamp等温扩增缓冲液。
与现有技术相比,本发明具有以下优点:
本发明首次将双aptamer夹心检测法、环介导等温扩增技术以及g-四链体-血红素dna酶酶促反应结合起来,实现了凝血酶的高灵敏、特异性检测。本发明的试剂盒及方法对凝血酶的检测非常灵敏,检测血浆中的凝血酶检测限为0.005pg/ml。
本发明lamp基础结构的形成需要双aptamer夹心结构中3’末端游离序列的引发,将带有3’突出末端的lamp初级基础结构转化为完整的lamp基础结构,最后进行lamp信号放大。
本发明所述的凝血酶检测试剂盒及方法具有很好的特异性,常见的其他干扰物质对凝血酶检测产生的影响极小。
本发明将凝血酶的检测与环介导等温扩增有机的结合起来,核酸适配体的高特异性和环介导等温扩增的高灵敏性的结合,是一种高灵敏度、高特异性的凝血酶检测新方法。核酸适配体具有高通用性的特点,本发明使环介导等温扩增这种方法具有了更高的通用性,且减少了dna提取的步骤,避免了此步骤造成的污染。本发明检测方法的建立充分整合了环介导等温扩增技术和g-四链体-血红素(hemin)dna酶的酶促扩增技术的成本优势、免标记优势、超灵敏优势、不依赖大型设备等,能够发展为现场检测技术,极大降低成本。
附图说明
图1为本发明基于双aptamer夹心结构开启环介导等温扩增的凝血酶检测方法示意图;
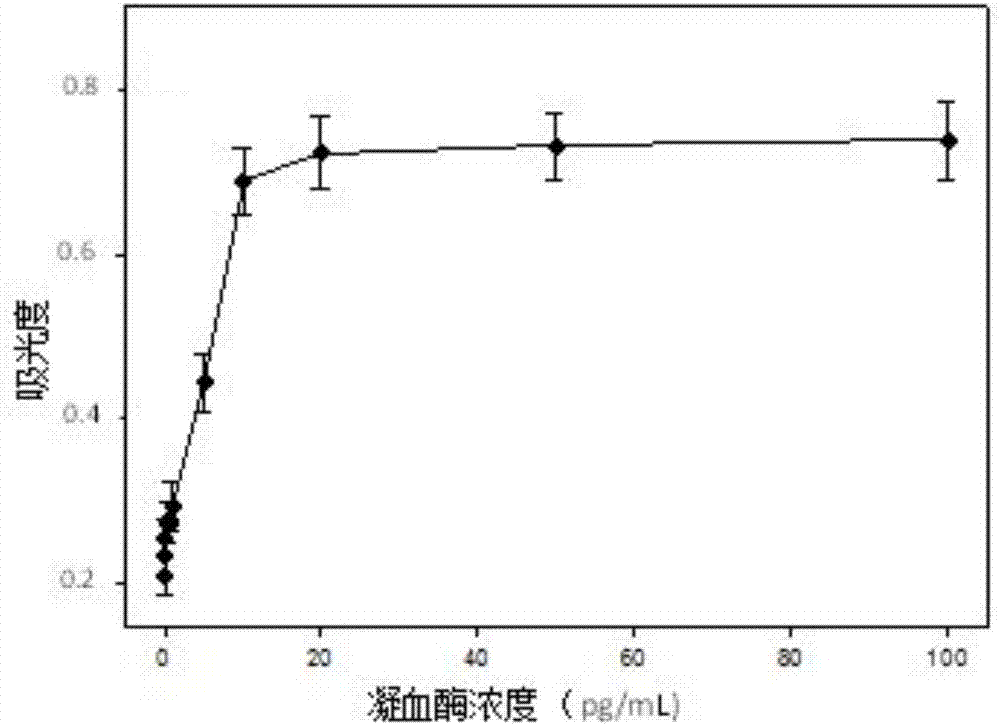
图2为采用本发明的方法检测0~100pg/ml凝血酶的吸光度结果图;
图3为采用本发明的方法检测0~10pg/ml凝血酶的吸光度结果图;
图4为本发明检测方法抗干扰能力分析结果图。
具体实施方式
本发明提供一种基于双aptamer夹心结构开启环介导等温扩增的凝血酶检测方法,将核酸适配体识别、环介导等温扩增技术有机结合起来,形成了一种用于凝血酶检测的高性能生物传感技术。
本发明基于双aptamer夹心结构开启环介导等温扩增的凝血酶检测方法,包括以下步骤:双aptamer夹心结构与lamp初级基础结构混合,在nb.bsrdi切刻内切酶作用下形成lamp基础结构,在引物的作用下对所述lamp基础结构进行环介导等温扩增,得到扩增产物;将所述扩增产物与血红素混合,利用abts-h2o2反应进行凝血酶的检测。
本发明中,所述双aptamer夹心结构包括亲和素修饰的微球载体和负载在所述微球载体上生物素化的凝血酶双aptamer夹心结构,所述双aptamer夹心结构的3’端带有一条游离单链序列,引发环介导等温扩增。
本发明中,优选所述双aptamer夹心结构中包括核酸适配体p1和核酸适配体p2,所述核酸适配体p1为生物素修饰的核酸适配体,固定在所述微球载体上,所述核酸适配体p2的3’端带有一条游离单链序列,所述核酸适配体p1与所述核酸适配体p2分别与凝血酶特异性结合形成双aptamer夹心结构。
本发明构建所述双aptamer夹心结构的方法优选包括以下步骤:以亲和素修饰的微球为载体,生物素修饰的核酸适配体p1为捕获探针固定在微球上,再加入凝血酶与核酸适配体p1特异性结合,最后加入另外一种核酸适配体p2形成夹心结构,p2的3’端带有一游离条单链序列;本发明中,优选核酸适配体p1的核苷酸序列如seqidno.1所示,核酸适配体p2的核苷酸序列如seqidno.2所示。
本发明对亲和素修饰微球的来源没有特殊限定,采用市售产品即可。在本发明具体实施例中所用亲和素修饰微球购自bangslab公司,其直径为15微米直径。本发明所用的适配体能通过氢键形成特定空间结构,与凝血酶的特定位点结合。本发明对选择的aptamer序列没有特殊限定,采用本领域中能够与凝血酶特异识别形成的aptamer序列均在本发明的保护范围之内。
本发明中,所述lamp初级基础结构具有游离的3’突出末端,所述3’突出末端序列与双aptamer夹心结构的3’端游离单链序列互补;所述lamp初级基础结构的3’突出末端还带有nb.bsrdi切刻内切酶的切割位点。
本发明中,所述lamp初级基础结构由探针p3-1和探针p3-2同时与探针p3-com互补结合,在ampligase连接酶的作用下构建得到。其中,所述探针p3-1的核苷酸序列如seqidno.3所示,所述探针p3-2的核苷酸序列如seqidno.4所示,所述探针p3-com的核苷酸序列如seqidno.5所示。
本发明中,优选所述lamp初级基础结构的构建包括以下步骤:探针p3-1和探针p3-2混合后,在p3-com探针和ampligase连接酶存在下,将探针p3-1与探针p3-2连接成3’带有游离末端的lamp初级基础结构,即p3。
本发明中,所述lamp初级基础结构构建优选采用100ul体系,其中优选含有10×reactionbuffer,1~10ul2~10um的p3-com探针,5~15ul5~15ump3-1和5~15ul5~15ump3-2,0.2~1ulampligase连接酶,更优选为5ul5um的p3-com探针,10ul10ump3-1和10ul10ump3-2,0.5ulampligase连接酶。构建条件优选为在90~98℃的温度下反应10~50s,再于30~40℃温度下反应5~10min,在上述温度下进行20~40个循环反应。更优选为在94℃的温度下反应30s,再于37℃温度下反应8min,进行25~35个循环。本发明中,ampligase为耐高温的连接酶,p3-1的3’端与p3-2的5’端通过与p3-com杂交相互靠近并在ampligase的作用下连接在一起,形成p3。连接完成后,高温变性解离p3和p3-com二聚体,p3-com可重复用于p3-1的3’端与p3-2的5’端的连接;然后缓慢冷却至室温以保证形成更多的3’突出的lamp初级基础结构。
本发明中,优选10×reactionbuffer溶液中包括150~250mmtris-hclph=8.0~8.5,200~300mmkcl,50~200mmmgcl2,1~10mmnad,和0.05~3%tritonx-100,优选为200mmtris-hclph=8.3,250mmkcl,100mmmgcl2,5mmnad,and0.1%tritonx-100。
本发明中,优选所述lamp初级基础结构的核苷酸序列如seqidno.6所示。
在本发明中,探针p3-com和ampligase连接酶可重复利用,构建更多的3’突出的环介导等温扩增(lamp)初级基础结构。
本发明形成lamp初级基础结构的反应液在90~98℃下变性2~6min,优选在94℃下变性5min后,缓慢冷却至室温。lamp初级基础结构两端都为茎环结构,其3’带有游离单链序列,由于溶液中存在大量非茎环结构的杂交二聚体,变性后缓慢退火,可形成较多的lamp初级基础结构。
将上述双aptamer夹心结构与上述形成的3’突出的lamp初级基础结构混合,在nb.bsrdi切刻内切酶作用下形成lamp基础结构。
由于双aptamer夹心结构中p2的3’端游离单链序列与lamp初级基础结构的3’游离末端完全互补,混合后可形成如图1所示的杂交二聚体,即lamp基础结构p4。由于形成的lamp基础结构其3’突出末端带有2个nb.bsrdi切刻内切酶切割位点,nb.bsrdi切刻内切酶能对杂交二聚体中lamp基础结构3’端的切割位点进行切割,产生缺口,形成较短的链而不稳定,释放出双aptamer夹心结构和lamp基础结构。双aptamer夹心结构可重新与另一个lamp初级基础结构的3’突出末端结合从而构成另一个循环。
本发明构建lamp基础结构的缓冲液优选为nebuffer2.1缓冲液,具体包括50mmnacl,10mmtris-hcl,10mmmgcl2,100ug/mlbsa,ph7.9。本发明对nebuffer2.1缓冲液的来源没有特殊限定,采用市售商品即可。
本发明中,nb.bsrdi切刻内切酶的浓度优选为0.5~3u,更优选为2u。
本发明中,所述lamp基础结构的构建优选为在60~65℃下反应0.5~2h,更优选为在65℃下反应1h。形成lamp基础结构后,将温度升高灭活nb.bsrdi切刻内切酶的活性。本发明中优选将形成lamp基础结构的反应液在75~85℃下保持10~30min,更优选为在80℃下保持20min。
将lamp基础结构在4条引物(fip、bip、flp-g4、blp-g4)作用下进行环介导等温扩增,扩增出大量的g-四链体序列。
本发明中,所述环介导等温扩增使用4条的引物fip、bip、flp-g4、blp-g4的核苷酸序列分别如seqidno.7~10所示。
本发明中,lamp基础结构环介导等温扩增的体系优选包括10×lamp等温扩增缓冲液2.5ul,10umfip4~6ul,10umbip4~6ul,10umflp-g42~4ul,10umblp-g42~4ul,10mmdntps4~8ul,lamp基础结构2~5ul,8u/ulbstdna聚合酶1~3ul。
其中所述10×lamp等温扩增缓冲液,优选包括200~400mmtris-hclph8.8,100~300mmkcl,100~200mm(nh4)2so4,60~80mmmgso4,1~2%tritonx-100。
由于溶液中存在大量非茎环结构的杂交二聚体,高温变性后缓慢退火,可形成较多的lamp基础结构,然后在dna聚合酶的适宜温度下进行延伸,保证等温扩增的顺利进行。本发明中,环介导等温扩增的条件优选为先在90~95℃下2~8min,更优选为在95℃下5min进行变性,再冷却至55~65℃,优选为60℃退火。退火温度不能太低,否则引物会非特异性的结合导致非特异性扩增;但也不能太高,否则会使加入的dna聚合酶失活,退火温度接近dna聚合酶的最适温度,扩增效率最高,能够形成较多的lamp基础结构。在扩增体系中加入dna聚合酶后在引物的作用下进行dna的延伸。延伸温度优选为dna聚合酶的最适温度,本发明中优选60~70℃下延伸30~90min,更优选为在65℃下延伸60min。延伸后升高温度,使dna聚合酶失活。本发明中,优选灭活为在80~90℃下1~2min,更优选为85℃下2min。扩增完成后,得到含有大量g-四链体序列的扩增产物。
本发明在形成的含有g-四链体序列的扩增产物中加入血红素,在90~95℃解开双螺旋结构并迅速冷却至4℃,形成g-四链体-血红素dna酶。
g-四链体-血红素dna酶能够催化abts-h2o2反应,生成浅绿色的abts·+,在420nm处有紫外吸收,可通过肉眼观察或分光光度法测定。在本发明具体实施例中,将上述形成的g-四链体-血红素dna酶溶液与abts和h2o2混合,在20~30℃下反应进行吸光度的测定,进行定性或定量分析。
本发明还提供了上述方法中,用于检测凝血酶的的环介导等温扩增试剂盒,包括亲和素修饰微球、生物素化的核酸适配体p1、核酸适配体p2、凝血酶;探针p3-1、探针p3-2、探针p3-com、ampligase连接酶、nb.bsrdi切刻内切酶、引物fip、引物bip、引物flp-g4、引物blp-g4、bstdna聚合酶、缓冲液、abts和h2o2;
所述生物素化的核酸适配体p1、核酸适配体p2、探针p3-1、探针p3-2和探针p3-com的核苷酸序列分别如seqidno.1~5所示;
所述引物fip、引物bip、引物flp-g4、引物blp-g4的核苷酸序列分别如seqidno.7~10所示。
本发明中,所述亲和素修饰微球的质量体积浓度优选为0.5~2%,更优选为1%;所述生物素化的核酸适配体p1的浓度优选为5~15um,更优选为10um;所述核酸适配体p2的浓度优选为5~15um,更优选为10um;所述凝血酶的浓度优选为0.001~200pg/ml,更优选为0.01pg/ml~100pg/ml;探针p3-1和探针p3-2的浓度优选独立地为5~20um,更优选为10um;所述探针p3-com的浓度优选为2~5um,更优选为5um;所述引物fip、引物bip、引物flp-g4和引物blp-g4的浓度优选独立地为5~20um,更优选为10um;所述ampligase连接酶的酶活力优选为20~100u,更优选为50u;所述nb.bsrdi切刻内切酶的酶活力优选为0.5~4u,更优选为2u;所述bstdna聚合酶的酶活力优选为5~15u,更优选为8u。
本发明中,上述试剂盒中所述缓冲液包括binding/wash缓冲液、bsatbbuffer、reactionbuffer、nebuffer2.1缓冲液和lamp等温扩增缓冲液。
所述binding/wash缓冲液中包括20~50mmtris-hcl,ph=7.5~8.0,0.8~1mnacl,1~3mmedta,0.0005~0.002%tritonx-100。binding/wash缓冲液确保生物素化的p1探针能较好的修饰在微球上。
所述reactionbuffer中包括150~250mmtris-hclph=8.0~8.5,200~300mmkcl,50~200mmmgcl2,1~10mmnad,和0.05~3%tritonx-100。reactionbuffer用于保证ampligase连接酶的活性。
所述nebuffer2.1缓冲液中包括50~100mmnacl,10~50mmtris-hcl,10~50mmmgcl2,100~200ug/mlbsa,ph7.5~7.9。用于保证nb.bsrdi切刻内切酶的活性。
所述bsatbbuffer中包括2~5%bsa,20~50mmtris-hcl,ph7.4~7.8,140~200mmnacl,5~10mmkcl,1~4mmmgcl2,1~3mmcacl2。所述bsatbbuffer保证aptamer能较好与凝血酶结合。
所述lamp等温扩增缓冲液中包括200~400mmtris-hclph8.8,100~300mmkcl,100~200mm(nh4)2so4,60~80mmmgso4,1~2%tritonx-100。所述lamp等温扩增缓冲液能保证较好的等温扩增效率。
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例对本发明进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
探针的设计
(1)p1结构如下(5’-3’):(seqidno.1)
其中,下划线为延长链,粗体为凝血酶识别序列,5’端修饰生物素分子。
(2)p2结构如下(5’-3’):(seqidno.2)
其中粗体为凝血酶识别序列;中间划线区与lamp初级基础结构3’游离末端完全互补,结合后形成杂交二聚体;斜体为游离末端。
(3)p3-1结构如下(5’-3’):seqidno.3
其中,下划线部分为分子内杂交互补区,3’端的黑色加粗部分为连接互补区,与p3-com探针互补。
(4)p3-2结构如下(5’-3’):seqidno.4
其中,该探针5’端修饰磷酸基团,用于与p3-1探针3’端的羟基在连接酶作用下进行交联。5’端的黑色加粗部分为连接互补区,与p3-com探针互补。
(5)p3-com结构如下(5’-3’):seqidno.5
其中,左侧加粗区能与p3-2探针的5’端互补,右侧下划线区能与p3-1探针的3’端互补,p3-1探针和p3-2探针同时与p3-com探针结合,在连接酶作用下,形成p3探针,即3’带有游离末端的环介导等温扩增(lamp)初级基础结构。
(6)环介导等温扩增(lamp)初级基础结构(p3)的设计(5’-3’):seqidno.6
其中加粗区为分子内互补区,5’端相邻互补,3’端相邻互补,分别在5’和3’端形成2个茎环结构,形成3’端带有游离单链序列的lamp初级基础结构。3’端带有游离序列,能够与p2探针3’游离单链序列完全互补,形成p4杂交二聚体,斜体部分为nb.bsrdi切刻内切酶的识别序列,切割位点为nncattgc中的n-c键,切割双链中的单链。
(7)环介导等温扩增引物的设计:
fip(seqidno.7):
bip(seqidno.8):
flp-g4(seqidno.9):
blp-g4(seqidno.10):
其中flp和blp的5’带有g-四链体序列的互补序列(加粗区),在通过lamp以后,加入血红素,可形成大量g-四链体-血红素dna酶进行酶促信号放大。
实施例2
对不同浓度凝血酶的检测
1.微球功能化
取100ul亲和素修饰的微球(1%即10mg/ml)于1.5ml的ep管中,离心(3500rpm,5min,后续步骤离心均以此条件),去除上清液。用100ulbinding/wash缓冲液(20mmtris-hcl,ph=7.5,1mnacl,1mmedta,0.0005%tritonx-100)洗涤3次,离心,去上清。将微球重新悬浮于20ulbinding/wash缓冲液中,加入4.5ul10um的生物素化的捕获探针p1,加入25.5ulbinding/wash缓冲液至50ul终体积。于室温孵育30min,每隔5分钟用移液管搅动几下。用100ulbinding/wash缓冲液洗涤三次,离心去上清。加入100ul10%bsatbbuffer(0.1gbsa,溶解于1mltbbuffer溶液中,tbbuffer:20mmtris-hcl,ph7.4,140mmnacl,5mmkcl,1mmmgcl2,1mmcacl2)37℃下封闭1h,4℃保存。
2.凝血酶特异性识别
5ul不同浓度的凝血酶(0.01pg/ml-100pg/ml)加入5ul上述固定有p1探针的微球,bindingbuffer为2%bsatbbuffer,每管总体积为100ul,在37℃下恒温振荡30min,反应后,离心,微球复合物用100ul含有2%bsa的洗脱液(20mmtris-hcl,0.1%tween20,ph7.4)洗涤3次,离心,去上清液,再加入92ul的2%bsatbbuffer和8ul1um的p2探针,37℃下轻摇孵育30min。反应后微球复合物用100ul含有2%bsa的洗脱液洗涤3次,离心,去上清液。
3.lamp基础结构的形成
(1)取干净的离心管,用移液枪加入64.5ul已灭菌的去离子水,再依次加入10ul的10×reactionbuffer(200mmtris-hclph=8.3,250mmkcl,100mmmgcl2,5mmnad,and0.1%tritonx-100)溶液,5ul5um的p3-com探针,10ul10ump3-1和10ul10ump3-2,0.5ulampligase,总体积达到100ul,94℃的温度下30s,再于37℃温度下8min,进行25个循环,使加入的两条的dna探针充分连接,构成3’突出的lamp初级基础结构,即p3。再94℃5min,缓慢冷却至室温。
(2)取上述溶液1ul,加入步骤2形成的夹心结构,再加入2unb.bsrdi切刻内切酶与nebuffer2.1(50mmnacl,10mmtris-hcl,10mmmgcl2,100ug/mlbsa,ph7.9)缓冲液共25ul,65℃下1h,形成lamp基础结构,然后80℃下20min,灭活nb.bsrdi切刻内切酶的活性。
4.lamp扩增:10×lamp等温扩增缓冲液(200mmtris-hclph8.8,100mmkcl,100mm(nh4)2so4,60mmmgso4,1%tritonx-100)2.5ul,10umfip4ul,10umbip4ul,10umflp-g42ul,10umblp-g42ul,10mmdntps4ul,lamp基础结构2ul,95℃5min,冷却至60℃,再加入8u/ulbstdna聚合酶1ul,加去离子水至25μl。配制完成后涡旋混匀,65℃60min,然后在85℃下2min,使bstdna聚合酶失活。
5.g-四联体过氧化物酶形成及信号放大:用0.05%tritonx-100水溶液将10mmhemin(用dmso溶液配制)母液稀释至10um。在扩增完成的lamp体系中加入10ul10umhemin,95℃2min,再从95℃降温至4℃,完成g-四联体折叠。取10ul上述溶液,加入45ulabts和45ulh2o2,37℃反应8min。选择420nm处的吸光度作为测量值。
定义δa420nm=a420nm-a0,其中a420nm为样品测量值,a0为凝血酶浓度为0时的背景值。
当凝血酶浓度达到20pg/ml时检测信号达到饱和(图2);当凝血酶浓度在0.01pg/ml~10pg/ml之间时,呈良好的线性关系(图3),回归方程为a420nm=0.045c凝血酶+0.237,线性相关系数r2=0.991。以空白组的3倍标准偏差除以标准曲线的斜率得到本发明方法的检出限为0.005pg/ml。
实施例3
抗干扰能力分析
为了检验本发明体系对凝血酶检测的选择性,选取4种其他干扰分子(bsa,igg,lysozyme,atp),并分别检验了它们对凝血酶检测的干扰程度。其中,凝血酶的浓度为5pg/ml,其他干扰物质的浓度为5ng/ml。
结果见图4。从结果来看,虽然干扰分子的浓度是凝血酶浓度的1000倍,但是凝血酶的检测信号远大于其他干扰分子的检测信号,这就表明了本发明的方法体系对凝血酶具有很高的选择性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>湖南工程学院
<120>一种基于双aptamer夹心结构开启环介导等温扩增的凝血酶检测方法及试剂盒
<160>11
<170>siposequencelisting1.0
<210>1
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttttttttttagtccgtggtagggcaggttggggtgact39
<210>2
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggttggtgtggttggtttccagcaatgaaccagcaatgggcagaggcatcctcgt55
<210>3
<211>95
<212>dna
<213>人工序列(artificialsequence)
<400>3
cacgaggagcatcgtggaaacgtcagtggagatatcacatccgtggttggaacgtcttct60
tttccacgatgctcctcgtgttttaggcagaggca95
<210>4
<211>90
<212>dna
<213>人工序列(artificialsequence)
<400>4
tcttcaacgatttcctttatcgcaatgatggcttgtaggagccaccttcctcgttgaaga60
tgcctctgcccattgctggttcattgctgg90
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
tcgttgaagatgcctctgcc20
<210>6
<211>185
<212>dna
<213>人工序列(artificialsequence)
<400>6
cacgaggagcatcgtggaaacgtcagtggagatatcacatccgtggttggaacgtcttct60
tttccacgatgctcctcgtgttttaggcagaggcatcttcaacgatttcctttatcgcaa120
tgatggcttgtaggagccaccttcctcgttgaagatgcctctgcccattgctggttcatt180
gctgg185
<210>7
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggcagaggcatcttcaacgaggaaggtggctcctacaa38
<210>8
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>8
cacgaggagcatcgtggaaacgtcagtggagatatcacatc41
<210>9
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>9
tcccaacccgccctacccatttcctttatcgcaatgatggc41
<210>10
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>10
tcccaacccgccctacccaagaagacgttccaaccacg38
<210>11
<211>165
<212>dna
<213>人工序列(artificialsequence)
<400>11
cacgaggagcatcgtggaaacgtcagtggagatatcacatccgtggttggaacgtcttct60
tttccacgatgctcctcgtgttttaggcagaggcatcttcaacgatttcctttatcgcaa120
tgatggcttgtaggagccaccttcctcgttgaagatgcctctgcc165
- 还没有人留言评论。精彩留言会获得点赞!
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 一套鉴定甘蔗上三种短体线虫的环介导等温扩增引物及其试剂盒的制造方法与工艺
- RNA扩增方法与制造工艺
- 用于扩增核酸样品的等温方法与制造工艺